Коррозия металлов виды: Коррозия металлов. Виды коррозии металлов
alexxlab | 20.07.2019 | 0 | Разное
Коррозия металлов и её виды
Химические и физико-химические реакции, возникающие в момент взаимодействия окружающей среды с металлами и сплавами, в большинстве случаев приводят к их самопроизвольному разрушению. Процесс саморазрушения имеет собственный термин – «коррозия». Результатом коррозии является существенное ухудшение свойств металла, вследствие чего изделия из него быстро выходят из строя. Каждый металл обладает свойствами, позволяющими ему сопротивляться разрушению. Коррозийная стойкость или, как ее еще называют, химическое сопротивление материала, является одним из главных критериев, по которым осуществляется отбор металлов и сплавов для изготовления тех или иных изделий.
В зависимости от интенсивности и длительности коррозийного процесса металл может быть подвергнут как частичному, так и полному разрушению. Взаимодействие коррозийной среды и металла приводят к образованию на поверхности металла таких явлений, как окалина, оксидная пленка и ржавчина. Данные явления отличаются друг от друга не только внешним видом, но еще и степенью адгезии с поверхностью металлов. Так, например, в процессе окисления такого металла, как алюминий, его поверхность покрывает пленка оксидов, отличающаяся высокой прочностью. Благодаря этой пленке разрушительные процессы купируются и не проникают вовнутрь. Если говорить о ржавчине, то результатом ее воздействия является образование рыхлого слоя. Процесс коррозии в данном случае очень быстро проникает во внутреннюю структуру металла, что способствует его скорейшему разрушению.
Показатели, по которым осуществляется классификация коррозийных процессов:
- вид коррозийной среды;
- условия и механизм протекания;
- характер коррозийных разрушений;
- вид дополнительных воздействий на металл.
По механизму коррозийного процесса различают как химическую, так и электрохимическую коррозию металлов и сплавов.
Химическая коррозия – это взаимодействие металлов с коррозийной средой, в процессе которого наблюдается единовременное осуществление окисления металла и восстановление окислительного компонента среды. Взаимодействующие между собой продукты не разделены пространственно.
Электрохимическая коррозия – это взаимодействие металлов с коррозийно-активной средой, представляющей собой раствор электролита. Процесс ионизации атомов металла, а также процесс восстановления окислительного компонента данной коррозийной среды протекают в разных актах. Электродный потенциал раствора электролита оказывает существенное влияние на скорость этих процессов.
В зависимости от типа агрессивной среды существует несколько видов коррозии
Атмосферная коррозия представляет собой саморазрушение металлов в воздушной атмосфере, либо в газовой атмосфере, отличающейся повышенной влажностью.
Газовая коррозия – это коррозия металлов, происходящая в газовой среде, содержание влаги в которой минимально. Отсутствие влаги в газовой среде не единственное условие, способствующее саморазрушению металла. Также коррозия возможна и при высоких температурах. Наиболее часто встречается данный вид коррозии в нефтехимической и химической промышленности.
Радиационная коррозия представляет собой саморазрушение металла под воздействием на него радиоактивного излучения разной степени интенсивности.
Подземная коррозия – это коррозия, происходящая в почвах и различных грунтах.
Контактная коррозия представляет вид коррозии, образованию которого способствует контакт нескольких металлов, отличающихся друг от друга стационарными потенциалами в конкретном электролите.
Биокоррозия – это коррозия металлов, происходящая под воздействием различных микроорганизмов и их жизнедеятельности.
Коррозия током (внешним и блуждающим) – еще один вид коррозии металлов. Если на металл воздействует ток от внешнего источника, то это коррозия внешним током. Если же воздействие осуществляется посредством блуждающего тока, то это коррозия блуждающего тока.
Коррозийная кавитация представляет собой процесс саморазрушения металлов, возникновению которого способствует как ударное, так и коррозионное воздействие внешней среды.
Коррозия под напряжением представляет собой коррозию металла, причиной появления которой является взаимодействие коррозийно-активной среды и напряжений механического типа. Данный вид коррозии представляет существенную опасность для конструкций из металла, которые подвергаются сильнейшим механическим нагрузкам.
Фреттинг-коррозия — вид коррозии металлов, к которой приводит совокупность вибрации и воздействие коррозийной среды. Чтобы минимизировать вероятность возникновения коррозии при трении и вибрации, необходимо внимательно подходить к выбору конструкционного материала. Также необходимо применять специальные покрытия и по возможности снизить коэффициент трения.
По характеру разрушений коррозия разделяется на сплошную и избирательную
Сплошная коррозия полностью покрывает поверхность металла. Если скорость разрушений на всей поверхности одинакова, то это равномерная коррозия. Если разрушение металла на различных его участках происходит с разной скоростью, то коррозия называется неравномерной.
Избирательная коррозия подразумевает разрушение одного из компонентов сплава или же одной структурной составляющей.
Местная коррозия, проявляющаяся в виде отдельно разбросанных по поверхности металла пятен, представляет собой углубления разной толщины. Разрушения могут представлять собой раковины или точки.
Подповерхностная коррозия образуется непосредственно на поверхности металла, после чего активно проникает вглубь. Данный вид коррозии сопровождается расслоением изделий из металла.
Межкристаллитная коррозия проявляется в разрушении металла по границам зерен. По внешнему виду металла ее достаточно сложно определить. Однако очень быстро меняются показатели прочности и пластичности металла. Изделия из него становятся хрупкими. Наиболее опасен этот вид коррозии для хромистых и хромоникелевых видов стали, а также для алюминиевых и никелевых сплавов.
Щелевая коррозия образуется на тех участках металлов и сплавов, которые находятся в резьбовых креплениях, различных зазорах и под всевозможными прокладками.
Коррозия металлов
Коррозия – это самопроизвольный окислительно-восстановительный процесс разрушения металлов и сплавов вследствие взаимодействия с окружающей средой.
Различают два вида коррозии – химическую и электрохимическую. Химическая коррозия обусловлена взаимодействием металлов с веществами, содержащимися в окружающей среде. В производственных условиях такими веществами, помимо О2, являются SO2, CO2, H2S, NH3 и др.
Химическую коррозию, обусловленную взаимодействием металлов с газами, называют газовой. Основной вклад в газовую коррозию металла вносит кислород воздуха. Различные металлы обладают различной устойчивостью по отношению к О2. Некоторые металлы (Al, Cr, Zn, Pb, Sn) образуют на воздухе плотные пленки оксидов, не разрушающиеся при изгибе или нагревании. Такие пленки защищают металл от дальнейшего доступа к нему газов и жидкостей, и процесс коррозии резко замедляется. Оксидные пленки других металлов (например, Fe) представляют собой рыхлые, пористые, механически непрочные образования. Они не предохраняют металл от доступа к нему газов и жидкостей. Поэтому такие металлы корродируют особенно быстро.
Процесс химической коррозии Fe схематически можно представить следующими уравнениями:
2Fe + O2=2FeO
4Fe + 3O2 = 2Fe2O3
3Fe + 2O2 =FeO · Fe2O3
4Fe + 3O2 +6H
Fe(OH)3=t H2O+FeOOH (ржавчина)
Однако наибольший вред приносит не химическая, а электрохимическая коррозия, связанная с переходом электронов от одних участков металла к другим. Химическая коррозия сопровождает электрохимическую и усиливает ее.
Сущность электрохимической коррозии
Металлы обычно содержат примеси других металлов и неметаллов. При соприкосновении таких металлов с электролитом (которым может служить Н2О, адсорбированная из воздуха, поскольку в ней как правило имеются ионы растворенных веществ) на поверхности металла возникает множество микрогальванических пар. В этих парах атомы более активного металла (обычно Fe) играют роль анода, а атомы менее активного – роль катода.
На катоде идет процесс восстановления молекул О2 в нейтральной и щелочной средах, или ионов Н+ – в кислой среде.
На аноде происходит окисление атомов металла, из которых состоит анод, с образованием катионов Men+.
Последние переходят в электролит (растворение анода) и соединяются с ионами ОН–, с образованием гидроксида Me(OH)n и других продуктов. Называемых ржавчиной. В результате металл, играющий роль анода, разрушается.
Скорость электрохимической коррозии тем больше, чем дальше друг от друга расположены металлы в ряду напряжений, и чем выше температура окружающей среды.
Чистые металлы устойчивы к коррозии. Однако, так ка абсолютно чистым металлов нет, а также вследствие того, что гальваническая пара может быть образована отдельными участками одного и того же металла, находящимися в различных условиях (под разными электролитами или под одним и тем же электролитом разной концентрации), то электрохимическая коррозия имеет место всегда при соприкосновении металла с электролитом (атмосферной влагой).
Роль катода при электрохимической коррозии могут выполнять не только менее активные металлы, но и примеси неметаллов, способных принимать электроны.
Коррозия – процесс поверхностный и при отсутствии трещин внутри металла развиваться не может. Поэтому одним из способов защиты от коррозии является нанесение на поверхность металла металлических и неметаллических покрытий.
В качестве металлических покрытий используются пленки Au, Ag, Ni, Cr, Zn и других металлов, которые мало подвергаются коррозии из-за своей индифферентности или по причине образования прочных оксидных пленок. Некоторые из этих металлов (Au, Ag, Ni, Cr), помимо защитной, выполняют и эстетическую – придают изделиям приятный внешний вид.
Различают два вида металлических покрытий – анодное и катодное. Покрытие называется
- анодным, если оно изготовлено из металла более активного, чем защищаемый;
- катодным, если изготовлено из менее активного металла.
Примером анодных покрытий для изделий из железа являются пленки из Cr, Zn, примером катодных – пленки из Ni, Sn, Ag, Au. Катодные покрытия не защищают металлы в случае нарушения их целостности (трещины, царапины), так как при наличии электролита возникает гальваническая пара, роль растворимого анода в которой играет защищаемый металл.
Неметаллические покрытия также делятся на два вида: неорганические и органические. В качестве органических покрытий используются пленки лаков, красок, пластмасс, резины, битума, в качестве неорганических – эмали.
Протекторная защита заключается в соединении защищаемого изделия проводником с протектором – пластиной из более активного металла (Al, Mg, Zn). В процессе коррозии протектор служит анодом и разрушается, предохраняя от коррозии металлическое изделие или конструкцию.
Электрохимическая (катодная) защита заключается в соединении защищаемого изделия с катодом внешнего источника тока, вследствие чего изделие становится катодом. Анодом служит вспомогательный, обычно стальной, электрод (кусок металла), который и разрушается в процессе коррозии.
Автор: Метельский А.В.
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
Виды коррозии и их характеристики
 Коррозия представляет собой процесс разрушительного характера, возникающий на различных поверхностях начиная от керамики и заканчивая металлом. Возникает она в результате воздействия химического либо химико-физического типа. Причинами возникновения этого процесса может выступать несколько факторов. Основными специалисты называют именно неустойчивость материала к воздействию термодинамического характера, которое возникает в окружающей среды.
Коррозия представляет собой процесс разрушительного характера, возникающий на различных поверхностях начиная от керамики и заканчивая металлом. Возникает она в результате воздействия химического либо химико-физического типа. Причинами возникновения этого процесса может выступать несколько факторов. Основными специалисты называют именно неустойчивость материала к воздействию термодинамического характера, которое возникает в окружающей среды.
Виды коррозии металлов
На сегодняшний день разновидностей коррозии металлов достаточно много, так как источниками её возникновения может выступать довольно большое количество разнообразных факторов. В целом коррозийные процессы классифицируют по нескольких параметров, а определённые типы коррозии различают между собой по схожести признаков проявления.
В зависимости от общего характера протекания коррозия может проявляться в двух основных формах, которые можно встретить и в повседневной жизни.
- Общего характера — иными словами, её ещё называют равномерной. Эта разновидность является одной из самых распространённых, так как причинами её появления являются химические и электрохимические реакции. Общая может приводить к ухудшению всей поверхности предмета. Однако, несмотря на это, она является одной из самых безопасных, среди всех существующих. Связанна эта особенность, прежде всего, с тем, что такой процесс можно как предсказать, так и угадать. В этом случае коррозия может быть:
- равномерной — в этом случае ржа даёт о себе знать одновременно на всей поражённой территории. Примером может быть разрушение труб, изготовленных из железа, которые находятся на открытом воздухе;
- неравномерной — при этой разновидности скорость реакции разрушения на поверхности варьируется, то есть разрушения одного участка может происходить значительно быстрее, нежели, например, соседнего.
- Местного характера — в отличие от предыдущего эта разновидность ориентирована на одну конкретную область, на которой и возникает поражение.
Механизм возникновения
Коррозийные процессы разделяют на различные разновидности в зависимости от механизмов протекания. Этот факт необходимо учитывать при эксплуатации изделий из металла. Выделяют два основных механизма:
- Химический — возникает в результате контакта, происходящего во время взаимодействия металла со средой. В процессе развития происходят реакции окисления элемента и восстановления одновременно. При этом продукты, который входят в состав реакции, не сепарированы в пространстве.
 Электрохимического характера — возникает в результате соприкосновения раствора электролита с существующим металлом. В качестве электролита может выступать как конденсат, так и вода от дождя. Таким образом, можно говорить о том, что чем больше содержание солей и кислот в жидкости, тем больше будет и электропроводность, а также и скорость протекания самого процесса. Наиболее уязвимыми перед электрохимическим типом являются конструкции из металла, а именно различные заклёпки, соединения, которые сварены, а также места их повреждений. Если конструкционные особенности материала делают его максимально устойчивым к образованию ржавчины, то процесс развития коррозии значительно замедляется. Примером можно назвать оцинковку. Цинк имеет потенциал отрицательный, если сравнивать его, например, с железом, именно по этой причине железный сплав восстанавливается, а цинк продолжает коррозировать. Однако, если на поверхности имеется специальная защитная плёнка, это значительно замедляет скорость развития коррозийных процессов.
Электрохимического характера — возникает в результате соприкосновения раствора электролита с существующим металлом. В качестве электролита может выступать как конденсат, так и вода от дождя. Таким образом, можно говорить о том, что чем больше содержание солей и кислот в жидкости, тем больше будет и электропроводность, а также и скорость протекания самого процесса. Наиболее уязвимыми перед электрохимическим типом являются конструкции из металла, а именно различные заклёпки, соединения, которые сварены, а также места их повреждений. Если конструкционные особенности материала делают его максимально устойчивым к образованию ржавчины, то процесс развития коррозии значительно замедляется. Примером можно назвать оцинковку. Цинк имеет потенциал отрицательный, если сравнивать его, например, с железом, именно по этой причине железный сплав восстанавливается, а цинк продолжает коррозировать. Однако, если на поверхности имеется специальная защитная плёнка, это значительно замедляет скорость развития коррозийных процессов.
Влияние окружающей среды на металл
Ни для кого не станет секретом тот факт, что это процесс развивается в основном на поверхности металла, однако, существуют и исключения, при которых происходит проникновения очагов поражения далеко внутрь. Кроме этого, коррозийный процесс может развиваться практически во всех существующих средах.
Разновидности коррозии:
 Газового типа — ржавления металлов происходит только в присутствии газовой среды и только если есть минимальное содержания воды. Этот тип коррозии наиболее часто встречается в сферах промышленности, а также в химических отраслях.
Газового типа — ржавления металлов происходит только в присутствии газовой среды и только если есть минимальное содержания воды. Этот тип коррозии наиболее часто встречается в сферах промышленности, а также в химических отраслях.- Подземная — такая разновидности возникает в грунтовой среде, когда происходит ржавления труб или иных оставляющих.
- Атмосферный тип — процессы возникают в воздухе либо если есть присутствие влажного газа.
- Биотипа — такой тип развивается преимущественно под воздействием различного рода микроорганизмов на материалы.
- Коррозия контактного типа — в этой разновидности принимают участие несколько разных металлов, которые отличаются друг от друга по своим потенциалам электролита.
 Коррозия, которая возникает преимущественно под напряжением — ржавление металла при этом типе происходит, только если присутствуют механические напряжения. Подобного рода процесс является небезопасным для конструкций опорного типа. Важным нюансом при этом типе является именно коррозийная усталость, которая имеет накопительный эффект и может возникать при периодическом напряжении.
Коррозия, которая возникает преимущественно под напряжением — ржавление металла при этом типе происходит, только если присутствуют механические напряжения. Подобного рода процесс является небезопасным для конструкций опорного типа. Важным нюансом при этом типе является именно коррозийная усталость, которая имеет накопительный эффект и может возникать при периодическом напряжении.- Межкристальный тип — ржа при таком типе появляется преимущественно по краям вкраплений. Металл при такой коррозии в минимальные сроки не только лишается своей эластичности, но и прочности. Наиболее часто от такой разновидности страдают именно сплавы, имеющие в своём составе никель и алюминий.
- Питтинговый тип — коррозия возникает в небольшом отверстии либо полости металла. Наиболее часто этот типа ассоциируют именно с застойной зоной агрессивной среды, например, под различными прокладками либо зажимами.
Коррозия металлов и способы защиты от неё
Коррозия – разрушение поверхности сталей и сплавов под воздействием различных физико-химических факторов – наносит огромный ущерб деталям и металлоконструкциям. Ежегодно этот невидимый враг «съедает» около 13 млн. т металла. Для сравнения – металлургическая промышленность стран Евросоюза в прошлом, 2014 году произвела всего на 0,5 млн. тонн больше. И это только – прямые потери. А длительная эксплуатация стальных изделий без их эффективной защиты от коррозии вообще невозможна.
Что такое коррозия и её разновидности
Основной причиной интенсивного окисления поверхности металлов (что и является основной причиной коррозии) являются:
- Повышенная влажность окружающей среды.
- Наличие блуждающих токов.
- Неблагоприятный состав атмосферы.
Соответственно этому различают химическую, трибохимическую и электрохимическую природу коррозии. Именно они в совокупности своего влияния и разрушают основную массу металла.
Химическая коррозия
Такой вид коррозии обусловлен активным окислением поверхности металла во влажной среде. Безусловным лидером тут является сталь (исключая нержавеющую). Железо, являясь основным компонентом стали, при взаимодействии с кислородом образует три вида окислов: FeO, Fe2O3 и Fe3O4. Основная неприятность заключается в том, что определённому диапазону внешних температур соответствует свой окисел, поэтому практическая защита стали от коррозии наблюдается только при температурах выше 10000С, когда толстая плёнка высокотемпературного оксида FeO сама начинает предохранять металл от последующего образования ржавчины. Это процесс называется воронением, и активно применяется в технике для защиты поверхности стальных изделий. Но это – частный случай, и таким способом активно защищать металл от коррозии в большинстве случаев невозможно.

Химическая коррозия активизируется при повышенных температурах. Склонность металлов к химическому окислению определяется значением их кислородного потенциала – способности к участию в окислительно-восстановительных реакциях. Сталь – ещё не самый худший вариант: интенсивнее её окисляются, в частности, свинец, кобальт, никель.
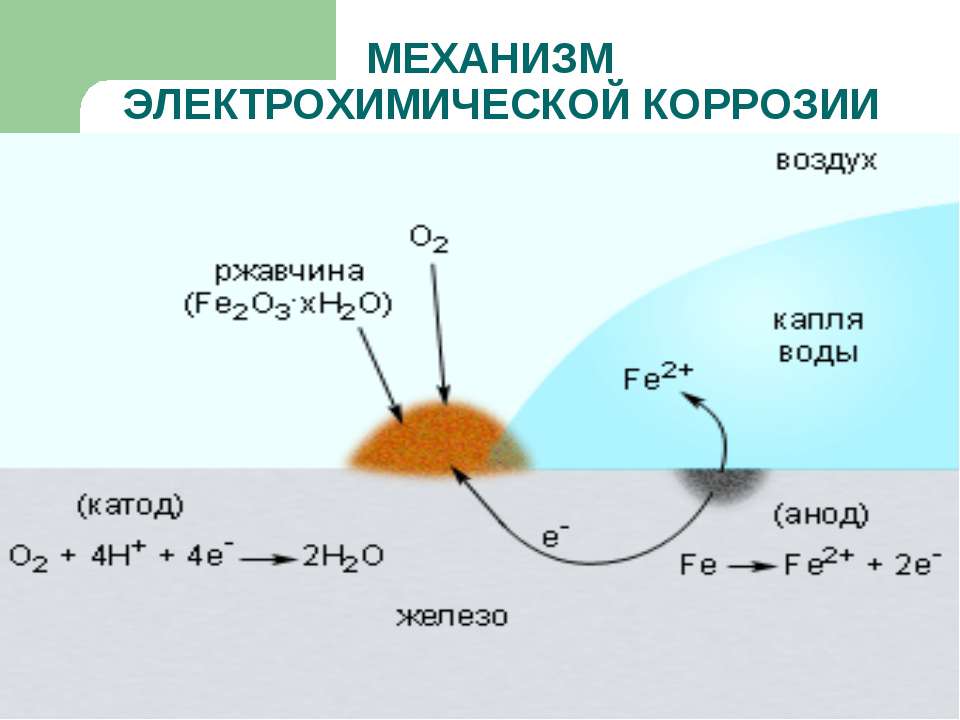
Электрохимическая коррозия
Эта разновидность коррозии более коварна: разрушение металла в данном случае происходит при совокупном влиянии воды и почвы на стальную поверхность (например, подземных трубопроводов). Влажный грунт, являясь слабощёлочной средой, способствует образованию и перемещению в почве блуждающих электрических токов. Они являются следствием ионизации частиц металла в кислородсодержащей среде, и инициирует перенос катионов металла с поверхности вовне. Борьба с такой коррозией усложняется труднодоступностью диагностирования состояния грунта в месте прокладки стальной коммуникации.
Электрохимическая коррозия возникает при окислении контактных устройств линий электропередач при увеличении зазоров между элементами электрической цепи. Помимо их разрушения, в данном случае резко увеличивается энергопотребление устройств.
Трибохимическая коррозия
Данному виду подвержены металлообрабатывающие инструменты, которые работают в режимах повышенных температур и давлений. Антикоррозионное покрытие резцов, пуансонов, фильер и пр. невозможно, поскольку от детали требуется высокая поверхностная твёрдость. Между тем, при скоростном резании, холодном прессовании и других энергоёмких процессах обработки металлов начинают происходить механохимические реакции, интенсивность которых возрастает с увеличением температуры на контактной поверхности «инструмент-заготовка». Образующаяся при этом окись железа Fe2O3 отличается повышенной твёрдостью, и поэтому начинает интенсивно разрушать поверхность инструмента.

Методы борьбы с коррозией
Выбор подходящего способа защиты поверхности от образования ржавчины определяется условиями, в которых работает данная деталь или конструкция. Наиболее эффективны следующие методы:
- Нанесение поверхностных атмосферостойких покрытий;
- Поверхностная металлизация;
- Легирование металла элементами, обладающими большей стойкостью к участию в окислительно-восстановительных реакциях;
- Изменение химического состава окружающей среды.
Механические поверхностные покрытия
Поверхностная защита металла может быть выполнена его окрашиванием либо нанесением поверхностных плёнок, по своему составу нейтральных к воздействию кислорода. В быту, а также при обработке сравнительно больших площадей (главным образом, подземных трубопроводов) применяется окраска. Среди наиболее стойких красок – эмали и краски, содержащие алюминий. В первом случае эффект достигается перекрытием доступа кислороду к стальной поверхности, а во втором – нанесением алюминия на поверхность, который, являясь химически инертным металлом, предохраняет сталь от коррозионного разрушения.
Положительными особенностями данного способа защиты являются лёгкость его реализации и сравнительно небольшие финансовые затраты, поскольку процесс достаточно просто механизируется. Вместе с тем долговечность такого способа защиты невелика, поскольку, не обладая большой степенью сродства с основным металлом, такие покрытия через некоторое время начинают механически разрушаться.

Химические поверхностные покрытия
Коррозионная защита в данном случае происходит вследствие образования на поверхности обрабатываемого металла химической плёнки, состоящей из компонентов, стойких к воздействию кислорода, давлений, температур и влажности. Например, углеродистые стали обрабатывают фосфатированием. Процесс может выполняться как в холодном, так и в горячем состоянии, и заключается в формировании на поверхности металла слоя из фосфатных солей марганца и цинка. Аналогом фосфатированию выступает оксалатирование – процесс обработки металла солями щавелевой кислоты. Применением именно таких технологий повышают стойкость металлов от трибохимической коррозии.
Недостатком данных методов является трудоёмкость и сложность их применения, требующая наличия специального оборудования. Кроме того, конечная поверхность изменяет свой цвет, что не всегда приемлемо по эстетическим соображениям.
Легирование и металлизация
В отличие от предыдущих способов, здесь конечным результатом является образование слоя металла, химически инертного к воздействию кислорода. К числу таких металлов относятся те, которые на линии кислородной активности находятся возможно дальше от водорода. По мере возрастания эффективности этот ряд выглядит так: хром→медь→цинк→серебро→алюминий→платина. Различие в технологиях получения таких антикоррозионных слоёв состоит в способе их нанесения. При металлизации на поверхность направляется ионизированный дуговой поток мелкодисперсного напыляемого металла, а легирование реализуется в процессе выплавки металла, как следствие протекания металлургических реакций между основным металлом и вводимыми легирующими добавками.

Изменение состава окружающей среды
В некоторых случаях существенного снижения коррозии удаётся добиться изменением состава атмосферы, в которой работает защищаемая металлоконструкция. Это может быть вакуумирование (для сравнительно небольших объектов), или работа в среде инертных газов (аргон, неон, ксенон). Данный метод весьма эффективен, однако требует дополнительного оборудования – защитных камер, костюмов для обслуживающего персонала и т.д. Используется он главным образом, в научно-исследовательских лабораториях и опытных производствах, где специально поддерживается необходимый микроклимат.
Кто нам мешает, тот нам поможет
В завершение укажем и на довольно необычный способ коррозионной защиты: с помощью самих окислов железа, точнее, одного из них – закиси-окиси Fe3O4. Данное вещество образуется при температурах 250…5000С и по своим механическим свойствам представляет собой высоковязкую технологическую смазку. Присутствуя на поверхности заготовки, Fe3O4 перекрывает доступ кислороду воздуха при полугорячей деформации металлов и сплавов, и тем самым блокирует процесс зарождения трибохимической коррозии. Это явление используется при скоростной высадке труднодеформируемых металлов и сплавов. Эффективность данного способа обусловлена тем, что при каждом технологическом цикле контактные поверхности обновляются, а потому стабильность процесса регулируется автоматически.
Виды коррозии металла
Коррозия – это процесс разрушения металлов под воздействием электрохимических или химических факторов окружающей среды. Отсюда, различают два типа коррозии, в зависимости от способа взаимодействия с окружающей средой и механизму протекания процесса окисления: химическая коррозия и электрохимическая коррозия.
Химическая коррозия – предполагается, что процессы, протекают без участия электрического тока. В результате: на поверхности металла образуются различные химические соединения: оксиды, сульфиды и др. (например, при нагреве стали для термической обработки или обработки давлением).
Но есть и плюсы такой коррозии: пленка, образовавшаяся на металле в результате процесса химической коррозии, служит препятствием для дальнейшего разрушения металла. Это происходит, например, у таких металлов, как свинец, олово, алюминий, никель и хром. На их поверхности образуется плотная пленка оксида. А вот на поверхности стали и чугуна пленка образуется непрочная, тонкая, она растрескивается и ведет к дальнейшей коррозии.
Электрохимическая коррозия протекает в присутствии электрического тока. Такая коррозия возникает в результате работы множества макро- или микрогальванопар в металле, соприкасающемся с электролитом.
Причины возникновения гальванических пар в металлах:
– соприкосновение двух разнородных металлов;
– наличие в металле примесей;
– наличие участков с различным кристаллическим строением;
– образование пор в окисной пленке;
– наличие участков с различной механической нагрузкой;
– наличие участков с неравномерным доступом активных компонентов внешней среды, например, воздуха.
Проявление электрохимической коррозии – появление ржавчины на корпусах судов, стальной арматуре гидравлических сооружений, под воздействием атмосферных осадков.
Резкого отличия между механизмами протекания химической и электрохимической коррозии нет. Процесс химической коррозии может плавно перейти к электрохимической, и наоборот, а также носить двоякий характер, как это бывает при электролизе.
В зависимости от условий протекания, коррозия металлопроката – труб бесшовных бывает:
газовая (протекает в присутствии газов при высокой температуре),неэлектролитическая (сталь в бензине),
атмосферная (металлические детали и конструкции на воздухе),
электролитическая (в жидкой среде под воздействием электрического тока),
почвенная (разрушение металлических труб , толстостенных стальных труб под землей),
электрокоррозия (под воздействием внешних токов),
контактная (разные виды металлов в электролите)
структурная (неоднородные по структуре металлы, например чугун и графит в растворе серной кислоты)
коррозия напряжения (снижение выносливости металла, вызывающее так называемую коррозионную усталость)
коррозия трения (вращающиеся детали машин в морской воде)
щелевая коррозия (протекает в зазорах между деталями механизмов)
биокоррозия (под воздействием микроорганизмов и биологических факторов)
В зависимости от характера и места распространения, различают следующие подвиды коррозии:
местная – более опасна, так как распространяется не в ширину, а в глубину, разрушая нижележащие слои и приводя к поломке и разрушению изделия. Возникает там, где имели место механические или другие повреждения поверхности детали.
сплошная – коррозия охватывает всю поверхность металлической детали, после чего деталь разрушается. Легко контролируется и поддается оценке.
и межкристаллитная – распространяется по границам зерен металла, начинается, по обыкновению, на поверхности и быстро распространяется в глубину. Приводит к хрупкости детали и снижению прочности. Является особо опасным подвидом коррозии. Возникает при сварке и термообработке металла.
О большей степени устойчивости стали к коррозии можно определить по процентному содержанию в ее составе углерода. Например, уменьшив до 0.015% содержание углерода в составе легированной хромоникелевой стали Х18Н9, возможно максимально повысить ее сопротивление к межкристаллитной коррозии.
По материалам сайтов:
http://www.etstal.ru
http://rmnt.net
http://nochveg.ru
Чтобы комментировать, зарегистрируйтесь или авторизуйтесь
Коррозия металлов. Виды и особенности. Защита и принцип действия
Коррозия металлов – это процесс разрушения металлической поверхности в результате неблагоприятного воздействия окружающей среды. Ее причиной является термодинамическая неустойчивость материала к влиянию различных веществ, которые с ним контактируют.
Виды коррозии
Разрушение поверхностей наступает вследствие химического или электрохимического взаимодействия неблагоприятной среды. Обе разновидности являются одинаково пагубными для изделий из металла.
Химическая коррозия
Данный процесс осуществляется в среде, которая не производит передачу электрического тока. Он наблюдается, например, при нагреве, в результате чего осуществляется образование химических соединений, таких как сульфиды, а также различные виды пленок. Нередко образованные сплошные пленки становятся непроницаемыми и консервируют поверхность, поэтому последующая коррозия металлов останавливается. Такой защитный слой можно встретить на поверхности из алюминия, хрома, никеля и свинца. Пленка на стали или чугуне является непрочной, поэтому ее наличие не останавливает дальнейшее продвижение разрушения вглубь материала.
Химическая коррозия может быть двух видов:
- Газовой.
- Жидкостной.
Газовая возникает в результате действия агрессивной газовой среды или пара на поверхность металла, что сопровождается повышенными температурами. Благодаря горячей среде на поверхности отсутствует конденсат. В качестве газа может применяться кислород, диоксид серы, водяной пар, сероводород и так далее. Подобное коррозийное влияние может вызывать абсолютное разрушение активного металла, за исключением случаев, когда образуется защитная непроницаемая пленка.
Жидкостная коррозия металлов возникает в жидкостных средах, которые не способны передавать электричество. В первую очередь она наблюдается при контакте металлов с сырой нефтью, нефтепродуктами или смазочными маслами. При наличии в таких веществах небольшой доли воды, коррозия переходит в электрохимическую.
В обоих вариантах химической коррозии скорость разрушения является пропорциональной химической реакции, с которой окислитель проникает сквозь созданную оксидную пленку на поверхности.
Электрохимическая коррозия металлов
Эта разновидность разрушения поверхности металла происходит в среде, которая может передавать электрический ток. В результате данного процесса наблюдается изменение состава металла. Атомы удаляются от кристаллической решетки в результате анодного или катодного воздействия. При анодном влиянии ионы металла переходят в раствор жидкости, которая его окружает. При катодном влиянии получаемые при анодном процессе электроны связываются с окислителем. Наиболее распространенной является электрохимическая коррозия под воздействием водорода или кислорода.
Процесс влияния электрохимической коррозии на металлы зависит от уровня их активности. По данному критерию их разделяют на 4 группы:
- Активные.
- Средней активности.
- Малоактивные.
- Благородные.
Активные имеют высокую нестабильность. Для них характерно возникновение коррозии даже в нейтральной водной среде, которая лишена растворенного кислорода или окислителей. Ярким представителем такого металла является кадмий.
Металлы средней активности располагаются на таблице химических элементов между кадмием и водородом. Они неподвержены началу разрушения в нейтральной жидкостной среде лишенной кислорода, но начинают интенсивно поддаваться коррозии при влиянии кислот.
Малоактивные металлы располагаются в таблице Менделеева между водородом и родием. Они не подвергаются влиянию коррозии при контакте с нейтральными жидкостями и кислой средой. Для активизации процесса их разрушения необходимо наличие кислорода или прочих окислителей.
Благородные металлы отличаются стабильностью, благодаря чему подвержены коррозии только при воздействии кислой среды при условии контакта с сильными окислителями. К перечню благородных металлов относится платина, золото, палладий и иридий.
Электрохимическая коррозия металлов является самой распространенной, поскольку естественные условия, в которых хранятся и эксплуатируются металлические изделия, зачастую подвержены влиянию влажной среды.
Различают следующие виды электрохимической коррозии:
- Электролитная – наблюдается при контакте с растворами солей, кислотами, оснований, в том числе и обычной водой.
- Атмосферная – наблюдается в условиях атмосферы, где содержатся испарения воды. Данный вид является самым распространенным, именно он влияет на практически все металлические изделия.
- Почвенная – наблюдается в результате воздействия влажной почвы, в составе которой могут содержаться различные химические элементы ускоряющие процесс разрушения металла. При воздействии с кислыми почвами процесс коррозии наблюдается наиболее агрессивно. Грунты с песком воздействуют медленней всего.
- Аэрационная – является более редкой и наблюдается в тех случаях, если к разным поверхностям металла оказывается неравномерный доступ воздуха. В результате неоднородного воздействия линии переходов между такими участками начинают разрушаться.
- Морская коррозия металлов подразумевает разрушение от влияния морской воды. Она выделяется в отдельную группу, поскольку данная жидкость отличается высоким содержанием солей и растворенных органических веществ. Это делает ее более агрессивной.
- Биокоррозия – данный вид разрушения возникает при условии воздействия на поверхность металла бактериями, которые в результате жизнедеятельности вырабатывают углекислый газ и прочие вещества.
- Электрокоррозия – такой вид разрушения металла наблюдается при воздействии на него блуждающих токов, что характерно для подземных сооружений, в частности рельсов метрополитена, стержней заземления, трамвайных линий и т.д.
Методы защиты от коррозии
Голая поверхность подавляющего большинства металлов склонна к быстрой коррозии, поэтому для снижения разрушающего воздействия применяются различные способы защиты.
Покрытие изоляционными слоями:
- Другим металлом.
- Цементным раствором.
- Лаками.
- Красками.
- Битумом.
Одним из самых эффективных способов защиты от коррозии является покрытие поверхности одного металла другим, менее склонным к коррозии. Примером такого технического решения является оцинковка, когда сталь защищается слоем цинка. Внутренний металл полностью изолирован до тех пор, пока цинк в результате естественной коррозии, которая протекает очень медленно, полностью не разрушится, оголив сталь. Такой метод защиты является одним из самых эффективных, поскольку покрывной металл полотна удерживается на основании, поэтому его невозможно срывать слоями. Недостаток метода заключается в том, что при механическом воздействии можно сцарапывать тонкую защитную пленку.
Покрытие металла защитным цементным раствором, битумом, лаками и красками является также очень распространенным решением, которое все же уступает оцинковке. Это связано с неоднородностью составов основания и покрытия. В результате низкой адгезии краски готовое покрытие будет отслаиваться. Такая защита может покрываться трещинами, обеспечивая доступ влаги.
Коррозия металлов может быть приостановлена при наличии химического покрытия:
- Оксидирование.
- Фосфатирование.
- Азотирование.
- Воронение.
- Цементация.
Поверхность металла подвергается влиянию различных веществ, фосфатов, азота или оксидов, в результате чего создаются пленки, которые благодаря своей непроницаемости предотвращают разрушение. Такие методы применимы в первую очередь для сталей. Также распространенным решением является воронение стали, когда поверхность металла взаимодействует с органическими веществами. Обработанные таким способом поверхности приобретают темный цвет, напоминающий крыло ворона, за что данный метод и получил свое название. Одним из наиболее эффективных вариантов химического покрытия является цементация, когда на поверхность воздействуют углеродом, в результате чего создается корка вступившего в реакцию металла.
Для защиты от коррозии черных металлов может применяться технология изменения их состава. Добавление различных соединений позволяет получить сплавы, отличающиеся большей устойчивостью к коррозии. Примером такого соединения является нержавеющая сталь.
Самым необычным является протекторная защита, которая подразумевает покрытие сооружений из одного металла пластинами из более активного металла, так называемого протектора. Поскольку он имеет более отрицательный потенциал, то выступает в роли анода. Защищаемая поверхность используется как катод. Они соединяются между собой проводником тока, благодаря чему создаются неблагоприятные условия для протектора. Как следствие разрушению поддается именно он, в то время как ценное сооружение остается целым.
Более редким решение является изменение состав окружающей среды. В таких условиях коррозия металлов замедляется или не происходит. Данный метод подразумевает очистку состава жидкости или газа от кислот и солей, вызывающих разрушение. Такой метод применим далеко не во всех случаях, поскольку отличается техническими сложностями и определенной дороговизной. Его используют в разных механизмах. К примеру, могут применять в определенных средах только те металлы, для которых те не агрессивны.
Похожие темы:
Виды коррозии металла в
- Главная
- Полезное
- Виды коррозии металла
Металлы и сплавы могут разрушаться под действием химического (химическая коррозия), электрохимического (электрохимическая коррозия) и механического (эрозия) воздействий внешней среды. Способность металла сопротивляться коррозионному воздействию среды называют коррозионной стойкостью.
Коррозия металла или сплава происходит, как правило, на границе раздела фаз, т. е. на границе соприкосновения твердого вещества с газом или жидкостью.
Коррозионные процессы подразделяются на следующие виды: по механизму взаимодействия металла со средой; по виду коррозионной среды; по виду коррозионных разрушений поверхности; по объему разрушенного металла; по характеру дополнительных воздействий, которым подвергается металл одновременно с действием коррозионной среды.
По механизму взаимодействия металла со средой различают химическую и электрохимическую коррозию.
Коррозию, протекающую под влиянием жизнедеятельности микроорганизмов, относят к биологической коррозии, а протекающую под действием радиоактивного излучения – к радиационной коррозии.
По виду коррозионной среды, участвующей в коррозионном разрушении металла или сплава, различают коррозию в жидкостях-неэлектролитах, коррозию в растворах и расплавах электролитов, газовую, атмосферную, подземную (почвенную) коррозию, коррозию блуждающим током и др.
По характеру изменения поверхности металла или сплава или по степени изменения их физико-механических свойств, в процессе коррозии независимо от свойств, среды коррозионные разрушения бывают нескольких видов.
1. Если коррозия охватывает всю поверхность металла, то такой вид разрушения называется – сплошной коррозией. К сплошной коррозии относится разрушение металлов и сплавов под действием кислот, щелочей, атмосферы. Сплошная коррозия может быть равномерной, т. е. разрушение металла происходит с одинаковой скоростью по всей поверхности, и неравномерной, когда скорость коррозии на отдельных участках поверхности неодинакова. Примером равномерной коррозии может служить коррозия при взаимодействии меди с азотной, железа – с соляной, цинка – с серной кислотами, алюминия – с растворами щелочей. В этих случаях продукты коррозии не остаются на поверхности металла. Аналогично коррозируют железные трубы на открытом воздухе. Это легко увидеть, если удалить слой ржавчины; под ним обнаруживается шероховатая поверхность металла, равномерно распределенная по всей трубе.
2. Сплавы некоторых металлов подвержены – избирательной коррозии, когда один из элементов или одна из структур сплава разрушается, а остальные практически остаются без изменений. При соприкосновении латуни с серной кислотой происходит компонентно-избирательная коррозия – коррозия цинка, а сплав обогащается медью. Такое разрушение легко заметить, так как происходит покраснение поверхности изделия за счет увеличения концентрации меди в сплаве. При структурно-избирательной коррозии происходит преимущественно разрушение какой-либо одной структуры сплава, так, например, при соприкосновении стали с кислотами феррит разрушается, а карбид железа остается без изменений. Этому виду коррозии особенно подвержены чугуны.
3. При местной коррозии на поверхности металла обнаруживаются поражения в виде отдельных пятен, язв, точек. В зависимости от характера поражений местная коррозия бывает в виде пятен, т. е. поражений, не сильно углубленных в толщу металла; язв – поражений, сильно углубленных в толщу металла; точек, иногда еле заметных глазу, но глубоко проникающих в металл. Коррозия в виде язв и точек очень опасна для таких конструкций, где важно поддерживать условия герметичности и непроницаемости (емкости, аппараты, трубопроводы, применяемые в химической промышленности).
4. Подповерхностная коррозия начинается с поверхности металла в тех случаях, когда защитное покрытие (пленки, оксиды и т. п.) разрушено на отдельных участках. В этом случае разрушение идет преимущественно под покрытием, и продукты коррозии сосредотачиваются внутри металла. Подповерхностная коррозия часто вызывает вспучивание и расслоение металла. Определить ее возможно только под микроскопом.
5. Щелевая коррозия – разрушение металла под прокладками, в зазорах, резьбовых креплениях, в клепаных соединениях и т. п. Она чаще развивается на участке конструкции, находящейся в зазоре (щели).
6. Межкристаллитная коррозия – разрушение металла по границам кристаллитов (зерен) с потерей его механической прочности, внешний вид металла при этом не меняется, но он легко разрушается на отдельные кристаллики под механическим воздействием. Объясняется это образованием между зернами металла или сплава рыхлых, малопрочных продуктов коррозии. Этому виду коррозии подвержены хромистые и хромоникелевые стали, никелевые и алюминиевые сплавы. Чтобы избежать межкристаллитной коррозии, в последние годы широко используют нержавеющие стали с пониженным содержанием углерода или в их состав вводят карбидообразователи – титан, тантал, ниобий (в 5-8 – кратном количестве от содержания углерода).
При одновременном воздействии на металл или сплав сильно агрессивных сред и механических растягивающих напряжений возможно коррозионное растрескивание, или транскристаллитная коррозия. В этом случае разрушение происходит не только по границам кристаллитов, но разделяется на части сам кристаллит металла. Это очень опасный вид коррозии, особенно для конструкций, несущих механические нагрузки (мосты, оси, тросы, рессоры, автоклавы, паровые котлы, двигатели внутреннего сгорания, водяные и паровые турбины и др.).
Коррозионное растрескивание зависит от конструкции аппаратуры, характера агрессивной среды, строения и структуры металла или сплава, температуры и т. д. Например, коррозионное растрескивание углеродистых сталей очень часто происходит в щелочных средах при высоких температурах; нержавеющих сталей – в растворах хлоридов, медного купороса, ортофосфорной кислоты; алюминиевых и магниевых сплавов – под действием морской воды; титана и его сплавов – под действием концентрированной азотной кислоты и растворов йода в метаноле.
Следует отметить, что в зависимости от природы металла или сплава и свойств агрессивной среды существует критическое напряжение, выше которого коррозионное растрескивание наблюдается часто.
По характеру дополнительных воздействий, которым подвергается металл, одновременно с воздействием агрессивной среды можно выделить коррозию под напряжением, коррозию при трении и кавитационную.
7. Коррозия под напряжением – это коррозия при одновременном воздействии коррозионной среды и постоянных или временных напряжений. Одновременное воздействие циклических растягивающих напряжений и коррозионной среды вызывает коррозионную усталость, т. е. Происходит преждевременное разрушение металла. Этот процесс можно представить следующим образом: сначала на поверхности изделия возникает местная коррозия в виде язв, которые начинают действовать в качестве концентратора напряжений, максимальное значение напряжения будет на дне язв, которое имеет более отрицательный потенциал, чем стенки, в результате чего разрушение металла будет идти вглубь, а язва будет переходить в трещину. Этому виду коррозии подвержены валы гребных винтов. Рессоры автомобилей, канаты, охлаждаемые валки прокатных станов и др.
8. Коррозия при трении – разрушение металла, вызываемое одновременным воздействием коррозионной среды и трения. При колебательном перемещении двух поверхностей относительно друг друга в условиях воздействия коррозионной среды происходит коррозия истиранием, или фреттинг-коррозия. Устранить коррозию при трении или вибрации возможно правильным выбором конструкционного материала, снижением коэффициента трения, применением покрытий и т.д.
9. Газовая коррозия – это химическая коррозия металлов в газовой среде при минимальном содержании влаги (как правило не более 0,1%) или при высоких температурах. В химической и нефтехимической промышленности такой вид коррозии встречается часто. Например, при получении серной кислоты на стадии окисления диоксида серы, при синтезе аммиака, получении азотной кислоты и хлористого водорода, в процессах синтеза органических спиртов, крекинга нефти и т.д.
10. Атмосферная коррозия – это коррозия металлов в атмосфере воздуха или любого влажного газа.
11. Подземная коррозия – это коррозия металлов в почвах и грунтах.
12. Контактная коррозия – это вид коррозии, вызванный контактом металлов, имеющих разные стационарные потенциалы в данном электролите.
Восемь форм коррозии Фонтаны
Восемь форм коррозии
Автор: Fontana & Greene, 1967
Идея описания различных способов, которыми коррозия может повредить металлы своим внешним видом, использовалась многими до того, как Фонтана и Грин стали соавторами своей знаменитой книги в 1967 году. Маккей и Уортингтон уже обсуждали различные формы коррозии в своей книге по коррозии 1936 года. вслед за Аланом Поллиттом в его собственной книге, опубликованной на тринадцать лет раньше, т.е.е. 1923. Однако следующая классификация, кажется, получила самое широкое признание с небольшими различиями между авторами.
Коррозию удобно классифицировать по формам, в которых она проявляется, основанием для этой классификации является внешний вид корродированного металла. Каждую форму можно идентифицировать простым визуальным наблюдением. В большинстве случаев достаточно невооруженного глаза, но иногда полезно или требуется увеличение. Ценную информацию для решения проблемы коррозии часто можно получить, внимательно наблюдая за корродированными образцами для испытаний или неисправным оборудованием.Осмотр перед чисткой особенно желателен. Некоторые из восьми форм коррозии уникальны, но все они более или менее взаимосвязаны. К восьми формам относятся: (1) равномерное или общее воздействие, (2) гальваническая коррозия или коррозия двух металлов, (3) щелевая коррозия, (4) точечная коррозия, (5) межкристаллитная коррозия, (6) избирательное выщелачивание или расслоение. , (7) стресс-коррозия. Этот список произвольный, но охватывает практически все повреждения и проблемы, связанные с коррозией. Формы не перечислены в каком-либо порядке важности.Ниже рассматриваются восемь форм коррозии с точки зрения их характеристик, механизмов и профилактических мер. Повреждение водородом, хотя и не является формой коррозии, часто происходит косвенно в результате коррозионного воздействия и поэтому включено в это обсуждение. ссылка
Единая атака
Равномерное разрушение – наиболее распространенная форма коррозии. Обычно он характеризуется химической или электрохимической реакцией, которая равномерно протекает по всей открытой поверхности или на большой площади.Металл становится тоньше и со временем выходит из строя. Например, кусок стали или цинка, погруженный в разбавленную серную кислоту, обычно растворяется с равномерной скоростью по всей своей поверхности. Крыша из листового железа будет иметь примерно одинаковую степень ржавчины по всей внешней поверхности.
Равномерное разрушение или общая общая коррозия представляет собой наибольшее разрушение металла на основе тоннажа. Однако с технической точки зрения эта форма коррозии не вызывает особого беспокойства, поскольку срок службы оборудования можно точно оценить на основе сравнительно простых испытаний.Часто достаточно просто погрузить образцы в жидкость. Равномерную атаку можно предотвратить или уменьшить с помощью (1) подходящих материалов, включая покрытия, (2) ингибиторов или (3) катодной защиты.
Гальваническая или двухкомпонентная коррозия
Обычно существует разность потенциалов между двумя разнородными металлами, когда они погружены в коррозионный или проводящий раствор. Если эти металлы соприкасаются (или иначе электрически связаны), эта разность потенциалов создает поток электронов между ними.Коррозия менее стойкого к коррозии металла обычно увеличивается, а воздействие более стойкого материала снижается по сравнению с поведением этих металлов, когда они не находятся в контакте. Менее стойкий металл становится анодным, а более стойкий – катодным. Обычно катод или катодный металл очень мало или совсем не корродируют в парах этого типа. Из-за наличия электрического тока и наличия разнородных металлов эта форма коррозии называется гальванической, или двухметаллической, коррозией.Это электрохимическая коррозия, но для ясности мы ограничим термин «гальваническая» воздействием разнородных металлов.
Щелевая коррозия
Интенсивная локальная коррозия часто возникает в щелях и других экранированных областях на металлических поверхностях, подверженных коррозионным воздействиям. Этот тип атаки обычно связан с небольшими объемами застойного раствора, вызванными отверстиями, поверхностями прокладок, соединениями внахлест, поверхностными отложениями и щелями под головками болтов и заклепок. В результате эту форму коррозии называют щелевой коррозией или, иногда, коррозией отложений или прокладок.
Питтинг
Точечная коррозия – это форма чрезвычайно локализованной атаки, в результате которой в металле образуются отверстия. Эти отверстия могут быть маленькими или большими в диаметре, но в большинстве случаев они относительно малы. Ямы иногда изолированы или расположены так близко друг к другу, что выглядят как шероховатая поверхность. Обычно яму можно описать как полость или отверстие с диаметром поверхности, примерно равным глубине или меньшим ее.
Точечная коррозия – одна из самых разрушительных и коварных форм коррозии.Это приводит к отказу оборудования из-за перфорации с небольшой потерей веса всей конструкции. Язвы часто бывает трудно обнаружить из-за их небольшого размера и из-за того, что ямы часто покрыты продуктами коррозии. Кроме того, трудно количественно измерить и сравнить степень ямок из-за разной глубины и количества ямок, которые могут возникнуть в одинаковых условиях. Язвенную коррозию также трудно предсказать с помощью лабораторных тестов. Иногда карьерам требуется много времени – несколько месяцев или год – для того, чтобы они появились в реальной эксплуатации.Точечная коррозия особенно опасна, потому что это локализованная и интенсивная форма коррозии, а отказы часто происходят очень внезапно.
Межкристаллитная коррозия
Эффекты границ зерен практически не влияют на большинство применений или применений металлов. Если металл корродирует, это приводит к равномерному разрушению, поскольку границы зерен обычно лишь немного более реактивны, чем матрица. Однако при определенных условиях границы раздела зерен очень реактивны и приводят к межкристаллитной коррозии.Локальное повреждение на границах зерен и рядом с ними при относительно небольшой коррозии зерен – это межкристаллитная коррозия. Сплав распадается (выпадают зерна) и / или теряет прочность.
Межкристаллитная коррозия может быть вызвана примесями на границах зерен, обогащением одного из легирующих элементов или истощением одного из этих элементов в зонах границ зерен. Было показано, что небольшие количества железа в алюминии, в котором растворимость железа низка, сегрегируют на границах зерен и вызывают межкристаллитную коррозию.Было показано, что исходя из соображений поверхностного натяжения, содержание цинка в латуни выше на границах зерен. Истощение хрома в областях границ зерен приводит к межкристаллитной коррозии нержавеющих сталей.
Селективное выщелачивание
Селективное выщелачивание – это удаление одного элемента из твердого сплава в результате коррозионных процессов. Самый распространенный пример – избирательное удаление цинка из латунных сплавов (децинковка). Подобные процессы происходят в других системах сплавов, в которых алюминий; железо, кобальт, хром и другие элементы удаляются.Селективное выщелачивание – это общий термин для описания этих процессов, и его использование исключает создание таких терминов, как деалюмификация, декобальтификация и т. Д. Разделение – это металлургический термин, который иногда применяется, но предпочтительным является селективное выщелачивание.
Эрозия Коррозия
Эрозионная коррозия – это ускорение или увеличение скорости разрушения или воздействия на металл из-за относительного движения между агрессивной жидкостью и поверхностью металла. Обычно это движение довольно быстрое и связано с механическим износом или истиранием.Металл удаляется с поверхности в виде растворенных ионов или образует твердые продукты коррозии, которые механически смываются с поверхности металла. Иногда движение окружающей среды уменьшает коррозию, особенно когда локальное повреждение происходит в застойных условиях, но это не эрозионная коррозия, поскольку износ не увеличивается.
Эрозионная коррозия проявляется в виде бороздок, оврагов, волн, закругленных отверстий и впадин и обычно имеет направленный характер.Во многих случаях отказы из-за эрозионной коррозии происходят за относительно короткое время, и они являются неожиданными в основном потому, что оценочные испытания на коррозию проводились в статических условиях или потому, что эффекты эрозии не учитывались.
Растрескивание от коррозии
Под коррозионным растрескиванием под напряжением понимается растрескивание, вызванное одновременным наличием растягивающего напряжения и определенной коррозионной среды. Многие исследователи классифицируют все отказы от растрескивания, происходящие в агрессивных средах, как коррозионное растрескивание под напряжением, включая отказы из-за водородного охрупчивания.Однако эти два типа отказов от взлома по-разному реагируют на переменные среды. Чтобы проиллюстрировать, катодная защита является эффективным методом предотвращения коррозионного растрескивания под напряжением, в то время как она быстро ускоряет эффекты водородного охрупчивания. Следовательно, важность рассмотрения коррозионного растрескивания под напряжением и водородной хрупкости как отдельных явлений очевидна. По этой причине два явления растрескивания обсуждаются отдельно в этой главе.
Во время коррозионного растрескивания металл или сплав практически не подвергаются атакам на большей части своей поверхности, в то время как мелкие трещины проходят через него.Это явление растрескивания имеет серьезные последствия, поскольку оно может возникать при напряжениях в диапазоне типичных расчетных напряжений. Показано, что воздействие кипящего MgCl2 при 310 ° F (154 ° C) снижает стойкость к прочности примерно до той, которая доступна при 1200 ° F.
Два классических случая коррозионного растрескивания – это «сезонное растрескивание» латуни и «каустическое охрупчивание» стали. Оба этих устаревших термина описывают существующие условия окружающей среды, которые привели к коррозионному растрескиванию под напряжением.Сезонное растрескивание относится к разрушению латунных гильз картриджей вследствие коррозионного растрескивания под напряжением. В период сильных дождей, особенно в тропиках, в латунных гильзах наблюдались трещины в месте опрессовки гильзы на пулю. Позже было обнаружено, что важным экологическим компонентом сезонного крекинга является аммиак, образующийся в результате разложения органических веществ.
В первых паровозах произошло много взрывов клепаных котлов. Исследование этих повреждений показало трещины или хрупкие разрушения в отверстиях под заклепки.Эти участки были подвергнуты холодной обработке во время клепки, и анализ белесых отложений, обнаруженных на этих участках, показал, что основным компонентом является едкий натр или гидроксид натрия. Следовательно, хрупкое разрушение в присутствии каустика привело к термину каустическое охрупчивание. В то время как одно только напряжение будет реагировать способами, хорошо известными в механической металлургии (т.е. ползучесть, усталость, разрушение при растяжении), а сама коррозия будет реагировать, вызывая характерные реакции растворения; одновременное действие обоих иногда приводит к катастрофическим результатам.
,Униформа Гальванический Dealloying расщелина выкрашивание SSC LME микрофон SCC HB-HE-HIC-HMX Усталость размывание Блуждающий ток Индекс | |
Гальваническая коррозия, биметаллическая коррозия или
Коррозия разнородных металлов: причины и профилактика | |
Распознавание гальванической коррозии | |
Что такое гальваническая коррозия? Гальваническая коррозия или «Биметаллическая коррозия» или «Коррозия разнородных металлов», как иногда ее называют, определяется как ускоренный коррозия металла из-за электрического контакта (включая физический контакт) с более благородным или неметаллическим металлом проводник (катод) в коррозионно-активном электролите. Менее устойчивый к коррозии или «активный» член опыт пары ускорился коррозия, в то время как коррозия больше стойкий или «благородный» член пары испытывает меньшую коррозию за счет эффекта «катодной защиты». Самый тяжелый приступ возникает на стыке между два разнородных металла. Чем дальше от биметаллического соединения, тем ниже степень ускоренной атаки снижается. На этом фото пластина из алюминиевого сплава толщиной 5 мм. физически (и, следовательно, электрически) соединены с мягкой сталью толщиной 10 мм. структурная опора. гальванический коррозия произошла на алюминиевой пластине вдоль соединение с мягкой сталью. Перфорация алюминиевой пластины произошла внутри 2 года из-за огромного ускорения гальванической коррозии. | |
Механизмы гальванической коррозии | |
Что вызывает гальваническую коррозию? У разных металлов и сплавов разные электрохимический потенциалы (или потенциалы коррозии) в том же электролит.Когда потенциалы коррозии различных металлов и сплавы измеряются в обычном электролите (например, в природной морской воде) и перечисленные в упорядоченном виде (по убыванию или возрастанию) в табличной форме, создается гальваническая серия. Следует подчеркнуть, что коррозия потенциалы должны быть измерены для всех металлов и сплавов в одном и том же электролит при одинаковых условиях окружающей среды (температура, pH, расход и т. д.), иначе потенциалы несопоставимы. Разность потенциалов (т.е. напряжение) между двумя разнородные металлы – движущая сила разрушительной атаки на активный металл (анод). Ток течет через электролит к более благородный металл (катод) и менее благородный металл (анод) будут подвержены коррозии. Электропроводность электролита также повлияет на степень атаки. Отношение площади катода к площади анода прямо пропорционально ускорению фактор. | |
Предотвращение гальванической коррозии | |
Как предотвратить гальваническая коррозия? Гальваническую коррозию можно предотвратить несколькими способами:
| |
| Гальваническая коррозия
Моделирование, прогнозирование и оценка GC-Compass : программный инструмент для гальваники Прогнозирование коррозии и оценка гальванической совместимости материалов GC-Compass – единственный независимый от устройства и ОС программный инструмент на рынок прогнозов гальванической коррозии и оценки материалов гальваническая совместимость.Дизайнеры, инженеры, архитекторы, консультанты, обслуживающий и инспекционный персонал может быстро оценить и количественно оценить влияние гальванической связи разнородных металлов на оставшийся срок службы их компоненты или системы в любое время, в любом месте, на любом устройстве под управлением любой ОС без необходимости устанавливать или скачивать что-либо. Более подробная информация о GC-Compass доступна. здесь . Более 200 гальванических пар включены в GC-Compass, компьютерное программное обеспечение для гальванической коррозии моделирование, прогнозирование и оценка совместимости материалов. Выходы программного обеспечения включают прогнозируемую скорость гальванической коррозии анодного элемента гальваническая пара, оставшийся срок службы анода и гальваническая класс совместимости. | |
Подробнее о Гальваническая коррозия – причины и предотвращение | |
Более подробная информация о гальванической или биметаллической коррозии содержится в следующих документах. курсы коррозии, которые вы можете пройти как внутренние учебные курсы, курс по запросу, онлайн курсы или дистанция учебных курсов по всему миру:
Если вам требуется свидетельство эксперта по коррозии или консультации по коррозии на гальваническая коррозия, наш сертифицированный специалист по коррозии NACE может вам помочь.Свяжитесь с нами, чтобы узнать цену. | |
Дом | Вверх | контакт Нас | PDF | Авторские права 1995-2020. Все права защищены. |
Точечная коррозия в сравнении с щелевой коррозией
Питтинговая коррозия и щелевая коррозия: определение различий
25 июня 2019 г. | Бехрам Гинвалла, старший менеджер по продукции
Коррозия – ухудшение технических материалов из-за химического взаимодействия с окружающей средой – является чрезвычайно дорогостоящей проблемой. Повреждение трубопроводных систем из-за неконтролируемой коррозии является основной причиной потери прибыли для морских и прибрежных сооружений, которая ежегодно обходится в миллиарды долларов.Коррозию можно предотвратить, если компании знают, что искать, и принимают превентивные меры для снижения рисков коррозии, пока еще не поздно.
Почти каждый металл, используемый в нашем мире, при определенных обстоятельствах подвергается коррозии. Существуют меры, которые можно предпринять для предотвращения коррозии в нефтегазовой отрасли, особенно на море. Эти шаги требуют фундаментального понимания различных типов коррозии и их причин. Знание того, где искать коррозию, может минимизировать риски для нефтяных вышек и нефтеперерабатывающих заводов, что значительно экономит время и деньги.
Заинтересованы в поиске подходящих материалов для морских и прибрежных территорий? Примите меры по борьбе с коррозией с помощью Руководства по выбору материалов Swagelok.
ПОСМОТРЕТЬ РУКОВОДСТВО ПО ВЫБОРУ МАТЕРИАЛОВ
Как возникает коррозия
Коррозия возникает, когда атом металла окисляется жидкостью, что приводит к потере материала на поверхности металла. В результате потери материала уменьшаются толщины стенок компонентов, изготовленных из углеродистой и низколегированной стали, которые подвержены общей коррозии, что делает их склонными к механическим повреждениям.
Металлические трубопроводные системы чаще всего используются для аналитических и технологических приборов, гидравлических линий, а также в системах управления и коммунальных службах. Многие технические металлы, используемые в нефтегазовой отрасли, изготавливаются из нержавеющей стали, содержащей более 10% хрома. Последний способствует образованию оксидного слоя, который защищает металлы от коррозии. Однако коррозия нержавеющей стали действительно возникает, когда условия окружающей среды вызывают разрушение этого слоя.
При определенных обстоятельствах почти каждый металл подвержен коррозии.Например, ржавчина является часто встречающимся побочным продуктом коррозии углеродистой стали, возникающей в результате коррозии железа и образования оксида железа. Однако существует множество других видов коррозии. Каждый тип представляет собой угрозу, которую необходимо оценить при выборе оптимального материала для вашего приложения.
Определение распространенных типов коррозии
Существует множество видов коррозии, которые могут нанести серьезный ущерб нефтегазовым установкам. Многие типы коррозии зависят от химического состава металла и окружающей среды.По мере чтения мы сосредоточимся на двух основных формах локальной коррозии нержавеющей стали: точечной коррозии и щелевой коррозии.
Питтинговая коррозия
Точечная коррозия возникает, когда защитный оксидный слой на поверхности нержавеющей стали разрушается, в результате чего металл становится восприимчивым к потере электронов. Эта электрохимическая реакция вызывает образование небольших полостей или «ямок».
Хотя ямки обычно обнаруживаются при тщательном визуальном осмотре, они могут вырасти достаточно глубоко, чтобы полностью пробить стенку трубы.Питтинговая коррозия также может способствовать возникновению трещин в компонентах, подверженных растягивающим нагрузкам. Среды с более высокими концентрациями хлоридов, в том числе создаваемые испарением из отложившихся капель соленой воды, склонны к точечной коррозии, особенно при высоких температурах.
При осмотре металлических трубок на предмет точечной коррозии ищите красновато-коричневые отложения оксида железа, а также потенциальные ямки, которые могли образоваться на поверхности металла.
Щелевая коррозия
Подобно точечной коррозии, щелевая коррозия начинается с разрушения защитной оксидной пленки нержавеющей стали и продолжается с образованием мелких ямок.Однако щелевая коррозия, как следует из названия, происходит не на виду, а в трещинах.
В типичной жидкостной системе существуют щели между трубками и опорами или зажимами трубок, между соседними участками трубок, а также под ними грязь и отложения, которые могли скопиться на поверхностях. В трубопроводах практически невозможно избежать трещин, а плотные трещины представляют собой одну из самых больших опасностей для целостности нержавеющей стали. Щелевая коррозия происходит, когда морская вода проникает в щель, что приводит к химически агрессивной среде, в которой вызывающие коррозию ионы не могут легко диффундировать из щели.В таком случае вся поверхность в щели может подвергнуться быстрой коррозии.
Щелевая коррозия может наблюдаться только визуально, когда хомут для трубки снят с установленной трубки. Важно помнить, что щелевая коррозия может происходить при более низких температурах, чем точечная коррозия.
Как предотвратить коррозию
Коррозию во многих случаях можно минимизировать за счет повышения квалификации персонала с базовыми знаниями материалов:
- Выбор материала: Во-первых, рассмотрите выбор материалов для труб, от самой трубки до опор и зажимов для труб.Трубки из нержавеющей стали 316 хорошо подходят для многих установок, если они содержатся в чистоте и при не слишком высоких температурах. В более теплом климате, особенно в местах, где легко образуются солевые отложения, и в установках, где ржавчина от конструкционных балок и полов из углеродистой стали накапливается на поверхностях из нержавеющей стали, легче наблюдается коррозия труб из нержавеющей стали 316.
Для таких ситуаций трубки из супераустенитной или супердуплексной нержавеющей стали обеспечивают гораздо лучшую коррозионную стойкость.Более высокий предел текучести и предел прочности на разрыв супердуплексной нержавеющей стали также упрощает создание систем, которые должны быть рассчитаны на более высокое максимально допустимое рабочее давление (МДРД). Чтобы избежать дорогостоящих ошибок и определить, какой материал подходит для вашего применения, обратитесь в местное уполномоченное лицо. Центр продаж и обслуживания Swagelok предоставит рекомендации по выбору подходящей продукции и материалов.
- Размещение и конструкция: Для предотвращения коррозии необходимы тщательные действия в системе, чтобы свести к минимуму количество мест, где может возникнуть щелевая коррозия.Один из способов уменьшить щели в системе труб – избегать размещения трубок непосредственно у стен или друг напротив друга. Когда наблюдается щелевая коррозия труб из нержавеющей стали 316, можно заменить трубки 316 на более устойчивые к коррозии трубки, которые можно установить с помощью недорогих трубных фитингов 316. Компания Swagelok предлагает несколько спроектированных комбинаций трубных обжимных фитингов из нержавеющей стали 316 с трубками из различных коррозионно-стойких сплавов.
Коррозия и материаловедение
Помимо этих простых мер, лучший подход к предотвращению коррозии включает углубленное обучение и выполнение регулярной и надежной программы мониторинга коррозии.Swagelok предлагает обучение материаловедению, чтобы научить инженеров, технических сотрудников и всех, кто участвует в процессе выбора материалов, правильно выбирать коррозионно-стойкие сплавы для ваших гидравлических систем. Базовое понимание коррозии – как она выглядит, где она возникает и по каким причинам – у тех, кто работает с системами трубопроводов каждый день, может предотвратить поломку материала и дорогостоящий ремонт. Обратитесь в местный центр продаж и обслуживания Swagelok, чтобы узнать, как программа обучения материаловедению может помочь вашей организации бороться с коррозией.
ПОДРОБНЕЕ ОБ ОБУЧЕНИИ SWAGELOK MATERIALS SCIENCE TRAINING
,Зеленые методы контроля коррозии
Зеленые ингибиторы коррозии или «экологически чистые ингибиторы» являются биоразлагаемыми соединениями и не содержат тяжелых металлов или других токсичных соединений. Они биосовместимы с природой. Подобно общей классификации «ингибиторов», «зеленые ингибиторы» также можно разделить на две категории, а именно: органические ингибиторы зеленого и неорганические ингибиторы зеленого.
2.1. Органические зеленые ингибиторы
Органические зеленые ингибиторы представляют собой хинин, алкалоиды, фенол, фенилпропаноидные флавоноиды, органические кислоты и другие натуральные продукты, полученные из природных источников, например растений.Он также включает синтетические соединения с незначительной токсичностью. Здесь растительные экстракты, камеди, лекарства и масла рассматриваются как ингибиторы зеленой коррозии. Использование отходов растений в качестве ингибиторов коррозии может быть еще одним способом расширения полезного использования этих растений и, таким образом, улучшения управления городскими отходами. Здесь обсуждаются некоторые заметные разработки в области органических зеленых ингибиторов, особенно экстрактов растений.
Водные растения содержат некоторые органические соединения, которые оказывают определенное физиологическое воздействие на организм человека, и эти биоактивные вещества включают алкалоиды, терпеноиды, стероиды, фенольные соединения, дубильные вещества и флавоноиды, и большинство из них, как известно, обладают эффективностью ингибирования коррозии.
Экстракты растительного сырья содержат много активных компонентов. Они содержат полярные или гетероатомы, такие как S, N, O, P, и ароматические кольца, способствующие адсорбции за счет донорно-акцепторного взаимодействия между π-электронами донорных атомов S, N, O, P и ароматических колец ингибиторов, а также вакантными d -орбитали поверхностных атомов металлов [16]. Из-за адсорбции молекул ингибитора на поверхности металла образуется защитная пленка, изолирующая металл от агрессивной среды. Таким образом, коррозия контролируется.
Большое количество органических экстрактов растительных материалов было использовано для предотвращения появления различных металлов, таких как мягкая сталь [17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28], различные виды стали [29, 30], чугун [31], алюминий и его сплавы [32, 33, 34], цинк и его сплавы [35, 36, 37, 38], медь [39, 40, 41], никель [42, 43] и олово [44, 45].
В зависимости от агрессивной среды экстракты растительного сырья использовались для предотвращения коррозии металлов в различных средах. Большинство исследований проводилось в кислой среде [31], чем в основной [34] и нейтральной [35].Для уменьшения коррозии использовались различные части растений, в том числе корни, листья, кора, цветы и плоды (скорлупа, сок и семена). Были использованы многие методы, такие как выделение водорода, метод потери веса, термометрические методы, электрохимические исследования и так далее, для оценки эффективности ингибирования коррозии ингибиторов, экстрагированных из растений. Защитная пленка была проанализирована с помощью различных методов анализа поверхности, таких как инфракрасная спектроскопия с преобразованием Фурье (FTIR), УФ-видимая спектроскопия, растровый электронный микроскоп (SEM), энергодисперсионный рентгеновский анализ (EDXA) и атомно-силовой микроскоп (AFM). ).
С течением времени экстракты растений использовались в качестве ингибиторов коррозии, отдельно или в сочетании с другими ингибиторами. Смесь экстрактов растений показывает лучшую эффективность ингибирования, чем отдельные компоненты, что называется синергетическим эффектом. Многие добавки использовались для повышения эффективности ингибирования растительных экстрактов. Например, Zn 2+ , метилендихлорид, н-бутанольный экстракт [46, 47, 48, 49, 50, 51], KI [22, 52, 53], KCl, KBr [54, 55, 56, 57, 58], формальдегид, диэтиламин [59], этилацетат [60] и диметилсульфоксид [61].
2.1.1. Преимущества и ограничения использования растительных экстрактов
Растительные экстракты безопасны для окружающей среды, нетоксичны, дешевы и легко поддаются биологическому разложению. Несмотря на эти характеристики экологически приемлемого, легкодоступного и возобновляемого источника широкого спектра зеленых ингибиторов, они имеют некоторые основные недостатки. Недостатком большинства сообщений о растительных экстрактах как ингибиторах коррозии является то, что активный ингредиент не идентифицирован. Кроме того, они легко поддаются биологическому разложению и заражаются микроорганизмами, которые ограничивают хранение жидкого экстракта или даже твердого экстракта в течение длительного времени.Согласно ряду исследований, опубликованных за последние два десятилетия по этим группам продуктов, растительные экстракты занимают первое место на 68% по ингибированию коррозии алюминия и его сплавов (рис. 1) [16].
Важно учитывать вид растительного экстракта (вода, спирт, кислота). Следовательно, качество ингредиентов, содержащихся в растительных экстрактах, влияет на эффективность экстрактов в ингибировании коррозии.
2.1.2. Механизм действия зеленых ингибиторов
Многие теоретические механизмы были заложены несколькими работниками.Эти механизмы суммируются в следующих пунктах:
Органические вещества могут образовывать ониевые ионы в кислых растворах и адсорбироваться на катодных участках поверхности металла.
Органические вещества в экстрактах некоторых растений содержат алкалоид берберин, который имеет длинную цепочку ароматических колец, атом азота в кольце и атомы O в качестве замещения атомов водорода. Свободные электроны на атомах O и N образуют связи с электронами на поверхности металла.
Аллилпропилдисульфид, который представляет собой S-содержащее ненасыщенное соединение, присутствует во многих растительных экстрактах и влияет на потенциальный катодный процесс металлов, таких как сталь.
Пирролидин в нейтральных и щелочных водных средах ионизируется, и атом азота приобретает отрицательный заряд, а более высокий заряд свободных электронов на N приводит к более прочной связи между пирролидином и металлами.
Атом N в алкалоиде рицинине находится в кольцевом присоединении –OCH 3 , способствуя взаимодействию с поверхностью металла.
2.2. Неорганические ингибиторы зеленого
Ингибиторы зеленого проявляют значительно улучшенные экологические свойства по сравнению с существующими ингибиторами, уровень токсичности которых превышает 50%. Действие неорганических зеленых ингибиторов заключается в улучшении пассивности металла и сплавов. В соответствии с этим, большинство неорганических ингибиторов зеленого являются соединениями или ионами металлов, которые имеют более положительный окислительно-восстановительный потенциал, чем поверхность металла, а также улучшают пассивность металла, способствуя восстановлению электроположительного металла и его осаждению на поверхности.Есть несколько неорганических солей, которые менее токсичны, чем ингибиторы хромата. Среди металлов, используемых в качестве ингибитора коррозии: ртуть (Hg) [62], соли лантаноидов (La) [63, 64], самарий (Sm) [63], соли церия [64, 65, 66, 67, 68] и платина (Pt) [69] (табл. 1).
| Ингибиторная среда | Металл и среда | Каталожный номер |
|---|---|---|
| La (NO 3 ) 3 , Sm (NO 3 ) 3 , LaCl 3 , SmCl 3 | AISI 434 SS в NaCl | [65] |
| CeCl 3 | Алюминиевый сплав в NaCl | [66] |
| CeCl 3 | Сплав AA5083 и оцинковка сталь в NaCl | [67] |
| CeCl 3 | Сплав Sn-Fe в NaCl | [68] |
| CeCl 3 | AA6964 Сплав Al-Zn в NaCl | [69 ] |
| (Ce (NO 3 ) 3 ∙ 6H 2 O) | Белая жесть в лимонно-цитрате | [70] |
| Триптамин (TA) | ARMCO железо в 0.5 M деаэрированный H 2 SO 4 | [71] |
Таблица 1.
Модельные неорганические зеленые ингибиторы.
Кроме того, существуют неорганические анионы, обеспечивающие пассивирующую защиту металлических поверхностей за счет их включения в оксидный слой; наиболее распространенными из них являются: хромат (CrO 4 2-), нитрат (NO 2 –), молибдат (MoO 3 –), фосфат (H 2 PO 3 – ) и силикаты [70].
2.2.1. Механизм действия ингибиторов
В нейтральных и щелочных средах реакция восстановления кислорода более предпочтительна, чем катодная реакция Ур. (1).
O2 + 2h3O + 2e → 4OH − E1
Катодная реакция в уравнении. (1) восстановления кислорода увеличивает локальный pH за счет создания высокой концентрации ионов OH –. Эти ионы OH – , сформированные над катодными узлами, реагируют с ионами металлов, присутствующими в растворе, в соответствии с уравнениями. (2) и (3).
Ce3 ++ 3OH− → CeOh4E2
La3 ++ 3OH− → LaOh4E3
Эти реакции вызывают осаждение оксидов или гидроксидов лантаноидов на катодных участках и блокируют их.Блокирование катодных активных центров этими соединениями снижает доступный катодный ток и, следовательно, уменьшает процесс коррозии.
.

 Электрохимического характера — возникает в результате соприкосновения раствора электролита с существующим металлом. В качестве электролита может выступать как конденсат, так и вода от дождя. Таким образом, можно говорить о том, что чем больше содержание солей и кислот в жидкости, тем больше будет и электропроводность, а также и скорость протекания самого процесса. Наиболее уязвимыми перед электрохимическим типом являются конструкции из металла, а именно различные заклёпки, соединения, которые сварены, а также места их повреждений. Если конструкционные особенности материала делают его максимально устойчивым к образованию ржавчины, то процесс развития коррозии значительно замедляется. Примером можно назвать оцинковку. Цинк имеет потенциал отрицательный, если сравнивать его, например, с железом, именно по этой причине железный сплав восстанавливается, а цинк продолжает коррозировать. Однако, если на поверхности имеется специальная защитная плёнка, это значительно замедляет скорость развития коррозийных процессов.
Электрохимического характера — возникает в результате соприкосновения раствора электролита с существующим металлом. В качестве электролита может выступать как конденсат, так и вода от дождя. Таким образом, можно говорить о том, что чем больше содержание солей и кислот в жидкости, тем больше будет и электропроводность, а также и скорость протекания самого процесса. Наиболее уязвимыми перед электрохимическим типом являются конструкции из металла, а именно различные заклёпки, соединения, которые сварены, а также места их повреждений. Если конструкционные особенности материала делают его максимально устойчивым к образованию ржавчины, то процесс развития коррозии значительно замедляется. Примером можно назвать оцинковку. Цинк имеет потенциал отрицательный, если сравнивать его, например, с железом, именно по этой причине железный сплав восстанавливается, а цинк продолжает коррозировать. Однако, если на поверхности имеется специальная защитная плёнка, это значительно замедляет скорость развития коррозийных процессов. Газового типа — ржавления металлов происходит только в присутствии газовой среды и только если есть минимальное содержания воды. Этот тип коррозии наиболее часто встречается в сферах промышленности, а также в химических отраслях.
Газового типа — ржавления металлов происходит только в присутствии газовой среды и только если есть минимальное содержания воды. Этот тип коррозии наиболее часто встречается в сферах промышленности, а также в химических отраслях. Коррозия, которая возникает преимущественно под напряжением — ржавление металла при этом типе происходит, только если присутствуют механические напряжения. Подобного рода процесс является небезопасным для конструкций опорного типа. Важным нюансом при этом типе является именно коррозийная усталость, которая имеет накопительный эффект и может возникать при периодическом напряжении.
Коррозия, которая возникает преимущественно под напряжением — ржавление металла при этом типе происходит, только если присутствуют механические напряжения. Подобного рода процесс является небезопасным для конструкций опорного типа. Важным нюансом при этом типе является именно коррозийная усталость, которая имеет накопительный эффект и может возникать при периодическом напряжении.