Кристаллическая решетка металлов это: Глава 2.2. Атомно-кристаллическое строение металлов — Купити в Харкові, Києві, Україні. Безкоштовне тестування
alexxlab | 29.04.2023 | 0 | Разное
атомная, молекулярная, металлическая и ионная
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно озучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно озучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другиеположения, то мы имеем дело с твердым веществом.
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.
Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.
Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.
Пластичность – это способность вещества деформироваться без разрушения.
Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.
По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.
В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.
Аморфный бор
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
Металлическаякристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Общее понятие о металлах
«Химия. 9 класс» — это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.
Смотреть галерею
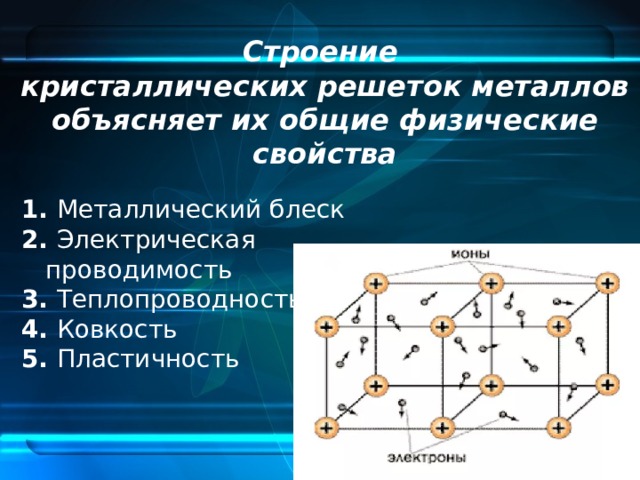
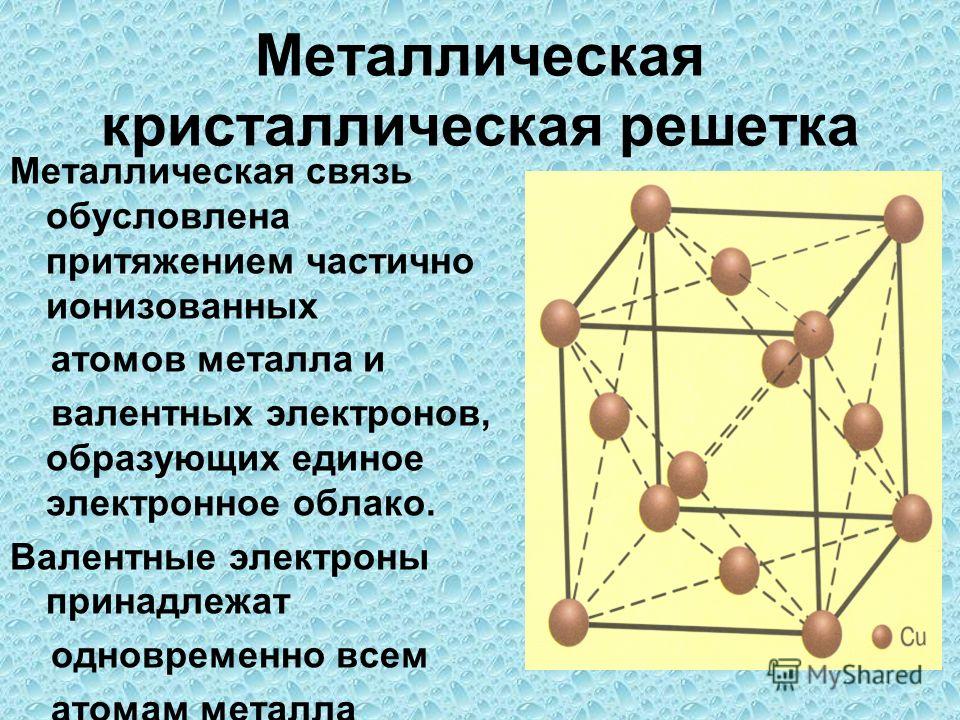
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки.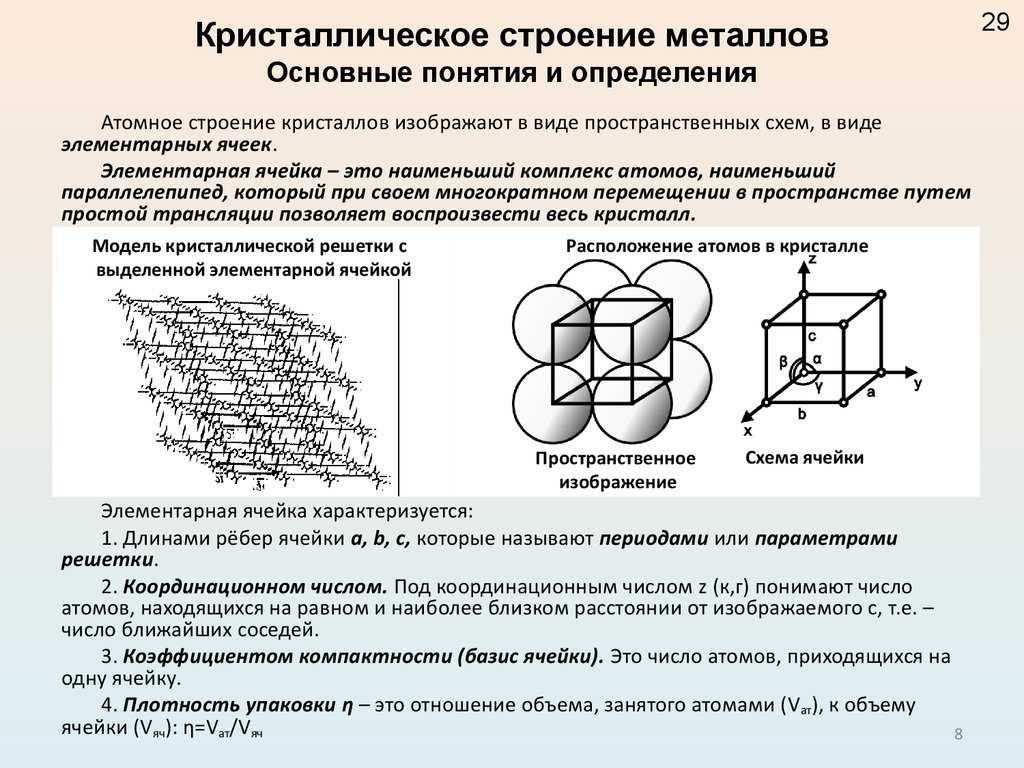 Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Свойства металлов
К специфическим свойствам рассматриваемых веществ относят следующие.
- Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
- Ковкость и пластичность — способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
- Электропроводность и теплопроводность — одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.
Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.
Смотреть галерею
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Научно-популярный журнал Познавайка
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Гранецентрированная решетка
Кристаллическое строение металлов, имеющих гранецентрированную кубическую решетку, представляет собой следующую структуру. Это куб, который включает в свой состав четырнадцать атомов. Восемь из них формируют узлы решетки, а еще шесть расположены по одному на каждой грани.
Восемь из них формируют узлы решетки, а еще шесть расположены по одному на каждой грани.
Подобную структуру имеют:
- алюминий;
- никель;
- свинец;
- гамма-железо;
- медь.
Основные отличительные свойства — блеск разного цвета, легкость, прочность, ковкость, повышенная устойчивость к коррозии.
Смотреть галерею
Кристаллическая решетка металлов – О производстве литья
Основные типы кристаллических решеток
Каждый металл(вещество) может находиться в трех агрегатных состояниях: газообразном, жидком и твердом, в каждом состоянии имеется своя кристаллическая решетка металлов.
В газообразном металле расстояние между атомами (частицами) велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве, отталкиваясь друг от друга. В газообразном состоянии атомы обладают большой кинетической энергией.
В жидком металле атомы (частицы) сохраняют лишь так называемый ближний порядок, т. е. закономерно расположено в объеме небольшое количество атомов, а не атомы всего объема. Ближний порядок неустойчив и может либо исчезнуть, либо возникнуть под действием тепловых колебаний.
е. закономерно расположено в объеме небольшое количество атомов, а не атомы всего объема. Ближний порядок неустойчив и может либо исчезнуть, либо возникнуть под действием тепловых колебаний.
В твердых телах порядок расположения атомов строго определенный, закономерный, силы взаимодействия уравновешены, тело сохраняет свою форму.
Правильное закономерное расположение атомов в пространстве характеризует кристаллическое состояние. Характер взаимодействия атомов в твердом теле определяется строением их внешних электронных оболочек.
Атомы металлов имеют небольшое количество внешних (валентных) электронов, слабо связанных с ядром (1 или 2 электрона). При сближении атомов электроны, находящиеся на внешних оболочках, теряют связь со своими атомами. Электроны коллективизируются и становятся достоянием всех атомов данного металла. Положительно заряженные ионы располагаются на таком расстоянии друг от друга, когда силы притяжения между электронами и ионами и отталкивания между ионами уравновешиваются.
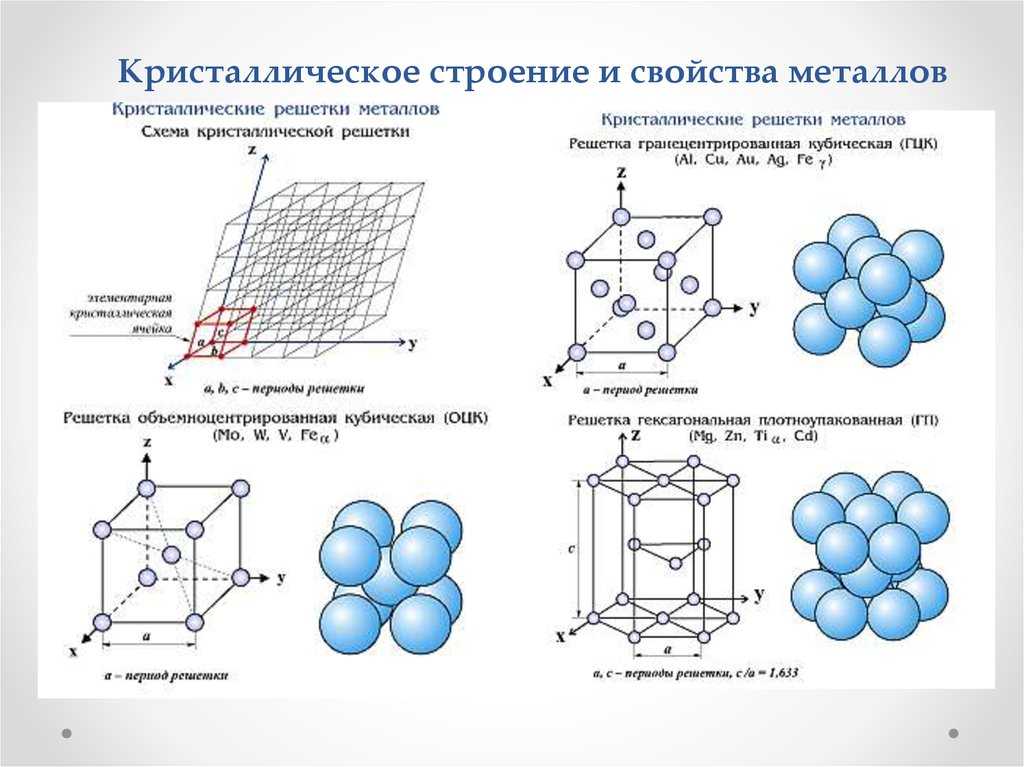
Закономерное расположение атомов (положительно заряженных ионов) приведено на рис.1. Воображаемые линии, в одной плоскости, образуют решетку, в узлах которой располагаются атомы (ионы). Такая конфигурация называется кристаллографической плоскостью.
Многократное повторение кристаллографических плоскостей в пространстве позволяет получить пространственную кристаллическую решетку (рис.2).
Пространственная кристаллическая решетка сложна в изображении, поэтому представление об атомном строении кристаллов дается в виде элементарных кристаллических ячеек. Под элементарной кристаллической ячейкой понимают минимальный объем кристалла, дающий представление об атомной структуре металла в любом объеме.
Простейшим типом кристаллического построения является кубическая решетка (рис.3). но в простой кубической решетке атомы уложены (упакованы) недостаточно плотно.
Поэтому стремление атомов занять места, наиболее близкие друг к другу, приводит к образованию новых типов решеток (рис. 4).
4).
Кристаллические решетки характеризуют следующие основные параметры: период решетки, координационное число, атомный радиус, энергия решетки, базис и коэффициент компактности решетки. Периодом решетки называется расстояние (a,b,c) между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решетки (см. рис.3).
Периоды решетки измеряют в ангстремах (А) или килоиксах (1А=10-8 см; кХ=1,00202·10-8см).
Координационное число К показывает количество атомов, находящихся на наиболее близком и равном расстоянии от любого выбранного атома в решетке.
Под атомным радиусом понимают половину межатомного расстояния между центрами ближайших атомов в кристаллической решетке элемента при равновесных условиях.
Базисом решетки называется количество атомов, приходящихся на одну элементарную ячейку решетки.
Коэффициент компактности ƞ решетки — отношение объема, занимаемого атомами Vа, ко всему объему решетки Vр. Для большинства металлов характерны следующие типы кристаллических решеток (см. рис.4).
Для большинства металлов характерны следующие типы кристаллических решеток (см. рис.4).
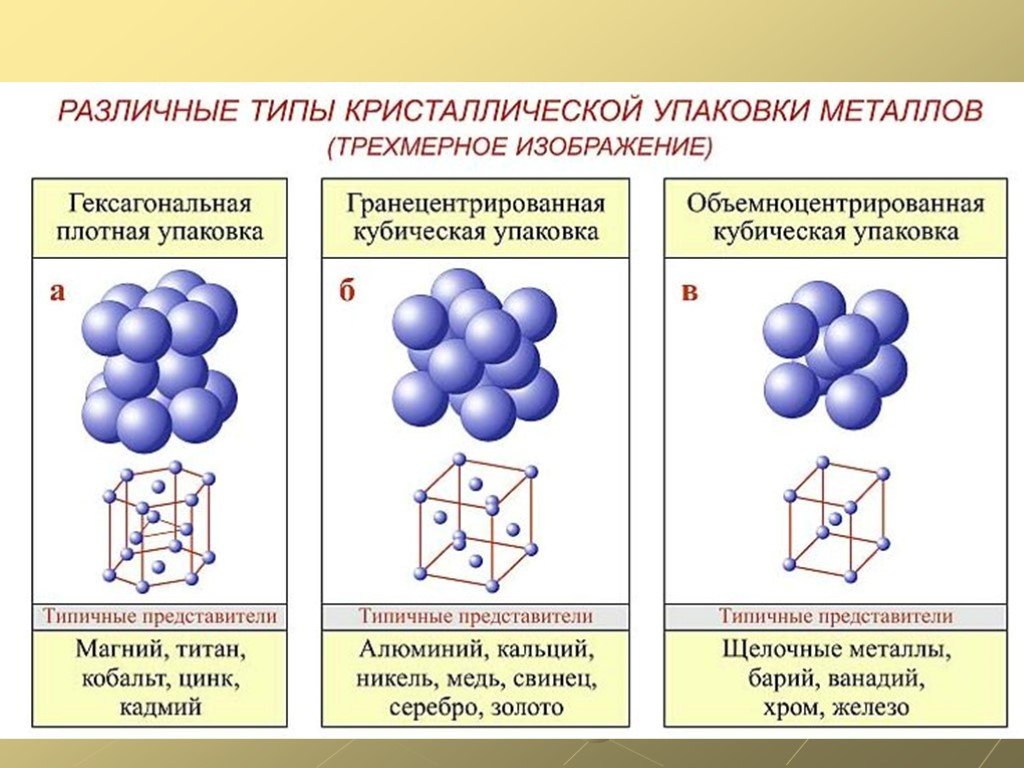
Кубическая объемно-центрированная решетка (ОЦК) имеет период решетки а, координационное число К=8, базис решетки равен 2(1+1/8·8=2). Коэффициентом компактности ƞ=68%. Данный тип решетки имеют металлы: K, Na, Li, Ta, W, Mo, Feα, Cr, Nb и т.д.
Кубическая гранецентрированная решетка (ГЦК) характеризуется периодом а, координационным числом К=12, базисом, равным 4, коэффициентом компактности ƞ=74%. Кубическую гранецентрированную решетку имеют следующие металлы: Ca, Pb, Ni, Ag, Pt, Feƴ и т.д.
Гексагональная плотноупакованная решетка (ГПУ) имеет период а и с, причем с/а=1,633, координационное число К=12, базис решетки равен 6, коэффициент компактности ƞ=74%. Такую решетку имеют металлы: J, Ru, Cd и т.д. Если с/аǂ1,633, то получаем гексагональную решетку с координационным числом К+6. Гексагональная решетка характерна для Mg, Zn.
Многие металлы в зависимости от температуры имеют два и три типа кристаллических решеток. Это объясняется тем, что у этих элементов происходит перекристаллизация в твердом состоянии, которая называется вторичной кристаллизацией. Способность некоторых металлов существовать в состояниях с различными атомно-кристаллическими решетками называется полиморфизмом.
Свойства каждой кристаллической решетки, взятые в одном направлении, отличаются от свойств в другом направлении. Различие свойств в зависимости от направления называется анизотропией.
Кристаллическая решетка, строение реальных кристаллов металлаТехнические металлы состоят из большого количества кристаллов (зерен), т.е. являются поликристаллическими. Кристаллы (зерна) в поликристаллическом металле не имеют правильной формы и идеально правильного расположения атомов. В них встречаются различного рода несовершенства кристаллического строения, которые оказывают большое влияние на свойства.
Увеличение количества дефектов кристаллического строения способствует повышению прочности реальных кристаллов.
Различают следующие несовершенства кристаллического строения- точечные, линейные и поверхностные.
Точечные несовершенства малы во всех трех измерениях. К ним относят вакансии, междоузельные (дислоцированные) атомы (рис.5).
Образование точечных несовершенств связано с диффузионным перемещением атомов под действием тепловых колебаний.
Под диффузией (для сплавов гетеродиффузией) понимают перемещение атомов в кристаллическом теле на расстояния, превышающие межатомные и вызывающие изменение концентрации в отдельных объемах. Если перемещения атомов не связаны с изменением концентрации в отдельных объемах, то такой процесс называется самодиффузией.
Скорость диффузии определяется количеством вещества m, диффундирующего через единицу площади поверхности раздела за единицу времени. Количество диффундирующего вещества m пропорционально коэффициенту диффузии D и зависит от градиента концентрации ds/dx элемента в направлении, нормальном к поверхности раздела.
Количество диффундирующего вещества m пропорционально коэффициенту диффузии D и зависит от градиента концентрации ds/dx элемента в направлении, нормальном к поверхности раздела.
m=-D· (ds/dx),
где ds – концентрация, dx- расстояние в выбранном направлении.
Эта зависимость называется первым законом Фика. Знак минус указывает, что диффузия протекает в направлении от объемов с большей концентрацией к объемам с меньшей концентрацией.
В большинстве случаев градиент концентрации изменяется во времени (τ) и тогда процесс диффузии описывается вторым законом Фика.
ds/dτ=D (d2c/dx2),
Коэффициент диффузии D равен массе вещества, диффундирующей за 1 с через площадку в 1 см2 при перепаде концентрации, равной единице. Он зависит от природы сплава, размеров зерна и особенно от температуры.
Процесс диффузии в кристаллическом теле возрастает с увеличением температуры. Под влиянием тепловых колебаний отдельные атомы с повышенной кинетической энергией покидают свои места в узлах решетки и выходят в междоузлия решетки или на поверхность кристалла. Атом, вышедший из равновесного положения в междоузлие, называют дислоцированным или междоузельным, а образовавшееся в узле решетки свободное место – «дыркой» или вакансией. С повышением температуры металла число вакансий растет.
Атом, вышедший из равновесного положения в междоузлие, называют дислоцированным или междоузельным, а образовавшееся в узле решетки свободное место – «дыркой» или вакансией. С повышением температуры металла число вакансий растет.
Точечные дефекты оказывают влияние на некоторые физических свойства металлов (электропроводность, магнитные свойства и т.п.) и на фазовые превращения в металлах и сплавах.
Линейные несовершенства имеют малые размеры в двух измерениях и большую протяженность в третьем измерении. Эти несовершенства называются дислокациями.
На рис 6., показана краевая дислокация, представляющая собой местное искажение кристаллической решетки, причиной которой явилась лишняя полуплоскость атомов, так называемая экстраплоскость. Для краевой дислокации характерно, что направление движения перпендикулярно линии дислокации Краевая дислокация простирается в длину на тысячи атомных рядов, может быть прямой, а также изгибаться в ту или иную сторону.
Если экстраплоскость расположена в верхней части кристалла, то дислокацию называют положительной и обозначают ꓕ, а если в нижней части – то отрицательной и обозначают ꓔ . Такое деление дислокаций условное и имеет важное значение при анализе их взаимодействия.
На рис.7 показана модель винтовой дислокации, у которой линия дислокации располагается параллельно направлению движения (параллельно вектору сдвига). Если винтовая дислокация образована движением по часовой стрелке, то ее называют правой, а против часовой стрелки – левой. Важной характеристикой дислокаций является вектор Бюргерса, который характеризует энергию искажения кристаллической решетки.
Для определения вектора Бюргерса краевой дислокации (рис.8) проведем вокруг дислокации контур ABCDE. Контур проводят таким образом, чтобы от точки А против часовой стрелки равномерно отложить по шесть межатомных расстояний снизу вверх AB, BC, CD, и DE. Контур замкнется на участке DA.
Участок DC состоит из шести межатомных расстояний, а DA – из пяти. Разность BC-DA=AE=b, где b – величина вектора Бюргерса. Определение вектора Бюргерса для кристалла, содержащего винтовую дислокацию, осуществляется аналогичным образом. В краевой дислокации вектор Бюргерса перпендикулярен ее линии, а у винтовой – параллелен ей. Если контур настроить вокруг нескольких дислокаций, то величина вектора Бюргерса будет соответствовать сумме векторов отдельных дислокаций. Вектор Бюргерса позволяет определить силы, необходимые для движения дислокации, силы взаимодействия и энергию дислокаций и т. д.
Важное значение имеет плотность дислокаций. Под плотностью дислокаций p (см-2) понимают суммарную длину дислокаций l (см), приходящуюся на единицу объема V кристалла (см3):
P=Ʃl/V,
Дислокации образуются в процессе кристаллизации, главным образом при деформации металла. Плотность дислокаций в металле до деформации составляет 106-108 см-2. Дислокации в металле распределены неравномерно. Плотность дислокаций на границах зерен выше, чем в самих зернах.
Дислокации в металле распределены неравномерно. Плотность дислокаций на границах зерен выше, чем в самих зернах.
Поверхностные или плоские, несовершенства малы только в одном измерении и велики в двух других измерениях. К ним относятся границы зерен (кристаллитов) и блоков мозаики (субзерен).
Зерна металла разориентированы относительно друг друга на величину от нескольких долей градуса (малоугловые границы) до нескольких градусов или нескольких десятков градусов (высокоугловые границы).
Граница между отдельными зернами представляет собой тонкую переходную зону (5-10 атомных диаметров) с максимальным нарушением порядка в расположении атомов (рис.9). Это нарушение усугубляется концентрацией на этих участках различного рода посторонних примесей.
Зерна металлов не являются однородными и состоят из мозаики однородных блоков (субзерен) размерами 10-8-10-3 см (1000-100 000 А). Блоки повернуты по отношению друг к другу на угол от нескольких секунд до нескольких минут (малоугловые границы). В пределах каждого блока решетка почти идеальная, если не принимать во внимание точечные дефекты. Атомы, расположенные на границах зерен, обладают повышенной энергией, вследствие некомпенсированности сил межатомного взаимодействия. Это обстоятельство приводит к тому, что многие процессы развиваются или осуществляются на границах зерен и субзерен.
В пределах каждого блока решетка почти идеальная, если не принимать во внимание точечные дефекты. Атомы, расположенные на границах зерен, обладают повышенной энергией, вследствие некомпенсированности сил межатомного взаимодействия. Это обстоятельство приводит к тому, что многие процессы развиваются или осуществляются на границах зерен и субзерен.
Используемая литература:
«Термическая обработка металлов» В.М. Зуев.
Определение кристаллической решетки в химии.
(существительное)
Правильное трехмерное геометрическое расположение атомов, молекул или ионов в кристалле.
Кристаллическая структура: упаковочные сферы
- Кристаллические материалы настолько высоко упорядочены, что кристалл решетка возникает из повторений вдоль всех трех пространственных измерений одного и того же паттерна.
- Кристалл Решетка представляет собой трехмерную структуру 9 атомных/молекулярных компонентов кристалла 0012.

- Структуру, наблюдаемую в кристаллической решетке материала, можно описать несколькими способами.
- В принципе, можно восстановить структуру всего кристалла , повторив элементарную ячейку так, чтобы создать трехмерную решетку .
- Для сферы внутри кристалла решетки количество сфер, контактирующих с оцениваемой сферой, известно как объемное координационное число.
Кристаллическая структура: ближайшая упаковка
- Эти ячейки периодически располагаются, образуя решетчатую структуру кристалла.
- В этом разделе рассматривается, как упаковка атомов в элементарных ячейках влияет на структуру решетки кристаллического твердого тела.
- Эффективность упаковки – это доля объема в структуре кристалла , которая занята составляющими частицами, а не пустым пространством.
- Понимание атомной упаковки в элементарной ячейке и кристалле решетке может дать представление о физических, химических, электрических и механических свойствах данного кристаллического материала.

- Обсудите два способа наиболее эффективной упаковки атомов/молекул в кристаллах .
Энергия решетки
- Энергия решетки является мерой прочности связи в ионном соединении.
- Например, энергия решетки хлорида натрия, NaCl, представляет собой энергию, высвобождаемую при объединении газообразных ионов Na+ и Cl- с образованием решетки чередующихся ионов в кристалле NaCl .
- Значение энергии можно оценить с помощью цикла Борна-Габера или теоретически рассчитать с помощью электростатического исследования структуры кристалла .
- Ионы натрия (Na+) и ионы хлорида (Cl-), изображенные фиолетовым и зеленым соответственно, чередуются в кристалл решетка твердого NaCl.
- В этом учебном пособии рассказывается об энергии решетки и о том, как сравнивать относительные энергии решетки различных ионных соединений.
Рентгеновские спектры: происхождение, дифракция на кристаллах и значение
- Показанный ниже закон Брэгга дает углы когерентного и некогерентного рассеяния света кристаллом
- Этот процесс известен как рентгеновская кристаллография из-за информации, которую он может дать о структуре кристалла .
- Например, текущие исследования в области высокотемпературных сверхпроводников включают сложные материалы, решетки которых имеют решающее значение для получения сверхпроводящего материала.
- Рентгеновская дифракция кристалла белка, лизоцима куриного яйца, дала эту интерференционную картину.
- Закон дифракции Брэгга: иллюстрация того, как рентгеновские лучи взаимодействуют с кристалл решетка .
- Показанный ниже закон Брэгга дает углы когерентного и некогерентного рассеяния света кристаллом
Ионные кристаллы
- Расположение ионов в правильной геометрической структуре называется кристаллом решеткой .

- Точное расположение ионов в решетке зависит от размера ионов в кристалле .
- Полученный кристалл решетка относится к типу, известному как «простая кубическая», что означает, что точек решетки равномерно распределены по всем трем измерениям, а все углы ячеек равны 90°.
- Энергия решетки , в то время как в основном за счет кулоновского притяжения между каждым ионом и его ближайшими соседями (шесть в случае NaCl) на самом деле является суммой всех взаимодействий внутри кристалла .
- Галит образует кубические кристаллы .
- Расположение ионов в правильной геометрической структуре называется кристаллом решеткой .
Третий закон
- Согласно третьему закону термодинамики энтропия идеального кристалл при абсолютном нуле точно равен нулю.
- Третий закон термодинамики иногда формулируют следующим образом: энтропия совершенного кристалла при абсолютном нуле точно равна нулю.
- Проще говоря, третий закон гласит, что энтропия совершенного 9Кристалл 0012 приближается к нулю, когда абсолютная температура приближается к нулю.
- При условии, что основное состояние уникально (или W=1), энтропия идеального кристалла решетки , как определено теоремой Нернста, равна нулю при условии, что его основное состояние уникально, поскольку log(1) = 0,
Растворы и теплоты гидратации
- Первая реакция (ионизация) всегда эндотермическая; требуется много работы, чтобы разрушить ionic кристалл решетка на составляющие его ионы.
- Чем больше значение энергии решетки соединения, тем больше сила, необходимая для преодоления кулоновского притяжения.
- На самом деле, некоторые соединения строго нерастворимы из-за их высокой энергии решетки , которую невозможно преодолеть для образования раствора.
- Горячий раствор получается, когда теплота гидратации намного больше, чем энергия решетки растворенного вещества.

- Предсказать, будет ли данное ионное твердое вещество растворяться в воде с учетом решетки энергии и теплоты гидратации
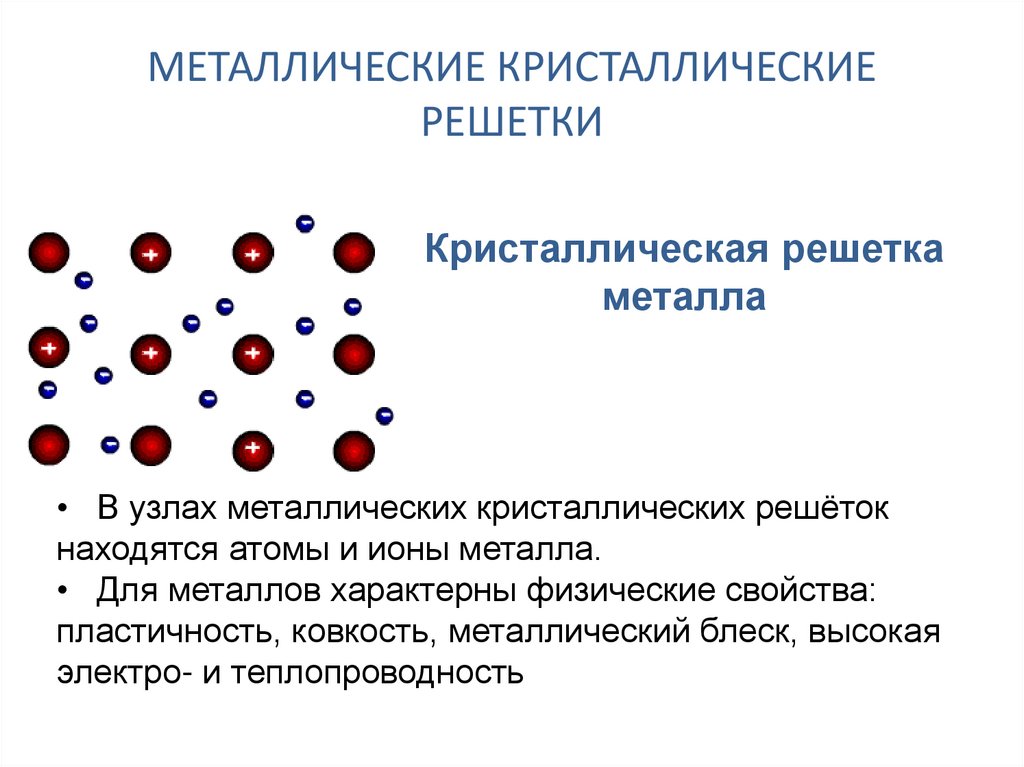
Металлические кристаллы
- Металлические кристаллы удерживаются вместе металлическими связями, электростатическими взаимодействиями между катионами и делокализованными электронами.
- Понимаемое как совместное использование «свободных» электронов в решетке положительно заряженных ионов (катионов), металлическая связь иногда сравнивается со связью расплавленных солей; однако эта упрощенная точка зрения справедлива для очень немногих металлов.
- Прочность металла обусловлена электростатическим притяжением между решеткой положительных ионов и «морем» валентных электронов, в которое они погружены.
- Высокая плотность большинства металлов обусловлена плотно упакованной кристаллической решеткой металлической структуры.
- В металлах носителями заряда являются электроны, и поскольку они свободно перемещаются по решетке , металлы обладают высокой проводимостью.

Кристаллические твердые вещества
- Существование более чем одной кристаллической формы для данного соединения называется полиморфизмом.
- Полиморфы соединения представляют собой различные кристаллические формы, в которых решетка расположение молекул отличается.
- Многие полиморфные соединения имеют гибкие молекулы, которые могут принимать различные конформации, и рентгенологическое исследование этих твердых веществ показывает, что их кристалл решетки накладывают определенные конформационные ограничения.
- Цвет кристалла варьируется от ярко-красного до фиолетового.
- На нем отображалось шесть полиморфных кристаллических форм, изображения которых показаны ниже.
Ковалентные кристаллы
- Ковалентные твердые вещества представляют собой класс соединений с расширенной решеткой , в которых каждый атом ковалентно связан со своим ближайшим соседом.
- Это означает, что все 9Кристалл 0012 , по сути, представляет собой одну гигантскую молекулу.
- Точно так же ковалентное твердое тело не может «плавиться» в обычном смысле, так как весь
- Он также довольно твердый из-за сильной ковалентной связи по всей решетке .
- Кубический нитрид бора имеет кристаллическую структуру , которую можно построить, заменив каждые два атома углерода в алмазе одним атомом бора и одним атомом азота.
- Ковалентные твердые вещества представляют собой класс соединений с расширенной решеткой , в которых каждый атом ковалентно связан со своим ближайшим соседом.
Изучение кристаллической структуры лития
Anne M Stark, stark8 [at] llnl.gov, (925) 422-9799
Элементарные металлы обычно образуют простые, плотно упакованные кристаллические структуры. Хотя литий (Li) считается типичным простым металлом, его кристаллическая структура при атмосферном давлении и низкой температуре остается неизвестной.
Ливерморская национальная лаборатория Лоуренса (LLNL) недавно разработала метод получения структурной информации для лития в условиях, когда традиционные кристаллографические методы недостаточны.
Li является самым легким металлом и наименее плотным твердым элементом в условиях окружающей среды. Li и его соединения имеют несколько промышленных применений, включая термостойкое стекло и керамику, литиевые консистентные смазки, флюсовые добавки для производства железа, стали и алюминия, литиевые батареи и литий-ионные батареи. Эти виды использования потребляют более трех четвертей производства лития.
«Сверхпроводимость щелочных металлов и лития — это вопрос, который обсуждался в течение многих лет», — сказал Станимир Бонев, ведущий автор статьи, опубликованной в последнем номере журнала 9.0325 Труды Национальной академии наук . «Только недавно была обнаружена сверхпроводимость лития при атмосферном давлении. Но чтобы понять сверхпроводящие свойства, необходимо знать кристаллическую структуру».
В дополнение к кристаллографическим методам группа ЛЛНЛ предложила измерения колебаний магнитного момента кристалла во внешнем магнитном поле. Команда провела теоретический анализ, показывающий, что спектр резонансов колебаний весьма различен для разных структур лития. Сравнение с имеющимися экспериментальными данными показывает, что низкотемпературная фаза Li несовместима с приписанным ранее 9Структура R (девять гексагональных слоев укладки).
Команда провела теоретический анализ, показывающий, что спектр резонансов колебаний весьма различен для разных структур лития. Сравнение с имеющимися экспериментальными данными показывает, что низкотемпературная фаза Li несовместима с приписанным ранее 9Структура R (девять гексагональных слоев укладки).
Li обладает очень интересными свойствами при высоком давлении. Когда он сжимается при низкой температуре, его критическая температура сверхпроводимости увеличивается — с 0,4 милликельвина при атмосферном давлении до 20 кельвинов при давлении около 500 000 атмосфер. Затем он превращается в полупроводник, затем снова в металл при более высоком давлении, но с очень сложной структурой.
В течение многих лет ученые пытались понять странное поведение лития. Теоретически существует несколько структур, очень близких по энергии. Чтобы окончательно определить, какая из них имеет абсолютную наименьшую энергию и, следовательно, является равновесной структурой, требуется огромная точность вычислений.