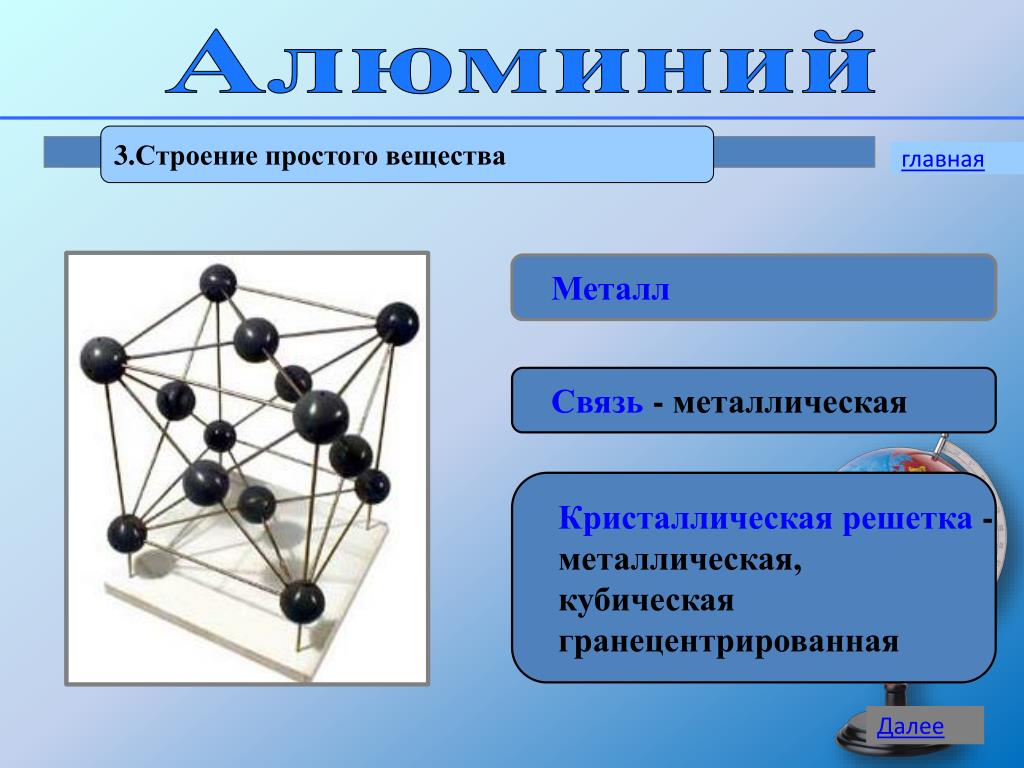
Кристаллическая решетка металлы: Кристаллическая решетка — что это? Типы и свойства
alexxlab | 23.04.2023 | 0 | Разное
Кристаллическая решетка — что это? Типы и свойства
Поможем понять и полюбить химию
Начать учиться
У каждого вещества есть набор физических свойств. Например, соли легко растворяются в воде и проводят электрический ток, а металлы имеют характерный блеск и ковкость. Такие характеристики зависят от строения вещества — от его кристаллической решетки. В этом материале мы расскажем о видах кристаллических решеток и о том, какие свойства придает веществу каждая из них.
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
д.
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).
Важно!
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.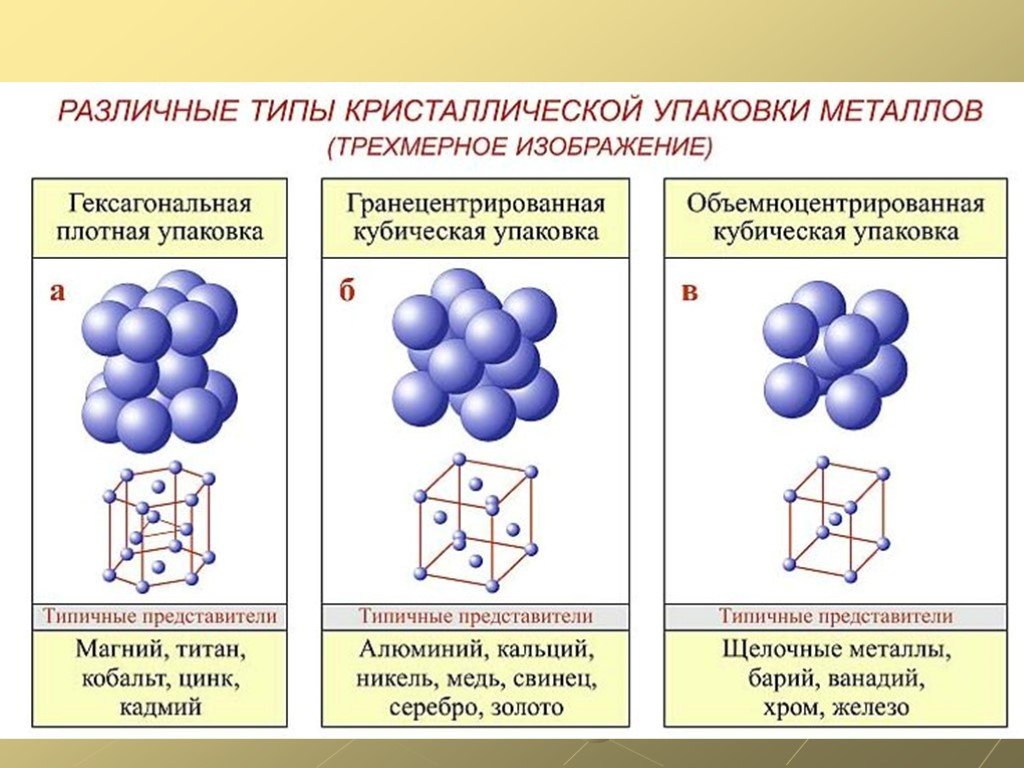
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка
— это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.Свойства веществ с атомной решеткой:
прочность,
твердость,
неспособность к растворению в воде,
высокая температура кипения и плавления.

К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Поэтому кристаллы таких веществ непрочные и легко распадаются.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
небольшая твердость;
низкая прочность;
легкоплавкость;
летучесть;
у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3
 Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Тип решетки | Частицы в узлах решетки | Тип связи между частицами | Примеры веществ | Физические свойства веществ |
|---|---|---|---|---|
| Атомная | Атомы | Ковалентная связь | Твердые неметаллы: графит, кремний, бор, германий и другие. | При обычных условиях прочные и твердые, тугоплавкие, нерастворимые в воде, нелетучие. |
| Молекулярная | Молекулы | Силы притяжения между молекулами | Вещества, образующие маленькие молекулы (CO2, Cl2, H2O), благородные газы, органические вещества. | При обычные условиях — газы или жидкости. Легкоплавкие, летучие, некоторые способны к возгонке. |
| Ионная | Ионы | Ионная связь | Соли, большая часть органических соединений, оксиды, щелочи. | Твердые, тугоплавкие, хрупкие, нелетучие, растворимы в воде, способны проводить электроток. |
| Металлическая | Атомы и ионы | Металлическая связь | Все металлы и сплавы. | Твердые (кроме ртути), ковкие, имеют блеск, отличаются теплопроводностью, электропроводностью. |
Строение и агрегатное состояние веществ
Выделяют три агрегатных состояния: твердое тело, жидкость и газ. Каждое из них предполагает определенное расположение частиц. Ниже мы расскажем подробнее, как связаны в химии кристаллическая решетка и агрегатное состояние вещества, а пока осветим общие закономерности.
Если частицы хаотично движутся, а расстояние между ними многократно превышает их собственные размеры — это газ. За счет большой удаленности друг от друга молекулы и атомы в таком веществе слабо взаимодействуют между собой.
Если частицы расположены все так же беспорядочно, но на небольшом расстоянии друг от друга — это

Если частицы собраны близко друг к другу и в определенном порядке — это твердое тело. В таком состоянии связи между ними наиболее прочны. Частицы могут двигаться только в пределах своего расположения и почти не перемещаются в пространстве.
Большинство веществ могут находиться и в твердом, и в жидком, и газообразном состоянии, а в зависимости от давления и температуры легко переходить из одного в другое. Типичный пример — вода, которая при нагревании превращается в пар, а при остывании становится твердым льдом.
Как определить кристаллическую решетку
Как понятно из предыдущего материала, строение вещества, его состав и физические характеристики тесно связаны. Поэтому для определения вида кристаллической решетки можно руководствоваться теми данными, которые у нас есть. Как правило, известен состав вещества, а значит, мы можем сделать вывод о химических связях внутри его молекулы, что позволит в свою очередь предположить тип решетки.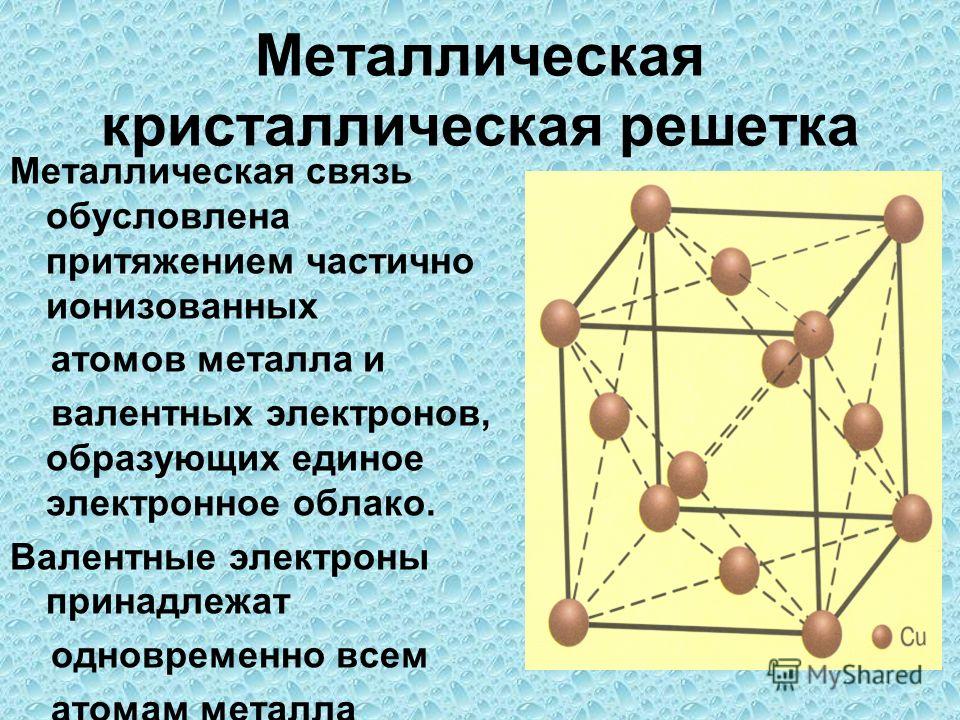
Также можно провести быстрый анализ:
если это неметалл, который при комнатной температуре представляет собой твердое тело — скорее всего он имеет атомную решетку;
если в обычных условиях это жидкость или газ либо речь об органическом веществе — предполагаем молекулярную решетку;
если это соль либо щелочь — кристаллы имеют ионную решетку;
если это металл или сплав — решетка точно будет металлической.
Вопросы для самопроверки:
Назовите виды кристаллических решеток.
Чем отличается кристаллическая решетка от химической связи?
Назовите примеры веществ с металлической кристаллической решеткой, с ионной, атомной и молекулярной.

Выберите лишнее вещество: молекулярную кристаллическую решетку имеет вода, поваренная соль, аргон, криптон.
Какое строение вещества придает ему высокую электропроводность?
Какое строение кристалла может придать веществу способность к возгонке?
Яна Кононенко
К предыдущей статье
198.1K
Химическая связь
К следующей статье
Массовая доля
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Кристаллическое строение металлов – кратко о типах
4. 5
5
Средняя оценка: 4.5
Всего получено оценок: 249.
4.5
Средняя оценка: 4.5
Всего получено оценок: 249.
Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
Рис. 2. Типы решёток.Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.

При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
Рис. 3. Кристаллические ячейки составляют решётку.Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 249.
А какая ваша оценка?
6.4: Кристаллические структуры металлов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 183327
- Химия 310
- Penn State University via Wikibook
Кристаллическая природа металлов
Все металлические элементы (кроме Cs, Ga и Hg) при комнатной температуре представляют собой твердые кристаллические вещества.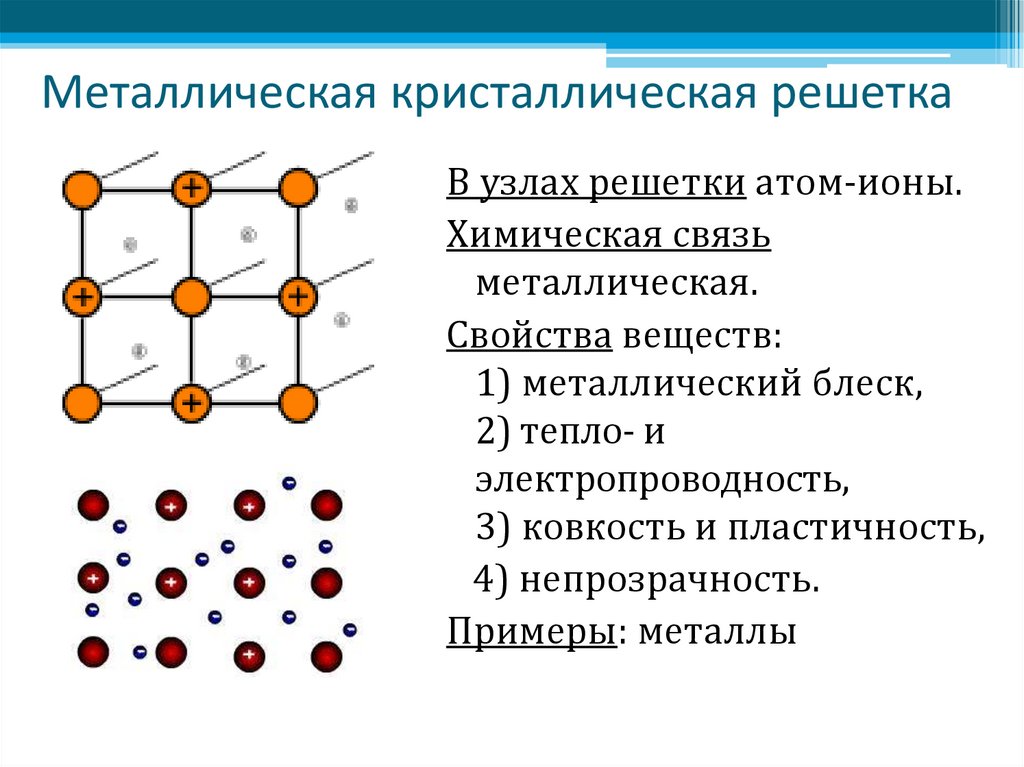 Подобно ионным твердым телам, металлы и сплавы имеют очень сильную тенденцию к кристаллизации, независимо от того, получены ли они термической обработкой или другими методами, такими как восстановление в растворе или гальваническое покрытие. Металлы легко кристаллизуются, и трудно получить стекловидный металл даже при очень быстром охлаждении. Расплавленные металлы имеют низкую вязкость, и одинаковые (по существу, сферические) атомы могут очень легко упаковываться в кристалл. Однако стеклообразные металлы можно получить путем быстрого охлаждения сплавов, особенно если составляющие их атомы имеют разные размеры. Различные атомы не могут упаковаться в простую элементарную ячейку, что иногда делает кристаллизацию достаточно медленной для образования стекла.
Подобно ионным твердым телам, металлы и сплавы имеют очень сильную тенденцию к кристаллизации, независимо от того, получены ли они термической обработкой или другими методами, такими как восстановление в растворе или гальваническое покрытие. Металлы легко кристаллизуются, и трудно получить стекловидный металл даже при очень быстром охлаждении. Расплавленные металлы имеют низкую вязкость, и одинаковые (по существу, сферические) атомы могут очень легко упаковываться в кристалл. Однако стеклообразные металлы можно получить путем быстрого охлаждения сплавов, особенно если составляющие их атомы имеют разные размеры. Различные атомы не могут упаковаться в простую элементарную ячейку, что иногда делает кристаллизацию достаточно медленной для образования стекла.
Кубический корпус |
ГПУ (слева) и ГЦК (справа) плотная упаковка сфер |
Кристаллические структуры
Большинство металлов и сплавов кристаллизуются в одной из трех очень распространенных структур: объемно-центрированной кубической (ОЦК), гексагональной плотноупакованной (ГПУ) или кубической плотноупакованной (ГЦК, также называемой гранецентрированной кубической, ГЦК) ). Во всех трех структурах координационное число атомов металла (т. е. число эквидистантных ближайших соседей) достаточно велико: 8 для ОЦК и 12 для ГПУ и ГПУ. Мы можем сравнить это с низкими координационными числами (то есть с низкими валентностями — например, 2 для O, 3 для N или 4 для C), обнаруженными у неметаллов. В ОЦК структуре ближайшие соседи находятся в углах куба, окружающего атом металла в центре. В ГПУ- и ПЦП-структурах атомы упаковываются подобно сложенным друг на друга пушечным ядрам или бильярдным шарам в слоях с шестикоординатным расположением. У каждого атома также есть еще шесть ближайших соседей из слоев выше и ниже. Последовательность укладки ABCABC… в решетке ccp и ABAB… в hcp. В обоих случаях можно показать, что сферы заполняют 74% объема решетки. Это наибольшая объемная доля, которой можно заполнить решетку из равных сфер.
Во всех трех структурах координационное число атомов металла (т. е. число эквидистантных ближайших соседей) достаточно велико: 8 для ОЦК и 12 для ГПУ и ГПУ. Мы можем сравнить это с низкими координационными числами (то есть с низкими валентностями — например, 2 для O, 3 для N или 4 для C), обнаруженными у неметаллов. В ОЦК структуре ближайшие соседи находятся в углах куба, окружающего атом металла в центре. В ГПУ- и ПЦП-структурах атомы упаковываются подобно сложенным друг на друга пушечным ядрам или бильярдным шарам в слоях с шестикоординатным расположением. У каждого атома также есть еще шесть ближайших соседей из слоев выше и ниже. Последовательность укладки ABCABC… в решетке ccp и ABAB… в hcp. В обоих случаях можно показать, что сферы заполняют 74% объема решетки. Это наибольшая объемная доля, которой можно заполнить решетку из равных сфер.
Атомы в металлических кристаллах имеют тенденцию собираться в плотные структуры, которые эффективно заполняют пространство. Простая квадратная упаковка (выше), на которой основана простая кубическая структура, неэффективна и поэтому редко встречается среди металлических кристаллических структур. Структуры, ориентированные на тело или лицо, заполняют пространство более эффективно и чаще.
Простая квадратная упаковка (выше), на которой основана простая кубическая структура, неэффективна и поэтому редко встречается среди металлических кристаллических структур. Структуры, ориентированные на тело или лицо, заполняют пространство более эффективно и чаще.
Периодические тенденции в структуре и поведении металлов
Вспомните, где мы находим металлические элементы в периодической таблице – везде, кроме правого верхнего угла. Это означает, что по мере того, как мы спускаемся по группе p-блока (скажем, группа IVA, группа углерода, или группа VA, группа азота), свойства элементов постепенно меняются от неметаллов к металлоидам и металлам. Углеродная группа прекрасно иллюстрирует этот переход. Начиная сверху, углерод имеет две стабильные аллотропные формы — графит и алмаз. В каждом из них валентность атомов углерода точно удовлетворяется за счет образования четырех электронных парных связей с соседними атомами. В графите у каждого атома углерода есть три ближайших соседа, поэтому имеется две одинарные связи и одна двойная связь. В алмазе есть четыре ближайших соседа, расположенных в вершинах тетраэдра, и поэтому с каждым из них связана одинарная связь.
В алмазе есть четыре ближайших соседа, расположенных в вершинах тетраэдра, и поэтому с каждым из них связана одинарная связь.
Два элемента сразу после углерода (кремний и германий) в периодической таблице также имеют структуру алмаза (напомним, что эти элементы не могут легко образовывать двойные связи друг с другом, поэтому для Si или Ge нет аллотропа графита). Хотя алмаз является хорошим изолятором, кремний и германий являются полупроводниками (то есть металлоидами). Механически они тверды, как алмаз. Подобно углероду, каждый атом Si и Ge удовлетворяет своей валентности, равной четырем, образуя одинарные связи с четырьмя ближайшими соседями.
Следующим элементом после германия является олово (Sn). Олово имеет две аллотропные формы: одну со структурой алмаза и одну со слегка искаженной ОЦК-структурой. Последний имеет металлические свойства (металлический блеск, ковкость) и проводимость примерно в 10 9 раз выше, чем Si. Наконец, свинец (Pb), элемент под Sn, имеет структуру ccp и также является металлическим. Обратите внимание на изменения координационного числа и проводящих свойств:
Обратите внимание на изменения координационного числа и проводящих свойств:
| Элемент | Структура | Координ. нет. | Проводимость |
|---|---|---|---|
| С | графит, алмаз | 3, 4 | полуметалл, изолятор |
| Си | алмаз | 4 | полупроводник |
| Ге | алмаз | 4 | полупроводник |
| Сн | алмаз, искаженный bcc | no.”> 4, 8 | полупроводник, металл |
| Пб | куб.см | 12 | металл |
Элементы C, Si и Ge подчиняются правилу октетов, и мы можем легко идентифицировать связи электронных пар в их структурах. Sn и Pb, с другой стороны, принимают структуры с высокими координационными числами. Они не имеют достаточного количества валентных электронов для создания электронных парных связей с каждым соседом (это общая черта металлов). В этом случае происходит то, что валентные электроны становятся «размазанными» или делокализованными по всем атомам в кристалле. Лучше всего думать о связи в металлах как о кристаллическом расположении положительно заряженных ядер с «морем» общих валентных электронов, склеивающих структуру. Поскольку электроны не локализованы в какой-либо конкретной связи между атомами, они могут двигаться в электрическом поле, поэтому металлы хорошо проводят электричество. Другой способ описать связь в металлах — ненаправленная. То есть ближайшие соседи атома окружают его во всех направлениях, а не в нескольких конкретных направлениях (как в углах тетраэдра, как мы обнаружили для алмаза). С другой стороны, неметаллы (изоляторы и полупроводники) имеют направленную связь. Поскольку связь является ненаправленной, а координационные числа высоки, относительно легко деформировать координационную сферу (т. Е. Разорвать или растянуть связи), чем в случае неметалла. Вот почему такие элементы, как Pb, гораздо более пластичны, чем C, Si или Ge.
Другой способ описать связь в металлах — ненаправленная. То есть ближайшие соседи атома окружают его во всех направлениях, а не в нескольких конкретных направлениях (как в углах тетраэдра, как мы обнаружили для алмаза). С другой стороны, неметаллы (изоляторы и полупроводники) имеют направленную связь. Поскольку связь является ненаправленной, а координационные числа высоки, относительно легко деформировать координационную сферу (т. Е. Разорвать или растянуть связи), чем в случае неметалла. Вот почему такие элементы, как Pb, гораздо более пластичны, чем C, Si или Ge.
Эта страница под названием 6.4: Кристаллические структуры металлов распространяется под лицензией CC BY-SA 4.0 и была создана, изменена и/или курирована Chemistry 310 (Wikibook) посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами Платформа LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Химия 310 Студенты
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- source@https://en.wikibooks.org/wiki/Introduction_to_Inorganic_Chemistry
Кристалл | Определение, типы, структура и факты
кристалл
Посмотреть все носители
- Ключевые люди:
- Николаус Стено Ральф Уолтер Грейстоун Вайкофф Макс фон Лауэ Жорж Фридель Торберн Улоф Бергман
- Похожие темы:
- жидкокристаллический плеохроизм двойное преломление симметрия полиморфизм
Просмотреть весь связанный контент →
Узнайте, как форма кристаллов определяет различные минералы в семейства
Просмотреть все видео к этой статье кристалл , любой твердый материал, в котором атомы компонентов расположены в определенном порядке и чья поверхность регулярна отражает его внутреннюю симметрию.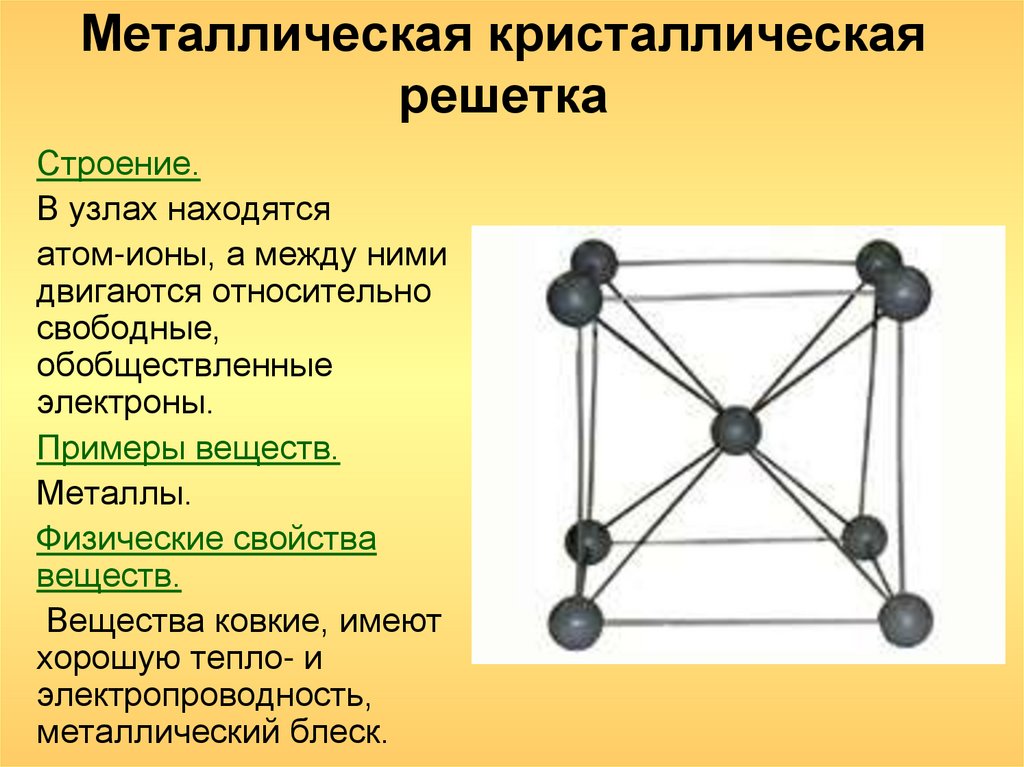
Классификация
Определение твердого тела кажется очевидным; твердое тело обычно считается твердым и твердым. Однако после проверки определение становится менее простым. Кусочек сливочного масла, например, после хранения в холодильнике становится твердым и явно твердым. Пролежав сутки на кухонном столе, тот же кубик становится довольно мягким, и неясно, следует ли по-прежнему считать масло твердым. Многие кристаллы ведут себя как масло в том смысле, что они тверды при низких температурах, но мягки при более высоких температурах. Они называются твердыми при всех температурах ниже их точки плавления. Возможное определение твердого тела – это объект, который сохраняет свою форму, если его не трогать. Актуальным вопросом является то, как долго объект сохраняет свою форму. Высоковязкая жидкость сохраняет свою форму в течение часа, но не года. Твердое тело должно дольше сохранять свою форму.
Основные единицы измерения твердых тел
Основными единицами твердых тел являются либо атомы, либо атомы, объединившиеся в молекулы. Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Электроны атома движутся по орбитам, образующим оболочечную структуру вокруг ядра. Оболочки заполняются в систематическом порядке, причем каждая оболочка содержит лишь небольшое количество электронов. Разные атомы имеют разное количество электронов, которые распределены в характерной электронной структуре заполненных и частично заполненных оболочек. Расположение электронов атома определяет его химические свойства. Свойства твердых тел обычно можно предсказать, исходя из свойств составляющих их атомов и молекул, и поэтому различные оболочечные структуры атомов ответственны за разнообразие твердых тел.
Все занятые оболочки атома аргона (Ar), например, заполнены, что приводит к сферической форме атома. В твердом аргоне атомы расположены в соответствии с плотнейшей упаковкой этих сфер. Атом железа (Fe), напротив, имеет одну электронную оболочку, которая заполнена лишь частично, что придает атому чистый магнитный момент. Таким образом, кристаллическое железо является магнитом. Ковалентная связь между двумя атомами углерода (C) является самой прочной связью в природе. Эта сильная связь делает алмаз самым твердым телом.
Эта сильная связь делает алмаз самым твердым телом.
Викторина “Британника”
Наука: правда или вымысел?
Твердое тело называется кристаллическим, если оно имеет дальний порядок. Как только положение атома и его соседей известно в одной точке, место каждого атома точно известно во всем кристалле. У большинства жидкостей отсутствует дальний порядок, хотя у многих есть ближний порядок. Ближний радиус определяется как первые или вторые ближайшие соседи атома. Во многих жидкостях первые соседние атомы расположены так же, как и в соответствующей твердой фазе. Однако на расстояниях, которые составляют много атомов, положения атомов становятся некоррелированными. Эти жидкости, такие как вода, имеют ближний порядок, но не имеют дальнего порядка. Некоторые жидкости могут иметь ближний порядок в одном направлении и дальний порядок в другом; эти специальные вещества называются жидкими кристаллами. Твердые кристаллы имеют как ближний, так и дальний порядок.
Твердые тела, имеющие ближний порядок, но не имеющие дальнего порядка, называются аморфными. Почти любой материал можно сделать аморфным путем быстрого затвердевания из расплава (расплавленное состояние). Это условие нестабильно, и твердое тело со временем кристаллизуется. Если время кристаллизации исчисляется годами, то аморфное состояние оказывается стабильным. Стекла являются примером аморфных твердых тел. В кристаллическом кремнии (Si) каждый атом тетраэдрически связан с четырьмя соседями. В аморфном кремнии (a-Si) существует тот же ближний порядок, но направления связей меняются на более удаленных от любого атома расстояниях. Аморфный кремний — это разновидность стекла. Квазикристаллы — еще один тип твердых тел, в которых отсутствует дальний порядок.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Большинство твердых материалов, встречающихся в природе, существуют в поликристаллической форме, а не в виде монокристалла.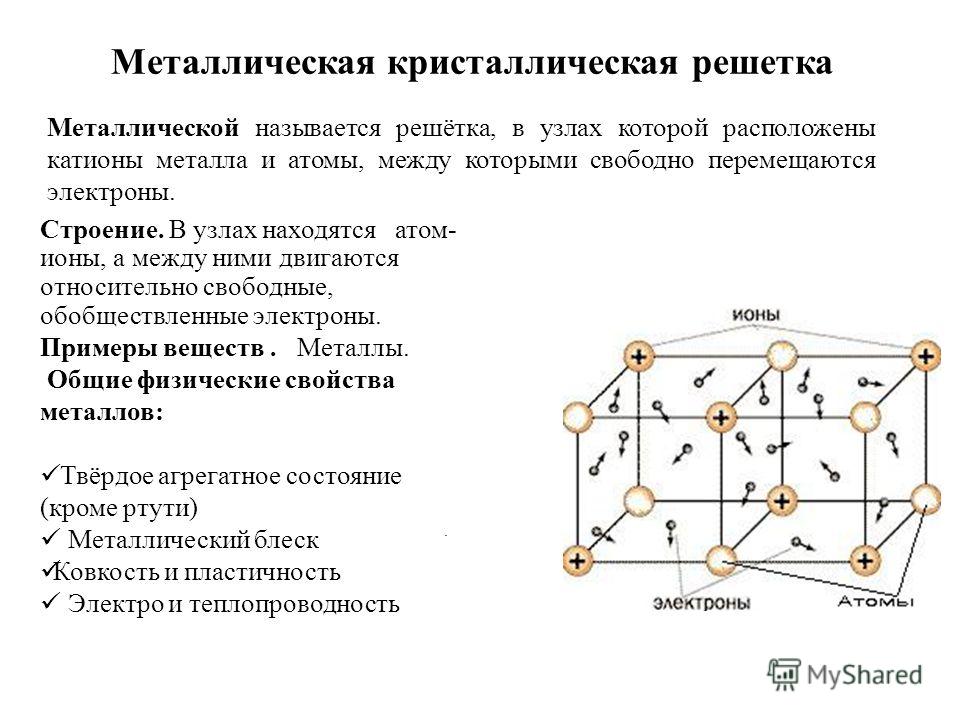 На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
На самом деле они состоят из миллионов зерен (маленьких кристаллов), упакованных вместе, чтобы заполнить все пространство. Каждое отдельное зерно имеет другую ориентацию, чем его соседи. Хотя дальний порядок существует в пределах одного зерна, на границе между зернами упорядочение меняет направление. Типичный кусок железа или меди (Cu) является поликристаллическим. Монокристаллы металлов мягки и пластичны, а поликристаллы тверже и прочнее и более применимы в промышленности. Большинство поликристаллических материалов можно превратить в крупные монокристаллы после длительной термообработки. В прошлом кузнецы нагревали кусок металла, чтобы сделать его ковким: тепло заставляет несколько зерен увеличиваться за счет включения более мелких. Кузнецы сгибали размягченный металл, придавая ему форму, а затем некоторое время растирали его; удары снова сделают его поликристаллическим, увеличив его прочность.
Категории кристаллов
Кристаллы классифицируются по общим категориям, таким как изоляторы, металлы, полупроводники и твердые молекулярные вещества.