Кристаллическое строение металлов: Глава 2.2. Атомно-кристаллическое строение металлов — Купити в Харкові, Києві, Україні. Безкоштовне тестування
alexxlab | 30.07.1996 | 0 | Разное
1. Кристаллическое строение металлов. Типы кристаллических решеток металлов
Лекция. Строение и свойство металлов
Вопросы
1. Кристаллическое строение металлов. Типы кристаллических решеток металлов
2. Анизотропия. Аллотропия (полиморфизм)
3. Аллотропические видоизменения железа
4. Кристаллизация металлов
5. Реальное строение металлических кристаллов
6. Методы исследования строения металлов
Твердые
вещества по взаимному расположению
атомов делят на аморфные и кристаллические. Аморфными называют
твердые вещества, атомы которых
располагаются в пространстве хаотично.
При нагревании они размягчаются и
переходят в жидкое состояние в широком
интервале температур и на кривой нагрева
(на штриховой на рис.1) не выражен этот
переход. К таким веществам относят
стекло, смолу, канифоль, клей и др.
К таким веществам относят
стекло, смолу, канифоль, клей и др.
Кристаллическими называют твердые вещества, в которых атомы расположены в пространстве в строго определенном порядке. Эти вещества при нагреве остаются в твердом состоянии и переходят в жидкое при определенной температуре (рис.1, сплошная линия).
Рис.1
Все металлы являются кристаллическими веществами. Для описания кристаллической структуры металлов пользуются понятием
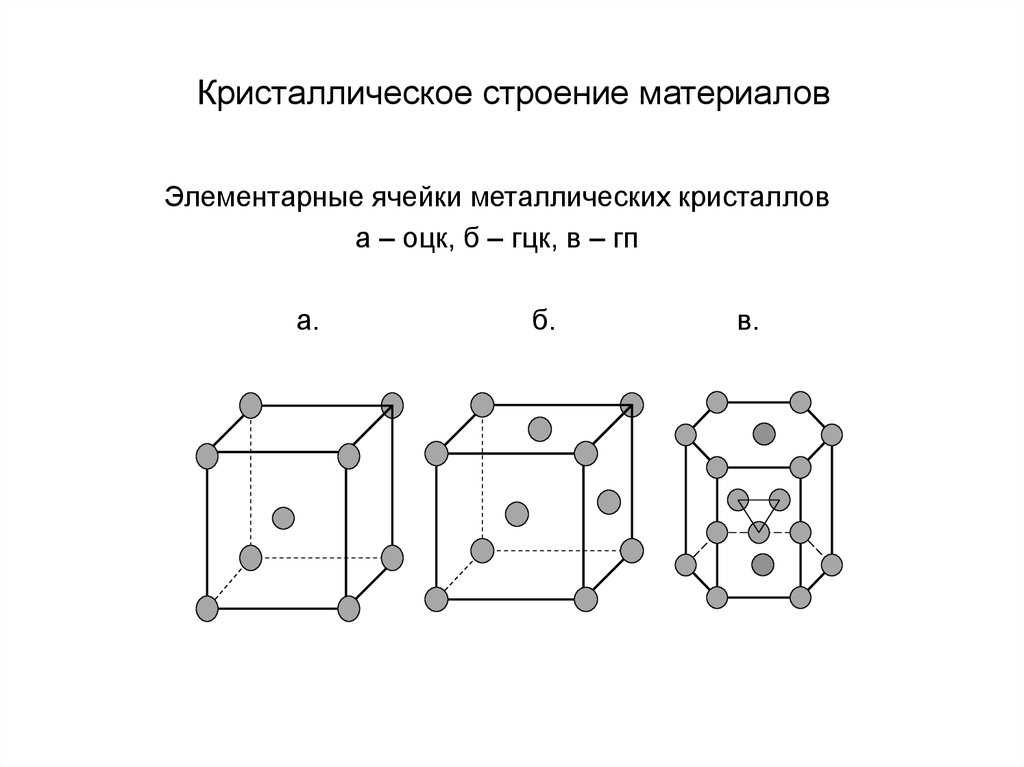
кристаллической решетки. Кристаллическая решетка – это воображаемая пространственная сетка, в узлах которой расположены атомы. Наименьшая часть кристаллической решетки, определяющая структуру металла, называется элементарной кристаллической ячейкой. Элементарная ячейка повторяется во всех трех измерениях и полностью характеризует структуру кристалла. На рис. 2 изображены элементарные ячейки для наиболее распространенных кристаллических решеток, которые имеют металлы:
Рис. 2.Пространственные
кристаллические решетки:
2.Пространственные
кристаллические решетки:а) кубическая объемно-центрированная; б) кубическая гранецентрированная: в) гексагональная плотноупакованная.
На рис.2,а приведена схема элементарной ячейки кубической объемно-центрированной решетки; она ограничивается девятью атомами, восемь из которых расположены по вершинам куба, а девятый – в его центре. Повторением этой ячейки путем переносов образуется вся структура кристалла.
Элементарная ячейка кубической гранецентрированной решетки (рис. 2, б) ограничивается 14 атомами: восемь из них расположены по вершинам куба, шесть – по его граням..
На рис. 2,в приведена схема элементарной ячейки гексагональной решетки. Она ограничена 17 атомами, из которых 12 расположены по вершинам шестигранной призмы, два атома – в центре оснований и три -внутри призмы.
В отдельно взятом кристалле свойства различны в разных направлениях.
Если
взять большой кристалл ( существуют методы выращивания крупных
кристаллов), вырезать из него несколько
одинаковых по размеру, но различно
ориентированных образцов и испытать
их свойства, можно иногда
наблюдать значительную разницу в
свойствах отдельных образцов.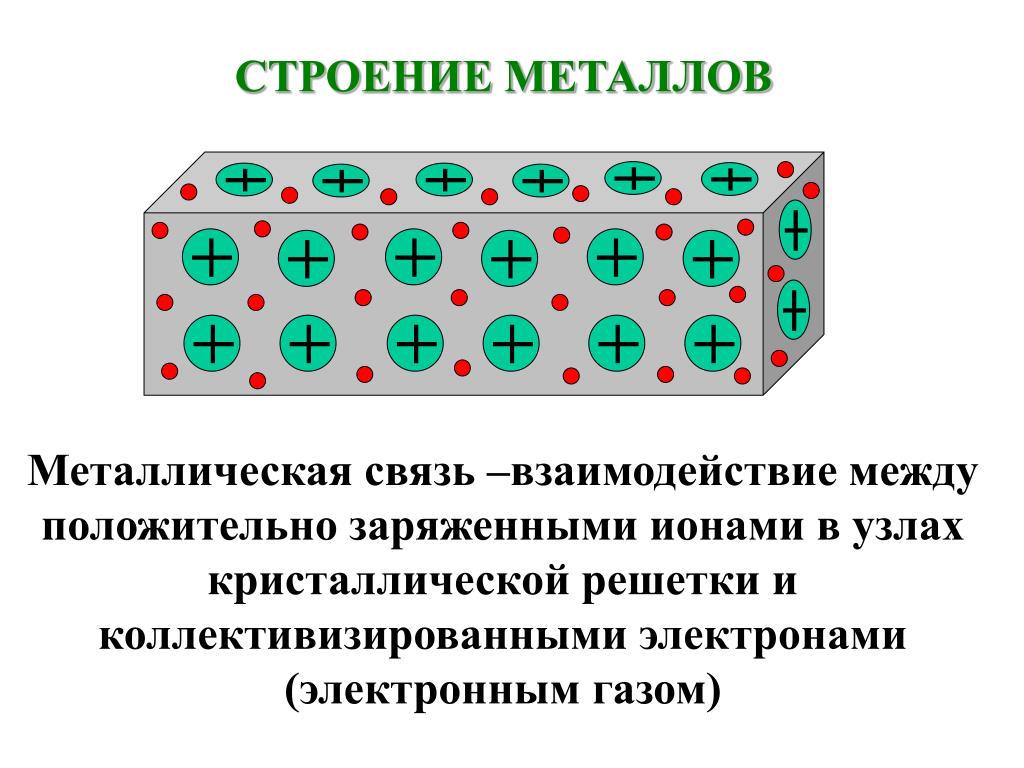 Например,
при испытании различных образцов из
кристалла меди относительное удлинение
изменяется от 10 до 55 %, а предел прочности
-от 140 до 350 МПа. Это свойство кристаллов
называют анизотропностью.
Например,
при испытании различных образцов из
кристалла меди относительное удлинение
изменяется от 10 до 55 %, а предел прочности
-от 140 до 350 МПа. Это свойство кристаллов
называют анизотропностью.
Анизотропность кристаллов определяется характером расположения атомов в кристаллической решетке.
Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях; излом аморфного тела всегда имеет неправильную, искривленную, так называемую раковистую форму.
Металлы, затвердевшие в обычных условиях, состоят из множества кристаллов, кристаллическая решетка которых по-разному ориентирована, поэтому свойства литого металла приблизительно одинаковы по всем направлениям; это называют квазиизотропностью.
Аллотропия
металлов.
Аллотропия металлов (или полиморфизм)-свойство
перестраивать решетку при определенных
температурах в процессе нагрева и
охлаждения – присуща многим металлам
(железу, марганцу, никелю, олову, титану,
ванадию и др. ). Каждое аллотропическое
превращение происходит при определенной
температуре (например, одно из
превращений железа происходит при
температуре 911о С, ниже которой! атомы составляют решетку
центрированного куба, а выше — решетку
гранецентрированного куба).
). Каждое аллотропическое
превращение происходит при определенной
температуре (например, одно из
превращений железа происходит при
температуре 911о С, ниже которой! атомы составляют решетку
центрированного куба, а выше — решетку
гранецентрированного куба).
Структура, имеющая ту или иную решетку, называется аллотропической формой или модификацией
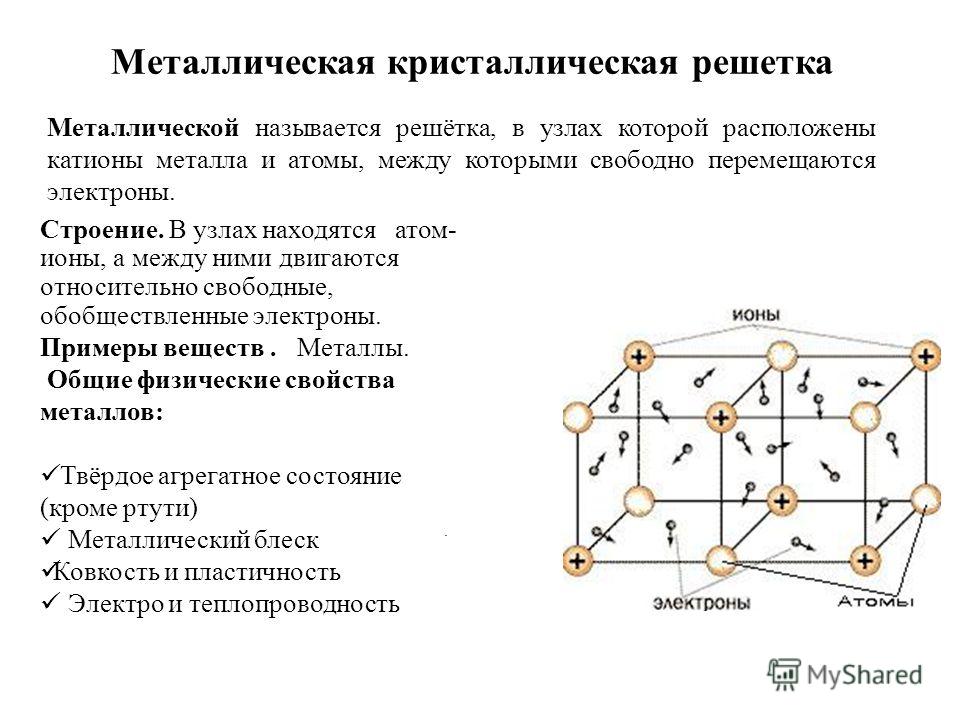
Кристаллическое строение металлов
У металлов электроны на внешних оболочках имеют слабую связь с ядром, легко отрываются и могут свободно перемещаться между положительно заряженными ядрами. Следовательно, в металле положительно заряженные ионы окружены коллективизированными электронами. Так как эти электроны подвижны аналогично частицам газа, то используется термин «электронный газ».
Металлургический тип связи характерен тем, что нет непосредственного соединения атомов друг с другом, нет между ними прямой связи. Атомы в металлах размещаются закономерно, образуя кристаллическую решетку.
Кристаллическая решетка — это мысленно проведенные в пространстве прямые линии, соединяющие ближайшие атомы и проходящие через их центры, относительно которых они совершают колебательные движения. В итоге образуются фигуры правильной геометрической формы — кристаллическая решетка (рис. 1.1).
Расстояния (а,b,с) между атомами, т.е. параметры кристаллической решетки, находятся в пределах 2… 6 A° (1 A°=10-8 см). Каждый атом принадлежит 8 кристаллическим решеткам. В аморфных телах с хаотическим расположением атомов в пространстве, свойства в различных направлениях одинаковы, а в кристаллических телах расстояния между атомами в различных направлениях неодинаковы, поэтому различны и свойства. Тип кристаллической решетки (рис. 1.2) зависит от металла, температуры и давления. Это используется при термообработке металлов для упрочнения их.
1.2) зависит от металла, температуры и давления. Это используется при термообработке металлов для упрочнения их.
Реальные металлы состоят из большого количества кристаллов, различно ориентированных в пространстве относительно друг друга. На границах зерен атомы кристаллов не имеют правильного расположения, здесь скапливаются примеси, дефекты и включения. Экспериментально установлено, что внутреннее кристаллическое строение зерен не является правильным. В решетках имеются различные дефекты (несовершенства), которые нарушают связь между атомами и оказывают влияние на свойства металлов.
Имеются следующие несовершенства в кристаллических решетках:
- 1. Точечные (рис. 1.3):
а) Наличие вакансий, т. е. мест в решетке, не занятых атомами. Это происходит из-за смещения атомов от равновесного состояния. Число вакансий увеличивается с ростом температуры.
б) Дислоцированные атомы, т. е. атомы вышедшие из узла решетки и занявшие место в междоузлии.
в) Примесные атомы, т.е. в основном металле имеются чужеродные примеси. Например, в чугуне основными атомами являются атомы железа, а примесными- атомы углерода, которые или занимают место основного атома, или внедряются внутрь ячейки.
- 2. Поверхностные несовершенства, имеющие небольшую толщину при значительных размерах в двух других направлениях.
3. Линейные несовершенства (цепочки вакансий, дислокаций и т. д.). Линейные дефекты малы в двух направлениях и значительно большего размера в третьем.
Количество дефектов в металле оказывает существенное влияние на его прочность. На первом участке кривой (рис. 1.4) при минимуме дислокаций меньше возможностей для сдвига атомов по кристаллической решетке, поэтому будет максимум прочности металла (теоретическая, недостижимая прочность). Путем восстановления из хлористого или бромистого железа в лабораторных условиях выращивают «усы» кристаллов железа длиной до 10 см и диаметром 0,5 … 1 мкм, имеющие относительно высокую прочность на растяжение (бb = 1200 …1300 кгс / мм Для сравнения, высокопрочная сталь имеет прочность всего 150 …200 кгс / мм2, т.е. на порядок ниже, а прочность железных «усов» примерно в 100 раз выше, чем у обычного железа (минимум на кривой).
Для сравнения, высокопрочная сталь имеет прочность всего 150 …200 кгс / мм2, т.е. на порядок ниже, а прочность железных «усов» примерно в 100 раз выше, чем у обычного железа (минимум на кривой).
Повышение прочности с увеличением плотности дислокаций выше их критического значения объясняется тем, что имеются не только параллельные, но и взаимопересекающиеся (объемные) дислокации. Они препятствуют взаимному перемещению металла и, как результат, приводят к увеличению прочности металла.
Все современные способы упрочнения металлов (легирование, закалка, прокатка, ковка, штамповка, волочение и т.д.) – это увеличение количества дефектов в металле. Наивысшая прочность, которую можно получить путем увеличения количества дефектов в металле, составляет около 1/3 от теоретически возможной (идеальной) прочности.
При нагреве и охлаждении (рис. 1.5) аморфных тел (смола, стекло, пластмассы,…) при переходе из жидкого в твердое состояние качественных изменений не происходит.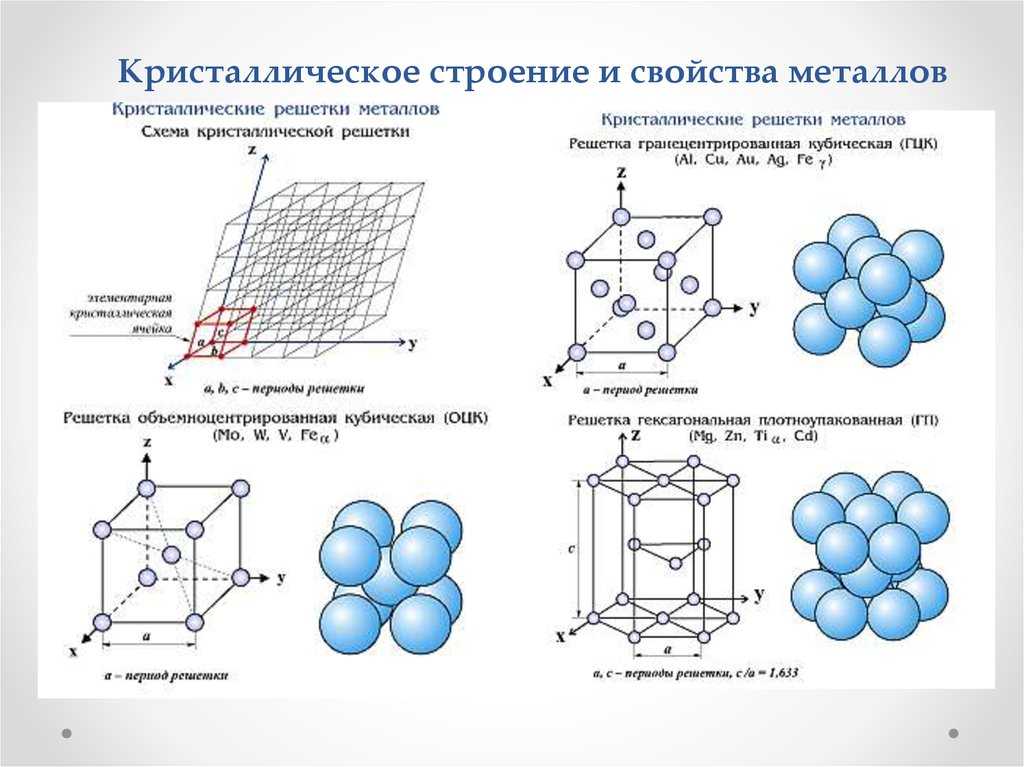 В твердом состоянии атомы в аморфном теле расположены так же хаотично, как и в жидком, имеют только меньшую степень перемещения. Из рис 1. 5 видим, что температура плавления Тпл равняется температуре кристаллизации Ткр, а переход из одного состояния в другое (из твердого в жидкое- точка Тпл, и из жидкого в твердое- точка Ткр ) происходит скачкообразно.
В твердом состоянии атомы в аморфном теле расположены так же хаотично, как и в жидком, имеют только меньшую степень перемещения. Из рис 1. 5 видим, что температура плавления Тпл равняется температуре кристаллизации Ткр, а переход из одного состояния в другое (из твердого в жидкое- точка Тпл, и из жидкого в твердое- точка Ткр ) происходит скачкообразно.
По другому ведут себя металлы (рис. 1.6). На участке 1 — 2 происходит нагрев металла ; кристаллическая решетка сохраняется, но атомы увеличивают амплитуду колебаний за счет поглощенной тепловой энергии. На горизонтальном участке 2 — 3 также подводится тепло, но температура Тпл не повышается, т.к. подводимое тепло целиком расходуется на разрушение кристаллической решетки. Атомы переходят в неупорядоченное (жидкое) состояние. После разрушения последнего участка кристаллов, после точки 3 начинается повышение температуры жидкого металла по линии 3 — 4.
При охлаждении (4- 5) на горизонтальном участке 5 — 6 происходит кристаллизация, при которой выделяется тепло, поэтому процесс проходит при постоянной температуре Ткр. Кристаллизация металла происходит не при температуре плавления Тпл, а при некотором переохлаждении Dt, величина которая зависит от природы металла, наличия примесей и от скорости охлаждения.
Кристаллизация металла происходит не при температуре плавления Тпл, а при некотором переохлаждении Dt, величина которая зависит от природы металла, наличия примесей и от скорости охлаждения.
Кристаллизация начинается с того, что при понижении температуры до значения Ткр начинают образовываться мелкие кристаллики, называемые центрами кристаллизации (зародышами). При дальнейшем уменьшении энергии металла происходит рост кристаллов и в то же время в жидкости возникают новые центры кристаллизации, т.е. процесс кристаллизации состоит из двух одновременно происходящих процессов :зарождение новых центров кристаллов и роста кристаллов из ранее образованных центров.
Скорости кристаллизации и числа центров в зависимости от Dt изменяются по закону нормального распределения (рис.1.7).
При переохлаждении (б) образуется мелкое зерно, т. к кристаллы быстро образуются, но медленно растут, а при меньших (а) значениях Dt возникает крупное зерно.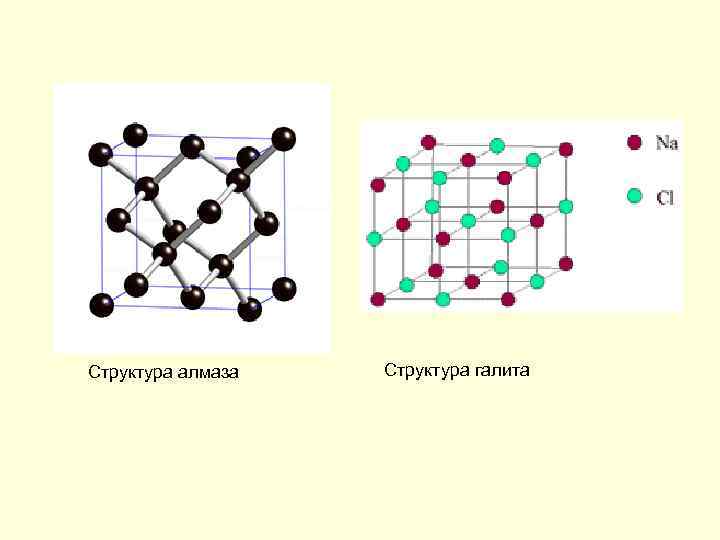 Мелкокристаллический металл более твердый и прочный, чем крупнокристаллический. Следовательно, подбором температуры переохлаждения Dt можно регулировать механические характеристики металла. Многое зависит от количества нерастворимых примесей, которые являются центрами кристаллизации. Чем больше этих частиц, тем меньше зерна металла.
Мелкокристаллический металл более твердый и прочный, чем крупнокристаллический. Следовательно, подбором температуры переохлаждения Dt можно регулировать механические характеристики металла. Многое зависит от количества нерастворимых примесей, которые являются центрами кристаллизации. Чем больше этих частиц, тем меньше зерна металла.
Влияние степени переохлаждения Dt на процесс кристаллизации хорошо видно в структуре слитка (рис. 1.8). Полученная в конверторе или в мартене, сталь (0,5…3 тн) заливается в изложницу. Большой перепад температур (свыше 1500 °С) будет между расплавленным металлом и атмосферой по высоте и ширине слитка. В результате на поверхности слитка, т. е. там, где имеется наибольший перепад температур, будет мелкозернистая структура, а в центре слитка при минимальном перепаде температур возникнут при кристаллизации крупные, а между ними –столбчатые кристаллы.
Российские ученые и практики сделали много открытий в металловедении и технологии обработки металлов. Так, основы научной металлургии и геологии заложил еще Михаил Васильевич Ломоносов, об этом свидетельствует написанный им в 1763 году труд «Первые основания металлургии или рудных дел».
Так, основы научной металлургии и геологии заложил еще Михаил Васильевич Ломоносов, об этом свидетельствует написанный им в 1763 году труд «Первые основания металлургии или рудных дел».
Дмитрий Иванович Менделеев систематизировал в периодической таблице химические элементы, что способствовало развитию многих вопросов металловедения (из известных в то время 63 химических элемента 50 были металлами). Родоначальником металлургии является и русский горный инженер Павел Петрович Аносов (1797…1851 г.), работающий в городе Златоусте на Урале. Он впервые применил световой микроскоп для изучения микроструктур металлов и нашел секрет булатной стали, заложил основы легирования стали (исследовал добавки золота, платины, хрома, марганца и других элементов к стали).
Дмитрий Константинович Чернов (1839…1921 г.) — основоположник теории и строения стального слитка. Работал на Обуховском заводе г. Санкт-Петербурга.
Единая картина кристаллических структур металлов
- Опубликовано:
- за Söderlind 1 ,
- Olle Eriksson 1 ,
- Börje Johansson 1 ,
- J. M. Wills 2 и
- …
- A. M. Boring 2
- …
- A. M. Boring 2
Природа том 374 , страницы 524–525 (1995 г. )Процитировать эту статью
)Процитировать эту статью
1012 доступов
179 цитат
Сведения о показателях
Abstract
Кристаллические структуры легких актинидов интригуют физиков и химиков уже несколько десятилетий 1 . Простые металлы и переходные металлы имеют плотноупакованные высокосимметричные структуры, такие как объемно-центрированная кубическая, гранецентрированная кубическая и гексагональная плотная упаковка. Напротив, структуры легких актинидов очень рыхло упакованы и имеют низкую симметрию — тетрагональную, орторомбическую и моноклинную. Чтобы понять эти различия, мы выполнили расчеты полной энергии в зависимости от объема как для структур с высокой, так и с низкой симметрией простого металла (алюминия), немагнитного переходного металла (ниобия), ферромагнитного переходного металла. (железо) и легкий актинид (уран). Мы обнаружили, что кристаллическая структура всех этих металлов определяется балансом между электростатическими (маделунговскими) взаимодействиями, которые способствуют высокой симметрии, и пайерлсовским искажением кристаллической решетки, которое способствует низкой симметрии. Мы показываем, что простые металлы и переходные металлы могут принимать структуры с низкой симметрией при расширении решетки; и мы предсказываем, что, наоборот, легкие актиниды будут претерпевать переходы в структуры более высокой симметрии при сжатии.
(железо) и легкий актинид (уран). Мы обнаружили, что кристаллическая структура всех этих металлов определяется балансом между электростатическими (маделунговскими) взаимодействиями, которые способствуют высокой симметрии, и пайерлсовским искажением кристаллической решетки, которое способствует низкой симметрии. Мы показываем, что простые металлы и переходные металлы могут принимать структуры с низкой симметрией при расширении решетки; и мы предсказываем, что, наоборот, легкие актиниды будут претерпевать переходы в структуры более высокой симметрии при сжатии.
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Соответствующие статьи
Статьи открытого доступа со ссылками на эту статью.
Ускоренное предсказание кристаллической структуры случайного сплава из нескольких элементов с использованием расширяемых функций
- Тэвон Джин
- , Ина Пак
- … Джи Хун Шим
Научные отчеты Открытый доступ 04 марта 2021 г.

Стабильность нового кубического монооксида тория под давлением
- Вэйвэй Сун
- , Вэй Луо
- и Раджив Ахуджа
Научные отчеты Открытый доступ 04 сентября 2015 г.
Варианты доступа
Подписаться на журнал
Получить полный доступ к журналу на 1 год
199,00 €
всего 3,90 € за выпуск
Подписаться
Расчет налога будет завершен во время оформления заказа.
Купить статью
Получите ограниченный по времени или полный доступ к статье на ReadCube.
32,00 $
Купить
Все цены указаны без учета стоимости.
Ссылки
Katz, J.J., Seaborg, G.T. & Morss, L.R. (eds) The Chemistry of the Actinide Elements Vols 1 & 2 (Chapman & Hall, New York, 1986).
Harrison, WA Псевдопотенциалы в теории металлов (Benjamin/Cummings, Menlo Park, California, 1966).
Google ученый
Friedel, J. in The Physics of Metals (ред. Ziman, JM) Ch. 8 (Cambridge Univ. Press, Нью-Йорк, 1969).
Google ученый
Skriver, H. L. Phys. Ред. B 31 , 1909–1923 (1985).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Duthie, J.
 C. & Pettifor, D.G. Phys. Преподобный Летт. 38 , 564–567 (1977).
C. & Pettifor, D.G. Phys. Преподобный Летт. 38 , 564–567 (1977).Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Pettifor, D.G. J. chem. физ. 69 , 2930–2931 (1978).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Johansson, B. & Rosengren, A. Phys. Ред. B 11 , 2836–2857 (1975).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Skriver, H.L., Johansson, B. & Andersen, O.K. Phys. Преподобный Летт. 41 , 42–45 (1978).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Skriver, H.L., Johansson, B. & Andersen, O.K. Phys. Преподобный Летт. 44 , 1230–1233 (1980).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Моруцци, В.
 Л. и Маркус, П. М. Phys. Ред. B 38 , 1613–1620 (1988).
Л. и Маркус, П. М. Phys. Ред. B 38 , 1613–1620 (1988).Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Brooks, M.S.S. & Johansson, B. J. Phys. F 13 , L197–202 (1983).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Wills, J. M. & Cooper, B. R. Phys. Rev. B 36 , 3809–3823 (1987).
Артикул ОБЪЯВЛЕНИЯ КАС Google ученый
Harrison, W. A. Электронная структура и свойства твердых тел (Фримен, Сан-Франциско, 1980 г.).
Google ученый
Ссылки на скачивание
Информация о авторе
Авторы и принадлежности
Группа теории конденсированных веществ, Департамент физики, Университет Уппсалы, PO Box 530, S-751 21, UPPSALA, Sweden
30, S-751 21, Uppsala, Sweden
303030, S-751 21, UPPSALA, Swedens.
 Eriksson & Börje Johansson
Eriksson & Börje JohanssonЦентр материаловедения и теоретического отдела, Лос-Аламосская национальная лаборатория, Лос-Аламос, Нью-Мексико, 87545, США
J. M. Wills & A.M. Boring
Авторы
- Per Söderlind
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Olle Eriksson
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Börje Johansson
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Академия
- J. M. Wills
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- A. M. Boring
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Ускоренное предсказание кристаллической структуры случайного сплава из нескольких элементов с использованием расширяемых функций
- Тэвон Джин
- Ина Пак
- Чжи Хун Шим
Научные отчеты (2021)
Исследование методом функционала плотности адсорбции молекулы h3O на поверхности α-U(001)
- Шанцисон Хуан
- Сю-Линь Цзэн
- Сюэхай Цзюй
Журнал молекулярного моделирования (2016)
Стабильность нового кубического монооксида тория под давлением
- Вэйвэй Сан
- Вэй Луо
- Раджив Ахуджа
Научные отчеты (2015)
Сайт-селективная электронная корреляция в металлическом α-плутонии
- Цзянь-Синь Чжу
- Р.
 К. Альберс
К. Альберс - Дж. М. Уиллс
Nature Communications (2013)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
4.2a Металлы и металлические сплавы
Черные металлы содержат железо, ржавчину и обладают магнитными свойствами.
| Цветные металлы не содержат железа и не подвержены коррозии.
|
Металлы часто описывают как положительно заряженные ядра в море электронов. Внешние электроны ядер атомов металлов свободны и могут проходить через кристаллическую структуру. Связь вызвана притяжением между положительно заряженными ядрами металлических атомов и отрицательно заряженным облаком свободных электронов. Особое расположение атомов металла не требуется.
Внешние электроны ядер атомов металлов свободны и могут проходить через кристаллическую структуру. Связь вызвана притяжением между положительно заряженными ядрами металлических атомов и отрицательно заряженным облаком свободных электронов. Особое расположение атомов металла не требуется.
Металлическая связь включает в себя совместное использование внешних электронов, но они более свободны и могут проходить через кристаллическую структуру. Связь вызвана притяжением между положительно заряженными ядрами атомов металла и отрицательно заряженным облаком свободных электронов и распространяется по всей решетке — «положительно заряженные ядра в море электронов».
Чистые и легированные металлы существуют в виде кристаллов. Металлы, многие виды керамики и некоторые полимеры имеют однородное геометрическое расположение атомов или ионов, которое повторяется по всему материалу, и поэтому их называют кристаллическими. Эта регулярная трехмерная структура атомов известна как пространственная решетка, а элементарная ячейка является наименьшей единицей решетки, которая сохраняет общие характеристики решетки. Кристаллическая структура относится к размеру, форме и расположению атомов элементарной ячейки решетки и варьируется от одного вещества к другому. Кристаллы представляют собой регулярное расположение частиц (атомов, ионов или молекул).
Кристаллическая структура относится к размеру, форме и расположению атомов элементарной ячейки решетки и варьируется от одного вещества к другому. Кристаллы представляют собой регулярное расположение частиц (атомов, ионов или молекул).
Решетчатая структура металлов |
Если взять в качестве примера скрепку. Типичная скрепка состоит из ок. 1 000 000 000 000 000 000 000 атомов железа. Эти атомы плотно упакованы в кристаллическую структуру (регулярное расположение атомов, которое повторяется много раз). |
Размер зерна
Затвердевание металла достигается в процессе зарождения и роста. Когда чистый расплавленный металл охлаждается чуть ниже температуры замерзания, в жидкости сначала образуются мельчайшие зародыши твердого вещества.
Структура атомов железа не является непрерывной на протяжении всей скрепки. Когда металл охлаждается и переходит из жидкого состояния в твердое, его атомы объединяются, образуя крошечные зерна или кристаллы. Хотя кристаллическая структура не продолжается от кристалла к кристаллу, кристаллы связаны друг с другом.
Затвердевание металлов заключается в том, что оно не происходит внезапно во всей жидкости. По мере затвердевания расплавленного чистого металла начинают формироваться кристаллы (зародыши), и эти кристаллы растут за счет добавления атомов с образованием дендрита, который, как можно видеть, представляет собой кристаллический скелет с остовом, от которого в разные стороны растут плечи, фиксируемые закономерностью элементарной ячейки.
Рост дерева, начиная с его ствола и растущих ветвей и побегов, часто используется в качестве аналогии для описания роста дендритов. |
Кристаллы, обнаруженные во всех коммерческих металлах, обычно называют зернами из-за этой вариации внешней формы. Область, вдоль которой встречаются кристаллы, известная как граница зерна, представляет собой область несоответствия. Границы образованы материалами, которые не являются частью решетки, такими как примеси, которые не имеют определенного рисунка зерен. Это приводит к некристаллической (аморфной) структуре на границе зерен с неравномерно расположенными атомами. Поскольку последняя жидкость затвердевает, как правило, вдоль границ зерен, в этой области наблюдается более высокая концентрация примесных атомов.
Повторный нагрев твердого металла или сплава позволяет материалу диффундировать между соседними зернами и изменять структуру зерен. Медленное охлаждение позволяет формировать более крупные зерна; быстрое охлаждение дает более мелкие зерна. Направленные свойства в структуре могут быть достигнуты за счет избирательного охлаждения одной области твердого тела.
Медленное охлаждение позволяет формировать более крупные зерна; быстрое охлаждение дает более мелкие зерна. Направленные свойства в структуре могут быть достигнуты за счет избирательного охлаждения одной области твердого тела.
Скорость охлаждения расплавленного металла будет определять размер зерна. Постепенное охлаждение приводит к образованию лишь нескольких зародышей и, следовательно, к большому размеру зерен, тогда как быстрое охлаждение приводит к образованию большого количества зародышей и зерен малого размера.
http://www.ehponline.org/members/2006/114-8/innovations.html
Пластическая деформация: Остаточная деформация твердого тела, подвергаемого напряжению.
Пластическая деформация: материалы остаются деформированными после того, как нагрузка добавлена, а затем удалена.
Упругая деформация металла представляет собой небольшое изменение формы при низком напряжении, которое восстанавливается после снятия напряжения. Этот тип деформации включает растяжение металлических связей, но атомы не скользят друг относительно друга.
Этот тип деформации включает растяжение металлических связей, но атомы не скользят друг относительно друга.
Пластическая деформация возникает, когда напряжение достаточно для необратимой деформации металла. Этот тип деформации включает разрыв связей, обычно за счет движения дислокаций.
Пластическая деформация приводит к образованию большего количества дислокаций в металлической решетке. Это может привести к уменьшению подвижности этих дислокаций из-за их склонности к запутыванию или закреплению. Пластическая деформация при температурах, достаточно низких, чтобы атомы не могли перестроиться (холодная обработка) , может упрочнить металл в результате этого эффекта. Одним из побочных эффектов является то, что металл становится более хрупким. По мере использования металла трещины имеют тенденцию образовываться и расти, что в конечном итоге приводит к его поломке или разрушению.
Прочность на растяжение : Способность материала выдерживать растягивающие усилия.
Деформационное упрочнение — увеличение твердости металлов в результате их холодной обработки. Это вызывает необратимое искажение кристаллической структуры и особенно заметно для железа, меди и алюминия и т. д., тогда как для свинца и цинка этого не происходит, поскольку эти металлы способны рекристаллизоваться при комнатной температуре. (мелкий размер зерна).
Холодная обработка:
Поскольку пластическая деформация возникает в результате движения дислокаций, металлы можно упрочнить, предотвращая это движение. Когда металл изгибается или формуется, дислокации генерируются и перемещаются. По мере увеличения количества дислокаций в кристалле они запутываются или скрепляются и не могут двигаться. Это укрепит металл, затруднит его деформацию. Этот процесс известен как холодная обработка. При более высоких температурах дислокации могут перестраиваться, поэтому упрочнение происходит незначительно.
Влияние холодной обработки давлением на предел прочности при растяжении и текучести меди. |
Прочность на растяжение, предел текучести и твердость увеличиваются, а пластичность снижается. Твердость обычно увеличивается наиболее быстро при первых 10 % обжатия (холодная обработка), в то время как предел прочности при растяжении увеличивается более или менее линейно. Предел текучести увеличивается быстрее, чем предел прочности при растяжении, так что по мере увеличения величины пластической деформации разрыв между пределом текучести и пределом прочности при растяжении уменьшается. |
Сплав: Смесь, содержащая хотя бы один металл.



 C. & Pettifor, D.G. Phys. Преподобный Летт. 38 , 564–567 (1977).
C. & Pettifor, D.G. Phys. Преподобный Летт. 38 , 564–567 (1977). Л. и Маркус, П. М. Phys. Ред. B 38 , 1613–1620 (1988).
Л. и Маркус, П. М. Phys. Ред. B 38 , 1613–1620 (1988). Eriksson & Börje Johansson
Eriksson & Börje Johansson К. Альберс
К. Альберс