Масса алюминия: Молярная масса алюминия (Al), формула и примеры
alexxlab | 24.04.2023 | 0 | Разное
Сколько весит куб алюминия
Главная > а >
Алюминиевые сплавы деформируемые – масса 1 кубического метра (1 м3, куба, кубометра):
| Наименование | Марка / обозначение | Масса, кг |
|---|---|---|
| Авиаль | АВ | 2690 |
| Авиаль повышенной прочности (ковочный) | АК6 | 2750 |
| Алюминий технический | АД1, АД | 2710 |
| Алюминиевый высокопрочный сплав с магнием и цинком | В95 | 2850 |
| Алюминиевомагниевый сплав | АМг | 2670 |
| Алюминиевомагниевый сплав (магналий с 5% М) | АМг5П | 2650 |
| Алюминиевомарганцевый сплав | АМц | 2730 |
| Дуралюмин | Д1 | 2800 |
| Дуралюмин повышенной прочности | Д16, Д6 | 2800 |
| Дуралюмин повышенной прочности (ковочный) | АК8 | 2800 |
| Дуралюмин для заклепок | ДЗП | 2780 |
| Дуралюмин повышенной пластичности | Д18П | 2750 |
Алюминиевые сплавы литейные – масса 1 кубического метра (1 м3, куба, кубометра):
| Наименование | Марка / обозначение | Масса, кг |
|---|---|---|
| Алюминиевомедномагниевый сплав с никелем | АЛ1 | 2750 |
| Алюминиевокремниевый сплав | АЛ2 | 2650 |
| Алюминиевокремниевомедный сплав с магнием и марганцем | АЛ3 | 2700 |
| Алюминиевокремниевомедный сплав с магнием и марганцем | АЛ4 | 2650 |
| Алюминиевокремниевый сплав с медью и магнием | АЛ5 | 2680 |
| Алюминиевокремниевый сплав с медью | АЛ6 | 2700 |
| Алюминиевомедный сплав | АЛ7 | 2800 |
| Алюминиевомагниевый сплав | АЛ8 | 2550 |
| Алюминиевокремниевый сплав с магнием | АЛ9 | 2660 |
| Алюминиевомедный сплав (8% меди) | АЛ12 | 2850 |
| Алюминиевомедный сплав (12% меди) | АЛ12 | 2950 |
| Алюминиевомагниевый сплав с кремнием и марганцем | АЛ13 | 2600 |
Случайные записи – cколько весит:
мультитул Grand Way 10465
мука картофельная
текстолит, 1 м3
холодильник Atlant ХМ-4009
какао порошок, стакан
известняк крымский, 1 м3
фунт (единица измерения массы)
Алюминий – Знаешь как
Алюминий это химический элемент, простое вещество, имеет формулу Al, считаеться одним из самых востребованных металлов, который используеться в быту, промышленности, в сельском хозяйстве, ядерной, космической промышленности и т. д.
д.
Основные минералы для его получения боксит, нефелин, алунит, каолин и др.
(Aluminium; от лат. alumen (aluminis) — квасцы], Al — химический элемент 13-й группы, по устаревшей III группы периодической системы элементов; ат. н. 13,ат. м. 26,98154.
Серебристо-белый металл, при обычных условиях покрыт тонкой окисной пленкой. Во всех устойчивых соединениях алюминий трехвалентен, но при высоких т-рах может быть одновалентным (образуя субсоединения) и, значительно реже, двухвалентным.
Состоит из стабильного изотопа 27Al . Впервые алюминий в свободном виде выделил в 1825 датский ученый X. К. Эрстед. Первый пром. способ произ-ва А. предложил в 1854 франц. химик А. Э. Сент-Клер Девиль.
Распространение в природеПо распространенности в природе алюминий занимает первое место среди металлов. Его содержание в земной коре составляет 8,8%. В свободном состоянии в природе не встречается из-за высокой хим. активности. Главная масса алюминия сосредоточена в боксит, нефелин, алунит, каолин и др.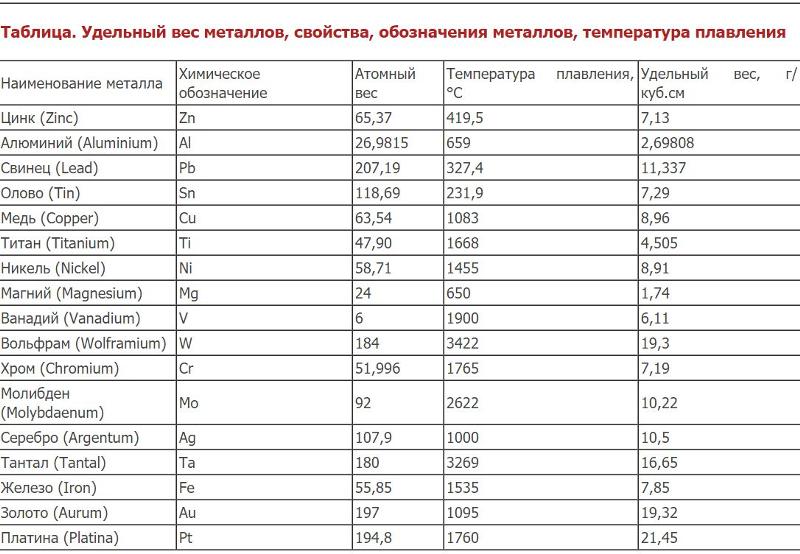
Наиболее ценная алюминиевая руда — бокситы, где содержится около 50% окиси алюминия.
Физические свойстваКристаллическая решетка алюминия гранецентрированная кубическая с периодом а = 4.0414А (т-ра 20° С), плотность (т-ра 20° С) 2,7 г/см³, tпл 660° С, tкип 2327° С, температурный коэфф. линейного расширения (т-ра 25° С) 24,3 X 10-6 град-1
Удельная теплопроводность (т-ра 20° С) 0,538 кал/см • сек • град, удельная теплоемкость (т-ра 20° С) 0,215 кал/г, удельное электрическое сопротивление (т-ра 20° С) 2,66•10-6 ом • см, электрическое сопротивление проводникового алюминия не более 0,028 ом • мм2/м.
Температурный коэффицент электрического сопротивления А.— 0,004 градˉ¹. Алюминий слабо парамагнитен. Отличается пластичностью, легко поддается прессованию, прокатке, ковке, штампованию и волочению.
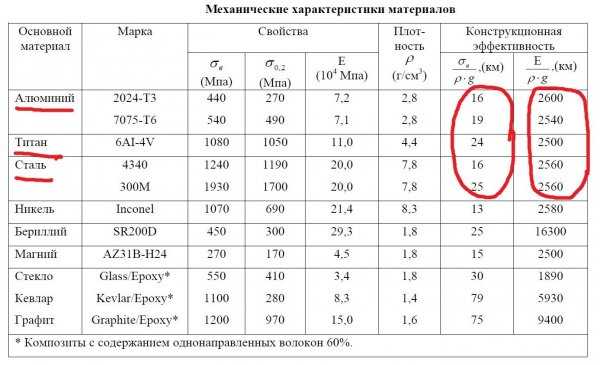
Предел прочности на растяжение 8—10 кгс/мм2, предел текучести при растяжении 3 кгс/мм2, относительное удлинение 35 %, относительное сужение 80 %, твердость по Бринеллю 25, модуль норм, упругости 7100 кгс/мм2, модуль сдвига 2600 кгс/мм2.
После холодной прокатки предел прочности возрастает до 18—25 кгс/мм2, твердость по Бринеллю — до 45 —60, относительное удлинение уменьшается до 3—5%.
Алюминий отличается высокой электропроводностью (четвертое место среди металлов — после серебра, меди и золота).
ЭлектропроводностьПримеси и легирующие добавки снижают электропроводность алюминия, особенно марганец, ванадий, хром и титан, в меньшей степени — никель, кремний, цинк, железо и медь.
Так, электропроводность алюминия чистотой 99,997% составляет 65,5% электропроводности меди, а электропроводность алюминия чистотой 99,5% снижается до 62,5%.
Алюминий относится к химически активным металлам. На воздухе быстро покрывается тонкой прочной окисной пленкой толщиной 50—100 А, защищающей от дальнейшего окисления.
Пленка имеет высокое электр. сопротивление (напряжение пробоя превышает 500 в) и, в отличие от органических изоляторов, выдерживает высокие т-ры.
Алюминий образует соединения почти со всеми элементами, растворяется в к-тах и щелочах. Однако он может успешно использоваться в коррозионных средах, в к-рых поверхностная защитная пленка окиси алюминия нерастворима.
Однако он может успешно использоваться в коррозионных средах, в к-рых поверхностная защитная пленка окиси алюминия нерастворима.
Алюминий отличается высокой коррозионной стойкостью в воде, в том числе кипящей и морской. Он устойчив в уксусной, лимонной, винной и др. органических к-тах.
Химические свойства алюминияМеталлические свойства выражены у алюминия гораздо сильнее , чем у бора , но химические связи алюминия с другими металлами ещё в основном ковалентного характера .
В отличие от бора атом алюминия имеет свободные d- подуровни на внешнем электронном уровне .
Кроме того, ион Al³⁺ отличается небольшим радиусом при довольно высоком заряде и поэтому является комплексообразователем с координационными числами четыре ( как у бора ) и шесть .
Химически чистый алюминий — серебристо- белый металл плотность 2,7 г / см³ c температурой плавления 660,1°C , имеет гранецентрированную кубическую решетку , отличается хорошей пластичностью в холодном и горячем состояниях .
Алюминий — активный металл с большим сродством к кислороду . На воздухе быстро покрывается защитной оксидной плёнкой , а в воде — защитной плёнкой гидроксида .
Разрушение защитной плёнки ( путём амальгамации ) приводит к быстрой коррозии алюминия на воздухе и к активному взаимодействию его с водой :
2Al + 6H2O = 2Al( OH )3 +3H2↑
Холодная концентрированная азотная кислота пассивирует алюминий , но в разбавленных серной кислоте и соляной кислоте он легко растворяется :
2Al + 3H2SO4 = Al2( SO4 ) + 3H2↑
С водными растворами щелочей алюминий взаимодействует , образуя тетрагидроксодиаквааюминат :
2Al + 2NaOH + 10H2O = 2Na[Al( OH )4( H2O )2] + 3H2↑
но могут получатся и гидроксоалюминаты Na[Al( OH )5] или Na3[Al( OH )6] .
Взаимодействие с галогенами при обычной температуре , алюминий образует галиды — летучие и гигроскопичные вещества , дымящие на воздухе вследствие гидролиза :
AlCl3 + H2O ⇄ AlOHHCl2 + HCl
Непосредственная реакция с неметаллами , алюминий образует нитрид AlN ( при 800°C ) , сульфид Al2S3 ( при 1000°C ) , карбид Al4C3 ( при 2000°C ) .
С водородом алюминий не реагирует , а полимерный гидрид его ( Alh4 )n получают косвенным путём.
Оксид алюминияОксид Al2O3 — единственный для алюминия — может получен при нагревании на воздухе мелкораздробленного металла или алюминиевой фольги :
2Al +³/2 O2 = Al2O3
Это белое тугоплавкое , нерастворимое в воде вещество . Встречается в виде минерала корунда , занимающего по плотности 2 место после алмаза.
Прозрачные кристаллы корунда бывают окрашены в красный или синий цвет ( рубин и сапфир ) . В настоящее время рубины получают искусственно для технических целей.
Кристаллы рубинов приобрели значение как квантовые усилители ( генераторы ) электромагнитных излучений ; усилителями радиоволн называют мазерами , а усилителями световых волн — лазерами .
Непрозрачные , содержащие много примесей кристаллы корунда , известны как наждак , применяемый для шлифовки и обработки металлов.
Оксид алюминия амфотерен. При сплавлении его с едкими щелочами получаются соли мета алюминиевой кислоты HAlO2 например мета алюминат калия :
Al2O3 + 2KOH = 2KAlO2 + H2O
Он взаимодействует и с кислотами :
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Но сильно прокаленный оксид алюминия не растворяется ни в кислотах , ни в щелочах.
Измельченный и активированный метаалюминатом натрия оксид алюминия используют как минеральный ионообменник под названием ( окись алюминия для хроматографии ).
Гидроксид алюминияГидроксид алюминия Al( OH )3 осаждают , действуя щелочами на растворы солей :
AlCl3 + 3NaOH = Al( OH )3 + 3NaCl
Белый студенистый осадок гидроксида алюминия растворяется в кислотах :
Al( OH )3 + 3HCl = AlCl3 + 3H2O
Растворяется в избытке растворов щелочей :
Al( OH )3 + NaOH = Na[Al( OH )4]
то есть проявляет амфотерность .
Формула Na[Al( OH )4] не вполне соответствует составу продукта реакции , в действительности у алюминия координационное число равно шести и получается тетрагидрооксодиакваалюминат натрия :
Al( OH )3 + OH⁻ + 2H2O = [Al( OH )4( H2O )2]⁻
Но при сплавлении со щелочами гидроксид алюминия образует соли метаалюминиевой или ортоалюминиевой кислот :
Al( OH)3 + NaOH = NaAlO2 + 2H2O
или ортоалминат натрия :
Al( OH )3 + 3NaOH = Na3AlO3 + 3H2O
У гидроксида алюминия основные и кислотные свойства выражены приблизительно одинаково .
Соли алюминия хорошо растворимы в воде , легко гидролизуются и некоторые из них ( Al2S3 ) то есть на основание и кислоту.
Хлорид алюминия AlCl3 известен как катализатор в органическом синтезе.
Сульфат алюминия Al2( SO4 )3 · 18H2O применяется для очистки природных вод от коллоидных частиц , которые захватываются гидроксидом алюминия , образующимся при гидролизе соли .
Сульфат калия — алюминия ( алюмокалиевые квасцы ) KAl( SO4 )2 · 12H2O применяется в кожевенной промышленности , служит протравой при крашении хлопчатобумажных тканей.
Растворимость в кислотах и других веществахАлюминий практически не взаимодействует с концентрированной азотной к-той, мн. органическими веществами и пищевыми продуктами.
Быстро растворяется в растворах едких щелочей (образуя алюминаты), соляной, плавиковой и бромистоводородной к-тах. Слабо взаимодействует с борной к-той.
При обычных т-рах не взаимодействует с водой, парами воды, окисью и двуокисью углерода; при достаточно высоких т-рах способен реагировать с ними.
Алюминий устойчив в растворах сернокислых нейтральных солей магния, натрия, а также гипосульфита. Мало влияют на металл сернистый газ, аммиак и сероводород.
Взаимодействие с веществамиДобавление к воде щелочей, солей, ртути, меди и ионов хлора увеличивает его коррозию. Водород растворяется в твердом алюминии, с повышением т-ры растворимость увеличивается (при т-ре 350° С она составляет 0,002 см3/100 г, а при т-ре 660° С — 0,036 см3/100 г). Компактный в среде азота покрывается тонкой пленкой нитрида.
Водород растворяется в твердом алюминии, с повышением т-ры растворимость увеличивается (при т-ре 350° С она составляет 0,002 см3/100 г, а при т-ре 660° С — 0,036 см3/100 г). Компактный в среде азота покрывается тонкой пленкой нитрида.
С галогенами, серой и фосфором А. взаимодействует при высоких т-рах. С более электроположительными элементами образует алюминиды. При нагревании алюминий восстанавливает большинство окислов др. металлов, что используется в алюмотермии.
Производство алюминия заключается в получении окиси алюминия из алюминиевых руд щелочным, кислотным, электротермическим или комбинированными способами, получении первичного металла электролизом окиси алюминия (в спец. аппаратах — электролизерах), растворенной в расплавленном криолите при т-ре около 950° С, и рафинировании этого металла.
Небольшие добавки фторидов кальция, магния и натрия улучшают физико-хим. св-ва электролита, повышая эффективность электролизеров. Макс, содержание окиси алюминия в электролите — 6—8%.
Макс, содержание окиси алюминия в электролите — 6—8%.
Получение алюминия
В производстве используют электролизеры с непрерывными самообжигающимися анодами и боковым или верхним подводом тока, электролизеры с обожженными анодами.
Катодом служит подина ванны, анодом — погруженные в электролит угольные обожженные блоки или набивные самообжигающиеся электроды. Ванну эксплуатируют при напряжении 4,0—4,5 в. Сила тока, подводимая к электролизерам,— 130—160 ка.
Плотность тока на аноде 0,7—0,8 а/см², на катоде 0,4—0,5а/см².. Расход электроэнергии на произ-во 1mA. составляет 14 000— 15000квт-ч.
Черновой алюминий содержит примеси от к-рых его очищают продуванием расплава хлором при т-ре 750—770 С в течение 10—15 мин, после чего разливают в чушки.
Получение чистого алюминияЧистоте первичного А, 99,7—99,5%. Перспективен хлоридный способ получения алюминия позволяющий уменьшить затраты энергии и слизать загрязнение окружающей среды.
В зависимости от способа получения и хим. состава различают:
- Алюминий особой чистоты,
- Алюминий высокой чистоты,
- Алюминий технической чистоты.
Алюминий особой чистоты (марки А999) содержит не более 0,001% примесей.
Получают его зонной плавкой и дистилляцией через субгалогениды электролитически рафинированного металла. Для более глубокой очистки эти способы комбинируют.
Применяется для научно-исследовательских целей, в полупроводниковой и ядерной технике. Алюминий высокой чисто-т ы (марок А995, А99, А97, А95) содержит от 0,005 до 0,05% примесей.
Сложность получения алюминияСложность получения алюминия обусловливается тем , что оксид алюминия не проводит электрический ток и отличается высокой температурой плавления 2050°C .
Поэтому электролизу подвергают расплавленную смесь , содержащую 6 — 8% Al2O3 и 92 — 94% криолита Na3[AlF6] .
Кроме того , в расплав добавляют фториды кальция , магния или алюминия для понижения температуры плавления электролита и улучшения хода процесса .
В результате всего этого удаётся вести процесс при температуре 960°C . Дно электролизёра , собранное из блоков спрессованного угля , служит катодом .
Алюминиевые каркасы , расположенные сверху и заполненные угольными брикетами , играют роль анодов :
Al2O3 ⇄ Al³⁺+ AlO3³ˉ
На катоде выделяется металлический алюминий :
Al³⁺+ 3eˉ = Al
а на аноде газообразный кислород :
2AlO — 6e = ³/2O2↑+ Al2O3
По мере накопления на дне электролизёра расплавленного алюминия его выпускают , а расплав добавляют новые порции полутораокиси алюминия.
Выделяющийся кислород взаимодействует с углём анода , который выгорает с выделением окиси и двуокиси углерода .
Применение алюминияПолученый алюминий из первичного металла технической чистоты дополнительным рафинированием по трехелойному способу, снижающему содержание примесей железа, кремния, титана, меди и др.
Используется в основном при произ-ве специальной хим. аппаратуры, электр. конденсаторов и др. Алюминий технической чистоты (марок А85, А8, А7, А6, А5, АО, А и АЕ) содержит от 0,15 до 1,00% примесей.
Марок А85 и А8 применяют для произ-ва алюминиевого проката, марок А 7, А6 и А5 — для получения алюминиевых сплавов, фольги, произ-ва кабельных и токопроводящих изделий, алюминиевого порошка, для плакирования и пр.
СплавыДля изготовления сплавов на алюминиевой и др. основах, спец. лигатур, кабельных и токопроводящих изделии применяют металл марки ДО, для подшихтовки алюминиевых сплавов, изготовления лигатур, в алюмотермни — металл марки А, для произ-ва алюминиевой катанки — металл марки АЕ.
Металл высокой и технической чистоты выпускают в чушках массой 5; 15 и 1000 кг. Осн. виды алюминиевых полуфабрикатов — листы, проволока и полосы.
Поставляют полуфабрикаты и изделия в горячекатаном, нагартованном и отожженном состоянии.
Малая плотность металла, высокая электропроводность, достаточная механическая прочность и высокая коррозионная стойкость по отношению к некоторым химическим реагентам, а также низкая себестоимость обусловливают широкое применение в различных областях техники.
Относительно низкое сечение поглощения тепловых нейтронов, малая чувствительность структуры и мех. св-в к радиационному воздействию, а также значительная коррозионная стойкость в некоторых средах-теплоносителях позволяют использовать как конструкционный материал ядерных реакторов, гл. обр. с водяным охлаждением.
Применяют также для изготовления защитных оболочек тепловыделяющих элементов, трубопроводов.
Алюминий служит основой для алюминия сплавов, легирующим элементом в магниевых, цинковых, медных, титановых и других сплавах.
Малая плотность , пластичность и устойчивость к коррозии обеспечили алюминию применение в авиа — и автопромышленности .
Он входит в состав лёгких сплавов : дуралюмина ( сплав алюминия , меди , магния и марганца ) , силумина ( сплава алюминия и кремния ) и некоторых других . Из алюминиевых сплавов изготовляют корпуса искусственных спутников Земли и космических кораблей .
В электротехнике алюминий заменил медь как материал для изготовления проводов . Используется как восстановитель при выплавке металлов ( алюминотермия ) :
Cr2O3 + 2Al = 2Cr + Al2O3
Алюминотермию , открыл Н.Н. Бекетовым в 1859 г. применяют и для сварки металлических деталей . При этом смесь порошкообразных алюминия и оксида железа ( II , III ) Fe3O4 называемую термитом :
8Al + 3Fe3O4 = 9Fe + 4Al2O3
в результате реакции развивается температура около 3000°C , получившееся железо плавится , стекая вниз и сваривает детали .
Биологическое значениеПомимо технического алюминий имеет также большое биологическое значение . Низкие концентрации ионов алюминия стимулируют некоторые процессы жизнедеятельности растений , например прорастание семян.
Но более высокие концентрации ( > 2 мг/л раствора ) , снижают интенсивность фотосинтеза , нарушают фосфорный обмен , задерживают рост корневой системы .
Присутствие катионов Al в почве отчасти обусловливает вредную для растений обменную кислотность почвенного раствора.
Ионы алюминия обычно поглощаются почвенными коллоидами , но под действием нейтральных солей ( например , хлорид калия ) они вытесняются из почвенного поглощающего комплекса.
В результате катионообменного процесса ионы алюминия переходят в почвенный раствор . Получившаяся при этом соль гидролизуется :
AlCl3 + H2O ⇄ HCl + Al( OH )Cl2
В результате гидролиза происходит нежелательное повышение концентрации водородных ионов в почвенном растворе ( понижение величины pH ) .
Другое применениеНа основе алюминия методом порошковой металлургии созданы спеченные алюминиевые сплавы, отличающиеся высокой жаропрочностью.
Используют для раскисления стали, получения некоторых металлов методом алюмотермии, взрывчатых веществ, а также в композиционных материалах на различной основе. См. также Алюминиевая бронза, Алюминиевая латунь. Алюминиевый чугун, Алюми-нирование, Алитирование.
Алюминиевый чугун, Алюми-нирование, Алитирование.
Природный алюминий, это стабильный изотоп 27Al
Несколько радиоактивных изотопов алюминия получены искусственно , из них применяется как меченый атом .
РаспространениеПо распространённости в литосфере алюминий занимает первое место среди металлов и общее третье место ( после кислорода и кремния ) . в следствие большой химической активности он не встречается в свободном состоянии.
Важные руды алюминия — бокситы Al2O3 · nH2O ( содержащего 32 — 60% Al2O3 ) , алунит K2SO4 · Al2( SO4 )3 · 2Al2O3 · 6H2O , каолин Al2O3 · 2SiO2 · 2H2O , нефелин Na2O · Al2O3 · 2SiO2 , залегающий совместно с апатитом .
Алюминий входит также в состав многочисленных полевых шпатов : ортоклаза K[AlSiO8] , альбита Na[AlSi3O8] , цеолита , слюда и др.
При какой температуре плавится алюминий?
Температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C. удельная теплота плавления — 390 кДж/кг. температура кипения — 2518,8 °C.
Какая молярная масса алюминия?
Молярная масса (в кг/моль) = Mr[Al] : 1000 = 26.9815386 : 1000 = 0.02698 кг/моль.
Какова плотность алюминия?
Плотность — 2712 кг/м³. температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C. удельная теплота плавления — 390 кДж/кг.
Как понять алюминий металл или неметалл?
Алюминий – химически активный металл и проявляет себя как восстановитель. Однако его активность снижает оксидная пленка, которая образуется на его поверхности.
Что делают из алюминия?
С помощью алюминия делают металлические конструкции, провода, профлисты; Алюминий зачастую используется в производстве автомобильных устройств и производстве деталей для машин.
Статья на тему алюминий
6.2: Атомная и молярная массы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 83085
Развитие навыков
- Чтобы узнать, как выражаются массы молей атомов и молекул. 9{20}\)?
Число в моле, число Авогадро, связано с относительными размерами единиц атомной массы и единиц массы граммов. В то время как один атом водорода имеет массу примерно 1 ед., 1 моль атомов Н имеет массу примерно 1 грамм . И в то время как один атом натрия имеет приблизительную массу 23 ед., 1 моль атомов натрия имеет приблизительную массу 23 граммов .
Один моль вещества имеет ту же массу в граммах, что и один атом или молекула в атомных единицах массы.

Один моль вещества имеет ту же массу в граммах, что и один атом или молекула в атомных единицах массы.
Пример \(\PageIndex{1}\): Преобразование молей в массу с элементами
Какова масса каждой величины?
- 1 моль атомов алюминия
- 2 моль атомов U
РАСТВОР
- Масса одного моля атомов алюминия в граммах численно эквивалентна атомной массе алюминия. Периодическая таблица показывает, что атомная масса (округленная до двух знаков после запятой) Al равна 26,98, поэтому 1 моль атомов Al имеет массу 26,98 г.
- Согласно периодической таблице, 1 моль урана имеет массу 238,03 г, поэтому масса 2 молей в два раза больше, или 476,06 г.
Понятие «моль» можно распространить и на массы формульных единиц и молекул.
 Масса 1 моль молекул (или формульных единиц) в граммах численно эквивалентна массе одной молекулы (или формульных единиц) в атомных единицах массы. Например, одна молекула O 2 имеет массу 32,00 ед, а 1 моль молекул O 2 имеет массу 32,00 г. Как и в случае масс, основанных на единицах атомной массы, чтобы получить массу 1 моля вещества, мы просто суммируем массы отдельных атомов в формуле этого вещества. Масса 1 моля вещества называется его молярной массой, независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.
Масса 1 моль молекул (или формульных единиц) в граммах численно эквивалентна массе одной молекулы (или формульных единиц) в атомных единицах массы. Например, одна молекула O 2 имеет массу 32,00 ед, а 1 моль молекул O 2 имеет массу 32,00 г. Как и в случае масс, основанных на единицах атомной массы, чтобы получить массу 1 моля вещества, мы просто суммируем массы отдельных атомов в формуле этого вещества. Масса 1 моля вещества называется его молярной массой, независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.Пример \(\PageIndex{2}\): преобразование молей в массу с соединениями
Какова масса 1 моля каждого вещества?
- NaCl
- билирубин (C 33 H 36 N 4 O 6 ), основной пигмент, присутствующий в желчи (печеночный секрет)
РАСТВОР
Суммирование молярных масс атомов в формуле NaCl дает
1 Na Молярная масса: 23,00 г 1 Cl Молярная масса: 35,45 г Итого: 58,45 г Масса 1 моля NaCl составляет 58,45 г.

- Умножая молярную массу каждого атома на количество атомов этого типа в формуле билирубина и складывая результаты, получаем
33 C Молярная масса: 33 × 12,01 г 396,33 г 36 H молярная масса: 36 × 1,01 = 36,36 г 4 N молярная масса: 4 × 14,00 = 56,00 г 6 O Молярная масса: 6 × 16,00 = 96,00 г Итого: 584,69 г Масса 1 моль билирубина 584,69 г.
Будьте осторожны при подсчете атомов. В формулах с многоатомными ионами в скобках нижний индекс вне скобок применяется к каждому атому внутри скобок.

1 Ва Молярная масса: 1 × 137,33 г = 137,33 г 2 O Молярная масса: 2 × 16,00 г = 32,00 г 2 H молярная масса: 2 × 1,01 г = 2,02 г Итого: 171,35 г Поскольку молярная масса определяется как масса 1 моля вещества, мы можем ссылаться на молярную массу в граммах на моль (г/моль). Знак деления (/) подразумевает «на», а «1» подразумевается в знаменателе. Таким образом, молярная масса билирубина может быть выражена как 584,05 г/моль, что читается как «пятьсот восемьдесят четыре целых ноль пять граммов на моль».

Упражнения по обзору концепции
- Как определяются молярные массы элементов?
- Как определяются молярные массы соединений?
Ответы
- Молярные массы элементов представляют собой то же числовое значение, что и массы одного атома в атомных единицах массы , но с другими единицами измерения, граммами (на один моль).
- Молярные массы соединений рассчитываются путем сложения молярных масс их атомов.
Key Takeaway
- Масса молей атомов и молекул выражается в граммах.
Упражнения
Какова молярная масса Si? Какова молярная масса U?
Какова молярная масса FeCl 2 ? Какова молярная масса FeCl 3 ?
Какова молярная масса (NH 4 ) 2 S? Какова молярная масса Ca(OH) 2 ?
Аспирин (C 9 H 8 O 4 ) является анальгетиком (обезболивающим) и жаропонижающим (лихорадочным средством).
 Какова молярная масса аспирина?
Какова молярная масса аспирина?
Ответы
- 28,09 г/моль; 238,00 г/моль
- 126,75 г/моль; 162,20 г/моль
- 68,15 г/моль; 74,10 г/моль
- 180,17 г/моль
6.2: Atomic and Molar Masses распространяется под лицензией CC BY-NC-SA 4.0 и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
Видео с вопросами: Расчет массы алюминия, полученного в ячейке Холла-Эру, с учетом тока и молярной массы алюминия
Стенограмма видео
Промышленная добыча алюминий с использованием ячеек Холла-Эру требует очень большого электрического тока 120 килоампер. Сколько алюминия производится в год час, принимая молярную массу алюминия равной 27,0 граммам на моль и одному фарадею заряжать как 90,65 умножить на 10 до четырех кулонов? Дайте ответ в килограммах два десятичных знака.
Добыча алюминия электролитический процесс. Ионы алюминия в расплавленной фазе восстанавливаются до жидкого металлического алюминия. На каждый моль алюминия ионов, необходимо три моля электронов, и это дает один моль алюминия металл.
 Нас спрашивают, сколько алюминия
производится в час. Другими словами, какая масса
производится алюминий?
Нас спрашивают, сколько алюминия
производится в час. Другими словами, какая масса
производится алюминий?Дана молярная масса алюминий. Мы видим, что сначала нам нужно рассчитать количество молей полученного алюминия. И используя это значение и моляр масса, тогда мы можем определить массу. Нам не дали количество молей алюминия, но нам даны другие данные. Нам дан ток, который течет в килоамперах и истекшее время, равное одному часу. Нам также дано значение одного фарадей заряда.
Полезное уравнение в электролизе 𝑄 равно 𝐼𝑡, где 𝑄 — переносимый заряд в кулонах, 𝐼 — ток в ампер, а 𝑡 время в секундах. Нам нужно преобразовать ток в ампер и время в секундах. Килоампер можно перевести в ампер путем умножения на этот коэффициент преобразования. Килоампер отменяется, и мы получаем 120 000 ампер.
 Затем мы можем перевести время в часы
в минуты с использованием этого коэффициента преобразования и минут в секунды с использованием этого преобразования
фактор. Отменяются часы, отменяются минуты и
мы получаем ответ 3600 секунд, что эквивалентно одному часу.
Затем мы можем перевести время в часы
в минуты с использованием этого коэффициента преобразования и минут в секунды с использованием этого преобразования
фактор. Отменяются часы, отменяются минуты и
мы получаем ответ 3600 секунд, что эквивалентно одному часу.Теперь мы можем рассчитать стоимость перенесено. Используя наше ключевое уравнение 𝑄 равно 𝐼𝑡, мы можем подставить ток в амперах и время в секундах. Решая, получаем заряд передано за один час, что составляет 432 000 000 кулонов. Следующим шагом является преобразование количество переданного заряда к числу молей переданных электронов. Существуют различные способы сделать этот. Один из способов – использовать ключевое уравнение 𝑄 равно 𝑛𝐹, где 𝑄 — переданный заряд в кулонах, 𝑛 количество моли переданных электронов и 𝐹 постоянная Фарадея.
Теперь нам дан один фарадей заряд как 9,65 умножить на 10 на четыре кулона.
 Однако постоянная Фарадея равна
то же значение заряда в кулонах, но на один моль переданных электронов. Следовательно, постоянная Фарадея равна
заряд на один моль элементарного заряда. Таким образом, мы можем изменить наш ключ
уравнение для получения 𝑛 равно 𝑄, деленному на 𝐹. Замена суммы начисления
что вытекло за один час, деленное на заряд одного моля элементарного заряда,
что эквивалентно заряду одного моля электронов, мы можем отменить
кулоновские единицы. Получаем число молей
переносимого за час заряда, что составляет 4476,68 моль.
Однако постоянная Фарадея равна
то же значение заряда в кулонах, но на один моль переданных электронов. Следовательно, постоянная Фарадея равна
заряд на один моль элементарного заряда. Таким образом, мы можем изменить наш ключ
уравнение для получения 𝑛 равно 𝑄, деленному на 𝐹. Замена суммы начисления
что вытекло за один час, деленное на заряд одного моля элементарного заряда,
что эквивалентно заряду одного моля электронов, мы можем отменить
кулоновские единицы. Получаем число молей
переносимого за час заряда, что составляет 4476,68 моль.Давайте освободим место. Следующим шагом является преобразование молей заряда, переданного молям произведенного алюминия. Из сбалансированного полууравнения мы известно, что три моля заряда дают один моль алюминия. Но у нас нет трех родинок электроны или заряд. У нас есть 4476,68 молей заряжать.




 Масса 1 моль молекул (или формульных единиц) в граммах численно эквивалентна массе одной молекулы (или формульных единиц) в атомных единицах массы. Например, одна молекула O 2 имеет массу 32,00 ед, а 1 моль молекул O 2 имеет массу 32,00 г. Как и в случае масс, основанных на единицах атомной массы, чтобы получить массу 1 моля вещества, мы просто суммируем массы отдельных атомов в формуле этого вещества. Масса 1 моля вещества называется его молярной массой, независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.
Масса 1 моль молекул (или формульных единиц) в граммах численно эквивалентна массе одной молекулы (или формульных единиц) в атомных единицах массы. Например, одна молекула O 2 имеет массу 32,00 ед, а 1 моль молекул O 2 имеет массу 32,00 г. Как и в случае масс, основанных на единицах атомной массы, чтобы получить массу 1 моля вещества, мы просто суммируем массы отдельных атомов в формуле этого вещества. Масса 1 моля вещества называется его молярной массой, независимо от того, является ли вещество элементом, ионным соединением или ковалентным соединением.


 Какова молярная масса аспирина?
Какова молярная масса аспирина?
 Нас спрашивают, сколько алюминия
производится в час. Другими словами, какая масса
производится алюминий?
Нас спрашивают, сколько алюминия
производится в час. Другими словами, какая масса
производится алюминий? Затем мы можем перевести время в часы
в минуты с использованием этого коэффициента преобразования и минут в секунды с использованием этого преобразования
фактор. Отменяются часы, отменяются минуты и
мы получаем ответ 3600 секунд, что эквивалентно одному часу.
Затем мы можем перевести время в часы
в минуты с использованием этого коэффициента преобразования и минут в секунды с использованием этого преобразования
фактор. Отменяются часы, отменяются минуты и
мы получаем ответ 3600 секунд, что эквивалентно одному часу. Однако постоянная Фарадея равна
то же значение заряда в кулонах, но на один моль переданных электронов. Следовательно, постоянная Фарадея равна
заряд на один моль элементарного заряда. Таким образом, мы можем изменить наш ключ
уравнение для получения 𝑛 равно 𝑄, деленному на 𝐹. Замена суммы начисления
что вытекло за один час, деленное на заряд одного моля элементарного заряда,
что эквивалентно заряду одного моля электронов, мы можем отменить
кулоновские единицы. Получаем число молей
переносимого за час заряда, что составляет 4476,68 моль.
Однако постоянная Фарадея равна
то же значение заряда в кулонах, но на один моль переданных электронов. Следовательно, постоянная Фарадея равна
заряд на один моль элементарного заряда. Таким образом, мы можем изменить наш ключ
уравнение для получения 𝑛 равно 𝑄, деленному на 𝐹. Замена суммы начисления
что вытекло за один час, деленное на заряд одного моля элементарного заряда,
что эквивалентно заряду одного моля электронов, мы можем отменить
кулоновские единицы. Получаем число молей
переносимого за час заряда, что составляет 4476,68 моль.