Медь это металл или неметалл: Металлы. Их разновидности и свойства
alexxlab | 12.05.2023 | 0 | Разное
Медь – Знаешь как
Медь это химический элемент, простое вещество, микроэлемент. Медь чрезвычайно пластичный металл, который помещен в 11-ю группу периодической таблицы Менделеева.
Атомный номер меди — 29. Он обладает многими химическими свойствами, например, является хорошим проводником электричества и тепла.
В природе он встречается в рудной форме. Эта самородная медь была впервые использована людьми нового каменного века примерно в 8000 году до нашей эры в качестве заменителя камня.
Он является основным элементом многих соединений и сплавов.
Содержание статьи
- 1 Что такое медь
- 1.1 Нахождение в природе
- 1.2 Как открыли медь
- 1.3 Физические свойства меди
- 1.4 Химические свойства
- 1.5 Получение
- 1.5.1 Пирометаллургическое получение меди
- 1.6 Применение
- 1.7 Природная медь
- 1.8 Соединения меди
- 1.9 Применение меди
- 1.10 Часто задаваемые вопросы ответы по меди
Медь (Cuprum) Сu — химический элемент 11-й группы (устаревшая I группы периодической системы элементов) , ат. н. 29, ат. м. 63,546. Металл красного цвета.
н. 29, ат. м. 63,546. Металл красного цвета.
В соединениях проявляет степени окисления + 1 и + 2.
Природная медь состоит из стабильных изотопов 63Сu (69,1%) и 65Сu (30,9%).
Получены радиоактивные изотопы 68Cu, 59Cu, 60Cu, 61Сu, 62Cu, 64Cu, 66Cu, 67Сu и 68Сu с периодами полураспада от 0,18 сек до 58,5 ч.
Медь известна с древнейших времен (6000—7000 лет до н. э.). Содержание меди в земной коре 4,7-10 %.
Нахождение в природеИзвестно более 250 медьсодержащих минералов. Из них пром. значение имеют халькопирит (медный колчедан) CuFeS2, халькозин (медный блеск) Cu2S, ковеллин CuS, малахит и азурит.
Медь самородная встречается редко.
Как открыли медьСамородная медь встречалась в различных местах или местоположениях в качестве основного минерала в базальтовых лавах.
Она также восстанавливается из соединений меди, таких как арсениды, карбонаты, хлориды и сульфиды.
Медь содержится в сочетании со многими минералами, такими как азурит, малахит, халькопирит, борнит, куприт и халькоцит.
Во многих морских кораллах он присутствует в золе морских водорослей, в печени человека, а также во многих моллюсках и членистоногих.
Медь необходима для живых существ, поскольку она играет такую же роль в транспортировке кислорода в гемоцианине моллюсков (голубокровных) и ракообразных, как железо в гемоглобине красно-кровных животных.
Медь присутствует в организме человека в качестве микроэлемента, который помогает катализировать образование гемоглобина.
Самым большим известным месторождением этих минералов является месторождение порфировой меди в Андах Чили. К началу 21 века Чили стала ведущим производителем меди в мире.
Другими крупными производителями меди являются Перу, Китай и Соединенные Штаты.
Физические свойства медиКристаллическая решетка меди гранецентрированная кубическая с периодом а — 3,6147 А. Плотность т-ра 20° С) 8,94 г/см3.
Атомный paдиус 1,28 А; ионные радиусы Cu+ и Сu2+ равны соответственно 0,98 и 0,80 А; tпл 1083° С; tкип 2360° С; температурный коэфф. линейного расширения, (в интервале т-р 20—100° С) 16,8 · 10-6 град-1.
линейного расширения, (в интервале т-р 20—100° С) 16,8 · 10-6 град-1.
Коэфф. теплопроводности 0,923 кал/см -сек х град; теплоемкость (т-ра 20° С) 0,092 кал/г · град; электрическое сопротивление (т-ра 20° С) 1,68 х 10 ом х см.
Электропроводность меди высока (уступает только серебру).
Незначительные примеси существенно понижают электропроводность. Модуль норм, упругости 13,2-103 кгс/мм2; модуль сдвига 4,24-103 кгс/мм2; предел прочности на растяжение 22—24 кгс/мм2; относительное удлинение 60%; НВ=35.
- Медь — это переходный металл с атомным номером меди 29, что означает, что атом меди содержит 29 протонов.
- Символом меди является Cu (от латинского cuprum), который в основном встречается в виде руды.
- Электронная конфигурация меди [Ar] 3d104s1, полная электронная конфигурация меди 1s22s22p63s23p63d104s1
- Его внешний вид красновато-оранжевый, и он представляет собой твердый металл.

- Атомная масса / вес Cu составляет 63,546 ед (единая единица атомной массы).
- Его температура плавления составляет 1084,62 ℃, а температура кипения — 2562 ℃.
- Плотность Cu равна 8,96г/м3.
- Он очень легко проводит тепло и электричество. Он также обладает превосходной коррозионной стойкостью.
- Природная медь представляет собой смесь или композицию меди из двух стабильных изотопов. Этими изотопами являются медь-63 (69,15%) и медь-65 (30,85%).
- Он может быть повторно переработан без потери качества.
Медь химически малоактивна. В сухом воздухе при обычной т-ре почти не изменяется и очень медленно окисляется при наличии влаги и углекислого газа с образованием зеленого налета основного карбоната (CuOH)2СО3.
При нагревании на воздухе окисляется до черной окиси CaO, а при т-ре 1000° С — до красной закиси Cu2О.
Легко взаимодействует с галогенами, серой и селеном, растворяется в азотной к-те и концентрированной серной к-те, образует комплексные соединения с аммиаком, цианидами и д р.
Металлическую медь получают главным образом из сульфидных руд, содержащих от 0,5 до 10% Сu.
Дроблением, измельчением и флотацией из руды удаляют значительную часть пустой породы, содержащей кварц, силикаты, алюмосиликаты и пирит.
Полученный мелкий сульфидный медный концентрат содержит Сu, S и Fe, а также некоторое количество пустой породы.
В процессе получения металлической меди примеси удаляют селективным окислением сульфидов железа, используя различие в сродстве к сере и кислороду у железа и меди.
Процесс проводят при высокой т-ре (800—1400° С), что сопровождается расплавлением всей шихты, в к-рую вводят флюсы. Во время нагрева и расплавления железо окисляется, образуя шлак.
После удаления шлака богатый медью штейн подвергается дальнейшему окислению кислородом вплоть до удаления всего железа и серы. Полученный черновой металл содержит от 97,5 до 99% Сu.
Благородные металлы и другие примеси ухудшают электрические свойства меди.
С целью очистки от примесей и извлечения благородных металлов черновую медь подвергают огневому и электролитическому рафинированию с последующей переплавкой катодов в т. н. вайербарсы (бруски).
Пирометаллургическое получение медиПирометаллургическое получение черновой меди сводится к обжигу медных концентратов в многоподовых печах или печах кипящего слоя если содержание меди в концентратах невелико.
А серы — значительно, плавлению огарка или концентрата в отражательных печах (до 75% получаемой меди проходит через эту стадию) или др. аппаратах и конвертированию медных штейнов, осуществляемому продувкой воздуха через расплав в горизонтальных конверторах.
Жидкую черновую медь очищают от основной массы примесей в анодных печах, разливают в аноды и подвергают электролитическому рафинированию, после чего катоды переплавляют в индукционных печах, а расплав разливают в вайербарсы.
Вайербарсовая медь содержит от 99,0 до 99,95% Сu. Наряду с пирометаллургическим развивается гидрометаллургическое получение меди.
Наряду с пирометаллургическим развивается гидрометаллургическое получение меди.
Высокая тепло- и электропроводность, ковкость, сравнительно высокая прочность на разрыв и коррозионная стойкость обусловливают широкое применение меди в промышленности.
ПрименениеОна служит основным материалом для проводов, кабелей, шин, контактов и др. токопроводящих частей электр. установок.
Ее применяют также при изготовлении теплообменников-нагревателей, холодильников, двигателей внутреннего сгорания и др.
Широкое применение находят меди сплавы, латуни, бронзы, медно-никелевые сплавы и др.
Медь используют для легирования алюминия сплавов, изготовления медного порошка и др. материалов.
Кроме того, медь применяют в виде солей для изготовления минеральных красок, катализаторов и др.
- Медь добавляют в некоторые металлы, чтобы улучшить их гибкость, твердость, эластичность, цвет и устойчивость к коррозии, поскольку это легко формуемый основной металл.

- Медные сплавы, используемые в ювелирных изделиях, такие как серебро и золото, являются распространенными металлами, которые легируются медью.
- Медь используется в большинстве распространенных материалов сантехнической и электротехнической промышленности, таких как трубы, детали двигателей, провода, трубопроводы и т.д.
- Медь также считается важным элементом для здоровья человека. Взрослому человеку требуется примерно 1,2 мг Cu в день, чтобы помочь ферментам переносить энергию в клетках.
- Избыточное количество меди в организме токсично. Болезнь Вильсона и болезнь Менкеса — это генетические заболевания, которые могут повлиять на способность организма правильно использовать медь.
Некоторые из важных сплавов меди являются медно-никелевые, латунные, медно-бериллиевые сплавы, бронзы, нейзильберные сплавы, оружейные металлы и т.д.
Природная медьСостоит из стабильного изотопа 63Cu ( 69,1% ) , 65Cu ( 30,9% ). Искусственные изотопы 61Cu и 64Cu использовали как радиоактивные как радиоактивные индикаторы.
Медь мало распространена в природе ; содержание её в литосфере 1· 10—² масс. % . Чаще встречаются сульфидные руды меди : халькозин Cu2S , ковелин CuS , халькопирит CuFeS2 , борнит Cu5FeS4 .
Менее распространены кислородсодержащие руды : куприт Cu2O , тенорит CuO , азурит 2CuCO3 • Cu (OH)2 , малахит Cu2(OH)2CO3 . Встречается медь и в виде крупных самородков.
Из кислородсодержащих руд медь непосредственно восстанавливают углём ( коксом ) , а сульфидные руды первоначально обжигаются до оксида меди ( II ).
Полученную ( черновую ) медь рафинируют , очищают от примесей при помощи электролиза.
Также её получают гидрометаллургическим способом : руду сначала обрабатывают серной кислотой ( или раствором аммиаком ) , затем выделяют медь путём электролиза.
Чистая медь — мягкий металл розового цвета . Хорошая теплопроводность и электропроводность , устойчивость к коррозии , ковкость — ценные свойства , обусловливающие широкое применение меди в технике.
На основе меди изготовляются сплавы : бронза ( 80% Cu , 15% Sn , 5% Zn ) , латунь ( 60 — 90 % Cu , 10 — 40 % Zn ) , мельхиор ( 80 % Cu, 20 % Ni ) , нейзильбер ( 65 % Cu , 20 % Zn , 15 % Ni ).
Сплавы меди с легирующими металлами применяют в авиа — , авто — и судостроении . Чистую медь применяют в электротехнике.
Медь малоактивна , устойчива к внешним воздействиям , но во влажном воздухе постепенно покрывается зелёным налётом гидроксокарбоната (CuOH)2CO3.
Она непосредственно соединяется с кислородом , галогенами и серой ; со щелочами не реагирует.
Из разбавленных соляной , серной и уксусной кислот медь не вытесняет водород. Азотная кислота окисляет медь и восстанавливается до оксида азота (II) :
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
а концентрированная серная кислота — до двуокиси серы :
Cu + 2H2SO4 = CuSO4 + SO2↑ + 2H2O
Оксид меди (I) Cu2O — красный порошок , образующийся при нагревании меди на воздухе .
Соответствующий ей гидроксид меди ( I ) CuOH не стоек и быстро окисляется , с аммиаком даёт комплексный катион [Cu(NH3)2]OH.
Хлорид меди ( I ) с соляной кислотой образует хлоридные комплексные анионы (H[CuCl2] и H2[CuCl3]).
Оксид меди ( II ) CuO чёрного цвета , получается при нагревании меди на воздухе выше 300°C .Этому амфотерному оксиду соответствует гидроксид меди ( II ) Cu(OH)
CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2SO4
Сине голубой осадок гидроксида меди ( II ) разлагается при нагревании с выделением чёрного оксида меди ( II ) :
Cu(OH)2 = CuO + H2O
Гидроксид меди ( II ) амфотерен , растворим в кислотах и в избытке щелочей при нагревании ( или в концентрированных щелочах без нагревания ). Получившийся куприты щелочных металлов имеют синюю окраску :
Cu(OH)2 + 2KOH = K2[Cu(OH)4]
Действуя на раствор сульфата меди ( II ) аммиаком , выделяют зелёный осадок гидросульфата меди :
2CuSO4 + 2NH4OH = (CuOH)2SO4↓ + (NH4)2SO4
Под действием избытка аммиака образуется комплексное соединение интенсивно синего цвета :
(CuOH)2SO4 + (NH4)2SO4 + 6NH4OH = 2[Cu(NH3)4]SO4 + 8H2O
В комплексных соединениях для меди характерно координационное число 4 .
Из соединений меди ( III ) известен оксид меди ( III ) Cu2O3 ( красноватого цвета ).
Медь является микроэлементом. В организмах растений она стимулирует фотосинтез и дыхание , а также углеводный обмен.
Недостаток меди в почве вызывает заболевание растений ; особенно бедны медью и нуждаются в микроудобрениях торфяные и болотные почвы.
При этом микроудобрениями служат отходы от переработки медь — содержащих руд , а также их соли.
У животных медь ( входящая в состав некоторых белков и ферментов ) концентрируется в печени , недостаток ведёт к появлению анемий.
Соединения меди оказывают влияние на синтез гемоглобина и фосфолипидов .
В больших дозах соединения меди токсичны и использовались как пестициды (фунгициды , бактерицид) .
Сульфид меди (II)
Сульфид меди ( II ) представляет собой аквакомплекс [Cu(H2O)4]SO4 · H2O , широко применялся как фунгицид.
Смесь раствора сульфата меди с гидроксидом кальция ( под названием бордоской жидкости ) применяют как средство борьбы с возбудителями болезней винограда и плодовых культур.
В ветеринарии сульфат меди известен как прижигающее , рвотное , противоглистное средство.
Гидроксокарбонат меди (CuOH)2CO3 входит в состав протравителей семян , используется для изготовления зелёных красок.
Соединения медиОксиды — Медь образует два окиси, поскольку она имеет две валентности. Эти соединения представляют собой оксид меди (Cu2O) и оксид меди (CuO).
Оксид меди получают печным способом или электролитами. Это красный кристаллический материал.
Оксид меди получают путем воспламенения подходящих солей, таких как гидроксид, нитрат или карбонат меди, или путем нагревания оксида меди. CuO — это порошок черного цвета.
Галогениды- хлорид меди (CuCl), хлорид меди (CuCl2) представляют собой соединения меди с хлором. При прямом соединении меди и йода в результате получается йодистый иодид меди (CuI). Иодид меди (Cul2
При прямом соединении меди и йода в результате получается йодистый иодид меди (CuI). Иодид меди (Cul2
) существует только в сложных органических соединениях или в сочетании с солями аммония.
Сульфаты- Сульфат меди (CuSO4) называют синим купоросом, потому что он имеет ярко-синий цвет и является самой важной солью меди.
Сульфат меди обычно кристаллизуется в виде CuSO4.
Карбонаты
При добавлении щелочного карбоната к раствору соли меди образуются основные карбонаты меди.
Соединения, имеющие ярко-зеленый или синий цвет, используются при получении пигментов, которые встречаются в природе, таких как минералы малахит и азурит.
Применение медиМедь добавляют в некоторые металлы, чтобы улучшить их гибкость, твердость, эластичность, цвет и устойчивость к коррозии, поскольку это легко формуемый основной металл.
Медные сплавы, используемые в ювелирных изделиях, такие как серебро и золото, являются распространенными металлами, которые легируются медью.
Медь используется в большинстве распространенных материалов сантехнической и электротехнической промышленности, таких как трубы, детали двигателей, провода, трубопроводы и т.д.
Медь также считается важным элементом для здоровья человека. Взрослому человеку требуется примерно 1,2 мг Cu в день, чтобы помочь ферментам переносить энергию в клетках.
Избыточное количество меди в организме токсично. Болезнь Вильсона и болезнь Менкеса — это генетические заболевания, которые могут повлиять на способность организма правильно использовать медь.
Он легирован металлами, чтобы сделать его пригодным для различных целей.
Некоторыми из важных сплавов меди являются медно-никелевые, латунные, медно-бериллиевые сплавы, бронзы, нейзильберные сплавы, оружейные металлы и т.д.
Часто задаваемые вопросы ответы по меди1. Что такое медь?
Медь — это элемент и минерал, который очень важен для нашей повседневной жизни. Его атомный номер равен 29 в Периодической таблице элементов.
Символ меди — “Cu”. Он обладает такими свойствами, как пластичность, пластичность, электрическая и теплопроводность, а также устойчивость к коррозии.
Благодаря этим свойствам он находит широкое промышленное применение.
Медь встречается в природе в различных минералах, включая самородную медь, сульфиды меди, такие как халькоцит, борнит, дигенит, ковеллит и халькопирит, сульфосоли меди, такие как энаргит и тетраэдрит-теннантит, карбонаты меди, такие как малахит и азурит, и в виде оксидов меди (I) или меди (II), таких как куприт и тенорит, соответственно.
Обычная степень окисления меди составляет +1 и +2.
Благодаря своей пластичности, то есть способности втягиваться в провода и нити, высокой термостойкости, а также тому, что медь является хорошим проводником электричества, медь используется в электротехнической промышленности для изготовления проводов и двигателей.
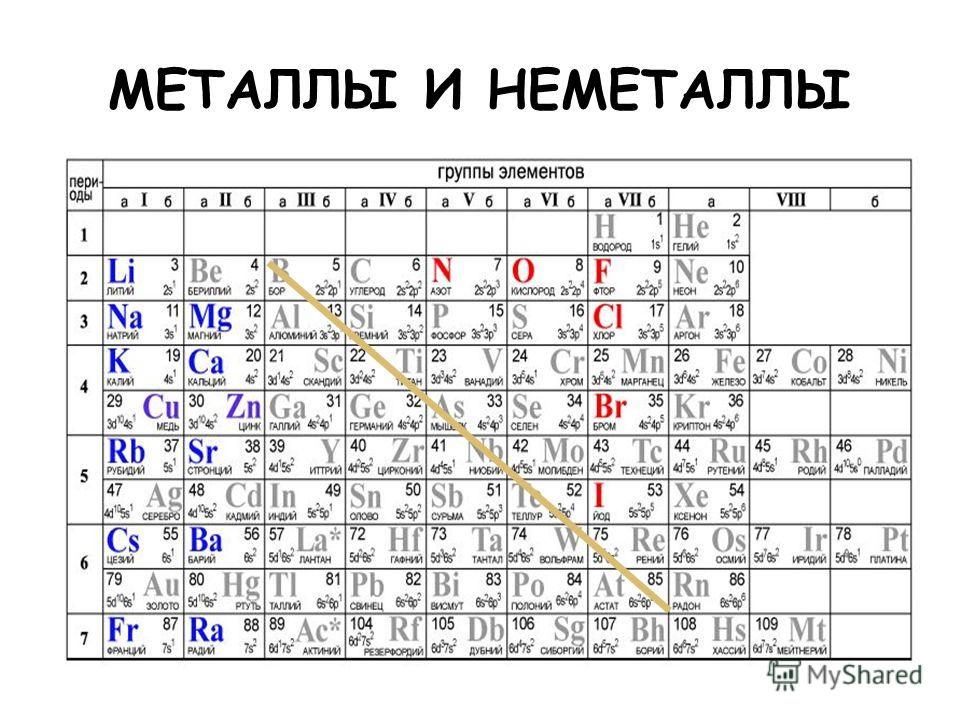
Медь — это металл или неметалл?
Медь — это металл. Он показывает свойства металлов. Он помещен в группу 11 периодической таблицы Менделеева, где металлы имеют один s-орбитальный электрон поверх заполненной d-электронной оболочки.
Он помещен в группу 11 периодической таблицы Менделеева, где металлы имеют один s-орбитальный электрон поверх заполненной d-электронной оболочки.
Металлы 11-й группы характеризуются высокой пластичностью, электрической и теплопроводностью. Заполненные d-орбитальные оболочки атома Cu в меньшей степени способствовали межатомным взаимодействиям.
Ковалентные свойства отсутствуют в металлических связях меди и являются относительно слабыми.
Медь считается очень важным металлом, который обладает такими свойствами, как ковкость, цветность, пластичность, и имеет широкий спектр применений в области строительства зданий, бытовой техники, электроснабжения и электроники, сантехники, промышленности, транспорта и товаров для здоровья.
Каковы области применения меди?
Медь — это металл красноватого цвета, который хорошо известен своей пластичностью, то есть способностью втягиваться в трубы и провода.
Это был первый металл, который люди использовали и модифицировали в различные формы для своих личных нужд.
Даже эпоха была названа в честь ее сплава, то есть бронзы, которую можно получить, смешав медь с оловом. Так же, как серебро и золото, исторически медь использовалась для изготовления монет.
Медь используется в электрических материалах, таких как провода, двигатели и т.д., и предпочтительнее изготавливать провода из-за своей пластичности, а также из меди, которая является хорошим проводником тепла и электричества.
Одно из соединений меди, то есть сульфат меди, используется для уничтожения водорослей в процессе очистки воды, а также для уничтожения вредителей в сельском хозяйстве.
Раствор Фелинга также представляет собой соединение меди, которое используется для определения присутствия сахаров в химии. Биологически медь очень важна для жизни человека.
Минимум 1,09 миллиграмма меди необходим для более быстрой передачи энергии из желудка в различные части тела, но чрезмерное потребление меди вредно для человека.
Млекопитающие используют железо, присутствующее в гемоглобине, для переноса кислорода, но некоторые ракообразные используют медь для переноса кислорода.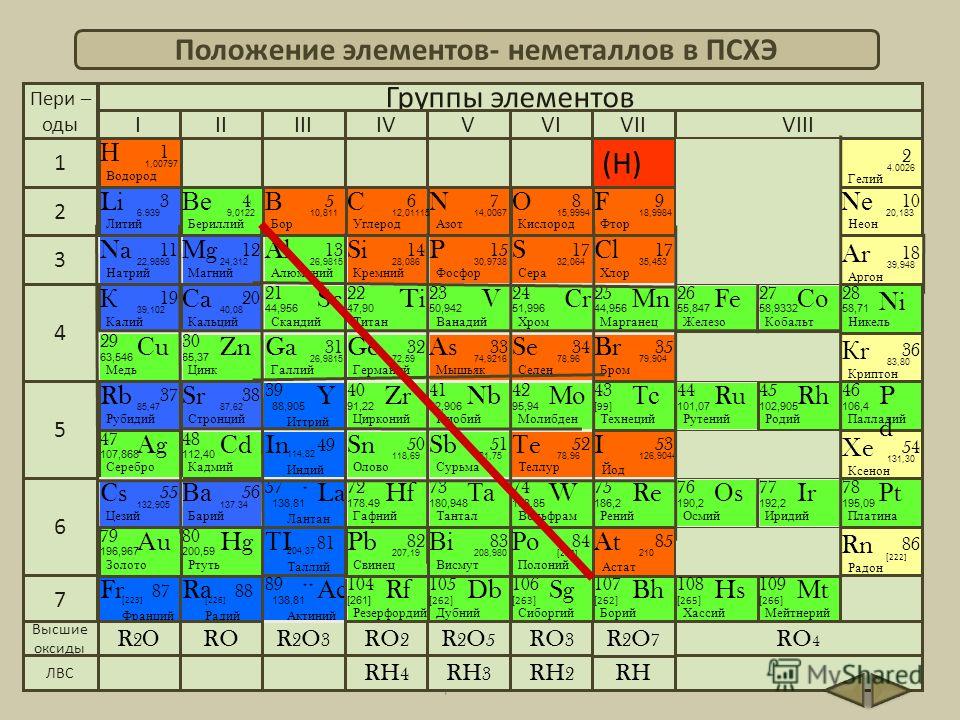
Почему в проводах используется медь?
Медь — это металл красноватого цвета, который хорошо известен своей пластичностью, то есть способностью втягиваться в трубы и провода.
Это был первый металл, который люди использовали и модифицировали в различные формы для своих личных нужд. Медь имеет множество применений, и использование ее в проводах — одно из них.
После серебра медь является очень хорошим проводником электричества, что означает, что электричество может легко проходить через медь.
Медь также очень недорога по сравнению с другими металлами, например, золото и серебро также являются отличными проводниками электричества, но они очень дороги для использования в электропроводке.
Компании, производящие провода из золота и серебра, только зря потратили бы кучу денег. Медь также очень пластична, что означает, что из нее можно вытягивать провода и трубы, которые очень гибки в использовании.
Медь может в некоторой степени выдержать повреждения, когда ее сгибают и складывают, это также является причиной, по которой золото смешивают с медью для изготовления украшений.
Лучше использовать медные провода, чем провода из других металлов, так как медь обладает высокой термостойкостью.
По этим причинам медь повсеместно признана лучшим выбором для изготовления проводов.
Лит.: Основы металлургии, т. 1—2. М., ; Ш е й н Я. П., Гудима Н. В. Краткий справочник металлурга по цветным металлам. М., 1964; Смирнов В. И. [и др.].
Статья на тему медь
Металлы и неметаллы
|
|
|
|||||||||||||||||||||
7.
 6: Металлы, неметаллы и металлоиды
6: Металлы, неметаллы и металлоиды- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
Цели обучения
- Понять основные свойства, отличающие металлы от нементальных и металлоидов
Элемент — это простейшая форма материи, которая не может быть разделена на более простые вещества или построена из более простых веществ любым обычным химическим или физическим методом. Нам известно 110 элементов, из которых 92 встречаются в природе, а остальные получены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Неблестящий, различных цветов |
| Ковкий и пластичный (гибкий) в виде твердых тел | Хрупкий, твердый или мягкий |
| Проведение тепла и электричества | Плохие проводники |
| Оксиды металлов основные, ионные | Оксиды неметаллов кислотные, соединения |
| Катионы в водном растворе | Анионы, оксианионы в водном растворе |
Металлы
Все элементы, кроме водорода, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются отличными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются отличными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, ковкие, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы являются твердыми при комнатной температуре, за исключением ртути, которая при комнатной температуре находится в жидком состоянии (галлий жидкий в жаркие дни).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут полироваться, например, золото, серебро и медь.
- Ковкость: Металлы обладают способностью выдерживать удары молотком и могут быть превращены в тонкие листы, известные как фольга (кусочек сахара из золота можно растолочь в тонкий лист, который покроет футбольное поле).

- Пластичность: Металлы можно вытягивать в проволоку. Из 100 г серебра можно вытянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и могут резаться ножом.
- Валентность: Металлы имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь являются двумя лучшими проводниками тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые. Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.
- Температуры плавления и кипения : Металлы имеют высокие температуры плавления и кипения. Вольфрам имеет самую высокую температуру плавления, тогда как серебро имеет низкую температуру кипения.
 Натрий и калий имеют низкие температуры плавления.
Натрий и калий имеют низкие температуры плавления.
Химические свойства металлов
Металлы представляют собой электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Другие химические свойства включают:
- Электроположительный характер 9- \метка{1.3}\]
- Щелочные металлы всегда 1 + (теряют электрон за с подоболочка)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона за с подоболочка)
- Ионы переходных металлов не следуют очевидной закономерности, обычно встречаются 2 + , а также 1 + и 3 +
Соединения металлов с неметаллами имеют тенденцию быть ионными в природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
Оксид металла + вода -> гидроксид металла
\[Na_2O_{(s)} + H_2O_{(l)} \rightarrow 2NaOH_{ (водн. )}\метка{1.4}\]
)}\метка{1.4}\]
\[CaO_{(т)} + H_2O_{(л)} \rightarrow Ca(OH)_{2(водн.)} \метка{1.5}\]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием 9{2-}\), таким образом, \(Al_2O_3\).
Пример \(\PageIndex{2}\)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Растворы
Оксиды металлов обычно твердые при комнатной температуре
Пример \(\PageIndex{3}\)
Напишите сбалансированное химическое уравнение реакции оксида алюминия с азотной кислотой:
Раствор
\[Al_2O_{3(s)} + 6HNO_{3(aq)} \rightarrow 2Al(NO_3)_{3(aq)} + 3H_2O_{(l)}\]
Неметаллы
Элементы, которые имеют тенденцию приобретать электроны с образованием анионов во время химических реакций, называются неметаллами. Это электроотрицательные элементы. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газообразными, жидкими или твердыми.
Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газообразными, жидкими или твердыми.
Физические свойства неметаллов:
- Физическое состояние : Большинство неметаллов существуют в двух из трех состояний вещества при комнатной температуре: газообразное (кислород) и твердое (углерод).
- Нековкий и пластичный : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Плохие проводники тепла и электричества.
- Блеск: Не имеют металлического блеска и не отражают свет
- Проводимость : Плохие проводники тепла и электричества
- Температуры плавления и кипения : Точки плавления неметаллов равны 9.0130 обычно ниже, чем у металлов
- Семь неметаллов существуют в стандартных условиях в виде двухатомных молекул :
- H 2 ( г )
- Н 2 ( г )
- O 2 ( г )
- F 2 ( г )
- Класс 2 ( г )
- Бр 2 ( л )
- I 2 ( л ) (летучая жидкость – легко испаряется)
Химические свойства неметаллов
- Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами.
 Они электроотрицательны по характеру.
Они электроотрицательны по характеру.
Неметаллы при взаимодействии с металлами склонны приобретать электроны (обычно принимают электронную конфигурацию благородного газа) и превращаются в анионы :
Неметалл + металл -> соль
\[3Br_{2(l)} + 2Al_{(s)} \rightarrow 2AlBr_{3(s)}\]
Соединения, полностью состоящие из неметаллов, являются молекулярными веществами (не ионными). Обычно они образуют кислотные или нейтральные оксиды с кислородом, которые при растворении в воде реагируют с образованием кислот:
Оксид неметалла + вода -> кислота
\[CO_{2(g)} + H_2O_{(l)} \rightarrow \underset {\text{угольная кислота}}{H_2CO_{3(водн.)}}\]
(газированная вода слабокислая)
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
Оксид неметалла + основание -> соль
\[CO_{2(г)} + 2NaOH_{(водн.)} \rightarrow Na_2CO_{3(водн. )} + H_2O_{(ж)}\]
)} + H_2O_{(ж)}\]
Металлоиды
Свойства, промежуточные между металлами и неметаллами. Металлоиды используются в полупроводниковой промышленности.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Железо | Азот | Сурьма |
| Меркурий | Сера | Германий |
| Цинк | Фосфор |
Все металлоиды твердые при комнатной температуре. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний например выглядит блестящим, но не ковкий или пластичный ( хрупкий – характеристика некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Они могут образовывать сплавы с другими металлами.
Это гораздо худший проводник тепла и электричества, чем металлы. Они могут образовывать сплавы с другими металлами.
Их физические свойства, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента этой группы может составлять от +3 до -2, в зависимости от группы, в которой он находится.
Тенденции металлических и неметаллических свойств
Металлический характер является самым сильным для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере продвижения вправо в любой период ( неметаллический характер увеличивается с увеличением значений ионизации). Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция , а не обязательно наблюдается для переходных металлов .
Авторы и ссылки
Майк Блабер (Университет штата Флорида)
Бинод Шреста (Университет Лотарингии)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.
- Теги
- сплав
- металл
- металлический символ
- металлоид
- неметалл
Металл и неметалл в периодической таблице
Содержание
Введение Периодическая таблица содержит в общей сложности 118 элементов. Все эти элементы широко классифицируются как металлы и неметаллы в периодической таблице. Помимо них, есть еще один раздел элементов, называемый металлоидом. Более 75% в левой и средней части таблицы Менделеева составляют металлы. Элементы в правой части периодической таблицы — неметаллы. Из сложных электронных устройств изучение металлов приобрело большое значение в повседневной жизни и их широком использовании. Металл и неметалл в периодической таблице обсуждаются ниже (1) и (3).
Все эти элементы широко классифицируются как металлы и неметаллы в периодической таблице. Помимо них, есть еще один раздел элементов, называемый металлоидом. Более 75% в левой и средней части таблицы Менделеева составляют металлы. Элементы в правой части периодической таблицы — неметаллы. Из сложных электронных устройств изучение металлов приобрело большое значение в повседневной жизни и их широком использовании. Металл и неметалл в периодической таблице обсуждаются ниже (1) и (3).
Металлы — это твердые, прочные по своей природе элементы. Они способны к яркому, блестящему и легкому отражению. Также относительно тяжелый по весу и издает металлический звук при ударе. Вступая в реакцию, он обычно образует щелочные оксиды (3).
Примеры металлов Примерами металлов являются серебро, медь, золото, платина, цинк, железо, алюминий, ртуть, свинец, магний и т. д. Все эти металлы твердые, за исключением ртути, которая находится в жидком состоянии. (3).
д. Все эти металлы твердые, за исключением ртути, которая находится в жидком состоянии. (3).
1. Твердость
Большинство металлов периодической таблицы являются твердыми, за исключением натрия, калия, лития и т. д. Этот металл является щелочным металлом. Эти металлы очень мягкие и их можно резать ножом.
2. Ковкость
Ковкость – важная характеристика металлов. Большинство металлов пластичны. То есть металлы можно сбивать молотком в тонкие листы. Благодаря этому свойству железо используется для изготовления больших кораблей.
3. Прочность
Большинство металлов прочны и обладают высокой прочностью на растяжение. Некоторые металлы не являются прочными. Например, натрий, калий и т. д.
4. Пластичность
Это еще одно важное свойство металлов. Металлы пластичны. Его можно втянуть в провода. Но не все металлы одинаково пластичны. Некоторые металлы более пластичны, чем другие. Медь и алюминий очень пластичны. Железо, магний также достаточно пластичны. Золото – самый пластичный металл.
Но не все металлы одинаково пластичны. Некоторые металлы более пластичны, чем другие. Медь и алюминий очень пластичны. Железо, магний также достаточно пластичны. Золото – самый пластичный металл.
5. Плотность
Металлы имеют высокую плотность и очень тяжелые. Иридий и осмий имеют самую высокую плотность, а литий — самую низкую плотность.
6. Проводимость
Металлы хорошо проводят тепло и электричество. Поэтому электрические провода сделаны из таких металлов, как медь и алюминий.
7. Плавление и кипение
Металлы имеют высокие температуры плавления и кипения. Вольфрам имеет самую высокую температуру плавления, а серебро имеет низкую температуру кипения.
8. Блеск
Металлы обладают способностью отражать свет от своей поверхности. Свойство металла иметь блестящую поверхность называется «металлическим блеском». Блестящий внешний вид металлов делает их полезными для изготовления украшений.
9. Физическое состояние
Металлы твердые при комнатной температуре, кроме ртути. Большинство металлов, таких как железо, медь, алюминий, серебро и т. д., при комнатной температуре находятся в твердом состоянии. Ртуть жидкая при комнатной температуре (1) и (3).
Химические свойства металлов1. Реакция металлов с кислородом :
Окись металла образуется при реакции металлов с кислородом.
Примеры:
а. Натрий образует оксид натрия при взаимодействии с кислородом.
4Na + O₂ → 2Na₂O
Натрий кислород оксид натрия
Литий, калий, натрий и т. д. известны как щелочные металлы. Эти металлы реагируют с кислородом.
б. Калий образует оксид калия при взаимодействии с кислородом.
4K + O₂ → 2K₂O
Калий кислород оксид калия
Серебро, золото и платина не соединяются с кислородом воздуха даже при высоких температурах.
2. Реакция металлов с водой:
Металлы образуют гидроксид и газообразный водород при взаимодействии с водой.
Примеры:
а. Натрий образует гидроксид натрия и газообразный водород вместе с большим количеством тепла при реакции с водой.
Na + H₂O → NaOH + H₂
Натрий вода гидроксид натрия водород
b. Кальций образует гидроксид кальция и газообразный водород при взаимодействии с водой.
Ca + 2H₂O → Ca(OH)₂ + H₂
Кальций вода оксид кальция водород
c. Магний реагирует с водой и образует гидроксид магния и газообразный водород.
Mg + H₂O → Mg(OH)₂ + h3
Магний вода оксид магния водород
Другие металлы не реагируют с водой или реагируют очень медленно. Медь, серебро, золото не реагируют с паром.
3. Реакция металлов с разбавленной кислотой:
Когда металлы реагируют с разбавленной кислотой, образуются соль металла и газообразный водород.
Пример:
а. Цинк реагирует с разбавленной соляной кислотой с образованием хлорида цинка и газообразного водорода.
ZN + 2HCL → ZnCl₂ + H₂
Цинк соляная кислота хлорид цинка водород
b. Хлорид магния и водород образуются при взаимодействии магния с разбавленной соляной кислотой.
мг +2HCl → MgCl₂ +H₂
Гидрохлорной кислоты магния. Хлоридный водород
4. Реакцией металлов с солевыми приветствиями:
Реакция смещения смещения является реакцией металлов с другими металлическими соленой соленой растволы. В этой реакции более активный металл вытесняет менее активный металл из его соли.
Пример:
а. Железо реагирует с раствором сульфата меди, образуя сульфат железа и медь.
Fe + CuSO₄ → FeSO₄ + Cu
Железо сульфат меди сульфат железа
b. Алюминий и цинк вытесняют медь из раствора медного купороса.
2AL +3CUSO₄ → Al₂ (SO₄) ₃ +3CU
Алюминиевая медная сульфатная алюминиевая сульфатная медная.0024
Цинк сульфат меди сульфат цинка медь
Во всех приведенных выше примерах железо, алюминий и цинк более реакционноспособны, чем медь. Вот почему они вытесняют медь из солевого раствора.
5. Реакция металлов с хлором
Металлы реагируют с хлором с образованием ионных хлоридов. Хлориды металлов имеют высокие температуры плавления и кипения. Итак, хлориды металлов нелетучи.
Пример:
а. Натрий – это металл. Он реагирует на хлор и образует ионный хлорид, называемый хлоридом натрия.
2Na + Cl₂ → 2NaCl
Натрий хлор хлорид натрия
b. Магний при нагревании с хлором легко образует хлористый магний. Это ионный хлорид.
Mg + Cl₂ → MgCl₂
Магний хлорид хлорид магния
6. Реакция металлов с водородом
Большинство металлов не соединяются с водородом. Только некоторые химически активные металлы, такие как натрий, кальций, калий и магний, реагируют с водородом с образованием гидридов металлов. В гидриде металла водород присутствует в форме отрицательного иона, называемого гидрид-ионом.
Только некоторые химически активные металлы, такие как натрий, кальций, калий и магний, реагируют с водородом с образованием гидридов металлов. В гидриде металла водород присутствует в форме отрицательного иона, называемого гидрид-ионом.
Пример:
Когда газообразный водород реагирует с натрием, образуется гидрид натрия.
2NA +H₂ → 2NAH
Гидддддрид натрия натрия
Гизовый водород реагирует с кальцием и образованным гидридом кальция
CA +H₂ → CaH₂
Кальциево -водород Гидрид (1) и (3).
Использование металлаВ повседневной жизни металлы используются в различных областях. Например:
- Ртуть используется в термометре для проверки температуры.
- Алюминий, в качестве посуды используется сталь.
- Золото, серебро, платина используются для изготовления украшений и украшений. Медь
- используется для изготовления кабельных проводов.
- Железо используется в автомобилях.

- Чугун и сталь используются в строительстве (3).
В химии неметаллы — это элементы, обладающие тремя видимыми свойствами вещества (твердое, жидкое и газообразное), не яркие и не блестящие, не отражающие свет, легкие, не проводящие тепло и электричество ( 3).
Примеры неметалловВодород, углерод, хлор, азот, бром, неон, аргон, сера, кремний, фосфор и т. д. являются неметаллами (3).
Физические свойства неметаллов1. Твердость
Большинство неметаллов обычно мягкие. Сера и фосфор – твердые неметаллы, достаточно мягкие. Но один неметаллический углерод (в форме алмаза) очень тверд.
2. Проводимость
Неметаллы не могут проводить тепло и электричество. Но некоторые неметаллы могут проводить тепло и электричество. Например, графит и углеродные неметаллы могут проводить тепло и электричество.
Но некоторые неметаллы могут проводить тепло и электричество. Например, графит и углеродные неметаллы могут проводить тепло и электричество.
3. Плавление и кипячение
Неметаллы имеют низкие температуры плавления и кипения. Но один неметалл имеет высокую температуру плавления и кипения. Алмаз имеет высокие температуры плавления и кипения. Однако температура плавления алмаза составляет более 3500°С, что очень высоко.
4. Блеск
Неметаллы не имеют блеска. Это означает, что неметаллы не имеют блестящей поверхности. Неметаллы скучны. Например, сера и фосфор не блестят. То есть они не имеют блестящей поверхности. А вот йод – это неметалл, который имеет блестящую поверхность.
5. Плотность
Неметаллы имеют низкую плотность, т.е. неметаллы являются легкими веществами. Сера имеет низкую плотность.
6. Пластичность и ковкость
Неметаллы не являются ни ковкими, ни пластичными. Неметаллы хрупкие, а это означает, что неметаллы распадаются на куски при ударе молотком или растяжении. Например, сера и фосфор — это твердые неметаллы, не поддающиеся податливости и пластичности. Но углерод также является хрупким неметаллом.
Неметаллы хрупкие, а это означает, что неметаллы распадаются на куски при ударе молотком или растяжении. Например, сера и фосфор — это твердые неметаллы, не поддающиеся податливости и пластичности. Но углерод также является хрупким неметаллом.
7. Звонкость
Неметаллы незвучны. Они не издают звука при ударе о другие предметы.
8. Физическое состояние
Неметаллы – это твердые вещества, жидкости и газы при комнатной температуре. Он может существовать во всех трех физических состояниях. Это твердые тела, жидкости и газы. Сера, фосфор — твердые неметаллы, бром — жидкие неметаллы, а водород, азот, кислород и т. д. — газообразные неметаллы.
9. Сильный
Неметаллы не являются прочными. Они легко ломаются. Графит не прочен и имеет низкую прочность.
10. Цвет
Неметаллы имеют много разных цветов. Например, сера имеет желтый цвет, фосфор — красный, графит — черный, а водород и кислород — бесцветные (2) и (3).
1. Реакция неметаллов с кислородом :
При взаимодействии неметаллов с кислородом образуется оксид.
Примеры:
Когда углерод реагирует с кислородом, образуется двуокись углерода с выделением тепла.
C + O₂ → CO₂ + Тепло
Углерод кислород-двуокись углерода
Сера дает диоксид серы при реакции с кислородом. Сера загорается при контакте с воздухом.
S + O₂ → SO₂
Сера кислород диоксид серы
2. Реакция неметаллов с водой:
Неметаллы не реагируют с водой с выделением газообразного водорода. Это связано с тем, что неметаллы не могут отдавать электроны для восстановления ионов водорода воды в газообразный водород.
3. Реакция неметаллов с разбавленной кислотой:
Неметаллы не реагируют с разбавленными кислотами.
4. Реакция неметаллов с солевыми приветствиями:
Реакция неметаллов с солевыми приветствиями:
Более реакционноспособный неметалл вытесняет менее реакционноспособный неметалл из его солевого приветствия.
- При взаимодействии хлора с раствором бромида натрия образуются хлорид натрия и бром
2NaBr + Cl₂ → 2NaCl + Br₂
Бромид натрия хлор хлорид натрия бром
5. Реакция неметаллов с хлором:
Неметаллы реагируют с хлором и образуются хлориды.
- Водород является неметаллом. При взаимодействии с хлором образуется хлорид, называемый хлористым водородом.
H₂ + Cl₂ → 2HCl
Хлористый водород Хлористый водород
6. Реакция неметаллов с водородом:
Неметалл реагирует с водородом и образует гидриды.
- Сера – это неметалл, который соединяется с водородом с образованием ковалентного гидрида, называемого сероводородом.

H₂ + S → H₂S
Сероводород сероводород (3).
Использование неметалла
- Кислород является неметаллом.
- Хлор используется для очистки воды.
- Азот используется растениями.
- Графит используется для изготовления поводков
- Углерод используется в качестве топлива. Алмаз
- используется в промышленности для резки стекла.
- Неон, аргон используется в разных типах фонарей (2).
В химии элемент, проявляющий свойства как металлов, так и неметаллов, называется металлоидом (3).
Примеры металлоидовБор, кремний, германий, мышьяк, сурьма, теллур и полоний являются металлоидами. (3).
Физические свойства металлоидов 1. Физическое состояние
Физическое состояние
Металлоиды твердые при комнатной температуре.
2. Блеск
Металлоиды могут быть блестящими или матовыми.
3. Проводимость
Металлоиды обладают низкой тепло- и электропроводностью. То есть металлоиды являются полупроводниками.
4. Пластичность и ковкость
Металлоиды не являются ни ковкими, ни пластичными. Металлоиды хрупкие, а это означает, что неметаллы распадаются на куски при ударе молотком или растяжении.
5. Плавление и кипение
Имеет температуру плавления и кипения.
6. Плотность
По сравнению с металлами, металлоиды имеют низкую плотность (3) и (5).
Использование металлоидов
- Карбид бора также используется для литья под давлением пуленепробиваемых курток.
- Кремний обладает полупроводниковыми свойствами.
 Таким образом, кремний используется в компьютерных чипах.
Таким образом, кремний используется в компьютерных чипах. - Используется в виде борной кислоты и может использоваться как чистящее средство.
- Германий используется в полупроводниковой промышленности для улучшения проводящих свойств.
- Сурьма используется как один из ингредиентов красок и керамических эмалей. В древние времена египтяне использовали сурьму в качестве косметического средства.
| Свойства | Металл | Неметалл | Металлоид | ||
| 1. Физическое состояние | Металлы твердые при комнатной температуре | Неметаллы бывают твердыми, жидкими и газообразными при комнатной температуре. | Металлоиды твердые при комнатной температуре.
| ||
| 2. Плотность | Металлы имеют высокую плотность и очень тяжелые. | Неметаллы имеют низкую плотность, то есть неметаллы являются легкими веществами. | По сравнению с металлами металлоиды имеют низкую плотность.
| ||
| 3. Теплопроводность | Металлы обладают хорошей теплопроводностью. | Неметаллы не проводят тепло. | Металлоиды обладают низкой теплопроводностью. | ||
| 4. Блеск | Металлы обладают свойством отражать свет от своей поверхности. | Неметаллы не имеют блеска. Это означает, что неметаллы не имеют блестящей поверхности. Неметаллы скучны. | Металлоиды могут быть блестящими или тусклыми. | ||
| 5. Электропроводка | Металлы обладают хорошей проводимостью электричества. | Неметаллы не могут проводить электричество. | Металлоиды обладают низкой проводимостью электричества. | ||
| 6. Температура плавления и кипения | Металлы имеют высокие температуры плавления и кипения. | Большинство неметаллов имеют низкие температуры плавления и кипения. | Имеет температуру плавления и кипения. | ||
| 7. Пластичность | Это еще одно важное свойство металлов. Металлы пластичны. Его можно втянуть в провода. | Неметаллы не пластичны. | Металлоиды также не пластичны. | ||
| 8. Пластичность | Ковкость — важная характеристика металлов. Большинство металлов пластичны. То есть металлы можно сбивать молотком в тонкие листы. Большинство металлов пластичны. То есть металлы можно сбивать молотком в тонкие листы. | Неметаллы не пластичны. Неметаллы хрупкие, а это означает, что неметаллы распадаются на куски при ударе молотком или растяжении. | Металлоиды не пластичны. Металлоиды хрупкие, а это означает, что неметаллы распадаются на куски при ударе молотком или растяжении.
| ||
| 9. Взаимодействие оксид-вода | Образует основание при реакции с оксидом-водой | Образует кислоту | Эти соединения могут образовывать как основания, так и кислоты. | ||
| 10. Природа оксидов
| Основной оксид металла. | Неметалл, образующий кислотный оксид. | Металлоиды образуют кислотный оксид. | ||
| 11. Ионная тенденция | Катионы формы | Форма анионов | Может образовывать оба | ||
В 1829 году немецкий ученый Доберейнер впервые попытался расшифровать происхождение нескольких атомов с атомной массой и сходством их религий. Это называется Законом Триад. В 1864 году другой ученый Ньюленд также пытался расшифровать происхождение нескольких атомов с помощью атомной массы и сходства их религий. Русский ученый Менделеев в 1869 г.расположил элементы по возрастанию атомной массы, что называется периодическим законом Менделеева. В периодической таблице металлы расположены в левой и средней части. Элементы в правой части периодической таблицы — неметаллы. И кроме них есть еще один раздел элементов под названием металлоид (4).
Это называется Законом Триад. В 1864 году другой ученый Ньюленд также пытался расшифровать происхождение нескольких атомов с помощью атомной массы и сходства их религий. Русский ученый Менделеев в 1869 г.расположил элементы по возрастанию атомной массы, что называется периодическим законом Менделеева. В периодической таблице металлы расположены в левой и средней части. Элементы в правой части периодической таблицы — неметаллы. И кроме них есть еще один раздел элементов под названием металлоид (4).
Периодическую таблицу элементов можно рассматривать как единый документ, отражающий поведение элементов простым и логичным способом. Это означает, что можно предсказать природу и поведение металлов и неметаллов, только зная положение металлов и неметаллов в периодической таблице. На самом деле организация металлов и неметаллов в периодической таблице была большим достижением в истории химии.






 Типичными металлами являются щелочные (литий, натрий, калий, рубидий, цезий) и щелочноземельные (кальций, стронций, барий, магний) металлы.
Типичными металлами являются щелочные (литий, натрий, калий, рубидий, цезий) и щелочноземельные (кальций, стронций, барий, магний) металлы.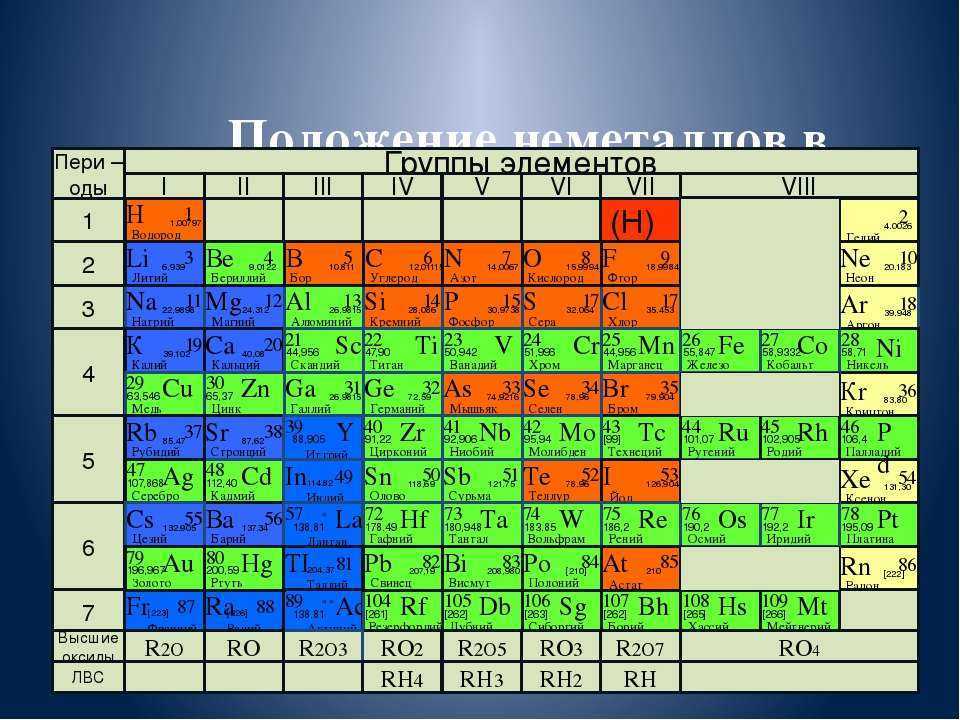


 Настройка.
Настройка.
 Натрий и калий имеют низкие температуры плавления.
Натрий и калий имеют низкие температуры плавления. Они электроотрицательны по характеру.
Они электроотрицательны по характеру.