Медь химическая формула: Формула меди в химии
alexxlab | 16.12.2022 | 0 | Разное
Металлические нанопорошки
19 Мая 2020 КОМПАНИЯ «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» (ТОМСК, РФ) ИЗГОТАВЛИВАЕТ НАНОПОРОШКИ ОКСИДА МЕДИ И ЦИНКА С АНТИМИКРОБНЫМ ДЕЙСТВИЕМ
КОМПАНИЯ «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» (ТОМСК, РФ) ИЗГОТАВЛИВАЕТ НАНОПОРОШКИ ОКСИДА МЕДИ И ЦИНКА С АНТИМИКРОБНЫМ ДЕЙСТВИЕМПандемия коронавируса COVID-19 показала, что существует неотложная потребность в эффективных мерах по предотвращению распространения вирусных инфекций различных нозологий. Последние случаи вспышек вируса атипичной пневмонии, птичьего гриппа, гриппа h2N1, и наконец, коронавируса COVID-19 показали, что высокоэффективные бытовые технические средства, позволяющие прервать пути распространения инфекций, отсутствуют. На данный момент известно, что есть два главных пути передачи вирусов. Во-первых, это воздушно-капельный механизм передачи инфекции, во-вторых, это контакт человека с зараженными поверхностями.
В настоящее время для прерывания путей передачи вирусов в быту в качестве индивидуальных защитных средств используются маски, защищающие органы дыхания, перчатки и различные антисептики, которыми обрабатываются руки и окружающие предметы и поверхности.
Защитные маски позволяют уменьшить распространение респираторных вирусов, особенно при использовании в замкнутом пространстве или при тесном контакте с человеком с симптомами заражения [1, 2]. Однако сами маски также могут быть источником инфекции [3]. Маска примерно через два часа становится влажной и уже в ней начинают размножаться микроорганизмы. По мнению ВОЗ, маски не гарантируют защиты от COVID-19. Установлено, что эффективность хирургических масок даже самого высокого класса защиты FFP3 недостаточна (гриппом заражается не менее 23 % медицинских сестер, носивших хирургические маски класса FFP3).
Вирус COVID-19 передается не только воздушно-капельным, но и контактным путем, и может сохраняться на поверхностях до 72 часов.
 Поэтому другой стороной вышеуказанной проблемы является передача вирусов, в т.ч. COVID-19, в лечебных учреждениях через медицинскую одежду, постельное белье, корпуса медицинского оборудования и др.
Поэтому другой стороной вышеуказанной проблемы является передача вирусов, в т.ч. COVID-19, в лечебных учреждениях через медицинскую одежду, постельное белье, корпуса медицинского оборудования и др.Одним из путей решений вышеуказанных проблем является придание натуральным и искусственным, в т.ч. медицинским, материалам и поверхностям антисептических свойств, например, с помощью биоцидных наночастиц. Волокна, импрегнированные биоактивными наночастицами, проявляют биоцидные свойства – антибактериальные, противогрибковые, противовирусные [4]. В большинстве современных исследований в области применения наночастиц для уничтожения патогеннов, основное внимание уделяется однокомпонентным наноматериалам (например, наночастицам оксида меди CuO, оксида цинка ZnO, серебра Ag). До недавнего времени серебро оставалось наиболее популярным материалом, который предлагался как эффективное антимикробное средство. Однако последние исследования показывают, что серебро при применении в действующих концентрациях оказывает цитотоксический эффект на клетки организма человека [5].

Например, импрегнация биоактивных наночастиц оксида меди в фильтрующий материал позволяет придать одноразовым респираторным маскам мощные биоцидные свойства без изменения их барьерных свойств [6]. При контакте с вирусом ионы меди вызывают массовое повреждение компонентов клеточной стенки, вирусных генов и ключевых белков [7].
Таким образом, с использованием нанопорошков оксидов меди и цинка, возможно разработать ряд продуктов, позволяющих прервать пути передачи вирусов в быту и в медицинских учреждениях – лицевых масок, одежды медицинского персонала, перчаток, больничных простыней, корпусов медицинского оборудования, контейнеры для хранения продуктов, клавиатуру компьютеров, корпуса мобильных телефонов и др.

Компания «ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ» может изготовить нанопорошки оксидов меди и цинка для разработки новых антимикробных материалов.
1. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2008) Physicalinterventions to interrupt or reduce the spread of respiratory viruses: systematicreview. BMJ 336: 77–80.
2. Jefferson T, Foxlee R, Del Mar C, Dooley L, Ferroni E, et al. (2007) Interventions for the interruption or reduction of the spread of respiratoryviruses. Cochrane Database Syst Rev 6207.
3. Zhiqing L. et al. Surgical masks as source of bacterial contamination during operative procedures //Journal of orthopaedic translation.2018; 14: 57-62.
5. Akter M. et al. A systematic review on silver nanoparticles-induced cytotoxicity: Physicochemical properties and perspectives //Journal of advanced research.
 – 2018. – Т. 9. – С. 1-16.
– 2018. – Т. 9. – С. 1-16.6. Gadi Borkow et al. A Novel Anti-Influenza Copper Oxide Containing Respiratory Face Mask // PLoS ONE, June 2010, Volume 5, Issue 6.
7. Borkow & Gabbay (2005) Copper as a biocidal tool. Current Medicinal Chemistry12:2163-75
ООО “ПЕРЕДОВЫЕ ПОРОШКОВЫЕ ТЕХНОЛОГИИ”
Адрес: 634055, Российская Федерация, Томск, проспект Академический, 8/8
Телефон/Факс: +7 (3822) 28-68-72 , 8-961-888-16-24
Оксид меди (I)
Оксид меди (I) (гемиоксид меди, окси́д димеди, устар. закись меди) — химическое соединение с формулой Cu2O. Соединение меди с кислородом, основный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта.
Содержание
- 1 Нахождение в природе
- 2 Физические свойства
- 3 Химические свойства
- 3.1 Реакции в водных растворах
- 3.2 Реакции при высоких температурах
- 3.3 Прочие реакции
- 4 Получение
- 5 Применение
- 6 Токсичность
Нахождение в природе
Оксид меди (I) встречается в природе в виде минерала куприта (устаревшие названия: красная медная руда, стекловатая медная руда, рубиновая медь). Цвет минерала красный, коричнево-красный, пурпурно-красный или чёрный. Твёрдость по шкале Мооса 3,5 — 4.
Цвет минерала красный, коричнево-красный, пурпурно-красный или чёрный. Твёрдость по шкале Мооса 3,5 — 4.
Разновидность куприта с удлиненными нитевидными кристаллами называется халькотрихит (устаревшее название: плюшевая медная руда). Кирпично-красная смесь куприта с лимонитом носит название «черепичная руда».
Физические свойства
Оксид меди (I) при нормальных условиях — твёрдое вещество коричнево-красного цвета нерастворимое в воде и этаноле. Плавится без разложения при 1242 °C.
Оксид меди (I) имеет кубическую сингонию кристаллической решётки, пространственная группа P n3m, a = 0,4270 нм, Z = 2.
Химические свойства
Реакции в водных растворах
Оксид меди (I) не реагирует с водой. В очень малой степени (ПР = 1,2⋅10−15) диссоциирует:
- Cu2O + H2O ⇄ 2Cu+ + 2OH−
Равновесие диспропорционирования:
- 2Cu+ ⇄ Cu2+ + Cu
Оксид меди (I) переводится в раствор:
- концентрированной соляной кислотой
- Cu2O + 4HCl ⟶ 2H[CuCl2] + H2O
- концентрированной щёлочью (частично)
- Cu2O + 2OH− + H2O ⇄ 2[Cu(OH)2]−
- концентрированным гидратом аммиака и концентрированными растворами солей аммония
- Cu2O + 4(NH3 ⋅ H2O) ⟶ 2[Cu(NH3)2]OH + 3H2O
- Cu2O + 2NH4+ ⟶ 2[Cu(H2O)(NH3)]+
- путём окисления до солей меди (II) различными окислителями (например, концентрированными азотной и серной кислотами, кислородом в разбавленной соляной кислоте)
- Cu2O + 6HNO3 ⟶ 2Cu(NO3)2 + 2NO2↑ + 3H2O
- Cu2O + 3H2SO4 ⟶ 2CuSO4 + SO2↑ + 3H2O
- 2Cu2O + 8HCl + O2 ⟶ 4CuCl2 + 4H2O
Также оксид меди (I) вступает в водных растворах в следующие реакции:
- медленно окисляется кислородом до гидроксида меди (II)
- 2Cu2O + 4H2O + O2 ⟶ 4Cu(OH)2↓
- реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди (I):
- Cu2O + 2HHal ⟶ 2CuHal↓ + H2O (Hal = Cl, Br, I)
- в разбавленной серной кислоте дисмутирует на сульфат меди (II) и металлическую медь
- Cu2O + H2SO4 ⟶ CuSO4 + Cu↓ + H2O
- восстанавливается до металлической меди типичными восстановителями, например гидросульфитом натрия в концентрированном растворе
- 2Cu2O + 2NaHSO3 ⟶ 4Cu↓ + Na2SO4 + H2SO4
Реакции при высоких температурах
Оксид меди (I) восстанавливается до металлической меди в следующих реакциях:
- при нагревании до 1800 °C (разложение)
- 2Cu2O →1800∘C 4Cu + O2
- при нагревании в токе водорода, монооксида углерода, с алюминием
- Cu2O + H2 →>250∘C 2Cu + H2O
- Cu2O + CO →250−300∘C 2Cu + CO2
- 3Cu2O + 2Al →1000∘C 6Cu + Al2O3
- при нагревании с серой
- 2Cu2O + 3S →>600∘C 2Cu2S + SO2
- 2Cu2O + Cu2S →1200−1300∘C 6Cu + SO2
Оксид меди (I) может быть окислен до соединений меди (II) в токе кислорода или хлора:
- 2Cu2O + O2 →500∘C 4CuO
- Cu2O + Cl2 →250∘C Cu2Cl2O
Также, при высоких температурах оксид меди (I) реагирует:
- с аммиаком (образуется нитрид меди (I) )
- 3Cu2O + 2NH3 →250∘C 2Cu3N + 3H2O
- c оксидами щелочных металлов и бария (образуются двойные оксиды)
- Cu2O + M2O →600−800∘C 2MCuO
- Cu2O + BaO →500−600∘C BaCu2O2
Прочие реакции
Оксид меди (I) реагирует с азидоводородом:
- при охлаждении выпадает осадок азида меди (II)
- Cu2O + 5HN3 →10−15∘C 2Cu(N3)2↓ + H2O + NH3↑ + N2↑
- при комнатной температуре в токе азидоводородной кислоты выпадает осадок азида меди (I)
- Cu2O + 2HN3 →20−25∘C 2CuN3↓ + H2O
Получение
Оксид меди (I) может быть получен:
- нагреванием металлической меди при недостатке кислорода
- 4Cu + O2 →>200∘C 2Cu2O
- нагреванием металлической меди в токе оксида азота (I) или оксида азота (II)
- 2Cu + N2O →500−600∘C Cu2O + N2
- 4Cu + 2NO →500−600∘C 2Cu2O + N2
- нагреванием металлической меди с оксидом меди (II)
- Cu + CuO →1000−1200∘C Cu2O
- термическим разложением оксида меди (II)
- 4CuO →1026−1100∘C 2Cu2O + O2
- нагреванием сульфида меди (I) в токе кислорода
- 2Cu2S + 3O2 →1200−1300∘C 2Cu2O + 2SO2
В лабораторных условиях оксид меди (I) может быть получен восстановлением гидроксида меди (II) (например, гидразином):
- 4Cu(OH)2 + N2H4 ⋅ H2O →100∘C 2Cu2O ↓ + N2↑ + 7H2O
Также, оксид меди(I) образуется в реакциях ионного обмена солей меди (I) с щелочами, например:
- в реакции йодида меди (I) с горячим концентрированным раствором гидроксида калия
- 2CuI + 2KOH ⟶ Cu2O↓ + 2KI + H2O
- в реакции дихлорокупрата (I) водорода с разбавленным раствором гидроксида натрия
- 2H[CuCl2] + 4NaOH ⟶ Cu2O↓ + 4NaCl + 3H2O
В двух последних реакциях не образуется соединения с составом, соответствующим формуле CuOH (гидроксид меди (I) ). Образование оксида меди (I) происходит через промежуточную гидратную форму переменного состава Cu2O ⋅ xH2O.
Образование оксида меди (I) происходит через промежуточную гидратную форму переменного состава Cu2O ⋅ xH2O.
- Окисление альдегидов гидроксидом меди (II). Если к голубому осадку гидроксида меди (II) прилить раствор альдегида и смесь нагреть , то сначала появляется жёлтый осадок гидроксида меди (I):
- R−CHO + 2Cu(OH)2 →t R−COOH + 2CuOH↓ + H2O
- при дальнейшем нагревании желтого осадка гидроксида меди (I) превращается в красный оксид меди (I):
- 2CuOH →tCu2O + H2O
Применение
Оксид меди (I) применяется как пигмент для окрашивания стекла, керамики, глазурей; как компонент красок, защищающих подводную часть судна от обрастания; в качестве фунгицида.
Обладает полупроводниковыми свойствами, используется в меднозакисных вентилях.
Токсичность
Оксид меди (I) — умеренно токсичное вещество: LD50 470 мг/кг (для крыс перорально). Вызывает раздражение глаз, может вызывать раздражение кожи и дыхательных путей.
Вызывает раздражение глаз, может вызывать раздражение кожи и дыхательных путей.
Очень токсично для водной среды: LC50 для Daphnia magna составляет 0,5 мг/л в течение 48 ч.
Химическая формула меди. Степени окисления, свойства и ответы на часто задаваемые вопросы валюты. В химии химическая формула меди обозначается как Cu. поскольку медь принадлежит к группе переходных металлов в периодической таблице, которая имеет подоболочку d и обозначается как (n – 1) d переход. Имеет атомный номер 29.. Медь очень мягкая, ковкая, пластичная, а свежая открытая поверхность меди имеет розовато-оранжевый цвет.
Они являются хорошими проводниками электричества с высокой теплопроводностью и поэтому широко используются в качестве металла в электропроводке. Различные сплавы также используются для изготовления ювелирных изделий, где используется стерлинговое серебро, медно-никелевый сплав используется для изготовления монет и морского оборудования, термопар для измерения температуры и тензодатчика из медного сплава константана. Необработанная металлическая форма меди показана ниже.
Необработанная металлическая форма меди показана ниже.
Степени окисления меди
Хотя медь демонстрирует несколько степеней окисления из-за наличия d-оболочек в диапазоне +1, +2,+3,+4, наиболее стабильной является степень окисления +2. Распределение электронов валентной оболочки переходного металла меди: Xe 4s 1 3d 10 . Таким образом, подоболочка 4s как 1 электрон вместе с 3d-электронами вместе действует как электроны валентной оболочки. Таким образом, получение стабильных степеней окисления относится к энергетическому балансу. Таким образом, потеря электронов из валентных оболочек требует энергии, а получение сильного окисления означает потерю валентных электронов, которые требуют большей энергии. Таким образом, затраты энергии на достижение определенной степени окисления должны компенсироваться сродством к электрону неметалла и электростатическими силами притяжения диполей и связывания отрицательных ионов.
Таким образом, металлическая медь может потерять дополнительный одиночный электрон из подоболочки 3d с одним 4s-электроном, энергия которого компенсируется, но переход к более высокому окислению требует большей энергии, которая компенсируется сродством к электрону неметалла и электростатическими силами притяжения диполей и отрицательных ионов. и поэтому неустойчивы по своей природе. Но для более электроотрицательных атомов, таких как фтор и кислород, которые обладают более высоким сродством к электрону, при образовании соединения возникает более высокая степень окисления меди. Но большинство известных соединений меди проявляют степень окисления меди +2, например CuSO 9 .0015 4 , который представляет собой формулу сульфата меди.
и поэтому неустойчивы по своей природе. Но для более электроотрицательных атомов, таких как фтор и кислород, которые обладают более высоким сродством к электрону, при образовании соединения возникает более высокая степень окисления меди. Но большинство известных соединений меди проявляют степень окисления меди +2, например CuSO 9 .0015 4 , который представляет собой формулу сульфата меди.
Так как сульфатная группа в формуле сульфата меди сама по себе имеет степень окисления +2, а в формуле сульфата меди только один атом меди уравновешивает один атом сульфата. Таким образом, ясно, что CuSO 4 имеет степень окисления Cu (II). Другим распространенным соединением окисления меди Cu (II) является оксид меди или оксид меди, который является названием соединения CuO. Химически формула оксида меди или формула оксида меди CuO.
Производство и метод
Большая часть меди добывается из крупных карьеров медно-порфировых месторождений в виде сульфидов меди, которые содержат около 0,5-1,0% меди.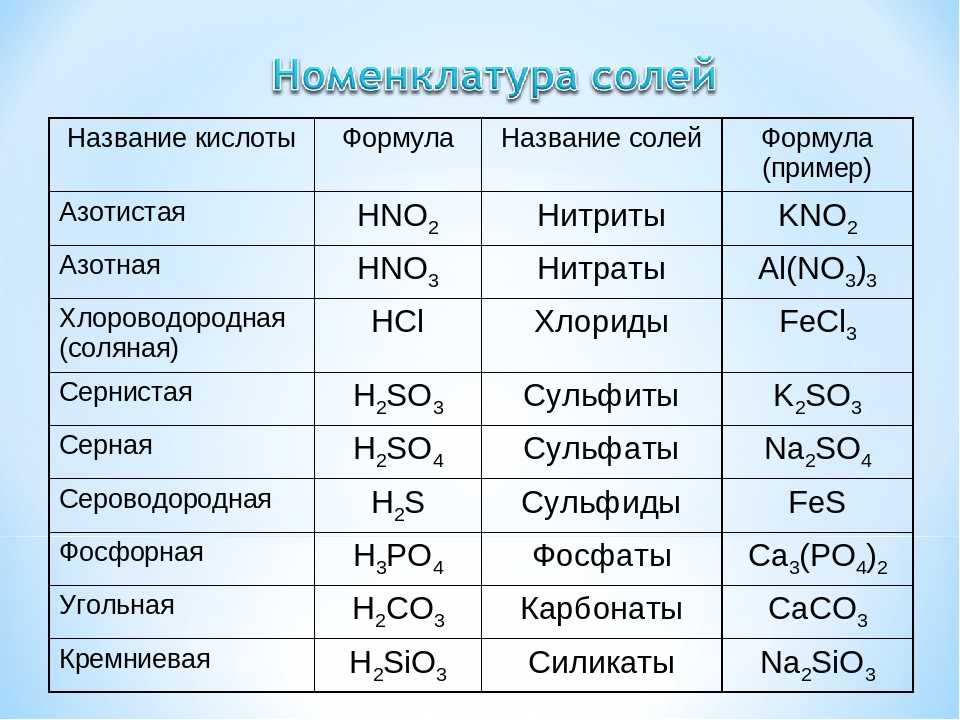 Большинство этих медных рудников расположены в Чили, штат Юта, США и Мексике. По данным Британской геологической службы, перец чили был одним из крупнейших производителей медной руды в 2005 году, за ним следуют США, Индонезия и Перу. С 1900 года использование меди резко возросло, и с учетом чистого количества меди, доступного по всему миру, было трудно сопоставить использование меди с использованием в развитых странах. Таким образом, появилась альтернатива меди, которая представляет собой полиметаллические конкреции, также известные как марганцевые конкреции, которые извлекаются из концентрических слоев меди и гидроксида марганца, присутствующих на дне океана.
Большинство этих медных рудников расположены в Чили, штат Юта, США и Мексике. По данным Британской геологической службы, перец чили был одним из крупнейших производителей медной руды в 2005 году, за ним следуют США, Индонезия и Перу. С 1900 года использование меди резко возросло, и с учетом чистого количества меди, доступного по всему миру, было трудно сопоставить использование меди с использованием в развитых странах. Таким образом, появилась альтернатива меди, которая представляет собой полиметаллические конкреции, также известные как марганцевые конкреции, которые извлекаются из концентрических слоев меди и гидроксида марганца, присутствующих на дне океана.
На протяжении многих лет, начиная с 1900 года, некоторые методы используются для добычи меди. Для извлечения меди из конкреций используются такие методы, как серное выщелачивание, плавка с последующим применением меднокислотного процесса. Таким образом, медь, присутствующая в рудах земли, восстанавливается до 10-15% меди путем пенной флотации и процесса отбеливания. Таким образом, чтобы удалить большую часть железа, присутствующего в рудном взвеси, проводят плавление материала с кремнеземом, так что железо удаляется в виде шлака. Этот метод превращает сульфиды железа в оксиды, которые реагируют с кремнеземом с образованием силикатного шлака, всплывающего на поверхность нагретого материала. Таким образом, оставшийся медный штейн находится в форме сульфида меди, то есть Cu 2 Название соединения S, и его обжигают для превращения сульфидов в оксид меди (l), который представляет собой другую формулу оксида меди со стадией окисления +1, которая нестабильна по своей природе и легко разлагается при нагревании до чистой меди.
Таким образом, чтобы удалить большую часть железа, присутствующего в рудном взвеси, проводят плавление материала с кремнеземом, так что железо удаляется в виде шлака. Этот метод превращает сульфиды железа в оксиды, которые реагируют с кремнеземом с образованием силикатного шлака, всплывающего на поверхность нагретого материала. Таким образом, оставшийся медный штейн находится в форме сульфида меди, то есть Cu 2 Название соединения S, и его обжигают для превращения сульфидов в оксид меди (l), который представляет собой другую формулу оксида меди со стадией окисления +1, которая нестабильна по своей природе и легко разлагается при нагревании до чистой меди.
2Cu 2 S + 3O 2 → 2Cu 2 O + 2SO 2
2Cu 2 O → 4Cu + O 2
Another process by which copper is synthesised in the laboratory происходит путем восстановления CuO, формулы оксида меди. В этой реакции оксид меди восстанавливается в присутствии водорода, где он теряет свой кислород, который присоединяется к водороду с образованием воды, и поэтому также называется гидролизом CuO.
В этой реакции оксид меди восстанавливается в присутствии водорода, где он теряет свой кислород, который присоединяется к водороду с образованием воды, и поэтому также называется гидролизом CuO.
CuO + H 2 → Cu + H 2 O
Еще один жизнеспособный процесс: формула сульфата меди помещается в контейнер, называемый автоклавом, и подвергается воздействию газообразного водорода при давлении 25 бар (где давление H 2 газ около 30 бар). Затем раствор сульфата меди (на самом деле это название соединения CuSO4) нагревают примерно до 150 oC в течение часа, что приводит к образованию меди, которая выпадает в осадок в виде медного порошка.
CuSO 4 (водн.) + H 2 (г) → Cu(s) + H 2 SO 4 (водн.)
Физико-химические свойства меди следующие:
Свойства меди
Properties | Values |
Atomic Weight | 63. |
Atomic Number | 29 |
Phase | Solid |
Melting Point | 1084.62 oC or 1357.77 K |
Boiling Point | 2562 oC or 2835 K |
Плотность | 8,96 г/см3 8,02 г/см3 в жидком состоянии. |
Теплота плавления | 13,26 кДж/моль |
ОТВЕТ ВАПУРИЗАЦИИ | 300,4 кДж/моль |
Молярная теплоемкость | 24.440 Дж. (Моль. Шкала Полинга. |
Энергия ионизации | 1-я: 745,5 кДж/моль 2-я: 1957,9 кДж/моль0 |
Атомный радиус | 128 PM |
Термическое расширение | 16,5 мкм/(M. |
Твердость | 3,0 мм.0090 |
Удельное электрическое сопротивление | 16,78 нОм·м при 20 oC. |
Young’s Modulus | 110 -128 GPa |
Spectra Lines of Copper | |
Conclusion
The chemical element copper has the atomic number 29 and the symbol Cu. Это металл с чрезвычайно высокой тепло- и электропроводностью, мягкий, ковкий и пластичный. Чистая медь имеет розовато-оранжевый оттенок при первом контакте с воздухом. В качестве тепло- и электропроводного материала медь также используется в строительстве. Он также является компонентом нескольких металлических сплавов, в том числе мельхиора, который используется для создания монет и военно-морского оборудования, и константана, который используется в тензодатчиках и термопарах для измерения температуры.
Химический состав меди | Джиндре
| Обозначение материала | СОСТАВ % | |||||||||
Элемент | Медь | Аг | Би | О | Р | Пб | Прочие элементы (см. примечание) | |||
| Символ | Номер | Всего | За исключением | |||||||
| Медь-ЭТП | КВ004А | мин. | 99,90(1) | – | – | – | – | – | – | Аг. |
| Cu-FRHC | КВ005А | мин. | 99,90(1) | – | – | – | – | – | – | Аг. О |
| Cu-OF | КВ008А | мин. | 99,95(1) | – | – | – | – | – | – 0,03 | Аг. |
| CuAg 0,04 | КВ0011А | мин. | Весы | 0,03 | – | – | – | – | – | Аг. |
| CuAg 0,07 | КВ0012А | мин. | Баланс | 0,06 | – | – | – | – | – | Аг. О |
| CuAg 0,10 | мин. | Весы | 0,08 | – | – | – | – | – | Аг. О | |
| CuAg 0,04P | КВ0014А | мин. | Весы | 0,03 | – | – | 0,001 | – | – | Аг. |
| CuAg 0,07P | КВ0015А | мин. | Весы | 0,06 | – | – | 0,001 | – | – | Аг. Р |
| CuAg 0,10P | КВ0016А | мин. | Весы | 0,08 | – | – | 0,001 | – | – | Аг. Р |
| CuAg 0,04(ОФ) | КВ0017А | мин. | Весы | 0,03 | – | – | – | – | – | Аг. |
| CuAg 0,07(ОФ) | КВ0018А | мин. | Весы | 0,06 | – | – | – | – | – | Аг. О |
| CuAg 0,10(ОФ) | КВ0019А | мин. | Весы | 0,08 | – | – | – | – | – | Аг. О |
| Cu-PHC | КВ0020А | мин. | 99,95(1) | – | – | – | 0,001 | – | – | Аг. |


 546 g/mol
546 g/mol K). )
K). ) О
О О
О Р
Р О
О