Медь химические свойства: Ошибка 403 — доступ запрещён
alexxlab | 06.05.2023 | 0 | Разное
Химия d-элементов (медь, серебро, цинк, хром, марганец, железо) – HIMI4KA
ЕГЭ 2018 по химии › Подготовка к ЕГЭ 2018
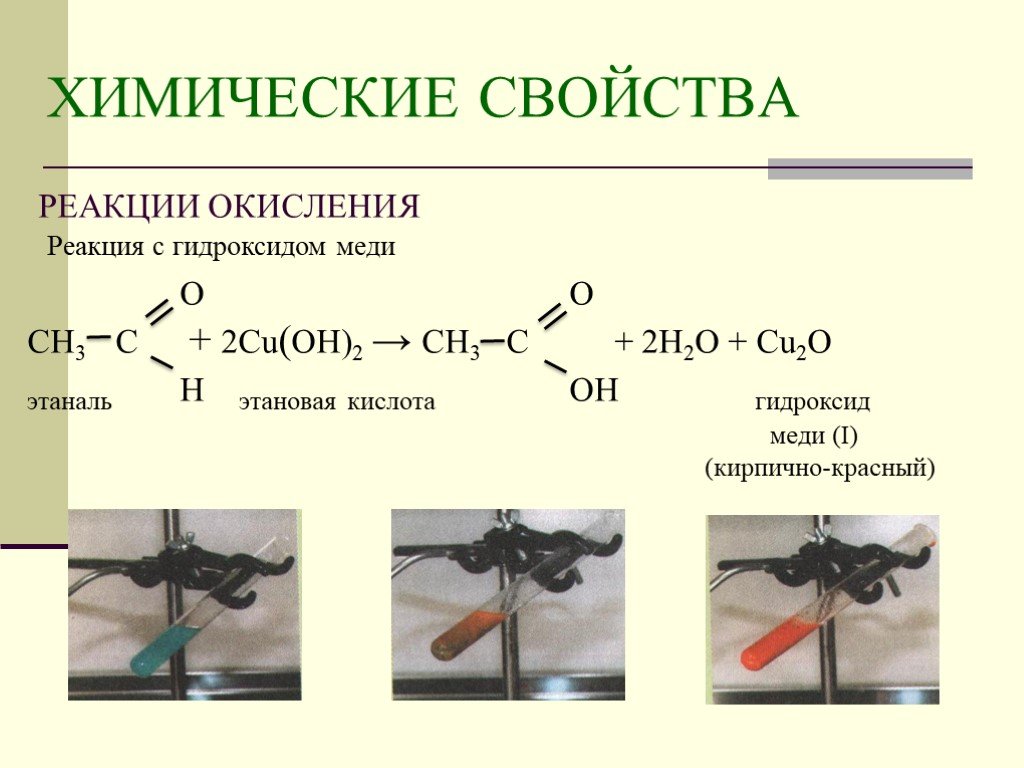
Медь находится в четвертом периоде, группе IБ. Ее электронная формула 29Cu 1s22s22p63s23p63d104s1, наиболее устойчивые степени окисления +2 и +1. Медь в промышленности получают пирометаллургическим методом, что можно описать следующим уравнением:
Полученную медь называют черновой (содержание меди 95–98%). Затем медь подвергают электролитическому рафинированию для получения меди высокой чистоты. Металл малой активности, в ряду напряжений металлов медь расположена после водорода. Ее химические свойства:
Йодид меди (II) не существует. Попытки получить его реакциями обмена приводят к иодиду меди (I) и йоду, например:
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому с разбавленной соляной кислотой она не реагирует. Однако с концентрированной соляной кислотой она взаимодействует с образованием дихлоркупрата (I) водорода:
Однако с концентрированной соляной кислотой она взаимодействует с образованием дихлоркупрата (I) водорода:
Кроме того, медь способна взаимодействовать с соляной кислотой в присутствии кислорода воздуха:
Медь образует оксиды состава Cu2O, CuO. Первый проявляет основные, а второй амфотерные с преобладанием основных свойства. Оба оксида легко восстанавливаются до меди под действием различных восстановителей:
Гидроксид меди (II) Cu(OH)2 разлагается при нагревании, проявляет амфотерные свойства с преобладанием основных:
Серебро находится в пятом периоде, группе IБ. Его электронная формула 1s22s22p63s23p63d104s24p64d105s1. В промышленности серебро получают комплексной переработкой полиметаллических руд. Химические реакции, характерные для серебра:
Оксид серебра Ag2O — термически нестабильный, типичный основный оксид. Его химические свойства:
Его химические свойства:
Цинк находится в четвертом периоде, группе IIБ. Его электронная формула 30Zn 1s22s22p63s23p63d104s2. В промышленности цинк получают либо электролизом водного раствора его сульфата, либо пирометаллургическим методом: сернистые руды подвергают обжигу с последующим восстановлением оксида цинка коксом:
Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Характерные для цинка химические реакции:
Особенностью цинка являются его реакции с серной и азотной кислотами различной концентрации. При этом в зависимости от концентрации кислот образуются различные продукты реакции:
Оксид и гидроксид цинка являются амфотерными. Их характерные реакции:
Хром расположен в четвертом периоде, группе VIБ. Его электронная формула 24Cr 1s22s22p63s23p63d54s1. Металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. В промышленности чистый хром получают восстановлением оксида хрома методом алюминотермии:
Металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. В промышленности чистый хром получают восстановлением оксида хрома методом алюминотермии:
Его характерные химические реакции:
Хром образует ряд оксидов: CrO — основный оксид, Cr2O3 — амфотерный оксид, CrO3 — кислотный оксид, следовательно, рост степени окисления сопровождается усилением кислотных свойств. Все оксиды хрома вступают в окислительно-восстановительные реакции.
Ниже приведены характерные для этих соединений химические реакции:
Гидроксид хрома (III) проявляет амфотерные свойства, вступает в окислительно-восстановительные реакции:
Марганец расположен в четвертом периоде, группе VIIБ, Периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p63s23p63d54s2. Характерные степени окисления марганца +2, +4, +6 и +7. В чистом виде марганец получают термическим восстановлением оксидов или галогенидов водородом, натрием, магнием, алюминием, углеродом или кремнием (метод кремнийтермии):
В чистом виде марганец получают термическим восстановлением оксидов или галогенидов водородом, натрием, магнием, алюминием, углеродом или кремнием (метод кремнийтермии):
Особо чистый марганец получают электролизом водного раствора сульфата марганца (II).
Химические свойства марганца:
Марганец образует пять оксидов: MnO, Mn2O3, MnO2, MnO3, Mn2O7. MnO проявляет основные свойства. Mn2O3 при взаимодействии с разбавленными растворами кислот диспропорционирует, а при нагревании с концентрированными растворами кислот выделяет кислород:
MnO2 не взаимодействует ни со щелочами, ни с разбавленными растворами кислот. С концентрированными кислотами при нагревании реагирует так же, как и Mn2O3:
Mn2O7 — единственный среди оксидов марганца, который является жидкостью при нормальных условиях. Кислотный оксид. Разлагается уже при температуре 55 °С, при ударе может взорваться.
Разлагается уже при температуре 55 °С, при ударе может взорваться.
Железо находится в четвертом периоде, группе VIIIБ. Его электронная формула 26Fe 1s22s22p63s23p63d64s2. Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6. Они являются сильными окислителями. Химически чистое железо получают разложением его пентакарбонила:
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах. Упрощенно этот процесс можно описать уравнением:
Характерные для железа химические реакции:
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции:
Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут также, как и у входящих индивидуально в его состав оксидов:
Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительно-восстановительные реакции:
Йодид железа (III) не существует. Попытки получить его обменными реакциями приводят к йодиду железа (II) и йоду:
Попытки получить его обменными реакциями приводят к йодиду железа (II) и йоду:
Введение в органическую химию →
← Водород
Оксид меди(II)
- Реактивы
Оксид меди(II)
ГОСТ 16539-71
CuO
Оксид меди(II) (окись меди) CuO — оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета.
Оксид меди получается нагреванием металлической меди в присутствии кислорода (на воздухе) при температуре ниже 1100. Другой способ получения – нагреванием гидроксида, нитрата или карбоната меди (II). В промышленности используется взаимодействием сульфата меди с гидроксидом натрия или калия при 80-90 С или с водным раствором аммиака и разложением получившегося гидроксида натрия примерно при 200С. В зависимости от содержания примесей на оксид меди цена может меняться довольно существенно, за подробностями обращайтесь по телефонам, указанным на сайте.
В зависимости от содержания примесей на оксид меди цена может меняться довольно существенно, за подробностями обращайтесь по телефонам, указанным на сайте.
Кристаллическая решётка оксида меди характеризуется следующими параметрами: моноклинная сингония, пространственная группа C2h, параметры ячейки a = 0.46837(5) нм, b = 0.34226(5) нм, c = 0.51288(6) нм, α = 90°, β = 99,54(1)°, γ = 90°. Атом меди окружён четырьмя атомами кислорода и имеет искажённую плоскую конфигурацию.
Химические свойства
Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
При сплавлении CuO со щелочами образуются купраты:
При нагревании до 1100 °C разлагается на медь и кислород.
Оксиду меди(II) соответствует гидроксид меди(II) Cu(OH)2, который является очень слабым основанием.
-
- (тетрагидроксокупрат(II) натрия).
Оксид меди(II) восстанавливается до металлической меди аммиаком, монооксидом углерода, водородом, углем:
Применение:
CuO применяют при производстве стекла и эмалей для придания им зелёной и синей окраски. Кроме того, оксид меди применяют в производстве медно-рубинового стекла.
Оксиды меди активно используются в гальванотехники для приготовления электролитов. Является сильным окислителем и разлагается при температуре 400 С и выше. Катализатор ряда процессов. Имеет перспективное использование как высокотемпературный сверхпроводник.
Оксид меди используется для производства эмалей, керамики, глазурей и стекол, которым она придает синие и зеленые оттенки, оксид меди используют для производства медно-рубинового стекла.
В лабораториях применяют для обнаружения восстановительных свойств веществ. Вещество восстанавливает оксид до металлической меди, при этом чёрный цвет оксида меди переходит в розовую окраску меди.
- Назад
- Вперед
Атомный номер, физические, химические свойства, использование и часто задаваемые вопросы
Перейти к содержимому
Что такое медь?
Медь – атомный номер: Медь – это химический элемент с символом Cu и атомным номером 29. Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Медь встречается в природе в виде различных минералов, но чаще всего добывается в виде сульфида меди. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных сплавов.
- Атомный номер меди 29. Это означает, что в ядре меди 29 протонов. Медь — мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. В природе встречается в различных минералах, но чаще всего добывается в виде сульфида меди. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных сплавов.
- Медь — это химический элемент с символом Cu и атомным номером 29. Это мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Медь встречается в природе в виде минералов сульфида меди и оксида меди, но чаще всего добывается из медных руд, обнаруженных в медных месторождениях.
Зарегистрируйтесь, чтобы получить бесплатный пробный тест и учебные материалы
+91
Подтвердите OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
Свойства меди
- Медь — красноватый металл, который очень хорошо проводит электричество.

- Он пластичен, что означает, что его можно растянуть в тонкую проволоку, и податлив, что означает, что из него можно сбить тонкие листы.
- Медь также является хорошим проводником тепла, что означает, что ее можно использовать для эффективной передачи тепла.
Использование меди
- Медь — это универсальный металл с широким спектром применения.
- Применяется в строительстве, электромонтаже, транспорте, производстве и других отраслях промышленности.
- Медь — мягкий, ковкий металл красновато-оранжевого цвета. В природе встречается в виде сульфидов меди и карбонатов меди. Медь — один из немногих металлов, встречающихся в природе в чистом виде.
- Медь использовалась людьми на протяжении многих тысяч лет. Он использовался для изготовления монет, украшений и других декоративных предметов. Медь также использовалась для изготовления кухонной утвари, сельскохозяйственных инструментов и других орудий.
- Медь также является отличным проводником электричества и используется для электропроводки и других электрических применений.

Соединения меди
- Медь может образовывать соединения в различных степенях окисления, включая медь (Cu1+), медь (Cu2+) и медь (Cu3+). Эти соединения можно разделить на две основные категории: купраты и цианид меди.
- Купраты представляют собой ионные соединения, содержащие медь в медно- или медносодержащем состоянии. Соединения меди обычно растворимы в воде, а соединения меди обычно нерастворимы. Цианиды меди также являются ионными соединениями, но они содержат медь в медном состоянии. Эти соединения также обычно растворимы в воде.
- Купраты и цианид меди могут образовываться в результате реакции меди с окислителем. Например, при реакции меди с газообразным кислородом образуется цианид меди:
Cu (т) + O 2 (г) → Cu 2 O (т) + ½ O 2 (г)
Cu 2 O (т) + 2 H+ (водн.) → Cu(H 2 O) 2 2+ (водн.)
Cu(H 2 O) 2 2+ (водн.) → Cu(OH) 2 (водн.) + 2 H+ (водн.)
Cu (OH) 2 (водн.) → CuO (т) + 2 H 2 O (ж)
Наличие меди
- Медь является обычным элементом, который можно найти в горных породах и почве.
 Он также содержится в воде и воздухе.
Он также содержится в воде и воздухе. - Медь добывается из земли и используется для изготовления различных продуктов.
Сопутствующее содержимое
Свойства и информация о медном элементе
МедьСвойства и информация о медном элементе
Медь является двадцать девятым элементом в периодической таблице. Элементы расположены в периодической таблице на основе атомного номера. Атомный номер – это количество протонов в ядре атома. Медь имеет атомный номер 29 . Он расположен в 11-й группе и 4-м периоде периодической таблицы элементов. Обозначается Cu . Название происходит от его старого английского имени «Coper».
Медь – один из тех элементов, который используется человечеством с доисторических времен. Наиболее широко медь использовалась в виде бронзы, которая представляет собой сплав меди и олова. Бронза использовалась для изготовления монет и инструментов. Медь была добыта в северном Ираке, возраст которой составляет десять тысяч лет.
Купер встречается в природе в чистом виде, а также в сочетании с другими элементами. Медь встречается во многих рудах, но самым большим источником являются халькопирит и борнит.
Физические свойства
- Медь имеет красновато-золотой или красновато-оранжевый металлический блеск, но свежая поверхность меди имеет розовато-оранжевый цвет.
- Атомная масса меди 63,546
- Температура плавления меди 1083°C
- Температура кипения меди 2595°С
- Плотность меди составляет 8900 в единицах СИ при 20°C
- Медь — чрезвычайно пластичный металл. Его очень легко вытянуть в проволоку.
- Cooper — превосходный проводник тепла и электричества.
- Известно 29 изотопов меди, среди которых только два стабильны; медь-63 и медь-65. Наиболее распространенным изотопом является медь-63, составляющая до 69% всей доступной меди.
Химические свойства
- Купер образует пассивирующий слой своего оксида на поверхности под воздействием воздуха.

- Медь не реагирует с водой.
- Старые медные конструкции, такие как статуя свободы и крыши старых зданий, со временем покрылись зеленым слоем карбоната меди.
- Медные предметы тускнеют при контакте с серой, потому что медь вступает в реакцию с образованием сульфида.
Методы производства
- Добыча меди: Сульфидные руды меди используются для извлечения меди в коммерческих целях. Они содержат около 0,6% меди. Биовыщелачивание впервые применяют для концентрирования количества меди в рудах от 0,6% до 10-15%. Концентрированная руда затем нагревается с кремнеземом для удаления железа, сульфиды железа превращаются в оксиды железа, а затем они вступают в реакцию с кремнеземом с образованием кремнеземистых шлаков, которые затем отделяются и всплывают на поверхность. Образовавшийся штейн в основном состоит из сульфидов меди. Его обжигают, чтобы преобразовать все сульфиды в оксиды. Оксид меди затем превращается в медь и кислород при нагревании.

- Переработка: лом меди высокой чистоты просто плавится в печах, а затем превращается в заготовки и слитки. Медный лом низкой чистоты очищают гальванопокрытием в ванне с серной кислотой.
Применение в химической и смежных отраслях
Антимикробные сплавы: сенсорные поверхности из медного сплава обладают естественными свойствами, уничтожающими бактерии. Говорят, что более 350 медных сплавов избавились от 99,9% бактерий всего за два часа после их очистки. Таким образом, многие продукты производятся, потому что, если это нравится; поручни, дверные ручки, раковины, туалетная фурнитура, клавиатура компьютера и т. д.
Применимость в других отраслях
- Проволока: Около 60% промышленно производимой меди используется для изготовления электрических проводов и кабелей. Они используются в силовых передачах, связи, электронике, почти везде в электротехнике.
- Архитектура: Поскольку медь довольно прочная, она с древних времен использовалась для изготовления крыш, водосточных желобов, куполов, водостоков и т.