Медь и сера температура плавления: Attention Required! | Cloudflare
alexxlab | 14.07.2020 | 0 | Разное
температура плавления, физические свойства, сплавы
Твердый металл медь люди научились плавить еще до нашей эры. Название элемента по таблице Менделеева – Cuprum, в честь первого массового расположения производства меди. Именно на острове Кипр в третьем тысячелетии до н.э. начали добывать руду. Металл зарекомендовал себя как хорошее оружие и красивый, блестящий материал для изготовления посуды и других приборов.

 Процесс плавления меди
Процесс плавления медиИзготовление предметов требовало множество усилий при отсутствии технологий. В первых шагах развития цивилизации и поиску новых металлов, люди научились добывать и плавить медную руду. Получение руды происходило в малахитовом, а не в сульфидном состоянии. Получение на выходе свободной меди, из которой можно изготавливать детали, требовало обжига. Для исключения окислов, металл с древесным углем размещалась в сосуд из глины. Поджигался металл в специально подготовленной яме, образующийся в процессе угарный газ способствовал процессу появления свободной меди.
Для точных расчетов использовался график плавления меди. В то время производился точный расчет времени и примерная температура, при которой происходит плавка меди.
Медь и ее сплавы
Металл имеет красновато-желтый оттенок благодаря оксидной пленке, которая образуется при первом взаимодействии металла с кислородом. Пленка придает благородный вид и обладает антикоррозийными свойствами.
Сейчас доступно несколько способов добычи металла. Распространёнными являются медный колчедан и блеск, которые встречаются в виде сульфидных руд. Каждая из технологий получения меди требует особого подхода и следования процессу.
Добыча в природных условиях происходит в виде поиска медных сланцев и самородков. Объемные месторождения в виде осадочных пород находятся в Чили, а медные песчаники и сланцы расположились на территории Казахстана. Использование металла обусловлено невысокой температурой плавления. Практически все металлы плавятся путем разрушения кристаллической решетки.
Основной порядок плавления и свойства:
- на температурных порогах от 20 до 100° материал полностью сохраняет свои свойства и внешний вид, верхний оксидный слой остается на месте;
- кристаллическая решетка распадается на отметке 1082°, физическое состояние становится жидким, а цвет белым. Уровень температуры задерживается на некоторое время, а затем продолжает рост;
- температура кипения меди начинается на отметке 2595°, выделяется углерод, происходит характерное бурление;
- при отключении источника тепла происходит снижение температуры, происходит переход в твердую стадию.
Плавка меди возможна в домашних условиях, при соблюдении определенных условий. Этапы и сложность задачи зависят от выбора оборудования.
Физические свойства
Основные характеристики металла:
- в чистом виде плотность металла составляет 8.93 г/см3;
- хорошая электропроводность с показателем 55,5S, при температуре около 20⁰;
- теплопередача 390 Дж/кг;
- кипение происходит на отметке 2600°, после чего начинает выделение углерода;
- удельное электрическое сопротивление в среднем температурном диапазоне – 1.78×10 Ом/м.
Основными направлениями эксплуатации меди является электротехнические цели. Высокая теплоотдача и пластичность дают возможность применения к различным задачам. Сплавы меди с никелем, латунью, бронзой, делаю более приемлемой себестоимость и улучшают характеристики.
Химический состав меди
В природе она не однородна по своему составу, так как содержит ряд кристаллических элементов, образующих с ней устойчивую структуру, так называемые растворы, которые можно подразделить на три группы:
- Твердые растворы. Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением.
- Примеси, растворяющиеся в медной решетке. К ним относятся висмут, свинец и другие компоненты. Не ухудшают качества электропроводимости, но затрудняют обработку под давлением.
- Примеси, формирующие хрупкие химические соединения. Сюда входят кислород и сера, а также другие элементы. Они ухудшают прочностные качества, в том числе снижают электропроводность.
Масса меди с примесями гораздо больше, чем в чистом виде. Ко всему прочему, элементы примесей существенно влияют на конечные характеристики уже готового продукта. Поэтому их суммарный состав, в том числе количественный, по отдельности должен регулироваться еще на этапе производства. Рассмотрим более подробно влияние каждого элемента на характеристики конечных медных изделий.
- Кислород. Один из самых нежелательных элементов для любого материала, не только медного. С его ростом ухудшается такое качество, как пластичность и устойчивость к коррозионным процессам. Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается.
- Никель. Образует устойчивый раствор и существенно снижает показатели проводимости.
- Сера или селен. Оба компонента одинаково влияют на качество готовой продукции. Высокая концентрация таких вхождений снижает пластичные свойства медных изделий. Содержание таких компонентов не должно превышать 0,001% от общей массы.
- Висмут. Негативно влияет на механические и технологические характеристики готовой продукции. Максимальное содержание не должно превышать 0,001%.
- Мышьяк. Он не меняет свойств, но образует устойчивый раствор, является своего рода защитником от пагубного влияния других элементов, как кислород, сурьма или висмут.


Химический состав меди
- Марганец. Он способен полностью раствориться в меди практически при комнатной температуре. Влияет на проводимость тока.
- Сурьма. Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди.
- Олово. Образует устойчивый раствор с медью и повышает ее свойства по проведению тепла.
- Цинк. Его содержание всегда минимально, поэтому такого пагубного влияния он не оказывает.
Фосфор. Основной раскислитель меди, максимальное содержание которого при температуре 714°С составляет 1,7%.
Латунь


Латунь
Сплав на основе меди с добавлением цинка называется латунь. В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
- простые, состоящие из двух компонентов – меди и цинка. Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
- многокомпонентные латуни – содержат множество других металлов в зависимости от назначения к использованию. Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Физические свойства латуни относительно высокие, коррозийная стойкость на среднем уровне. Большинство сплавов не критично к пониженным температурам, возможно эксплуатировать металл в различных условиях.
Технологии получения латуни взаимодействует с процессами медной и цинковой промышленности, обработке вторичного сырья. Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.


Плавка латуни
Применение материала в различных отраслях, повышает на него спрос с каждым годом. Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Бронза


Бронза
Цветной металл для изготовки изделий разных типов начали использовать с древних времен. Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Промышленностью выпускается различное количество разновидностей бронзы. Опытный мастер способен по цвету металла определить его предназначение. Однако не каждому под силу определить точную марку бронзы, для этого используется маркировка. Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Состав металла зависит от предназначения к использованию. Основным показателем является наличие бериллия. Повышенная концентрация элемента в сплаве, подвергнутая процедуре закаливания, может соперничать с высокопрочными сталями. Наличие в составе олова отнимает у металла гибкость и пластичность.
Производство бронзовых сплавов изменилось с древних времен фактически внедрением современного оборудования. Технология с использованием в качестве флюса в виде древесного угля используется до сих пор. Последовательность получения бронзы:
- печь разогревается для требуемой температуры, после этого в нее устанавливается тигель;
- после плавки металл может окислится, во избежание этого добавляют флюс в качестве древесного угля;
- кислотным катализатором служит фосфорная медь, добавление происходит после полного прогрева сплава.


Плавка бронзы
Старинные изделия из бронзы подвержены естественным процессам – патинирование. Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Температура плавления меди
Плавится материал при определенной температуре, которая зависит от наличия и количества сплавов в составе.
В большинстве случаев, процесс происходит при температуре от 1085°. Наличие олова в сплаве дает разбег, плавление меди может начаться при 950°. Цинк в составе также понижает нижнюю границу до 900°.
Для точных расчетов времени понадобится график плавления меди. На обычном листке бумаги используется график, где по горизонтали отмечается время, а по вертикали градусы. График должен указывать, на каких моментах поддерживается температура при нагреве для полного процесса кристаллизации.


Печь для плавки меди
Плавление меди в домашних условиях
В домашних условиях медные сплавы возможно плавить несколькими способами. При использовании любого из методов, понадобятся сопутствующие материалы:
- тигель – посуда, изготовленная из закаленной меди или другого огнеупорного металла;
- древесный уголь, понадобится в роли флюса;
- крюк металлический;
- форма будущего изделия.
Наиболее легким вариантом для плавления является муфельная печь. В емкость опускаются куски материала. После установки температуры плавления процесс можно наблюдать через специальное окошко. Установленная дверца позволяет удалять образованную в процессе оксидную пленку, для этого понадобиться заранее подготовленный металлический крюк.
Вторым способом плавления в домашних условиях является использование горелки или резака. Пропан – кислородное пламя отлично подойдет для работ с цинком или оловом. Куски материалов для будущего сплава помещаются в тигель, и нагреваются мастером произвольными движениями. Максимальная температура плавления меди может быть достигнута при взаимодействии с пламенем синего цвета.
Плавка меди в домашних условиях подразумевает работу с повышенными температурами. Приоритетом служит соблюдение техники безопасности. Перед любой процедурой следует одеть защитные огнеупорный перчатки и плотную, полностью закрывающую тело одежду.
Значение плотности меди
Плотность — это отношение массы к объему. Выражается она в килограммах на кубический метр всего объема. В виду неоднородности состава, значение плотности может меняться в зависимости процентного содержания примесей. Поскольку существуют разные марки медных прокатов с разным содержанием компонентов, то и значение плотности у них будет разное. Плотность меди можно найти в специализированных технических таблицах, которая равна 8,93х103 кг/м3. Это справочная величина. В этих же таблицах показан удельный вес меди, который равен 8,93 г/см3. Таким совпадением значений плотности и его весовых показателей характеризуются не все металлы.


Основные показатели меди
Не секрет, что от плотности напрямую зависит конечная масса изготовленного изделия. Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
Расчет удельного веса
В настоящее время учеными разработано огромное количество способов, помогающих найти характеристики удельного веса меди, которые позволяют даже без обращения к специализированным таблицам вычислять этот немаловажный показатель. Зная его, можно с легкостью подобрать необходимые материалы, благодаря которым в конечном итоге можно получить нужную деталь с требуемыми параметрам. Это делается еще на стадии подготовки, когда планируется создать необходимую деталь из меди или ее содержащих сплавов.
Как уже говорилось выше, удельный вес меди можно подсмотреть в специализированном справочнике, но если под рукой такого нет, то его можно рассчитать по следующей формуле: вес делим на объем и получаем необходимую нам величину. Общими словами такое соотношение можно выразить как общее весовое значение к общему значению объема всего изделия.
Не стоит путать его с понятием плотности, так как он характеризует металл по-другому, хоть и имеет одинаковые значения показателей.
Рассмотрим, как можно вычислить удельный вес, если известна масса и объем медного изделия.
Например, имеем чистый медный лист толщиной 5 мм, шириной 2 м и длиной 1 м. Для начала посчитаем его объем: 5 мм * 1000 мм (1 м = 1000 мм) * 2000 мм, что составляет 10 000 000 мм3 или 10 000 см3. Для удобства расчетов будем считать, что масса листа составляет 89 кг 300 грамм или 89300 грамм. Делим рассчитанный результат на объем и получаем 8,93 г/см3. Зная этот показатель, мы всегда с легкостью можем вычислить весовое содержание в меди того или иного сплава. Это удобно, например, для обработки металла.
Единицы измерения удельного веса
В разных системах измерения используются разные единицы для обозначения удельного веса меди:
- В системе измерения СГС или сантиметр-грамм-секунда используется дин/см3.
- В Международной СИ используются единицы н/м3.
- В системе МКСС или метр-килограмм-секунда-свеча применяется кг/м3.
Первые два показателя равны между собой, а третий при конвертации равен 0,102 кг/м3.
Расчет веса с использованием значений удельного веса
Не будем уходить далеко и воспользуемся примером, описанным выше. Вычислим общее содержание меди в 25 листах. Поменяем условие и будем считать, что листы изготовлены из медного сплава. Таким образом, берем удельный вес меди из таблицы и он равен 8.93 г/см3. Толщина листа 5 мм, площадь (1000 мм * 2000 мм) составляет 2 000 000 мм, соответственно объем будет равняться 10 000 000 мм3 или 10 000 см3. Теперь умножаем удельный вес на объем и получаем 89 кг и 300 гр. Мы вычислили общий объем меди, который содержится в этих листах без учета веса самих примесей, то есть общее весовое значение может быть больше.
Теперь умножаем рассчитанный результат на 25 листов и получаем 2 235 кг. Такие расчеты уместно использовать при обработке медных деталей, так как позволяют узнать, сколько меди всего содержится в изначальных объектах. Аналогичным образом можно рассчитать медные прутки. Площадь сечения провода умножается на его длину, где получим объем прутка, а далее по аналогии с вышеописанным примером.
Как определяется плотность
Плотность меди, как и плотность любого другого вещества, является справочной величиной. Она выражается соотношением массы к объему. Самостоятельно вычислить этот показатель весьма сложно, так как без специальных приборов состав проверить невозможно.


Пример расчета плотности меди
Выражается показатель в килограммах на кубический метр или в граммах на кубический сантиметр. Показатель плотности более полезен для производителей, которые на основе имеющихся данных могут скомпоновать ту или иную деталь с требуемыми свойствами и характеристиками.
Области использования меди
Благодаря физико-механическим свойствам, она широко используется для различных отраслей промышленности. Наиболее часто ее можно встретить в электротехнической области в качестве составляющей части электрического провода. Не меньшей популярностью она пользуется также в производстве систем отопления и охлаждения, электроники и системах теплового обмена.
В строительной отрасли она используется, прежде всего, для создания разного рода конструкций, которые получаются гораздо меньше по массе, чем из любых других аналогичным материалов. Часто ее используют для кровли, так как такие изделия обладают легкостью и пластичностью. Такой материал легко обрабатывается и позволяет менять геометрии профиля, что очень удобно.
Как уже говорилось выше, основное свое применение она находит в изготовлении электрических и иных токопроводящих кабелей, где она используется для изготовления жил проводов и кабелей. Обладая хорошей электропроводностью, она дает достаточное сопротивление электронам тока.
Широко используются также сплавы меди, например, сплав меди и золота повышает прочность последнего в разы.
На стенках медных прокатов никогда не образуются соляные отложения. Такое качество полезно для транспортировки жидкостей и паров.
На основе оксидов меди получают сверхпроводники, а в чистом виде она идет на изготовление гальванических источников питания.


Схема гальванического источника питания
Она входит в состав бронзы, которая обладает стойкостью к агрессивным средам, как морская вода. Поэтому часто ее используют в навигации. Также бронзовые продукты можно увидеть на фасадах домов, как элемент декора, так как такой сплав обрабатывается легко, так как очень пластичен.
| Азот Температура плавления азота | -210.1 (°C) |
| Актиний Температура плавления актиния | 1050 (°C) |
| Алюминий Температура плавления алюминия | 660.32 (°C) |
| Америций Температура плавления америция | 1176 (°C) |
| Аргон Температура плавления аргона | -189.3 (°C) |
| Астатин Температура плавления астатина | 302 (°C) |
| Барий Температура плавления бария | 727 (°C) |
| Бериллий Температура плавления бериллия | 1287 (°C) |
| Берклий Температура плавления берклия | 1050 (°C) |
| Бор Температура плавления бора | 2075 (°C) |
| Бром Температура плавления брома | -7.3 (°C) |
| Ванадий Температура плавления ванадия | 1910 (°C) |
| Висмут Температура плавления висмута | 271.3 (°C) |
| Водород Температура плавления водорода | -259.14 (°C) |
| Вольфрам Температура плавления вольфрама | 3422 (°C) |
| Гадолиний Температура плавления гадолиния | 1313 (°C) |
| Галлий Температура плавления галлия | 29.76 (°C) |
| Гафний Температура плавления гафния | 2233 (°C) |
| Германий Температура плавления германия | 938.3 (°C) |
| Гольмий Температура плавления гольмия | 1474 (°C) |
| Диспрозий Температура плавления диспрозия | 1412 (°C) |
| Европий Температура плавления европия | 822 (°C) |
| Железо Температура плавления железа | 1538 (°C) |
| Золото Температура плавления золота | 1064.18 (°C) |
| Индий Температура плавления индия | 156.6 (°C) |
| Иридий Температура плавления иридия | 2466 (°C) |
| Иттербий Температура плавления иттербия | 819 (°C) |
| Иттрий Температура плавления иттрия | 1526 (°C) |
| Йод Температура плавления йода | 113.7 (°C) |
| Кадмий Температура плавления кадмия | 321.07 (°C) |
| Калий Температура плавления калия | 63.38 (°C) |
| Калифорний Температура плавления калифорния | 900 (°C) |
| Кальций Температура плавления кальция | 842 (°C) |
| Кислород Температура плавления кислорода | -218.3 (°C) |
| Кобальт Температура плавления кобальта | 1495 (°C) |
| Кремний Температура плавления кремния | 1414 (°C) |
| Криптон Температура плавления криптона | -157.36 (°C) |
| Ксенон Температура плавления ксенона | -111.8 (°C) |
| Кюрий Температура плавления кюрия | 1345 (°C) |
| Лантан Температура плавления лантана | 920 (°C) |
| Литий Температура плавления лития | 180.54 (°C) |
| Лоуренсий Температура плавления лоуренсия | 1627 (°C) |
| Лютеций Температура плавления лютеция | 1663 (°C) |
| Магний Температура плавления магния | 650 (°C) |
| Марганец Температура плавления марганца | 1246 (°C) |
| Медь Температура плавления меди | 1084.62 (°C) |
| Менделевий Температура плавления менделевия | 827 (°C) |
| Молибден Температура плавления молибдена | 2623 (°C) |
| Мышьяк Температура плавления мышьяка | 817 (°C) |
| Натрий Температура плавления натрия | 97.72 (°C) |
| Неодим Температура плавления неодима | 1021 (°C) |
| Неон Температура плавления неона | -248.59 (°C) |
| Нептуний Температура плавления нептуния | 644 (°C) |
| Никель Температура плавления никеля | 1455 (°C) |
| Ниобий Температура плавления ниобия | 2477 (°C) |
| Нобелий Температура плавления нобелия | 827 (°C) |
| Олово Температура плавления олова | 231.93 (°C) |
| Осмий Температура плавления осмия | 3033 (°C) |
| Палладий Температура плавления палладия | 1554.9 (°C) |
| Платина Температура плавления платины | 1768.3 (°C) |
| Плутоний Температура плавления плутония | 640 (°C) |
| Полоний Температура плавления полония | 254 (°C) |
| Празеодим Температура плавления празеодима | 931 (°C) |
| Прометий Температура плавления прометия | 1.1×103 (°C) |
| Протактиний Температура плавления протактиния | 1572 (°C) |
| Радий Температура плавления радия | 700 (°C) |
| Радон Температура плавления радона | -71 (°C) |
| Рений Температура плавления рения | 3186 (°C) |
| Родий Температура плавления родия | 1964 (°C) |
| Ртуть Температура плавления ртути | -38.83 (°C) |
| Рубидий Температура плавления рубидия | 39.31 (°C) |
| Рутений Температура плавления рутения | 2334 (°C) |
| Самарий Температура плавления самария | 1072 (°C) |
| Свинец Температура плавления свинца | 327.46 (°C) |
| Селен Температура плавления селена | 221 (°C) |
| Сера Температура плавления серы | 115.21 (°C) |
| Серебро Температура плавления серебра | 961.78 (°C) |
| Скандий Температура плавления скандия | 1541 (°C) |
| Стронций Температура плавления стронция | 777 (°C) |
| Сурьма Температура плавления сурьмы | 630.63 (°C) |
| Таллий Температура плавления таллия | 304 (°C) |
| Тантал Температура плавления тантала | 3017 (°C) |
| Теллур Температура плавления теллура | 449.51 (°C) |
| Тербий Температура плавления тербия | 1356 (°C) |
| Технеций Температура плавления технеция | 2157 (°C) |
| Титан Температура плавления титана | 1668 (°C) |
| Торий Температура плавления тория | 1750 (°C) |
| Тулий Температура плавления тулия | 1545 (°C) |
| Углерод Температура плавления углерода | 3550 (°C) |
| Уран Температура плавления урана | 1135 (°C) |
| Фермий Температура плавления фермия | 1527 (°C) |
| Фосфор Температура плавления фосфора | 44.2 (°C) |
| Фтор Температура плавления фтора | -219.6 (°C) |
| Хлор Температура плавления хлора | -101.5 (°C) |
| Хром Температура плавления хрома | 1907 (°C) |
| Цезий Температура плавления цезия | 28.44 (°C) |
| Церий Температура плавления церия | 798 (°C) |
| Цинк Температура плавления цинка | 419.53 (°C) |
| Цирконий Температура плавления циркония | 1855 (°C) |
| Энштейний Температура плавления эйнштейния | 860 (°C) |
| Эрбий Температура плавления эрбия | 1497 (°C) |
Температура и условия плавления меди в домашних условиях. Описание элемента.
С давних времен медные предметы пользовались спросом у людей. В настоящее время материал ценится за декоративные свойства. Однако осуществить плавление меди в домашних условиях непросто. Умельцы пробуют разные методы, чтобы провести эту процедуру самостоятельно.

Медь можно расплавить в домашних условиях
Описание элемента и распространение его в природе
Медь на Кипре добывали и плавили еще в середине третьего тысячелетия до нашей эры. Поэтому свое название элемент носит в честь упомянутого острова. Добыча и производство элемента подействовали на историю развития острова и его экономическое положение.
В периодической системе Менделеева медь получила 29 атомный номер. Элемент расположен в одиннадцатой группе четвертого периода. Элемент имеет золотисто-розовый цвет и принадлежит к пластичным переходным металлам. В природе встречается продукт в виде сульфидных руд, по распространению в литосфере металл занимает 23-е место. Медный блеск и колчедан являются самыми распространенными видами элемента.
В природных условиях элемент медь находят в руде и в виде самородков. Самые лучшие месторождения находятся на территории государства Чили. Медные месторождения встречаются там в осадочных породах. Медные песчаники и сланцы находятся в Казахстане и Читинской области России.

Медные сланцы в Казахстане
Медь наделена высокой электро и теплопроводностью. Ее удельная теплоемкость при температуре +20ºС равна 390 Дж/кг. Температура кипения металла – 2595ºС.
В момент плавления металл меняет свое агрегатное состояние, т. е. из кристаллической твердой фазы он переходит в жидкую форму. Меди присуще своя температура плавления, она имеет определенную зависимость от находящихся в металле примесей. Плавка меди чаще всего проходит при температуре +1083ºС. Если в медном сплаве присутствует олово, то процесс плавления способен произойти при +950–1140ºС. В составе с цинком теплота плавления меди равна от +900 до +1050ºС.
Процесс плавки проходит следующим образом: в начале нагрева рушится кристаллическая решетка металла, постепенно температура увеличивается, но в определенный период она удерживается в некотором значении. Именно в этот промежуток медь начинает плавиться. После окончания выплавки температура вновь повышается. Далее, металл постепенно охлаждается и принимает твердую форму.
Кипение металла очень похоже на бурление жидкости при активном нагреве. В это время выделяется газ. На поверхности расплавленного продукта появляются пузырьки. При максимальном нагреве из жидкого металла выделяется углерод, он формируется в результате окисления элемента.
Плавление меди в домашних условиях
В давние времена человек обнаружил медную руду, а,возможно, и самородки. В определенный момент принял решение: переплавлю металл на костре. Из металлических отливок люди готовили разнообразные бытовые принадлежности, украшения и даже оружие. Для тех кто хотел бы, но не знает, как расплавить медь самостоятельно, необходимо запастись следующими предметами, основные из которых:
- Тигель — посуда из огнеупорного материала для меди.
- Специальное нагревательное устройство (муфельная печь), автоген или горн.
- Древесный уголь.
- Стальной удобный крюк.
- Пылесос бытовой.
- Специальная форма для плавки металла.

Чтобы плавить металлы в домашних условиях, необходима, в первую очередь, муфельная печь
При производстве металла следует соблюдать технику безопасности. Плавка должна производиться поэтапно. В первую очередь переплавляемый продукт должен поместиться в тигель, далее этот сосуд определяется в муфельную печь. Агрегат нагревается до нужной температуры, следить за этим мероприятием необходимо в специальное смотровое окошко. В момент образования окисной пленки на металле, его следует убрать с помощью стального крюка. Окисел необходимо аккуратно отодвинуть в сторону.
В том случае, если расплав меди планируется производить при помощи автогена, то важно понимать, что при данном процессе происходит естественный доступ воздуха. Нагревая тигель, нужно следить за тем, чтобы пламя охватывало его полностью. При помощи паяльной лампы можно качественно нагреть легкоплавкую бронзу или желтую медь.
Если дома нет вышеупомянутых предметов для плавки металла, то стоит попробовать осуществить это при помощи горна, его ставят на древесный уголь. Для усиления температурного режима используется пылесос. Важно помнить, пылесос можно использовать только в режиме выдувания и его наконечник должен быть выполнен из металла. Желательно иметь наконечник у поддува утонченный, чтобы струя воздуха хорошо попадала на тигель. Эта процедура поможет увеличить температуру до 1400ºС.
В настоящее время в промышленных условиях чистую медь не используют, в ее состав может входить сурьма, железо, никель и т. д. На качество продукта влияет количество примесей, их не должно быть более 1%. Основными показателями для медных изделий являются электропроводность и теплопроводность.
Проводя плавку меди в домашних условиях, стоит понимать, данное мероприятие требует определенных знаний и затрат. Невозможно расплавить медь без тигеля. Горн соорудить можно самостоятельно из огнеупорного кирпича. Для того чтобы медь не сильно окислялась, ее присыпают древесным углем. В остальном процесс плавки не отличается от кокильного литья или заливки в земляные формы.
химический элемент, температура плавления и кипения, пошаговая инструкция
Медь входит в семёрку самых древних металлов, с которыми люди познакомились на самом начальном этапе своего существования. Период с 4 по 3 тысячелетие до нашей эры так и называется медный век в истории развития человечества. Древние люди изготавливали из неё предметы быта, орудия труда и боевое оружие. Это стало возможным благодаря относительно невысокой температуре плавления меди.

Купрум: характеристика элемента
 Научное наименование меди Cuprum (Купрум) происходит от названия греческого острова Кипр, где медь начали добывать ещё в середине третьего тысячелетия до нашей эры. В периодической таблице Менделеева химический элемент медь имеет 29 атомный (порядковый) номер, находится в 11 группе четвёртого периода. Принадлежит к пластичным переходным металлам. В чистом виде имеет характерный золотисто-розовый цвет. Чистую медь легко окислить, поэтому в естественных условиях она всегда образует на своей поверхности тонкую оксидную плёнку, которая придаёт ей красноватый оттенок.
Научное наименование меди Cuprum (Купрум) происходит от названия греческого острова Кипр, где медь начали добывать ещё в середине третьего тысячелетия до нашей эры. В периодической таблице Менделеева химический элемент медь имеет 29 атомный (порядковый) номер, находится в 11 группе четвёртого периода. Принадлежит к пластичным переходным металлам. В чистом виде имеет характерный золотисто-розовый цвет. Чистую медь легко окислить, поэтому в естественных условиях она всегда образует на своей поверхности тонкую оксидную плёнку, которая придаёт ей красноватый оттенок.
Физические свойства
Это второй металл после серебра по уровню электропроводности, что делает её крайне востребованной в современной электронике. Второе ценное качество — высокая теплопроводность, это позволяет её широко применять во всевозможных теплообменниках и в холодильной аппаратуре.
- Температура плавления 1083 градуса.
- Температура кипения 2567 градусов.
- Удельное сопротивление при 20 градусах составляет 1,68·10 -3 Ом·м.
- Плотность 8,92 г/см.
Нахождение в природе
В природе встречается в самородном виде и в виде соединений.
 Самые крупные месторождения самородной меди находятся в США в районе озера Верхнего. Именно в этом районе был найден самый крупный медный самородок весом 3560 килограмм. А также много самородной меди встречается в рудных горах Германии.
Самые крупные месторождения самородной меди находятся в США в районе озера Верхнего. Именно в этом районе был найден самый крупный медный самородок весом 3560 килограмм. А также много самородной меди встречается в рудных горах Германии.
В России и на постсоветском пространстве добыча меди происходит путём извлечения из сульфидной руды. Её можно добыть, извлекая из медного колчедана или халькопирита CuFeS2. Наиболее известны такие месторождения, как Удокан в Забайкалье и Джезказган в Казахстане.
Сульфиты меди чаще всего образуются в так называемых среднетемпературных гидротермальных жилах. Могут образовываться и в осадочных породах в виде медистых песчаников и сланцев.
Как правило, медная руда всегда добывается открытым способом. Процентное содержание чистой меди в руде составляет от 0,2 до 1,0 процента в зависимости от месторождения.
Медные сплавы
Являются самыми первыми металлическими сплавами, получение которых человечество освоило ещё на самой заре своего развития. При какой температуре плавится медь, зависит от того, в каком сплаве она находится. В настоящее время наиболее известны и востребованы такие сплавы, как:
- Латунь. Сплав с добавление цинка, содержание которого может доходить до 40%. Цинк повышает пластичность и прочность металла. Температура, при которой латунь плавится, составляет 880 — 950 градусов.
- Бронза. Сплав с оловом, с добавлением некоторых других компонентов, таких как кремний, бериллий, свинец. Получать бронзу из меди человек научился ещё в самом начале бронзового века. Бронза не утратила своей актуальности даже с наступлением века железа, например, ещё в начале 20 века стволы пушек изготавливали из так называемой орудийной бронзы. Температура, при которой бронза начинает плавиться, составляет 930 — 1140 градусов.
 Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.
Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.- Дюраль, или дюралюминий. Основную массу сплава составляет алюминий 93%, на медь приходится 5%, оставшиеся 2% занимают марганец, железо и магний. Название происходит от названия немецкого города Дюрен, где в 1906 году был впервые получен этот высокопрочный сплав алюминия. Одной из его особенностей является тот факт, что его прочностные характеристики с течением времени имеют тенденцию к увеличению. Поэтому он не теряет своей прочности после нескольких лет эксплуатации, как другие металлы. В настоящее время этот сплав является основой самолётостроения.
- Ювелирные сплавы. Сплавы меди с золотом. Тем самым увеличивается устойчивость драгметалла к механическим воздействиям и истиранию.
Переплавка меди дома
Этот металл обладает целым набором полезных свойств, которые делают её весьма желанным металлом в домашнем хозяйстве. А относительно невысокая температура при плавлении и изрядное количество медного лома, которое можно обнаружить на ближайшей свалке, позволяют задавать вопрос о том, как расплавить медь в домашних условиях, не как риторический, а вполне реальный и практический.
График плавления меди
Расплавление любого металла заключается в том, что под воздействием высоких температур разрушается кристаллическая решётка и металл переходит из твёрдого состояния в жидкое. Можно выделить некоторые закономерности, свойственные любому металлу в процессе расплавления:
 Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.
Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.- При достижении температуры плавления, для меди это 1083 градуса, температура внутри металла перестаёт повышаться, несмотря на то что общий нагрев и передача тепла продолжаются.
- После того как вся масса метала переходит в расплавленное состояние, температура внутри металла снова начинает резко повышаться.
В случае процесса охлаждения расплавленного металла происходит всё то же самое, но в обратной последовательности. Сначала происходит резкое снижение температуры внутри металла, затем на значении 1080 градусов падение температуры прекращается до тех пор, пока вся масса метала не перейдёт в твёрдое состояние. После этого температура снова начинает резко падать, пока не сравняется с температурой окружающего воздуха и кристаллизация не завершится окончательно.
Температура кипения
Медь начинает активно выделять углерод в виде пузырьков газа при температуре 2560 градусов. Внешне это очень напоминает кипение воды. На самом деле это процесс активного окисления меди, в результате которого металл теряет практически все свои уникальные свойства. Детали, отлитые из кипящей меди, имеют в своей структуре большое количество пор, которые будут уменьшать механическую прочность материала и ухудшать его декоративные свойства. Потому в процессе плавки необходимо внимательно следить за температурой и не допускать закипания меди.
Способы плавки
Медный лом можно переплавить в домашних условиях разными способами в зависимости от технического оснащения домашней мастерской. При этом нужно иметь в виду, что придётся нагревать медь не до её температуры плавления, а чуть выше — примерно до 1100−1200 градусов.
Для этих целей годятся следующие приспособления:
 Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса.
Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса.- Газовая горелка. Ручная газовая горелка размещается под дном ёмкости из тугоплавкого материала, в которой непосредственно будет размещаться медный лом. Этот способ предполагает наличие тесного контакта расплавляемой массы металла с воздухом, что будет способствовать усилению процесса окисления расплавляемого металла. Чтобы этому как-то противостоять, на расплавляемую массу сверху насыпают слой древесного угля.
- Паяльная лампа. Способ практически ничем не отличается от плавки с помощью газовой горелки. Но в этом случае невозможно достигнуть относительно высоких температур, поэтому он годится для переплавки сплавов меди, которые обладают меньшей температурой плавления, чем чистая медь.
- Кузнечный горн. На раскалённые древесные угли специального костра помещается тугоплавкий тигель с измельчённым металлом. Для ускорения процесса расплавления задействуют обычный бытовой пылесос, включённый в режиме выдувания. Труба пылесоса должна быть небольшого диаметра и иметь металлический наконечник, в противном случае она расплавится. Данный способ подходит для тех, кто занимается плавкой меди дома регулярно и имеет дело с большими объёмами исходного материала, который необходимо отжечь.
- Микроволновая печь. Бытовая мощная микроволновка с небольшими изменениями конструкции может легко плавить довольно большие объёмы медного лома. Для этого необходимо убрать из микроволновки вращающуюся тарелку, а вместо неё поместить соответствующих размеров тигель, который необходимо сделать из тугоплавкого материала, например, из шамотного кирпича.
Пошаговая инструкция
Процесс плавления любого металла происходит поэтапно и подчиняется определённому алгоритму, который одинаков как для промышленного производства, так и для кустарного. Для тех, кто озадачен вопросом плавки меди в домашних условиях, пошаговая инструкция будет выглядеть следующим образом:
 Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.
Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.- После полного расплавления всего объёма медного лома тигель с помощью специальных длинных щипцов извлекается из печи.
- На поверхности расплавленного металла образуется плёнка его оксида. Эту плёнку необходимо аккуратно сдвинуть в сторону к одной из стенок тигля. Для этих целей используют специальный крючок, изготовленный из тугоплавкого металла.
- После того как металл освобождён от оксидной плёнки, необходимо его очень быстро разлить в предварительно подготовленные формы.
Практические рекомендации
Температура плавления меди в домашних условиях зависит от того, в каком сплаве она содержится.
Техническая чистая медь содержится в проводах и кабелях, а также в обмотках трансформаторов, электродвигателей и генераторов. При этом нужно иметь в виду, что химически чистая медь содержится только в столовых приборах и в прочей кухонной утвари. Во всех остальных случаях в ней присутствуют те или иные вредные компоненты.
В чистом виде обладает повышенной вязкостью в расплавленном состоянии, поэтому отливать из неё изделия сложной конфигурации и небольших размеров очень сложно. Гораздо легче для этих целей использовать латунь.
В сплавах бронзы, изготовленных вначале и середине прошлого века, использовали в качестве компонентов мышьяк и сурьму. Поэтому следует избегать расплавления так называемой старинной бронзы, так как пары мышьяка могут привести к отравлению организма.
происхождение, физические свойства и температура плавления

 Добывать и плавить медь люди научились с древности. Уже в то время элемент находил широкое применение в быту и из него делали различные предметы. Сплав меди с оловом (бронзу) научились делать около трех тысяч лет назад, из него получалось хорошее оружие. Бронза сразу стала популярной, поскольку отличалась прочностью и красивым внешним видом. Из нее изготавливали украшения, посуду, орудия труда и охоты.
Добывать и плавить медь люди научились с древности. Уже в то время элемент находил широкое применение в быту и из него делали различные предметы. Сплав меди с оловом (бронзу) научились делать около трех тысяч лет назад, из него получалось хорошее оружие. Бронза сразу стала популярной, поскольку отличалась прочностью и красивым внешним видом. Из нее изготавливали украшения, посуду, орудия труда и охоты.
Благодаря невысокой температуре плавления человечеству не составило большого труда быстро освоить производство меди в домашних условиях. Как происходит процесс плавления меди, при какой температуре начинает плавиться?
Происхождение и нахождение меди в природе

 Свое название химический элемент получил от названия острова Кипр (Cuprum), там его научились добывать еще в 3 тысячелетии до н.э. В периодической системе химических элементов у меди 29 атомный номер, она расположена в 11 группе 4-го периода. Элемент является пластичным переходным металлом, имеющим золотисто-розовый цвет.
Свое название химический элемент получил от названия острова Кипр (Cuprum), там его научились добывать еще в 3 тысячелетии до н.э. В периодической системе химических элементов у меди 29 атомный номер, она расположена в 11 группе 4-го периода. Элемент является пластичным переходным металлом, имеющим золотисто-розовый цвет.
По распространению в земной коре элемент занимает среди других элементов 23 место и чаще всего встречается в виде сульфидных руд. Самыми распространенными видами являются медный колчедан и медный блеск. На сегодняшний день есть несколько способов получения меди из руды, но любая из технологий требует поэтапного подхода, чтобы достичь конечного результата.

 В самом начале развития цивилизации люди научились получать и использовать медь, а также ее сплавы. Уже в то далекое время они добывали не сульфидную, а малахитовую руду.В таком виде она не нуждалась в предварительном обжиге. Смесь руды с углями помещали в глиняный сосуд, которые опускали в небольшую яму, после чего смесь поджигали, угарный газ помогал восстановиться малахиту до состояния свободной меди.
В самом начале развития цивилизации люди научились получать и использовать медь, а также ее сплавы. Уже в то далекое время они добывали не сульфидную, а малахитовую руду.В таком виде она не нуждалась в предварительном обжиге. Смесь руды с углями помещали в глиняный сосуд, которые опускали в небольшую яму, после чего смесь поджигали, угарный газ помогал восстановиться малахиту до состояния свободной меди.
В природе медь встречается не только в руде, но и в самородном виде, самые богатые месторождения находятся на территории Чили. Сульфиды меди часто образуются в среднетемпературных геотермальных жилах. Часто медные месторождения могут быть в виде осадочных пород — сланцы и медяные песчаники, которые встречаются в Читинской области и Казахстане.
Физически свойства
Пластичный металл на открытом воздухе быстро покрывается оксидной пленкой, она и придает элементу характерный желтовато-красный оттенок, в просвете пленки могут иметь зеленовато-голубой цвет. Медь относится к тем немногим элементам, которые имеют заметную для глаза цветовую окраску. Она обладает высоким уровнем тепло- и электропроводности — это второе место после серебра.

 Плотность — 8,94*103 кг/м3
Плотность — 8,94*103 кг/м3- Удельная теплоемкость при Т=20оС — 390 Дж/кг*К
- Электрическое удельное сопротивление в температурном режиме от 20-100оС — 1,78*10-8Ом/м
- Температура кипения — 2595оС
- Удельная электропроводность при Т=20оС — 55,5-58 МСм/м.
Температура плавления меди

 Процесс плавления происходит, когда металл из твердого состояния переходит в жидкое и у каждого элемента есть своя температура плавления. Многое зависит от наличия примесей в составе металла, обычно медь плавится при температуре 1083оС. Когда к ней добавляют олово, то температура плавления снижается и составляет 930-1140оС, температура плавления здесь будет зависеть от содержания в сплаве олова. В сплаве меди с цинком температура плавления становится еще ниже — 900-1050оС.
Процесс плавления происходит, когда металл из твердого состояния переходит в жидкое и у каждого элемента есть своя температура плавления. Многое зависит от наличия примесей в составе металла, обычно медь плавится при температуре 1083оС. Когда к ней добавляют олово, то температура плавления снижается и составляет 930-1140оС, температура плавления здесь будет зависеть от содержания в сплаве олова. В сплаве меди с цинком температура плавления становится еще ниже — 900-1050оС.
В процессе нагрева любого металла происходит разрушение кристаллической решетки. По мере нагревания температура плавления становится выше, но затем она остается постоянной, после того как достигла определенного температурного предела. В такой момент и происходит процесс плавления металла, он полностью расплавляется и после этого температура снова начинает повышаться.
Когда начинает происходить охлаждение металла, то температура начинает снижаться и в какой-то момент она остается на прежнем уровне до момента полного затвердения металла. Затем металл затвердевает полностью и температура снова снижается. Это можно увидеть на фазовой диаграмме, где отображен весь температурный процесс с начала момента плавления и до затвердения металла.
Разогретая медь при нагревании начинает переходить в состояние кипения при температуре 2560оС. Процесс кипения металла очень напоминает процесс кипения жидких веществ, когда начинает выделяться газ и на поверхности появляются пузырьки. В моменты кипения металла при максимально высоких температурах начинает выделяться углерод, который образуется в результате окисления.
Плавление меди в домашних условиях
Низкая температура плавления позволила людям в древности расплавлять металл прямо на костре и затем использовать готовый металл в быту, чтобы сделать оружие, украшения, посуду, орудия труда. Для плавления меди в домашних условиях понадобятся следующие предметы:

 Тигель и специальные щипцы для него.
Тигель и специальные щипцы для него.- Древесный уголь.
- Муфельная печь.
- Горн.
- Бытовой пылесос.
- Форма для плавления.
- Стальной крюк.
Весь процесс происходит поэтапно, для начала металл нужно положить в тигель, после чего разместить в муфельную печь. Установить нужную температуру и наблюдать за процессом через стеклянное окошко. В процессе плавления в емкости с металлом появится окисная пленка, ее необходимо убрать, открыв окошко и стальным крюком отодвинуть в сторону.
Если нет муфельной печи, то медь можно расплавить с помощью автогена, плавление будет происходить при нормальном доступе воздуха. Используя паяльную лампу можно расплавить желтую медь (латунь) и легкоплавкие виды бронзы. Следить за тем, чтобы пламя охватило весь тигель.

 Если в домашних условиях нет ничего из перечисленных средств, тогда можно воспользоваться горном, установив его на слой древесного угля. Чтобы усилить температуру можно использовать бытовой пылесос, включив режим выдувания, но только если шланг имеет металлический наконечник. Хорошо, если наконечник будет иметь зауженный конец, чтобы струя воздуха была более тонкой.
Если в домашних условиях нет ничего из перечисленных средств, тогда можно воспользоваться горном, установив его на слой древесного угля. Чтобы усилить температуру можно использовать бытовой пылесос, включив режим выдувания, но только если шланг имеет металлический наконечник. Хорошо, если наконечник будет иметь зауженный конец, чтобы струя воздуха была более тонкой.
В современных промышленных условиях медь в чистом виде не применятся, ее состав содержит в себе много различных примесей — железа, никеля, мышьяка и сурьмы, а также других элементов. Качество готового изделия определяется наличием процентного содержания примесей в сплаве, но не более 1%. Важными показателями являются тепло- и электропроводность металла. Медь широко используется во многих отраслях промышленности благодаря своей пластичности, гибкости и низкой температуре плавления.
Оцените статью: Поделитесь с друзьями!Сера, Вступление | |
| Символ | S |
| Латинское название | Sulfur |
| Тип вещества | простой химический элемент |
Основные параметры серы по таблице Менделеева | |
| Атомный номер Z | 16 |
| Атомная масса | 32.065 |
| Группа | 16 |
| Период | 3 |
| Принадлежность к группе | неметаллы |
Термодинамические свойства серы | |
| Агрегатное состояние при нормальных условиях | твердое тело |
| Точка плавления по Кельвину | 388.36 (Кельвин) |
| Точка плавления по Цельсию | 115.21 (°C) |
| Точка кипения по Кельвину | 717.87 (Кельвин) |
| Точка кипения по Цельсию | 444.72 (°C) |
Электрические свойства серы | |
| Тип электрической проводимости | диэлектрик |
Магнитные свойства серы | |
| Тип магнитной проницаемости | диамагнетик |
Свойства атома серы | |
| Конфигурация электронного облака | 1s2 | 2s22p63s23p4 |
| Радиус атома | 88 · 10 − 12 (Метр) |
| Число протонов p | 16 |
| Число нейтронов n | 16 |
| Число электронов e | 16 |
| Массовое число A | 32 |
| Атомная структура серы | 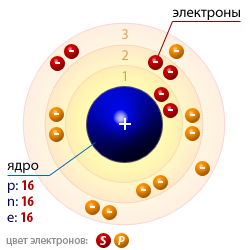 |
Химические свойства серы | |
| Валентность | 6 |
Распространенность серы | |
| Вселенная состоит из серы на | 0.05% |
| Солнце состоит из серы на | 0.04% |
| Мировой океан состоит из серы на | 0.093% |
| Человеческое тело состоит из серы на | 0.2% |
Вселенная | |
| Вселенная состоит из серы на | 0.05% |
Сера — урок. Химия, 8–9 класс.
Химический элемент
Сера — химический элемент № \(16\). Она расположена в VIА группе третьем периоде Периодической системы.
S16+16)2e)8e)6e
На внешнем слое атома серы содержатся шесть валентных электронов. До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления \(–2\). При взаимодействии с более электроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная (\(+4\) или \(+6\)).
В земной коре сера встречается в самородном виде или в виде минералов и горных пород: (пирит — FeS2, цинковая обманка — ZnS, свинцовый блеск — PbS, гипс — CaSO4⋅2h3O, глауберова соль — Na2SO4⋅10h3O).

Самородная сера

Свинцовый блеск
Сера относится к макроэлементам живых организмов. Она содержится в белках. Особенно много серы в белках волос, рогов, шерсти. Входит она также в состав некоторых витаминов и гормонов.
Простое вещество
Сера образует несколько аллотропных модификаций. Обычно мы имеем дело с кристаллической серой, которая состоит из восьмиатомных циклических молекул.

Молекулы образуют кристаллы разного строения, и поэтому существуют аллотропные видоизменения: ромбическая и моноклинная сера. Обе модификации представляют собой жёлтые легкоплавкие вещества. Температуры плавления их несколько различаются (\(+112,8\) °С и \(+119,3\) °С).

При нагревании сера плавится, превращается в лёгкую жидкость, а затем начинает темнеть и становится вязкой. Образуется пластическая сера, состоящая из длинных линейных молекул.
В воде сера не растворяется и ею не смачивается. Поэтому порошок серы не тонет в воде, несмотря на более высокую плотность (\(2,07\) г/см³). Такое явление называется флотацией.
Подожжённая сера реагирует с кислородом, и образуется сернистый газ. Сера в этой реакции — восстановитель.
S0+O20=tS+4O2−2.
Окислительные свойства сера проявляет в реакциях с металлами и водородом.
С активными металлами и ртутью реагирует при комнатной температуре:
Hg0+S0=Hg+2S−2.
При нагревании сера вступает в реакцию с большинством металлов — железом, алюминием, цинком и другими, кроме золота и платины.
2Al0+3S0=tAl+32S−23.
В реакциях с металлами образуются сульфиды.
При повышенной температуре сера реагирует с водородом. Образуется сероводород:
h30+S0=th3+1S−2.
Применение серы
- Используется в химической промышленности для производства серной кислоты;
- находит применение в сельском хозяйстве для обеззараживания помещений;
- входит в состав некоторых мазей;
- используется в производстве спичек и бумаги;
- с её помощью каучук превращают в резину;
- входит в состав взрывчатых веществ.
Точки плавления и кипения, плотности и растворимость неорганических соединений в воде
- Точка кипения – температура, при которой жидкость превращается в газ
- Точка плавления – температура, при которой твердое вещество превращается в жидкость
См. Стандартное состояние и энтальпию образования, Свободную энергию Гиббса образования, энтропию и теплоемкость для термодинамических данных для тех же соединений.
Полная таблица с плотностью, плотностью жидкости при температуре плавления и растворимостью в воде – поверните экран!
| Вещество | Формула | Точка плавления ° C | Точка кипения ° C | Плотность при 25 ° C г / см 3 9000 Плотность жидкости | при температуре плавления г / см 3 Растворимость в воде | при 25 ° C 1) г / 100 г H 2 O Комментарии (*) | | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Алюминий | Алюминий | 660.3 | 2519 | 2,7 | 2,77 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бромид алюминия | AlBr 3 | 97,5 | 255 | 3,2 | 2,647 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлорид алюминия | AlCl 3 | 192,6 | переходник 180 | 2,48 | 1,302 | 45 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фторид алюминия | AlF 3 | tp 2250 * | переходник 1276 | 3.1 | 0,5 | @ 220 МПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гидроксид алюминия | Al (OH) 3 | 2,42 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Иодид алюминия | AlI 3 | 188,28 | 382 | 3,98 | 3,223 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксид алюминия | Al 2 O 3 | 2053 | 2977 | 3.99 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фосфат алюминия | AlPO 4 | > 1460 | 2,56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Аммоний | NH 3 | -77,65 | -33,33 | 0,7329 * | жидкость при -77,7 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлорид аммония | NH 4 Cl | tp 520,1 | sub 338 | 1.519 | 39,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Нитрат аммония | NH 4 NO 3 | 169,7 | d 200-260 | 1,72 | 213 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сульфат аммония | (NH 4 ) 2 SO 4 | d 280 | 1,77 | 76,4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бор | B | 2077 | 40000 | 2.34 | 2,08 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фторид бора | BF 3 | -126,8 | -99,9 | 0,002772 * | газ при 25 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сульфид бора | B 2 S 3 | 563 | ~ 1,7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Барий | Ba | 727 | ~ 1845 | 3,62 | 3.338 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бромид бария | BaBr 2 | 857 | 1835 | 4,781 | 3,991 | 100 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Карбонат бария | BaCO 3 | 1555 | 0,0014 20 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлорид бария | BaCl 2 | 961 | 1560 | 3.9 | 3,174 | 37 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фторид бария | BaF 2 | 1368 | 2260 | 4,893 | 4,14 | 0,161 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гидрид бария | BaH 2 | 1200 | 4,16 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Йодид бария | BaI 2 | 711 | 5,15 | 4.26 | 221 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксид бария | BaO | 1973 | 5,72 | 1,5 20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сульфат бария | BaSO 4 | 1580 | 4,49 | 0,00031 20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бериллий | Be | 1287 | 2468 | 1,85 | 1,69 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бромид бериллия | BeBr 2 | 508 | 3.465 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлорид бериллия | BeCl 2 | 415 | 482 | 1,9 | 1,54 | 71,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фторид бериллия | BeF 2 | 12 552 2 | 12 552 | 2,1 | 1,96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гидроксид бериллия | Be (OH) 2 | d ~ 200 | 1.92 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Иодид бериллия | BeI 2 | 480 | 590 | 4.32 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксид бериллия | BeO | 2578 | 3,01 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сульфат бериллия | BeSO 4 | 1127 | 2,5 | 41,3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Висмут | Bi | 271.4 | 1564 | 9,79 | 10,05 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксид висмута | Bi 2 O 3 | 825 | 1890 | 8,9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бром | Br 2 | -7,2 | 58,8 | 3,1028 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлорид брома | BrCl | -66 | d 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фторид брома | BrF | ~ – 33 | d ~ 20 | 0.004043 * | газ при 25 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Трифторид брома | BrF 3 | 8,77 | 125,8 | 2,803 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кадмий | Cd | 321,167 | 8,69 | 7,996 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бромид кадмия | CdBr 2 | 568 | 863 | 5,19 | 4.075 | 115 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлорид кадмия | CdCl 2 | 568 | 964 | 4,08 | 3,392 | 120 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Карбонат кадмия | CdCO 3 | d 50074 | 5,026 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фторид кадмия | CdF 2 | 1075 | 1750 | 6,33 | 4.36 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сульфид кадмия | CdS | ~ 1480 | 4,826 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сульфат кадмия | CdSO 4 | 1000 | 4,69 | 76,7 | Кальций | Ca | 842 | 1484 | 1,54 | 1,378 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бромид кальция | CaBr 2 | 742 | 1815 | 3.38 | 3,111 | 156 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Карбонат кальция | CaCO 3 (арагонит) | 450 * | 2,93 | 0,00066 20 | преобразование в кальцит | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кальций карбонат | CaCO 3 (кальцит) | 800 | 2,71 | 0,00066 20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлорид кальция | CaCl 2 | 775 | 1935 | 2.15 | 2,085 | 81,3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Цианамид кальция | CaCN 2 | ~ 1340 | sub | 2,29 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фторид кальция | CaF 2
Сера – Информация об элементе, свойства и использованиеРасшифровка: Химия в своем элементе: сера(Promo) Вы слушаете Химию в ее элементе, представленную вам журналом Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит Привет, на этой неделе вонючие отложения, скунсы и запах ада.Все они начинаются с буквы S, как и элемент этой недели. Вот Стив Милон. Стив Майлон «Как пахло?» Это был единственный вопрос, который мне нужно было задать своему коллеге-геологу об отложениях, которые она пыталась понять. Запах осадка многое говорит о химическом составе, лежащем в основе. Густые черные бескислородные отложения могут сопровождаться гнилостным запахом, характерным только для восстановленной серы. Может быть, поэтому сера имеет такую плохую репутацию.Мой сын полгода не ел яйца, когда почувствовал запах своего первого тухлого яйца. В Библии кажется, что всякий раз, когда что-то случается или вот-вот должно произойти, горящая сера изображена на картинке: Например, В Бытие мы слышим: «Господь пролил дождем горящую серу на Содом и Гоморру» И в Откровении мы читаем, что грешники найдут свое место в огненном озере из горящей серы ». Странно то, что в обоих случаях мы не должны ожидать появления чего-либо пахнущего.Когда сера горит на воздухе, она обычно образует диоксид серы или триоксид серы, последний из которых не имеет запаха [исправлено из аудиофайла подкаста, в котором говорится, что диоксид серы не имеет запаха]. Эти соединения могут далее окисляться и выпадать в виде серной или сернистой кислоты. Это механизм кислотных дождей, которые опустошили леса на северо-востоке США, поскольку богатые серой угли сжигаются для выработки электроэнергии в штатах Среднего Запада и уносятся на восток преобладающими ветрами, когда серная кислота выпадает, вызывая всевозможные экологические проблемы. Кроме того, горящий уголь и туман создают смог во многих промышленных городах, вызывая респираторные заболевания у местных жителей. Здесь также виноваты диоксид серы и серная кислота. Но опять же, с этой формой серы не связано никакого запаха. Так что, если говорят, что ад или дьявол «пахнет серой», может быть, это не так уж и плохо. Но уменьшите серу, отдав ей пару электронов, и ее запах будет безошибочным. Требование восстановления серы до сульфида явно потеряно при переводе. Ад, пахнущий сероводородом или любым количеством сероорганических соединений, совсем не будет хорошим местом. Органические сульфидные соединения, известные как тиолы или меркаптаны, настолько плохо пахнут, что их обычно добавляют в природный газ без запаха в очень небольших количествах, чтобы служить «сигнализатором запаха» в случае утечки в трубопроводе природного газа. Скунсы используют неприятный запах бутил-селеномеркаптана как средство защиты от врагов. И лично для меня наихудшая химия происходит тогда, когда восстановленная сера придает неприятный привкус бутылкам с вином или пивом.-приведены, чтобы испортить приятную ночь в городе или послеобеденное время в местном пабе. Итак, откуда берется “запах ада” в бескислородных отложениях. Интересно, что некоторые бактерии эволюционировали, чтобы использовать окисленную серу, сульфат, в качестве акцептора электронов во время дыхания. Подобно тому, как люди превращают элементарный кислород в воду, эти бактерии восстанавливают сульфат до сероводорода – они явно не обращают внимания на запах. Запах – не единственный интересный химический состав, который сопровождает восстановленную серу.Глубокий черный цвет, связанный с бескислородными отложениями, является результатом низкой растворимости большинства сульфидов металлов. Восстановление сульфата до сульфида обычно сопровождает осаждение пирита (сульфида железа), киновари (сульфида ртути), галенита (сульфида свинца) и многих других минералов. Эти сульфиды металлов стали важным промышленным источником многих из этих важных металлов. Промышленность – это то место, где вы почти наверняка найдете серу или, что более важно, серную кислоту, которая используется в различных процессах, от производства удобрений до переработки нефти.На самом деле серная кислота считается самым производимым химическим веществом в промышленно развитом мире. Представьте себе, что элемент с такой адской репутацией стал одним из самых важных. А некоторые даже предполагают, что сера может спасти планету. Биогенное соединение диметилсульфид (ДМС) образуется в результате расщепления диметилсульфоноприопоната, осмотического регулирующего соединения, вырабатываемого планктоном в океане. Летучесть и низкая растворимость ДМС приводит к тому, что ежегодно в атмосферу выбрасывается около 20 тг (10 ^ 12) серы.DMS окисляется до SO2 и, наконец, до частиц серной кислоты, которые могут действовать как ядра конденсации облаков, образуя облака, которые имеют общий охлаждающий эффект для планеты. Представьте себе более высокие температуры, сопровождаемые большей биологической активностью, приводящей к большему выбросу DMS в атмосферу. Образовавшееся облако может охладить нагреющуюся планету. Это похоже на то, как планктон раскрывает зонтик, частично состоящий из серы. Из символа проклятия в спасителя … что за поворот !!. Крис Смит Стив Майлон нюхает вонючую историю Sulphur. К счастью, элемент на следующей неделе намного менее пахучий. Джон Эмсли История его открытия началась, когда Рэлей обнаружил, что азот, извлеченный из воздуха, имеет более высокую плотность, чем азот, полученный при разложении аммиака. Разница была небольшой, но реальной. Рамзи написал Рэли, предлагая поискать более тяжелый газ в азоте, полученном из воздуха, в то время как Рэли должен искать более легкий газ из аммиака.Рамзи удалил весь азот из своего образца, многократно пропуская его через нагретый магний. Ему оставили один процент, который не вступил в реакцию, и обнаружил, что он плотнее азота. В его атомном спектре появились новые красные и зеленые линии, подтверждающие, что это новый элемент. Крис Смит И этот новый элемент был аргоном, прозванным ленивым элементом, потому что первоначально ученые думали, что он ни с чем не будет реагировать. Теперь мы знаем, что это неправда, и Джон Эмсли будет здесь, чтобы раскрыть секреты аргона в программе «Химия в ее элементе» на следующей неделе. Надеюсь, вы присоединитесь к нам.Я Крис Смит, спасибо за внимание и до свидания. (промо) (конец промо) .Фактов о сереСера – это 16 -й элемент периодической таблицы Менделеева. Эти факты о сере содержат химические и физические данные, а также общую информацию и историю.  Основные факты по сере Имя: Сера Атомный номер: 16 Символ элемента: S Группа: 16 Период 3 Блок: p Семейство элементов: Неметалл Атомная масса: [32.059; 32.076] Электронная конфигурация: [Ne] 3s 2 3p 4 (сокращенно) или 1s 2 2s 2 2p 6 3s 2 3p 4 (полное) Discovery Древние времена Люди знали о сере с древних времен. Это один из немногих элементов, которые можно найти в исходной форме.Сера была известна под множеством названий: суфра (арабское слово для обозначения желтого), сера, шульбари (санскрит означает «враг меди») и сера (латинское). Он был признан элементом французским химиком Антуаном Лавуазье в 1789 году. Происхождение названия: Сера была взята из латинского написания серы. Суффикс -ium был опущен, потому что сера не была металлом. Написание: Значение f в сере было официально принято ИЮПАК в 1990 году. Сера использовалась британскими химиками с 19 века.В 1992 году Королевское общество официально закрепило британское написание серой. Изотопы: Природная сера состоит из четырех стабильных изотопов: 32 S, 33 S, 34 S и 36 S. Существует 21 радиоактивный изотоп в диапазоне от 26 S до 49 S. 32 S 33 S 34 S 36 S 35 S  Физические данные Плотность: 2,07 г / см 3 Точка плавления: 388,36 K (115,21 ° C, 239,38 ° F) Кипение Точка: 717,8 K (444,6 ° C, 832,3 ° F) Критическая точка: 1314 K при 20,7 МПа Состояние при 20 ° C: Твердое вещество Теплота плавления: 1.727 кДж / моль Теплота испарения: 45 кДж / моль Молярная теплоемкость: 22,75 Дж / моль · К  Атомные данные Атомный радиус: 1,80 Å Ковалентный радиус: 1,05 Å Ван-дер-Ваальсовый радиус: 1,80 Å Сродство к электрону: 200,41 кДж / моль 2.581 st Энергия ионизации: 999,589 кДж / моль 2 nd Энергия ионизации: 2251,763 кДж / моль 3 rd Энергия ионизации 3356,72 кДж / моль th Энергия ионизации: 4556,231 кДж / моль 5 th Энергия ионизации: 7004,305 кДж / моль 6 th Энергия ионизации: 8495,824 кДж / моль 7 Энергия ионизации 7 : 27107.363 кДж / моль8 th Энергия ионизации: 31719,56 кДж / моль Степени окисления: +6, +4, +2 (общий), +5, +3, +1, -1, -2 (редко)  Интересные факты о сере
Узнайте больше об элементах периодической таблицы Менделеева. .XPS Интерпретация меди Первичная область XPS: Cu2p
Экспериментальная информация
Интерпретация спектров XPS
Пик Cu2p3 / 2 в оксиде Cu (I) НЕ смещен, но шире по сравнению с металлической Cu.
Символ: Cu Точка плавления: 1358 К Медь играет важную роль в истории на протяжении по крайней мере 10 000 лет. Она красноватого цвета и обладает высокой электрической и теплопроводностью. Медь используется во многих домашних хозяйствах, включая провода, дверные ручки и другие приспособления, сантехнику, кровлю и кухонные принадлежности.Большинство американских монет в значительной степени состоят из этого элемента, в то время как Статуя Свободы содержит 179 200 фунтов меди. Из него также делают несколько музыкальных инструментов, особенно духовых инструментов и тарелок. Медь необходима всем высшим растениям и животным и транспортируется в основном с кровотоком. Вернуться к таблице элементов . | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро.
Мельхиор. Кроме меди, содержит в своём составе 5−30% никеля. Никель увеличивает прочность медного сплава и повышает его электрическое сопротивление. Кроме того, сильно повышается коррозионная стойкость. Температура плавления — 1170 градусов. По своим внешним характеристикам мельхиор очень похож на серебро, раньше его называли белой медью. Но он обладает более высокой механической прочностью, чем обычное серебро. Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние.
Во время нагревания температура внутри металла повышается, но кристаллическая решётка не подвергается разрушению. Металл сохраняет своё твёрдое состояние. Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса.
Муфельная печь. Наиболее рациональное решение проблемы расплавления меди, так как такая печь позволяет регулировать температуру во время процесса плавки, что очень удобно. Подобные лабораторные печи оснащены специальным окном из жаропрочного стекла, что позволяет постоянно осуществлять визуальный контроль всего процесса. Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.
Необходимо взять тугоплавкий тигель. Металл в измельчённом состоянии насыпается в тигель. После этого тигель помещается в предварительно прогретую муфельную печь. С помощью специального окошка наблюдают за процессом расплавления.