Медь простое вещество: Глава 1. Медь – простое вещество
alexxlab | 15.12.1984 | 0 | Разное
Глава 1. Медь – простое вещество
§1. Электронное строение. Степени окисления.
Медь — элемент первой группы побочной подгруппы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum).
Электронное строение атома: 1s22s22p63s23p63d104s1. Подобно атомам щелочных металлов, атомы меди имеют в наружном слое один электрон, но в отличие от атомов щелочных металлов, предпоследний электронный слой содержит восемнадцать электронов. Медь – предпоследний член первой декады d-элементов. Поэтому у меди наблюдается так называемый «провал электрона» – конфигурация наружного электронного слоя 3d104s1 устойчивее, чем 3d94s2.
Элемент | Радиус атома, нм | Э0→Э +, эВ | Радиус иона Э+, нм | Стандартный электродный потенциал процесса Э++e–→Э0, эВ |
K | 0. | 4.18 | 0.149 | -2.925 |
Cu | 0.128 | 7.73 | 0.098 | +0.52 |
Сравнивая медь с металлом главной подгруппы того же периода – калием, можно видеть, что радиус атома и иона меди почти в два раза меньше соответственно атома и иона калия. Это обуславливает значительно бóльшую плотность, высокие температуры плавления, так как меньшие по размеру атомы располагаются в кристаллической решетке более плотно, вследствие чего силы притяжения между ними велики.
Малый
радиус объясняет так же более высокие
значения энергии ионизации меди, чем
калия. Это приводит к большим различиям
в химических свойствах этих металлов
одного периода и одной группы. Медь –
малоактивный металл, в ряду напряжений
стоит после водорода, в отличие от калия
– одного из самых активных металлов.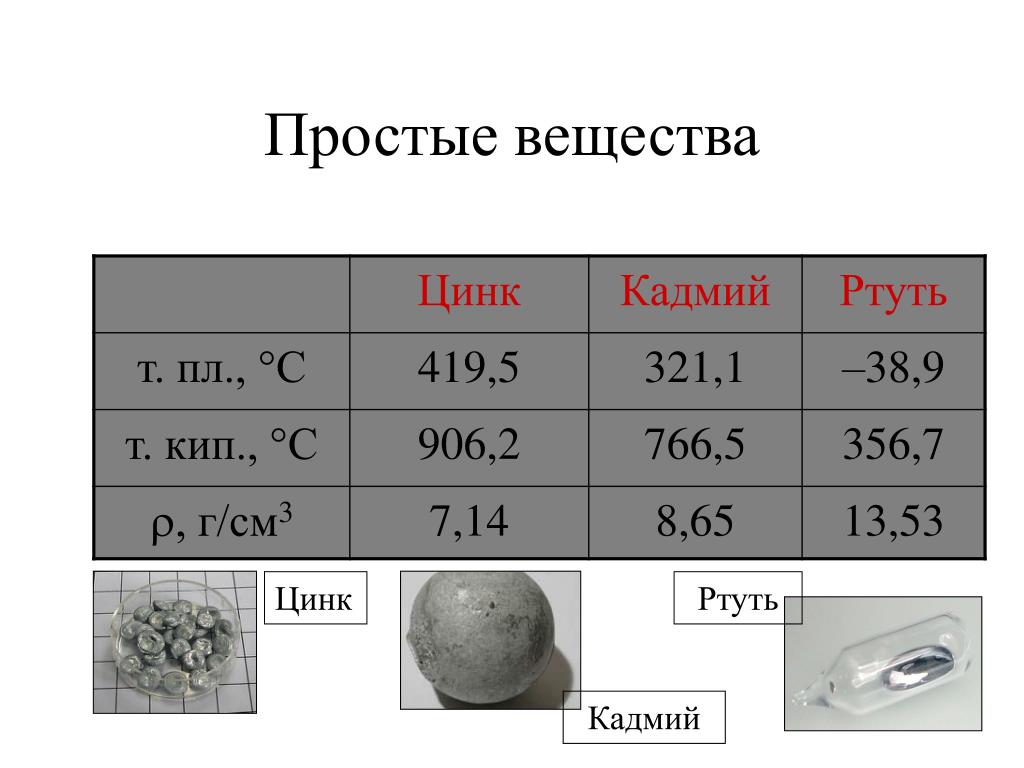 В
то же время, восмнедцатиэлектронный
наружный слой, устойчивый у других
элементов, здесь еще не вполне
стабилизируется, и способен к частичной
потере электронов. Так, медь, наряду с
однозарядными катионами образует и
двухзарядные, которые для нее наиболее
характерны. Так же известны соединения
со степенью окисления +3 в составе анионов
или в комплексных соединений.
В
то же время, восмнедцатиэлектронный
наружный слой, устойчивый у других
элементов, здесь еще не вполне
стабилизируется, и способен к частичной
потере электронов. Так, медь, наряду с
однозарядными катионами образует и
двухзарядные, которые для нее наиболее
характерны. Так же известны соединения
со степенью окисления +3 в составе анионов
или в комплексных соединений.
§2. Нахождение в природе. Месторождения.
Металлы подгруппы меди обладают небольшой химической активностью, поэтому они находятся частично в виде химических соединений, а частично в свободном виде, особенно золото.
Медь в далекие геологические эпохи, очевидно, находилась только в виде сернистых соединений – халькопирита (или) и халькозина. Объясняется это тем, что медь обладает довольно большим химическим сродством к сере, в настоящее время сульфиды – наиболее распространенные минералы меди. При высоких температурах, например, в районах вулканической деятельности, под действием избытка кислорода происходило превращение сульфидов меди в окислы, например:
При температуре ниже 10000C происходило образование окиси меди, которая в небольших количествах встречается в природе:
.
Самородная (металлическая) медь, очевидно, возникла в природе при сильном нагревании частично окисленных сернистых руд. Можно представить, что после землетрясений, грандиозных извержений окисленные минералы меди были погребены под толстым слоем горных пород и нагревались за счет земного тепла. При этом происходило взаимодействие окислов с сульфидами:
.
Подобные процессы протекают при выплавке меди на металлургических заводах. Такие природные “металлургические заводы” выплавляют громадные количества меди: самый крупный из найденных самородков весил 420 т. По-видимому, в меньших масштабах взаимодействие окислов некоторых металлов с сульфидами идет и в настоящее время, например, в районе некоторых Курильских островов.
Некоторые другие минералы меди получились из окисных руд. Например, под действием влаги и двуокиси углерода происходила гидратация окиси меди и образование основных карбонатов:
.
В лаборатории мы эти процессы не наблюдаем, так как они идут медленно. В “лаборатории” природы сроки в несколько тысяч лет совершенно незначительны. В дальнейшем под влиянием давления вышележащих горных пород и некоторого нагревания происходило уплотнение основного карбоната меди, и он превратился в изумительный по красоте минерал – малахит. Особенно красив полированный малахит. Он бывает окрашен от светло-зеленого до темно-зеленого цвета. Переходы оттенков причудливы и создают фантастический рисунок на поверхности камня.
Переход нерастворимых сульфидных соединений меди в раствор мог осуществляться за счет взаимодействия растворов сульфата железа (III):
.
Растворы сульфата железа, как указано выше, получаются в природе при действии воды, насыщенной кислородом, на пирит. Эти процессы медленно идут в природе и в настоящее время. [1, с.8-10]
Медь
входит более чем в 198 минералов, из
которых для промышленности важны лишь
17. Для производства меди наибольшее
значение имеют халькопирит (он же –
медный колчедан) CuFeS2,
халькозин (медный блеск) Cu2S,
ковеллин CuS,
борнит (пестрая медная руда) Cu5FeS4.
Иногда встречается и самородная медь.
Распространение меди в земной коре
–4,7*103%
по массе (1015 – 1016 тонн).
[3]
Для производства меди наибольшее
значение имеют халькопирит (он же –
медный колчедан) CuFeS2,
халькозин (медный блеск) Cu2S,
ковеллин CuS,
борнит (пестрая медная руда) Cu5FeS4.
Иногда встречается и самородная медь.
Распространение меди в земной коре
–4,7*103%
по массе (1015 – 1016 тонн).
[3]
Соединения меди распределены в земной коре неравномерно, что объясняется различием в геологических условиях, сложившихся в различных местах земного шара. Богатейшие месторождения меди имеются в Конго (Катангский пояс). Материалы, собранные археологами о древнейших месторождениях датируются тысячелетиями до новой эры. Древнейшие выработки меди на территории нашей страны найдены в Закавказье, на побережье Балхаша, в многочисленных пунктах Сибири.
Планомерные
поиски месторождений меди начинаются
при Иване III, Иване Грозном и особенно
при Петре I. При Иване Грозном в Олонецкий
уезд был послан новгородский гость
(купец) Семен Гаврилов “для сыску медные
руды”, где она и была найдена. В 1652 г.
Казанский воевода сообщил царю: “Медные
руды… сыскано много и заводы к медному
делу заводим”. [2, с.26] Из документов
следует, что с 1562 по 1664 г. было послано
из “Казани к Москве чистыя меди 4641 пуд.
6 гривенков”. В 1702 г. стала выходить
первая русская газета “Ведомости”,
которую, очевидно, редактировал Петр
I. 2 января 1703 г. в ней писали: “Из Казани
пишут. На реке Соку нашли много нефти и
медной руды, из той руды меди выплавили
изрядно, отчего чают не малую прибыль
Московскому государству”. [2, с.27]
При Иване Грозном в Олонецкий
уезд был послан новгородский гость
(купец) Семен Гаврилов “для сыску медные
руды”, где она и была найдена. В 1652 г.
Казанский воевода сообщил царю: “Медные
руды… сыскано много и заводы к медному
делу заводим”. [2, с.26] Из документов
следует, что с 1562 по 1664 г. было послано
из “Казани к Москве чистыя меди 4641 пуд.
6 гривенков”. В 1702 г. стала выходить
первая русская газета “Ведомости”,
которую, очевидно, редактировал Петр
I. 2 января 1703 г. в ней писали: “Из Казани
пишут. На реке Соку нашли много нефти и
медной руды, из той руды меди выплавили
изрядно, отчего чают не малую прибыль
Московскому государству”. [2, с.27]
В начале этого столетия главнейшими месторождениями, которые разрабатывались, были: в районе Северного Урала – Богословский завод, в районе Нижнего Тагила – Выйский завод, а на Кавказе – Калакентский и Кедабекский заводы.
В
наше время известны месторождения меди
на восточном склоне Урала, Средней Азии,
Закавказье и т. д.
д.
Большое количество меди и других ископаемых находится на дне океанов, которое покрыто так называемыми конкрециями – скоплениями в виде камней округлой неправильной формы. Они содержат в среднем 0,5% меди. По подсчетам ученых запасы этой ценной и своеобразной руды составляют 5 млрд. тонн. [1, с.16-18]
Медь | это… Что такое Медь?
Медь | |
Cu 63,546 | |
| 3d104s1 | |
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
Содержание
|
История и происхождение названия
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков считают русское слово медь (польск. miedz, чешск. med) родственным древненемецкому smida (металл) и Schmied (кузнец, англ. Smith). От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь «венера» (Venus). В более древние времена встречается название «марс» (Mars).
ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков считают русское слово медь (польск. miedz, чешск. med) родственным древненемецкому smida (металл) и Schmied (кузнец, англ. Smith). От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь «венера» (Venus). В более древние времена встречается название «марс» (Mars).
См. также: История меди и бронзы
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3].
Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь – один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвертой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвертой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[4] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C 55,5-58 МСм/м[5]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
Изотопы меди
Основная статья: Изотопы меди
Природная медь состоит из двух стабильных изотопов — 63Cu 65Cu с распространённостью 69 и 31 атомных процентов соответственно. Известны более двух деясятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
Известны более двух деясятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
Химические свойства
Возможные степени окисления
Диаграмма Пурбе для меди
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например [Cu(NH3)2]+. Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной серной кислотой при 200 °C:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
Реагирует с концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С царской водкой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата(I) калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов.
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I)
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответсвует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет:
Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, про которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, про которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Медный купорос
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга).
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Аналитическая химия меди
Возбуждённые атомы меди окрашивают пламя в голубовато-зелёный цвет
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этой сульфид меди выпадает в далее взвешиваемый осадок .
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C 0,01724-0,0180 мкОм·м[5]), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[6].
Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[6].
Теплообмен
Система охлаждения из меди на тепловых трубках в ноутбуке
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[7], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы
Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллейрийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности.
действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллейрийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности.
Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25-29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[8].
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[8].
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно, из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей
Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют, как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[9].
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 511 и 578 нм.
Стоимость
На 2011 год стоимость меди составляет около $8900 за тонну[10].
Биологическая роль
Продукты, богатые медью.
Метаболизм меди у человека. Поступление в энтероцит с помощью транспортёра CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азы ATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей[11].
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[12].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[12]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[13] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[14]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»)[15].
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т[16][17]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т подтверждённые запасы[16], на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов[16]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн[18]. Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское»[19]. Мировое производство меди в 2007 году составляло[20] 15,4 млн т, а в 2008 году — 15,7 млн т Лидерами производства были:
Мировое производство меди в 2007 году составляло[20] 15,4 млн т, а в 2008 году — 15,7 млн т Лидерами производства были:
- Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
- США (1,170/1,310),
- Перу (1,190/1,220),
- КНР (0,946/1,000),
- Австралия (0,870/0,850),
- Россия (0,740/0,750),
- Индонезия (0,797/0,650),
- Канада (0,589/0,590),
- Замбия (0,520/0,560),
- Казахстан (0,407/0,460),
- Польша (0,452/0,430),
- Мексика (0,347/0,270).
Смотрим также более полный список стран по производству меди.
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров.
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика.
Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика.
Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили.
Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C.
С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[21].
Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[21].
Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в кратере медного рудника.
Интересные факты
- Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 мм по сторонам и 0,5 мм толщиной. Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков[22].
- В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
- Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).

- В организме взрослого человека содержится до 80 мг меди.
- Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными размерами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов[23].
Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8
- ↑ Медь самородная в БСЭ
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны)
- ↑ при 20 °С 394,279 Вт/(м·К), то есть 0,941 кал/(см·сек·°С)
- ↑ 1 2 Электротехнический справочник. Т. 1. / Составитель И. И. Алиев. — М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- ↑ Применение меди
- ↑ ГОСТ Р 52318-2005 Трубы медные круглого сечения для воды и газа.
 Технические условия
Технические условия - ↑ Смирягин А. П.,Смирягина Н. А., Белова А. В. Промышленные цветные металлы и сплавы. 3-е изд. — Металлургия, 1974. — С. 321. — 488 с.
- ↑ СП 31-116-2006 Проектирование и устройство кровель из листовой меди
- ↑ Цена меди
- ↑ Медь и рост человека // Наука и жизнь. — М.: «Правда», 1990. — № 1. — С. 17.
- ↑ 1 2 CHEMICAL FACT SHEETS (англ.). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009.
- ↑ US EPA
- ↑ В США наблюдается вспышка инфекции MRSA за пределами госпиталей
- ↑ British Scientist Shares Expertise on Swine Flu Control in Beijing
- ↑ 1 2 3 Производство меди
- ↑ В 2005 г. мировая добыча меди увеличится на 8 % до 15,7 млн т. — Новости металлургии
- ↑ Стратегия развития металлургической промышленности Российской Федерации на период до 2020 года.
 Минпромэнерго РФ (18 марта 2009). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009.
Минпромэнерго РФ (18 марта 2009). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009. - ↑ Металлонвест оплатил лицензию за Удокан
- ↑ MINERAL COMMODITY SUMMARIES 2009
- ↑ Получение меди
- ↑ Espinoza Soriano, Waldemar. Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135.
- ↑ Интересные факты о меди и медных трубах
Литература
- Данные на начало XX века : Медь // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Фримантл М. Химия в действии. — М.: «Мир», 1991. — Т. 2.
- Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. Химические свойства неорганических веществ. — «Химия», 2000. — С. 286.
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Российский Центр Меди, некоммерческий
- Медь в месторождениях
- Некоммерческий ресурс о меди (eng)
- Свойства меди
 И. Менделеева И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Соединения меди
Азид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) •
Медь | это.
 .. Что такое Медь?
.. Что такое Медь?| 29 | Медь |
Cu 63,546 | |
| 3d104s1 | |
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
Содержание
|
История и происхождение названия
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков считают русское слово медь (польск. miedz, чешск. med) родственным древненемецкому smida (металл) и Schmied (кузнец, англ. Smith). От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь «венера» (Venus). В более древние времена встречается название «марс» (Mars).
Алхимики именовали медь «венера» (Venus). В более древние времена встречается название «марс» (Mars).
См. также: История меди и бронзы
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3].
Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь – один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвертой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[4] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C 55,5-58 МСм/м[5]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
Изотопы меди
Основная статья: Изотопы меди
Природная медь состоит из двух стабильных изотопов — 63Cu 65Cu с распространённостью 69 и 31 атомных процентов соответственно. Известны более двух деясятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
Химические свойства
Возможные степени окисления
Диаграмма Пурбе для меди
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например [Cu(NH3)2]+. Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например [Cu(NH3)2]+. Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной серной кислотой при 200 °C:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
Реагирует с концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С царской водкой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата(I) калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов.
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I)
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответсвует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет:
Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, про которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, про которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Медный купорос
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга).
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Аналитическая химия меди
Возбуждённые атомы меди окрашивают пламя в голубовато-зелёный цвет
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этой сульфид меди выпадает в далее взвешиваемый осадок .
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C 0,01724-0,0180 мкОм·м[5]), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[6].
Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[6].
Теплообмен
Система охлаждения из меди на тепловых трубках в ноутбуке
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[7], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы
Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллейрийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности.
действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллейрийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности.
Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25-29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[8].
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[8].
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно, из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей
Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют, как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[9].
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 511 и 578 нм.
Стоимость
На 2011 год стоимость меди составляет около $8900 за тонну[10].
Биологическая роль
Продукты, богатые медью.
Метаболизм меди у человека. Поступление в энтероцит с помощью транспортёра CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азы ATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей[11].
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[12].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[12]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[13] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[14]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»)[15].
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т[16][17]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т подтверждённые запасы[16], на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов[16]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн[18]. Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское»[19]. Мировое производство меди в 2007 году составляло[20] 15,4 млн т, а в 2008 году — 15,7 млн т Лидерами производства были:
Мировое производство меди в 2007 году составляло[20] 15,4 млн т, а в 2008 году — 15,7 млн т Лидерами производства были:
- Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
- США (1,170/1,310),
- Перу (1,190/1,220),
- КНР (0,946/1,000),
- Австралия (0,870/0,850),
- Россия (0,740/0,750),
- Индонезия (0,797/0,650),
- Канада (0,589/0,590),
- Замбия (0,520/0,560),
- Казахстан (0,407/0,460),
- Польша (0,452/0,430),
- Мексика (0,347/0,270).
Смотрим также более полный список стран по производству меди.
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров.
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика.
Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика.
Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили.
Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C.
С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[21].
Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[21].
Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в кратере медного рудника.
Интересные факты
- Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 мм по сторонам и 0,5 мм толщиной. Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков[22].
- В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
- Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).

- В организме взрослого человека содержится до 80 мг меди.
- Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными размерами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов[23].
Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8
- ↑ Медь самородная в БСЭ
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны)
- ↑ при 20 °С 394,279 Вт/(м·К), то есть 0,941 кал/(см·сек·°С)
- ↑ 1 2 Электротехнический справочник. Т. 1. / Составитель И. И. Алиев. — М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- ↑ Применение меди
- ↑ ГОСТ Р 52318-2005 Трубы медные круглого сечения для воды и газа.
 Технические условия
Технические условия - ↑ Смирягин А. П.,Смирягина Н. А., Белова А. В. Промышленные цветные металлы и сплавы. 3-е изд. — Металлургия, 1974. — С. 321. — 488 с.
- ↑ СП 31-116-2006 Проектирование и устройство кровель из листовой меди
- ↑ Цена меди
- ↑ Медь и рост человека // Наука и жизнь. — М.: «Правда», 1990. — № 1. — С. 17.
- ↑ 1 2 CHEMICAL FACT SHEETS (англ.). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009.
- ↑ US EPA
- ↑ В США наблюдается вспышка инфекции MRSA за пределами госпиталей
- ↑ British Scientist Shares Expertise on Swine Flu Control in Beijing
- ↑ 1 2 3 Производство меди
- ↑ В 2005 г. мировая добыча меди увеличится на 8 % до 15,7 млн т. — Новости металлургии
- ↑ Стратегия развития металлургической промышленности Российской Федерации на период до 2020 года.
 Минпромэнерго РФ (18 марта 2009). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009.
Минпромэнерго РФ (18 марта 2009). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009. - ↑ Металлонвест оплатил лицензию за Удокан
- ↑ MINERAL COMMODITY SUMMARIES 2009
- ↑ Получение меди
- ↑ Espinoza Soriano, Waldemar. Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135.
- ↑ Интересные факты о меди и медных трубах
Литература
- Данные на начало XX века : Медь // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Фримантл М. Химия в действии. — М.: «Мир», 1991. — Т. 2.
- Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. Химические свойства неорганических веществ. — «Химия», 2000. — С. 286.
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Российский Центр Меди, некоммерческий
- Медь в месторождениях
- Некоммерческий ресурс о меди (eng)
- Свойства меди
 И. Менделеева И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Соединения меди
Азид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) •
Медь | это.
 .. Что такое Медь?
.. Что такое Медь?| 29 | Медь |
Cu 63,546 | |
| 3d104s1 | |
Медь — элемент побочной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком.
Содержание
|
История и происхождение названия
Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III тысячелетии до н. э. существовали медные рудники и производилась выплавка меди.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр, ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник. Сторонники индогерманской теории происхождения европейских языков считают русское слово медь (польск. miedz, чешск. med) родственным древненемецкому smida (металл) и Schmied (кузнец, англ. Smith). От этого слова произошли и родственные названия — медаль, медальон (франц. medaille). Слова медь и медный встречаются в древнейших русских литературных памятниках. Алхимики именовали медь «венера» (Venus). В более древние времена встречается название «марс» (Mars).
Алхимики именовали медь «венера» (Venus). В более древние времена встречается название «марс» (Mars).
См. также: История меди и бронзы
Нахождение в природе
Самородная медь
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн[2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3].
Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси)[3].
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь – один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвертой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[4] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C 55,5-58 МСм/м[5]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем, баббиты — со свинцом и другие.
Изотопы меди
Основная статья: Изотопы меди
Природная медь состоит из двух стабильных изотопов — 63Cu 65Cu с распространённостью 69 и 31 атомных процентов соответственно. Известны более двух деясятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
Химические свойства
Возможные степени окисления
Диаграмма Пурбе для меди
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например [Cu(NH3)2]+. Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например [Cu(NH3)2]+. Её соединения бесцветны. Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11H11)23−, полученных в 1994 году.
Простое вещество
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди(II):
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной серной кислотой при 200 °C:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
Реагирует с концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С царской водкой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди(I) при недостатке кислорода и 200 °C и до оксида меди(II), при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой (в жидком сероуглероде) и бромом (в эфире), при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата(I) калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
Соединения меди(I)
Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Соответствующий гидроксид CuOH (жёлтого цвета) быстро разлагается с образованием оксида. Гидроксид CuOH проявляет основные свойства.
Многие соединения меди +1 имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе Сu+ все пять Зd-орбиталей заполнены парами электронов.
Ионы меди(I) в водном растворе неустойчивы и легко диспропорционируют:
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
Свойства соединений меди (I) похожи на свойства соединений серебра (I). В частности, CuCl, CuBr и CuI нерастворимы. Также существует нестабильный сульфат меди(I)
Соединения меди(II)
Степень окисления II — наиболее стабильная степень окисления меди. Ей соответсвует чёрный оксид CuO и голубой гидроксид Cu(OH)2, который при стоянии легко отщепляет воду и при этом чернеет:
Гидроксид меди (II) носит преимущественно основный характер и только в концентрированной щелочи частично растворяется с образованием синего гидроксокомплекса. Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, про которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Наибольшее значение имеет реакция гидроксида меди (II) с водным раствором аммиака, про которой образуется так называемый реактив Швейцера (растворитель целлюлозы):
Соли меди(II) образуются при растворении меди в кислотах-окислителях (азотной, концентрированной серной). Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Медный купорос
Соединения меди(II) обладают слабыми окислительными свойствами, что используется в анализе (например, использование реактива Фелинга).
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди и медных сплавов при взаимодействии оксидной плёнки с углекислым газом воздуха в присутствии воды. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5H2O, используется как фунгицид.
Оксид меди (II) используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников.
Соединения меди(III) и меди(IV)
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Аналитическая химия меди
Возбуждённые атомы меди окрашивают пламя в голубовато-зелёный цвет
Медь можно обнаружить в растворе по зелёно-голубой окраске пламени бунзеновской горелки, при внесении в него платиновой проволочки, смоченной исследуемым раствором.
- Традиционно количественное определение меди в слабокислых растворах проводилось с помощью пропускания через него сероводорода, при этой сульфид меди выпадает в далее взвешиваемый осадок .
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими и спектральными методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C 0,01724-0,0180 мкОм·м[5]), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[6].
Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Например, присутствие в меди 0,02 % алюминия снижает её электрическую проводимость почти на 10 %[6].
Теплообмен
Система охлаждения из меди на тепловых трубках в ноутбуке
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления, компьютерных кулерах, тепловых трубках.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005[7], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы
Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллейрийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности.
действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. Большое количество латуни идёт на изготовление гильз артиллейрийских боеприпасов и оружейных гильз, благодаря технологичности и высокой пластичности.
Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30—40 кгс/мм² у сплавов и 25-29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не изменяют механических свойств при термической обработке, и их механические свойства и износостойкость определяются только химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900—12000 кгс/мм², ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред (медно-никелевые сплавы и алюминиевые бронзы) и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[8].
Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевый сплав (мельхиор) используются для чеканки разменной монеты[8].
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении (трубки конденсаторов отработавшего пара турбин, охлаждаемых забортной водой) и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за высокой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно, из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей
Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют, как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006[9].
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Пары меди используются в качестве рабочего тела в лазерах на парах меди, на длинах волн генерации 511 и 578 нм.
Стоимость
На 2011 год стоимость меди составляет около $8900 за тонну[10].
Биологическая роль
Продукты, богатые медью.
Метаболизм меди у человека. Поступление в энтероцит с помощью транспортёра CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азы ATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей[11].
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта[12].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[12]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[13] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[14]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»)[15].
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т, a в 2004 году — около 14 млн т[16][17]. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т подтверждённые запасы[16], на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов[16]. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн[18]. Основными производителями меди в России являлись:
| Компания | тыс. тонн | % |
|---|---|---|
| Норильский никель | 425 | 45 % |
| Уралэлектромедь | 351 | 37 % |
| Русская медная компания | 166 | 18 % |
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское»[19]. Мировое производство меди в 2007 году составляло[20] 15,4 млн т, а в 2008 году — 15,7 млн т Лидерами производства были:
Мировое производство меди в 2007 году составляло[20] 15,4 млн т, а в 2008 году — 15,7 млн т Лидерами производства были:
- Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.),
- США (1,170/1,310),
- Перу (1,190/1,220),
- КНР (0,946/1,000),
- Австралия (0,870/0,850),
- Россия (0,740/0,750),
- Индонезия (0,797/0,650),
- Канада (0,589/0,590),
- Замбия (0,520/0,560),
- Казахстан (0,407/0,460),
- Польша (0,452/0,430),
- Мексика (0,347/0,270).
Смотрим также более полный список стран по производству меди.
По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, на Украине, в Сибири, на Алтае.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров.
Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика.
Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика.
Эскондида — самый большой в мире карьер, в котором добывают медную руду. Расположен в Чили.
Современные способы добычи
90 % первичной меди получают пирометаллургическим способом, 10 % — гидрометаллургическим. Гидрометаллургический способ — это получение меди путём её выщелачивания слабым раствором серной кислоты и последующего выделения металлической меди из раствора. Пирометаллургический способ состоит из нескольких этапов: обогащения, обжига, плавки на штейн, продувки в конвертере, рафинирования.
Для обогащения медных руд используется метод флотации (основан на использовании различной смачиваемости медьсодержащих частиц и пустой породы), который позволяет получать медный концентрат, содержащий от 10 до 35 % меди.
Медные руды и концентраты с большим содержанием серы подвергаются окислительному обжигу. В процессе нагрева концентрата или руды до 700—800 °C в присутствии кислорода воздуха, сульфиды окисляются и содержание серы снижается почти вдвое от первоначального. Обжигают только бедные (с содержанием меди от 8 до 25 %) концентраты, а богатые (от 25 до 35 % меди) плавят без обжига.
После обжига руда и медный концентрат подвергаются плавке на штейн, представляющий собой сплав, содержащий сульфиды меди и железа. Штейн содержит от 30 до 50 % меди, 20—40 % железа, 22—25 % серы, кроме того, штейн содержит примеси никеля, цинка, свинца, золота, серебра. Чаще всего плавка производится в пламенных отражательных печах. Температура в зоне плавки 1450 °C.
С целью окисления сульфидов и железа, полученный медный штейн подвергают продувке сжатым воздухом в горизонтальных конвертерах с боковым дутьём. Образующиеся окислы переводят в шлак. Температура в конвертере составляет 1200—1300 °C. Интересно, что тепло в конвертере выделяется за счёт протекания химических реакций, без подачи топлива. Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Таким образом, в конвертере получают черновую медь, содержащую 98,4—99,4 % меди, 0,01—0,04 % железа, 0,02—0,1 % серы и небольшое количество никеля, олова, сурьмы, серебра, золота. Эту медь сливают в ковш и разливают в стальные изложницы или на разливочной машине.
Далее, для удаления вредных примесей, черновую медь рафинируют (проводят огневое, а затем электролитическое рафинирование). Сущность огневого рафинирования черновой меди заключается в окислении примесей, удалении их с газами и переводе в шлак. После огневого рафинирования получают медь чистотой 99,0—99,7 %. Её разливают в изложницы и получают чушки для дальнейшей выплавки сплавов (бронзы и латуни) или слитки для электролитического рафинирования.
Электролитическое рафинирование проводят для получения чистой меди (99,95 %). Электролиз проводят в ваннах, где анод — из меди огневого рафинирования, а катод — из тонких листов чистой меди. Электролитом служит водный раствор. При пропускании постоянного тока анод растворяется, медь переходит в раствор, и, очищенная от примесей, осаждается на катодах. Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[21].
Примеси оседают на дно ванны в виде шлака, который идёт на переработку с целью извлечения ценных металлов. Катоды выгружают через 5—12 дней, когда их масса достигнет от 60 до 90 кг. Их тщательно промывают, а затем переплавляют в электропечах[21].
Влияние на экологию
При открытом способе добычи после её прекращения карьер становится источником токсичных веществ. Самое токсичное озеро в мире — Беркли Пит — образовалось в кратере медного рудника.
Интересные факты
- Индейцы культуры Чонос (Эквадор) ещё в XV—XVI веках выплавляли медь с содержанием 99,5 % и употребляли её в качестве монеты в виде топориков 2 мм по сторонам и 0,5 мм толщиной. Данная монета ходила по всему западному побережью Южной Америки, в том числе и в государстве Инков[22].
- В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких».
- Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства).

- В организме взрослого человека содержится до 80 мг меди.
- Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными размерами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов[23].
Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — М.: Советская энциклопедия, 1992. — Т. 3. — С. 7. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8
- ↑ Медь самородная в БСЭ
- ↑ Крупнейшие мономинеральные месторождения (рудные районы, бассейны)
- ↑ при 20 °С 394,279 Вт/(м·К), то есть 0,941 кал/(см·сек·°С)
- ↑ 1 2 Электротехнический справочник. Т. 1. / Составитель И. И. Алиев. — М. : ИП РадиоСофт, 2006. — C. 246. — ISBN 5-93037-157-1
- ↑ Применение меди
- ↑ ГОСТ Р 52318-2005 Трубы медные круглого сечения для воды и газа.
 Технические условия
Технические условия - ↑ Смирягин А. П.,Смирягина Н. А., Белова А. В. Промышленные цветные металлы и сплавы. 3-е изд. — Металлургия, 1974. — С. 321. — 488 с.
- ↑ СП 31-116-2006 Проектирование и устройство кровель из листовой меди
- ↑ Цена меди
- ↑ Медь и рост человека // Наука и жизнь. — М.: «Правда», 1990. — № 1. — С. 17.
- ↑ 1 2 CHEMICAL FACT SHEETS (англ.). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009.
- ↑ US EPA
- ↑ В США наблюдается вспышка инфекции MRSA за пределами госпиталей
- ↑ British Scientist Shares Expertise on Swine Flu Control in Beijing
- ↑ 1 2 3 Производство меди
- ↑ В 2005 г. мировая добыча меди увеличится на 8 % до 15,7 млн т. — Новости металлургии
- ↑ Стратегия развития металлургической промышленности Российской Федерации на период до 2020 года.
 Минпромэнерго РФ (18 марта 2009). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009.
Минпромэнерго РФ (18 марта 2009). Архивировано из первоисточника 22 августа 2011. Проверено 29 декабря 2009. - ↑ Металлонвест оплатил лицензию за Удокан
- ↑ MINERAL COMMODITY SUMMARIES 2009
- ↑ Получение меди
- ↑ Espinoza Soriano, Waldemar. Etnohistoria ecuatoriana: estudios y documentos. — Quito: Abya-Yala, 1988. — p. 135.
- ↑ Интересные факты о меди и медных трубах
Литература
- Данные на начало XX века : Медь // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб., 1890—1907.
- Фримантл М. Химия в действии. — М.: «Мир», 1991. — Т. 2.
- Р. А. Лидин, В. А. Молочко, Л. Л. Андреева. Химические свойства неорганических веществ. — «Химия», 2000. — С. 286.
Ссылки
- Медь на Webelements
- Медь в Популярной библиотеке химических элементов
- Российский Центр Меди, некоммерческий
- Медь в месторождениях
- Некоммерческий ресурс о меди (eng)
- Свойства меди
 И. Менделеева И. Менделеева | ||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | ||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
Соединения меди
Азид меди(II) (Cu(N3)2) • Арсенат меди(II) (Cu3(AsO4)2) • Ацетат меди(I) (СН3СООCu) • Ацетат меди(II) ((СН3СОО)2Cu) • Ацетиленид меди(I) (Cu2C2) • Ацетиленид меди(II) (CuC2) • Бромид меди(I) (CuBr) • Бромид меди(II) (CuBr2) • Бромат меди(II) (Cu(BrO3)2) • Гексафторокупрат(III) калия (K3[CuF6]) • Гексафторосиликат меди(I) (Cu2[SiF6]) • Гексафторосиликат меди(II) (Cu[SiF6]) • Гидрид меди(I) (CuH) • Гидроксид меди(I) (CuOH) • Гидроксид меди(II) (Cu(OH)2) • Дигексателлуратокупрат(III) натрия (Na9[Cu(TeO6)2]) • Дигидроксодикарбонат меди(II) (Cu3(OH)2(CO3)2) • Дигидроксокарбонат меди(II) ((CuOH)2CO3) • Диортопериодатокупрат(III) калия (K7[Cu(IO6)2]) • Дифосфид тримеди (Cu3P2) • Иодид меди(I) (CuI) • Иодат меди(II) (Cu(IO3)2) • Карбонат меди(II) (CuCO3) • Купрат(III) калия (KCuO2) • Метаборат меди(I) (CuBO2) • Метаборат меди(II) (Cu(BO2)2) • Нитрат меди(I) (CuNO3) • Нитрат меди(II) (Cu(NO3)2) • Нитрид меди (Cu3N) • Оксалат меди(II) (CuC2O4) • Оксид меди(I) (Cu2O) • Оксид меди(II) (CuO) • Оксид меди(III) (Cu2O3) • Ортофосфат меди(II) (Cu3(PO4)2) • «Парижская зелень» (Cu(CH3COO)2•3Cu(AsO2)2) • Периодады меди(II) • Полииодиды меди(II) (CuIn) • Роданид меди(I) (CuSCN) • Роданид меди(II) (Cu(SCN)2) • Селенат меди(II) (CuSeO4) • Селенид меди(I) (Cu2Se) • Селенид меди(II) (CuSe) • Силицид димеди (Cu2Si) • Силицид пентамеди (Cu5Si) • Силицид тетрамеди (Cu4Si) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфид меди(I) (Cu2S) • Сульфид меди(II) (CuS) • Сульфит меди(I) (Cu2SO3) • Теллурид меди(I) (Cu2Te) • Фенилмедь (CuC6H5) • Фосфат меди(I) (Cu3PO4) • Фосфаты меди(II) • Фосфид димеди (Cu2P) • Фосфид тримеди (Cu3P) • Фторид меди(I) (CuF) • Фторид меди(II) (CuF2) • Хлорат меди(II) (Cu(ClO3)2) • Хлорид меди(I) (CuCl) • Хлорид меди(II) (CuCl2) • Цианид меди(I) (CuCN) • Цианид меди(II) (Cu(CN)2) • Этилмедь (CuC2H6) •
МЕДЬ | Энциклопедия Кругосвет
МЕДЬ – элемент 11 группы Периодической системы, плотность 8,9 г см–3, один из первых металлов, ставших известными человеку. Считают, что медь начали использовать около 5000 до н.э. В природе медь изредка встречается в виде металла. Из медных самородков, возможно, с помощью каменных топоров, были изготовлены первые металлические орудия труда. У индейцев, живших на его берегах оз. Верхнее (Сев. Америка), где есть очень чистая самородная медь, способы ее холодной обработки были известны до времен Колумба.
Считают, что медь начали использовать около 5000 до н.э. В природе медь изредка встречается в виде металла. Из медных самородков, возможно, с помощью каменных топоров, были изготовлены первые металлические орудия труда. У индейцев, живших на его берегах оз. Верхнее (Сев. Америка), где есть очень чистая самородная медь, способы ее холодной обработки были известны до времен Колумба.
Около 3500 до н.э. на Ближнем Востоке медь научились извлекать из руд, ее получали восстановлением углем. Медные рудники были и в Древнем Египте. Известно, что глыбы для знаменитой пирамиды Хеопса обрабатывали медным инструментом.
К 3000 до н.э. в Индии, Месопотамии и Греции для выплавки более твердой бронзы в медь стали добавлять олово. Открытие бронзы могло произойти случайно, однако ее преимущества по сравнению с чистой медью быстро вывели этот сплав на первое место. Так начался «бронзовый век».
Изделия из бронзы были у ассирийцев, египтян, индусов и других народов древности. Однако цельные бронзовые статуи древние мастера научились отливать не раньше 5 в. до н.э. Около 290 до н.э. Харесом в честь бога солнца Гелиоса был создан Колосс Родосский. Он имел высоту 32 м и стоял над входом во внутреннюю гавань древнего порта острова Родоса в восточной части Эгейского моря. Гигантская бронзовая статуя была разрушена землетрясением в 223 н.э. (см. также СЕМЬ ЧУДЕС СВЕТА).
до н.э. Около 290 до н.э. Харесом в честь бога солнца Гелиоса был создан Колосс Родосский. Он имел высоту 32 м и стоял над входом во внутреннюю гавань древнего порта острова Родоса в восточной части Эгейского моря. Гигантская бронзовая статуя была разрушена землетрясением в 223 н.э. (см. также СЕМЬ ЧУДЕС СВЕТА).
Предки древних славян, жившие в бассейне Дона и в Приднепровье, применяли медь для изготовления оружия, украшений и предметов домашнего обихода. Русское слово «медь», по мнению некоторых исследователей, произошло от слова «мида», которое у древних племен, населявших Восточную Европу, обозначало металл вообще.
Символ Cu происходит от латинского aes cyproum (позднее, Cuprum), так как на Кипре (Cyprus) находились медные рудники древних римлян.
Относительное содержание меди в земной коре составляет 6,8·10–3%. Самородная медь встречается очень редко. Обычно элемент находится в виде сульфида, оксида или карбоната. Важнейшими рудами меди являются халькопирит CuFeS2, который, по оценкам, составляет около 50% всех месторождений этого элемента, медный блеск (халькоцит) Cu2S, куприт Cu2O и малахит Cu2CO3(OH)2. Большие месторождения медных руд найдены в различных частях Северной и Южной Америк, в Африке и на территории нашей страны. В 18–19 вв. близ Онежского озера добывали самородную медь, которую отправляли на монетный двор в Петербург. Открытие промышленных месторождений меди на Урале и в Сибири связано с именем Никиты Демидова. Именно он по указу Петра I в 1704 начал чеканить медные деньги.
Большие месторождения медных руд найдены в различных частях Северной и Южной Америк, в Африке и на территории нашей страны. В 18–19 вв. близ Онежского озера добывали самородную медь, которую отправляли на монетный двор в Петербург. Открытие промышленных месторождений меди на Урале и в Сибири связано с именем Никиты Демидова. Именно он по указу Петра I в 1704 начал чеканить медные деньги.
Богатые месторождения меди давно выработаны. Сегодня почти весь металл добывается из низкосортных руд, содержащих не более 1% меди. Некоторые оксидные руды меди могут быть восстановлены непосредственно до металла нагреванием с коксом. Однако большая часть меди производится из железосодержащих сульфидных руд, что требует более сложной переработки. Эти руды сравнительно бедные, и экономический эффект при их эксплуатации может обеспечиваться лишь ростом масштабов добычи. Руду обычно добывают в огромных карьерах, где используются экскаваторы с ковшами до 25 м3 и грузовики грузоподъемностью до 250 т. Сырье размалывают и концентрируют (до содержания меди 15–20%) с использованием пенной флотации, при этом серьезной проблемой является сброс многих миллионов тонн тонко измельченных отходов в окружающую среду (см. ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ). К концентрату добавляют кремнезем, а затем смесь нагревают в отражательных печах (доменные печи для тонко измельченной руды неудобны) до температуры 1400° С, при которой она плавится. Суммарное уравнение протекающих реакций можно представать в виде:
Сырье размалывают и концентрируют (до содержания меди 15–20%) с использованием пенной флотации, при этом серьезной проблемой является сброс многих миллионов тонн тонко измельченных отходов в окружающую среду (см. ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ). К концентрату добавляют кремнезем, а затем смесь нагревают в отражательных печах (доменные печи для тонко измельченной руды неудобны) до температуры 1400° С, при которой она плавится. Суммарное уравнение протекающих реакций можно представать в виде:
2CuFeS2 + 5O2 + 2SiO2 = 2Cu + 2FeSiO3 + 4SO2
Cu+I + 1e– = Cu0 |
FeIII + 1e– = FeII | –10e–
2S–II – 12e– = 2SIV |
O2 + 4e– = 2O–II
Большую часть полученной черновой меди очищают электрохимическим методом, отливая из нее аноды, которые затем подвешивают в подкисленном растворе сульфата меди CuSO4, а катоды покрывают листами очищенной меди. В процессе электролиза чистая медь осаждается на катодах, а примеси собираются около анодов в виде анодного шлама, который является ценным источником серебра, золота и других драгоценных металлов.
В процессе электролиза чистая медь осаждается на катодах, а примеси собираются около анодов в виде анодного шлама, который является ценным источником серебра, золота и других драгоценных металлов.
Около 1/3 используемой меди представляет собой вторичную медь, выплавленную из лома. Годовое производство нового металла составляет около 8 млн. т. Лидируют по производству меди Чили (22%), США (20%), СНГ (9%), Канада (7,5%), Китай (7,5%) и Замбия (5%).
Главное применение металла – в качестве проводника электрического тока. Кроме того, медь используется в монетных сплавах, поэтому ее часто называют «монетным металлом». Она также входит в состав традиционных бронзы (сплавы меди с 7–10% олова) и латуни (сплав меди с цинком) и специальных сплавов, таких как монель (сплав никеля с медью). Металлообрабатывающий инструмент из медных сплавов не искрит и может использоваться во взрывоопасных цехах. Сплавы на основе меди служат для изготовления духовых инструментов и колоколов.
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро- и теплопроводности медь уступает только серебру. Металлическая медь, как и серебро, обладает антибактериальными свойствами.
Медь металл мягкий и пластичный. По электро- и теплопроводности медь уступает только серебру. Металлическая медь, как и серебро, обладает антибактериальными свойствами.
Медь устойчива в чистом сухом воздухе при комнатной температуре, однако при температуре красного каления образует оксиды. Она реагирует также с серой и галогенами. В атмосфере, содержащей соединения серы, медь покрывается зеленой пленкой основного сульфата. В электрохимическом ряду напряжений медь находится правее водорода, поэтому она практически не взаимодействует с неокисляющими кислотами. Металл растворяется в горячей концентрированной серной кислоте, а также в разбавленной и концентрированной азотной кислоте. Кроме того, медь можно перевести в раствор действием водных растворов цианидов или аммиака:
2Cu + 8NH3·H2O + O2 = 2[Cu(NH3)4](OH)2 + 6H2O
В соответствии с положением меди в Периодической системе, ее единственная устойчивая степень окисления должна быть (+I), но это не так. Медь способны принимать более высокие степени окисления, причем наиболее устойчивой, особенно в водных растворах, является степень окисления (+II). В биохимических реакциях переноса электрона, возможно, участвует медь(III). Эта степень окисления редко встречается и очень легко понижается под действием даже слабых восстановителей. Известно несколько соединений меди(+IV).
Медь способны принимать более высокие степени окисления, причем наиболее устойчивой, особенно в водных растворах, является степень окисления (+II). В биохимических реакциях переноса электрона, возможно, участвует медь(III). Эта степень окисления редко встречается и очень легко понижается под действием даже слабых восстановителей. Известно несколько соединений меди(+IV).
При нагревании металла на воздухе или в кислороде образуются оксиды меди: желтый или красный Cu2O и черный CuO. Повышение температуры способствует образованию преимущественно оксида меди(I) Cu2O. В лаборатории этот оксид удобно получать восстановлением щелочного раствора соли меди(II) глюкозой, гидразином или гидроксиламином:
2CuSO4 + 2NH2OH + 4NaOH = Cu2O + N2 + 2Na2SO4 + 5H2O
Эта реакция – основа чувствительного теста Фелинга на сахара и другие восстановители. К испытываемому веществу добавляют раствор соли меди(II) в щелочном растворе. Если вещество является восстановителем, появляется характерный красный осадок.
Если вещество является восстановителем, появляется характерный красный осадок.
Поскольку катион Cu+ в водном растворе неустойчив, при действии кислот на Cu2O происходит либо дисмутация, либо комплексообразование:
Cu2O + H2SO4 = Cu + CuSO4 + H2O
Cu2O + 4HCl = 2 H[CuCl2] + H2O
Оксид Cu2O заметно взаимодействует со щелочами. При этом образуется комплекс:
Cu2O + 2NaOH + H2O 2Na[Cu(OH)2]
Для получения оксида меди(II) CuO лучше всего использовать разложение нитрата или основного карбоната меди(II):
2Cu(NO3)2 = 2CuO + 4NO2 + O2
(CuOH)2CO3 = 2CuO + CO2 + H2O
Оксиды меди не растворимы в воде и не реагируют с ней. Единственный гидроксид меди Cu(OH)2 обычно получают добавлением щелочи к водному раствору соли меди(II). Бледно-голубой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4]2–. Гидроксид меди(II) растворяется также в растворе аммиака:
Бледно-голубой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4]2–. Гидроксид меди(II) растворяется также в растворе аммиака:
Cu(OH)2 + 4NH3.H2O = [Cu(NH3)4](OH)2 + 4H2O
Гидроксид меди(II) термически неустойчив и при нагревании разлагается:
Cu(OH)2 = CuO + H2O
Есть сведения о существовании темно-красного оксида Cu2O3, образующегося при действии K2S2O8 на Cu(OH)2. Он является сильным окислителем, при нагревании до 400° С разлагается на CuO и О2.
Большой интерес к химии оксидов меди в последние два десятилетия связан с получением высокотемпературных сверхпроводников, из которых наиболее известен YBa2Cu3O7. В 1987 было показано, что при температуре жидкого азота это соединение является сверхпроводником. Главные проблемы, препятствующие его широкомасштабному практическому применению, лежат в области обработки материала. Сейчас наиболее перспективным считается изготовление тонких пленок.
В 1987 было показано, что при температуре жидкого азота это соединение является сверхпроводником. Главные проблемы, препятствующие его широкомасштабному практическому применению, лежат в области обработки материала. Сейчас наиболее перспективным считается изготовление тонких пленок.
Многие из халькогенидов меди – нестехиометрические соединения. Сульфид меди(I) Cu2S образуется при сильном нагревании меди в парах серы или в среде сероводорода. При пропускании сероводорода через водные растворы, содержащие катионы Cu2+, выделяется коллоидный осадок состава CuS. Однако, CuS – не простое соединение меди(II). Оно содержит группу S2 и лучше описывается формулой CuI2CuII(S2)S. Селениды и теллуриды меди проявляют металлические свойства, а CuSe2, CuTe2, CuS и CuS2 при низких температурах являются сверхпроводниками.
При нагревании меди с галогенами можно синтезировать безводные дифторид, дихлорид и дибромид. Растворы галогенидов меди(II) удобнее получать взаимодействием металла, его оксида, гидроксида или карбоната с соответствующей галогеноводородной кислотой. Из водных растворов всегда выделяются кристаллогидраты.
Растворы галогенидов меди(II) удобнее получать взаимодействием металла, его оксида, гидроксида или карбоната с соответствующей галогеноводородной кислотой. Из водных растворов всегда выделяются кристаллогидраты.
Попытки получить иодид меди(II) приводят к образованию иодида меди(I) CuI:
2Cu2+ + 4I– = 2CuI + I2
При этом раствор и осадок окрашиваются в бурый цвет за счет присутствия иода. Образовавшийся иод можно удалить действием тиосульфат-иона:
I2 + 2SO3S2– = 2I– + S4O62–
Однако при добавлении избытка тиосульфат-иона иодид меди(I) растворяется:
CuI + 2SO3S2– = [Cu(SO3S)2]3– + I–
Точно так же попытки получить цианид меди(II) приводят к образованию CuCN. С другой стороны, с электроотрицательным фтором не удается получить соль меди(I). Три других галогенида меди(I), представляющие собой белые нерастворимые соединения, осаждаются из водных растворов при восстановлении галогенидов меди(II).
В водных растворах бесцветный ион меди(I) очень неустойчив и диспропорционирует
2CuI CuII + Cu(р)
Возможно, причиной этого является размер атома. Ион CuII меньше, чем CuI, и, имея вдвое больший заряд, намного сильнее взаимодействует с водой (теплоты гидратации составляют ~2100 и ~580 кДж моль–1, соответственно). Разница является существенной, так как она перевешивает вторую энергию ионизации для меди. Это делает ион CuII более стабильным в водном растворе (и ионных твердых веществах), чем CuI, несмотря на устойчивую конфигурацию d10 последнего. Тем не менее, CuI может стабилизироваться в соединениях с очень низкой растворимостью или за счет комплексообразования. Комплексы легко образуются в водном растворе при взаимодействии Cu2O с соответствующими лигандами. В водных растворах хлоро- и амминкомплексы меди(I) медленно окисляются кислородом воздуха до соответствующих соединений меди(II).
Катион меди(II), напротив, в водном растворе вполне устойчив. Соли меди(II), в основном, растворимы в воде. Голубой цвет их растворов связан с образованием иона [Cu(H2O)4]2+. Они часто кристаллизуются в виде гидратов. Водные растворы в небольшой степени подвержены гидролизу и из них часто осаждаются основные соли. Основный карбонат есть в природе – это минерал малахит, основные сульфаты и хлориды образуются при атмосферной коррозии меди, а основный ацетат (ярь-медянка) используется в качестве пигмента.
Ярь-медянка известна со времен Плиния Старшего (23–79 н.э.). В русских аптеках ее начали получать в начале 17 в. В зависимости от способа получения она может быть зеленого или голубого цвета. Ею были окрашены стены царских палат в Коломенском в Москве.
Наиболее известную простую соль – пентагидрат сульфата меди(II) CuSO4·5H2O – часто называют медным купоросом. Слово купорос, по-видимому, происходит от латинского Cipri Rosa – роза Кипра. В Росси медный купорос называли синим, кипрским, затем турецким. То, что купорос содержит медь, было впервые установлено в 1644 Ван Гельмонтом. В 1848 Р.Глаубер впервые получил медный купорос из меди и серной кислоты. Сульфат меди широко используется в электролитических процессах, при очистке воды, для защиты растений. Он является исходным веществом для получения многих других соединений меди.
В Росси медный купорос называли синим, кипрским, затем турецким. То, что купорос содержит медь, было впервые установлено в 1644 Ван Гельмонтом. В 1848 Р.Глаубер впервые получил медный купорос из меди и серной кислоты. Сульфат меди широко используется в электролитических процессах, при очистке воды, для защиты растений. Он является исходным веществом для получения многих других соединений меди.
Тетрааммины легко образуются при добавлении аммиака к водным растворам меди(II) до полного растворения первоначально выпавшего осадка. Темно-синие растворы тетраамминов меди растворяют целлюлозу, которую можно вновь осадить при подкислении, что используется в одном из процессов для получения вискозы. Приливание этанола к раствору вызывает осаждение [Cu(NH3)4]SO4·H2O. Перекристаллизация тетраамминов из концентрированного раствора аммиака приводит к образованию фиолетово-синих пентаамминов, однако пятая молекула NH3 легко теряется. Гексааммины можно получить только в жидком аммиаке, и их хранят в атмосфере аммиака.
Медь(II) образует плоско-квадратный комплекс с макроциклическим лигандом фталоцианином. Его производные используются для получения ряда пигментов от синего до зеленого, которые устойчивы вплоть до 500° С и широко используются в чернилах, красках, пластиках и даже в цветных цементах.
Медь имеет важное биологическое значение. Ее окислительно-восстановительные превращения участвуют в различных биохимических процессах растительного и животного мира.
Высшие растения легко переносят сравнительно большое поступление соединений меди из внешней среды, низшие же организмы, наоборот, чрезвычайно чувствительны к этому элементу. Самые незначительные следы соединений меди их уничтожают, поэтому растворы сульфата меди или их смеси с гидроксидом кальция (бордосская жидкость) применяют как противогрибковые средства.
Из представителей животного мира наибольшие количества меди содержатся в телах осьминогов, устриц и других моллюсков. В их крови она играет ту же роль, что железо в крови других животных. В составе белка гемоцианина она участвует в переносе кислорода. Неокисленный гемоцианин бесцветен, а в окисленном состоянии он приобретает голубовато-синюю окраску. Поэтому не зря говорят, что у осьминогов – голубая кровь.
В составе белка гемоцианина она участвует в переносе кислорода. Неокисленный гемоцианин бесцветен, а в окисленном состоянии он приобретает голубовато-синюю окраску. Поэтому не зря говорят, что у осьминогов – голубая кровь.
Организм взрослого человека содержит около 100 мг меди, сосредоточенной, в основном, в белках, только содержание железа и цинка выше. Ежедневная потребность человека в меди составляет около 3–5 мг. Дефицит меди проявляется в анемии, однако избыток меди также опасен для здоровья.
Елена Савинкина
это тело или вещество? свойства меди||year|IMAGESNAMESmed—eto-telo-ili-veshestvo-svojstva-medi/IMAGESNAMES
Приблизительно III тысячелетие до нашей эры считается переходным от камня как основного промышленного вещества к бронзе. Период перестройки принято считать медным веком. Ведь именно это соединение на тот период времени было самым главным в строительстве, в изготовлении предметов быта, посуды и прочих процессах.
sadržaj
- Общая характеристика элемента медь
- Медь – это тело или вещество?
- Простое вещество медь – это цветной металл
- Физические свойства
- Химические свойства
- Области применения
- Сплавы меди и их свойства
- Биологическое значение
На сегодняшний день медь своей актуальности не потеряла и по-прежнему считается очень важным металлом, часто используемым в разных нуждах. Медь – это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.
Медь – это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.
Общая характеристика элемента медь
Как химический элемент, медь имеет свое местоположение в периодической системе. Оно следующее.
- Четвертый большой период, первый ряд.
- Первая группа, побочная подгруппа.
- Порядковый номер 29.
- Атомный вес – 63,546.
- Электронная конфигурация внешнего слоя выражается формулой 3d104s1.
Элемент имеет два стабильных природных изотопа с массовыми числами 63 и 65. Латинское название элемента cuprum, что объясняет его химический символ Cu. В формулах читается как “купрум”, русское наименование – медь.
Медь – это тело или вещество?
Чтобы ответить на данный вопрос, следует для начала определиться с понятиями “вещество” и “тело”. Они изучаются еще на школьных ступенях, так как являются основополагающими. С точки зрения науки химии и физики, веществом считаются все материалы, из которых изготавливаются те или иные предметы. То есть примерами веществ могут служить все химические соединения как органической, так и неорганической природы.
То есть примерами веществ могут служить все химические соединения как органической, так и неорганической природы.
Тело – это сам предмет, который состоит как раз из какого-то вещества. Они могут быть искусственно сконструированы человеком, либо же иметь природное происхождение. Примеры тел: гвозди, окна, пластинки, стол, шкаф, цветочный горшок и прочее.
Чтобы различить эти два понятия, приведем несколько сравнительных примеров.
- Сахар – вещество, леденец на палочке – тело.
- Железо – вещество, гвоздь – тело.
- Окно – тело, стекло – вещество.
Очевидно из этих рассуждений, что на вопрос: “Медь – это тело или вещество?” – ответ однозначен. Это вещество. Вот если речь пойдет о медной пластинке или медном колечке, тогда, безусловно, следует говорить о них как о теле.
С точки зрения химии, медь – это вещество, относящееся к категории металлов. Оно обладает рядом очень ценных свойств, которые лежат в основе широкого использования данного соединения.
Простое вещество медь – это цветной металл
Как мы уже обозначили, медь – металл. Однако не все представители этой группы веществ одинаковы по своим характеристикам. Существуют мягкие и твердые, белые и желтые, красные металлы и прочее. Медь же относится к цветным мягким металлам.
Электронное строение ее атома позволяет точно определить, медь – это металл или неметалл. Ведь на внешнем уровне у нее всего один электрон, это значит, что его она способна легко отдавать, проявляя типичные металлические восстановительные свойства. Следовательно, в том, что она должна относиться к категории именно металлов, сомнений быть не может. Об этом же говорят и физические свойства ее простого вещества.
Физические свойства
Медь – это вещество или тело? Полностью убедиться в правильности ответа можно лишь рассмотрев ее физические свойства. Если мы говорим о данном элементе как о простом веществе, то для него характерен следующий набор свойств.
- Металл красного цвета.

- Мягкий и очень ковкий.
- Отличный теплопроводник и электропроводник.
- Не тугоплавкий, температура плавления составляет 1084,5 0С.
- Плотность составляет 8,9 г/см3.
- В природе встречается в основном в самородном виде.
Таким образом, получается, что медь – это вещество, причем известное с самой древности. На основе нее издревле создаются многие архитектурные сооружения, изготовляется посуда и предметы быта.
Химические свойства
С точки зрения химической активности, медь – это тело или вещество, обладающее низкой способностью к взаимодействию. Существует две основные степени окисления этого элемента, которые он проявляет в соединениях. Это:
- +1;
- +2.
Очень редко можно встретить вещества, в которых данные значения заменяются на +3.
Итак, медь может взаимодействовать с:
- воздухом;
- углекислым газом;
- соляной кислотой и некоторыми другими соединениями только при очень высоких температурах.

Все это объясняется тем, что на поверхности металла формируется защитная оксидная пленка. Именно она предохраняет его от дальнейшего окисления и придает стабильность и малоактивность.
Из простых веществ медь способна взаимодействовать с:
- галогенами;
- селеном;
- цианидами;
- серой.
Часто формирует комплексные соединения либо двойные соли. Практически все сложные соединения данного элемента, кроме оксидов – ядовитые вещества. Те молекулы, которые образует одновалентная медь, легко окисляются до двувалентных представителей.
Области применения
Медь – это смесь или чистое вещество, которое в любом из этих состояний находит широкое применение в промышленности и быту. Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
- Кожевенная промышленность, в которой используются некоторые соли.
- Производство меха и шелка.
- Изготовление удобрений, средств защиты растений от вредителей (медный купорос).

- Сплавы меди находят широкое применение в автомобилестроении.
- Судостроение, авиаконструкции.
- Электротехника, в которой медь используется, благодаря хорошей антикоррозионной устойчивости и высокой электро- и теплопроводности.
- Различное приборостроение.
- Изготовление посуды и бытовых предметов хозяйственного значения.
Очевидно, что несмотря на долгие сотни лет, рассматриваемый металл только укрепил свои позиции и доказал состоятельность и незаменимость в применении.
Сплавы меди и их свойства
Существует много сплавов на основе меди. Она сама отличается высокими техническими характеристиками, так как легко поддается ковке и прокатке, является легкой и достаточно прочной. Однако при добавлении определенных компонентов свойства значительно улучшаются.
В данном случае следует задать вопрос: “Медь – это вещество или физическое тело, когда речь идет о ее сплавах?” Ответ будет такой: это вещество. Все равно она является именно им до тех пор, пока из сплава не будет изготовлено какое-либо физическое тело, то есть определенный продукт.
Какие сплавы меди бывают?
- Практически равное сочетание меди и цинка в одном составе принято называть латунью. Этот сплав отличается высокой прочностью и устойчивостью к химическим воздействиям.
- Оловянистая бронза – сочетание меди и олова.
- Мельхиор – никель и медь в соотношении 20/80 из 100. Используется для изготовления украшений.
- Константан – сочетание никеля, меди и добавка марганца.
Биологическое значение
Не столь важно, медь – это вещество или тело. Значимо другое. Какую роль играет медь в жизни живых организмов? Оказывается, весьма немаловажную. Так, ионы рассматриваемого металла выполняют следующие функции.
- Участвуют в преобразовании ионов железа в гемоглобин.
- Являются активными участниками процессов роста и размножения.
- Позволяют усваиваться аминокислоте тирозину, следовательно влияют на проявление цвета волос, кожи.
Если организм недополучает данный элемент в нужном количестве, то могут возникать неприятные заболевания. Например, анемия, облысение, болезненная худоба и прочее.
Например, анемия, облысение, болезненная худоба и прочее.
Dijelite na društvenim mrežama:
Povezan
Является ли медь элементом? – Techiescientist
Медь представляет собой металл розовато-оранжевого цвета, который встречается в природе в сочетании с другими элементами в виде минералов, таких как малахит, куприт, борнит, азурит и т. д. Однако в природе он также встречается в свободном элементном состоянии. .
Будучи хорошим проводником электричества, медь используется в производстве ряда электроприборов. Также благодаря своему яркому и привлекательному внешнему виду медь используется в производстве украшений и других декоративных изделий.
Натыкались ли вы дома или в другом месте на медные изделия и любовались ими, думая, что за материал в них? Вы думали об этом с точки зрения химии? Или, что еще хуже, вы спрашивали других о его функциях, но не могли получить ответ?
Если это произошло, то не волнуйтесь. Techiescientist здесь, чтобы решить все ваши вопросы.
Techiescientist здесь, чтобы решить все ваши вопросы.
Итак, продолжайте читать, чтобы узнать больше о меди…
Является ли медь элементом? Да, Медь — элемент. Медь состоит только из одного типа атомов, т. е. атомов меди, которые не могут быть далее разделены. Он указан в периодической таблице в группе 11 и имеет атомный номер 29. Следовательно, медь является элементом.
Что такое элемент?
Элементы – это основные вещества, присутствующие в чистом виде. Они состоят только из атомов одного типа и не могут быть далее разделены ни на какое другое вещество, кроме своих собственных атомов. Например, медь, кислород, фтор и т. д. Основной единицей элемента является атом.
В периодической таблице перечислены все элементы, открытые учеными на данный момент, и они расположены в соответствии с их характеристиками. Элементы со схожими свойствами помещаются в одну группу. Они представлены своими атомарными символами.
В основном элементы делятся на металлы и неметаллы.
Что такое соединение?
Соединения – это вещества, которые образуются при химическом соединении атомов двух или более элементов вместе в определенных соотношениях. Основной единицей соединения является молекула.
Каждое соединение обладает уникальными физическими и химическими свойствами, которые отличаются от любого из соединяющихся атомов.
Свойства соединения изменяются, если соотношение атомов нарушено. Вот почему соединения представлены их химическими формулами.
Например, вода представлена химической формулой H 2 O, что указывает на то, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Медь – атомный номер, массовое число, атомная диаграмма
Медь является элементом 11 группы и 4 периода периодической таблицы. Он принадлежит к элементам D-блока, также известным как переходные металлы. Положение меди в периодической таблице показано ниже:
Информация, которую мы можем извлечь из приведенного выше рисунка:
• Атомный номер меди 29.
• Атомная масса или массовое число меди 63,546
• Атомный символ меди — Cu.
• Электронная конфигурация меди [Ar]3d 10 4с 1 .
Атомная структура меди также может быть построена на основе приведенной выше информации.
Обратите внимание, что количество протонов = количество электронов = атомный номер элемента
В случае меди атомный номер = 29.
Следовательно, количество протонов = количество электронов = 29
Кроме того, Количество нейтронов = Атомная масса (округление до ближайшего целого числа) – Количество протонов
Следовательно, количество нейтронов в меди = 63 – 29= 34
С учетом приведенной выше информации атомная модель меди нарисована ниже:
Следовательно, атом меди состоит из 29 протонов и 34 нейтронов в ядре, а 29 электронов вращаются вокруг ядра в различных оболочках.
Почему медь не является соединением?
Как элементы, так и соединения представляют собой чистые вещества, образованные одним типом повторяющихся единиц, а именно. атомы и молекулы.
атомы и молекулы.
Элементы — это чистейшая форма материи, состоящая только из атомов одного типа. Эти атомы расположены по определенному образцу и считаются основной единицей элемента. Невозможно далее разделить атомы на более простые объекты.
Периодическая таблица содержит список всех 118 элементов и классифицирует элементы на металлы и неметаллы. Элементы в периодической таблице занимают определенные позиции и идентифицируются по их атомным номерам.
Обычно элементы встречаются в природе в сочетании с другими элементами, такими как минералы, а иногда и в своем естественном состоянии. Например, золото, серебро, натрий и т. д.
С другой стороны, соединения представляют собой вещества, образованные сочетанием двух или более типов атомов. Эти атомы объединены в определенном соотношении и связаны химической связью.
Основной единицей соединений является молекула. Можно дополнительно разделить эти молекулы на составляющие их атомы. Однако для этого требуются строгие химические процессы.
Например, молекулу воды можно разделить на водород и кислород, так как она содержит два атома водорода и один атом кислорода.
Медь относится к 11 группе периодической таблицы и помещается наравне с металлами. Он состоит только из атомов меди, которые составляют его основную единицу. Его нельзя далее разделить на какое-либо более простое вещество, и, следовательно, медь можно правильно назвать элементом.
Является ли медь чистым веществом?
Чистые вещества – это виды материи, состоящие только из частиц одного типа, атомов или молекул. Они имеют однородный состав и, таким образом, обладают специфическими физическими и химическими свойствами.
Кроме того, атомы или молекулы внутри чистого вещества всегда расположены определенным образом, т. е. имеют определенную структуру решетки.
Медь состоит только из атомов меди, которые расположены вместе определенным образом. Эти атомы составляют основную единицу меди и расположены в определенной структуре решетки.
Медь также обладает определенными физическими и химическими свойствами. Так как все эти свойства принадлежат чистым веществам, то Медь, безусловно, является чистым веществом.
Является ли медь смесью?
Смесь состоит из двух или более типов атомов или молекул, смешанных вместе в непостоянных соотношениях.
Смешанные атомы или молекулы не соединяются химически и могут быть легко разделены на составляющие их частицы с помощью простых физических процессов.
Определенной схемы расположения составляющих частиц нет. Физические и химические свойства смеси изменяются с изменением доли одной или нескольких составляющих ее частиц.
Смеси можно дополнительно разделить на гомогенные и гетерогенные смеси.
В гомогенных смесях атомы или молекулы распределены равномерно, из-за чего может быть невозможно визуально отличить их друг от друга. Например, соль в воде.
В гетерогенных смесях количество соединяющихся атомов или молекул не является постоянным по всей смеси, а также составляющие ее частицы можно различить визуально. Смесь сахара и соли является примером гетерогенной смеси.
Смесь сахара и соли является примером гетерогенной смеси.
В случае меди присутствует только один тип атомов, которые химически связаны друг с другом и не могут быть разделены с помощью физических процессов.
Более того, эти атомы расположены по определенной схеме, что также обусловливает специфические физико-химические свойства меди.
Похожие темы, которые вы должны прочитать:
Является ли соленая вода соединением
Является ли алмаз элементом Соединение Чистое вещество
Латунь Смесь
Бензин Однородная смесь
Молоко Однородная смесь
Решетчатая структура меди
Структура решетки элемента также известна как его кристаллическая структура. Он состоит из двух компонентов: решетки Браве и атомов.
Решетка Браве — это пространство, в котором предполагается, что атомы расположены. Обычно его рассматривают в виде куба, в котором атомы располагаются на определенных позициях в определенных количествах.
Атомы внутри решетки Браве расположены под определенным углом и на расстоянии друг от друга. Другие параметры внутри этой структуры также остаются постоянными.
Атомы в решетке Браве меди организованы в структуру гранецентрированной кубической решетки.
Это станет легко понять, если вы представите куб с маленькими шариками, размещенными в каждом углу этого куба, а также в центре каждой из его граней.
Здесь куб — это решетка Браве, а шарики — это атомы. Следовательно, гранецентрированная кубическая структура решетки меди выглядит следующим образом:
В приведенной выше структуре красные кружки обозначают атомы меди, расположенные под определенным углом и на определенном расстоянии друг от друга.
Свойства меди
Ниже перечислены несколько важных свойств меди:
• Медь представляет собой металл розовато-оранжевого цвета.
• Это очень хороший проводник тепла и электричества, благодаря чему он используется при изготовлении ряда кухонных принадлежностей и электроприборов.
• Температуры плавления и кипения меди составляют 1083 °C и 2595 °C соответственно.
• Медь устойчива к коррозии, но подвержена потускнению.
• Медь обладает высокой ковкостью и пластичностью.
• Атомы меди расположены в гранецентрированной кубической структуре решетки.
• Медь также используется для борьбы с биообрастанием, а ее противомикробные свойства делают ее идеальной для очистки воды.
Заключение
Медь состоит только из атомов одного типа и занимает определенное положение в периодической таблице. Следовательно, медь является элементом.
Медь является чистым веществом, так как состоит только из атомов одного типа, расположенных в определенном порядке.
Медь не является соединением или смесью, поскольку она не может быть далее разделена на различные атомы ни физическим, ни химическим способом.
Атомы меди расположены в гранецентрированной кубической решетке.
Является ли медь чистым веществом?
Медь или Cu представляет собой химический элемент, встречающийся в природе.
Название «медь» происходит от слова «coper», которое является старым английским названием меди. Медь также происходит от латинского слова «Cyprium aes», что означает «металл с Кипра».
В этой статье мы обсудим, является ли медь чистым веществом или нет.
Далее рассмотрим понятия чистого вещества, смеси, элемента, соединения, гомогенного и гетерогенного вещества.
Итак, медь — это чистое вещество или смесь? Да, медь — чистое вещество, так как медь обладает определенными свойствами. Он состоит только из атомов одного вида. Вещество, имеющее один или несколько атомов в одинаковой пропорции по всему веществу, является чистым веществом.
Это металл d-блока с атомным номером 29. Электронная конфигурация Cu: [Ar] 3s2 3p6 4s1 3d10. Электронная конфигурация отличается от нормальной для достижения стабильной, полностью заполненной конфигурации d10.
Красновато-коричневый цвет, твердое вещество при комнатной температуре. Температура плавления составляет около 1084,2°C.
Наиболее важным источником меди являются такие минералы, как борнит и халькопирит. Медь является одним из важнейших металлов для человеческого организма.
Cu реагирует с кислородом воздуха с образованием оксида меди черного цвета.
Медь была первым металлом, из которого был изготовлен сплав. Медь довольно легко перерабатывается, и почти 70% меди, которую мы используем, было переработано.
Что такое Материя?
Существуют различные определения материи, но здесь изложено самое простое.
Материя — это все, что занимает пространство и имеет массу. Вещество далее классифицируется на твердое, жидкое и газообразное в зависимости от физического состояния вещества.
Аналогичным образом вещество классифицируется на чистые вещества и смеси на основе состава.
В этой статье мы обсудим последнюю классификацию.
Что такое чистое вещество?
Чистые вещества имеют фиксированное значение различных свойств, таких как температура плавления, температура кипения, плотность и т. д. Они состоят только из частиц одного типа.
Все чистые вещества однородны, т. е. их состав остается однородным по всему объему.
Чистые вещества не могут подвергаться дальнейшему расщеплению с образованием различных продуктов. Например] золото, медь, серебро и т. д.
Чистые вещества далее классифицируются как элементы и соединения.
Чистые вещества очень полезны. Они нужны для производства лекарств, приготовления химикатов в промышленных масштабах, для научных целей и поддержания хорошего здоровья человека.
Что такое смесь?
Смеси изготавливаются из чистых веществ. Смеси образуются при физическом соединении двух или более чистых веществ (элементов или соединений).
Они могут быть снова разделены на чистые вещества, используемые для образования смеси, поскольку в них нет химической связи.
При наличии в смеси чистого вещества его свойства сохраняются.
Определенных свойств смеси нет. Их состав изменчив.
Например, поваренную соль и черный перец хранят вместе в миске, соль в воде и т. д.
Смеси далее подразделяются на гомогенные смеси и гетерогенные смеси.
Почему медь является чистым веществом?
Медь является элементом, подпадающим под категорию чистого вещества.
Подобно чистому веществу-
• Cu обладает определенными свойствами, такими как точка кипения, точка плавления и т. д.
• Состав медного элемента остается неизменным, независимо от условий.
• Ни в коем случае нельзя конвертировать во что-то более простое.
Из-за этих свойств медь нельзя считать смесью.
Что такое элемент?
Элемент — это чистая субстанция, которую нельзя разложить ни на что более простое, чем она сама.
Все атомы в элементе одинаковы; у них одинаковое количество протонов в ядрах.
Каждый элемент имеет свои уникальные свойства.
Элемент – основная форма материи или строительные блоки материи.
Например] Cu, Ag, Au и т. д.
Что такое соединение?
Соединение также является чистым веществом. Он образуется путем химического соединения двух или более элементов в фиксированном соотношении по массе.
Их можно разложить на более простые вещества только химическими средствами.
Например, h3O, CuO и т. д.
Является ли медь соединением или элементом?
Медь относится к категории элементов, поскольку медь не может быть подвергнута дальнейшему разложению.
Все атомы в медном элементе имеют 29протонов в ядрах. Медь является строительным материалом для многих соединений меди.
Это не соединение, так как в Cu есть только один тип атома.
Что такое гомогенное вещество?
Вещество, имеющее однородный состав по всему объему, является однородным веществом. Обычно имеет одну фазу.
Например,] смесь соли в воде образует однородный раствор при тщательном перемешивании.
Если вынуть 1 мл этого раствора с любой стороны, он будет иметь тот же состав. Мы не можем отличить соль от воды.
Другими примерами являются золото, серебро, вода и т. д.
Что такое гетерогенное вещество?
Вещество, имеющее неоднородный по объему состав, является гетерогенным веществом. Он имеет более одной фазы.
Например, смесь соли в воде образует негомогенный раствор, если ее тщательно не перемешать. Если мы возьмем 1 мл этого раствора с любой стороны, он не будет иметь тот же состав.
Можно различить твердую соль и воду.
Другими примерами являются смесь соли и перца, песка и шнека и т. д.
Чистые вещества всегда гомогенны, но смеси могут быть гомогенными или гетерогенными.
Однородные смеси, такие как соленая вода в примере, можно легко спутать с чистым веществом.
Является ли медь гомогенным или гетерогенным веществом?
Медь является однородным веществом, так как состав остается однородным по всему объему.
Обычно все элементы и соединения однородны.
Является ли оксид меди чистым веществом?
Да, оксид меди считается чистым веществом.
Оксид меди образуется при взаимодействии меди с кислородом воздуха. Он черного цвета.
Цвет меди со временем темнеет из-за образования CuO на поверхности Cu. CuO имеет фиксированный состав по массе.
Существует химическая связь между Cu и O. CuO может снова превратиться в Cu при обработке газообразным водородом.
Это не может быть элемент, потому что в образце CuO имеется более одного типа ядер. Это не может быть смесь, потому что между Cu и O образуется химическая связь.
Это соединение, потому что два элемента присутствуют в фиксированной массовой пропорции. Соединение – это чистое вещество.
Соединение – это чистое вещество.
Свойства меди
Физические свойства
• Ковкость – можно ковать в тонкие листы без разрушения.
• Ductile- можно втягивать в провода.
• Звонкий- при сильном ударе издает звонкий звук.
• Lustrous- свежая поверхность меди блестящая. Через некоторое время образуется черный слой CuO, и блеск уменьшается.
• Soft- Легко режется сталью.
• Обладает высокой тепло- и электропроводностью.
• Плотное вещество – медь имеет плотность 8,96 г/см3.
• Биостатический- не позволяет размножаться бактериям.
• Медь обладает хорошей прочностью на растяжение.
• Медь не обладает магнитными свойствами. Я также написал специальную статью об этом. Проверьте магнетизм меди.
Химические свойства
• Соединения меди могут выступать в качестве катализатора в различных реакциях.
Например, CuCl2 катализирует синтез акрилонитрила из ацетилена и цианистого водорода.
• Медь образует различные соединения в состояниях +1 и +2.
• Реагирует с кислородом воздуха в соответствии со следующей реакцией
2Cu + O2 ➔ 2CuO
• Медь зеленеет под воздействием влажного воздуха из-за реакции с водой, углекислым газом и кислородом.
• Медь имеет более низкий восстановительный потенциал, чем водород. Поэтому он не реагирует с кислотами. Проверьте, реагирует ли медь с кислотой.
Использование меди
Медь находит применение в различных областях. Некоторые из них
1. Чистая медь смешивается с другими металлами для образования сплавов, которые обычно используются. • Монеты некоторых стран представляют собой сплавы меди
• Золотые украшения на самом деле представляют собой сплав золота и меди, поскольку золото очень мягкое для использования в качестве драгоценного камня.
• Олово и медь образуют бронзу.
2. Медь часто втягивается в провода и используется в электрическом оборудовании, таком как двигатели, из-за ее свойств пластичности и проводимости.
3. Медь используется в строительстве
• Кровля
• Сантехника
4. В различном промышленном оборудовании, таком как теплообменники, используется медь.
5. Сульфат меди производится из Cu, который используется в качестве
• Сельскохозяйственный яд
• Альгицид при очистке воды.
6. В качестве реактива Фелинга А используется водный раствор сульфата меди.
Используется для различения альдегидов и кетонов. Cu имеет различное применение в лаборатории.
Заключение
Медь — чистое вещество.
Чистые вещества подразделяются на элементы и соединения.
Cu относится к классу элементов.
Чистый Вещества и элементы в большинстве случаев однородны, следовательно, Cu однородна. CuO является чистым веществом и относится к классу соединений.
Cu — очень полезный элемент для промышленности и здоровья человека.
Надеюсь, вам понравилось. Пожалуйста, поделитесь им со своими школьными друзьями. Не стесняйтесь задавать свои вопросы в разделах комментариев.
Спасибо и удачного обучения!
Классификация веществ. Химия пищевых продуктов и кулинария
Материю можно разделить на несколько категорий. Две широкие категории – это чистые вещества (включая элементы и соединения) и смеси (включая гетерогенные смеси или гомогенные смеси).
Чистое вещество имеет постоянный состав. Все образцы чистого вещества имеют одинаковый состав и свойства. Любой образец сахарозы (столового сахара) состоит из 12 атомов углерода, 22 атомов водорода и 11 атомов кислорода. Любой образец сахарозы также имеет одинаковые физические свойства, такие как температура плавления, цвет и сладость, независимо от источника, из которого он выделен.
Любой образец сахарозы также имеет одинаковые физические свойства, такие как температура плавления, цвет и сладость, независимо от источника, из которого он выделен.
Чистые вещества бывают двух видов: элементы и соединения. На сегодняшний день в известной Вселенной насчитывается около 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
Элементы
Чистое вещество, которое нельзя разложить на более простые вещества с помощью физических или химических изменений, является элементом . В качестве примера рассмотрим медный пенни. (Медные пенни, отчеканенные до 1982 года, были чистой медью.) Медный пенни состоит из множества атомов меди. Атом меди нельзя разбить на более мелкие и простые частицы — атом уже является самой маленькой частицей. Поскольку чистая медь состоит из этих неделимых атомов, она классифицируется как элемент.
Медный пенни до 1982 года (слева) содержит примерно 3 × 1022 атомов меди (несколько десятков представлены коричневыми сферами справа), каждый из которых имеет одинаковые химические свойства. (кредит: модификация работы «slgckgc»/Flickr)
(кредит: модификация работы «slgckgc»/Flickr)Некоторые элементы могут быть вам знакомы, например, железо, серебро, золото, сера, кислород, углерод и алюминий. Некоторые из них вы даже можете найти у себя на кухне. Вы не должны быть знакомы со всеми 118 открытыми элементами, и вам определенно не нужно их запоминать! Вам предлагается использовать периодическую таблицу в качестве инструмента на протяжении всего занятия. Если вы не уверены, является ли то или иное вещество элементом, проверьте его название в периодической таблице. Если он изображен в таблице Менделеева, значит, это элемент. Забавный факт: из 118 известных элементов только около 90 встречаются в природе на Земле, и около двух десятков были созданы в лабораториях.
Соединения
Чистое вещество, которое можно разложить путем химического превращения на более простые компоненты (поскольку оно состоит из более чем одного элемента), представляет собой соединение . Соединение состоит из атомов двух или более элементов, объединенных в небольшом, целочисленном отношении. В данном соединении количество атомов каждого из его элементов всегда присутствует в одном и том же соотношении (см. Рисунок ниже для примера).
В данном соединении количество атомов каждого из его элементов всегда присутствует в одном и том же соотношении (см. Рисунок ниже для примера).
Вода — это соединение, состоящее из элементов водорода и кислорода. Вода может быть химически разделена в топливных элементах для получения водорода и кислорода. При нагревании в отсутствие воздуха составная сахароза (столовый сахар) расщепляется на элемент углерод и составную воду. (Начальная стадия этого процесса, когда сахар становится коричневым, известна как карамелизация — это то, что придает характерный сладкий и ореховый вкус карамельным яблокам, карамелизированному луку и карамели). Каждое соединение имеет определенный состав и обладает определенными химическими и физическими свойствами, отличающими его от всех других соединений.
Свойства комбинированных элементов (соединений) отличаются от свойств в свободном или несвязанном состоянии. Например, белый кристаллический сахар (сахароза) представляет собой соединение, полученное в результате химического соединения элемента углерода, который представляет собой черное твердое вещество в одной из его несвязанных форм, и двух элементов, водорода и кислорода, которые в несоединенном состоянии представляют собой бесцветные газы. Свободный натрий, элемент, представляющий собой мягкое, блестящее металлическое твердое вещество, и свободный хлор, элемент, представляющий собой желто-зеленый газ, объединяются с образованием хлорида натрия (поваренной соли) — соединения, представляющего собой белое кристаллическое твердое вещество.
Смесь состоит из двух или более веществ. Смесь может быть смесью элементов, смесью соединений или смесью того и другого. Существует бесчисленное множество способов комбинирования элементов и соединений для образования различных смесей. В смеси отдельные вещества сохраняют свою химическую идентичность. Вещества в смеси могут присутствовать в различных количествах. Например, смесь соли и воды (также известная как рассол) может содержать 5% соли или 20% соли. Еще одним отличительным свойством смесей является то, что вещества в смеси могут быть разделены физическими изменениями, такими как испарение. Чтобы отделить соль от смеси соли и воды, мы просто испарим воду, оставив соль в твердом состоянии.
В смеси отдельные вещества сохраняют свою химическую идентичность. Вещества в смеси могут присутствовать в различных количествах. Например, смесь соли и воды (также известная как рассол) может содержать 5% соли или 20% соли. Еще одним отличительным свойством смесей является то, что вещества в смеси могут быть разделены физическими изменениями, такими как испарение. Чтобы отделить соль от смеси соли и воды, мы просто испарим воду, оставив соль в твердом состоянии.
Гетерогенные смеси
Многие смеси представляют собой очевидные комбинации двух или более веществ, например смесь песка и воды. Такие смеси называются гетерогенными смесями. Гетерогенная смесь — это смесь, состав которой меняется от точки к точке. Итальянская заправка является примером неоднородной смеси. Его состав может варьироваться, потому что он может быть приготовлен из разного количества масла, уксуса и трав. Это не то же самое от точки к точке во всей смеси – одна капля может быть в основном уксусом, тогда как другая капля может быть в основном маслом или травами, потому что масло и уксус разделяются, а травы оседают. Другими примерами неоднородных смесей являются печенье с шоколадной крошкой (мы можем видеть отдельные кусочки шоколада, орехов и теста для печенья) и гранит (мы можем видеть кварц, слюду, полевой шпат и многое другое).
Другими примерами неоднородных смесей являются печенье с шоколадной крошкой (мы можем видеть отдельные кусочки шоколада, орехов и теста для печенья) и гранит (мы можем видеть кварц, слюду, полевой шпат и многое другое).
Гомогенные смеси
В некоторых смесях компоненты настолько тесно связаны, что действуют как единое вещество (хотя это и не так). Смеси с однородным составом называются гомогенными смесями (или растворами) . Однородные смеси выглядят визуально одинаковыми на всем протяжении. Примером однородной смеси (или раствора) является спортивный напиток, состоящий из воды, сахара, красителя, ароматизатора и электролитов, смешанных однородно. Каждая капля спортивного напитка имеет одинаковый вкус, потому что каждая капля содержит одинаковое количество воды, сахара и других компонентов. Обратите внимание, что состав спортивного напитка может быть разным: он может содержать больше или меньше сахара, ароматизаторов или других компонентов и при этом оставаться спортивным напитком. Другие примеры гомогенных смесей включают кленовый сироп, бензин и раствор соли в воде. Металлический сплав, такой как сталь, является примером твердой однородной смеси. Воздух, смесь в основном азота и кислорода, представляет собой газообразную гомогенную смесь.
Другие примеры гомогенных смесей включают кленовый сироп, бензин и раствор соли в воде. Металлический сплав, такой как сталь, является примером твердой однородной смеси. Воздух, смесь в основном азота и кислорода, представляет собой газообразную гомогенную смесь.
Краткое изложение того, как различать различные основные Классификация материи показана на следующем рисунке:
В зависимости от своих свойств данное вещество может быть классифицировано как гомогенная смесь, гетерогенная смесь, соединение или элемент.Специальная секция Производство морской соли – разделение смесей путем физического изменения
Морская соль добывается в больших мелких прудах, называемых соляными садами. Морская соль отделяется от смеси соленой воды с помощью простого физического изменения – испарения. Солнечное тепло медленно испаряет воду из мелких прудов соляного сада. Соленую воду перемещают из одного пруда в другой до тех пор, пока кристаллы соли не станут прозрачными, а вода не испарится. Затем соль очищают, полностью сушат, измельчают, просеивают и сортируют. Соляные сады можно найти в странах, чей сухой и теплый климат способствует ускорению процесса испарения.]
Морская соль отделяется от смеси соленой воды с помощью простого физического изменения – испарения. Солнечное тепло медленно испаряет воду из мелких прудов соляного сада. Соленую воду перемещают из одного пруда в другой до тех пор, пока кристаллы соли не станут прозрачными, а вода не испарится. Затем соль очищают, полностью сушат, измельчают, просеивают и сортируют. Соляные сады можно найти в странах, чей сухой и теплый климат способствует ускорению процесса испарения.]
Атрибуция
Эта страница основана на публикации «Chemistry 2e» Пола Флауэрса, Клауса Теопольда, Ричарда Лэнгли, Уильяма Р. Робинсона, доктора философии, Openstax под лицензией CC BY 4.0. Бесплатный доступ на https://openstax.org/books/chemistry-2e/pages/1-introduction
.Эта страница основана на статье «Кулинарная химия» Сорангеля Родригеса-Веласкеса под лицензией CC BY-NC-SA 4.0. Бесплатный доступ на http://chemofcooking.openbooks.wpengine.com/
Эта страница основана на «Основах общей, органической и биологической химии» Дэвида В. Болла, Джона У. Хилла, Ронды Дж. Скотт, Сейлор, лицензия CC BY-NC-SA 4.0. Бесплатный доступ по адресу http://saylordotorg.github.io/text_the-basics-of-general-organic-and-biological-chemistry/index.html
Болла, Джона У. Хилла, Ронды Дж. Скотт, Сейлор, лицензия CC BY-NC-SA 4.0. Бесплатный доступ по адресу http://saylordotorg.github.io/text_the-basics-of-general-organic-and-biological-chemistry/index.html
Chemguide: Core Chemistry 14–16 Элементы, соединения и смеси На этой странице объясняется разница между элементом и соединением, а также чем они оба отличаются от смесей. Это также позволяет быстро взглянуть на Периодическую таблицу — действительно важный инструмент в химии. Элементы Что такое элемент? Я собираюсь включить некоторые химические формулы в то, что будет дальше. Не беспокойтесь об этом, если вы еще не работали с символами. Они здесь только для того, чтобы проиллюстрировать сложность различных веществ. Cu — обозначение меди; остальные достаточно очевидны. Если нагреть голубые кристаллы нитрата меди(II), Cu(NO 3 ) 2 ,3H 2 O, произойдет химическое изменение, и он превратится в черный оксид меди(II), CuO, выделяющийся диоксид азота, кислород и пар в процессе. Оксид меди(II), очевидно, является более простым веществом, чем нитрат меди(II). Если вы пропускаете водород над горячим оксидом меди (II), водород удаляет кислород и оставляет розовато-коричневую медь Cu. Опять же, медь – более простое вещество, чем оксид меди (II). Но ничего нельзя сделать химически, чтобы превратить медь во что-то еще более простое. Медь — это элемент. Элементы — это вещества, которые не могут быть разделены химическим путем на что-либо более простое. Периодическая таблица В Периодической таблице перечислены все известные элементы в определенном порядке, о котором мы поговорим через минуту. Я упростил его, исключив элементы, с которыми вы вряд ли столкнетесь на этом уровне. | |
Примечание: Вам действительно нужна полноразмерная бумажная копия Периодической таблицы, которую вы сможете легко читать. Вы найдете простую периодическую таблицу, которую вы можете скачать с этого сайта. Здесь нет всех недавно обнаруженных элементов, но их больше, чем вам когда-либо понадобится на этом уровне. | |
Итак. . . если что-то появляется в полной версии Периодической таблицы, это элемент; иначе это не так. Элементы и атомы Если бы у вас было немного меди и вы попытались бы нарезать ее на все более и более мелкие кусочки, в конечном итоге вы бы получили наименьший возможный кусок меди. В этот момент у вас будет отдельный атом меди. Сами атомы состоят из еще более мелких частиц (протонов, нейтронов и электронов), но если вы разделите атом меди на них, у вас больше не будет меди. И в любом случае нельзя расщеплять атомы химическим путем. Протоны и нейтроны находятся вместе в ядре в центре атома и составляют большую часть массы атома. Электроны окружают ядро на относительно больших расстояниях. Атомный номер (число протонов) Количество протонов в атоме известно как атомный номер или номер протона . Если вы посмотрите на Таблицу Менделеева выше, маленькие цифры в каждой ячейке — это атомные номера элементов. Периодическая таблица расположена в порядке возрастания атомных номеров. Действительно важно то, что количество протонов определяет, что такое атом. Например, если атом имеет 8 протонов, это атом кислорода, а каждый атом кислорода содержит 8 протонов. Более полное определение элемента Элементы — это вещества, которые не могут быть разделены химическим путем на что-либо более простое. (Мы уже говорили об этом.) Вещество является элементом, если все присутствующие атомы имеют одинаковый атомный номер. Некоторые примеры элементов В моделях или схемах Если все атомы в модели или диаграмме имеют одинаковый размер и цвет, то мы предполагаем, что все они одинаковы — у них одинаковый атомный номер. Если все присутствующее имеет одинаковый атомный номер, то это элемент. Неважно, как расположены атомы, поодиночке, парами или большими неопределенными группами — если они все одинакового размера и цвета, то на диаграмме изображен элемент. Примеры, когда атомы находятся в небольших четко определенных группах | |
Примечание: Для удобства рисования все частицы выше представлены не в масштабе. Отдельные атомы серы, например, больше, чем атомы кислорода. Упаковка в твердой сере также не точна и предполагает, что частицы плотно упакованы друг с другом. Упаковка блоков S 8 на самом деле очень сложна, и ее трудно понять по единственной схеме, которую я смог найти.  | |
Еще одно важное слово: молекула . На приведенных выше диаграммах два атома кислорода, соединенные вместе, образуют молекулу кислорода. Восемь атомов серы образуют молекулу серы. Молекула представляет собой электрически нейтральную частицу, состоящую из фиксированного числа атомов, химически связанных друг с другом. Если все атомы в молекуле имеют одинаковый атомный номер, то вещество является элементом. Если они имеют разные атомные номера, то это соединение (см. ниже). Примеры больших неопределенных групп – гигантские структуры Металлы, такие как медь, не имеют фиксированного числа атомов в своей структуре. Вы можете отломать кусочки, и у вас останутся только кусочки меди поменьше. На диаграмме показан идеализированный кусочек меди. В реальности будут перекосы в структуре, где все не так аккуратно выстраивается. Но важно то, что если все атомы одинаковы (как здесь), то это элемент. Алмаз — еще одна гигантская структура, на этот раз состоящая из атомов углерода, и на диаграмме показана очень малая ее часть. На диаграмме показаны связи, соединяющие атомы углерода — в действительности все атомы углерода соприкасаются со своими ближайшими соседями. Практически невозможно нарисовать полезную диаграмму структуры алмаза, не разделив таким образом атомы. Каждый атом углерода присоединен к четырем другим, продолжаясь на огромное количество атомов. На диаграмме вы не должны предполагать, что некоторые атомы углерода имеют только две связи — у них их четыре, но для простоты две другие не показаны. Опять же, присутствует только один тип атома, и поэтому это элемент. Примеры элементов в химических формулах Если формула содержит только один вид символов, то это элемент. Например, формулы Ar, H 2 , O 2 , P 4 , S 8 , C и Cu содержат символы одного типа. Если он содержит более одного символа, то он не является элементом. Например, формулы NaCl, H 2 O, NH 3 , C 3 H 8 содержат более одного типа атомов, поэтому не являются элементами. На самом деле все это соединения, и мы как раз собираемся взглянуть на них. Соединения Что такое соединение? Соединение состоит из двух или более различных элементов, химически соединенных друг с другом. Некоторые соединения состоят из молекул, где определенное фиксированное число атомов связано друг с другом. Другие состоят из гигантских структур, содержащих огромные, но переменные числа. Примеры соединений, содержащих молекулы Вода, H 2 O, является простым примером соединения. Он состоит из двух атомов водорода и одного атома кислорода, объединенных вместе, и так всегда. Существует еще одно соединение водорода и кислорода, называемое перекисью водорода, H 2 O 2 , но оно химически сильно отличается от воды. Еще два простых соединения, также включающие атомы водорода, — это аммиак и пропан. На самом деле существует огромное количество других соединений углерода и водорода. Пример соединения, содержащего гигантскую структуру Поваренная соль, хлорид натрия, NaCl, является хорошим примером соединения, которое состоит из гигантской структуры. На самом деле хлорид натрия не содержит простых атомов натрия и хлора, а вместо этого содержит натрий и хлорид ионы . Ионы – это атомы или группы атомов, которые приобрели электрический заряд. В этом случае натрий образует положительный ион Na + , а хлор образует отрицательный ион Cl – . | |
Примечание: Когда хлор представляет собой простой атом или молекулу Cl 2 , его называют просто хлором.  Когда он находится в соединении, таком как хлорид натрия или хлористый водород, название меняется на хлорид. Когда он находится в соединении, таком как хлорид натрия или хлористый водород, название меняется на хлорид. | |
Хлорид натрия удерживается вместе за счет притяжения между положительными и отрицательными ионами. На диаграмме показана небольшая часть гигантской структуры, которая просто продолжает двигаться во всех трех направлениях, пока не достигнет края, где вы немного оторвались. Каким бы большим ни был кристалл соли, соотношение ионов натрия и хлорида всегда составляет 1:1. Смеси Кристаллы нитрата меди(II) в сравнении со смесью его элементов Вверху этой страницы я говорил о голубых кристаллах нитрата меди(II), Cu(NO 3 ) 2 ,3H 2 O. Это соединение состоит из меди, азота, кислорода и водорода. . Они присутствуют в фиксированных пропорциях, показанных в формуле. А теперь представьте, как будет выглядеть смесь меди, азота, кислорода и водорода. Чистая медь — розовато-коричневый металл, а все остальное — бесцветные газы: это не имеет ничего общего с соединением на картинке. И если бы у вас была эта смесь, то пропорции могли быть любые. Вытащить медь из смеси, конечно, было бы тривиально – можно было просто подобрать! И хотя это не совсем возможно в школьной лаборатории, вы можете отделить все газы, просто охладив их. Кислород превращается в жидкость при -183°C, а азот становится жидким при -196°C. Это просто оставило бы водород в виде газа, который не сжижается до -253°C. В основном таким образом разделяются отдельные газы, из которых состоит воздух. Попытка получить все отдельные элементы из кристаллов нитрата меди(II) была бы чем-то вроде кошмара! В начале страницы я предложил, как можно превратить нитрат меди(II) в медь. Часть присутствующего кислорода выделяется в виде газа при нагревании кристаллов, но остальная часть по-прежнему связана с азотом (в виде диоксида азота) и водородом (в виде пара). Разделение смесей обычно можно осуществить физическими средствами — нагреванием, охлаждением, растворением в воде или каком-либо другом растворителе, с помощью магнита, если один из них магнитный, и т. д. После того, как элементы объединены в соединение, вы можете разделить их только с помощью химических реакций. Смесь водорода и кислорода по сравнению с ее составной водой, H 2 O Смесь, конечно, может присутствовать в любых пропорциях, и просто будет видна как бесцветный газ. Вода представляет собой бесцветную жидкость, и ее молекулы всегда содержат два атома водорода и один атом кислорода. Вы можете разделить смесь водорода и кислорода, как описано выше, достаточно охладив ее. Но разделить воду на водород и кислород можно только химическим путем — в данном случае с помощью электролиза, который мы подробно рассмотрим далее в курсе. И химические свойства смеси полностью отличаются от соединения. Представьте себе, что смесь водорода и кислорода зажигают пламенем — вы получите значительный взрыв, когда они вступят в реакцию с образованием воды. Поместите пламя в воду, и оно просто погаснет. На YouTube есть замечательное видео, показывающее, что произойдет, если зажечь большой воздушный шар, содержащий водородно-кислородную смесь в правильных пропорциях.
© Джим Кларк 2018 | |
Соединения и элементы — разница и сравнение
Элементы и соединения представляют собой чистые химические вещества, встречающиеся в природе. Разница между элементом и соединением состоит в том, что элемент представляет собой вещество, состоящее из атомов одного типа, тогда как соединение состоит из различных элементов в определенных пропорциях. Примеры элементов включают железо, медь, водород и кислород. Примеры соединений включают воду (H 2 O) и соль (хлорид натрия – NaCl).
Разница между элементом и соединением состоит в том, что элемент представляет собой вещество, состоящее из атомов одного типа, тогда как соединение состоит из различных элементов в определенных пропорциях. Примеры элементов включают железо, медь, водород и кислород. Примеры соединений включают воду (H 2 O) и соль (хлорид натрия – NaCl).
Элементы перечислены в соответствии с их атомным номером в периодической таблице. Среди 117 известных элементов 94 встречаются в природе, такие как углерод, кислород, водород и т. д. 22 созданы искусственно, претерпев радиоактивные изменения. Причиной этого является их нестабильность, из-за которой они подвергаются радиоактивному распаду в течение определенного периода времени с образованием новых элементов в процессе, таких как уран, торий, висмут и т. д. Элементы объединяются в фиксированных соотношениях и образуют стабильные соединения благодаря химическим связям. которые облегчают образование соединений.
Сравнительная таблица
| Соединение | Элемент | |
|---|---|---|
| Определение | Соединение содержит атомы различных элементов, химически объединенных вместе в фиксированном соотношении. | Элемент — это чистое химическое вещество, состоящее из атомов того же типа. |
| Состав | Соединения содержат различные элементы в фиксированном соотношении, расположенные определенным образом посредством химических связей. Они содержат только один тип молекулы. Элементы, входящие в состав соединения, химически связаны. | Элементы содержат только один тип атома. Каждый атом имеет одинаковый атомный номер, то есть одинаковое количество протонов в ядре. |
| Способность к разрушению | Соединение можно разделить на более простые вещества с помощью химических методов/реакций. | Элементы не могут быть разделены на более простые вещества с помощью химических реакций. |
| Представление | Соединение представляется с использованием его химической формулы, которая представляет собой символы составляющих его элементов и число атомов каждого элемента в одной молекуле соединения. | Элемент представлен с помощью символов. |
| Типы | Можно создать огромное, практически безграничное количество химических соединений. Соединения подразделяются на молекулярные соединения, ионные соединения, интерметаллические соединения и комплексы. | Наблюдено около 117 элементов. Могут быть классифицированы как металлические, неметаллические или металлоидные. |
| Примеры | Вода (h3O), хлорид натрия (NaCl), бикарбонат натрия (NaHCO3) и соляная кислота (HCl) являются примерами соединений. | Водород (H), кислород (O), натрий (Na), хлор (Cl), углерод (C), железо (Fe), медь (Cu), серебро (Ag) и золото (Au) являются примерами элементов. . |
Различия в свойствах
Элементы различаются по названию, символу, атомному номеру, температуре плавления, температуре кипения, плотности и энергии ионизации. В Периодической таблице элементы располагаются в соответствии с их атомным номером, и они сгруппированы в соответствии с аналогичными химическими свойствами и изображаются их символами.
- Атомный номер – атомный номер обозначается буквой Z и представляет собой количество протонов, присутствующих в ядре атома элемента. Например, углерод имеет 6 протонов в своем ядре, а для углерода Z = 6. Количество протонов также указывает на электрический заряд или количество электронов, присутствующих в ядре, которое определяет химические свойства элемента.
- Атомная масса – буква А обозначает атомную массу элемента, которая представляет собой общее количество протонов и нейтронов в ядре атома элемента.
 Изотопы одних и тех же элементов различаются атомными массами.
Изотопы одних и тех же элементов различаются атомными массами. - Изотопы – изотопы элемента имеют одинаковое количество протонов в ядре, но отличаются количеством нейтронов. Встречающиеся в природе элементы имеют более одного стабильного изотопа. Таким образом, изотопы имеют сходные химические свойства (из-за одинакового количества протонов), но разные ядерные свойства (из-за разного количества нейтронов). Например, углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14.
- Аллотропы – атомы элемента могут образовывать связи друг с другом более чем одним способом, что приводит к различиям в их химических свойствах. Например, углерод связывается в тетраэдр, образуя алмаз, а слои шестиугольников углерода образуют графит.
Соединения состоят из различных элементов в фиксированной пропорции. Например, 1 атом натрия (Na) соединяется с 1 атомом хлора (Cl) с образованием одной молекулы соединения хлорида натрия (NaCl). Элементы в соединении не всегда сохраняют свои первоначальные свойства и не могут быть разделены физическими средствами. Объединению элементов способствует их валентность. Валентность определяется как количество необходимых атомов водорода, которые могут соединиться с атомом элемента, образующего соединение. Большинство соединений могут существовать в твердом состоянии (достаточно низкие температуры) и могут разлагаться при нагревании. Иногда посторонние элементы задерживаются внутри кристаллической структуры соединений, придавая им неоднородную структуру. Соединения изображаются по их химической формуле, которая соответствует системе Хилла, в которой атомы углерода перечислены первыми, за которыми следуют атомы водорода, после чего элементы перечислены в алфавитном порядке.
Элементы в соединении не всегда сохраняют свои первоначальные свойства и не могут быть разделены физическими средствами. Объединению элементов способствует их валентность. Валентность определяется как количество необходимых атомов водорода, которые могут соединиться с атомом элемента, образующего соединение. Большинство соединений могут существовать в твердом состоянии (достаточно низкие температуры) и могут разлагаться при нагревании. Иногда посторонние элементы задерживаются внутри кристаллической структуры соединений, придавая им неоднородную структуру. Соединения изображаются по их химической формуле, которая соответствует системе Хилла, в которой атомы углерода перечислены первыми, за которыми следуют атомы водорода, после чего элементы перечислены в алфавитном порядке.
Визуализация различий
На этом рисунке показаны различия между элементами и соединениями на атомарном уровне. Элементы имеют только 1 тип атомов; соединения имеют более 1. Элементы и соединения являются веществами; они отличаются от смесей, в которых разные вещества смешиваются друг с другом, но не посредством атомных связей.
Визуализация различий между элементами, соединениями и смесями, как гомогенными, так и гетерогенными.
История элементов и соединений
Элементы изначально использовались для обозначения любого состояния материи, такого как жидкость, газ, воздух, твердое тело и т. д. Индийские, японские и греческие традиции относятся к пяти элементам, а именно: воздуху, воде, земле, огню и эфиру. Аристотель концептуализировал новый пятый элемент, названный «квинтэссенцией», который, по-видимому, сформировал небеса. По мере продолжения исследований многие выдающиеся ученые проложили путь к современному пониманию и описанию элементов. Среди них особенно выделяются работы Роберта Бойля, Антуана Лавуазье, Дмитрия Менделеева. Лавуазье первым составил список химических элементов, а Менделеев первым расположил элементы в соответствии с их атомными номерами в периодической таблице. Самое современное определение элемента дано в исследованиях, проведенных Генри Мозли, в которых говорится, что атомный номер атома физически выражается зарядом его ядра.
До 1800-х годов использование термина соединение также могло означать смесь. Именно в 19 веке значение соединения можно было отличить от смеси. Такие алхимики, как Джозеф Луи Пруст, Дальтон и Бертолле, и их исследования различных соединений дали современной химии нынешнее определение соединения. Работа Пруста продемонстрировала миру химии, что соединения состоят из постоянного состава соответствующих элементов.
Номер CAS
Каждое химическое вещество идентифицируется своим уникальным числовым идентификатором – номером CAS (Службы химических рефератов). Следовательно, каждое химическое соединение и элемент имеют номер CAS. Это делает поиск элементов и соединений в базе данных более удобным.
Ссылки
- Химический элемент – Википедия
- Химическое соединение – Википедия
- Подписаться
- Поделиться
- Укажите
- Авторов
Поделитесь этим сравнением:
Если вы дочитали до этого места, подписывайтесь на нас:
«Соединение против элемента». Diffen.com. Diffen LLC, н.д. Веб. 7 сентября 2022 г. < >
Diffen.com. Diffen LLC, н.д. Веб. 7 сентября 2022 г. < >
Лавуазье
Лавуазье из Элементы химии Эдинбургское издание 1790 г., стр. 175–178 [из Дэвида М. Найта, изд., Classical Scientific Papers — Chemistry, Second Series , 1970]ТАБЛИЦА ПРОСТЫХ ВЕЩЕСТВ.
Простые субстанции, принадлежащие ко всем царствам природы, которые можно рассматривать как элементы тел.
| Новые имена. | Соответствующие старые имена. |
|---|---|
| Светлый | Светлый. |
| Калорийность | Жар. |
| Принцип или элемент тепла. | |
| Огонь. Магматическая жидкость. | |
| Материя огня и тепла. | |
| Кислород | Дефольгированный воздух. |
| Небесный воздух. | |
| Витальный воздух или | |
База жизненного воздуха. | |
| Азот | Флогистированный воздух или газ. |
| Мефитис или его основа. | |
| Водород | Воспламеняющийся воздух или газ, |
| или основание горючего воздуха. |
Окисляемые и подкисляемые простые вещества, не являющиеся металлическими.
| Новые имена. | Соответствующие старые имена. |
|---|---|
| Сера | Те же названия. |
| Фосфор | |
| Древесный уголь | |
| Соляной радикал | Пока неизвестно. |
| Фтористый радикал | |
| Борный радикал |
Окисляемые и подкисляемые простые металлические тела.
| Новые имена. | Старые имена корреспондентов. | |
|---|---|---|
| Сурьма | Регул | Сурьма. |
| Мышьяк | ” ” | Мышьяк |
| Висмут | ” ” | Висмут |
| Кобальт | ” ” | кобальт |
| Медь | ” ” | Медь |
| Золото | ” ” | Золото |
| Железо | ” ” | Железо |
| Свинец | ” ” | Свинец |
| Марганец | ” ” | Марганец |
| Меркурий | ” ” | Меркурий |
| Молибден | ” ” | Молибден |
| Никель | ” ” | Никель |
| Платина | ” ” | Платина |
| Серебро | ” ” | Серебро |
| Олово | ” ” | Олово |
| Вольфрам | ” ” | Вольфрам |
| Цинк | ” ” | Цинк |
Солевые простые земляные вещества
Новые имена. | Старые имена корреспондентов. |
|---|---|
| Известь | Мел, известковая земля. |
| Негашеная известь. | |
| Магнезия | Магнезия, основа английской соли. |
| Магнезия кальцинированная или каустическая. | |
| Барит | Барит или тяжелая земля. |
| Аргилл | Глина, земля квасцов. |
| Silex | Кремнистая или стекловидная земля. |
РАЗДЕЛ. I.–
Наблюдения над таблицей простых веществ. Основной целью химических экспериментов является разложение природных тел, чтобы по отдельности исследовать различные вещества, входящие в их состав. сочинение. Консультируясь с химическими системами, можно обнаружить, что это наука о химическом анализе сделала быстрый прогресс в наше время. Раньше нефть и соль считались элементами тел, а позже наблюдение и опыт показали, что все соли не только простые, состоят из кислоты, соединенной с основанием. Границы анализа были
значительно расширен современными открытиями*; кислоты
показано, что он состоит из кислорода, как подкисляющего принципа, общего для всех,
объединены в каждом к определенному основанию. Я доказал то, что имел г-н Хассенфрац.
раньше выдвигали, что эти радикалы кислот не все простые элементы,
многие из них, подобно маслянистому принципу, состоят из водорода и
древесный уголь. Даже основания нейтральных солей были доказаны г-ном Бертолле.
быть соединениями, так как он показал, что аммиак состоит из азота и
водород.
Границы анализа были
значительно расширен современными открытиями*; кислоты
показано, что он состоит из кислорода, как подкисляющего принципа, общего для всех,
объединены в каждом к определенному основанию. Я доказал то, что имел г-н Хассенфрац.
раньше выдвигали, что эти радикалы кислот не все простые элементы,
многие из них, подобно маслянистому принципу, состоят из водорода и
древесный уголь. Даже основания нейтральных солей были доказаны г-ном Бертолле.
быть соединениями, так как он показал, что аммиак состоит из азота и
водород. Таким образом, по мере того, как химия движется к совершенству, разделяя и подразделяя, невозможно сказать, где она должна закончиться; и то, что мы в настоящее время считаем простым, вскоре может оказаться совершенно иным. Все, что мы смеем утверждать о каком-либо веществе, это то, что оно должно считаться простым при нынешнем состоянии наших знаний и в той мере, в какой до сих пор был в состоянии показать химический анализ. Можно даже предположить, что вскоре земли должны перестать считаться простыми телами; это единственные тела класса, пригодного для продажи, которые не имеют склонности к соединению с кислородом; и я очень склонен полагать, что это происходит от того, что они уже насыщены этим элементом.


 2 Современные способы добычи
2 Современные способы добычи 5 Соединения меди(III) и меди(IV)
5 Соединения меди(III) и меди(IV)