Медь щелочной металл или нет: общая характеристика, строение; свойства и получение простых веществ — урок. Химия, 9 класс.
alexxlab | 27.05.2023 | 0 | Разное
Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Режим работы и обучения
Студенту
Информация для студентов очной и заочной формы обученияЦентр дополнительного образования и профориентационной работы
Факультет последипломного образования
Информация о вузе
Информация о ПМФИВиртуальный кабинет психологической помощи
О приеме заявлений о зачислении в порядке перевода от граждан РФ, Украины, Донецкой и Луганской народных республик
Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВO ВолгГМУ Минздрава России осуществляет прием заявлений о зачислении в порядке перевода от граждан Российской Федерации, а также от граждан Украины, Донецкой и Луганской народных республик, вынужденно покинувших территорию республик и прибывших на территорию Российской Федерации, изъявивших желание перевестись для обучения в ПМФИ.
Перевод осуществляется на программы, реализуемые в ПМФИ, в соответствии с действующим законодательством, Положениями и Уставом ВолгГМУ.
Заявления о переводе принимаются ежедневно с 9:00 до 17:00 (выходные дни: суббота, воскресенье).
Ответственные сотрудники за прием заявлений о переводе:
ЧАХИРОВА Виктория Анатольевна, начальник учебного отдела
Тел. +7 (906) 460-09-80
e-mail: [email protected]
Дирекция ПМФИ
Центр дополнительного образования и профориентационной работы
Повышение квалификации
- Для педагогических работников
Профессиональная переподготовка
- Для педагогических работников
ПМФИ в: Youtube Instagram Вконтакте
Юбилей ПМФИ — 75
СЛОВО ДИРЕКТОРА
О ВУЗЕ
Пятигорский медико-фармацевтический институт, как правопреемник Пятигорской государственной фармацевтической академии, является признанным лидером фармацевтического образования России. Авторитет вуза признан не только в России, но и за её пределами.
Авторитет вуза признан не только в России, но и за её пределами.
Ахвердова Ольга Альбертовна
Директор, доктор психологических наук, кандидат медицинских наук
Подробнее о вузе
Виртуальный кабинет психологической помощи
Очные психологические консультации (с использованием дистанционных технологий)
Время работы: пятница с 18:00 — 20:00 (платформа VooVMeeting)
Психолог invites you to a meeting on VooVMeeting
Meeting Topic: Психологическая служба
Meeting Time: 2022/3/18 17:00-19:00 (GMT+03:00) Moscow Standard Time – Moscow Recurrence:Every Fri
Click the link to join the meeting or to add it to your meeting list: https://voovmeeting.com/dm/9LrpICRwUcOT
#VooVMeeting: 818-0338-2767 Meeting Password: 12345
Attendees: Психолог
Заочные психологические консультации
e-mail: ovz@pmedpharm. ru
ru
Подробнее
Дополнительное профессиональное образование медицинских и фармацевтических специалистов
Все программы разработаны в соответствии с требованиями профессиональных стандартов, нормативной базой министерства здравоохранения и министерства образования Российской Федерации.
Для специалистов с высшим и средним профессиональным фармацевтическим и медицинским образованием:
- Провизоров;
- Фармацевтов;
- Врачей;
- Среднего медицинского персонала;
Больше информации
Новости
Читать все
В ПМФИ состоялось собрание полуфиналистов Олимпиады “Я-профессионал”
2 марта 2023
Современные тренды и прогнозы развития искусственного интеллекта
2 марта 2023
Первенство города Пятигорска по гиревому спорту
28 февраля 2023
Студенты ПМФИ приняли участие в международном брифинге
28 февраля 2023
В ПМФИ прошёл концерт, посвящённый 23 февраля
22 февраля 2023
Директор ПМФИ поздравляет сотрудников с 23 февраля
22 февраля 2023
Расписание он-лайн
Уточните курс и группу для просмотра актуального расписания.
Посмотреть расписание
Материалы
Доступ к методическим,
консультационным и справочным
материалам, лекциям, тестовым
заданиям.
Узнать больше
Галерея Посмотреть фотографии
Кафедры и подразделения
Учебный процесс в вузе осуществляется на 27 кафедрах
и в 41 подразделении.
Узнать больше
Сайт олимпиады ЖМИ здесь и участвуй!
ПМФИ — Соорганизатор направления «Фармация», материалы
Главный корпус ПМФИ –
Пятигорского филиала ФГБОУ ВО ВолгГМУ
Минздрава России
Объявления
Важно
Летняя онлайн языковая школа в Центре мировых языков и культур
26 мая 2022
Важно
Летняя профильная школа Юного провизора Пятигорского медико-фармацевтического института начнет свою работу в июне
23 мая 2022
Важно
Собеседование на восстановление по специальности “Фармация”, “Стоматология”, “Лечебное дело”, “Медицинская биохимия”, будет проходить 30 августа 2021 г. на кафедрах
на кафедрах
6 июля 2021
Читать все
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ “О введение в действие новой редакции Устава и изменении наименования Университета” с 13.07.2016 г. в связи с переименованием Университета считать:
№1029-КМ “О введение в действие новой редакции Устава и изменении наименования Университета” с 13.07.2016 г. в связи с переименованием Университета считать:
– полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
– сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
– полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
– сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.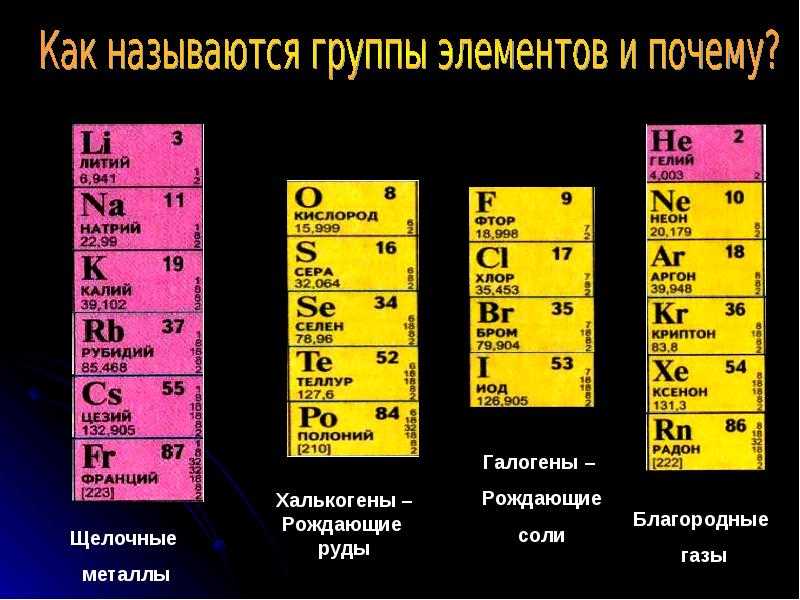 07.2016.
07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
ТОП-20 самых легких металлов
К легким причисляют металлы, плотность которых колеблется в диапазоне 5-7,5 граммов на кубический сантиметр. Еще один определяющий показатель — атомный вес. Легкие металлы задействованы в фармацевтической, энергетической, автомобильной, авиакосмической и других отраслях промышленности, в металлургии, строительной сфере и медицине. Они составляют 20 % от массы земной коры. ТОП-20 самых легких металлов во вселенной собраны в нашем перечне.
Литий
Это самый легкий металл из существующих в мире. Он выделяется серебристо-белым окрасом, предельно низким атомным весом и плотностью, которая в два раза меньше, нежели у воды. Пластичный литий имеет тридцать минералов, два изотопа природного происхождения. Температура плавления щелочного металла составляет +180,5 градуса Цельсия.
Литий — уникальный элемент, который всплывает на поверхности керосина. Он редко эксплуатируется в чистом виде, поскольку очень активен, легко вступает в реакции с окружающей средой. Это токсичный металл, поэтому в быту не применяется, но подходит для создания пиротехники, используется в роли окислителя, в пищевой промышленности, электронике, при производстве аккумуляторов, смартфонов, электромобилей. Литий в сорок раз меньше весит, чем иридий и осмий. Он был открыт в 1817 году шведским ученым — выделен из природного петалита.
Он редко эксплуатируется в чистом виде, поскольку очень активен, легко вступает в реакции с окружающей средой. Это токсичный металл, поэтому в быту не применяется, но подходит для создания пиротехники, используется в роли окислителя, в пищевой промышленности, электронике, при производстве аккумуляторов, смартфонов, электромобилей. Литий в сорок раз меньше весит, чем иридий и осмий. Он был открыт в 1817 году шведским ученым — выделен из природного петалита.
Калий
Вторую строчку в ТОПе занимает калий. Это мягкий щелочной металл. В природе он обнаруживается исключительно в химических соединениях — в морской воде. Калий реактивно окисляется при попадании на воздух. Его открыли в 1807 году — выделили путем электролиза. К свойствам его относятся:
- температура плавления +63,6 градуса;
- температура кипения +773 градуса;
- высокая химическая активность — калий является сильнейшим восстановителем.
В жидком виде металл применяется для производства теплоносителей. Важнейший биогенный элемент используется при изготовлении удобрений, в гальванотехнике.
Важнейший биогенный элемент используется при изготовлении удобрений, в гальванотехнике.
Натрий
Это высоко-реактивный металл с бело-серебристым окрасом (относится к категории щелочных). Мягкий натрий без труда режется ножом, блестит на срезе. В природе он содержится в морской воде. На воздухе он легко окисляется до оксида натрия. Этот легкий металл плавится при +97 градусах Цельсия, а кипит — при +882 градусах. Натрий впервые был добыт путем электролиза химиком Хэмфри Дэви в Великобритании.
Этот металл активно эксплуатируется в металлургии, при изготовлении энергоемких аккумуляторов, в создании ядерных реакторов и при анализе органических веществ, в газоразрядных лампах.
Рубидий
Один из самых легких щелочных металлов, с плотностью выше чем у воды. Рубидий имеет серый цвет с белым отливом. Его смогли выделить немецкие химики в 1861 году методом пламенной спектроскопии. Этот металл вступает в химическую реакцию с водой, самовоспламеняется на воздухе, плавится при +39,3 градусах Цельсия.
Рубидий — моноизотопный, радиоактивный элемент. Он занимает 23 ступень по уровню распространенности в земной коре, встречается чаще меди и цинка. Этот металл используется при изготовлении пиротехнической продукции, в ядерной медицине и промышленности. Его эксплуатация важна при производстве паровых турбин, топливных генераторов.
Кальций
Это щелочноземельный металл, легко взаимодействующий с углекислым газом и кислородом. Кальций имеет серую тусклую поверхность со светло-желтым оттенком. Получают его путем электролиза или алюминотермии. Природный калий состоит из трех изотопов. По степени распространенности элементов в земной коре он занимает пятое место. Металлический кальций плавится при +884 градусах Цельсия. Он активно применяется при выплавке стали из-за сходства по свойствам с кислородом. Кальций используется в металлургии, для выделения азота из чистого аргона, при производстве циркония и урана.
Магний
Этот металл с малой атомной массой был получен в 1808 году. Он характеризуется пластичностью, без труда поддается резке, обработке. Магний плавится при +650 градусах, не боится коррозии.
Он характеризуется пластичностью, без труда поддается резке, обработке. Магний плавится при +650 градусах, не боится коррозии.
В составе минералов и солей металл обнаруживается в земной коре, морской воде. Залежи природного магния находятся в Таджикистане и Восточной Сибири. Он используется в автомобиле- и самолетостроении, при производстве пиротехники, поскольку обладает высокими горючими свойствами. Магний применяется и при создании вооружения. В порошкообразной форме он применяется в фотографическом мастерстве.
Бериллий
Сероватый цвет, высокая хрупкость и токсичность характеризуют еще один легкий металл. В чистом виде он был получен в 1828 году. Название металл получил от известного минерала — берилла. В природе он встречается в магме, горных породах. Бериллий добывают в Индии, Бурятии, Казахстане.
Этот металл применяется в виде добавок при легировании сплавов. Он почти не поглощает рентгеновское излучение, поэтому применяется при создании детекторов гамма-излучения. Используется бериллий в аэрокосмической промышленности, в акустике, задействован в ядерной энергетике.
Используется бериллий в аэрокосмической промышленности, в акустике, задействован в ядерной энергетике.
Цезий
Один из самых мягких и легких металлов с температурой плавления всего +28,6 градуса Цельсия. При комнатной температуре он находится в полужидком состоянии. Он представляет собой вещество золотистого цвета, отлично отражает свет. Этот металл открыли в 1860 году в Германии, но в чистом виде его получил уже шведский химик и только через 22 года.
Цезий используется как катализатор в органическом и неорганическом синтезе, в инфракрасных аппаратах и очках, при изготовлении светящихся трубок. Он применяется в энергетике и медицинской сфере. Кстати, на основе цезия создают твердые электролиты для автомобильного топлива.
Стронций
Это высокоактивный химический элемент, который легко соединяется с воздухом, при нагревании быстро воспламеняется. Металлический стронций — мягкий, ковкий, имеет белый оттенок с отливом. Щелочноземельный элемент не встречается в свободном виде, но входит в состав 40 минералов. Плавится он при температуре +768 градусов Цельсия. Элемент обнаружили в шотландском руднике в восемнадцатом веке, но в чистом виде его удалось получить в 1808 году.
Плавится он при температуре +768 градусов Цельсия. Элемент обнаружили в шотландском руднике в восемнадцатом веке, но в чистом виде его удалось получить в 1808 году.
Месторождения стронциевых руд разрабатываются в Тульской области и в Дагестане. Стронций эксплуатируется в металлургии, пищевой и радиоэлектронной промышленности.
Алюминий
Один из самых распространенных металлов, который был открыт в 1825 году. До запуска масштабного производства алюминий ценился выше золота. Он обладает незначительными парамагнитными свойствами, проводит электрический ток и тепло. Алюминий подвергается механическому воздействию, но не коррозийному. Сплавы на его основе могут похвастаться пластичностью. Этот металл занимает третье место по степени распространенности в земной коре, плавится при +660 градусах.
Алюминий находит применение в черной металлургии, при производстве пиротехники, посуды, столовых приборов, в авиационной промышленности.
Барий
Это щелочноземельный металл, который быстро окисляется на воздухе, реагирует с водой, воспламеняется даже при слабом нагревании. Он активно взаимодействует с разбавленными кислотами. К другим свойствам бария относятся:
Он активно взаимодействует с разбавленными кислотами. К другим свойствам бария относятся:
- температура плавления +728 градусов Цельсия;
- температура кипения +1636 градусов;
- ковкость;
- вязкость;
- хрупкость (раскалывается при резком ударе).
Серебристо-белый металл применяется в ядерно-энергетической отрасли, пиротехнике, оптике. В чистом виде барий получили в 1774-ом.
Титан
Металл насыщенного серебристого окраса был открыт в конце восемнадцатого века немецким химиком — выделен из минерала рутила. Образец металлического титана получили лишь в 1825 году. Он характеризуется высокой удельной прочностью и устойчивостью к коррозии. По концентрации титановых руд Россия находится на второй позиции в мире после Китая. К свойствам металла относятся:
- пластичность;
- хорошая ударная вязкость;
- температура плавления, которая составляет +1670 градусов Цельсия.

Титан используется в авиа-, кораблестроении, при производстве трубопроводов, в химической, автомобильной промышленности, при создании вооружения.
Германий
Хрупкий металл стального цвета с четко выраженным блеском. Это твердосплавный элемент, который плавится при +938 градусах Цельсия, кипит при +2850 градусах, является полупроводником. Германий был выделен в 1886 году немецким химиком Клеменсом Винклером. Это аномальное вещество, плотность которого увеличивается при плавлении.
Главные сферы применения германия — волоконная и тепловизорная оптика, электроника, химическая промышленность (в качестве катализаторов).
Галлий
Это мягкий, хрупкий металл стального цвета с синеватым оттенком. Он выделен в 1875 году французским химиком. Галлий плавится при +29,7 градусах Цельсия. Это один из наиболее дорогих металлов, свыше 97 % которого уходит на производство полупроводников. Галлий активно используется в медицине — в онкологии, в качестве антисептика.
Теллур
Хрупкий белый металл с блеском, применяется при производстве свинцовых сплавов. На просвет он выглядит красно-коричневым. Редкое, слегка токсичное вещество было обнаружено в Трансильвании в конце восемнадцатого века. Но выделить его в чистом виде удалось только через 17 лет. При нагревании металл становится пластичным. Он плавится при +448,8 градусах Цельсия.
Теллур широко применяется при создании полупроводников, в процессе вулканизации каучука. Металл используют при изготовлении ламп, специальных марок халькогенидных стекол.
Ванадий
Это пластичный металл средней твердости сине-стального цвета. Ванадий — хороший полупроводник. Он обладает высокими показателями теплоизоляции, отличается:
- податливостью;
- прочностью (тверже большинства сплавов).
Это редкий тугоплавкий элемент, который был открыт в 1801 году мексиканским профессором минералогии. Но сам ученый назвал его хроматом свинца. В чистом виде из железной руды ванадий был получен только в 1830 году шведским химиком. Этот металл плавится при +1887 градусах Цельсия. Он применяется как легирующая добавка для сталей, для изготовления электроники, сувенирной продукции, в металлургии, автомобильной промышленности, при производстве буровых установок.
Этот металл плавится при +1887 градусах Цельсия. Он применяется как легирующая добавка для сталей, для изготовления электроники, сувенирной продукции, в металлургии, автомобильной промышленности, при производстве буровых установок.
Цирконий
Этот металл обладает высокой коррозийной стойкостью. Он встречается в природе в виде четырех стабильных изотопов. Серо-белый блестящий переходный металл отличается химической стойкостью. Он плавится при +1852 градусах Цельсия. Температура плавления составляет 4377 градусов. Цирконий встречается в 140 минералах, но не в самородном виде.
Металл был открыт в 1789 году, а в чистом виде — получен по истечении 35 лет после этого. Цирконий широко используется в авиационной, космической промышленности и медицине.
Цинк
Это металл, который становится пластичным при 150 градусах Цельсия, а при 210 градусах — может деформироваться. Температура плавления — низкая. Она составляет 418 градусов. Металл характеризуется:
- высокой электропроводностью;
- химической активностью — сплавляется с щелочами, подвергается воздействию серной кислоты.

Цинк имеет голубовато-серый окрас. Он тускнеет на воздухе и покрывается слоем оксида, имеет пять стабильных изотопов. Этот металл был получен в 1746 году в Германии путем прокалки смеси оксида с углем. Цинк применяется при производстве ювелирных украшений (сплавы добавляются в золото), в автомобилестроении, для защиты металлов от коррозии, при изготовлении аккумуляторов и батареек.
Хром
Тугоплавкий, твердый металл с характерным блеском, имеет голубовато-белый окрас. Он царапает стекло, в чистом виде характеризуется пластичностью, отлично поддается механической обработке. При наличии азотно-кислородных примесей становится хрупким. Температура плавления — 1856 градусов Цельсия. Хром — составляющий компонент стали, который повышает ее прочность, закаливаемость, жаростойкость. Он был открыт во Франции в 1797 году. Химик Воклен выделил тугоплавкий металл с примесью карбидов. Используется хром в легированных сталях, в качестве эстетических гальванических покрытий. Он относится к токсичным элементам.
Он относится к токсичным элементам.
Марганец
Этот серебристо-серый металл напоминает железо. Он обладает незначительными парамагнитными свойствами, медленно окисляется и тускнеет на воздухе. Это твердый и хрупкий металл, который был открыт в 1774 году. Марганец имеет температурные показатели плавления и кипения 1246 и 2061 градус Цельсия соответственно.
Марганец используется для раскисления стали при ее выплавке, в металлургии и химической промышленности. Металл является остродефицитным сырьем в России. Известно лишь несколько месторождений (в Кемеровской области, Красноярском крае).
Таблица самых легких металлов (список по возрастанию плотности)
|
Порядковый номер |
Наименование |
Плотность, г/см3 |
Атомный вес, г/моль |
|
1 |
Литий |
0,534 |
6,941 |
|
2 |
Калий |
0,862 |
39,09 |
|
3 |
Натрий |
0,968 |
23,98 |
|
4 |
Рубидий |
1,532 |
85,47 |
|
5 |
Кальций |
1,54 |
40,08 |
|
6 |
Магний |
1,739 |
24,305 |
|
7 |
Бериллий |
1,848 |
9,01 |
|
8 |
Цезий |
1,9 |
132,9 |
|
9 |
Стронций |
2,63 |
87,62 |
|
10 |
Алюминий |
2,7 |
26,98 |
|
11 |
Барий |
3,76 |
137,3 |
|
12 |
Титан |
4,505 |
47,9 |
|
13 |
Германий |
5,33 |
72,64 |
|
14 |
Галлий |
5,91 |
69,723 |
|
15 |
Теллур |
6,25 |
127,6 |
|
16 |
Ванадий |
6,5 |
50,941 |
|
17 |
Цирконий |
6,53 |
91,224 |
|
18 |
Цинк |
7,13 |
65,409 |
|
19 |
Хром |
7,14 |
51,996 |
|
20 |
Марганец |
7,2 |
54,938 |
Части периодической таблицы
Группа 2A (или IIA ) периодической таблицы являются щелочными
земные металлы : бериллий (Be), магний (Mg), кальций (Ca),
стронций (Sr), барий (Ba) и радий (Ra). Они тяжелее и
менее реакционноспособны, чем щелочные металлы группы 1А. Имя приходит
от того, что оксиды этих металлов давали основные растворы
при растворении в воде и оставались твердыми при температурах
доступны древним алхимикам. Как и элементы группы 1А,
Щелочноземельные металлы слишком реакционноспособны, чтобы их можно было найти в природе. элементарная форма.
Они тяжелее и
менее реакционноспособны, чем щелочные металлы группы 1А. Имя приходит
от того, что оксиды этих металлов давали основные растворы
при растворении в воде и оставались твердыми при температурах
доступны древним алхимикам. Как и элементы группы 1А,
Щелочноземельные металлы слишком реакционноспособны, чтобы их можно было найти в природе. элементарная форма.
Щелочноземельные металлы имеют два валентных электрона на орбиталях с наивысшей энергией. ( нс 2 ). Они меньше, чем щелочные металлы тот же период и, следовательно, имеют более высокие энергии ионизации. В большинстве случаев щелочноземельные металлы ионизируются. для формирования заряда 2+.
Щелочноземельные металлы имеют гораздо более высокую температуру плавления, чем щелочные
металлы: бериллий плавится при 1287С, магний при 649С, кальций при 839С,
стронций при 768°С, барий при 727°С и радий при 700°С. Они есть
более твердые металлы, чем элементы группы 1А, но мягкие и легкие
по сравнению со многими переходными металлами.
Соли металлов 2А группы менее растворимы в воде, чем соли Группа 1А из-за более высокой плотности заряда на катионах 2+; тем не менее, многие соли группы 2А, по крайней мере, умеренно растворимы. Некоторые соли группы 2А прочно связываются с молекулами воды и кристаллизуются в виде гидраты ; среди них английская соль, MgSO 4 7H 2 O и гипс, CaSO 4 2H 2 О.
Бериллий (Be, Z=4).
Бериллий — серебристо-белый мягкий металл. Его название происходит от
греческое слово, обозначающее минерал берилл, beryllo . Он находится в
земной коры с концентрацией 2,6 промилле, что делает ее 47-й по величине
обильный элемент. Первичные руды
бериллия – это берилл [алюмосиликат бериллия, Be 3 Al 2 (SiO 3 ) 6 ]
и бертрандит [гидроксид силиката бериллия, Be 4 Si 2 O 7 (OH) 2 ]. Бериллы драгоценного качества включают изумруды и аквамарины; зеленый цвет
этих драгоценных камней происходит из следовых количеств хрома.
Бериллы драгоценного качества включают изумруды и аквамарины; зеленый цвет
этих драгоценных камней происходит из следовых количеств хрома.
Из-за небольшого размера и высокой плотности заряда бериллий через ковалентную связь вместо ионной связи. Элементаль бериллий очень инертен по отношению к воздуху и воде даже при высоких температурах. температуры.
Бериллий используется для изготовления окон для рентгеновских трубок (это прозрачен для рентгеновских лучей) и используется в сплавах с другими металлами, такими как медь и никель для изготовления искробезопасных инструментов и часовых пружин. Бериллий также используется в корпусах ядерного оружия и в атомной промышленности. электростанции из-за его способности отражать нейтроны. Бериллий накапливается в костях; Длительное воздействие бериллия приводит к воспаление в легких и одышка (состояние, называемое бериллиозом).
Магний (Mg, Z=12).
Магний — относительно мягкий металл серебристо-белого цвета. Название элемента происходит от
Магнезия, район в Фессалии в центральной Греции. Он находится в
земная кора с концентрацией 2,3%, что делает ее 7-й по величине
обильный элемент. Большое количество магния также содержится в
полезных ископаемых в мантии Земли. Получают из морской воды, карналита
[MgKCl 3 6H 2 O], доломит
[смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ],
и магнезит [карбонат магния, MgCO 3 ].
Название элемента происходит от
Магнезия, район в Фессалии в центральной Греции. Он находится в
земная кора с концентрацией 2,3%, что делает ее 7-й по величине
обильный элемент. Большое количество магния также содержится в
полезных ископаемых в мантии Земли. Получают из морской воды, карналита
[MgKCl 3 6H 2 O], доломит
[смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ],
и магнезит [карбонат магния, MgCO 3 ].
Магний, легированный алюминием и следами других металлов, используется в автомобилестроение и авиастроение; магниевые сплавы также используются в других легкие устройства, такие как лестницы, камеры, велосипедные рамы, жесткий диск диски и т. д. Магний легче окисляется, чем железо, и используется в жертвенные аноды для защиты железных труб и других структуры, которые легко подвергаются коррозии.
Магний горит на воздухе ярко
белое пламя,
и используется в фейерверках и зажигательных бомбах. (Это было
используется в одноразовых лампах-вспышках, но это использование было вытеснено другими
виды освещения.) Магниевые костры очень трудно зажечь
наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с
азот с образованием нитрида магния (Mg 3 N 2 ), и
с водой для получения гидроксида магния и газообразного водорода.
(Это было
используется в одноразовых лампах-вспышках, но это использование было вытеснено другими
виды освещения.) Магниевые костры очень трудно зажечь
наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с
азот с образованием нитрида магния (Mg 3 N 2 ), и
с водой для получения гидроксида магния и газообразного водорода.
Магний содержится в ряде известных соединений. Магний
оксид MgO используется в огнеупорных кирпичах, способных
выдерживать высокие температуры в каминах и печах (магниевый
оксид плавится при 2800 С). Гептагидрат сульфата магния, MgSO 4 7H 2 O,
более известная как английская соль, является
миорелаксант и мягкое слабительное. Гидроксид магния, Mg(OH) 2 ,
также известный как молоко магнезии, является слабительным и антацидом.
(«Молоко» в «молоке магнезии» относится к тому факту, что, поскольку магний
гидроксид плохо растворяется в воде, имеет тенденцию образовывать известковую, белую
суспензия, похожая на молоко, но со значительно
физиологические эффекты. )
)
Зеленые растения содержат молекулу под названием хлорофилл, состоящий из плоского кольца атомов углерода и азота с большим открытым пространством посередине, в котором связан ион магния, удерживается на месте атомами азота. молекула хлорофилла поглощает солнечный свет, и в процессе фотосинтеза, энергия света превращается в химическую энергии, которую завод может использовать для питания множества процессов.
В органической химии магний реагирует с бромалканами.
(углеводороды, содержащие бромуглеродные связи) с образованием магнийорганических соединений
известны как реактивы Гриньяра (в честь их первооткрывателя Виктора
Гриньяр, получивший Нобелевскую премию по химии в 1912 г.). Эти соединения чрезвычайно полезны при формировании
новый углерод-углерод
связи и часто используются в синтезе органических соединений. Известно, что реактивы Гриньяра чувствительны к воде, поэтому необходимо соблюдать осторожность.
удостовериться, что аппарат, в котором идет реакция,
проведено очень сухо.
Кальций (Ca, Z=20).
Кальций — относительно мягкий металл серебристого цвета. Название элемента происходит от Латинское слово, обозначающее известь, calx . Он находится в земная кора с концентрацией 4,1%, что делает ее пятой по величине обильный элемент. Основными источниками кальция являются кальцит и известняк. [карбонат кальция, CaCO 3 ], ангидрит [кальций сульфат, CaSO 4 ], гипс [дигидрат сульфата кальция, CaSO 4 2H 2 O], и доломит [смесь карбонатов кальция и магния, CaMg(CO 3 ) 2 ].
Соли кальция образуют твердые части тела большинства живых существ. существ, из раковин морских организмов и кораллов кораллов рифы (в виде кальция карбонат, CaCO 3 ) к костям и зубам наземных существ (в виде гидроксиапатита кристаллы, Са 3 (PO 4 ) 2 ] 3 Ca(OH) 2 ).
Поскольку кальций образует такие твердые минералы, он полезен в строительстве. материалов, таких как гипс, раствор и цемент. Раствор изготавливается из оксида кальция CaO, также известного как известь или негашеная известь. При взаимодействии оксида кальция с водой образуется гидроксид кальция.
Ca(OH) 2 или гашеная известь, которая поглощает углекислый газ из
воздух и постепенно образует карбонат кальция CaCO 3 .
Известь, нагретая водородом, горящим в кислороде, горит ярко-белым цветом.
свет, который можно сфокусировать в узкий пучок, видимый на большой
расстояния. Такое освещение использовалось на маяках, в
съемки, а в театрах производить прожекторы (оставляя актера «в
в центре внимания”).
материалов, таких как гипс, раствор и цемент. Раствор изготавливается из оксида кальция CaO, также известного как известь или негашеная известь. При взаимодействии оксида кальция с водой образуется гидроксид кальция.
Ca(OH) 2 или гашеная известь, которая поглощает углекислый газ из
воздух и постепенно образует карбонат кальция CaCO 3 .
Известь, нагретая водородом, горящим в кислороде, горит ярко-белым цветом.
свет, который можно сфокусировать в узкий пучок, видимый на большой
расстояния. Такое освещение использовалось на маяках, в
съемки, а в театрах производить прожекторы (оставляя актера «в
в центре внимания”).
Хлорид кальция расплывается (он поглощает достаточное количество воды из
воздух, который он растворяет в растворе), и используется для удаления влаги
с воздуха в сырых подвалах. (Потребуется более сильный человек
что я не могу назвать только что открытую коробку с хлоридом кальция,
не вел себя должным образом как «несовершеннолетний распутник». )
)
«Жесткая вода» содержит растворенные минералы, имеющие 2+ или 3+ заряда, такие как кальций и магний; эти соли вызывают некоторые мыла и моющие средства, выпадающие в осадок в виде «мыльной пены»; эти минералы осаждаются со временем образует «накипь» в воде обогреватели и кастрюли. Кальций можно удалить водой умягчители, которые обменивают ионы кальция на ионы натрия, которые имеют 1+ заряжается и не выпадает в осадок.
Стронций (Sr, Z=38).
Стронций — блестящий, относительно мягкий металл. Название элемента происходит от Стронтиан — город в Шотландии, где добывали минерал стронтианит. открыт, из которого впервые был выделен стронций. Он находится в земная кора с концентрацией 370 частей на миллион, что делает ее 16-й по величине обильный элемент. Встречается в рудах целестита [стронция сульфат, SrSO 4 ] и стронцианит [карбонат стронция, SrCO 3 ].
Соли стронция при нагревании окрашиваются в ярко-красный цвет. по этой причине используется в фейерверках и сигнальных ракетах. Радиоактивный
стронций-90 (бета-излучатель) образуется при ядерных взрывах; с
он химически похож на кальций, он включается в кости
у людей, подвергающихся его воздействию. Стронций-90 является бета-излучателем,
и препятствует выработке эритроцитов.
по этой причине используется в фейерверках и сигнальных ракетах. Радиоактивный
стронций-90 (бета-излучатель) образуется при ядерных взрывах; с
он химически похож на кальций, он включается в кости
у людей, подвергающихся его воздействию. Стронций-90 является бета-излучателем,
и препятствует выработке эритроцитов.
Барий (Ba, Z=56).
Барий — блестящий мягкий металл. Название элемента происходит от греческое слово barys , означающее «тяжелый», по отношению к высокая плотность некоторых минералов бария. Он находится в земная кора с концентрацией 500 частей на миллион, что делает ее 14-й по величине обильный элемент. Встречается в баритовых рудах [сульфат бария, БаСО 4 ] и витерит [карбонат бария, BaCO 3 ].
Барий был обнаружен в
1500-х годов в виде «болонских камней» (теперь известных как бариевые
сульфат, BaSO 4 ), обнаруженный недалеко от Болоньи, Италия. Эти
камни светились в присутствии света, а также при нагревании.
Соли бария при нагревании окрашиваются в зеленый цвет и используются в
фейерверки (в форме нитрата бария, Ba(NO 3 ) 2 ).
Эти
камни светились в присутствии света, а также при нагревании.
Соли бария при нагревании окрашиваются в зеленый цвет и используются в
фейерверки (в форме нитрата бария, Ba(NO 3 ) 2 ).
Сульфат бария, BaSO 4 , ядовит, но это так нерастворимым, что он проходит через тело до любого поглощения может иметь место барий. Используется в диагностике некоторых проблемы с кишечником в виде «бариевых клизм»: сульфат бария непрозрачен для рентгеновских лучей и может быть использован для рентгенографии пищеварительного тракта. тракт.
Радий (Ra, Z=88).
Радий — мягкий, блестящий, радиоактивный металл. Название элемента
произошло от латинского слова «луч» 9.0013 радиус , из-за его
способность светиться в темноте слабым голубым светом. Он находится в
земной коры с концентрацией 0,6 ppt (частей на триллион), что делает ее
84-й самый распространенный элемент. Он содержится в следовых количествах в
урановых руд, но коммерчески используемый радий легче получить из
отработавшее ядерное топливо.
Открыт радий Пьером и Марией Кюри в 1898 году; они извлекли миллиграмм радия из трех тонн урановой руды. Радий производится в радиоактивный распад урана-235, урана-238, тория-232 и плутоний-241. После его открытия и до опасностей радиация была понята, радий использовался во многих шарлатанских лекарствах и патентованные лекарства. Радий использовался для изготовления часов, светящихся в темноте. лица в начале 1900-е годы; альфа-частицы, испускаемые радием ударил частицы сульфида цинка, заставив их светиться, но был остановлен по корпусу часов по стеклу циферблата. Многие из рабочие, расписывавшие эти циферблаты, заболели или умерли от лучевая болезнь.
Джон Эмсли, Элементы , 3-е издание. Оксфорд: Clarendon Press, 1998.
.Джон Эмсли, Строительные блоки природы: Путеводитель по элементам от А до Я . Оксфорд: Оксфордский университет Пресс, 2001.
Дэвид Л. Хейзерман, Исследование
Химические элементы и их соединения . Нью-Йорк: TAB
Книги, 1992.
Нью-Йорк: TAB
Книги, 1992.
Видео с вопросами: сравнение переходного металла с щелочным металлом
Стенограмма видео
Медь является переходным металлом, натрий – щелочной металл. Какой из следующих тестов будет дают аналогичные результаты для этих металлов? (A) Тестирование, если они электропроводный. (B) Хранение их в сухом воздухе. (C) Помещение их в холодную воду. (D) Нагрев их до 100 градусов Цельсия. Или (E) с помощью молотка, чтобы изменить их форма.
Щелочные металлы и переходные металлы имеют некоторое сходство в своих свойствах и много различий. Давайте посмотрим, как медь и натрия подобны и различны в зависимости от ситуации.
При хранении в сухом воздухе натрий
реагируют с кислородом воздуха и быстро тускнеют. Это связано с тем, что металлический натрий
легко окисляется. Медь, однако, довольно сильно окисляется.
медленно, как и многие переходные металлы. Некоторые переходные металлы, такие как золото,
окисляется только в очень специфических условиях. И поэтому мы знаем, что выбор ответа
(B) не может быть правильным ответом, потому что эти результаты будут очень разными.
Медь, однако, довольно сильно окисляется.
медленно, как и многие переходные металлы. Некоторые переходные металлы, такие как золото,
окисляется только в очень специфических условиях. И поэтому мы знаем, что выбор ответа
(B) не может быть правильным ответом, потому что эти результаты будут очень разными.
Когда щелочные металлы, такие как натрий, помещаются в холодную воду, они реагируют очень энергично и бурно и могут даже вызвать опасные взрывы. Медь, с другой стороны, практически не вступает в реакцию с водой и определенно не реагирует бурно или взорваться. Таким образом, мы можем исключить выбор ответа (С).
Далее, щелочные металлы, как правило, имеют
низкие температуры плавления и кипения, в то время как переходные металлы имеют невероятно высокую температуру плавления
и температуры кипения. Например, натрий имеет температуру плавления. точка ниже 100 градусов по Цельсию. Так что при температуре выше 100 градусов будет
в жидком состоянии при нормальном давлении. И поэтому мы можем исключить ответ
выбор (Д).
точка ниже 100 градусов по Цельсию. Так что при температуре выше 100 градусов будет
в жидком состоянии при нормальном давлении. И поэтому мы можем исключить ответ
выбор (Д).
Глядя на вариант ответа (E), мы Знайте, что переходные металлы тверды и прочны и не меняют форму. При ударе молотком мы обычно нужно ударить по переходному металлу с большой силой и несколько раз, если мы хотел изменить свою форму. Вы можете даже представить себе кузнец работает, чтобы сделать меч. Однако щелочные металлы значительно более мягкий и податливый. Они склонны больше менять форму легко поддается механическому воздействию. И так, мы можем исключить ответ выбор (Е).
И это оставляет нас с ответом
выбор (А). И переходные металлы, и щелочи
металлы, как правило, являются хорошими проводниками электричества, потому что у них мало сопротивления
чтобы электроны проходили через эти элементы, давая им аналогичные электронные
характеристики.

