Медь свойства химические и физические: Химические и физические свойства меди и медных сплавов
alexxlab | 22.06.1988 | 0 | Разное
Физические и химические свойства меди
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
Выполнил:
Содержание
О меди
Физические и химические свойства меди
Медь и здоровье
Применение меди
История меди
Народная медицина
Медь – первый металл, который
впервые стал использовать человек
в древности за несколько
тысячелетий до нашей эры. Первые
медные орудия изготовлялись из
самородной меди, которая
встречается довольно часто. Самый
крупный самородок меди был
найден на территории США, он имел
массу 420 т.
Но в виду того, что медь – мягкий
металл, медь в древности не смогла
вытеснить каменные орудия труда.
Лишь когда человек научился
плавить медь и изобрел бронзу
(сплав меди с оловом), металл
заменил камень. Широкое
использование меди началось в IV
тысячелетии до н.э.
Медь — тяжелый розово-красный металл, мягкий и
ковкий, ее температура плавления 1083° С,
является отличным проводником электрического
тока и теплоты электрическая проводимость меди в
1,7 раза выше, чем алюминия, и в 6 раз выше
железа.
В повседневной жизни все время приходится иметь
дело с медью и ее сплавами: включаем компьютер
или настольную лампу — ток идет по медным
проводам, пользуемся металлическими деньгами,
которые, как желтые, так и белые, изготовлены из
сплавов меди. Некоторые дома украшают изделия
из бронзы, из меди изготавливается посуда. Тем
временем медь- далеко не самый
распространенный в природе элемент: содержание
меди в земной коре составляет 0,01%, что
позволяет ей занимать лишь 23-е место среди всех
элементов.

Медь – первый металл, который
впервые стал использовать человек
в древности за несколько
тысячелетий до нашей эры. Первые
медные орудия изготовлялись из
самородной меди, которая
встречается довольно часто. Самый
крупный самородок меди был
найден на территории США, он имел
массу 420 т.
Медь – малоактивный металл, в
Но в виду того, что медь – мягкий
электрохимическом ряду
металл, медь в древности не смогла
напряжений она стоит правее
вытеснить каменные орудия труда. водорода. Она не взаимодействует с
Лишь когда человек научился
водой, растворами щелочей,
плавить медь и изобрел бронзу
соляной и разбавленной серной
(сплав меди с оловом), металл
кислотой. Однако в кислотах —
сильных окислителях (например,
использование меди началось в IV
азотной и концентрированной
тысячелетии до н. э.
серной) — медь растворяется:
Сu + 4НМО3 – Сu(NO3)2 + 2NO+
2Н2О концентрированная
Медь обладает достаточно высокой
стойкостью к коррозии.
 Однако во
Однако вовлажной атмосфере, содержащей
углекислый газ медь покрывается
зеленоватым налетом основного
карбоната меди:
2Сu + O2 + СO2 + Н2O = СU(ОН)2
СuСО3
В соединениях медь может проявлять
степени окисления +1,
+•2 и +3, из которых +2 — наиболее
характерная и устойчивая.
Медь (II) образует устойчивые оксид
СuО и гидроксид Си(ОН)2.
Этот гидроксид амфотерен, хорошо
растворяется в кислотах
Сu(ОН)2 + 2НСl = СuСl2 + 2Н2О и в
концентрированных щелочах. Соли
меди (II) нашли широкое применение в
народном хозяйстве. Особенно важным
является медный купорос —
кристаллогидрат сульфата меди (II)
СuSО4 • 5Н2.
Медь и здоровье
Организму человека медь необходима для образования
различных протеинов и ферментов. Медь нужна:
Для синтеза гемоглобина
Для образования костей
Для функционирования системы кровообращения
Для функционирования центральной нервной системы
Для получения энергии из клеток
Последние исследования показали, что весьма близко к
истине предположение о том, что питание с недостаточным
содержанием меди повышает риск сердечно-сосудистых
заболеваний.
 Дефицит меди в организме может привести к
Дефицит меди в организме может привести ктаким тяжелым последствиям как порок развития костей,
малокровие и мозговая недостаточность. Дельнейшими
последствиями являются:
Блокировка клеточного дыхания
Неправильное образование нейромедиаторов
Остановка образования пигментов (белые волосы)
Человек вместе с пищей должен получать
определенное количество меди для достаточного
насыщения организма этим элементом. Ежедневная
потребность взрослого человека в меди составляет 2-3
мг. Многие продукты и напитки содержат этот важный
элемент в различном количестве. Одного потребления
питьевой воды с ионами меди недостаточно. К
продуктам с высоким содержанием меди относятся:
Шоколад
Белая и зеленая фасоль
Рыба
Лесные и южные орехи
А ниже перечисленные продукты наоборот содержат
медь лишь в малом количестве:
Сыр
Молоко
Белый хлеб
Говядина и баранина
В данной таблице приведен список продуктов и
содержание в них меди
Выделяется технический металл, содержащий 97 — 98% меди.
 Одна из
Одна изважнейших отраслей применения меди — электротехническая
промышленность. Из меди изготовляют электрические провода. Для этой
цели металл должен быть очень чистый: примеси резко снижают
электрическую проводимость. Присутствие в меди 0,02% алюминия снизит
ее электрическую проводимость почти на 10%. Еще более резко
возрастает сопротивление металла в присутствии неметаллических
примесей. Для получения чистой меди, которую можно использовать в
электротехнике, проводят ее электрорафинирование. Этот метод основан
На проведении электролиза водного раствора соли меди с растворимым
медным анодом. Техническую или черновую медь, кото-служит одним из
электродов, погружают в ванну, заполненную водным раствором сульфата
меди. В ванну погружают еще один электрод. К электродам подключают
источник постоянного тока таким образом чтобы техническая медь стала
анодом (положительный полюс источника тока), а другой электрод —
Очень важная область применения
меди — производство медных сплавов.

Со многими металлами медь образует
так называемые твердые растворы,
которые похожи на обычные растворы
тем, что в них атомы одного компонента
(металла) равномерно распределены
среди атомов другого (рис. 34).
Большинство сплавов меди — это
твердые растворы.
Сплав меди, известный с древнейших
времен, — бронза — содержит 4—30%
олова (обычно 8—10%). Интересно, что
бронза по своей твердости превосходит
отдельно взятые чистые медь и олово.
Бронза более легкоплавка по
сравнению с медью. До наших дней
сохранились изделия из бронзы
мастеров Древнего Египта, Греции,
Китая. Из бронзы отливали в средние
века орудия и многие другие изделия.
Знаменитые Царь-пушка (рис. 35) и
Царь-колокол в Московском Кремле
также отлиты из сплава меди с оловом.
Народная
медицина
Лечебные свойства меди известны очень давно. Древние считали, что
лечебный эффект меди связан с её обезболивающем жаропонижающим
антибактериальным и противовоспалительным свойствами.
 Ещё
ЕщёАвиценна и Гален описывали медь, как лекарственное средство, а
Аристотель, указывая на общеукрепляющее действие меди на организм,
предпочитал засыпать с медным шариком в руке. Царица Клеопатра
носила тончайшие медные браслеты, предпочитая их золотым и
серебряным, хорошо зная медицину и алхимию. В медных доспехах
античные воины меньше уставали, а их раны меньше гноились и быстрее
заживали. Была подмечена и широко использовалась в Древнем мире
способность меди положительно влиять на «мужскую силу».
В наши дни применение медных изделий широко
распространено. В Средней Азии носят медные изделия и
практически не болеют ревматизмом. В Египте и Сирии медные
расстройства слуха. В США медные браслеты носят как средства
от артрита. В китайской медицине используются аппликации
медных дисков на активные точки. А в Непале медь считают
священным металлом.
Медетерапия (лечение медью) – один из видов народной
медицины.
 В детстве прикладывая по совету бабушки медный
В детстве прикладывая по совету бабушки медныйпятак на шишку, мы уменьшали боль и воспаление, хотя в 5-ти
копеечной монете, выпущенной в советское время, содержание
меди было невелико. В медетерапии используются изделия с
содержанием меди не менее 99,9%. Самым простым,
эффективным, эстетически красивым и практичным средством в
медетерапии является медный браслет, разрешенный и
рекомендуемый МинЗдравом РФ
English Русский Правила
Свойства и применение меди.
Медь отличается высокими электропроводностью, теплопроводностью, пластичностью, температурой плавления, коррозионной стойкостью, отличной обрабатываемостью давлением в холодном и горячем состоянии, хорошими литейными свойствами и удовлетворительной обрабатываемостью резанием. Благодаря этим ценным качествам медь используют в электротехнике, различных отраслях машиностроения, радиоэлектронике и приборостроении.| Марка | Сu (не менее) | Примеси (не более) | ||||||||||||
| Bi | Sb | As | Fe | Ni | Pb | Sn | S | O2 | Zn | P | Ag | Всего | ||
| ||||||||||||||
| M00 | 99,99 | 0,0005 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,001 | 0,002 | – | 0,001 | 0,001 | – | 0,01 |
| М0 | 99,95 | 0,001 | 0,002 | 0,002 | 0,004 | 0,002 | 0,004 | 0,002 | 0,004 | 0,02 | 0,004 | 0,002 | 0,003 | 0,05 |
| М0б | 99,97 | 0,001 | 0,002 | 0,002 | 0,004 | 0,002 | 0,004 | 0,002 | 0,004 | 0,001 | 0,003 | 0,002 | 0,003 | 0,03 |
| Ml | 99,90 | 0,001 | 0,002 | 0,002 | 0,005 | 0,002 | 0,005 | 0,002 | 0,005 | 0,05 | 0,005 | – | 0,003 | 0,1 |
| Mlp | 99,90 | 0,001 | 0,002 | 0,002 | 0,005 | 0,002 | 0,005 | 0,002 | 0,005 | 0,01 | 0,005 | 0,04 | 0,003 | 0,1 |
| М2 | 99,70 | 0,002 | 0,005 | 0,01 | 0,05 | 0,2 | 0,01 | 0,05 | 0,01 | 0,07 | – | – | – | 0. 3 3 |
| М2р | 99,70 | 0,002 | 0,005 | 0.01 | 0,05 | 0,2 | 0,01 | 0,05 | 0,01 | 0,01 | – | 0,04 | – | 0,3 |
| МЗ | 99,50 | 0,003 | 0,05 | 0,01 | 0,05 | 0,2 | 0,05 | 0,05 | 0,01 | 0,08 | – | – | – | 0,5 |
| МЗр | 99,50 | 0,003 | 0,05 | 0,05 | 0,05 | 0,2 | 0,03 | 0,05 | 0,01 | 0,01 | – | 0,04 | – | 0,5 |
| М4 | 99,0 | 0,005 | 0,2 | 0,2 | 0,1 | – | 0,3 | – | 0,02 | 0,15 | – | – | – | 1,0 |
| АМФ | Остальное | 0,001 | 0,002 | 0,002 | 0,005 | 0,002 | 0,005 | 0,002 | 0,005 | 0,05 | 0,005 | 0,03-0,16 | 0,003 | 0,1 |
Согласно ГОСТ 859-66 промышленность выпускает медь десяти марок в виде катодов, вайербасов, слитков и полуфабрикатов (листов, полос, лент, прутков, труб, проволоки, поковок). Из этих полуфабрикатов готовят обработкой давлением и резанием всевозможные детали. Медь является хорошим материалом для фасонных отливок.
Из этих полуфабрикатов готовят обработкой давлением и резанием всевозможные детали. Медь является хорошим материалом для фасонных отливок.
Медь также широко применяют для защитных коррозионностойких покрытий. Для электролиза чаще используют медные аноды из специальной меди АМФ.
Особености выплавки меди
При плавлении меди в ней может растворяться некоторое количество кислорода в виде закиси меди. Примеси кислорода несколько снижают электропроводность и пластичность меди в горячем и холодном состоянии, а также могут привести к «водородной болезни».
В изделиях, содержащих закись меди, при нагреве в водороде образуются трещины и пузыри, из-за чего резко снижаются их прочность и пластичность. «Водородная болезнь» возникает вследствие того, что при нагреве водород быстро диффундирует в медь, и, соединяясь с кислородом, образует пары воды. Эти пары из-за незначительной скорости диффузии создают высокое давление, что и приводит к образованию
упомянутых дефектов в меди. Для предохранения от окисления медь плавят или под слоем древесного угля, или с использованием защитных газов, или в вакууме.
Для предохранения от окисления медь плавят или под слоем древесного угля, или с использованием защитных газов, или в вакууме.
В ряде случаев производят дополнительное раскисление жидкой меди. Один из наиболее эффективных и употребляемых раскислителей — фосфор (0,01-0,05%). Расплавленную медь также предохраняют от насыщения серой, примеси которой ухудшают ее механические свойства.
Технологические свойства
Высокая теплопроводность и электропроводность меди затрудняют ее электросварку (точечную или роликовую), особенно в виде массивных изделий. Тонкие медные детали и полуфабрикаты можно сваривать электродами из вольфрама и молибдена. Предварительное лужение соединяемых поверхностей облегчает сварку. Легче осуществить сварку встык, но для этого необходимы трансформаторы большой мощности. Детали толщиной более 2 мм можно сваривать нейтральным ацетилено-кислородным пламенем, при этом необходимо предохранять их от окисления и загрязнения. Наиболее надежный способ соединения медных изделий — пайка твердыми и мягкими припоями.
Медь отлично штампуется, но при этом необходимо помнить, что в отожженном состоянии она отличается значительной анизотропией механических свойств, вызывающей образование фестонов при глубокой вытяжке. Для уменьшения фестонов листовую (ленточную) медь следует готовить по особому технологическому процессу. Чистовая обработка резанием мягкой меди ввиду ее большой вязкости затруднена. Для деталей, изготавливаемых резанием, рекомендуется применять нагартованную (твердую) медь. Химический состав меди см. ГОСТ 13938.0-68; 13938.12-68; 13938.13-69.
Склонность к «водородной болезни» (ГОСТ 15471-70) определяют путем отжига образцов в виде пластин в водороде при 825-875° С (40 мин), последующего визуального осмотра и испытания на перегиб. Испытание проволоки на растяжение см. ГОСТ 10446-63, а на перегиб — ГОСТ 1579-63. Механические свойства плоского проката в условиях растяжения см. ГОСТ 1497-73, ГОСТ 11701-66, а на изгиб — ГОСТ 14019-68.
Основное количество меди используют для приготовления сплавов.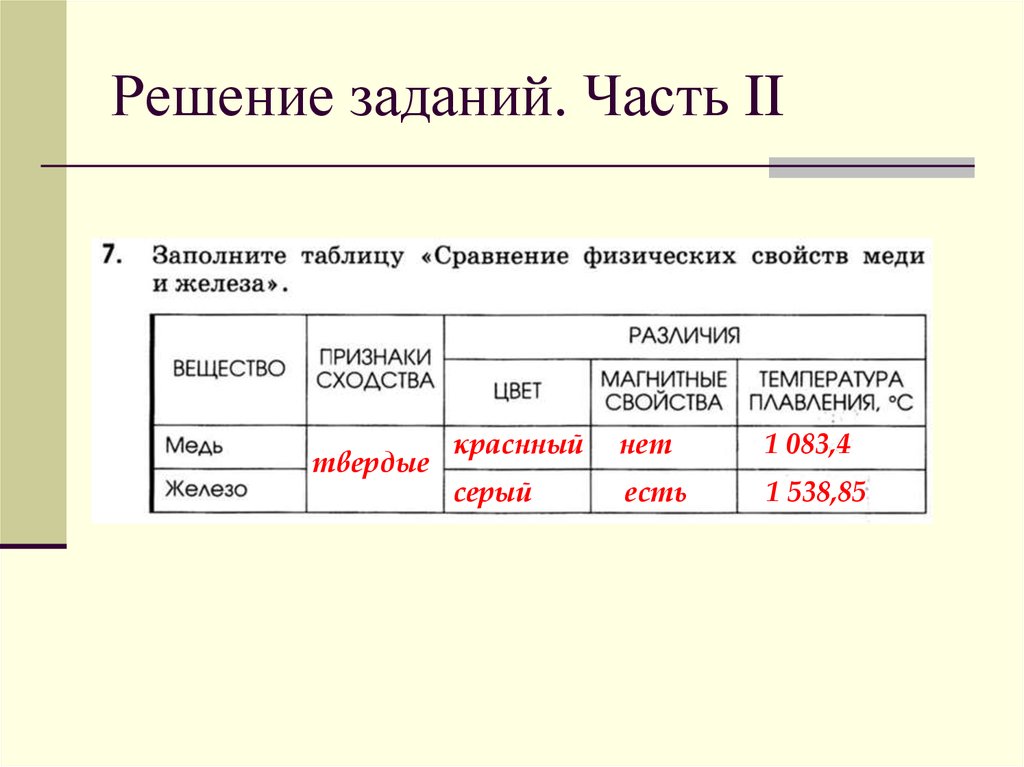 В технической литературе медные сплавы разделяют на три группы: латуни, бронзы и медно-никелевые сплавы.
В технической литературе медные сплавы разделяют на три группы: латуни, бронзы и медно-никелевые сплавы.
Полуфабрикаты из меди поставляют в мягком (отожженном), полутвердом (обжатие 10-30%) и твердом (обжатие более 35%) состоянии.
Медь – свойства, применение, характеристики медных сплавов
История меди
Человечество начало добывать медь несколько тысячелетий назад. Самые древние изделия, найденные из этого металла, датируются 7-6 веками до нашей эры. Среди них – украшения, инструменты, посуда и орудия труда.
Большим шагом вперед в развитии металлургии было открытие сплава меди с оловом – бронзы. Этот материал отличался повышенной прочностью и способностью к ковке, благодаря чему все изделия из данного медного сплава получались более качественными.
На территории нашей страны медь издавна добывают на Урале, Алтае и в Сибири. Из нее отлиты известнейшие культурные памятники: Царь-пушка, Царь-колокол, Медный всадник.
youtube.com/embed/H0PbGKNYXcU?feature=oembed” frameborder=”0″ allow=”accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture” allowfullscreen=””/>Медь
В Греции медь была известна под названием халькос (χαλκός). Она была важным ресурсом для римлян, греков и других античных народов. Во времена Римской Империи она была известна как Cyprium, так как является обобщенным латинским термином для обозначения медных сплавов, и Cyprium от названия острова Кипр, где добывалось большое количество меди. Слово было сокращено до cuprum, а затем до английского copper. Афродита и Венера представляют медь в мифологии и алхимии, поскольку, за счет ее глянцевитой красоты, в античности она использовалась для производства зеркал, а также за счет связи с Кипром, который был посвящен богине. Семь небесных светил, известных в античности, ассоциировались с семью известными в то время металлами, и Венера была закреплена за медью. Первое применение в Британии латуни датируется около III–II века до н.э. В Северной Америке добыча меди началась с малодоходных работ, проводимых коренными американцами. Самородная медь извлекалась из мест заложения на Айл Роял примитивными каменными инструментами между 800 и 1600 гг.20) Медная металлургия процветала в Южной Америке, а именно в Перу около 1000 г. н.э.; более медленно она переходила на другие континенты. Были найдены погребальные украшения из меди XIV века, но коммерческое производство металла не начиналось до ранних годов XX века. Роль меди в культуре достаточно важна, в частности в качестве платежного средства. Римляне с VI до III века до н.э. использовали куски меди в качестве денег. В первую очередь, медь ценилась сама по себе, но постепенно форма и внешний вид меди становились все более важными. У Юлия Цезаря имелись собственные монеты, изготовленные из латуни, в то время как монеты цезаря Октавиана Августа были выполнены из сплава Cu-Pb-Sn.
Семь небесных светил, известных в античности, ассоциировались с семью известными в то время металлами, и Венера была закреплена за медью. Первое применение в Британии латуни датируется около III–II века до н.э. В Северной Америке добыча меди началась с малодоходных работ, проводимых коренными американцами. Самородная медь извлекалась из мест заложения на Айл Роял примитивными каменными инструментами между 800 и 1600 гг.20) Медная металлургия процветала в Южной Америке, а именно в Перу около 1000 г. н.э.; более медленно она переходила на другие континенты. Были найдены погребальные украшения из меди XIV века, но коммерческое производство металла не начиналось до ранних годов XX века. Роль меди в культуре достаточно важна, в частности в качестве платежного средства. Римляне с VI до III века до н.э. использовали куски меди в качестве денег. В первую очередь, медь ценилась сама по себе, но постепенно форма и внешний вид меди становились все более важными. У Юлия Цезаря имелись собственные монеты, изготовленные из латуни, в то время как монеты цезаря Октавиана Августа были выполнены из сплава Cu-Pb-Sn. Учитывая расчетный ежегодный выход приблизительно в 15000 т, активность римлян в отношении добычи и плавки меди достигла уровня, непревзойденного до времен Промышленной революции; добыча наиболее интенсивно велась в провинциях, таких как Испания, Кипр и Центральная Европа. Ворота Иерусалимского храма выполнены из коринфской бронзы, покрытой позолотой. Это было широко распространено в Александрии, где предположительно получила начало алхимия. В древней Индии медь использовалась в холистической медицинской науке Аюрведе для хирургических инструментов и другого медицинского оборудования. Древние египтяне (~2400 г. до н.э.) использовали медь для обеззараживания ран и питьевой воды, а позже в отношении головных болей, ожогов и зуда. Багдадская батарея с медными цилиндрами, припаянными к проволочному выводу, датируется с 248 г. до н.э. до 226 г. н.э. и имеет сходство с гальваническим элементом, в связи с чем люди полагают, что это была первая батарейка; не было подтверждено.21)
Учитывая расчетный ежегодный выход приблизительно в 15000 т, активность римлян в отношении добычи и плавки меди достигла уровня, непревзойденного до времен Промышленной революции; добыча наиболее интенсивно велась в провинциях, таких как Испания, Кипр и Центральная Европа. Ворота Иерусалимского храма выполнены из коринфской бронзы, покрытой позолотой. Это было широко распространено в Александрии, где предположительно получила начало алхимия. В древней Индии медь использовалась в холистической медицинской науке Аюрведе для хирургических инструментов и другого медицинского оборудования. Древние египтяне (~2400 г. до н.э.) использовали медь для обеззараживания ран и питьевой воды, а позже в отношении головных болей, ожогов и зуда. Багдадская батарея с медными цилиндрами, припаянными к проволочному выводу, датируется с 248 г. до н.э. до 226 г. н.э. и имеет сходство с гальваническим элементом, в связи с чем люди полагают, что это была первая батарейка; не было подтверждено.21)
Физические характеристики
Характерный цвет медь приобретает в результате взаимодействия с кислородом и образования тонкой оксидной пленки. Более тонкие пластины на просвет выглядят зеленовато-голубыми. Наиболее ярко выраженные физические свойства меди:
Более тонкие пластины на просвет выглядят зеленовато-голубыми. Наиболее ярко выраженные физические свойства меди:
- высокая электро- и теплопроводность (уступает только серебру),
- мягкость,
- пластичность,
- легко поддается вытягиванию и обработке,
- коррозионная стойкость.
Из прочих характеристик меди стоит отметить хорошую невосприимчивость к внешним природным факторам (температура, ультрафиолет, химическое воздействие) и приятный внешний вид (возможность патирования). В случаях, когда необходимо использовать более твердый материал, в ход идут латунь и бронза – сплавы меди с цинком и оловом соответственно. Медная продукция обладают высокой плотностью, может прокатываться в проволоку, пруток или лист любой толщины.
AllMetals
Медь
Большая роль меди в технике обусловлена рядом ее ценных свойств и прежде всего высокой электропроводностью, пластичностью, теплопроводностью. Благодаря этим свойствам медь — основные материал для проводов; свыше 50% добываемой меди применяют в электротехнической промышленности. Все примеси понижают электропроводность Меди, а потому в электротехнике используют металл высших сортов, содержащий не менее 99,9% Cu.
Все примеси понижают электропроводность Меди, а потому в электротехнике используют металл высших сортов, содержащий не менее 99,9% Cu.
Высокие теплопроводность и сопротивление коррозии позволяют изготовлять из меди ответственные детали теплообменников, холодильников, вакуумных аппаратов и т. п.
Применение сплавов меди
Более 30% меди идет на сплавы. Сплавы меди с другими металлами используют в машиностроении, в автомобильной и тракторной промышленности (радиаторы, подшипники), для изготовления химической аппаратуры. Медные сплавы — латуни (основная добавка цинк, Zn), бронзы (сплавы с разными элементами, главным образом металлами — оловом, алюминием, берилием, свинцом, кадмием и другими, кроме цинка и никеля) и медно-никелевые сплавы, в том числе мельхиор и нейзильбер. В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с алюминием и медь с никелем) применяют для чеканки монет — «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.
Применение меди в быту
Медь как художественный материал используется с медного века (украшения, скульптура, утварь, посуда). Кованые и литые изделия из меди и сплавов украшаются чеканкой, гравировкой и тиснением. Легкость обработки меди (обусловленная ее мягкостью) позволяет мастерам добиваться разнообразия фактур, тщательности проработки деталей, тонкой моделировки формы. Изделия из меди отличаются красотой золотистых или красноватых тонов, а также свойством обретать блеск при шлифовке. Медь нередко золотят, патинируют, тонируют, украшают эмалью. С 15 века медь применяется также для изготовления печатных форм.
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей. Медь самый широкоупотребляемый катализатор полимеризации ацетилена.
Кроме нужд тяжелой промышленности, связи, транспорта, некоторое количество меди (главным образом в виде солей) потребляется для приготовления минеральных пигментов, борьбы с вредителями и болезнями растений, в качестве микроудобрений, катализаторов окислительных процессов, а также в кожевенной и меховой промышленности и при производстве искусственного шелка.
Химические свойства
В условия низкой влажности медь почти не демонстрирует каких-либо особенных химических свойств. Однако при контакте с водой и углекислым газом она быстро вступает в окислительную реакцию, на ее поверхности образуется пленка, защищающая ее от разрушения. Также окисление происходит при нагреве до 375 градусов.
Металл вступает в активную реакцию с неметаллами галогеновой группы, селеном и серой. В паре с последней, к примеру, он воспламеняется. Медь с валентностью I и II участвует в создании комплексных соединений (двойных солей и аммиачных смесей), обладающих высокой стойкостью и применяемых во многих промышленных сферах.
Методы добычи
Медь добывают открытым и закрытым способом. Первый актуален, если руда находится в толще до 500 метров. Для более глубоких залежей строят специальные подземные шахты. Чистую медь получают в основном пирометаллургическим способом, реже – гидрометаллургическим.
Пирометаллургическая методика условно подразделяется на два этапа, и в качестве исходного сырья использует халькопирит (медный купорос). Первая стадия – флотация или окислительный обжиг. Целью этой технологии является обогащение медной руды, в которой повышена концентрация серы. В процессе обработки, сера удаляется до 1%, другие содержащиеся в руде металлы переводятся в оксидные соединения.
Первая стадия – флотация или окислительный обжиг. Целью этой технологии является обогащение медной руды, в которой повышена концентрация серы. В процессе обработки, сера удаляется до 1%, другие содержащиеся в руде металлы переводятся в оксидные соединения.
Химические формулы процесса:
- ZnS + 1.5O2 = ZnO + SO2 + Q – реакция протекает при температуре, превышающей +800 градусов;
- ZnS + 2O2 = ZnSO2 + Q – оптимальная температура варьируется в пределах +600/+700 градусов.
После этого, обогащённая руда плавится в шахтных печах при температуре + 14 500 градусов, преобразуясь в сплав, состоящий из сульфидов железа и меди (штейн). Чтобы повысить качество, проводится конвертерный обдув без подачи топлива. Содержание меди в таком сплаве составляет примерно 91%. Вторая стадия – рафинирование, после чего медная составляющая увеличивается до 99.9%.
Гидрометаллургический способ основывается на выщелачивании. Для этого руду дробят на небольшие куски, и заливают растворителями:
- Nh5OH;
- h3SO4;
- Fe (SO4).

В результате получается раствор, в котором выделяется медь и другие металлы. Формулы процесса:
- CuO+h3SO4>CuSO4+h3O – выщелачивание серной кислотой;
- CuSO4+2Fe2SO4>4FeSO4+2CuSO+S – применение сульфата железа;
- Cu2S + 2 Fe2 (SО4)3>2 СuSO4 + 4 FeSO4 + S – выщелачивание сернокислым железом.
Полученный раствор проходит последующую обработку для извлечения металла. Например, может использоваться методика цементации: CuSО4 + Fe>FeSО4 + Cu. Здесь в состав добавляются куски железа, заменяющие медную составляющую в сернокислых солях.
Область применения
Медная плита находит широкое применение в строительстве, автомобильной, корабельной и железнодорожной промышленности.
Медный лист применяется при возведении кровель, фасадов, заборов и ограждений. А из-за бактерицидности металлической поверхности изделий из меди делают предметы для использования в больницах: двери, ручки, поручни, перила и даже посуду.
Медная труба предназначена для транспортировки жидких и воздушных сред в системах водо- и газоснабжения, отопления, кондиционирования, а также в теплообменниках и холодильных установках. Помимо бытовых инженерных коммуникаций, такие трубы применяются в судостроении и энергетике.
Помимо бытовых инженерных коммуникаций, такие трубы применяются в судостроении и энергетике.
Медная проволока идет на производство кабельной продукции и проводов с невысоким сопротивлением и особенными магнитными свойствами.
Медная лента используется в приборостроении, электротехнике и радиоэлектронике, при изготовлении проводников, обмотков, силовых трансформаторов.
Медный пруток также нередко применяется в строительной и промышленной отрасли. Из него могут готовить подшипники, стеклоподъемники, водозапорную арматуру, декоративные конструкции в архитектуре и интерьере зданий.
Ее использование в строительстве
Высокие показатели электро- и теплопроводности обусловили для меди активное использование, как в строительстве, так и в автомобиле- и приборостроении. Сам же материал устойчив к негативному воздействию коррозии и ультрафиолетовых лучей, также без деформации и нарушения структуры переносит резкие температурные перепады.
Благодаря таким особенностям, позволяет производить детали и прочие конструкции, которые рассчитаны на длительное воздействие влаги.
Провода
Наибольший спрос медь получила именно в электротехнической области, в частности для производства проводов. С этой целью используется максимально чистый металл, поскольку второстепенные компоненты существенно снижают его токопроводимость. Если в готовом материале присутствует более 0,02% алюминия, то его способность проводить ток снижается на 10%.
Существенно возрастание сопротивления происходит в результате присутствия в сырье примесей неметаллического характера. Сам же металл относится крайне низким сопротивлением, которое уступает лишь серебру. Такая особенность металла также послужила его использованию в силовых трансформаторах и энергосберегающих приводах.
Проволока
Высокий уровень вязкости и пластичности обусловили активное использование меди для производства изделий с различными узорами. Проволока, которая была изготовлена из красной меди, после обжига становится максимально пластичной и мягкой. В таком состоянии она позволяет создавать узоры и орнаменты любой сложности.
Такая проволока активно используется в следующих отраслях:
- Электротехника;
- Электроэнергетика;
- Автомобилестроение;
- Судостроение;
- Производство кабеля и проводов.
Водо- и теплоснабжение
Благодаря своей высокой теплопроводности медь используется в различных теплообменниках и теплоотводных приборах. Иными словами, из нее изготавливают кулера для системных блоков, радиаторы отопления, трубы, кондиционеры и прочие приборы.
Медные трубы обладают абсолютно уникальными характеристиками, которые и обусловили их широкое распространение не смотря на высокую стоимость самого сырья. Такие изделия не бояться ультрафиолетового излучения, устойчивы к возникновению коррозии и температурным перепадам. Эти свойства позволяют производить монтаж медных труб даже при низких температурах воздуха.
Высокий показатель механической прочности, а также возможность механической обработки материала позволяют создавать бесшовные медные трубы, обладающие круглым сечением. Они рассчитаны на транспортировку жидких веществ или газов в системах газо- и водоснабжения, кондиционирования и отопления.
Они рассчитаны на транспортировку жидких веществ или газов в системах газо- и водоснабжения, кондиционирования и отопления.
О роли медных труб в водоснабжении расскажет данное видео:
Кровля
Одним из первых материалов, используемых в качестве кровельного покрытия, является медь. Такая кровля отличается длительным сроком службы (до 200 лет), который происходит благодаря ее уникальным особенностям. Кровля из меди спустя некоторое время претерпевает процесс окисления, который заключается в образовании патины.
Этот своего рода защитный слой уберегает поверхность меди от негативного влияния ультрафиолета, низких температур, влаги и прочих погодных явлений.
Таким образом, медная кровля сразу после своего монтажа имеет золотистый оттенок, но уже через 10 лет становится более темной, в некоторых случаях практически черного цвета. Этот процесс образования патины при желании можно искусственно ускорить.
Этот процесс образования патины при желании можно искусственно ускорить.
Про иные сфера применения меди читайте ниже.
Особенности популярных медных сплавов
Сплав М1 изготавливается в соответствии с ГОСТ 859-2014, является высокопластичным и хорошо обрабатываемым металлом, отличается наибольшим содержанием меди (99,9%). В качестве дополнительных элементов встречаются цинк, никель, фосфор, железо, мышьяк, кислород, олово, висмут (суммарно не более 0,1%). Удельное электрическое сопротивление составляет 0,018 мкОм. Сплав может быть двух типов – твердый (М1т) и мягкий (М1м), они различаются по пределам прочности и текучести. Металлопрокат востребован в автомобиле- и авиастроении, при создании проводников тока, криогенной техники, проволоки и прутков.
Сплав М2 имеет меньший коэффициент меди в составе (99,7%). Остальные 0,3% приходятся на никель, железо, сурьму, кислород, олово, свинец, серу, мышьяк. Данная марка пластична и не поддается ржавлению, превосходно обрабатывается под давлением и применяется для изготовления сплавов на медной основе и деталей холодильной техники.
Сплав М3 – это медь техническая, она включает наименьший процент металла среди представленных (99,5%). В качестве легирующих компонентов используются те же элементы, что и в М2, только в большей пропорции (до 0,5%), что делает этот сплав самым доступным по стоимости. Оптимально подходит для металлических изделий, которые реализуются прокатным способом, а также литейных сплавов.
Применение меди в разрезе теплопроводности
Высокая электропроводность меди является лишь одним из главных свойств, которые определяют широчайшие использования в быту и промышленности. Вторым основополагающим свойством меди является ее крайне высокая теплопроводность, которая при наличии примесей олова, мышьяка, фосфора, железа их других элементов резко падает вместе с ростом электрического сопротивления. Высокая теплопроводность, хороший теплообмен позволяют применять медь в теплообменниках, теплоотводах и приборах где они используются — холодильниках, кулерах, в кондиционерах. Лучшие компьютерные кулеры используют медные радиаторы, которые отводят тепло от процессоров и видеокарт.
Примеры применения меди — медицина, ювелирка, аксессуары
В настоящее время проводится широкий спектр исследований бактерицидных свойств меди. Издавна считалось, что медная посуда способствует уничтожению болезнетворных бактерий и является очень гигиеничным. Современные научные изыскания говорят о том, что использование меди в быту снижают перенос бактерий. Таким образом, возникают рекомендации использование меди в больничном быту и в поликлиниках как антисептика. Окружающие нас золотые изделия из золота разных проб являются стволам меди и золота, их пропорции и называют пробой. Чистое золото без меди мы видим , практически, только в слитках , которые хранятся в банках. Медь входит в число жизненно важных микроэлементов. Она участвует в процессе фотосинтеза и усвоении растениями азота, способствует синтезу сахара, белков, крахмала, витаминов. Чаще всего медь вносят в почву в виде медного купороса — пятиводного сульфата меди. В значительных количествах он ядовит, как и многие другие соединения меди, особенно для низших организмов. В малых дозах медь совершенно необходима всему живому. Также медь используют для никелирования и хромирования стали. Можно заметить, что когда с блестящих ручек и прочих элементов хоть капельку стирается серебристый блестящий слой, то под ним мы видим не сталь, а розоватый, тончайший слой медного напыления. Без этого слоя хромированные, никелированные детали становились бы облезлыми и некрасивыми очень быстро.
В малых дозах медь совершенно необходима всему живому. Также медь используют для никелирования и хромирования стали. Можно заметить, что когда с блестящих ручек и прочих элементов хоть капельку стирается серебристый блестящий слой, то под ним мы видим не сталь, а розоватый, тончайший слой медного напыления. Без этого слоя хромированные, никелированные детали становились бы облезлыми и некрасивыми очень быстро.
Биологическая ценность для человека
Медь относится к категории жизненно-необходимых элементов, и в организме взрослого человека, содержится около 100 граммов этого металла. Переоценка токсичности данного вещества проводилась в 2003 году Всемирной Организацией Здравоохранения. Исследования установили, что медь не является причиной заболеваний пищеварительного тракта, и не провоцирует развитие болезни Вильсона-Коновалова (гепатоцеребральная дистрофия, поражающая печень и головной мозг), как считалось ранее. Учёные пришли к выводу, что для здоровья человека больше вреден недостаток меди, а не её переизбыток.
Бактерицидность меди известна давно, а последние исследования в этой области подтвердили эффективность металла в профилактике свиного гриппа, поражения золотистым стафилококком. В экспериментах было установлено, что на медной поверхности погибает 99% болезнетворных бактерий в течение 2-х часов. Поэтому медь и её сплавы широко применяется для обеззараживания воды. В Европе из этого металла изготавливаются дверные ручки, замки, петли и перила, которые устанавливаются в медучреждениях и местах общего пользования.
Cooper and Silver: Physical & Chemical Properties – 1976 Words
Для химической и металлургической промышленности важно тщательное изучение свойств используемых материалов и применение справочных данных для анализа и возможного прогнозирования результатов практического применения. существенный. Таким образом, фактически информация о материале, его химическом составе и физико-химических свойствах имеет решающее значение для принятия решения о его полезности в конкретных практических задачах. Вообще говоря, возможность применения конструкционного материала в технических науках определяется его характеристиками. Такой подход обусловлен как необходимостью соответствия параметров материала промышленному применению, так и минимизацией повреждений в сочетании с созданием продукции более высокого качества.
Вообще говоря, возможность применения конструкционного материала в технических науках определяется его характеристиками. Такой подход обусловлен как необходимостью соответствия параметров материала промышленному применению, так и минимизацией повреждений в сочетании с созданием продукции более высокого качества.
Исследовательский вопрос данной работы сводился к анализу двух неактивных металлов — серебра и меди — по их физико-химическим параметрам для оценки их потенциального использования в промышленности. Характеристики, представляющие интерес и, следовательно, подлежащие измерению в данной работе, включают температуру, термодинамические и физические параметры. В частности, для меди и серебра описаны температуры плавления и кипения, а также плотность материалов и их удельная теплоемкость. Также указано электрическое сопротивление в сочетании с коэффициентом термической стабильности. Кроме того, учитывая, что оба металла являются классическими проводниками электрического тока, повышенный интерес вызвал регрессионный анализ электрического сопротивления в зависимости от температуры: если оба материала линейно увеличивают сопротивление, важно определить более подходящий материал для производственных задач. при заданной температуре. В то же время исследование удельной поглощаемой энергии является задачей проектирования элементов уменьшенной массы. Известно, что эта характеристика определяется как количество энергии — тепловой или электрической — поглощаемой единицей массы вещества. Таким образом, при разных значениях параметра приоритетное преимущество будет иметь тот материал, который поглощает больше энергии в электрохимической и машиностроительной промышленности. По этой причине оценка этого параметра представляет собой интригующую часть исследования, позволяющего определить эффективность меди и серебра как конструкционных материалов.
при заданной температуре. В то же время исследование удельной поглощаемой энергии является задачей проектирования элементов уменьшенной массы. Известно, что эта характеристика определяется как количество энергии — тепловой или электрической — поглощаемой единицей массы вещества. Таким образом, при разных значениях параметра приоритетное преимущество будет иметь тот материал, который поглощает больше энергии в электрохимической и машиностроительной промышленности. По этой причине оценка этого параметра представляет собой интригующую часть исследования, позволяющего определить эффективность меди и серебра как конструкционных материалов.
Актуальность данной темы была продиктована необходимостью качественной и количественной оценки двух металлов для реализации проектных задач. Исследования широкого спектра цифровых научных статей привели к выводу, что хотя сравнение серебра и меди не является новаторской идеей данной работы, большинство работ ориентированы на узко заданное направление, игнорируя общую информацию (Хлина и др. , 2017; Барахона и др., 2016). По этой причине данная диссертация будет подходящим материалом для обобщения имеющейся информации и демонстрации логики расчета и интерпретации некоторых наиболее важных величин.
, 2017; Барахона и др., 2016). По этой причине данная диссертация будет подходящим материалом для обобщения имеющейся информации и демонстрации логики расчета и интерпретации некоторых наиболее важных величин.
Определение физических свойств
Для облегчения визуализации и создания более понятного сравнения физические свойства двух металлов показаны в таблице 1.
Таблица 1. Сводная информация о физических свойствах материалов (Helmenstine, 2019 ; Hampson & Hanssen, 2019; Sebastian et al., 2017).
Как видно, данные по каждому металлу представляют собой набор чисел, значение которых, однако, больше для меди, чем для серебра. Таким образом, физические свойства меди и серебра различны по каждому из параметров, что и обосновывает столь разное использование материалов в промышленности. Прежде чем продемонстрировать практическое использование данных, необходимо уточнить, какие параметры были предложены для обсуждения. Температурой плавления металлов называют температуру перехода твердого кристаллического вещества в жидкую фазу, и наоборот. Температура кипения считается температурным порогом, при котором жидкость закипает при постоянном давлении. В то же время интересно отметить, что температуры плавления и кипения, хотя и являются сходными характеристиками, на самом деле представляют собой совершенно разные структурные изменения в материалах. При плавлении жидкая и твердая фазы находятся в равновесии, тогда как при кипении начинает преобладать жидкость. Плотность — скалярная физическая величина, зависящая от строения кристаллической решетки, определяемая для однородного вещества массой единицы его объема. Таким образом, из двух материалов одинакового объема большую массу имеет тот, у которого плотность выше. Удельная теплоемкость характеризует количество тепловой энергии, которое необходимо передать материалу, чтобы изменить его температуру на один градус. Из названия этого термина, электрическое сопротивление, становится ясно, что он описывает потенциал для проведения электрического тока: чем выше сопротивление, тем слабее проводится ток.
Температура кипения считается температурным порогом, при котором жидкость закипает при постоянном давлении. В то же время интересно отметить, что температуры плавления и кипения, хотя и являются сходными характеристиками, на самом деле представляют собой совершенно разные структурные изменения в материалах. При плавлении жидкая и твердая фазы находятся в равновесии, тогда как при кипении начинает преобладать жидкость. Плотность — скалярная физическая величина, зависящая от строения кристаллической решетки, определяемая для однородного вещества массой единицы его объема. Таким образом, из двух материалов одинакового объема большую массу имеет тот, у которого плотность выше. Удельная теплоемкость характеризует количество тепловой энергии, которое необходимо передать материалу, чтобы изменить его температуру на один градус. Из названия этого термина, электрическое сопротивление, становится ясно, что он описывает потенциал для проведения электрического тока: чем выше сопротивление, тем слабее проводится ток. Наконец, зависимость электрического сопротивления вещества от его текущей температуры характеризуется температурным коэффициентом сопротивления.
Наконец, зависимость электрического сопротивления вещества от его текущей температуры характеризуется температурным коэффициентом сопротивления.
Ориентируясь только на цифры из таблицы, необходимо сделать сразу несколько важных замечаний. Прежде всего, правильно будет отметить, что медь – более «твердый» металл, чем серебро. Хотя серебро на самом деле имеет большую молекулярную массу и плотность, оно относительно хорошо проводит электрический ток и требует меньших внешних усилий для использования в качестве проводника. Это также может быть связано с большим количеством свободных электронов. Во-вторых, для меди ситуация, по-видимому, обратная: металл имеет более высокие температуры кипения и плавления, что свидетельствует об относительной сложности его атомной структуры по сравнению с серебром. В-третьих, термоэлектрические свойства меди также показывают более высокую жесткость, а именно то, что металлу требуется больше тепловой энергии для нагрева на 1 градус: теплоемкость меди выше. Более высокая теплоемкость по сравнению с серебром делает медь более устойчивой к передаче электричества, а превосходное удельное электрическое сопротивление только подтверждает этот факт.
Более высокая теплоемкость по сравнению с серебром делает медь более устойчивой к передаче электричества, а превосходное удельное электрическое сопротивление только подтверждает этот факт.
Для того чтобы построить зависимость электрического сопротивления от температуры, необходимо обратиться к формуле этого параметра, представленной ниже. С помощью программы MS Excel были выполнены расчеты сопротивления для семнадцати контрольных точек и построен график, показанный на рисунке 1. Нетрудно заметить, что электрическое сопротивление каждого из металлов линейно возрастает с повышением температуры. Фактически это означает, что чем выше температура среды, тем более сложный материал будет выполнять функции проводника. Например, если бы нужно было выбирать, какой материал использовать для высокотемпературной работы под высоким напряжением, то при прочих равных условиях серебро было бы более выгодным вариантом.
p i = p 20 [1 + α(t – 20°C)]
Рис. 1. График зависимости электрического сопротивления от температуры.
1. График зависимости электрического сопротивления от температуры.Интересно отметить, что в основе явления линейности увеличения теплоемкости при повышении температуры лежит квантовое изменение конфигураций атомов. В частности, каждый из элементов имеет определенный запас колебательных и вращательных уровней внутренней энергии, которые начинают возбуждать в случае поступления в вещество дополнительной теплоты. Так как атом нагревается, их кинетическая энергия увеличивается, что приводит к более активным колебаниям атомов. Нагрев сопровождается увеличением заполнения этих уровней, в связи с чем увеличивается количество запасенной энергии металла.
Между тем представленные выше данные позволяют прогнозировать и оценивать характер физических свойств. В частности, с помощью графика можно прогнозировать значения теплоемкости металлов при конкретных температурах. Например, если бы в строительной отрасли стоял выбор между использованием меди и серебра в качестве материала высоковольтного провода, и уточнялось бы, что рабочая температура процесса будет достигать 1300 градусов, то благодаря графике это можно было понять, что серебро было бы более удобным вариантом.
Следует признать, что удельное количество поглощенной энергии представляет собой количество энергии (т. е. тепла), которая была передана веществу для изменения его сопротивления. Учитывая линейность роста удельного сопротивления и физический смысл величины, для установления связи между удельным электрическим сопротивлением и поглощенной энергией можно использовать следующее соотношение:
В то же время величину удельной поглощенной энергии можно найти формула:
В этой формуле нет. 4 видно, что существует прямая зависимость между удельной теплоемкостью вещества и удельной поглощенной энергией. В то же время величина энергии определяется разницей температур: чем существеннее был нагрет материал, тем больше энергии он смог поглотить. Разница температур также важна в формуле поиска электрического сопротивления. Таким образом, эта разница температур (ΔT) в формуле №. 4 является эквивалентом того, что используется в формуле удельного электрического сопротивления №. 1. После выражения разности температур получится следующее уравнение:
1. После выражения разности температур получится следующее уравнение:
Далее, если результат, полученный в пятой формуле, подставить в формулу №. 4 можно получить готовое выражение. При этом следует отметить, что вместо обобщенных значений удельной теплоемкости, электрического сопротивления и температурного коэффициента сопротивления правильнее использовать известные значения.
В целом нетрудно заметить несколько закономерностей, которые можно обнаружить при обращении к формуле №2. Первый момент, на который следует обратить внимание, это прямая зависимость уникальной поглощаемой энергии от теплоемкости материала: чем выше один из этих показателей, тем выше другой. При этом следует обратить внимание на знаменатель, в котором стоит температурный коэффициент сопротивления. Если подставить известные значения серебра и меди в формулы №. 6 и нет. 7, то должны получиться следующие выражения:
На основе формулы №. 9 и нет. 11, необходимо сказать, что первый член уравнения для серебра SEA сравним с таким же значением для меди. Подставив в формулы оставшееся значение p 20 , получим:
Подставив в формулы оставшееся значение p 20 , получим:
Завершающим этапом сравнения двух элементов по приведенным выше формулам будет определение характера зависимости удельной поглощаемой энергии от вида металл. Учитывая, что в формулах нет. 12 и нет. 13 единственной переменной является значение электрического сопротивления в конкретной точке, можно построить две функции и оценить кажущуюся разницу. Как показано на рисунке 2, значения удельной поглощенной энергии для серебра всегда будут выше, чем значения SEA для меди при тех же значениях удельного электрического сопротивления. Этот результат можно интерпретировать следующим образом: преобладание плотности энергии серебра свидетельствует о более высокой ценности этого материала, чем меди.
Рис. 2. Визуализация формул для определения особой поглощаемой энергии для двух материалов: меди (синяя линия) и серебра (зеленая). Выбор того или иного материала в качестве исходного для работы должен сопровождаться анализом его физических свойств. Конкретные критерии сравнения могут включать плотность, термоэлектрические и механические характеристики. Например, медь имеет более высокий приоритет с точки зрения термической стабильности и плотности, но проигрывает по удельной теплоемкости и сопротивлению. Серебро лучше проводит электрический ток, но само по себе является более плотным веществом, что увеличивает вес изделия на 15% по сравнению с медью. Подводя итог, важно сделать вывод, что выбор конкретного источника должен основываться на совокупности факторов, включая потребности, затраты и обоснованность использования.
Конкретные критерии сравнения могут включать плотность, термоэлектрические и механические характеристики. Например, медь имеет более высокий приоритет с точки зрения термической стабильности и плотности, но проигрывает по удельной теплоемкости и сопротивлению. Серебро лучше проводит электрический ток, но само по себе является более плотным веществом, что увеличивает вес изделия на 15% по сравнению с медью. Подводя итог, важно сделать вывод, что выбор конкретного источника должен основываться на совокупности факторов, включая потребности, затраты и обоснованность использования.
Ссылки
Хэмпсон, Дж., и Ханссен, С. (2019). Электротехническая практика . Cengage AU.
Helmenstine, AM (2019). Факты о меди: химические и физические свойства. МысльКо. Веб.
Helmenstine, AM (2019). Факты о серебре (атомный номер 47 и символ элемента Ag) . МысльКо. Веб.
МысльКо. Веб.
Helmenstine, AM (2019). Таблица удельного электрического сопротивления и проводимости . МысльКо. Веб.
Себастьян, М. Т. и др. (2017). Материалы для микроволновых печей и их применение . Джон Уайли и сыновья.
Хлина, Дж., Ребоун, Дж., Хирман, М., и Хамачек, А. (2017). Сравнение свойств толстой пленки меди и серебра на подложках из оксида алюминия [документ в формате PDF]. Веб.
Бараона, М., Бетанкур, Д., и Эллинджер, Ф. (2016). Сравнение бесчиповых меток СШП на гибких подложках , изготовленных из алюминия, меди или серебра [документ в формате PDF]. Веб.
Медь, свойства атома, химические и физические свойства
Медь, свойства атома, химические и физические свойства.
Поделитесь информацией:
Cu 29 Copper
63,546(3) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1
Copper is an element of периодическая таблица химических элементов Д. И. Менделеева с атомным номером 29. Находится в 11-й группе (по старой классификации — во вторичной подгруппе первой группы), в четвертом периоде периодической системы.
И. Менделеева с атомным номером 29. Находится в 11-й группе (по старой классификации — во вторичной подгруппе первой группы), в четвертом периоде периодической системы.
Общие сведения
Свойства атома меди
Химические свойства меди
Физические свойства меди
Кристаллическая решетка меди
Дополнительные сведения
Таблица химических элементов по Д.И. Менделеев
Общая информация:
| 100 | Общая информация | |
| 101 | Имя | Медь |
| 102 | Бывшее имя | |
| 103 | Латинское название | Купрум |
| 104 | Английское название | Медь |
| 105 | Символ | Медь |
| 106 | Атомный номер (номер в таблице) | 29 |
| 107 | Тип | Металл |
| 108 | Группа | Переход тяжелый, цветной металл |
| 109 | Был обнаружен | Известен с древних времен |
| 110 | Дата обнаружения | 9000 год. ДО Н.Э. ДО Н.Э. |
| 111 | Внешний вид И другие. | Ковкий металл розовато-оранжевого цвета (или розового цвета при отсутствии оксидной пленки) |
| 112 | Происхождение | Натуральный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и другие условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | 2D-материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0068 % |
| 120 | Содержание в морях и океанах (по массе) | 3,0·10 -7 % |
| 121 | Содержимое Вселенной и космоса (по массе) | 6,0·10 -6 % |
| 122 | Содержание на Солнце (по массе) | 0,00007 % |
| 123 | Содержание в метеоритах (по массе) | 0,011 % |
| 124 | Содержание в организме человека (по массе) | 0,0001 % |
Свойства атома меди:
| 200 | Свойства атома | |
| 201 | Атомная масса ( молярная масса ) | 63 546(3) у. (г/моль) (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 | 8
| 203 | Электронная оболочка | K2 L8 M18 N1 O0 P0 Q0 R0
|
| 204 | Атомный радиус (расчетный) | 145 вечера |
| 205 | Эмпирический радиус атома * | 135 вечера |
| 206 | Ковалентный радиус * | 132 вечера |
| 207 | Ионный радиус (кристалл) | Cu + 60 (2) вечера, 74 (4) вечера, 91 (6) пм, 71 (4) вечера, 87 (6) вечера, Cu 3+ низкое вращение 68 (6) вечера (в скобках указано координационное число – характеристика, определяющая число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 140 вечера |
| 209 | Электроны, протоны, нейтроны | 29 электронов, 29 протонов, 35 нейтронов |
| 210 | Семья (блок) | крестовина |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа периодической таблицы | 11-группа (по старой классификации – во вторичной подгруппе 1-й группы) |
| 213 | Спектр излучения |
Химические свойства меди:
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, 0, +1, +2 , +3, +4 |
| 302 | Валентность | I, II |
| 303 | Электроотрицательность | 1,90 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 745,48 кДж/моль (7,726380(4) эВ) |
| 305 | Электродный потенциал | Cu + + e – → Cu, E o = +0,520 В, Cu 2+ + e – → Cu + , E o = +0,153 В, Cu 2+ + 2e – → Cu, E или = +0,337 В |
| 306 | Сродство к электрону | 119,235(4) кДж/моль (1,23578(4) эВ) |
Физические свойства меди:
| 400 | Физические свойства | |
| 401 | Плотность * | 8,96 г/см 3 (при 20 °C и других стандартных условиях , состояние вещества – твердое), 8,02 г/см 3 (при температуре плавления 1084,62 °С и др. 7,962 г/см 3 (при 1127 °С и других стандартных условиях , состояние вещества – жидкость), 7,225 г/см 3 (при 2027 °С и других стандартных условиях, состояние вещества – жидкость), |
| 402 | Температура плавления * | 1084,62 °С (1357,77 К, 1984,32 °F) |
| 403 | Температура кипения * | 2562 °С (2835 К, 4643 °F) |
| 404 | Точка сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения газовоздушной смеси | |
| 407 | Молярная теплота плавления (энтальпия плавления ΔH плавка )* | 13,26 кДж/моль |
| 408 | Молярная теплота парообразования (энтальпия парообразования ΔH vap )* | 300,4 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,384 Дж/г·К (при 20 °С) |
| 410 | Молярная теплоемкость | 24,44 Дж/(К·моль) |
| 411 | Молярный объем | 7,12399 см³/моль |
| 412 | Теплопроводность | 401 Вт/(м·К) (при стандартных условиях), 401 Вт/(м·К) (при 300 К) |
| 413 | Коэффициент теплового расширения | 16,5 мкм/(М·K) (при 25 °C) |
| 414 | Коэффициент температуропроводности | |
| 415 | Критическая температура | |
| 416 | Критическое давление | |
| 417 | Критическая плотность | |
| 418 | Тройная точка | |
| 419 | Давление паров (мм рт. ст.) ст.) | 0,000000001 мм рт.ст. (при 672 °С), 0,00000001 мм рт. (при 727°С), 0,0000001 мм рт.ст. (при 787°С), 0,000001 мм рт.ст. (при 857°С), 0,00001 мм рт.ст. (при 934°С), 0,0001 мм рт.ст. (при 1025°С), 0,001 мм рт.ст. (при 1133°С), 0,01 мм рт.ст. (при 1264°С), 0,1 мм рт.ст. (при 1419°С), 1 мм рт.ст. (при 1617°С), 10 мм рт.ст. (при 1910°С), 100 мм рт.ст. (при 2312°С) |
| 420 | Давление пара (Па) | 1 Па (при 1509 К), 10 Па (при 1661 К), 100 Па (при 1850 К), 1 кПа (при 2089 К), 10 кПа (при 2404 К), 100 кПа (при 2834 К) |
| 421 | Стандартная энтальпия (теплота) образования ΔfH°
| 0 кДж/моль (при 298 К, для состояния вещества – твердое), 338 кДж/моль (при 298 К, для состояния вещества – газ) |
| 422 | Свободная энергия Гиббса (или энергия Гиббса) ΔG | 0 кДж/моль (при 298 К, для состояния вещества – твердое) |
| 423 | Стандартная молярная энтропия S° | 33,15 Дж/(моль К) (при 298 К, для состояния вещества – твердое), 166,3 Дж/(моль К) (при 298 К, для состояния вещества – газ) |
| 424 | Стандартная молярная теплоемкость C p | 24,4 Дж/(моль·К) (при 298 К, для состояния вещества – твердое), 20,8 Дж/(моль К) (при 298 К, для состояния вещества – газ) |
| 425 | Энтальпия (теплота) диссоциации (энтальпия растворения) ΔH дисс | |
| 426 | Абсолютная диэлектрическая проницаемость (диэлектрическая проницаемость) | |
| 427 | Магнитный тип | Диамагнитный материал |
| 428 | Температура Кюри (точка Кюри) | |
| 429 | Объемная магнитная восприимчивость | -9,63·10 -6 |
| 430 | Массовая магнитная восприимчивость | -1,08·10 -9 |
| 431 | Молярная магнитная восприимчивость | -5,46·10 -6 см 3 /моль |
| 432 | Электрический тип | Проводник |
| 433 | Электрическая проводимость в твердом теле | 59,0·10 6 см/м |
| 434 | Удельное электрическое сопротивление (удельное электрическое сопротивление) | 16,78 нОм·м (при 20 °C) |
| 435 | Сверхпроводимость при температуре | |
| 436 | Критическое поле разрушения сверхпроводимости | |
| 437 | Ширина запрещенной зоны | |
| 438 | Плотность носителей заряда | |
| 439 | Твердость по шкале Мооса | 3,0 |
| 440 | Твердость по Бринеллю | 235-878 МПа |
| 441 | Твердость по Виккерсу | 343-369 МПа |
| 442 | Скорость звука | 3810 м/с (при 20 °C) (тонкий отожженный стержень) |
| 443 | Поверхностное натяжение | 1120 мН/м (при 1140 °С) |
| 444 | Динамическая вязкость газов и жидкостей | 3,33 мПа·с (при 1100 °C), 3,12 мПа·с (при 1200 °C), 1,96 мПа·с (при 1677 °C) |
| 445 | Взрывоопасные концентрации газовоздушной смеси, % от объема | |
| 446 | Взрывоопасные концентрации газокислородной смеси, % от объема | |
| 446 | Предел прочности при растяжении | |
| 447 | Напряжение течения | |
| 448 | Предел удлинения | |
| 449 | Модуль Юнга | 110-128 ГПа |
| 450 | Модуль сдвига | 48 ГПа |
| 451 | Объемный модуль упругости | 140 ГПа |
| 452 | Коэффициент Пуассона | 0,34 |
| 453 | Показатель преломления |
Кристаллическая решетка меди:
| 500 | Кристаллическая решетка | |
| 511 | Кристаллическая решетка #1 | |
| 512 | Решетчатая конструкция | Гранецентрированный куб
|
| 513 | Параметры решетки | 3,615 Å |
| 514 | Отношение к/с | |
| 515 | Температура Дебая | 315 К |
| 516 | Имя пространственной группы симметрии | Fm_ 3м |
| 517 | Номер пространственной группы симметрии | 225 |
Дополнительная информация:
| 900 | Дополнительная информация | |
| 901 | Номер КАС | 7440-50-8 |
Примечание:
205* Эмпирический радиус атома меди согласно [1] и [3] равен 128 пм.
206* Ковалентный радиус меди согласно [1] и [3] составляет 132 ± 4 пм и 117 пм соответственно.
401* Плотность меди по [3] составляет 8,92 г/см 3 (при 0 °С и других стандартных условиях, состояние вещества – твердое).
402* Температура плавления меди по [3] и [4] составляет 1083,4 °С (1356,55 К, 1982,12 °F) и 1083 °С (1356,15 К, 1981,4 °F) ) соответственно.
403* Температура кипения меди по [3] и [4] составляет 2567 °С (2840,15 К, 4652,6 °F) и 2543 °С (2816,15 К, 4609,4 °F) соответственно .
407* Молярная теплота плавления (энтальпия плавления ΔH fus ) меди по [3] и [4] составляет 13,01 кДж/моль и 13 кДж/моль соответственно.
408* Молярная теплота парообразования (энтальпия парообразования ΔH vap ) меди по данным [3] и [4] составляет 304,6 кДж/моль и 302 кДж/моль соответственно.
Источники:
- https://en.wikipedia.org/wiki/Copper
- https://de.
 wikipedia.org/wiki/Купфер
wikipedia.org/wiki/Купфер - https://ru.wikipedia.org/wiki/Медь
- http://chemister.ru/Database/properties.php?dbid=1&id=239
[знать]
Таблица химических элементов Д.И. Менделеев
Коэффициент спроса 3492
Формула хлорида меди(II) – структура, свойства, применение, примеры вопросов
Хлорид меди(II) является неорганическим соединением и встречается в природе в виде безводного минерала, называемого толбахитом, и обезвоженного эриохальцита. Оба минерала добываются из фумарол. Хлорид меди (II) также известен как дихлорид меди, хлорид меди или дихлорид меди. В безводном виде представляет собой желтовато-коричневый порошок. В дигидрате он выглядит как зеленое кристаллическое твердое вещество.
Формула хлорида меди(II)
Формула хлорида меди(II): CuCl 2 . Хлорид меди(II) состоит из одного атома меди и двух атомов хлора. Медь — ковкий, пластичный металл, который присутствует в 11-й группе периодической таблицы. Его атомный номер равен 29 и представлен символом Cu. Медь является очень хорошим проводником тепла и электричества. Он используется вместе с различными металлами, такими как золото и серебро, в ювелирных изделиях. Хлор токсичен, едкий газ присутствует в 17-й группе периодической таблицы. Это второй по легкости газ в семействе галогенов. Его атомный номер равен 17 и представлен символом Cl. При комнатной температуре он имеет зеленовато-желтый цвет.
Его атомный номер равен 29 и представлен символом Cu. Медь является очень хорошим проводником тепла и электричества. Он используется вместе с различными металлами, такими как золото и серебро, в ювелирных изделиях. Хлор токсичен, едкий газ присутствует в 17-й группе периодической таблицы. Это второй по легкости газ в семействе галогенов. Его атомный номер равен 17 и представлен символом Cl. При комнатной температуре он имеет зеленовато-желтый цвет.
Структура хлорида меди(II)
Структура хлорида меди(II)
Физические свойства хлорида меди(II)
- Молекулярная масса хлорида меди(II) составляет 134,45 г/моль.
- Температура плавления хлорида меди(II) составляет 498°C.
- Температура кипения хлорида меди(II) составляет 993°C.
- Плотность CuCl 2 составляет 3,386 г/см 3 .
Химические свойства хлорида меди(II)
- Хлорид меди(II) вызывает коррозию алюминия.

- Степень окисления хлорида меди(II) +2. Это слабый окислитель, который реагирует с алюминиевой фольгой с образованием водорода, оксида меди(I) и хлорида алюминия.
Использование хлорида меди(II)
- CuCl 2 используется в качестве консерванта древесины, фунгицида, инсектицида и гербицида.
- Используется в чернилах для маркировки белья.
- CuCl 2 используется в производстве сельскохозяйственной химии.
- Также используется для очистки воды.
- Действует как дезодорант (предотвращает неприятный запах) в нефтяной промышленности.
- Является окислителем и очищающим средством.
- Дихлорид меди используется в качестве протравы при крашении и печатании текстиля.
- CuCl 2 используется в качестве катализатора в органических и неорганических реакциях. В производстве хлора CuCl 2 действует как катализатор из HCl.
Примеры вопросов
Вопрос 1: Как получают хлорид меди(II)?
Ответ:
Коммерчески Хлорид меди(II) получают хлорированием меди.
Химическая реакция хлорирования меди задается формулой хлорида меди?
Ответ:
Заряд хлора в хлориде меди равен -1, и для того, чтобы соединение меди в хлориде меди было стабильным, оно должно иметь заряд +1. Таким образом, заряд меди в хлориде меди равен +1. Поэтому его называют хлоридом меди (I).
Вопрос 3: Найдите молекулярную массу хлорида меди(II)?
Решение:
Атомный вес 1 атома меди = 63,546
Атомный вес 1 атома хлора = 35,453
Молекулярная масса CuCl 2 = 63,546 + (2 × 35,453)
= 134,45
Молекулярная масса хлорида меди(II) составляет 134,45 г/моль.
Вопрос 4: Опасен ли дихлорид меди?
Ответ:
Дихлорид меди опасен для здоровья. Вдыхание CuCl 2 вызывает кашель. Глотание вызывает рвоту и боль.




 стандартных условиях , состояние вещества – жидкое),
стандартных условиях , состояние вещества – жидкое), wikipedia.org/wiki/Купфер
wikipedia.org/wiki/Купфер
 Химическая реакция хлорирования меди задается формулой хлорида меди?
Химическая реакция хлорирования меди задается формулой хлорида меди? 