Металл cu это: Как рождается Cu
alexxlab | 11.12.1994 | 0 | Разное
Как рождается Cu
Главная / Спецпроекты / Элементарно
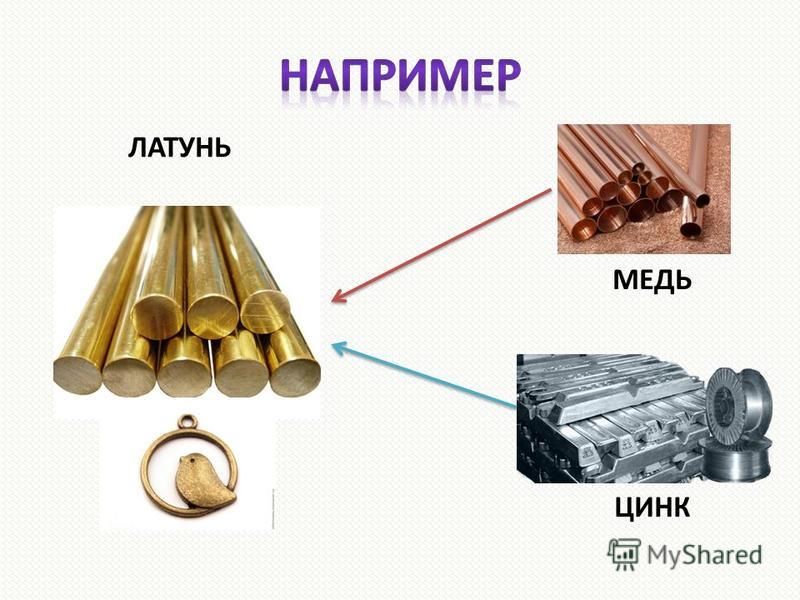
Медь (Cu) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Менделеева, с атомным номером 29. Изначально медь — это пластичный переходный металл золотисто–розового цвета.
История открытия
Медь является одним из самых известных и полезных металлов. Его латинское название — Cuprum — произошло от названия острова Кипр, где в древности — уже в III тысячелетии до нашей эры — обнаружили богатые месторождения этого металла. Согласно верованиям греков, люди получали медь от Афродиты, богини любви и плодородия. При этом металл начали применять ещё в VI–IV тысячелетии до нашей эры: в период, который, по мнению археологов, был промежуточным звеном между каменным и бронзовым веками. Согласно исследованиям учёных, наши древние предки ошибочно принимали куски самородной меди за камни.
Распространению меди способствовали возможность её холодной ковки, относительная простота выплавки из богатых руд, а также мягкость.
Русское «медь» происходит от греческого слова, означающего «рудник, копь». На территории современной России и соседних стран медные рудники появились за два тысячелетия до нашей эры. Остатки копей сейчас находят на Урале, в Закавказье, в Сибири и на Алтае.
Промышленную выплавку меди освоили только в XIII–XIV веках. В Москве в XV веке был основан Пушечный двор, где из бронзы — сплава меди с оловом или некоторыми другими металлами — отливали орудия разных калибров. Были выполнены и такие произведения литейного искусства, как Царь–пушка и Царь–колокол. В XVIII–XIX веках близ Онежского озера добывали самородную медь, которую отправляли на монетный двор в Санкт–Петербург. Открытие промышленных месторождений меди на Урале и в Сибири связано с именем Никиты Демидова. Именно он по указу Петра I в 1704 году начал чеканить медные деньги.
С открытием электричества большие объёмы меди стали идти на производство проводов и других, связанных с ними, изделий. И хотя в XX веке их чаще стали делать из алюминия, медь не потеряла значения в электротехнике. В современной индустрии медь — один из самых востребованных промышленных металлов. Она незаменима в автомобилестроении, изготовлении бытовой техники, прокладке электрических сетей, выпуске точных приборов, фурнитуры и прочем.
В недрах Таймыра
Весной 1945 года Сталин подписал знаменитое постановление «Об увеличении производства цветных металлов на Норильском комбинате», которое предусматривало как увеличение вдвое выпуска меди, так и, собственно, строительство медеплавильного завода. При этом руководству комбината удалось убедить Москву в том, что будущий завод должен быть не медеплавильным (с выпуском конечной продукции в виде черновой меди), а медным — с полным циклом огневого и электролитического рафинирования. Спустя три года — в 1948–м — разработали проект будущего объекта и приступили к его строительству.
Спустя ровно год после пуска завода, 21 декабря 1950 года, гидрометаллургический цех выдал первые катоды. После строительства и ввода в эксплуатацию в 1952 году второй печи производительность анодного передела увеличилось вдвое. В 1954 году на территории медного завода началось строительство сернокислотного цеха, где предполагалось получать серную кислоту для нужд комбината. В этом же году в цехе электролиза меди блоки электролизных ванн были переведены на оборотную циркуляцию, смонтирована оригинальная схема подогрева электролита, не имевшая аналогов в отрасли. С ноября 1976 года по май 1977 года на заводе был смонтирован опытно–промышленный плавильный агрегат нового поколения — печь плавки в жидкой ванне, она же печь Ванюкова (по имени изобретателя). 10–миллионная тонна норильской меди была выгружена из ванн электролизного цеха в декабре 1988 года.
Сегодня медный завод перерабатывает весь объём медных концентратов Норильской и Талнахской обогатительных фабрик. Он состоит из четырёх цехов — сушильного, плавильного, электролиза меди, а также МЦ–1.
Технология успеха
«Норникель» входит в первую десятку мировых производителей меди. По статистике, каждая вторая тонна этого металла в России – плод труда медеплавильщиков Норильска. Каждая сороковая тонна катодной меди в мире производится на нашем медном заводе.
При этом на мировом рынке цена меди, как и других металлов, постоянно колеблется, и сейчас на Лондонской бирже её стоимость составляет примерно 5 700 долларов за тонну. В 2019 году Заполярным филиалом было выпущено
360 тысяч тонн катодной меди.
Если не расписывать технологическую цепочку слишком подробно, получение меди в НПР выглядит следующим образом. С Талнахской и Норильской обогатительных фабрик концентрат поступает на медный завод, где его сперва осушают, а затем плавят в печи Ванюкова до получения штейна. Его на конвертерах перерабатывают в черновую медь, затем в анодных печах — в анодную. Из неё в свою очередь получают катодную медь. Затем продукция идёт на переработку в электролизный цех — там в огромных ваннах с серной кислотой при помощи электрического тока и получается основная продукция завода — первоклассные медные листы.
Его на конвертерах перерабатывают в черновую медь, затем в анодных печах — в анодную. Из неё в свою очередь получают катодную медь. Затем продукция идёт на переработку в электролизный цех — там в огромных ваннах с серной кислотой при помощи электрического тока и получается основная продукция завода — первоклассные медные листы.
© Заполярная Правда
Товарный вид
Антисептик
Природные бактерицидные и бактериостатические свойства меди способны минимизировать риск передачи заражения, поэтому металл является наиболее подходящим материалом для изготовления дверных ручек, поручней, перил, воздухо– и водоводов в местах большого скопления людей, в частности, в медицинских учреждениях.
Архитектура и декор
Медь используется во многих архитектурных элементах. Конструкции из этого металла обладают декоративными качествами: благодаря природным процессам окисления металл меняет расцветку от оранжевого цвета до коричневого и оттенков зелёного в течение десяти лет.
Трубы
Медные трубы широко используются для прокладки трубопроводов, тепловых коммуникаций, при установке климатического оборудования, в гидравлических и топливных системах двигателей. Медь распространена в теплотехнике, холодильном оборудовании и кондиционировании.
Электропроводники
Благодаря способности быстро и без потерь проводить электрический ток металл в чистом виде используют для изготовления кабелей широкого назначения — сетевых и силовых, аудиокабелей, проводов электропередачи. Для сердцевины кабелей применяется только чистая медь, наличие примесей значительно снижает проводниковый эффект.
Текст Михаил Туаев
28 февраля 2020г. в 15:45 22800
I found this helpful I did not find this helpful
элементарно
Химические свойства металлов — с чем реагируют? Свойства и таблица
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O 2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al 2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется h3. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + Nh5NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Деятельность металлов
Деятельность металлов
| Активность металлов | Классификация металлов На основе мероприятия |
| Прогнозирование Продукт реакций металлов основной группы | |
Деятельность Металлы
Основное различие между металлами заключается в легкости их обработки. они вступают в химические реакции. Элементы ближе к низу
левый угол периодической таблицы – это металлы,
большинство активный в смысле быть самым реактивным .
Например, литий, натрий и калий реагируют с водой.
Скорость этой реакции увеличивается по мере того, как мы спускаемся по этой колонке,
однако, поскольку эти элементы становятся более активными по мере того, как они становятся
более металлический.
они вступают в химические реакции. Элементы ближе к низу
левый угол периодической таблицы – это металлы,
большинство активный в смысле быть самым реактивным .
Например, литий, натрий и калий реагируют с водой.
Скорость этой реакции увеличивается по мере того, как мы спускаемся по этой колонке,
однако, поскольку эти элементы становятся более активными по мере того, как они становятся
более металлический.
Классификация металлов На основе деятельности
Металлы часто делят на четыре класса на основе их активность, как показано в таблице ниже.
Общие металлы, разделенные на классы на Основа их деятельности
| Металлы класса I: активные Металлы |
| Li, Na, K, Rb, Cs (группа IA) |
| Ca, Sr, Ba (группа IIA) |
| Металлы класса II: менее активные Металлы |
| Mg, Al, Zn, Mn |
| Металлы класса III: структурные Металлы |
| Cr, Fe, Sn, Pb, Cu |
| Металлы класса IV: чеканка Металлы |
| Ag, Au, Pt, Hg |
Наиболее активные металлы настолько реакционноспособны, что легко
в сочетании с O 2 и H 2 Пары O в
атмосфере и поэтому хранятся под инертной жидкостью, такой
как минеральное масло. Эти металлы встречаются исключительно в группах IA.
и IIA периодической таблицы.
Эти металлы встречаются исключительно в группах IA.
и IIA периодической таблицы.
Металлы второго класса несколько менее активны. Они не реагируют с водой при комнатной температуре, но реагируют быстро с кислотами.
Третий класс содержит такие металлы, как хром, железо, олово, и свинец, которые реагируют только с сильными кислотами. Он также содержит даже менее активные металлы, такие как медь, которая растворяется только при обрабатывают кислотами, способными окислять металл.
Металлы четвертого класса настолько нереакционноспособны, что практически инертны при комнатной температуре. Эти металлы идеально подходят для изготовление украшений или монет, потому что они не реагируют с огромным большинство веществ, с которыми они ежедневно поступают контакт. В результате их часто называют «чеканкой монет». металлов.”
Прогнозирование продукта Реакций металлов основной группы
Продукт многих реакций между металлами основной группы и
другие элементы можно предсказать по электронным конфигурациям
элементов.
Пример. Рассмотрим реакцию между натрием и хлором с образованием образуют хлорид натрия. Требуется больше энергии, чтобы удалить электрон из атома натрия в ион Na + , чем получаем обратно когда этот электрон присоединяется к атому хлора с образованием Cl – ион. Однако после образования этих ионов сила притяжения между этими ионами высвобождает достаточно энергии, чтобы сделать следующее реакция экзотермическая.
| Na( с ) + 1 / 2 Cl 2 ( г ) NaCl( с ) | Н или = -411,3 кДж/моль |
Конечным результатом этой реакции является перенос одного электрона
от нейтрального атома натрия к нейтральному атому хлора с образованием Na + и ионы Cl – , имеющие конфигурации с заполненными оболочками.
Калий и водород имеют следующий электрон конфигурации.
| К: [Ar] 4 с 1 | Г: 1 с 1 |
Когда эти элементы реагируют, электрон должен быть передан от одного элемента к другому. Мы можем решить, какой элемент должен потерять электрон, сравнив первую энергию ионизации для калия (418,8 кДж/моль) с водородом (1312,0 кДж/моль).
Калий с гораздо большей вероятностью потеряет электрон в этой реакции, что означает, что водород получает электрон с образованием ионов K + и H – .
Открытый доступ SCIRP
Издательство научных исследований
Журналы от A до Z
Журналы по темам
- Биомедицинские и медико-биологические науки.

- Бизнес и экономика
- Химия и материаловедение.
- Информатика. и общ.
- Науки о Земле и окружающей среде.
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные науки. и гуманитарные науки
Журналы по теме
- Биомедицина и науки о жизни
- Бизнес и экономика
- Химия и материаловедение
- Информатика и связь
- Науки о Земле и окружающей среде
- Машиностроение
- Медицина и здравоохранение
- Физика и математика
- Социальные и гуманитарные науки
Публикация у нас
- Представление статей
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
Публикуйте у нас
- Представление статьи
- Информация для авторов
- Ресурсы для экспертной оценки
- Открытые специальные выпуски
- Заявление об открытом доступе
- Часто задаваемые вопросы
Подпишитесь на SCIRP
Свяжитесь с нами
клиент@scirp. org org | |
| +86 18163351462 (WhatsApp) | |
| 1655362766 | |
| Публикация бумаги WeChat |
| Недавно опубликованные статьи |
| Недавно опубликованные статьи |
Исследование приложения пятой силы с использованием модели Дилатона и скалярного поля инфлатона Падманабхана в ранней Вселенной для генерации ГВ и гравитонов()
Эндрю Уолкотт Беквит
Журнал физики высоких энергий, гравитации и космологии Том 8 №4, 28 октября 2022 г.

DOI: 10.4236/jhepgc.2022.84081 17 загрузок 108 просмотров
Гибридная модель для прогнозирования ответа опухоли прямой кишки во время лучевой терапии()
Апеке Сена, Гобер Лоран, Буссион Николя, Висвикис Димитрис, Саут Оливье, Колин Тьерри, Ламбен Филипп, Роден Винсент, Реду Паскаль
Открытый журнал биофизики Том 12 № 4, 28 октября 2022 г.
DOI: 10.4236/ojbiphy.2022.124012 15 загрузок 82 просмотров
Геофизические исследования потенциала подземных вод песка Нанка в Обоси и его окрестностях, штат Анамбра, Нигерия()
Нельсон Оньебути Нвоби, Соломон Экене Океке, Чеквубе Ннамди Диди, Августин Обиора Окпара
Журнал «Водные ресурсы и охрана» Том 14 №10, 28 октября 2022 г.

DOI: 10.4236/jwarp.2022.1410038 12 загрузок 95 просмотров
Исследование надежности нового электромеханического устройства, предназначенного для измерения относительной дорсальной подвижности первого луча стопы()
Нильс Реймонд, Квентин Праз, Спиридон Шойнас, Навиндравадханам Сокалингам, Антуан Акер, Виктор Дюбуа-Ферьер, Филипп Пассероб, Матье Ассаль
Открытый журнал ортопедии Том 12 №10, 28 октября 2022 г.
DOI: 10.4236/ojo.2022.1210039 12 загрузок 97 просмотров
Разработка перспективной конструкции ВТСП-проводника центрального соленоида малогабаритного термоядерного реактора ТРТ()
Виктор Сытников, Сергей Лелехов, Василий Зубко
Машиностроение Том 14 №10, 28 октября 2022 г.