Металлическая кристаллическая решетка определение: Типы кристаллических решёток — урок. Химия, 8 класс.
alexxlab | 10.03.2022 | 0 | Разное
Кристаллическая решетка: определение, ее основные типы
Абсолютно любое химическое вещество, существующее в природе, образовано большим числом одинаковых частиц, которые связаны между собою. Все вещества существуют в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Когда затруднено тепловое движение (при низких температурах), а также в твердых веществах частицы строго ориентированы в пространстве, что проявляется в их точной структурной организации.
Абсолютно любое химическое вещество, существующее в природе, образовано большим числом одинаковых частиц, которые связаны между собою. Все вещества существуют в трёх агрегатных состояниях: газообразном, жидком и твёрдом. Когда затруднено тепловое движение (при низких температурах), а также в твердых веществах частицы строго ориентированы в пространстве, что проявляется в их точной структурной организации.
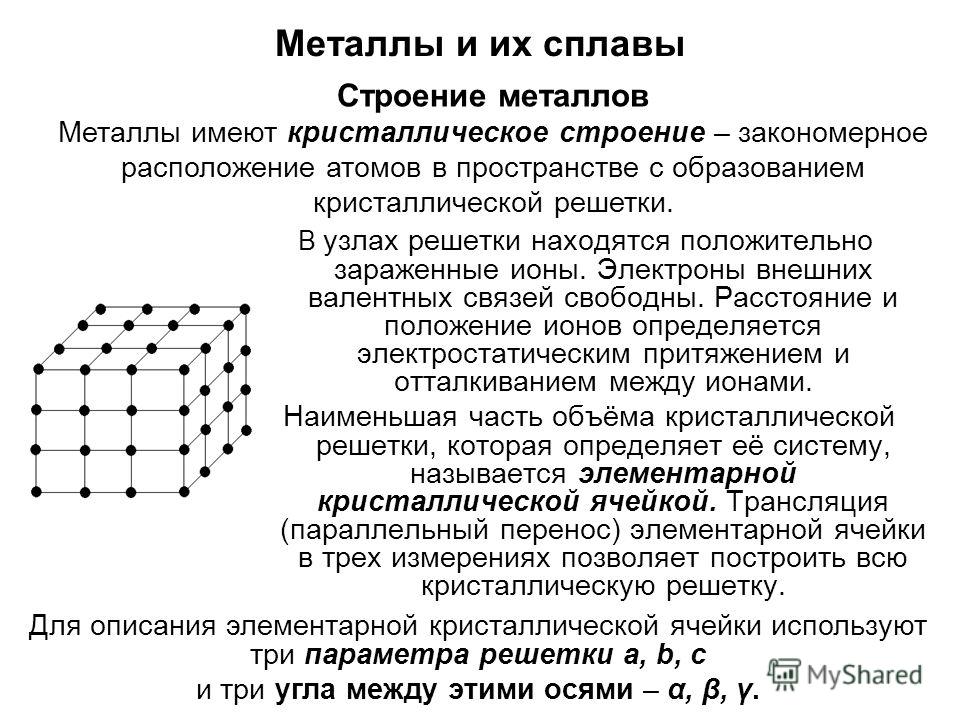
Кристаллическая решётка вещества – это структура с геометрически упорядоченным расположением частиц (атомы, молекулы либо ионы) в определённых точках пространства. В различных решетках различают межузловое пространство и непосредственно узлы – точки, в которых расположены сами частицы.
В различных решетках различают межузловое пространство и непосредственно узлы – точки, в которых расположены сами частицы.
Кристаллическая решётка бывает четырех типов: металлическая, молекулярная, атомная, ионная. Типы решеток определяются в соответствии с видом частиц, расположенных в их узлах, а также характером связей между ними.
Кристаллическая решётка называется молекулярной в том случае, если в ее узлах располагаются молекулы. Они связаны между собой межмолекулярными сравнительно слабыми силами, называемые ван-дер-ваальсовыми, однако сами атомы внутри молекулы соединяются существенно более сильной ковалентной связью (полярной либо неполярной). Молекулярная кристаллическая решетка свойственна хлору, твердому водороду, двуокиси углерода и другим веществам, являющимся газообразными при обычной температуре.
Кристаллы, которые образуют благородные газы, также имеют молекулярные решетки, состоящие из одноатомных молекул. Большинство твердых органических веществ имеют именно такую структуру. Число же неорганических веществ, которым свойственна молекулярная структура, весьма невелико. Это, например, твердые галогеноводороды, природная сера, лед, твердые простые вещества и некоторые другие.
Число же неорганических веществ, которым свойственна молекулярная структура, весьма невелико. Это, например, твердые галогеноводороды, природная сера, лед, твердые простые вещества и некоторые другие.
При нагревании относительно слабые межмолекулярные связи разрушаются довольно легко, поэтому вещества с такими решетками имеют очень низкие температуры плавления и малую твердость, они нерастворимы либо малорастворимы в воде, растворы их практически не проводят электрический ток, характеризуются значительной летучестью. Минимальные температуры кипения и плавления – у веществ из неполярных молекул.
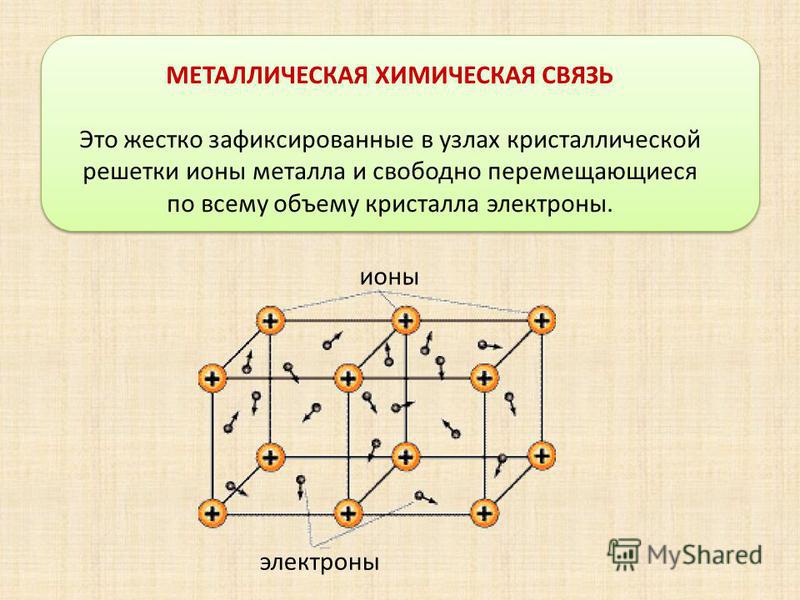
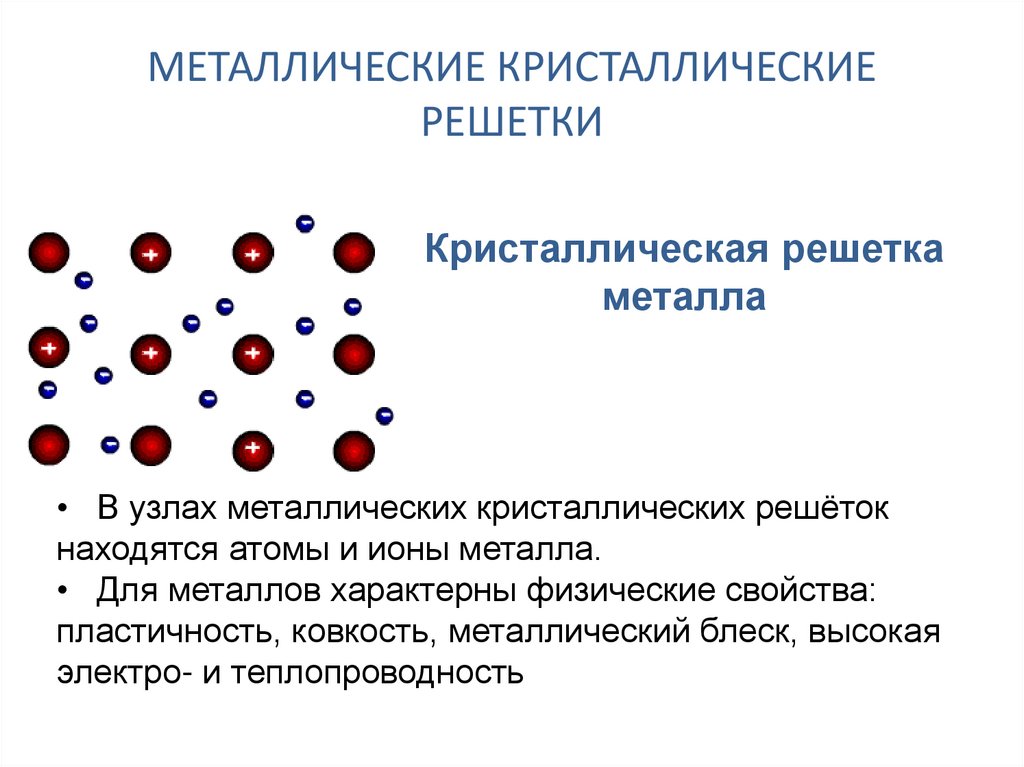
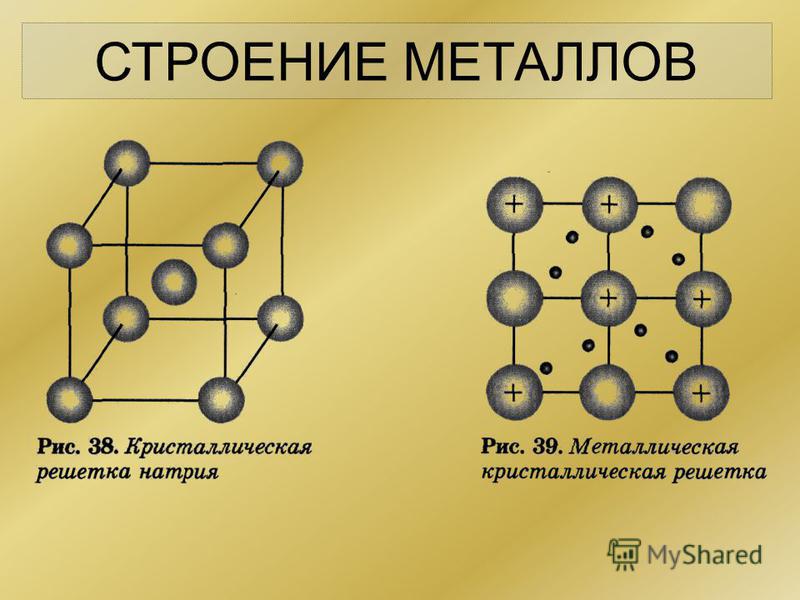
Металлической называется такая кристаллическая решетка, узлы которой сформированы атомами и положительными ионами (катионами) металла со свободными валентными электронами (отцепившимися от атомов при образовании ионов), беспорядочно движущимися в объеме кристалла. Однако эти электроны по существу являются полусвободными, так как могут беспрепятственно перемещаться только в рамках, которые ограничивает данная кристаллическая решетка.
Электростатические электроны и положительные ионы металлов взаимно притягиваются, чем объясняется стабильность металлической кристаллической решетки. Совокупность свободных движущихся электронов называют электронным газом – он обеспечивает хорошую электро- и теплопроводность металлов. При появлении электрического напряжения электроны устремляются к положительной частице, участвуя в создании электрического тока и взаимодействуя с ионами.
Металлическая кристаллическая решетка характерна, главным образом, для элементарных металлов, а также для соединений различных металлов друг с другом. Основные свойства, которые присущи металлическим кристаллам(механическая прочность, летучесть, температура плавления), достаточно сильно колеблются. Однако такие физические свойства, как пластичность, ковкость, высокая электро- и теплопроводность, характерный металлический блеск свойственны лишь исключительно кристаллам с металлической решеткой.
Типы кристаллических решёток ℹ️ таблица с примерами атомной, ионной, молекулярной, металлической кристаллической решеткой
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном.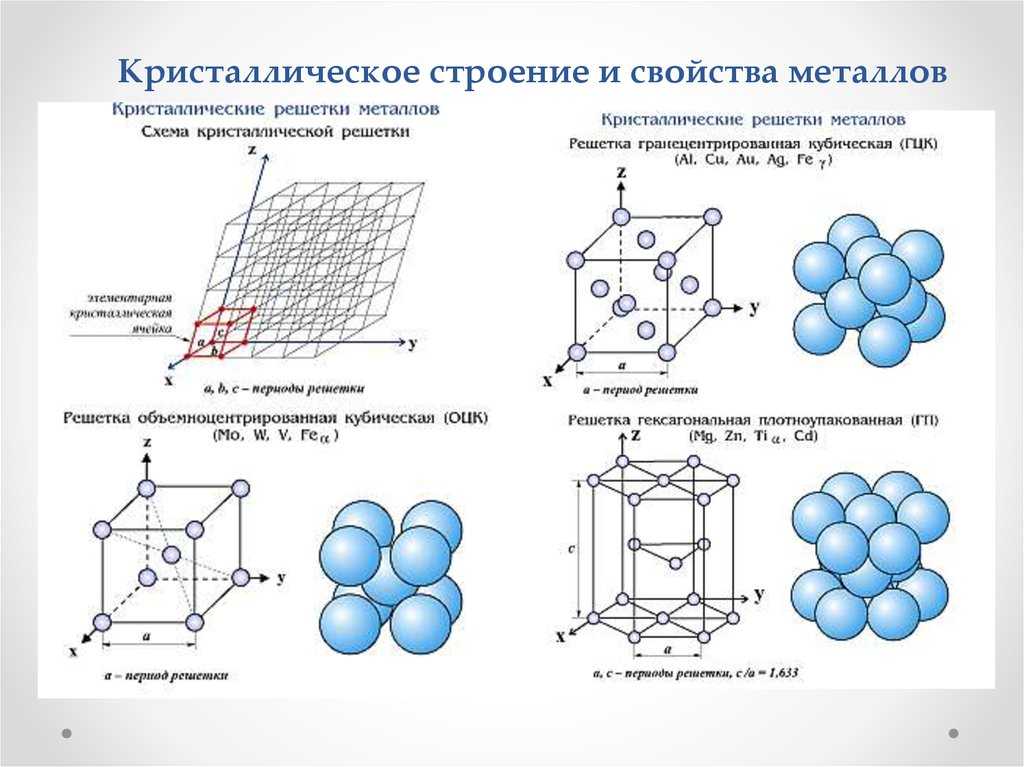 Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Молекулярно-кинетическая теория
Все молекулы состоят из мельчайших частиц – атомов. Все открытые на настоящий момент атомы собраны в таблице Менделеева.
Атом – это мельчайшая, химически неделимая частица вещества, сохраняющая его химические свойства. Атомы соединяются между собой химическими связями. Ранее мы уже рассматривали виды химических связей и их свойства. Обязательно изучите теорию по теме: Типы химических связей, перед тем, как изучать эту статью!
Теперь рассмотрим, как могут соединяться частицы в веществе.
В зависимости от расположения частиц друг относительно друга свойства образуемых ими веществ могут очень сильно различаться. Так, если частицы расположены друг от друга далеко (расстояние между частицами намного больше размеров самих частиц), между собой практически не взаимодействуют, перемещаются в пространстве хаотично и непрерывно, то мы имеем дело с газом.
Если частицы расположены близко друг к другу, но хаотично, больше взаимодействуют между собой, совершают интенсивные колебательные движения в одном положении, но могут перескакивать в другое положение, то это модель строения жидкости.
Если же частицы расположены близко к друг другу, но более упорядоченно, и больше взаимодействуют между собой, а двигаются только в пределах одного положения равновесия, практически не перемещаясь в другие положения, то мы имеем дело с твердым веществом.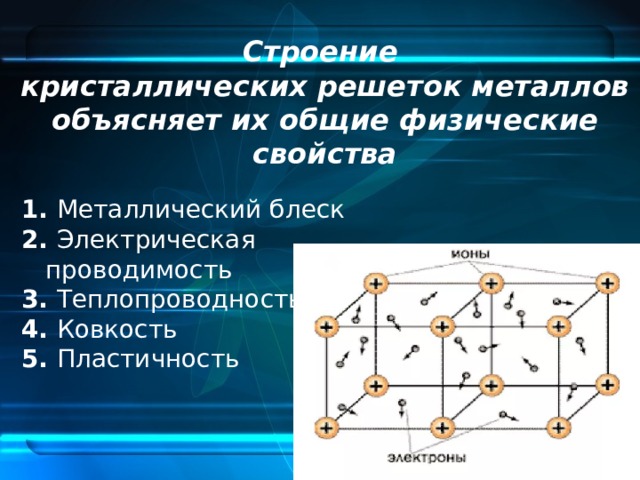
Большинство известных химических веществ и смесей могут существовать в твердом, жидком и газообразном состояниях. Самый простой пример – это вода. При нормальных условиях она жидкая, при 0 оС она замерзает – переходит из жидкого состояния в твердое, и при 100 оС закипает – переходит в газовую фазу – водяной пар. При этом многие вещества при нормальных условиях – газы, жидкости или твердые. Например, воздух – смесь азота и кислорода – это газ при нормальных условиях. Но при высоком давлении и низкой температуре азот и кислород конденсируются и переходят в жидкую фазу. Жидкий азот активно используют в промышленности. Иногда выделяют плазму, а также жидкие кристаллы, как отдельные фазы.
Очень многие свойства индивидуальных веществ и смесей объясняются взаимным расположением частиц в пространстве друг относительно друга!
Данная статья рассматривает свойства твердых тел, в зависимости от их строения. Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Основные физические свойства твердых веществ: температура плавления, электропроводность, теплопроводность, механическая прочность, пластичность и др.
Температура плавления – это такая температура, при которой вещество переходит из твердой фазы в жидкую, и наоборот.
Пластичность – это способность вещества деформироваться без разрушения.
Электропроводность – это способность вещества проводить ток.
Ток – это упорядоченное движение заряженных частиц. Таким образом, ток могут проводить только такие вещества, в которых присутствуют подвижные заряженные частицы. По способности проводить ток вещества делят на проводники и диэлектрики. Проводники – это вещества, которые могут проводить ток (т.е. содержат подвижные заряженные частицы). Диэлектрики – это вещества, которые практически не проводят ток.
В твердом веществе частицы вещества могут располагаться хаотично, либо более упорядоченно. Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.
Если частицы твердого вещества расположены в пространстве хаотично, вещество называют аморфным. Примеры аморфных веществ – уголь, слюдяное стекло.
Аморфный бор
Если частицы твердого вещества расположены в пространстве упорядоченно, т.е. образуют повторяющиеся трехмерные геометрические структуры, такое вещество называют кристаллом, а саму структуру – кристаллической решеткой. Большинство известных нам веществ – кристаллы. Сами частицы при этом расположены в узлах кристаллической решетки.
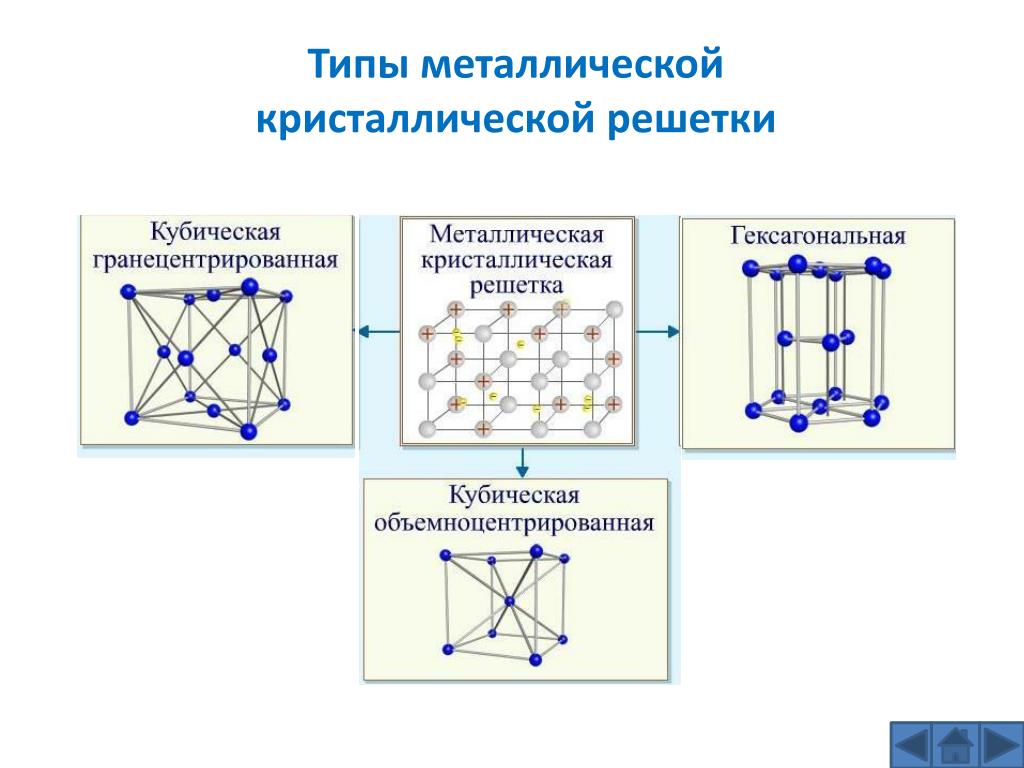
Кристаллические вещества различают, в частности, по типу химической связи между частицами в кристалле – атомные, молекулярные, металлические, ионные; по геометрической форме простейшей ячейки кристаллической решетки – кубическая, гексагональная и др.
В зависимости от типа частиц, образующих кристаллическую решетку, различают атомную, молекулярную, ионную и металлическую кристаллическую структуру.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
Металлическаякристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Что такое металл и чем он отличается от неметалла?
Иными словами, как можно понять, что перед нами находится металлический материал? Ответы на все эти вопросы можно получить, если рассмотреть уникальные свойства металлов. К ним относятся следующие основные:
- Наличие металлического блеска при полировке поверхности. Все металлы блестят, в своем большинстве они имеют серый цвет, однако, некоторые металлы обладают специфической окраской, например, висмут розовый, медь красноватая, а золото желтое.
- Высокая теплопроводность и электропроводность. При комнатной температуре наиболее высокие показатели для этих физических свойств характерны для меди и серебра.

- При комнатной температуре практически все металлы находятся в твердом агрегатном состоянии материи. Исключение составляет ртуть, которая плавится уже при -39 oC.
- Будучи в твердом состоянии, металлы кристаллическим строением характеризуются. Если расплав рассматриваемого материала слишком быстро охлаждать, то он приобретает аморфную структуру, в которой все же сохраняется ближний порядок.
- Температуры плавления и плотности металлов варьируются в широких пределах. Так, элемент вольфрам является самым тугоплавким (3410 oC). Самым же тяжелым считается осмий (в 22,6 раза плотнее воды), а самым легким – литий (почти в 2 раза менее плотный, чем вода).
- Все металлы химически активны. Поскольку они обладают низкой электроотрицательностью, то в химических реакциях их атомы отдают электроны и превращаются в положительно заряженные ионы (катионы).
Выше в списке были перечислены основные свойства металлов, которые их отличают от неметаллических материалов.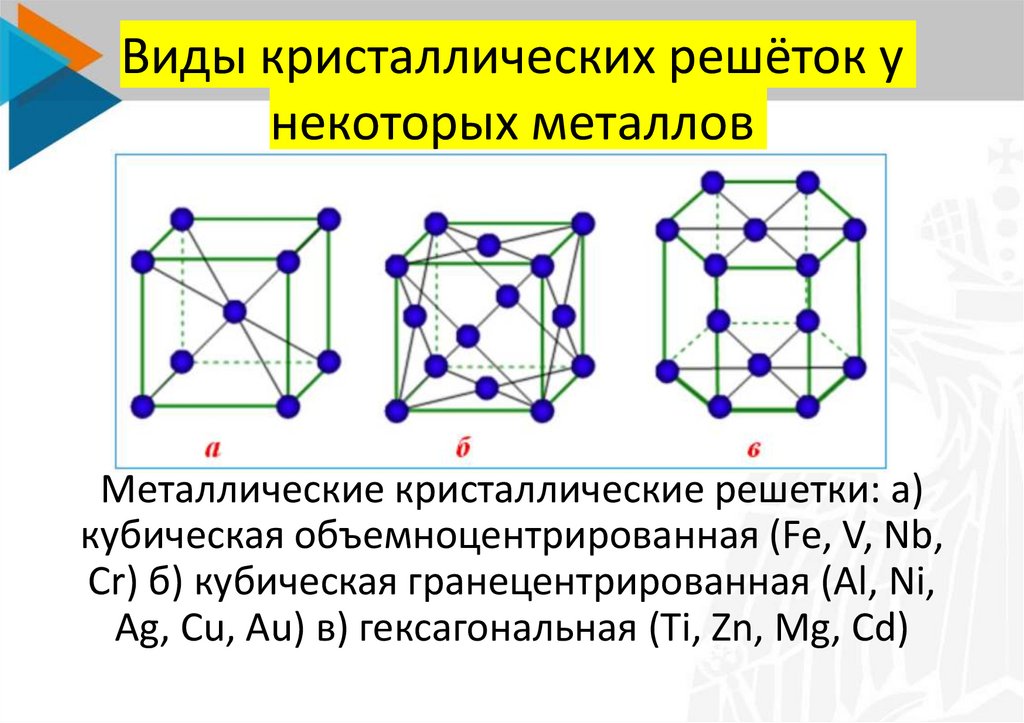 Примерами последних являются кислород, азот, благородные газы, сера, кремний, углерод и некоторые другие. Заметим, что все живые организмы состоят в основном из неметаллов.
Примерами последних являются кислород, азот, благородные газы, сера, кремний, углерод и некоторые другие. Заметим, что все живые организмы состоят в основном из неметаллов.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Классификация металлов по химическому составу
Химические свойства чистых элементов определяются строением атомов реальных металлов и прежде всего их атомным числом, характеризующим их способность реагировать с водородом, кислородом и другими элементами. Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Химические характеристики реально применяемых металлов могут сильно отличаться от параметров чистого вещества как в лучшую, так и в худшую сторону.
Нежелательные добавки называют примесями, а те, что вносятся преднамеренно для изменения параметров в нужную сторону — легирующими присадками.
Общепризнанной является классификация, основанная на указании главного компонента сплава.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Физические свойства металлов
Физические свойства определяются внутренним строением металлов.
Главное отличие металлов от других элементов — это их электропроводность и магнитные свойства.
И хотя ученые создали неметаллические материалы, обладающие другим строением, но такими же свойствами, как у металлов и сплавов, они еще слишком дороги для массового применения. Многие химически чистые металлы обладают недостаточной прочностью для практических применений, чтобы исправить ситуацию, в технике и строительстве используют их сплавы.
Физические свойства металлов
Добавление тех или иных присадок приводит к росту прочность получаемого вещества в десятки раз по отношению к исходному элементу.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье.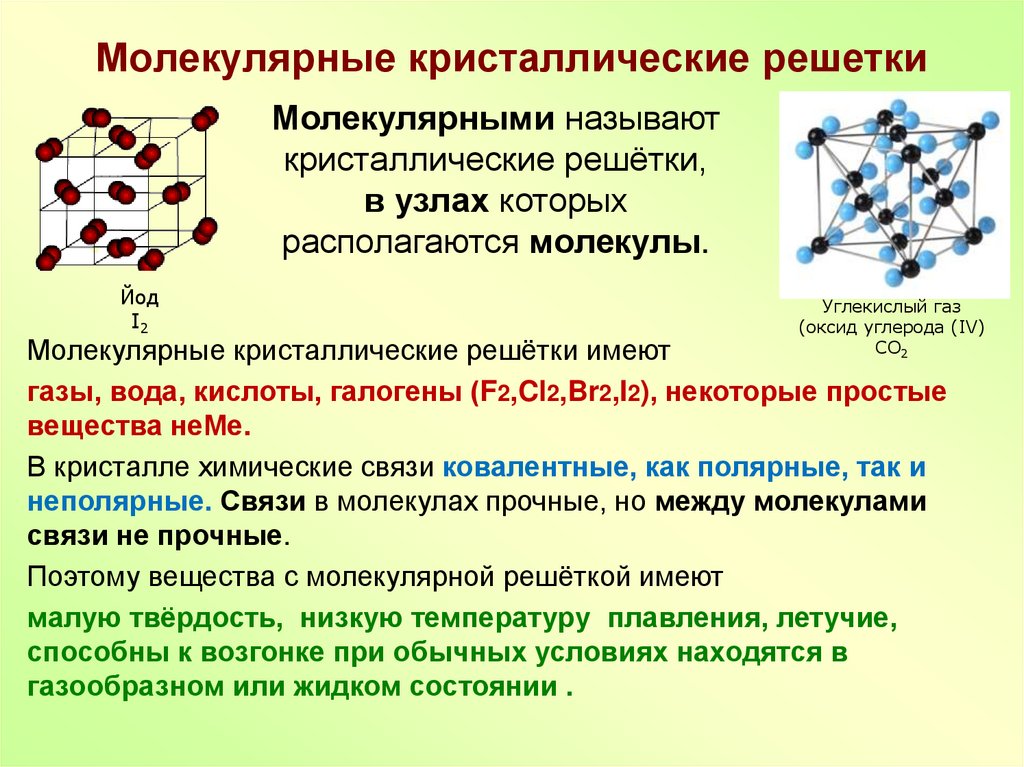 Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Основные группы металлов в промышленности
Индустрия делит металлы на большие группы:
- Черные.
- Цветные легкие.
- Цветные тяжелые.
- Благородные.
- Редкоземельные и щелочные.
Черные металлы
В эту группу входят железо, марганец, хром и их сплавы. Группа также включает в себя стали, чугуны и ферросплавы. Эти вещества обладают хорошей электропроводностью и уникальными магнитными характеристиками.
Черные металлы
Черные металлы покрывают до 90% мировой потребности в металлоизделиях.
Легкие цветные металлы
Отличаются низкой плотностью. Группа включает в себя алюминий, титан, магний. Эти реже встречаются, чем железо, и обходятся дороже в добыче руды и в производстве. Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.
Они используются там, где малый вес изделия или детали окупает ее большую стоимость – в самолетостроении, производстве электроники, в коммуникационной индустрии.
Легкие цветные металлы
Титан не вызывает отторжения со стороны иммунной системы и применяется в протезировании костной ткани.
Тяжелые цветные металлы
Это элементы с большим удельным весом, такие, как медь, олово, свинец, цинк и никель. Обладают хорошей электропроводностью.
Медь Олово Цинк Свинец Чистый никель
Они широко используются как катализаторы реакций, в изготовлении электроматериалов, в электронике, на транспорте – везде, где требуются достаточно прочные, упругие и коррозионностойкие материалы.
Благородные металлы
В эту группу входят золото, серебро, платина, а также редко встречающееся рутений, родий, палладий, осмий, иридий. Они обладают наибольшим удельным весом, высокой коррозионной устойчивостью и высокой электрической и тепловой проводимостью.
Золото и платина
Серебро
На заре человечества золото, серебро и платина применялись как универсальный платежный инструмент и как средство накопления богатств. С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
С развитием цифровой экономики и переходом платежей в виртуальность важнее стаи их уникальные физические свойства
Редкоземельные и щелочные
К редкоземельным относятся скандий, иттрий, лантан и еще 15 редких элементов. Эти элементы отличаются значительным удельным весом, высокой химической активностью и применяются в высокотехнологичных отраслях.
Иттрий
Сканидий
Лантан
К щелочным относятся литий, калий, натрий и другие. Все они отличаются малым удельным весом и исключительной химической активностью и при реакции с водой образуют щелочи, широко применяемы в быту и промышленности в составе мыла и других моющих средств.
Щелочные металлы
Добыча золота
Сегодня основным добытчиком золота является государство, которое добывает металл промышленным методом. В России первый самородок, а в последствии и рудник был найден в 1745 году. Сегодня добычей золота в России занимаются 16 компаний. Добыча ведется на территории Чукотки, Магаданской области, в Амурской и Иркутской области, в Хабаровском и Красноярском крае, в Челябинске.
Самыми крупными золотодобывающими странами являются Китай, Россия и Австралия.
Так процесс золотодобычи сложный и дорогостоящий, специалисты постоянно работают над его удешевлением. Наиболее распространенный способ – закрытие нерентабельных мест добычи.
За все время человечеством добыто около 170 тонн драгоценного металла.
Понятие об индексах Миллера
Чтобы удобно было описывать численно показанные выше пространственные решетки, в кристаллографии используют так называемые индексы Миллера. Они представляют собой наборы чисел, которые позволяют точно определить положение в пространстве данного атомного ряда или атомной плоскости. По этим числам судят о поверхностных энергиях, о способности металлов проявлять пластические свойства. Например, в ГЦК решетке краевые дислокации движутся по плоскостям (1,1,1) (эти плоскости являются максимально плотноупакованными, нормалью к ним будут диагонали куба).
Кристаллическая решетка: определение и структура
Оставить комментарий
Содержание:
Определение
Все материальные субстанции существуют в трех основных состояниях: жидком, твердом и газообразном.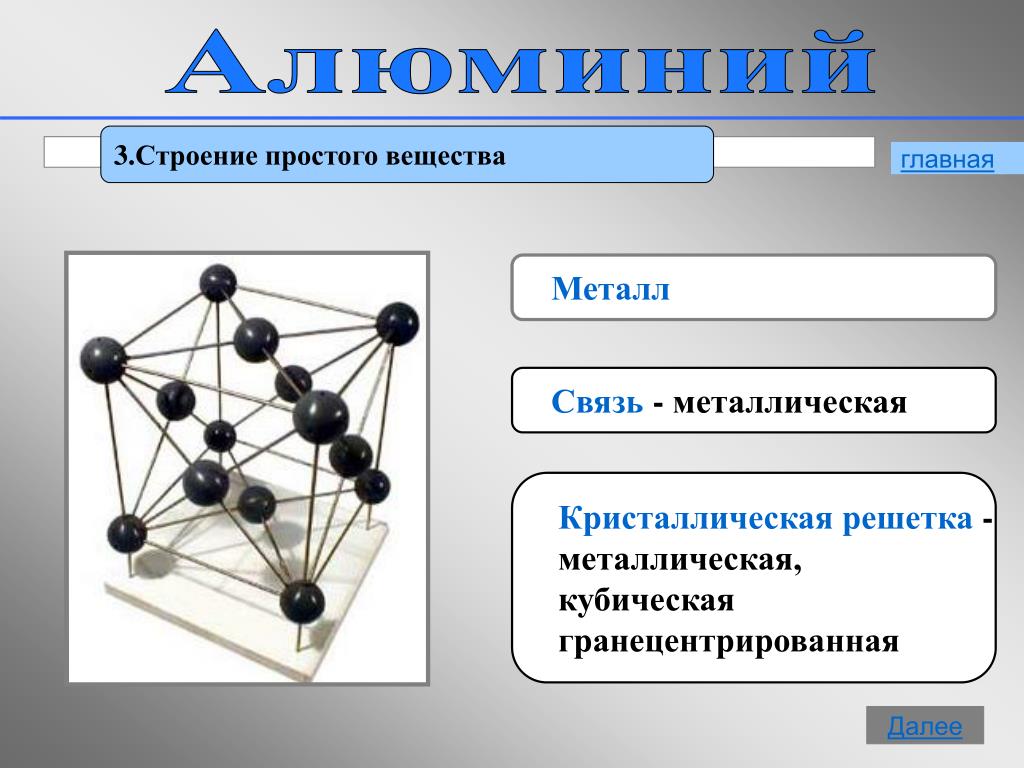 Еще есть состояние плазмы, которое ученые считают четвертым состоянием вещества, но наша статья не о плазме. Знаете, что общего у поваренной соли и прекрасного бриллианта? Основываясь на своей структуре, они оба являются твердыми объектами. Твердые объекты (будь то алмаз или соль) имеют особую кристаллическую структуру; они содержат крошечные взаимосвязанные кристаллы. Эта кристаллическая структура имеет определенный порядок, создавая кристаллическую решетку. Кристаллическая решетка — это расположение атомов в кристалле.
Еще есть состояние плазмы, которое ученые считают четвертым состоянием вещества, но наша статья не о плазме. Знаете, что общего у поваренной соли и прекрасного бриллианта? Основываясь на своей структуре, они оба являются твердыми объектами. Твердые объекты (будь то алмаз или соль) имеют особую кристаллическую структуру; они содержат крошечные взаимосвязанные кристаллы. Эта кристаллическая структура имеет определенный порядок, создавая кристаллическую решетку. Кристаллическая решетка — это расположение атомов в кристалле.
Структура
Структура кристаллической решетки состоит из мелких элементарных ячеек: атомов, молекул, ионов и других элементарных частиц. Здесь показано строение кристаллической решетки.
Типы
Существует четырнадцать типов кристаллических решеток.
Самые популярные среди них:
- Ионная решетка.
- Атомная решетка.
- Молекулярная решетка.
- Металлическая решетка.
Ионная решетка
Ионная решетка имеет противоположный электрический заряд ионов. Эти электрические заряды создают электромагнитное поле, и это поле определяет свойства веществ, имеющих ионную решетку: тугоплавкость, твердость, плотность и способность проводить электричество. Поваренная соль является хорошим примером ионной решетки.
Эти электрические заряды создают электромагнитное поле, и это поле определяет свойства веществ, имеющих ионную решетку: тугоплавкость, твердость, плотность и способность проводить электричество. Поваренная соль является хорошим примером ионной решетки.
Атомная решетка
Вещества с атомной решеткой имеют сильную ковалентную связь в своих узлах, состоящих из самих атомов. Ковалентные связи возникают, когда два одинаковых атома делят электроны друг с другом. Они образуют общую пару электронов для соседних атомов. Именно поэтому ковалентные связи связывают атомы в строгом порядке. Возможно, это самая характерная черта атомной решетки. Химические элементы с атомной решеткой имеют высокую температуру плавления. Такие химические элементы, как алмаз, кремний, германий и бор, имеют атомные решетки.
Молекулярная решетка
Молекулярная решетка характеризуется наличием стабильных и плотно упакованных молекул. Они расположены в узлах кристаллической решетки. Их удерживают силы Ван-дер-Уолша, которые в десять раз слабее сил ионного взаимодействия. Хорошим примером молекулярной решетки является лед – твердое вещество, имеющее свойство переходить в жидкое вещество. Связи между молекулами решетки довольно слабые.
Хорошим примером молекулярной решетки является лед – твердое вещество, имеющее свойство переходить в жидкое вещество. Связи между молекулами решетки довольно слабые.
Металлическая решетка
Металлическая решетчатая структура более гибкая и пластичная, чем ионная, хотя внешне они очень похожи. Металлические решетки имеют положительно заряженные ионы металлов в узлах решетки. Между узлами находятся электроны, которые участвуют в создании электрического поля. Иногда эти электроны называют электрическим газом. Структура решетки металла объясняет его свойства: механическую прочность, теплопроводность, электропроводность и плавкость.
Ссылки и дополнительная литература
- Петренко В. Ф.; Уитворт, Р. В. (1999). Физика льда. Издательство Оксфордского университета. ISBN 9780198518945.
- Бернал, JD; Фаулер, Р. Х. (1933). «Теория воды и ионного раствора с особым упором на ион водорода и гидроксил». Журнал химической физики. 1 (8): 515. Бибкод: 1933JChPh…1.
 .515B. дои: 10.1063/1.1749327.
.515B. дои: 10.1063/1.1749327. - Крюк, младший; Холл, Е.П. (2010). Физика твердого тела. Серия Manchester Physics (2-е изд.). Джон Уайли и сыновья. ISBN 9780471928041.
- Запад, Энтони Р. (1999). Основы химии твердого тела (2-е изд.). Уайли. п. 1. ISBN 978-0-471-98756-7.
- Международные таблицы кристаллографии (2006 г.). Том A, Пространственно-групповая симметрия.
Видео
Автор: Павел Чайка, главный редактор журнала «Познавайка»
При написании этой статьи я старался сделать ее максимально интересной и полезной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Вы также можете написать свое пожелание/вопрос/предложение на мою почту [email protected] или в Facebook.
Страница об авторе
Определение решетки в химии.
Равномерное расстояние или расположение геометрических точек.
(существительное)
Регулярное расстояние или расположение атомов/молекул внутри кристалла.
Энергия решетки
- Энергия решетки является мерой прочности связи в ионном соединении.
- Энергия решетки является оценкой прочности связи в ионных соединениях.
- по мере увеличения заряда ионов энергия решетки увеличивается
- по мере увеличения размера ионов энергия решетки уменьшается
- В этом учебном пособии рассказывается об энергии решетки и о том, как сравнивать относительные энергии решетки различных ионных соединений.
Кристаллическая структура: упаковочные сферы
- Рассмотрите расположение сфер в решетке , чтобы составить представление о структуре и сложности кристаллических материалов.

- Кристаллические материалы настолько высоко упорядочены, что кристаллическая решетка возникает из-за повторений вдоль всех трех пространственных измерений одного и того же узора.
- Кристаллическая решетка представляет собой трехмерную структуру атомных/молекулярных компонентов кристалла.
- Структура внутри кристалла решетку материала можно описать несколькими способами.
- В принципе, можно реконструировать структуру всего кристалла, повторяя элементарную ячейку, чтобы создать трехмерную решетку .
- Рассмотрите расположение сфер в решетке , чтобы составить представление о структуре и сложности кристаллических материалов.
Растворы и теплоты гидратации
- Взаимодействия притяжения между ионными молекулами называются энергией решетки , и их необходимо преодолеть, чтобы образовался раствор.
- Чем больше значение соединения энергии решетки , тем больше сила, необходимая для преодоления кулоновского притяжения.
- На самом деле, некоторые соединения строго нерастворимы из-за их высокой энергии

- Горячий раствор получается, когда теплота гидратации намного превышает энергию решетки растворенного вещества.
- Предсказать, будет ли данное ионное твердое вещество растворяться в воде, учитывая энергию решетки и теплоту гидратации
Ионные кристаллы
- Расположение ионов в правильной геометрической структуре называется кристаллической решеткой .
- Точное расположение ионов в решетке зависит от размера ионов в кристалле.
- Полученная кристаллическая решетка относится к типу, известному как «простая кубическая», что означает, что точки решетки равномерно разнесены по всем трем измерениям, а все углы ячеек равны 90°.
- Таким образом, решетка CsCl принимает другое расположение.
- В CsCl ионы металлов смещаются в центр каждого кубического элемента решетки ионов Cl– .
Связь в металлах: Модель электронного моря
- Металлическая связь может быть описана как совместное использование свободных электронов в решетке положительно заряженных ионов металлов.

- Металлическая связь может быть описана как совместное использование свободных электронов между 9решетка 0117 из положительно заряженных ионов металлов.
- Металлическая связь может быть описана как совместное использование свободных электронов в решетке положительно заряженных ионов металлов.
Металлические кристаллы
- Понимаемое как совместное использование «свободных» электронов в решетке положительно заряженных ионов (катионов), металлическая связь иногда сравнивается со связью расплавленных солей; однако эта упрощенная точка зрения справедлива для очень немногих металлов.
- Прочность металла обусловлена электростатическим притяжением между
- Высокая плотность большинства металлов обусловлена плотно упакованной кристаллической решеткой металлической структуры.
- В металлах носителями заряда являются электроны, и поскольку они свободно перемещаются по решетке , металлы обладают высокой проводимостью.

- Электропроводность, а также вклад электронов в теплоемкость и теплопроводность металлов можно рассчитать по модели свободных электронов, которая не учитывает детальную структуру иона решетка с учетом.
Формулы ионных соединений
- В макроскопическом масштабе ионные соединения, такие как хлорид натрия (NaCl), образуют кристаллическую решетку и являются твердыми веществами при нормальных температурах и давлениях.
Кристаллическая структура: ближайшая упаковка
- Эти ячейки периодически располагаются, образуя кристаллическую решетчатую структуру.
- В этом разделе рассматривается, как упаковка атомов в элементарных ячейках способствует 9 кристаллическому твердому телу.0117 решетка структура.
- Понимание атомной упаковки в элементарной ячейке и кристаллической решетке может дать представление о физических, химических, электрических и механических свойствах данного кристаллического материала.

Легирование: соединение полупроводников
- В атомной решетке вещества есть набор заполненных атомных энергетических «полос» с полным набором электронов и набор более высоких энергий незаполненных «полос», в которых нет электронов.
- Электроны в зоне проводимости могут свободно перемещаться в
- Когда легирующая примесь p-типа включается в атомную решетку полупроводника, она способна принимать электроны из зоны проводимости, что позволяет легко образовывать положительные дырки.
- При этом атом легирующей примеси замещает атом кремния в решетке , и поэтому в структуру вводится дополнительный валентный электрон.
- Когда всего несколько атомов примеси заменяют атомы кремния в решетке , создается полупроводник n-типа.
Точки кипения и плавления
- Расстояние между молекулами в кристаллической решетке маленькое и регулярное, при этом межмолекулярные силы ограничивают движение молекул сильнее, чем в жидком состоянии.

- Расстояние между молекулами в кристаллической решетке маленькое и регулярное, при этом межмолекулярные силы ограничивают движение молекул сильнее, чем в жидком состоянии.



 .515B. дои: 10.1063/1.1749327.
.515B. дои: 10.1063/1.1749327.