Металлические кристаллические решетки: Типы кристаллических решёток — урок. Химия, 8 класс.
alexxlab | 08.07.1992 | 0 | Разное
Самая прочная кристаллическая решетка. Школьная энциклопедия
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества. По типу связи различают вещества молекулярного и немолекулярного строения.
Это вещества, состоящие из молекул. Связи между молекулами в таких веществах очень слабые, намного слабее, чем между атомами внутри молекулы, и уже при сравнительно низких температурах они разрываются – вещество превращается в жидкость и далее в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярной массы. К молекулярным веществам относятся вещества с атомной структурой (С, Si, Li, Na, К, Си, Fe, W), среди них есть металлы и неметаллы.
Немолекулярное строение веществК веществам немолекулярного строения относятся ионные соединения. Таким строением обладает большинство соединений металлов с неметаллами: все соли (NaCl, K 2 S0 4), некоторые гидриды (LiH) и оксиды (CaO, MgO, FeO), основания (NaOH, КОН).
Аморфные вещества не имеют четкой температуры плавления – при нагревании они постепенно размягчаются и переходят в текучее состояние. В аморфном состоянии, например, находятся пластилин и различные смолы.
Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят: атомов, молекул и ионов – в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, называемый кристаллической решеткой . Точки, в которых размещены частицы кристалла, называют узлами решетки .
В зависимости от типа частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические
. Ионные кристаллические решеткиИонными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na + , Сl — , так и сложные S0 4 2- , ОН — . Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Сl — , образующих решетку в форме куба.
Их образуют вещества с ионной связью, которой могут быть связаны как простые ионы Na + , Сl — , так и сложные S0 4 2- , ОН — . Следовательно, ионными кристаллическими решетками обладают соли, некоторые оксиды и гидроксиды металлов. Например, кристалл хлорида натрия построен из чередующихся положительных ионов Na + и отрицательных Сl — , образующих решетку в форме куба.
Ионная кристаллическая решетка поваренной соли
Связи между ионами в таком кристалле очень устойчивы. Поэтому вещества с ионной решеткой отличаются сравнительно высокой твердостью и прочностью, они тугоплавки и нелетучи.
Атомные кристаллические решеткиАтомными называют кристаллические решетки, в узлах которых находятся отдельные атомы. В таких решетках атомы соединены между собой очень прочными ковалентными связями. Примером веществ с таким типом кристаллических решеток может служить алмаз – одно из аллотропных видоизменений углерода.
Атомная кристаллическая решетка алмаза
Большинство веществ с атомной кристаллической решеткой имеют очень высокие температуры плавления (например, у алмаза она свыше 3500 °С), они прочны и тверды, практически нерастворимы.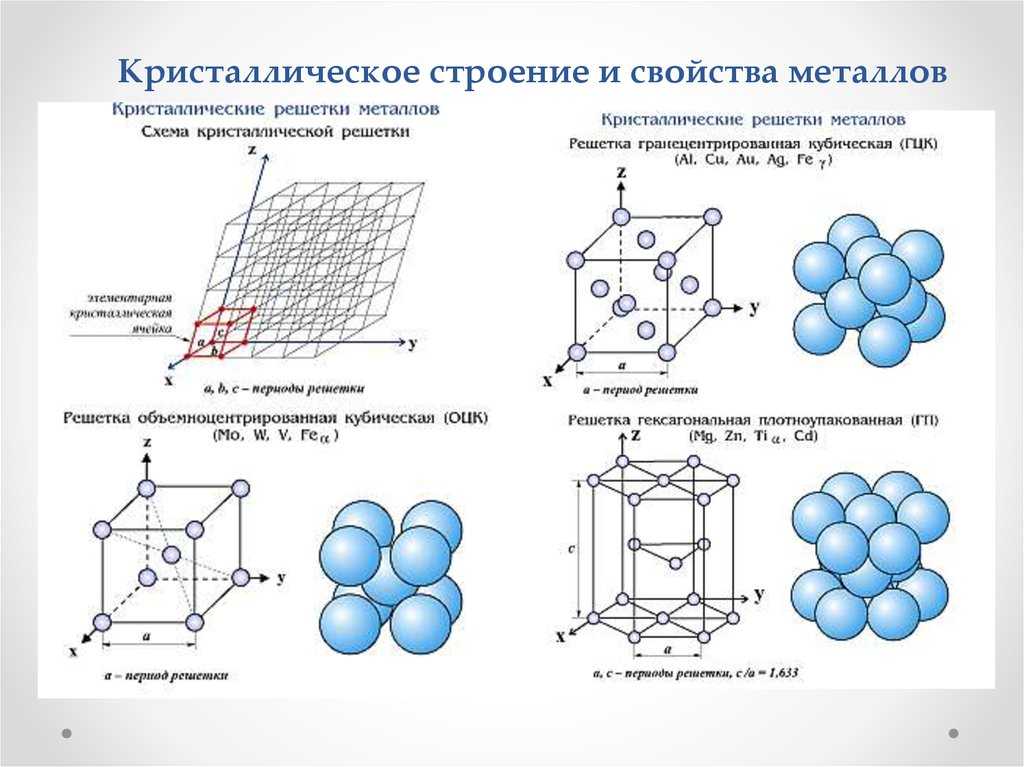
Молекулярными называют кристаллические решетки, в узлах которых располагаются молекулы.
Молекулярная кристаллическая решетка йода
Химические связи в этих молекулах могут быть и полярными (НСl, Н 2 O), и неполярными (N 2 , О 2). Несмотря на то, что атомы внутри молекул связаны очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому вещества с молекулярными кристаллическими решетками имеют малую твердость, низкие температуры плавления, летучи. Большинство твердых органических соединений имеют молекулярные кристаллические решетки (нафталин, глюкоза, сахар).
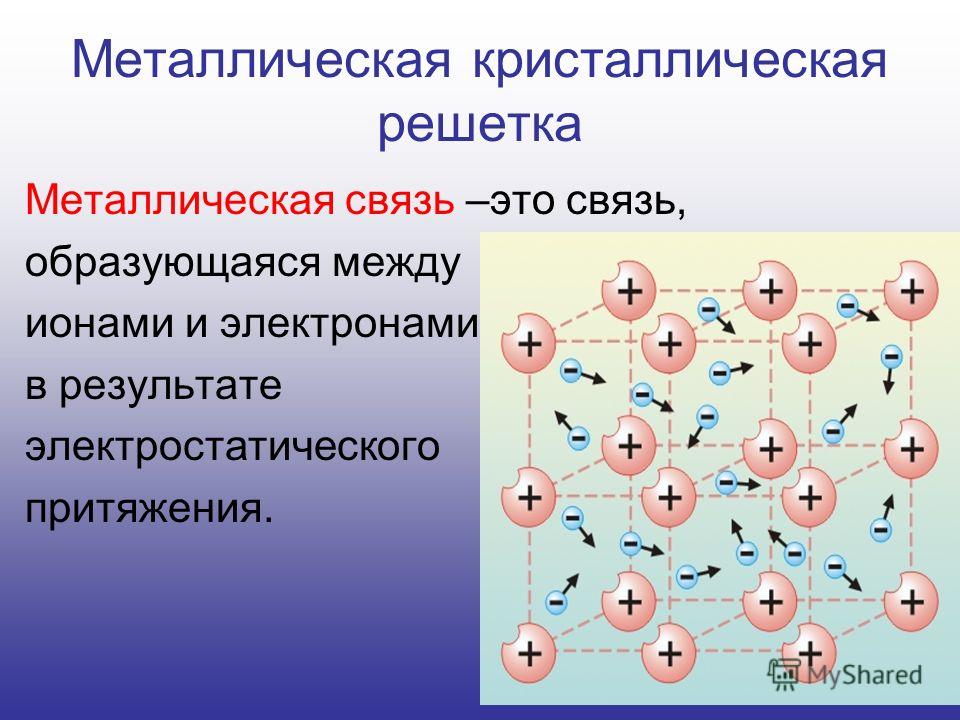
Металлические кристаллические решеткиВещества с металлической связью имеют металлические кристаллические решетки.
В узлах таких решеток находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы металла, отдавая свои внешние электроны «в общее пользование»).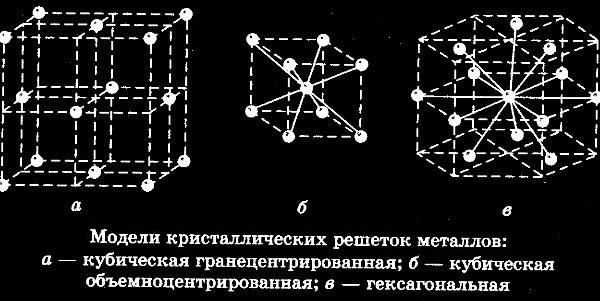 Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
Такое внутреннее строение металлов определяет их характерные физические свойства: ковкость, пластичность, электро- и теплопроводность, характерный металлический блеск.
При осуществлении многих физических и химических реакций вещество переходит в твердое агрегатное состояние. При этом молекулы и атомы стремятся расположиться в таком пространственном порядке, при котором силы взаимодействия между частицами вещества были бы максимально сбалансированы. Этим и достигается прочность твердого вещества. Атомы, однажды заняв определенное положение, совершают небольшие колебательные движения, амплитуда которых зависит от температуры, но положение их в пространстве остается фиксированным. Силы притяжения и отталкивания уравновешивают друг друга на определенном расстоянии.
Современные представления о строении вещества
Современная наука утверждает, что атом состоит из заряженного ядра, несущего положительный заряд, и электронов, несущих заряды отрицательные. Со скоростью несколько тысяч триллионов оборотов в секунду электроны вращаются по своим орбитам, создавая вокруг ядра электронное облако. Положительный заряд ядра численно равен отрицательному заряду электронов. Таким образом, атом вещества остается электрически нейтральным. Возможные взаимодействия с другими атомами происходят тогда, когда электроны отсоединяются от родного атома, тем самым нарушая электрический баланс. В одном случае атомы выстраиваются в определенном порядке, который и называется кристаллической решеткой. В другом – за счет сложного взаимодействия ядер и электронов соединяются в молекулы различного вида и сложности.
Положительный заряд ядра численно равен отрицательному заряду электронов. Таким образом, атом вещества остается электрически нейтральным. Возможные взаимодействия с другими атомами происходят тогда, когда электроны отсоединяются от родного атома, тем самым нарушая электрический баланс. В одном случае атомы выстраиваются в определенном порядке, который и называется кристаллической решеткой. В другом – за счет сложного взаимодействия ядер и электронов соединяются в молекулы различного вида и сложности.
Определение кристаллической решетки
В совокупности различные типы кристаллических решеток веществ представляют собой сетки с различной пространственной ориентацией, в узлах которых располагаются ионы, молекулы или атомы. Это стабильное геометрическое пространственное положение и называется кристаллической решеткой вещества. Расстояние между узлами одной кристаллической ячейки называется периодом идентичности. Пространственные углы, под которыми расположены узлы ячейки, называются параметрами. По способу построения связей кристаллические решетки могу быть простыми, базоцентрированными, гранецентрированными и объемно-центрированными. Если частицы вещества расположены лишь в углах параллелепипеда, такая решетка называется простой. Пример такой решетки показан ниже:
По способу построения связей кристаллические решетки могу быть простыми, базоцентрированными, гранецентрированными и объемно-центрированными. Если частицы вещества расположены лишь в углах параллелепипеда, такая решетка называется простой. Пример такой решетки показан ниже:
Если, кроме узлов, частицы вещества расположены и в середине пространственных диагоналей, то такое построение частиц в веществе имеет название объемно-центрированной кристаллической решетки. На рисунке этот тип показан наглядно.
Если кроме узлов в вершинах решетки имеется узел и в месте, где пересекаются воображаемые диагонали параллелепипеда, то перед вами – гранецентрированный тип решетки.
Виды кристаллических решеток
Различные микрочастицы, из которых состоит вещество, определяют различные типы кристаллических решеток. Они могут определять принцип построения связи между микрочастицами внутри кристалла. Физические типы кристаллических решеток – ионные, атомные и молекулярные. Сюда же относятся различные типы кристаллических решеток металлов. Изучением принципов внутреннего строения элементов занимается химия. Типы кристаллических решеток подробнее представлены ниже.
Сюда же относятся различные типы кристаллических решеток металлов. Изучением принципов внутреннего строения элементов занимается химия. Типы кристаллических решеток подробнее представлены ниже.
Ионные кристаллические решетки
Данные типы кристаллических решеток присутствуют в соединениях с ионным типом связи. В этом случае узлы решетки содержат ионы, обладающие противоположным электрическим зарядом. Благодаря электромагнитному полю, силы межионного взаимодействия оказываются достаточно сильными, и это обуславливает физические свойства вещества. Обычными характеристиками являются тугоплавкость, плотность, твердость и возможность проводить электрический ток. Ионные типы кристаллических решеток имеются у таких веществ, как поваренная соль, нитрат калия и прочие.
Атомные кристаллические решетки
Этот тип строения вещества присущ элементам, структуру которых определяет ковалентная химическая связь. Типы кристаллических решеток подобного рода содержат в узлах отдельные атомы, связанные между собой крепкими ковалентными связями. Подобный тип связи возникает тогда, когда два одинаковых атома «делятся» электронами, тем самым образуют общую пару электронов для соседних атомов. Благодаря такому взаимодействию ковалентные связи равномерно и сильно связывают атомы в определенном порядке. Химические элементы, которые содержат атомные типы кристаллических решеток, обладают твердостью, высокой температурой плавления, плохо проводят электрический ток и химически неактивны. Классическими примерами элементов с подобным внутренним строением можно назвать алмаз, кремний, германий, бор.
Подобный тип связи возникает тогда, когда два одинаковых атома «делятся» электронами, тем самым образуют общую пару электронов для соседних атомов. Благодаря такому взаимодействию ковалентные связи равномерно и сильно связывают атомы в определенном порядке. Химические элементы, которые содержат атомные типы кристаллических решеток, обладают твердостью, высокой температурой плавления, плохо проводят электрический ток и химически неактивны. Классическими примерами элементов с подобным внутренним строением можно назвать алмаз, кремний, германий, бор.
Молекулярные кристаллические решетки
Вещества, имеющие молекулярный тип кристаллической решетки, представляют собой систему устойчивых, взаимодействующих, плотноупакованных между собой молекул, которые расположены в узлах кристаллической решетки. В подобных соединениях молекулы сохраняют свое пространственное положение в газообразной, жидкой и твердой фазе. В узлах кристалла молекулы удерживаются слабыми ван-дер-ваальсовыми силами, которые в десятки раз слабее сил ионного взаимодействия.
Образующие кристалл молекулы могут быть как полярными, так и неполярными. Из-за спонтанного движения электронов и колебания ядер в молекулах электрическое равновесие может смещаться – так возникает мгновенный электрический момент диполя. Соответствующим образом ориентированные диполи создают силы притяжения в решетке. Двуокись углерода и парафин являются типичными примерами элементов с молекуляной кристаллической решеткой.
Металлические кристаллические решетки
Металлическая связь гибче и пластичней ионной, хотя может показаться, что обе они базируются на одном и том же принципе. Типы кристаллических решеток металлов объясняют их типичные свойства – такие, например, как механическая прочность, тепло- и электропроводность, плавкость.
Отличительной особенностью металлической кристаллической решетки является наличие положительно заряженных ионов металла (катионов) в узлах этой решетки. Между узлами находятся электроны, которые непосредственно участвуют в создании электрического поля вокруг решетки. Количество электронов, перемещающихся внутри этой кристаллической решетки, называется электронным газом.
Количество электронов, перемещающихся внутри этой кристаллической решетки, называется электронным газом.
При отсутствии электрического поля свободные электроны совершают хаотическое движение, беспорядочно взаимодействуя с ионами решетки. Каждое такое взаимодействие меняет импульс и направление движения отрицательно заряженной частицы. Своим электрическим полем электроны притягивают к себе катионы, уравновешивая их взаимное отталкивание. Хотя электроны считаются свободными, их энергии не хватает для того, чтобы покинуть кристаллическую решетку, поэтому эти заряженные частицы постоянно находятся в ее пределах.
Присутствие электрического поля придает электронному газу дополнительную энергию. Соединение с ионами в кристаллической решетке металлов не является прочным, поэтому электроны легко покидают ее пределы. Электроны двигаются по силовым линиям, оставляя позади положительно заряженные ионы.
Выводы
Огромное значение изучению внутреннего строения вещества уделяет химия. Типы кристаллических решеток различных элементов определяют практически весь спектр их свойств. Воздействуя на кристаллы и меняя их внутренне строение, можно добиться усиления нужных свойств вещества и удалить нежелательные, преобразовывать химические элементы. Таким образом, изучение внутренней структуры окружающего мира может помочь познать суть и принципы устройства мироздания.
Типы кристаллических решеток различных элементов определяют практически весь спектр их свойств. Воздействуя на кристаллы и меняя их внутренне строение, можно добиться усиления нужных свойств вещества и удалить нежелательные, преобразовывать химические элементы. Таким образом, изучение внутренней структуры окружающего мира может помочь познать суть и принципы устройства мироздания.
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Виды кристаллических решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- кристаллическая решетка.
Ионная кристаллическая решетка
Главной особенностью строения кристаллической решетки ионов являются противоположные электрические заряды, собственно, ионов, вследствие чего образуется электромагнитное поле, определяющее свойства веществ, имеющих ионную кристаллическую решетку. А это тугоплавкость, твердость, плотность и возможность проводить электрический ток. Характерным примером ионной кристаллической решетки может быть поваренная соль.
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные . Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов.
Молекулярная кристаллическая решетка
Молекулярный тип кристаллической решетки характеризуется наличием устойчивых и плотноупакованных молекул. Они располагаются в узлах кристаллической решетки. В этих узлах они удерживаются такими себе вандервальсовыми силами, которые в десять раз слабее сил ионного взаимодействия. Ярким примером молекулярной кристаллической решетки является лед – твердое вещество, имеющее однако свойство переходить в жидкое – связи между молекулами кристаллической решетки совсем слабенькие.
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Согласно атомно-молекулярной теории Бойля, все вещества состоят из молекул, которые находятся в постоянном движении. Но существует ли какая-то определённая структура в веществах? Или они просто состоят из хаотично движущихся молекул?
В действительности чёткую структуру имеют все вещества, пребывающие в твёрдом состоянии. Атомы и молекулы движутся, но силы притяжения и отталкивания между частицами сбалансированы, поэтому атомы и молекулы располагаются в определённой точке пространства (но продолжают совершать небольшие колебания, зависящие от температуры).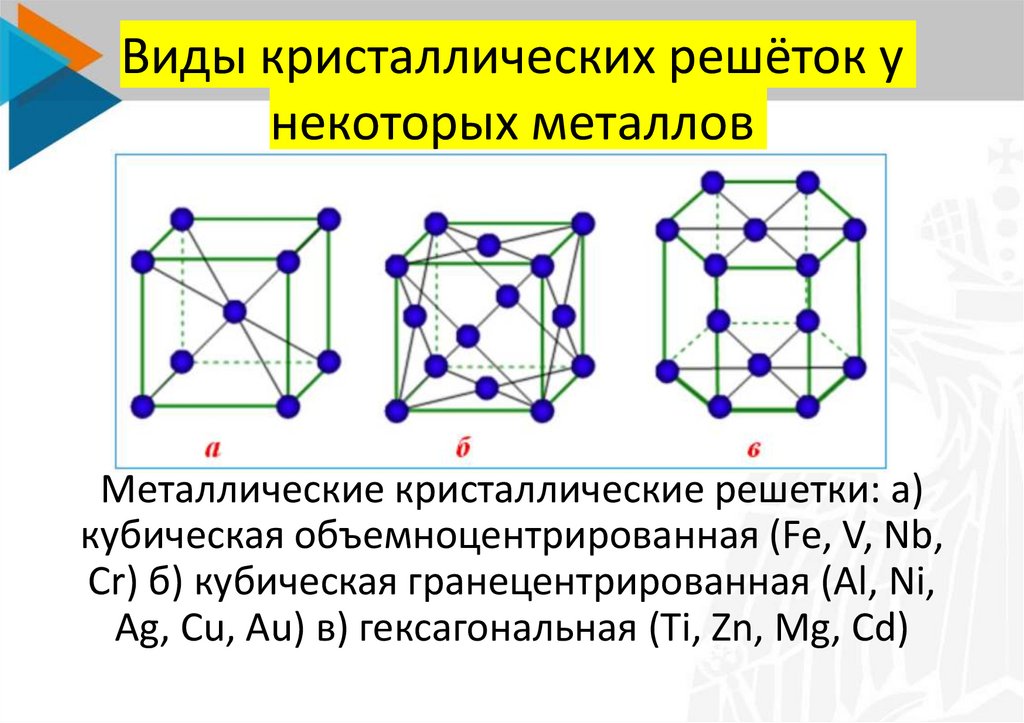
- атомная;
- ионная;
- молекулярная;
- металлическая.
В жидком и газообразном состоянии вещества не имеют чёткой решётки, их молекулы движутся хаотично, именно поэтому они не имеют формы. Например, кислород, находясь в газообразном состоянии, представляет собой бесцветный газ без запаха, в жидком (при -194 градусов) – раствор голубоватого цвета. Когда температура опускается до -219 градусов, кислород переходит в твёрдое состояние и приобретает кр. решётку, при этом он превращается в снегообразную массу синего цвета.
Интересно, что у аморфных веществ нет чёткой структуры, поэтому у них и нет строгой температуры плавления и кипения. Смола и пластилин при нагревании постепенно размягчаются и становятся жидкими, у них нет чёткой фазы перехода.
Атомная кристаллическая решётка
В узлах находятся атомы, о чём и говорит название. Эти вещества очень крепкие и прочные , так как между частицами образуется ковалентная связь. Соседние атомы образуют между собой общую пару электронов (а, точнее, их электронные облака наслаиваются друг на друга), и поэтому они очень хорошо связаны друг с другом. Самый наглядные пример – алмаз, который по шкале Мооса обладит наибольшей твёрдостью. Интересно, что алмаз, как и графит, состоит из углевода. Графит является очень хрупким веществом (твёрдость по шкале Мооса – 1), что является наглядным примером того, как много зависит от вида.
Атомная кр. решётка плохо распространена в природе, к ней относятся: кварц, бор, песок, кремний, оксид кремния (IV), германий, горный хрусталь. Для этих веществ характерна высокая температура плавления, прочность, а также эти соединения очень твёрдые и нерастворимые в воде. Из-за очень сильной связи между атомами, эти химические соединения почти не взаимодействуют с другими и очень плохо проводят ток.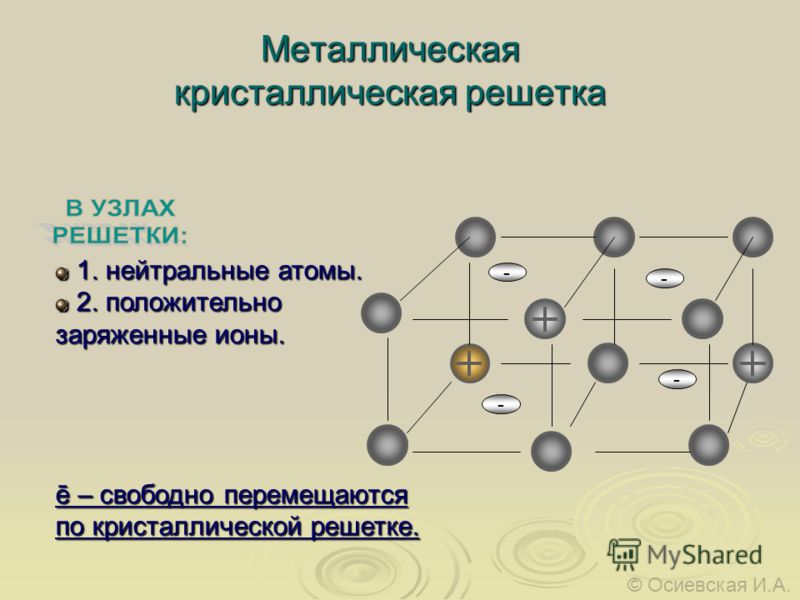
Ионная кристаллическая решётка
В этом типе ионы располагаются в каждом узле. Соответственно, этот вид характерен для веществ с ионной связью, например: хлорид калия, сульфат кальция, хлорид меди, фосфат серебра, гидроксид меди и так далее. К веществам с такой схемой соединения частиц относятся ;
- соли;
- гидроксиды металлов;
- оксиды металлов.
Хлорид натрия имеет чередование положительных (Na +) и отрицательных (Cl —) ионов. Один ион хлора, находящийся в узле, притягивает к себе два иона натрия (благодаря электромагнитному полю), которые находятся в соседних узлах. Таким образом, образуется куб, в котором частицы связаны между собой.
Для ионной решётки характерна прочность, тугоплавкость, устойчивость, твёрдость и нелетучесть. Некоторые вещества могут проводить электрический ток.
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Одна из отличительных черт — это то, что структурная и пространственная модель сохраняется во всех фазах (как в твёрдых, так в жидких и газообразных).
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
Строение вещества.
В химические взаимодействия вступают не отдельные атомы или молекулы, а вещества.
Наша задача познакомиться со строением вещества.
При низких температурах для веществ устойчиво твёрдое состояние.
☼ Самым твёрдым веществом в природе является алмаз. Он считается царём всех самоцветов и драгоценных камней. Да и само его название означает по-гречески «несокрушимый». На алмазы с давних пор смотрели как на чудодейственные камни. Считалось, что человек, носящий алмазы, не знает болезней желудка, на него не действует яд, он сохраняет до глубокой старости память и весёлое расположение духа, пользуется царской милостью.
☼ Алмаз, подвергнутый ювелирной обработке – огранке, шлифовке, называют бриллиантом.
При плавлении в результате тепловых колебаний порядок частиц нарушается, они становятся подвижными, при этом характер химической связи не нарушается. Таким образом, между твёрдым и жидким состояниями принципиальных различий нет.
У жидкости появляется текучесть (т. е. способность принимать форму сосуда).
Жидкие кристаллы.
Жидкие кристаллы открыты в конце XIX века, но изучены в последние 20-25 лет. Многие показывающие устройства современной техники, например некоторые электронные часы, мини-ЭВМ, работают на жидких кристаллах.
В общем-то слова «жидкие кристаллы» звучат не менее необычно, чем «горячий лёд» . Однако на самом деле и лёд может быть горячим, т.к. при давлении более 10000 атм. водяной лёд плавится при температуре выше 2000 С. Необычность сочетания «жидкие кристаллы» состоит в том, что жидкое состояние указывает на подвижность структуры, а кристалл предполагает строгую упорядоченность.
Если вещество состоит из многоатомных молекул вытянутой или пластинчатой формы и имеющих несимметричное строение, то при его плавлении эти молекулы ориентируются определённым образом друг относительно друга (их длинные оси располагаются параллельно). При этом молекулы могут свободно перемещаться параллельно самим себе, т. е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
е. система приобретает свойство текучести, характерное для жидкости. В то же время система сохраняет упорядоченную структуру, обусловливающую свойства, характерное для кристаллов.
Высокая подвижность такой структуры даёт возможность управлять ею путём очень слабых воздействий (тепловых, электрических и др.), т.е. целенаправленно изменять свойства вещества, в том числе оптические, с очень малыми затратами энергии, что и используется в современной технике.
Типы кристаллических решёток.
Любое химическое вещество образованно большим числом одинаковых частиц, которые связаны между собою.
При низких температурах, когда тепловое движение затруднено, частицы строго ориентируются в пространстве и образуют кристаллическую решётку.
Кристаллическая решетка – это структура с геометрически правильным расположением частиц в пространстве.
В самой кристаллической решетке различают узлы и межузловое пространство.
Одно и то же вещество в зависимости от условий (p, t,…) существует в различных кристаллических формах (т. е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
е. имеют разные кристаллические решетки) – аллотропных модификациях, которые отличаются по свойствам.
Например, известно четыре модификации углерода – графит, алмаз, карбин и лонсдейлит.
☼ Четвёртая разновидность кристаллического углерода «лонсдейлит» мало кому известна. Он обнаружен в метеоритах и получен искусственно, а строение его ещё изучается.
☼ Сажу, кокс, древесный уголь относили к аморфным полимерам углерода. Однако теперь стало известно, что это тоже кристаллические вещества.
☼ Кстати, в саже обнаружили блестящие чёрные частицы, которые назвали «зеркальным углеродом». Зеркальный углерод химически инертен, термостоек, непроницаем для газов и жидкостей, обладает гладкой поверхностью и абсолютной совместимостью с живыми тканями.
☼ Название графита происходит от итальянского «граффитто» – пишу, рисую. Графит представляет собой тёмно – серые кристаллы со слабым металлическим блеском, имеет слоистую решётку. Отдельные слои атомов в кристалле графита, связанные между собой сравнительно слабо, легко отделяются друг от друга.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК
Свойства веществ с различной кристаллической решёткой (таблица)
Если скорость роста кристаллов мала при охлаждении – образуется стеклообразное состояние (аморфное).
Взаимосвязь между положением элемента в Периодической системе и кристаллической решёткой его простого вещества.
Между положением элемента в периодической системе и кристаллической решёткой его соответствующего простого вещества существует тесная взаимосвязь.
Простые вещества остальных элементов имеют металлическую кристаллическую решётку.
ЗАКРЕПЛЕНИЕ
Изучите материал лекции, ответьте на следующие вопросы письменно в тетради:
– Что такое кристаллическая решётка?
– Какие виды кристаллических решёток существуют?
– Охарактеризуйте каждый вид кристаллической решётки по плану:
Что в узлах кристаллической решётки, структурная единица → Тип химической связи между частицами узла → Силы взаимодействия между частицами кристалла → Физические свойства, обусловленные кристаллической решёткой → Агрегатное состояние вещества при обычных условиях → Примеры
Выполните задания по данной теме:
– Какой тип кристаллической решётки у следующих широко используемых в быту веществ: вода, уксусная кислота (Ch4
COOH), сахар (C12
h32
O11
), калийное удобрение (KCl), речной песок (SiO2
) – температура плавления 1710 0C, аммиак (Nh4
), поваренная соль? Сделайте обобщённый вывод: по каким свойствам вещества можно определить тип его кристаллической решётки?
По формулам приведённых веществ: SiC, CS2
, NaBr, C2
h3
– определите тип кристаллической решётки (ионная, молекулярная) каждого соединения и на основе этого опишите физические свойства каждого из четырёх веществ.
Тренажёр №1. “Кристаллические решётки”
Тренажёр №2. “Тестовые задания”
Тест (самоконтроль):
1) Вещества, имеющие молекулярную кристаллическую решётку, как правило:
a). тугоплавки и хорошо растворимы в воде
б). легкоплавки и летучи
в). Тверды и электропроводны
г). Теплопроводны и пластичны
2) Понятия «молекула» не применимо по отношению к структурной единице вещества:
б). кислород
в). алмаз
3) Атомная кристаллическая решётка характерна для:
a). алюминия и графита
б). серы и йода
в). оксида кремния и хлорида натрия
г). алмаза и бора
4) Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, электропроводно, то его кристаллическая решётка:
А). молекулярная
б). атомная
в). ионная
г). металлическая
Кристаллическое строение металлов – кратко о типах
4.5
Средняя оценка: 4.5
Всего получено оценок: 229.
4.5
Средняя оценка: 4.5
Всего получено оценок: 229.
Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
Рис. 2. Типы решёток.Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.
При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 229.
А какая ваша оценка?
💎 Основные типы кристаллической структуры в металле
by EnggStaff
Содержание
Что такое кристаллическая структура?
Мы знаем, что кристаллическая структура связана с расположением атомов в твердой кристаллической структуре, показывающей регулярную трехмерную структуру атомов. С геометрической точки зрения кристаллическая структура известна как пространственная решетка или точечная решетка.
Давайте узнаем о различных типах кристаллической структуры.
Диаграмма различных 4 типов кристаллической структурыРазличные типы кристаллической структуры:
Существует четыре типа кристаллической структуры, как указано ниже:
- Простая кубическая кристаллическая структура (SC)
- Объемно-центрированная кристаллическая структура (ОЦК)
- Гранецентрированная кристаллическая структура (FCC)
- Гексагональная плотноупакованная структура (HCP)
Читать о: 5 лучших справочников по металлургии
1. Простая кубическая кристаллическая структура (SC):
В этом типе кристаллической структуры один атом расположен в каждом углу элементарной ячейки, как показано на рисунке. В простой кубической кристаллической структуре общее число атомов равно восьми.
В простой кубической кристаллической структуре общее число атомов равно восьми.
Простая кубическая кристаллическая структура не имеет атома в центре элементарной ячейки или гранях элементарной ячейки. Теперь можно сказать, что среднее число атомов на единицу в простой кубической кристаллической структуре равно единице. Этот тип кристаллической структуры не существует ни в одном инженерном материале.
2. Объемно-центрированная кристаллическая структура (ОЦК):
В объемно-центрированной кристаллической структуре один атом расположен в каждом углу элементарной ячейки, как в простой кубической кристаллической структуре, но, в дополнение к этому, имеется один атом в центр элементарной ячейки. Объемно-центрированная кристаллическая структура является более сложной по сравнению с простой кубической кристаллической структурой.
Центральный атом в объемно-центрированной кристаллической структуре не вступает в контакт с другим атомом, поэтому он остается неразделенным.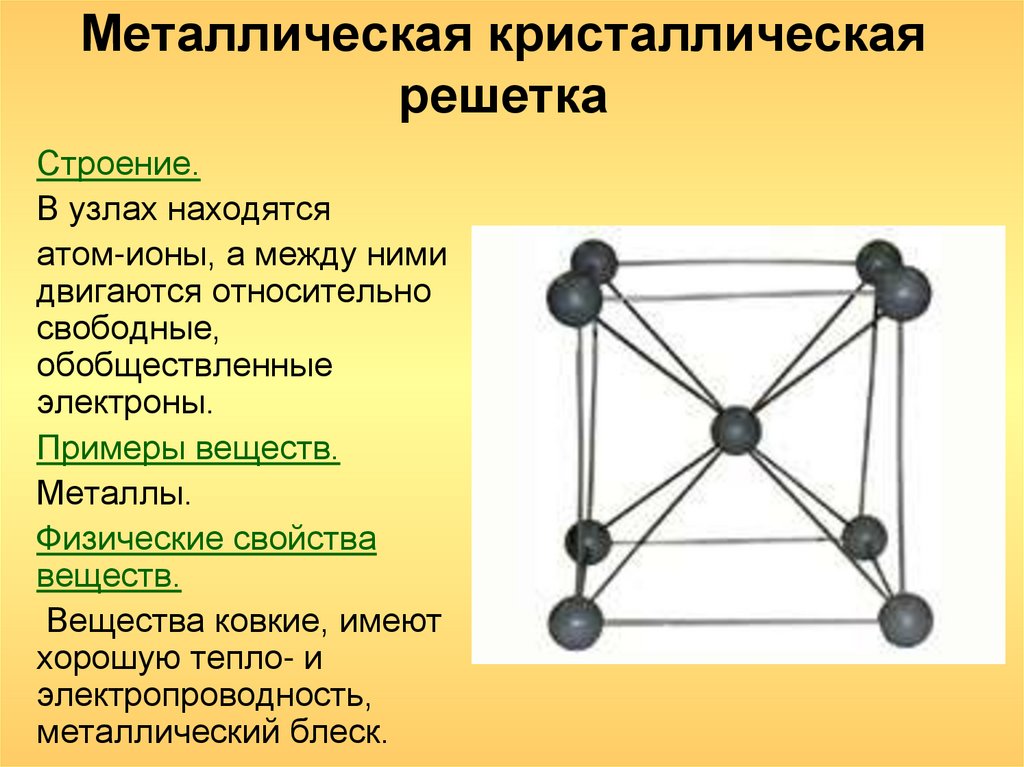 Среднее число атомов на элементарную ячейку в объемноцентрированной кристаллической структуре равно двум. Такие металлы, как Li, K, Na, V, Ta и т. д., имеют кристаллическую структуру такого типа.
Среднее число атомов на элементарную ячейку в объемноцентрированной кристаллической структуре равно двум. Такие металлы, как Li, K, Na, V, Ta и т. д., имеют кристаллическую структуру такого типа.
3. Гранецентрированная кристаллическая структура (ГЦК):
В гранецентрированной кристаллической структуре атомы располагаются в каждом углу элементарной ячейки, состоящей из восьми угловых атомов. В центр каждой грани помещается один атом, что составляет шесть атомов грани. В гранецентрированной кристаллической структуре нет центрального атома. В этом типе кристаллической структуры среднее число атомов на элементарную ячейку равно четырем. Такие металлы, как Cu, Ag, Al, Ca, Pt и т. д., имеют кристаллическую структуру такого типа.
Подробнее: Координационные числа различных кристаллических структур
4. Гексагональная плотноупакованная структура (HCP):
В гексагональной плотноупакованной структуре кристаллическая структура показывает по одному атому в каждом углу шестиугольника. Следовательно, в гексагональной плотноупакованной структуре имеется 12 угловых атомов. Кроме того, на каждой грани шестиугольника находится по одному атому.
Следовательно, в гексагональной плотноупакованной структуре имеется 12 угловых атомов. Кроме того, на каждой грани шестиугольника находится по одному атому.
Три внутренних атома в шестиугольнике остаются неразделенными. В гексагональной плотноупакованной структуре среднее число атомов в элементарной ячейке равно шести. Такие металлы, как Zn, Co, Cd, Mg, Be, Ca и т. д., имеют кристаллическую структуру такого типа.
Заключение:
Мы подробно обсудили кристаллическую структуру и типы кристаллической структуры, такие как простая кубическая, объемно-центрированная, гранецентрированная и гексагональная плотно упакованная кристаллическая структура. Если у вас есть какие-либо вопросы по поводу этой статьи, не стесняйтесь поделиться ими в поле для комментариев.
Кристаллические структуры металлов | Химия для неспециалистов |
- Определение ближайшей упаковки.
- Опишите наиболее плотную упаковку из металлов.
Как бы вы уложили пушечные ядра?
До появления современной артиллерии с разрывными снарядами для стрельбы ядрами по врагу использовались пушки. Солдаты, управляющие пушкой, должны были быстро и эффективно добраться до пушечных ядер. Такое расположение, как пирамида, хорошо подходило для этой цели.
Солдаты, управляющие пушкой, должны были быстро и эффективно добраться до пушечных ядер. Такое расположение, как пирамида, хорошо подходило для этой цели.
Кристаллические структуры металлов
Когда одинаковые сферы укладываются друг на друга, каждый последующий слой занимает небольшое пространство, где встречаются разные сферы. Такое упорядоченное и регулярное расположение металлических шариков сводит к минимуму пустое пространство между ними. Плотнейшая упаковка — наиболее эффективное расположение сфер. Атомы металлического кристалла расположены по сходной схеме, называемой плотноупакованными структурами. Чистые металлы принимают одну из нескольких родственных плотноупакованных структур, как показано ниже.
Рис. 8.18
Большинство чистых металлов естественным образом принимают одну из этих трех наиболее близких упаковок.
В крайнем левом углу находится объемно-центрированная кубическая (ОЦК) структура. В этом кристалле атомы металла занимают восемь углов куба вместе с одним атомом в самом центре. Координационное число каждого атома в объемно-центрированной кубической структуре равно 8. В гранецентрированной кубической (ГЦК) структуре восемь атомов находятся в каждом углу куба и шесть атомов в центре каждой грани. Координационное число каждого атома в гранецентрированной кубической структуре равно 12. Гексагональная плотноупакованная (ГПУ) структура также имеет координационное число 12, но кристаллы этого типа имеют гексагональную форму, а не кубическую.
В этом кристалле атомы металла занимают восемь углов куба вместе с одним атомом в самом центре. Координационное число каждого атома в объемно-центрированной кубической структуре равно 8. В гранецентрированной кубической (ГЦК) структуре восемь атомов находятся в каждом углу куба и шесть атомов в центре каждой грани. Координационное число каждого атома в гранецентрированной кубической структуре равно 12. Гексагональная плотноупакованная (ГПУ) структура также имеет координационное число 12, но кристаллы этого типа имеют гексагональную форму, а не кубическую.
Резюме
- Атомы кристалла металла расположены в плотноупакованных структурах.
- Этот тип структуры минимизирует пустое пространство между атомами.
Практика
Вопросы
Используйте ссылку ниже, чтобы ответить на следующие вопросы:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch23/structure.php
- Просто кубическая упаковка — эффективный способ укладки сфер?
- Какое координационное число объемно-центрированной кубической упаковки?
- Как лучше всего складывать сферы?
- Сколько места занимает эта конструкция?
Обзор
Вопросы
- Какое расположение сфер наиболее эффективно?
- Какое координационное число имеет гранецентрированная кубическая структура?
- Какая еще структура имеет координационное число 12?
- ближайшая упаковка: Наиболее эффективное расположение сфер.