Молекулярная формула ацетилена: Структурная и молекулярная формула: ацетилен
alexxlab | 27.02.2023 | 0 | Разное
Структурная и молекулярная формула: ацетилен
Особенности строения ацетилена влияют на его свойства, получение и применение. Условное обозначение состава вещества — С2Н2 — это его простейшая и брутто-формула. Ацетилен образован двумя атомами углерода, между которыми возникает тройная связь. Ее наличие отражают разные виды формул и моделей молекулы этина, позволяющих разобраться в проблеме влияния строения на свойства вещества.
Алкины. Общая формула. Ацетилен
Углеводороды алкины, или ацетиленовые, являются ациклическими, непредельными. Цепочка атомов углерода — не замкнутая, в ней присутствуют простые и кратные связи. Состав алкинов отражает сводная формула CnH2n– 2. В молекулах веществ этого класса присутствует одна или несколько тройных связей. Ацетиленовые соединения относятся к ненасыщенным. Это означает, что только одна валентность углерода реализуется за счет водорода. Оставшиеся три связи используются при взаимодействии с другими атомами углерода.
Первый – и наиболее известный представитель алкинов – ацетилен, или этин. Тривиальное название вещества произошло от латинского слова «acetum» — «уксус» и греческого — «hyle» — «дерево». Родоначальник гомологического ряда был открыт в 1836 году в химических опытах, позже вещество синтезировали из угля и водорода Э. Дэви и М. Бертло (1862 год). При обычной температуре и нормальном атмосферном давлении ацетилен находится в газообразном состоянии. Это бесцветный газ, без запаха, малорастворимый воде. Этин легче растворяется в этаноле и ацетоне.
Молекулярная формула ацетилена
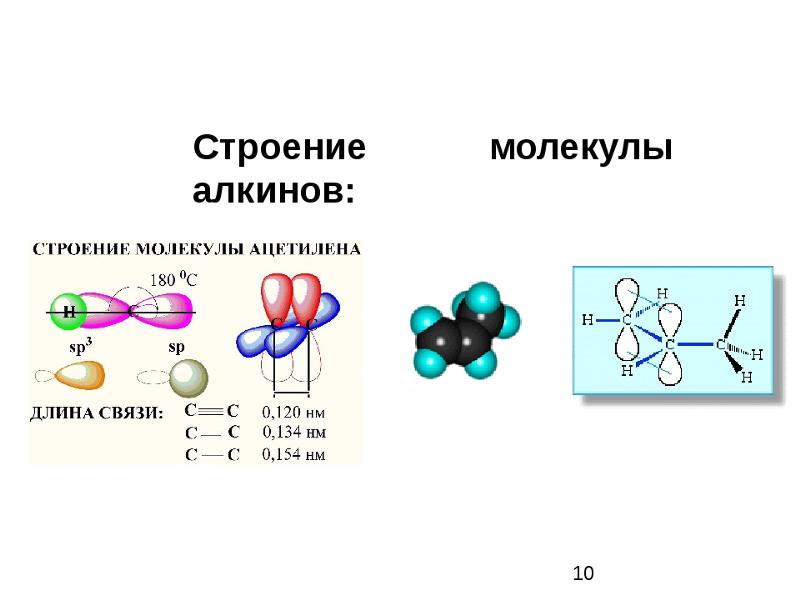
Этин — простейший член своего гомологического ряда, его состав и строение отражают формулы:
- С2Н2 — молекулярная запись состава этина, которая дает представление о том, что вещество образовано двумя углеродными атомами и таким же числом атомов водорода. По этой формуле можно рассчитать молекулярную и молярную массы соединения. Mr (С2Н2) = 26 а. е.
 м., М (С2Н2) = 26,04 г/моль.
м., М (С2Н2) = 26,04 г/моль. - Н:С:::С:Н — электронно-точечная формула ацетилена. Подобные изображения, получившие название «структуры Льюиса», отражают электронное строение молекулы. При написании необходимо соблюдать правила: атом водорода стремится при образовании химической связи обладать конфигурацией валентной оболочки гелия, другие элементы — октетом внешних электронов. Каждое двоеточие означает общую для двух атомов или неподеленную пару электронов внешнего энергетического уровня.
- H—C≡C—H — структурная формула ацетилена, отражающая порядок и кратность связей между атомами. Одна черточка заменяет собой одну пару электронов.
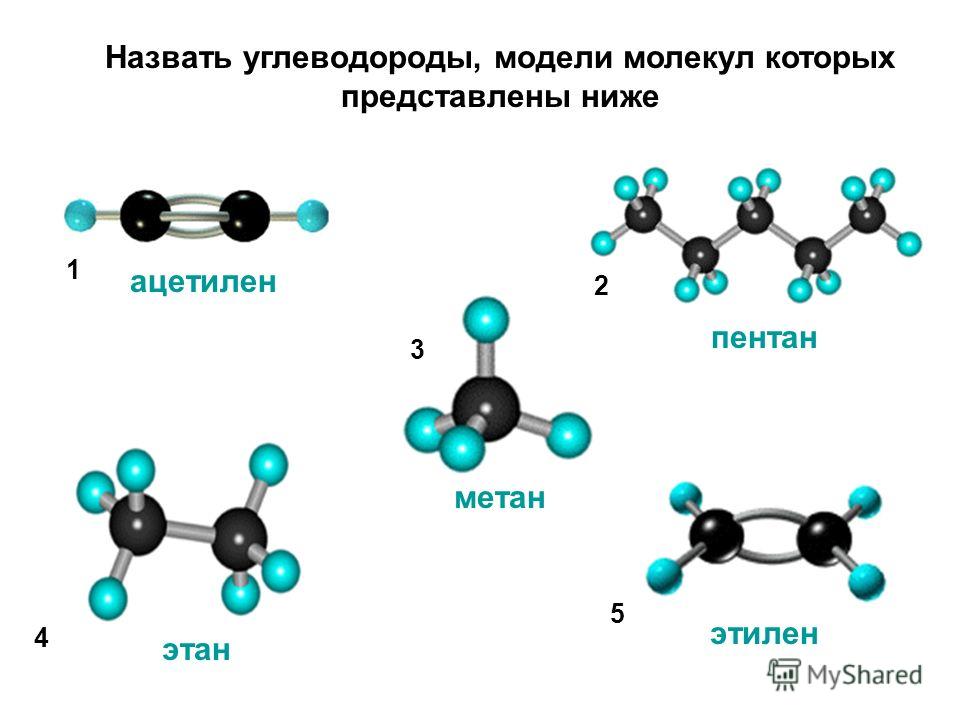
Модели молекулы ацетилена
Формулы, показывающие распределение электронов, послужили фундаментом для создания атомно-орбитальных моделей, пространственных формул молекул (стереохимических). Еще в конце XVIII века получили распространение шаростержневые модели – например, шарики разного цвета и размера, обозначающие углерод и водород, которые образуют ацетилен. Структурная формула молекулы представлена в виде стержней, символизирующих химические связи и их количество у каждого атома.
Структурная формула молекулы представлена в виде стержней, символизирующих химические связи и их количество у каждого атома.
Шаростержневая модель ацетилена воспроизводит валентные углы, равные 180°, но межъядерные расстояния в молекуле отражаются приблизительно. Пустоты между шариками не создают представления о заполнении пространства атомов электронной плотностью. Недостаток устранен в моделях Дрейдинга, обозначающих ядра атомов не шариками, а точками присоединения стержней друг к другу. Современные объемные модели дают более яркое представление об атомных и молекулярных орбиталях.
Гибридные атомные орбитали ацетилена
Углерод в возбужденном состоянии содержит три р-орбитали и одну s с неспаренными электронами. При образовании метана (СН4) они принимают участие в создании равноценных связей с атомами водорода. Известный американский исследователь Л. Полинг разработал учение о гибридном состоянии атомных орбиталей (АО). Объяснение поведения углерода в химических реакциях заключается в выравнивании АО по форме и энергии, образовании новых облаков. Гибридные орбитали дают более прочные связи, становится устойчивее формула.
Гибридные орбитали дают более прочные связи, становится устойчивее формула.
Атомы углерода в молекуле ацетилена, в отличие от метана, подвергаются sp-гибридизации. По форме и энергии смешиваются s- и р электроны. Появляются две sp-орбитали, лежащие под углом 180°, направленные по разные стороны от ядра.
Тройная связь
В ацетилене гибридные электронные облака углерода участвуют в создании σ-связей с такими же соседними атомами и с водородом в парах С—Н. Остаются две перпендикулярные друг другу негибридные p-орбитали. В молекуле этина они участвуют в образовании двух π-связей. Вместе с σ возникает тройная связь, которую отражает структурная формула. Ацетилен отличается от этана и этилена расстоянием между атомами. Тройная связь короче двойной, но обладает большим запасом энергии, является более прочной. Максимальная плотность σ- и π-связей расположена в перпендикулярных областях, что приводит к образованию цилиндрического электронного облака.
Особенности химической связи в ацетилене
Молекула этина имеет линейную форму, что удачно отражает химическая формула ацетилена — H—C≡C—H. Атомы углерода и водорода находятся вдоль одной прямой, между ними возникают 3 σ- и 2 π-связи. Свободное движение, вращение вдоль оси C—C невозможно, этому препятствует наличие кратных связей. Другие особенности тройной связи:
Атомы углерода и водорода находятся вдоль одной прямой, между ними возникают 3 σ- и 2 π-связи. Свободное движение, вращение вдоль оси C—C невозможно, этому препятствует наличие кратных связей. Другие особенности тройной связи:
- количество пар электронов, связывающих два атома углерода, — 3;
- длина — 0,120 нм;
- энергия разрыва — 836 кДж/моль.
Для сравнения: в молекулах этана и этилена длина одинарной и двойной химической связи — 1,54 и 1,34 нм соответственно, энергия разрыва С—С составляет 348 кДж/моль, C=C — 614 кДж/моль.
Гомологи ацетилена
Ацетилен — простейший представитель алкинов, в молекулах которых также присутствует тройная связь. Пропин СН3С≡СН — гомолог ацетилена. Формула третьего представителя алкинов — бутина-1 — СН3СН2С≡СН. Ацетилен — тривиальное название этина. Систематическая номенклатура алкинов подчиняется правилам ИЮПАК:
- в линейных молекулах указывается название основной цепи, возникшее от греческого числительного, к которому добавляется суффикс -ин и номер атома при тройной связи, например, этин, пропин, бутин-1;
- нумерацию главной цепочки атомов начинают с конца молекулы, ближайшего к тройной связи;
- для разветвленных углеводородов сначала идет наименование бокового ответвления, затем следует название главной цепочки атомов с суффиксом -ин.

- заключительная часть наименования — цифра, указывающая расположение в молекуле тройной связи, например, бутин-2.
Изомерия алкинов. Зависимость свойств от строения
Этин и пропин не имеют изомеров положения тройной связи, они появляются, начиная с бутина. Изомеры углеродного скелета есть у пентина и следующих за ним гомологов. Относительно тройной связи не проявляется пространственная изомерия ацетиленовых углеводородов.
Первые 4 гомолога этина — газы, плохо растворимые в воде. Ацетиленовые углеводороды C5 – C15 — жидкости. Твердыми веществами являются гомологи этина, начиная с углеводорода C17. Химическая природа алкинов испытывает значительное влияние тройной связи. Углеводороды этого типа активнее, чем этиленовые, присоединяют различные частицы. На этом свойстве основано широкое применение этина в промышленности и технике. При горении ацетилена выделяется большое количество теплоты, что находит применение в газовой резке и сварке металлов.
Ацетилен
Урок 32. Химия 9 класс ФГОС
В этом уроке изучаются свойства ацетилена, как первого представителя класса алкинов. Здесь рассматриваются особенности строения молекулы ацетилена (валентный угол, тройная связь). На основании строения молекулы ацетилена изучаются физические и химические свойства. Кроме этого, в видеоуроке есть материал по получению и применению алкинов. А в конце урока разобран пример задачи «на примеси».
Конспект урока “Ацетилен”
Ацетилен
Впервые ацетилен получил в 1836 году Дэви, действуя на карбид кальция водой. Дал название ацетилену французский химик – П.Э. Бертло в 1860 году.
Ацетилен,
или этин является первым представителем ненасыщенных углеводородов с тройной
связью. Его молекулярная формула С2Н2.
Начиная с ацетилена, можно построить гомологический ряд, в котором
каждый последующий углеводород отличается от предыдущего на одну группу СН
С3Н4 – это пропин, С4Н6 – бутин. Поэтому общая формула гомологического ряда ненасыщенных углеводородов с одной тройной связью СnНn-2. Общее название этого класса – алкины.
Названия ацетилена и его гомологов образуют изменением суффикса – ан на суффикс –ин.
В отличие от этилена, имеющего плоскостное строение, ацетилен имеет линейное строение: все четыре атома молекулы ацетилена лежат на одной прямой с углами связей, равными 1800. Каждый атом углерода образует три связи с атомами углерода и одну – с атомами водорода.
Ацетилен при обычных условиях
представляет собой бесцветный газ, смесь которого с воздухом взрывается от искры. Ацетилен плохо растворяется в воде, хорошо растворяется в ацетоне: в одном объёме ацетона при обычных условиях растворяется двадцать пять объёмов ацетилена.
Так как ацетилен содержит кратные связи, то для него характерны реакции присоединения. Например, при присоединении водорода количеством один моль к ацетилену количеством один моль в присутствии катализатора образуется этилен.
В данной реакции происходит разрыв только одной ковалентной связи в молекуле ацетилена.
Этилен, в свою очередь, также может взаимодействовать с водородом в присутствии катализатора с образованием этана. Поэтому можно написать суммарное уравнение присоединения водорода количеством два моль к ацетилену количеством один моль с разрывом двух ковалентных связей и образованием этана.
Ацетилен вступает и в реакции присоединения галогенов.
Например,
при присоединении хлора количеством 1 моль к ацетилену количеством один моль,
разрывается одна ковалентная связь и образуется 1,2–дихлорэтен, если к
ацетилену присоединить сразу два моль хлора, то разрывается две ковалентные
связи и образуется соединение 1,1,2,2–тэтрахлорэтан.
Кроме галогенов, ацетилен вступает в реакции присоединения галогеноводородов. Например, при присоединении хлороводорода количеством один моль к ацетилену количеством один моль, то разрывается только одна ковалентная связь и образуется хлорэтен. Если к ацетилену количеством один моль добавить два моль хлороводорода, то разрываются две связи и образуется 1,1–дихлорэтан
.При горении ацетилена образуется углекислый газ и вода.
В лаборатории ацетилен получают действием воды на карбид кальция СаС2. В результате этого взаимодействия образуется ацетилен и гидроксид кальция.
Например, если на карбид кальция подействовать водой, а затем поджечь выделяющийся газ, то он горит коптящим пламенем. Это горит ацетилен.
В
смеси с кислородом ацетилен широко используется для резки и сварки
металлов. Ацетилен используют при получении растворителей, уксусной кислоты,
клея ПВА, поливинилхлорида, а также его используют как горючее.
Решим задачу. Вычислите, какой объём ацетилена при нормальных условиях, образуется в результате взаимодействия с водой 100 г технического карбида кальция, содержащего 4% примесей.
По
условию задачи нам дана масса карбида кальция 100 г и массовая доля примесей в
этом техническом карбиде кальция 4%. Найти нужно объём ацетилена. Согласно
уравнению, в результате этой реакции образуется газ ацетилен и гидроксид
кальция. Найдём массовую долю чистого карбида кальция, для этого от 100
вычитаем 4 и получаем 96%, поэтому масса чистого карбида кальция равна
произведению массы технического карбида кальция на массовую долю чистого
карбида кальция. Получается нужно 100 умножить на 0,96%, получаем 96 г.
Нам необходимо найти количество вещества карбида кальция, для этого необходимо
его массу разделить на молярную массу. Чтобы найти молярную массу карбида
кальция нужно атомную массу кальция умножить на один и сложить с произведением
атомной массы углерода, умноженной на два, получается 64 г/моль.
Таким
образом, ненасыщенные углеводороды с одной тройной связью (алкины) образуют
гомологический ряд общей формулой СnНn-2.
Названия ацетилена и его гомологов образуют изменением суффикса –ан на суффикс
–ин. Ацэтилен имеет линейное строение и образует угол связи равный 1800.
Характерными свойствами ацетилена являются реакции присоединения.
Предыдущий урок 31 Алкены. Химические свойства этилена
Следующий урок 33 Ароматические углеводороды на примере бензола
Получите полный комплект видеоуроков, тестов и презентаций Химия 9 класс ФГОС
Чтобы добавить комментарий зарегистрируйтесь или войдите на сайт
Ацетилен – определение, формула, структура, производство и свойства
Ацетилен также может называться этином, также известным как нарсилен, а также винилен. Он широко используется в качестве химических строительных блоков и в качестве топлива. В своей основной форме он нестабилен и используется в качестве раствора. Соединение является ненасыщенным и. Два атома углерода, образующие его, связаны двумя связями.
Два атома углерода, образующие его, связаны двумя связями.
Винилен представляет собой бесцветный газ со слабым запахом, напоминающим запах эфира. Легко растворяется в хлороформе, воде, ацетоне и бензоле. Он несколько растворяется в сероуглероде, а также в спирте. Он легче воздуха и способен воспламеняться. Длительное воздействие пламени или тепла может привести к быстрому растрескиванию контейнеров.
Основные виды применения
Освещение, кислородно-ацетиленовая сварка, резка и пайка металлов; сигнализация; осаждение меди, в частности, и ацетальдегида; Производство уксусной кислоты.
Применяется для металлизации пайки, а также для закалки, факельной сварки и локального нагрева в металлургических процессах. Пламя также используется в производстве стекла. В химическом отношении ацетилен можно использовать в производстве искусственного каучука, бутиролактона, винилалкилового эфира и пирролидона. Он используется для пайки, локального нагрева и в стекольной промышленности.
В химической промышленности ацетилен может быть использован в качестве исходного сырья при производстве акрилонитрила, винилхлорида, синтетического каучука, винилацетата, бутиролактона, акрилата, трихлорэтилена, 1,4-бутандиола, винилалкиловых эфиров и пирролидона и так далее.
Применяется для резки, сварки, металлизации, пайки, изготовления поврежденных материалов, поверхностной закалки, локальной закалки и закрепления, надрезов местного нагрева (термоусадочная и т.п.).
Производство винилхлорида, винилацетата, акрилатов, акрилонитрила Ацетальдегид; пер- и трихлорэтилен 1,4-бутандиол, циклооктатетраен черный; а также резка и сварка металлов.
Междунар. хим. для хлорированных растворителей акриловой кислоты и тетрагидрофурана и других химических соединений.
Продукты, изготовленные из ацетилена, включают мономер винилхлорида, ацетиленовую чернь, винилфторид, N-винилкарбазол, N-винилкапролактам и другие производные, такие как 1,4-бутандиол, виниловые эфиры, N-винил-2-пирролидон и винил сложные эфиры.
Ацетилен использовался в 1900-х годах в качестве анестетика (под именем Марселин). Он больше не используется в качестве анестетика, поскольку теперь доступны более эффективные и менее взрывоопасные альтернативы.
Ключевой промышленный сырьевой материал, ацетилен, может быть использован для получения алкенов и растворителей, которые затем используются в качестве мономеров при производстве пластика. Он также используется при резке, пайке, пламенной зачистке, металлургическом нагреве и закалке, а также в стекольной промышленности. В оптометрии это компонент контактных линз. Как и этилен, ацетилен можно использовать для созревания фруктов и взрослых деревьев, цветов.
При черном процессе ацетилена ацетилен и воздух воспламеняются, чтобы нагреть сосуд, в котором он используется. Он отключается, позволяя ацетилену распадаться на водород и углерод при недостатке кислорода. Это приводит к… одной из самых «чистых» саж.
Прочие детали
Ацетилен – выбрасываемый газ (C 2 H 2 ), состоящий из водорода и углерода. Ацетилен известен как D.A. — растворенный ацетилен. Цилиндр имеет темно-бордовый цвет. кислород (коммерческий) находится в баллоне черного цвета. Химическая формула ацетилена может быть описана как C 2 H 2 .
Ацетилен известен как D.A. — растворенный ацетилен. Цилиндр имеет темно-бордовый цвет. кислород (коммерческий) находится в баллоне черного цвета. Химическая формула ацетилена может быть описана как C 2 H 2 .
Образуется при контакте карбида кальция с водой. Карбид кальция представляет собой химическое соединение, состоящее из углерода и металлов кальция. Углерод – это атом углерода. один атом кальция из металла можно найти в одной молекуле карбида кальция. Химическая формула карбида кальция может быть описана как CaC 2 .
Если карбонат кальция вступает в контакт с водой, углерод в карбиде реагирует с одним атомом водорода из воды и образует газообразный ацетилен. CaC 2 + H 2 O = CaO +C 2 H 2 . Основная примесь присутствует в товарной форме карбида кальция СаО, реагирующего с водой по реакции СаО + Н 2 О = Са(ОН) 2 +15,1 кг ккал/гмоль.
Газообразный ацетилен может быть нестабильным при высоких давлениях, он находится внутри баллона, растворенный в кислоте, называемой ацетоном.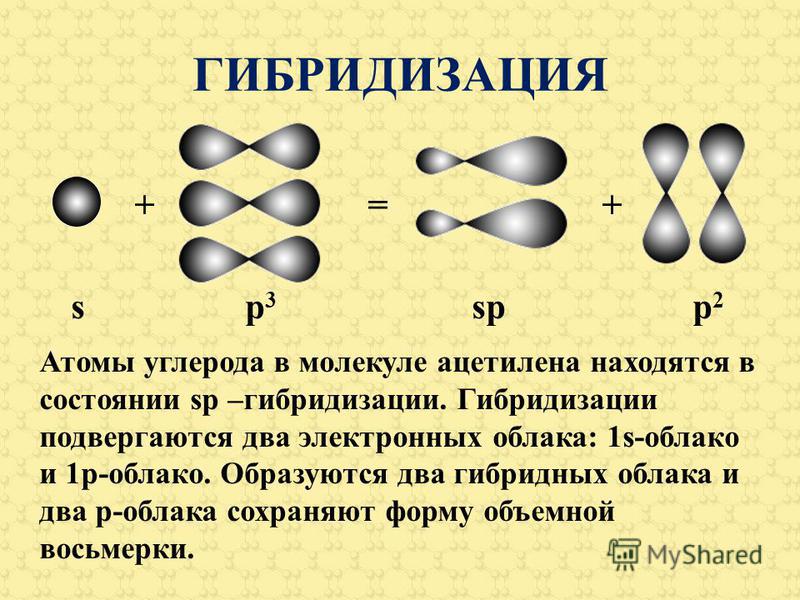 Ацетон содержится в пористом асбесте, древесном угле или любом другом веществе.
Ацетон содержится в пористом асбесте, древесном угле или любом другом веществе.
Ацетилен представляет собой смесь водорода и углерода в соотношении 24 части углерода и 2 части водорода – 92,3 процента углерода и 7,7 процента водорода. Углерод и водород способны создавать высокие температуры от 3100 до 3300°C. Имеет самую высокую температуру пламени.
Причиной его нагревательной способности является выделение огромного количества тепла, которое было поглощено в процессе производства карбида кальция. Ацетилен растворяют в цилиндрических цилиндрах при оптимальном давлении 250 фунтов/кв. дюйм. Тепло, производимое комбинацией карбида кальция и воды внутри генератора, называется «скрытым теплом».
Подробнее об ацетоне
Ацетилен — это химическое соединение, имеющее формулу C 2 H 2 . Это простейший алкин и представляет собой углеводород. Ацетилен представляет собой бесцветный газ (как правило, низшие углеводороды газообразны по своей природе), который широко используется в качестве химического строительного материала, а также в качестве топлива.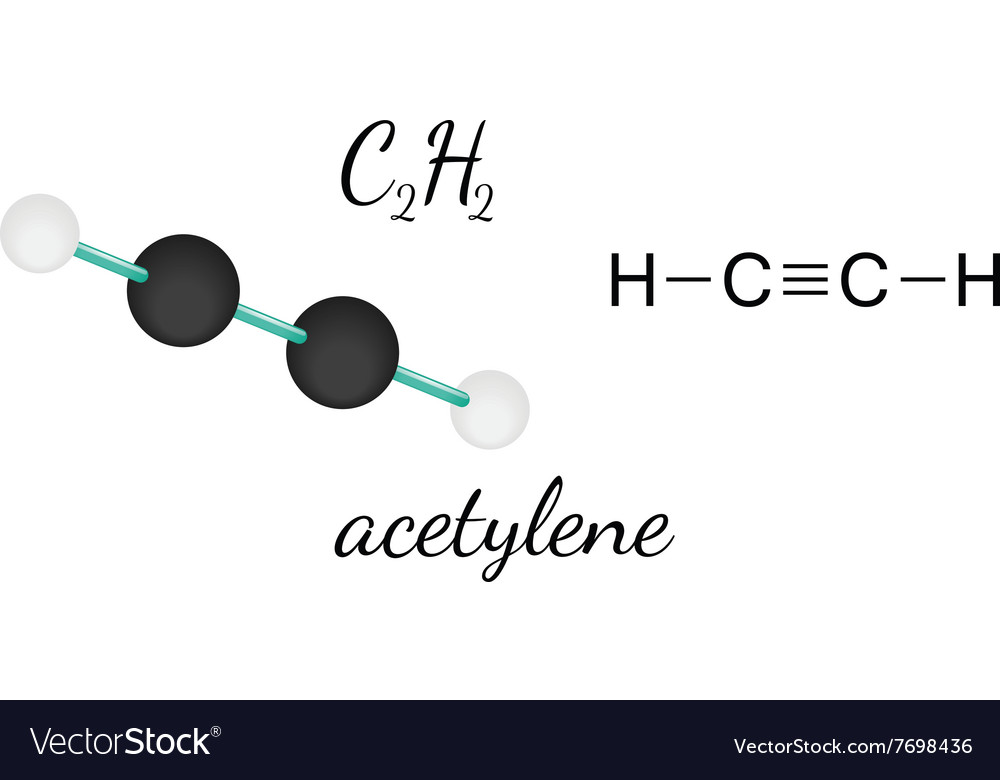 В чистом виде ацетилен нестабилен, поэтому с ним обычно обращаются в виде раствора. Чистый ацетилен не имеет запаха, но, как правило, товарные марки имеют выраженный запах из-за примесей. Систематический C 2 H 2 название может быть указано как этин.
В чистом виде ацетилен нестабилен, поэтому с ним обычно обращаются в виде раствора. Чистый ацетилен не имеет запаха, но, как правило, товарные марки имеют выраженный запах из-за примесей. Систематический C 2 H 2 название может быть указано как этин.
Ацетилен является ненасыщенным алкином, поскольку два его атома углерода связаны тройной связью. Тройная связь углерод-углерод размещает все четыре атома на одной прямой линии с валентными углами CCH, равными 180 °.
Формула и структура ацетилена
Химическая формула ацетилена C 2 H 2 , расширенная формула CH≡CH. Молярная масса ацетилена может быть равна 26,04 г/моль-1. Кроме того, это простейшая молекула алкина, представляющая собой охарактеризованную учеными функциональную группу, имеющую тройные связи.
Его молекулы линейны на 180 градусов, следовательно, его атомы углерода гибридизованы sp. Кроме того, оба атома углерода имеют 2 sp-орбитали, на которых одна связана с водородом, а другая связана с простой связью углерода. С другой стороны, тройная связь, то есть 2 связи, образующиеся между четырьмя орбиталями P без гибридизации, лежит ортогонально линейной системе.
С другой стороны, тройная связь, то есть 2 связи, образующиеся между четырьмя орбиталями P без гибридизации, лежит ортогонально линейной системе.
В обычном представлении, используемом для органических молекул, его химическая структура представляется как C 2 H 2 , а структура ацетилена или структура C 2 H 2 может быть представлена следующим образом.
Наличие ацетилена
Мы можем обнаружить присутствие ацетилена в природе, особенно растворенного в воде. Несколько бактерий используют его в качестве основного источника в производстве ацетальдегида. Мы также можем найти это соединение в природном газе и в нефтяных скважинах вместе с сырой нефтью и другими газами. Более того, он также является частью некоторой атмосферы солнечной планеты.
Производство ацетилена
С 1950 года ацетилен синтезируют частичным сжиганием CH 4 (метан). До 1983 года было произведено около 4 00 000 тонн.
Он был получен по реакции, открытой Фридрихом Вёлерте в 1862 году. Реакция гидролиза карбида кальция может быть представлена следующим образом:
\[ CaC_{2} + 2H_{2}O → Ca(OH)_{2 } + C_{2}H_{2} \]
Реакция, представленная выше, протекает при чрезвычайно высокой температуре, приблизительно 2000°С, с использованием электродуговой печи.
Свойства ацетилена
Рассмотрим физические и химические свойства ацетилена.
Физические свойства
Ацетилен представляет собой бесцветный газ с чесночным запахом, но в самой чистой форме он не имеет запаха. Растворяем соединение в ацетоне для отправки. Точки плавления (точнее тройной точки, обусловленной равновесием между тремя фазами) и сублимации (процесс превращения твердого вещества в газообразное и наоборот без перехода через жидкое состояние) составляют -80,7 0С и -84,7 0С соответственно.
Плотность ацетилена может быть равна 1,097 г/мл-1. Можно легко зажечь закопченное пламя. Однако ацетилен смешивается с ацетоном, водой, бензолом и хлороформом. Он также слабо растворим в этаноле.
Можно легко зажечь закопченное пламя. Однако ацетилен смешивается с ацетоном, водой, бензолом и хлороформом. Он также слабо растворим в этаноле.
Химические свойства
Ацетилен является высокореактивным химическим соединением благодаря наличию у него электронов в тройной связи С-С. Вот почему ацетилен — блестящий нуклеофил. Таким образом, он может подвергаться широкому спектру реакций для получения коммерческих продуктов, таких как акриловая кислота, ацетилид, спирт и виниловое соединение. Мы также можем использовать его для получения металлоорганических соединений при взаимодействии с таким металлом, как медь.
Использование ацетилена
Многие отрасли промышленности широко используют ацетилен в процессах сварки из-за высокой температуры ацетиленового пламени (3300°C). Некоторые менее развитые страны используют это пламя в качестве ламп накаливания. Кроме того, он может давать промежуточные продукты, такие как этилен, который очень полезен при производстве полипропилена, получаемого в пластмассовой промышленности.
Применение ацетилена
Портативное освещение
Карбид кальция использовался для производства ацетилена, который используется в лампах для переносных или удаленных применений. Он использовался для спелеологов и горняков до широкого использования ламп накаливания; он до сих пор используется горнодобывающей промышленностью в нескольких странах без законов о безопасности на рабочем месте; много лет спустя маломощное или яркое светодиодное освещение. Кроме того, карбидные лампы широко использовались в качестве фар в первых автомобилях и в качестве источника света для маяков.
Опасности для здоровья и безопасности
Давайте рассмотрим некоторые важные опасности для здоровья и безопасности, связанные с ацетиленом.
Это соединение легче воздуха и просто токсично, если производится методами, которые могут оставить другие химические соединения в виде примесей. Кроме того, он легко воспламеняется сажевым пламенем. Кроме того, его нельзя хранить вместе с окислителями. В частности, он взрывается при воздействии тепла или огня.
Кроме того, его нельзя хранить вместе с окислителями. В частности, он взрывается при воздействии тепла или огня.
2.11: Эмпирические и молекулярные формулы
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 50439
- Роберт Белфорд
- Университет Арканзаса в Литл-Роке
целей обучения
- Различие между эмпирической формулой и молекулярной формулой
- Определите эмпирическую формулу и молекулярную формулу, используя процентный состав
- Определите эмпирическую формулу и молекулярную формулу, используя массовые данные
Введение
Эмпирические измерения основаны на измеримой (эмпирической) величине, такой как масса. Зная массу каждого элемента в соединении, мы можем определить его формулу. Существует два типа формул: эмпирические и молекулярные.
Зная массу каждого элемента в соединении, мы можем определить его формулу. Существует два типа формул: эмпирические и молекулярные.
Молекулярная формула: Фактическое целочисленное соотношение элементов в соединении.
Эмпирическая формула представляет собой наименьшее соотношение целых чисел элементов в соединении. В (раздел 2.10) мы обнаружили, что бензол и ацетилен имеют одинаковый массовый процентный состав, а значит, логично, что они имеют одинаковое соотношение элементов друг к другу, то есть имеют одинаковую эмпирическую формулу.
| Соединение | Ацетилен | бензол | NaCl |
| Структура | |||
| Эмпирическая формула | Ч | Ч | NaCl |
| Молекулярная формула | С 2 Н 2 | С 6 Н 6 | не молекула (используйте NaCl) |
Рисунок \(\PageIndex{1}\): Эмпирические и молекулярные формулы нескольких простых соединений.
Эмпирическая формула
Эмпирическая формула представляет собой наименьшее соотношение целых чисел элементов в соединении. В (раздел 2.10) мы обнаружили, что бензол и ацетилен имеют одинаковый массовый процентный состав, а значит, логично, что они имеют одинаковое соотношение элементов друг к другу, то есть имеют одинаковую эмпирическую формулу.
Для солей, не содержащих гомоядерных двухатомных ионов (например, Hg 2 +2 или O 2 -2 ), эмпирическая формула — это формула, которую мы пишем для описания соли. Хлорид ртути(I) имеет эмпирическую формулу HgCl, но реальная формула соединения Hg 2 Cl 2 (см. таблицу 2.7.3)
Несколько молекул могут иметь одну и ту же эмпирическую формулу. Например, бензол (C 6 H 6 ) и ацетилен (C 2 H 2 ) обе эмпирической формулы CH (см. рисунок \(\PageIndex{1}\).
Расчет эмпирических формул
Шаги:
- Получение массы каждого элемента (в граммах)
- если задана общая масса, вам нужна масса всех элементов, кроме одного (сумма масс равна общей массе).

- , если указан % состава, принимают за 100 г и переводят в массу.
- если задан % состава, вам нужны данные для всех элементов, кроме одного (сумма процентов равна 100%).
- если задана общая масса, вам нужна масса всех элементов, кроме одного (сумма масс равна общей массе).
- Рассчитайте количество молей каждого присутствующего элемента (из массы и атомной массы).
- Теперь у вас есть формула, представляющая молярное соотношение элементов в соединении, и вам нужно получить эти целые числа.
- Разделите число молей каждого элемента на число с наименьшим значением (приравняв его к единице и сделав все остальные значения больше единицы).
- Умножьте результаты шага 3 на наименьшее целое число, которое преобразует их все в целые числа.
Примечание
Хитрость заключается в том, чтобы преобразовать десятичные дроби в дроби, а затем умножить на наименьший общий знаменатель (см.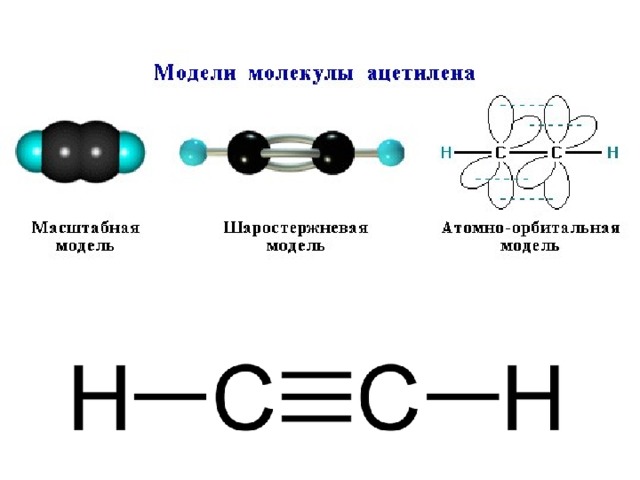 видео \(\PageIndex{1}\))
видео \(\PageIndex{1}\))
| 0,5=\(\frac{1}{2 }\) | 0,33=\(\frac{1}{3}\) | 0,67 = \ (\ гидроразрыва {2} {3} \) | 0,25=\(\frac{1}{4}\) | 0,75 = \ (\ гидроразрыва {3} {4} \) |
| 0,2=\(\frac{1}{5}\) | 0,4 = \ (\ гидроразрыва {2} {5} \) | 0,6=\(\frac{3}{5}\) | 0,8 = \ (\ гидроразрыва {4} {5} \) | 0,167 = \ (\ гидроразрыва {1} {6} \) |
В следующем видео показано, как рассчитать эмпирическую формулу стремления.
Рассчитайте эмпирическую формулу аспирина:
Аспирин состоит из H, O и C, и анализ показал, что он содержит 60,0% углерода и 35,5% кислорода.
Видео \(\PageIndex{1}\): Эмпирическая формула аспирина
Пример \(\PageIndex{1}\)
Определенное соединение содержит 67,6 % C, 22,5 % O и 9,9 % H. Какова эмпирическая формула?
Какова эмпирическая формула?
Раствор
\[22,5gO\влево ( \frac{1molO}{16,00g} \right )= 1,4\стрелка вправо \frac{1,4}{1,4}= 1\]
\[67,6gC\влево ( \frac{1molC}{12,011g} \right )= 5,63\стрелка вправо \frac{5,63}{1,4}= 4\]
\[9,9gH\left ( \frac{1molH}{1,007g} \right ) = 9.9\стрелка вправо \frac{9.9}{1.4}= 7\]
C 4 H 7 O
Этот апплет принадлежит ChemCollective Университета Карнеги-Меллона. Эта ссылка отправит вас к видео и учебнику, связанному с этим апплетом. Каждый раз, когда вы загружаете страницу, загружается новая проблема, и есть ряд многоуровневых подсказок, которые помогут вам справиться с проблемами.
Упражнение \(\PageIndex{1}\): эмпирическая формула
Вычислить эмпирическую формулу для следующего и 1,7248 г кислорода.

- Ответить на
CuN 2 O 6
- Ответ b
№ 2
- Ответ c
Н 2 Н 4 СО
Упражнение \(\PageIndex{2}\): эмпирическая формула
Учитывая эмпирическую формулу соединения в части (a) выше:
- Какой может быть формула соединения.
- Как будет называться соединение, используя формулу в ответе из части (а) этого вопроса.
- Ответить на
Cu(№ 3 ) 2
- Ответ б
Медь(II) нитрат нитрата меди
Упражнение \(\PageIndex{3}\): эмпирическая формула
В разделе 2.10.2 мы видели, что бензол и ацетилен имеют одинаковый массовый процентный состав (92,3% С и 7,7% Н), поэтому рассчитайте их эмпирические формулы
- Какова эмпирическая формула ацетилена (C 2 H 2 )?
- Какова эмпирическая формула бензола (C 6 H 6 )? (Зная (а) эмпирическую формулу ацетилена и (б) то, что бензол и ацетилен имеют одинаковый состав в процентах по массе, можете ли вы ответить на этот вопрос, не занимаясь математикой?)
- Ответить на
Ч
- Ответ б
Ч
Молекулярная формула
Для расчета молекулярной формулы нам нужна дополнительная информация, помимо информации о массе или массовых процентах состава, нам необходимо знать молярную массу вещества. Есть много экспериментальных способов, которые можно определить, и мы изучим некоторые из них в течение семестра. Масс-спектрометр, который мы использовали для определения изотопного состава в разделе 2.3 этой главы, можно использовать для определения молярной массы многих неизвестных веществ. Но есть и другие методы, и на данном этапе семестра молярная масса будет считаться заданной.
Есть много экспериментальных способов, которые можно определить, и мы изучим некоторые из них в течение семестра. Масс-спектрометр, который мы использовали для определения изотопного состава в разделе 2.3 этой главы, можно использовать для определения молярной массы многих неизвестных веществ. Но есть и другие методы, и на данном этапе семестра молярная масса будет считаться заданной.
Эмпирическая формула представляет собой наименьшее целочисленное соотношение элементов в молекуле, тогда как молекулярная формула представляет фактическую формулу молекулы. Таким образом, молекулярная формула должна быть целым числом, кратным эмпирической формуле, то есть она в n раз больше, где n=1, или 2, или 3, или… но это целое число. Это дает следующее соотношение
\[\text{[Молекулярная формула = n([Эмпирическая формула)]}\]
тогда, если у нас есть один моль
\[\text{[Молекулярная масса = n([Эмпирическая масса )]}\]
или
\[n=\frac{\text{[Молекулярный вес]}}{\text{[Эмпирический вес]}}\]
Таким образом, вы вычисляете эмпирическую формулу, как указано выше, затем определяете вес одного моль, разделите его на молярную массу, и это скажет вам, во сколько раз она больше, а затем умножьте эмпирическую формулу на это число.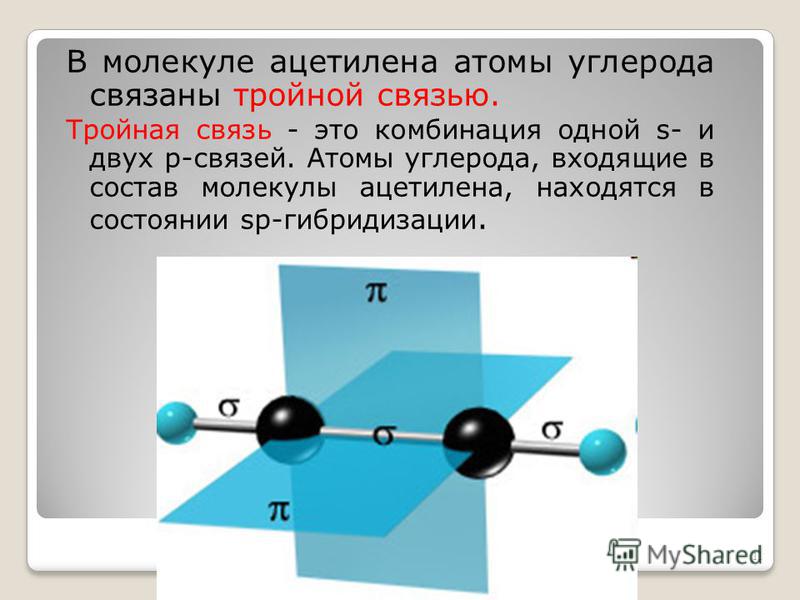
Давайте сравним бензол с ацетиленом. В видео 2.10.2 (раздел 2.10.2) мы видели, что бензол и ацетилен имеют одинаковый состав в процентах по массе, а в упражнении 2.11.3 мы говорим, что они имеют одинаковую эмпирическую формулу
| Имя: | Бензол | Ацетилен |
| Вес формулы | 78,12 г/моль | 26,04 г/моль |
| Эмпирическая формула | Ч | Ч |
| Вес эмпирической формулы | 13.017 | 13.017 |
| n=\(\frac{\text{[Молекулярный вес]}}{\text{[Эмпирический вес]}}\) | \(\frac{78.12}{13.017}=6\) | \(\frac{26.04}{13.017}=2\) |
| Формула = n раз эмпирическая формула | 6(СН) = С 6 Н 6 | 2(СН) = С 2 Н 2 |
Расчет молекулярных формул
Пример \(\PageIndex{2}\)
Определенное соединение содержит 67,6 % C, 22,5 % O и 9,9 % H. Если обнаружено, что молекулярная масса соединения равна примерно 142 г/моль, какова правильная молекулярная формула соединения?
Если обнаружено, что молекулярная масса соединения равна примерно 142 г/моль, какова правильная молекулярная формула соединения?
Раствор
C 4 H 7 O имеет эмпирический вес
(4)(12,01) + (7)(1,007) + (16,00) = 71,09 г/моль 90[90 слева ( \frac{142 г/моль}{71,09г/моль} \right )= 2\]
умножьте коэффициенты на 2
C 8 H 14 O 2
Упражнение \(\PageIndex{40} Formula):
Рассчитайте молекулярную формулу следующего соединения
- Соединение имеет эмпирическую формулу C 2 HF имеет молярную массу 132,06 г/моль.
- 200,0 г пробы кислоты с молекулярной массой 616,73 г/моль содержит 171,36 г углерода, 18,18 г азота, остальное – водород.
- Стрихин имеет молярную массу 334 г/моль и процентный состав 75,42% C, 6,63% H и 8,38% N, а остальное кислород.
- Ответить на
С 6 Н 3 Ж 3
- Ответ b
С 44 С 4 Н 32
- Ответ c
С 21 Н 2 Н 22 О 2
Авторы и ссылки
Роберт Э.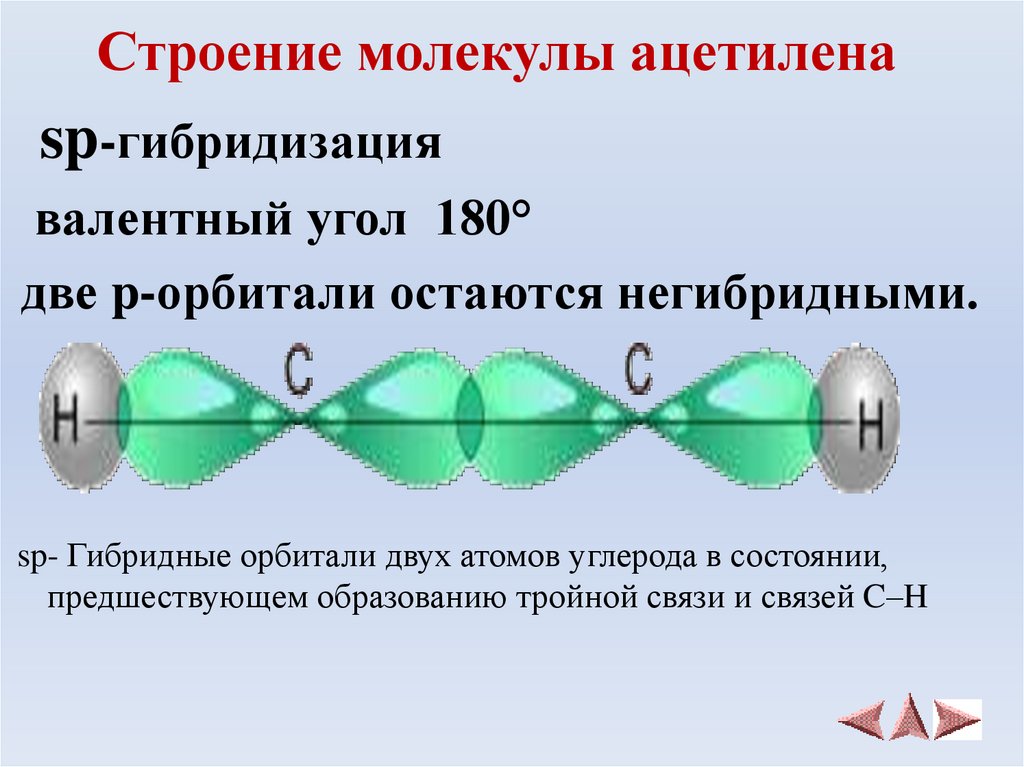 Белфорд (Университет Арканзаса Литл-Рок; химический факультет). Ответственность за широту, глубину и правдивость этой работы несет Роберт Э. Белфорд, [email protected]. Вы должны связаться с ним, если у вас есть какие-либо опасения. Этот материал содержит как оригинальные материалы, так и контент, основанный на предыдущих вкладах сообщества LibreTexts и других ресурсов, включая, помимо прочего:
Белфорд (Университет Арканзаса Литл-Рок; химический факультет). Ответственность за широту, глубину и правдивость этой работы несет Роберт Э. Белфорд, [email protected]. Вы должны связаться с ним, если у вас есть какие-либо опасения. Этот материал содержит как оригинальные материалы, так и контент, основанный на предыдущих вкладах сообщества LibreTexts и других ресурсов, включая, помимо прочего:
- Ноябрь Палмер и Эмили Чоут (UALR)
- Рония Каттум (цели обучения)
Эта страница под названием 2.11: Эмпирические и молекулярные формулы распространяется по незаявленной лицензии, ее автором, ремиксом и/или куратором является Роберт Белфорд.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Роберт Белфорд
- Показать страницу TOC
- да на странице
- Метки



 м., М (С2Н2) = 26,04 г/моль.
м., М (С2Н2) = 26,04 г/моль.