Молекулярная масса аргона: Молярная масса аргона (Ar), формула и примеры
alexxlab | 13.10.1991 | 0 | Разное
| ГОСТы, СНиПы Карта сайта TehTab.ru Поиск по сайту TehTab.ru | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация/ / Физический справочник/ / Газы. Свойства газов. / / Таблица. Молярная масса газов (г/моль = кг/кмоль) от азота до хлористого этила.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
TehTab.ru Реклама, сотрудничество: [email protected] | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Помогите решить / разобраться (Ф)
| AAK |
| ||
29/03/11 |
| ||
| |||
| Munin |
| |||
30/01/06 |
| |||
| ||||
| AAK |
| ||
29/03/11 |
| ||
| |||
| Munin |
| |||
30/01/06 |
| |||
| ||||
| AAK |
| ||
29/03/11 |
| ||
| |||
| Munin |
| |||
30/01/06 |
| |||
| ||||
| AAK |
| ||
29/03/11 |
| ||
| |||
| Показать сообщения за: Все сообщения1 день7 дней2 недели1 месяц3 месяца6 месяцев1 год Поле сортировки АвторВремя размещенияЗаголовокпо возрастаниюпо убыванию |
| Страница 1 из 1 | [ Сообщений: 7 ] |
Модераторы: photon, whiterussian, profrotter, Jnrty, Aer, Парджеттер, Eule_A, Супермодераторы
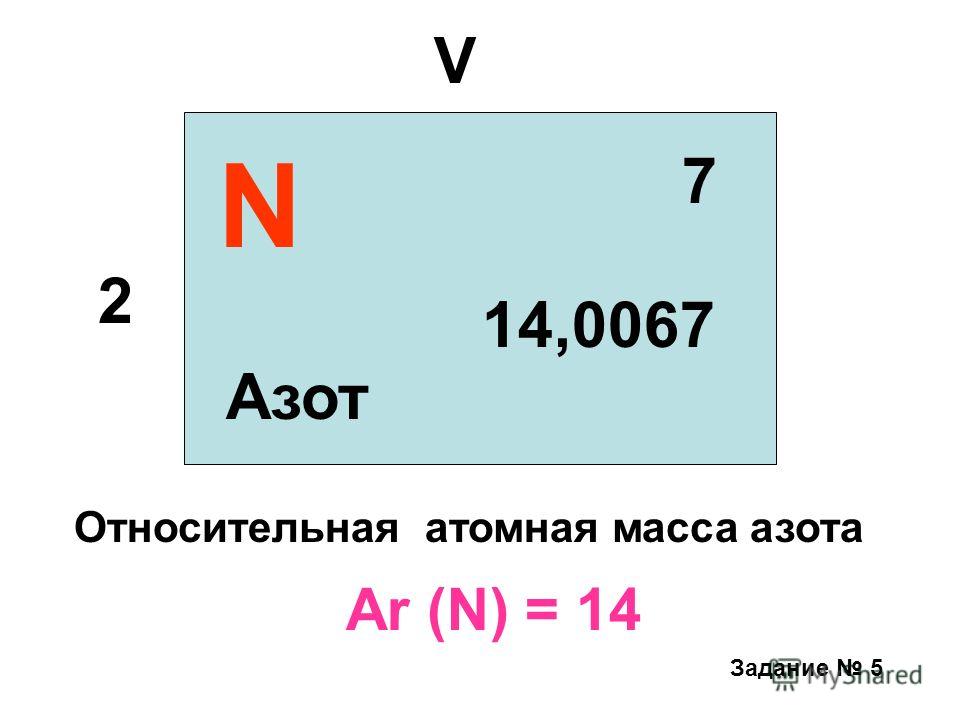
Молярная масса аргона.
 Таблица. Молярная масса газов (г/моль = кг/кмоль) от азота до хлористого этила.
Таблица. Молярная масса газов (г/моль = кг/кмоль) от азота до хлористого этила.ГлавнаяАргонМолярная масса аргона
Молярная масса некоторых газов значения (Таблица)
Молярная масса газа (или вещества) — это отношение массы газа к количеству молей этого газа, то есть масса одного моля газа (вещества).
В системе СИ молярная масса выражается в кг/моль (или г/моль), обозначают обычно буквой M.
Название газа и его химическая формула | Молярная масса, г/моль |
Азот (N2) | 28,016 |
Аммиак (Nh5) | 17,031 |
Аргон (Ar) | 39,944 |
Ацетилен (C2h4) | 26,04 |
Ацетон (C3H6O) | 58,08 |
Н-бутан (C4h30) | 58,12 |
Изо-бутан ( C4HJ0) | 58,12 |
Н-бутиловый спирт ( C4HJ0O) | 74,12 |
Вода (h4O) | 18,016 |
Водород (h4) | 2,0156 |
Воздух (сухой) | 28,96 |
Н-гексан (C6HJ4) | 86,17 |
Гелий (He) | 4,003 |
Н-гептан (C7HJ6) | 100,19 |
Двуокись углерода (CO2) | 44,01 |
Н-декан ( C10h42) | 142,30 |
Дифенил ( C12h30) | 154,08 |
Дифениловый эфир ( CJ2h30O) | 168,8 |
Дихлорметан ( Ch4Cl2) | 84,94 |
Диэтиловый эфир (C4h30O) | 74,12 |
Закись азота (N2O) | 44,016 |
Йодистый водород (HJ) | 127,93 |
Кислород (O2) | 32,00 |
Криптон (Kr) | 83,7 |
Ксенон (Xe) | 131,3 |
Метан (Ch5) | 16,04 |
Метиламин (CH5N) | 31,06 |
Метиловый спирт (Ch5O) | 32,04 |
Неон (Ne) | 20,183 |
Нитрозилхлорид (NOCl) | 65,465 |
Озон (O3) | 48,00 |
Окись азота (NO) | 30,008 |
Окись углерода (CO) | 28,01 |
Н-октан ( C8h38) | 114,22 |
Н-пентан ( C5h32) | 72,14 |
Изо-пентан ( C5h32) | 72,14 |
Пропан ( C3H8) | 44,09 |
Пропилен ( C3H6) | 42,08 |
Селеновая кислота (h4Se) | 80,968 |
Сернистый газ (SO2) | 64,06 |
Сернистый ангидрид (SO3) | 80,06 |
Сероводород (h4S) | 34,08 |
Фосфористый водород (Ph5) | 34,04 |
Фреон 11 (CF3CI) | 137,40 |
Фреон-12 (CF2CI2) | 120,92 |
Фреон-13 (CFCI3) | 114,47 |
Фтор (F2) | 38,00 |
Фтористый кремний (SiF4) | 104,06 |
Фтористый метил (Ch5F) | 34,03 |
Хлор (Cl2) | 70,914 |
Хлористый водород (HCl) | 36,465 |
Хлористый метил (Ch5Cl) | 50,49 |
Хлороформ (CHCl3) | 119,39 |
Циан (C2N2) | 52,04 |
Цианистая кислота (HCN) | 27,026 |
Этан (C2H6) | 30,07 |
Этиламин (C2H7N) | 45,08 |
Этилен (C2h5) | 28,05 |
Этиловый спирт (C2H6O) | 46,07 |
64,52 |
infotables. ru
ru
Плотность аргона (Ar), значение и примеры
Плотность аргона и другие его физические свойства
Молекулы аргона одноатомные и взаимодействуют друг с другом лишь за счет слабых лондоновских сил.
Аргон образует клараты на основе воды и гидрохинона, например, состава 8Ar×46Н2О. Плохо растворяется в воде (растворимость понижается в присутствии сильных электролитов), лучше — в органических растворителях.
Важнейшие константы аргона приведены в таблице ниже.
Таблица 1. Физические свойства и плотность аргона.
|
Плотность, г/см3 |
1,784×10-3 |
|
Температура плавления, oС |
-248,6 |
|
Температура кипения, oС |
-246,1 |
|
Стандартная энтальпия испарения, кДж/моль (20 oС) |
1,74 |
|
Растворимость в воде при 20oС, мл/л |
10,5 |
Распространенность аргона в природе
Аргон содержится, главным образом, в воздухе (его содержание составляет 0,932% (об. ), 1,28% (масс.)), являясь сырьем для его промышленного получения.
), 1,28% (масс.)), являясь сырьем для его промышленного получения.
Краткая характеристика химических свойств и плотность аргона
Аргон не реагирует со всеми другими веществами (простыми и сложными).
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
Таблица. Молярная масса газов (г/моль = кг/кмоль) от азота до хлористого этила.
|
tehtab. ru
ru
Калькулятор молярной массы, молекулярной массы и строения элементов
| ||||||||||
ru.webqc.org
Молекулярная масса вещества
Молекулярная масса вещества, также называемая молярной массой , M, представляет собой массу 1 моля этого вещества, выраженную в M граммах.
В системе СИ единицей измерения М является [кг/кмоль], в английской системе единицей измерения является [фунт/фунтмоль], а в системе СГ единицей измерения М является [г/моль]. Молекулярная масса представлена одним и тем же числом во всех системах единиц независимо от используемой системы. По этой причине во многих случаях единица молекулярной массы не упоминается; однако следует понимать, что это не безразмерный параметр.
Молекулярная масса представлена одним и тем же числом во всех системах единиц независимо от используемой системы. По этой причине во многих случаях единица молекулярной массы не упоминается; однако следует понимать, что это не безразмерный параметр.
Молекулярная масса чистого соединения определяется по его химической формуле и атомным массам его элементов. Атомные массы элементов, обнаруженных в органических веществах: C = 12,011, H = 1,008, S = 32,065, O = 15,999 и N = 14,007.
Пример: Молекулярная масса этанола (C 2 H 5 OH)
Для расчета молекулярной массы этанола суммируется молекулярная масса каждого атома в молекуле:
M этанол = 2*12,011[кг/кмоль] + 6*1,008[кг/кмоль] + 1*15,999 [кг/кмоль] = 46,069 [кг/кмоль]
См. также Физические данные для углеводородов, Физические данные для спиртов и карбоновых кислот кислоты, Физические данные для органических соединений азота и Физические данные для органических соединений серы
 038
038 286
286 178
178 189
189 097
097Выпот – AP Chemistry
Все ресурсы AP Chemistry
6 Диагностические тесты 225 практических тестов Вопрос дня Карточки Learn by Concept
AP Chemistry Help » Растворы и состояния вещества » Газы » Выпот
Смесь газа неона и газа аргона находится в контейнере (контейнер А). В сосуде одинаковое количество обоих газов. В контейнере создается небольшое отверстие, позволяющее газам выходить в пустой контейнер (контейнер B). Время выпота очень короткое, и отверстие в конечном итоге закупоривается, в результате чего в обоих контейнерах образуется смесь обоих газов.
В сосуде одинаковое количество обоих газов. В контейнере создается небольшое отверстие, позволяющее газам выходить в пустой контейнер (контейнер B). Время выпота очень короткое, и отверстие в конечном итоге закупоривается, в результате чего в обоих контейнерах образуется смесь обоих газов.
Какое из следующих утверждений верно после закрытия отверстия?
Возможные ответы:
Контейнер B будет содержать в два раза больше атомов неона, чем атомов аргона
Оба газа будут иметь одинаковое парциальное давление в контейнере A
Парциальное давление аргона больше, чем парциальное давление неона в контейнере Контейнер B
будет содержать в два раза больше атомов аргона, чем атомов неона
Правильный ответ:
Парциальное давление аргона больше, чем парциальное давление неона в контейнере А
Пояснение:
Скорость выделения двух газов можно сравнить друг с другом с помощью следующего уравнения:
Здесь скорость выделения обратно пропорциональна квадратному корню из молекулярных масс рассматриваемых газов. Поскольку это отношение представляет собой квадратный корень из молекулярных масс, мы не будем наблюдать соотношение 2:1 для неона по сравнению с аргоном.
Поскольку это отношение представляет собой квадратный корень из молекулярных масс, мы не будем наблюдать соотношение 2:1 для неона по сравнению с аргоном.
Однако мы увидим, что больше неона вытекает из контейнера А по сравнению с количеством аргона, потому что неон является более легким газом и, следовательно, будет иметь более высокую скорость вытекания. В результате аргона в контейнере А будет больше, чем неона после того, как отверстие будет заткнуто. Это приводит к тому, что аргон имеет большее парциальное давление, чем неон в контейнере A.
Сообщить об ошибке
Стеклянный ящик содержит равное количество водорода, азота, кислорода и брома. Газы могут выходить из контейнера через крошечное отверстие. Какой газ выйдет из отверстия быстрее?
Возможные ответы:
Они все выходят с той же скоростью, потому что температура является постоянной
Бром
азот
Кислород
Hydrogen
Правильный ответ:
Hydrogen 9000
Правильный ответ:
7005
. Правильный ответ:
Правильный ответ:
Hydrogen 9000
. Пояснение:
При определенной температуре средняя кинетическая энергия всех молекул газа одинакова. Поскольку газообразный водород имеет самую низкую массу из этих газов, он будет иметь самую высокую среднюю скорость. Это означает, что он будет выходить из крошечного отверстия быстрее, чем другие газы. И наоборот, бром, который имеет наибольшую массу по сравнению с другими газами, будет выходить из отверстия медленнее.
Это соотношение математически представлено законом Грэма:
По мере увеличения массы скорость выпота уменьшается.
Сообщить об ошибке
Какой из следующих газов будет иметь самую высокую скорость выпота?
Возможные ответы:
Кислород
Гелий
Диоксид серы
азот
Диоксид углерода
Правильный ответ:
Helium
9008 . 0608
Пояснение:
0608
Пояснение:Скорость истечения газа обратно пропорциональна квадратному корню из его молекулярной массы (закон Грэма).
Газ с наименьшей молекулярной массой истечет быстрее.
Кислород:
Азот:
Двуокись углерода:
Двуокись серы:
Гелий:
Самый легкий и, следовательно, самый быстрый газ — гелий.
Сообщить об ошибке
Масса молекулы A в два раза больше массы молекулы B. Образец каждой молекулы помещается в отдельные одинаковые контейнеры. Какое соединение будет иметь более высокую скорость диффузии?
Возможные ответы:
Они будут иметь одинаковую скорость диффузии
Молекула А
Недостаточно информации для определения относительных скоростей диффузии
Молекула А будет иметь более высокую начальную скорость; обе молекулы достигли бы одинаковой конечной скорости Пояснение:
Согласно закону Грэма, скорость диффузии молекулы газа обратно пропорциональна квадратному корню из массы этой молекулы. Поскольку молекула В имеет меньшую массу, чем молекула А, она будет иметь более высокую скорость диффузии.
Поскольку молекула В имеет меньшую массу, чем молекула А, она будет иметь более высокую скорость диффузии.
Примечание: это также относится к определению скорости выпота.
Сообщить об ошибке
В контейнере (контейнер A) находится смесь неона и аргона. В сосуде одинаковое количество обоих газов. В контейнере создается небольшое отверстие, позволяющее газам выходить в пустой контейнер (контейнер B). Время выпота очень короткое, и отверстие в конечном итоге закупоривается, в результате чего в обоих контейнерах образуется смесь обоих газов.
Предположим, что после закрытия отверстия в контейнере B осталось 100 атомов аргона. Сколько примерно атомов неона, по вашему мнению, будет в контейнере B?
Возможные ответы:
Правильный ответ:
Объяснение:
Мы можем сравнить скорости истечения этих газов, используя следующее уравнение.
Назвав неон «газом 1», а аргон «газом 2», мы можем сравнить скорости истечения двух газов, подставив в уравнение их молекулярные массы.
Эта пропорция равна скорости истечения неона к скорости истечения аргона, что дает отношение атомов неона к атомам аргона в контейнере B.
отверстия на каждые 100 атомов аргона. Имейте в виду, что более тяжелый газ будет испаряться медленнее, чем более легкий; таким образом, мы ожидаем, что в контейнере B будет больше неона, чем аргона.
Сообщить об ошибке
Трубка длиной 20 см содержит два ватных шарика, по одному на каждом конце. Левый ватный тампон пропитан неразбавленной HCl. Правильный ватный тампон пропитан неразбавленным таинственным составом. Пары от двух ватных шариков смешиваются внутри трубки.
Предположим, что два соединения образуют осадок в пробирке в 6 см слева от правого ватного тампона. Какова молярная масса загадочного соединения?
Возможные ответы:
Правильный ответ:
Объяснение:
Этот вопрос особенно сложен, так как может быть не сразу понятно, какая концепция тестируется. По мере того, как пары соединений смешиваются и реагируют, мы можем установить расстояние, которое каждый пар прошел от ватного тампона до трубки за заданный промежуток времени. Длина трубки 20 см, а реакция происходит на расстоянии 6 см от ватного тампона. Отсюда мы можем установить, что за равное время пары HCl прошли 14 см, а загадочное соединение — 6 см.
По мере того, как пары соединений смешиваются и реагируют, мы можем установить расстояние, которое каждый пар прошел от ватного тампона до трубки за заданный промежуток времени. Длина трубки 20 см, а реакция происходит на расстоянии 6 см от ватного тампона. Отсюда мы можем установить, что за равное время пары HCl прошли 14 см, а загадочное соединение — 6 см.
Чтобы решить эту проблему, мы используем закон Грэма для сравнения молярных масс со скоростями диффузии двух газов.
Поскольку HCl переместилась на 14 см вправо перед взаимодействием с загадочным соединением, мы знаем, что таинственное соединение сместилось всего на 6 см влево. В результате коэффициент диффузии составляет 2,33.
Теперь нам нужно найти квадратный корень из обратных молярных масс, который равен этому коэффициенту диффузии.
Итак, молярная масса загадочного соединения составляет 198 граммов на моль. Это имеет смысл, потому что более крупные газы будут двигаться медленнее по сравнению с более легкими газами.
Сообщить об ошибке
Какой из следующих газов имеет самую высокую скорость выпота?
Возможные ответы:
Правильный ответ:
Пояснение:
Скорость истечения газа обратно пропорциональна квадратному корню из молекулярного веса газа.
Чем легче газ, тем быстрее он истечет; чем тяжелее газ, тем медленнее он будет выделяться.
Из всех вариантов гелий (He) имеет наименьшую молекулярную массу (в данном случае атомную массу), поэтому у него будет самая высокая скорость истечения.
Сообщить об ошибке
Молярная масса газа A в разы больше, чем у газа B. Какой из этих газов, как ожидается, будет выходить через маленькое отверстие быстрее? Насколько?
Возможные ответы:
Газ B истечет в раз быстрее газа A
Газ A истечет в раз быстрее газа B
Газ B истечет в раз быстрее газа A
Газ A истечет в раз быстрее газа B
Объяснение:
Чтобы ответить на этот вопрос, давайте начнем с рассмотрения того, что такое выпот и что на него влияет.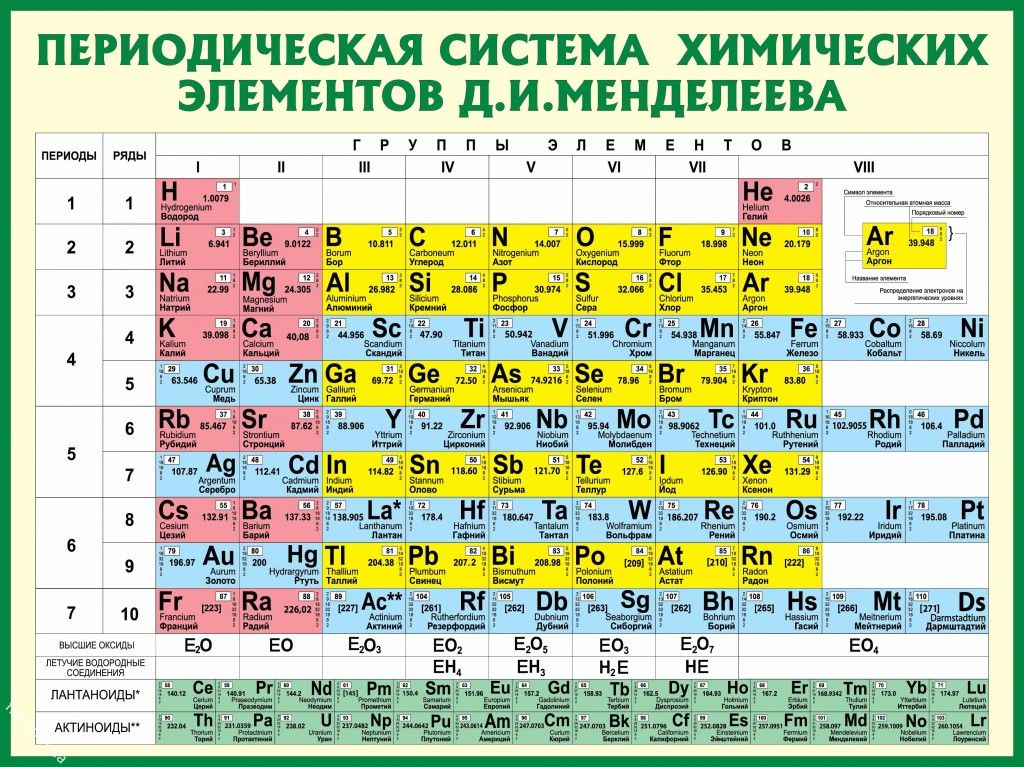 Выпот — это движение газа через крошечное отверстие, разделяющее два разных пространства. Поскольку частицы газа движутся в случайных направлениях со средней скоростью, которая зависит от температуры образца, более легкие частицы газа будут двигаться быстрее, чем более тяжелые частицы газа. Это связано с тем, что при данной температуре все частицы газа в образце будут иметь одинаковую среднюю кинетическую энергию. Следовательно, можно ожидать, что частицы газа с более высокой молекулярной массой будут испаряться медленнее, чем газы с более низкой молекулярной массой. Это означает, что газ B должен выделяться быстрее, чем газ A.
Выпот — это движение газа через крошечное отверстие, разделяющее два разных пространства. Поскольку частицы газа движутся в случайных направлениях со средней скоростью, которая зависит от температуры образца, более легкие частицы газа будут двигаться быстрее, чем более тяжелые частицы газа. Это связано с тем, что при данной температуре все частицы газа в образце будут иметь одинаковую среднюю кинетическую энергию. Следовательно, можно ожидать, что частицы газа с более высокой молекулярной массой будут испаряться медленнее, чем газы с более низкой молекулярной массой. Это означает, что газ B должен выделяться быстрее, чем газ A.
Следующим шагом является фактический расчет того, насколько больше выделяется газа B по сравнению с газом A. Для этого нам нужно использовать следующее уравнение: , мы можем подставить это в уравнение, чтобы найти отношение скорости истечения газа B к скорости истечения газа A.
Следовательно, газ B истечет в раз быстрее, чем газ A.
Сообщить об ошибке
Насколько быстрее / медленнее скорость выделения газообразного кислорода по сравнению с газообразным водородом?
Возможные ответы:
2 раза быстрее
2 раза медленнее
16 раза медленнее
4 раза медленнее
4 раза быстрее
Правильный ответ:
4 раза
. Объяснение:
Объяснение:
Скорость выпота:
и должны использоваться, поскольку они существуют в виде бимолекулярных молекул. Правильный ответ: газообразный кислород будет выделяться в 4 раза медленнее, чем газообразный водород.
Сообщить об ошибке
Уведомление об авторских правах
Все ресурсы AP Chemistry
6 Диагностические тесты 225 практических тестов Вопрос дня Карточки Learn by Concept
Быстрый способ определения молярной массы воздуха
- Воздух — что это такое?
- Как найти молярную массу воздуха?
- Как теоретически рассчитать молярную массу воздуха?
- Как применять эти формулы на практике?
- Какие газы есть в воздухе?
- Плотность воздуха
- Водяной пар
- Свойства воздуха
Воздух окружает нас каждый день, но мы его не замечаем, хотя и не можем без него жить. Для человека дыхание является рефлекторным. Мы не думаем о дыхании, и мы делаем это. Вы когда-нибудь задумывались, что вы знаете о воздухе? Если нет, то наша статья станет для вас дверью в мир химии. Вы узнаете, как найти молярную массу сухого воздуха, молекулярную массу воздуха, из чего состоит вещество и много интересных фактов. Если вам сложно справиться с заданием по химии, вы всегда можете получить нашу профессиональную помощь с домашним заданием.
Для человека дыхание является рефлекторным. Мы не думаем о дыхании, и мы делаем это. Вы когда-нибудь задумывались, что вы знаете о воздухе? Если нет, то наша статья станет для вас дверью в мир химии. Вы узнаете, как найти молярную массу сухого воздуха, молекулярную массу воздуха, из чего состоит вещество и много интересных фактов. Если вам сложно справиться с заданием по химии, вы всегда можете получить нашу профессиональную помощь с домашним заданием.
Воздух – что это такое?
Формула воздуха : поскольку воздух представляет собой смесь газов, формулы не существует.
Средняя молярная масса : 28,97 г/моль.
Молекулярная масса : молекулярные массы CO2, h3O и атомная масса кислорода составляют 44, 18 и 16 а.е.м.
Растворимость воздуха в воде: 29,18 см3/л
Как найти молярную массу воздуха?
Если вы впервые сталкиваетесь с такой задачей, есть два метода, которые вы можете использовать, чтобы правильно заполнить химическую бумагу. Рассмотрим первый — можно рассчитать молярную массу воздуха, сложив вес каждого газа. Используя уравнение идеального газа, вы можете определить молярную массу газа. При не слишком высоких давлениях, но достаточно высоких температурах газ можно считать идеальным. Уравнение Менделеева – Клапейрона описывает состояние такого газа:
Рассмотрим первый — можно рассчитать молярную массу воздуха, сложив вес каждого газа. Используя уравнение идеального газа, вы можете определить молярную массу газа. При не слишком высоких давлениях, но достаточно высоких температурах газ можно считать идеальным. Уравнение Менделеева – Клапейрона описывает состояние такого газа:
В этой формуле:
- P – давление газа;
- В – объем газа;
- m — масса газа;
- М — число молей газа;
- R = 8,3145 Дж/(моль∙К) – универсальная газовая постоянная;
- T – абсолютная температура газа.
Из первой формулы получаем выражение для молярной массы газа:
Следовательно, для расчета молярной массы воздуха необходимо знать массу газа – m, температуру – T , давление газа – Р и занимаемый им объем.
Если погрешности измерения P, V и T в любом опыте не превышают 1%, то определение массы газа представляет собой сложную задачу. Полное удаление газа из сосуда практически невозможно: даже при наличии самого лучшего современного инженерного инструментария.
Существует и другой способ определения М, при котором не нужно добиваться полного удаления газа из сосуда – достаточно незначительно изменить его массу. Пусть в сосуде объемом V находится газ массой m1 под давлением P1 и при температуре T. Уравнение состояния для этого газа примет вид:
Откачиваем часть газа из сосуда без изменения его температуры. После вакуумирования масса газа в сосуде и парциальные давления уменьшатся. Обозначим их соответственно m2, P2 и перепишем уравнение состояния:
Из уравнений получим:
Это выражение позволяет определить – М. Если изменение массы газ, давление, температура, объем известны.
В данной работе исследуемым газом является воздух, известный как смесь азота, кислорода, углекислого газа, аргона, паров воды и других газов. Вышеприведенная формула подходит и для определения М смеси газов. В этом случае найденное значение М представляет собой некоторую среднюю или эффективную молярную массу газовой смеси.
Как теоретически рассчитать молярную массу воздуха?
Молярную массу смеси газов (воздух) можно рассчитать теоретически. Этот метод удобен тем, что известно относительное содержание и молярная масса каждого из газов, входящих в смесь. Формула выглядит так:
В этой формуле:
- м1/м, м2/м – относительные доли содержания каждого газа;
- М1, М – молярные массы газов, входящих в смесь.
Как применять эти формулы на практике?
В домашнем задании по химии учителя дают расширенные данные, процентное содержание газа, атомный вес и различные коэффициенты. Поэтому, имея все данные, можно применять формулы. Возьмем пример:
Задача: Рассчитайте среднюю молярную массу воздуха следующего состава: 21% O2, 78% N2, 0,5% Ar и 0,5% CO2.
Решение: Поскольку объемы газов пропорциональны их количествам (закон Авогадро), средняя молярная масса смеси может быть выражена как через объемы, так и через количества веществ:
Mср = (M1 · V1 + M2 · V2 + M3 · V3 +) / (V1 + V2 + V3 + . ..) (1)
..) (1)
Mср = (M1 ν1 + M2 ν2 + M3 ν3 +) / (ν1 + ν2 + ν3 + …) (2)
Возьмем 1 моль воздуха, тогда v(O2) = 0,21 моль, v(N2) = 0,78 моль, v(Ar) = 0,005 моль и v (CO2) = 0,005 моль. Подставив эти значения в формулу, получим:
Mср (воздух) = (0,21 · 32 + 0,78 · 28 + 0,005 · 40 + 0,005 · 44) / (0,21 + 0,78 + 0,005 + 0,005) = 29 г/моль.
Вот почему в многочисленных вычислительных задачах, связанных с относительной плотностью газов в воздухе, средняя молярная масса воздуха всегда принимается равной 29г/моль.
Ответ: Mav (воздух) = 29 г/моль.
Какие газы находятся в воздухе?
Атмосферный воздух представляет собой смесь газов. Однако это не полное определение, и для его расширения обратимся к истории. В 1754 году шотландский физик и химик Джозеф Блэк при нагревании белой магнезии обнаружил выделение «связанного воздуха». Получив СО2, мистер Блэк сделал еще одно важное открытие — состав воздуха, который раньше считался одним веществом, неоднороден.
Джозеф Блэк указал путь другим ученым, которые один за другим стали все больше и больше расшифровывать состав атмосферы, рассчитывать содержание кислорода в воздухе и других газов. Сформировалось само определение, которое сегодня звучит так: воздух – это смесь газов, образующих атмосферу Земли. Основная функция воздуха — сделать планету пригодной для дыхания и существования живых организмов.
Газообразный азот занимает большую часть воздуха. Однако химический состав оставшейся части интересен и разнообразен. Вкратце список необходимых элементов таков:
- Кислород. Доля газообразного кислорода в воздухе колеблется в пределах 21% по объему и 23% по массе. Вместе с азотом эти два газа составляют 99% всего земного воздуха.
- Аргон. Аргон не имеет запаха, цвета и вкуса. Существенной биологической роли этого газа не выявлено, но он обладает наркотическим действием и даже считается допингом.
- Углекислый газ.
 Углекислый газ составляет атмосферу Венеры и Марса. Его процентное содержание в земном воздухе значительно ниже. В то же время в океане содержится значительное количество углекислого газа. В твердой форме углекислый газ является одним из самых известных хладагентов сухого льда.
Углекислый газ составляет атмосферу Венеры и Марса. Его процентное содержание в земном воздухе значительно ниже. В то же время в океане содержится значительное количество углекислого газа. В твердой форме углекислый газ является одним из самых известных хладагентов сухого льда. - Неон. Неон оказывает на человека наркотическое действие при определенном давлении, но это идеальный газ, используемый при обучении водолазов и других людей, работающих под полным давлением.
- Метан. Сегодня этот газ, добываемый и используемый в качестве топлива и сырья в производстве, не так широко распространен в атмосфере, но все же улетучивается с Земли.
- Гелий. Этот газ не относится к числу наиболее важных с точки зрения важности. Трудно определить биологическое значение этого газа.
- Криптон. Криптон — инертный газ, в три раза тяжелее воздуха, химически инертен, добывается из воздуха, используется в лампах накаливания, лазерах и до сих пор активно изучается.

- Hydroge н. Атомы водорода в воздухе занимают 0,00005 % по объему и 0,00008 % по массе, но при этом являются самыми распространенными элементами во Вселенной.
- Ксенон. В наше время без ксенона не обойтись: производство мощных и импульсных источников света, диагностика и анестезия в медицине, двигатели космических кораблей, ракетное топливо.
Плотность воздуха
Какова плотность воздуха? Плотность газа можно определить аналитически, разделив его массу на объем, который он занимает при данных условиях (давление воздуха, абсолютная температура и влажность). Также можно рассчитать его плотность, используя закон идеального газа: pV = nRT, где n — молекулы газа, R — газовая постоянная. Таким образом, необходимо знать абсолютное давление и температуру воздуха, его газовую постоянную и мольную долю. Это уравнение вычисляет плотность сухого воздуха.
Водяной пар
Из-за испарения воды с поверхности океана в воздухе всегда присутствует влажный воздух.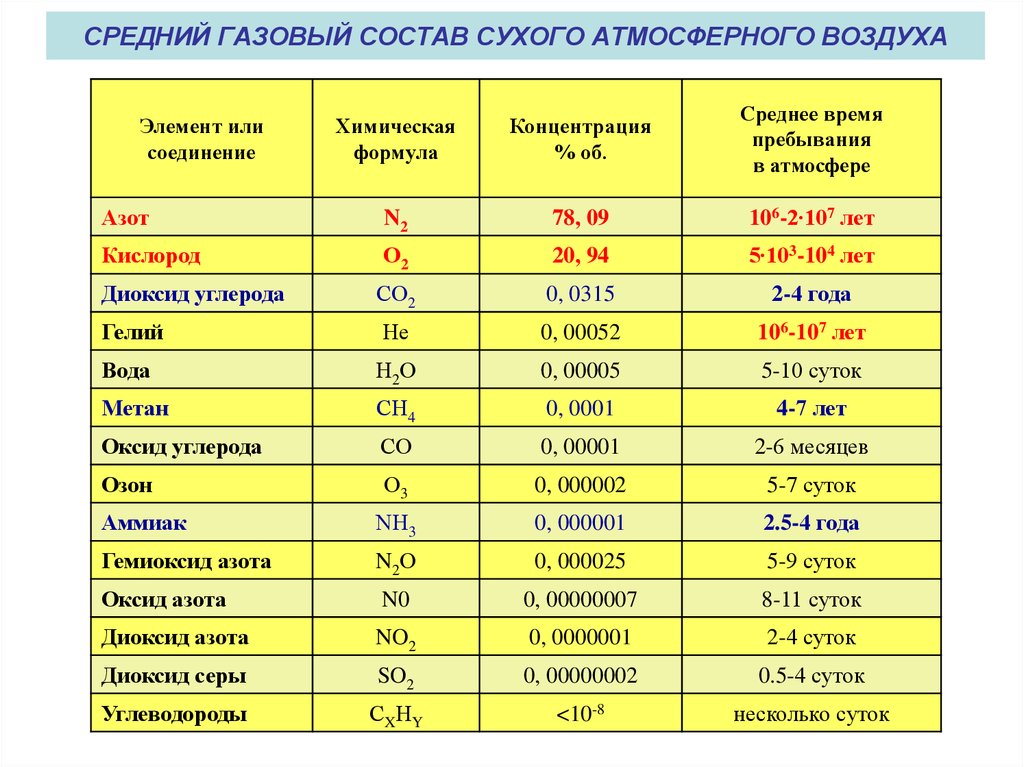 Количество влажного воздуха зависит от температуры воздуха, наличия и скорости ветра, характера рельефа, растительного покрова и цвета почвы.
Количество влажного воздуха зависит от температуры воздуха, наличия и скорости ветра, характера рельефа, растительного покрова и цвета почвы.
Согласно закону Дальтона, давление воздуха, содержащего водяной пар, равно сумме давления сухого воздуха и давления водяного пара. Атмосферное давление: Па = Pda + Pp.
О влажности воздуха можно судить либо по величине давления, создаваемого паром. Количество водяных паров, содержащихся в 1 м3 воздуха, называется абсолютной влажностью. Отношение плотности водяного пара при данной температуре к плотности насыщенного пара при той же температуре называется относительной влажностью.
Свойства воздуха
Воздух обладает многими свойствами, и вам нужно знать об этих:
- Воздух прозрачен, бесцветен, не имеет запаха и плохо проводит тепло.
- Воздух хорошо проводит солнечный свет.
- Воздух занимает место в окружающем мире.
- Воздух можно сжимать.
- Воздух эластичен.
- Воздух расширяется при нагревании; при охлаждении воздух сжимается.



 ru:
ru: 08.2013, 18:26
08.2013, 18:26  08.2013, 18:46
08.2013, 18:46  08.2013, 19:36
08.2013, 19:36 

 08.2013, 22:34
08.2013, 22:34 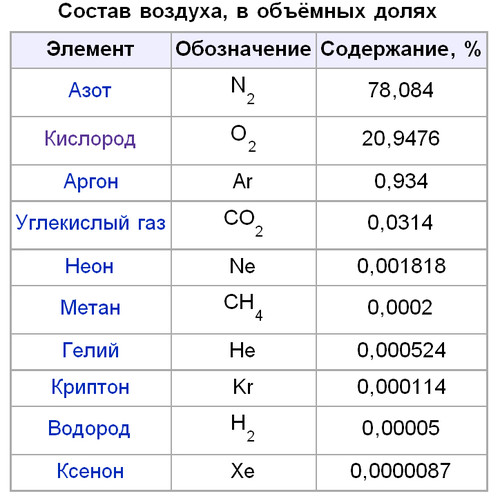 Поскольку моли считаются чисто формально по числу частиц, даже если это такие незначительные частицы, как электроны. Поэтому, та же масса ядра (40 а. е. м.) приходится уже на две частицы, и получается После повторной ионизации – на три: И так далее. Молярный объём, соответственно, тоже растёт ступеньками. Ступеньки не чёткие, поскольку ионизация с температурой происходит постепенно (для какой-то части атомов).
Поскольку моли считаются чисто формально по числу частиц, даже если это такие незначительные частицы, как электроны. Поэтому, та же масса ядра (40 а. е. м.) приходится уже на две частицы, и получается После повторной ионизации – на три: И так далее. Молярный объём, соответственно, тоже растёт ступеньками. Ступеньки не чёткие, поскольку ионизация с температурой происходит постепенно (для какой-то части атомов). 08.2013, 22:49
08.2013, 22:49  08.2013, 07:08
08.2013, 07:08 
 Углекислый газ составляет атмосферу Венеры и Марса. Его процентное содержание в земном воздухе значительно ниже. В то же время в океане содержится значительное количество углекислого газа. В твердой форме углекислый газ является одним из самых известных хладагентов сухого льда.
Углекислый газ составляет атмосферу Венеры и Марса. Его процентное содержание в земном воздухе значительно ниже. В то же время в океане содержится значительное количество углекислого газа. В твердой форме углекислый газ является одним из самых известных хладагентов сухого льда.