Молибден металл или неметалл: Молибден. Свойства, применение, марки. Соединения, сплавы молибдена
alexxlab | 18.07.1995 | 0 | Разное
Системы тугоплавкий металл – кремний » Все о металлургии
28.01.2015
Краткий анализ взаимодействия кремния с некоторыми тугоплавкими металлами, а именно с молибденом, вольфрамом и ниобием, на наш взгляд, необходим, так как силицирование является весьма перспективным методом резкого повышения их окалиностойкости.Силицирование молибдена и вольфрама уже приобрело важное техническое значение, для ниобия и тантала использование силицирования — дело ближайшего будущего.
Силициды молибдена. Из тугоплавких металлов, жаропрочность которых используется во многих областях авиационной, ракетной, металлургической, вакуумной, электронной техники, молибдену принадлежит ведущее место. Это объясняется сочетанием у него высоких технических свойств с довольно широкой (в сравнении с редкими металлами — ниобием, цирконием., танталом и т. п.) распространенностью в природе. Однако молибден не обладает высокой окалиностой-костью. В свете сказанного проблема повышения сопротивляемости поверхности молибдена окислению прежде всего путем химико-термической обработки приобретает первостепенное значение.
Диаграмма состояния Mo—Si приведена на рис. 10, а основные данные, характеризующие особенности кристаллического строения силицидов молибдена, — в табл. 2.
В ранних работах вместо силицида Mo5Si3 описывается силицид Mo3Si2, что, по всей вероятности, является следствием малого различия в весовом содержании кремния в указанных силицидах и их тугоплавкости. Второму силициду молибдена приписывались также две структурные модификации: W5Si3 и Mn5Si3. В более поздних работах полиморфизм этого соединения не подтвердился.
Дисилицид молибдена — фаза, обеспечивающая высокую окалиностойкость молибдена после силицирования, — является прототипом структурного типа, к которому принадлежит также высокостойкий дисилицид вольфрама. MoSi2 относится к группе структур с плотнейшими слоями из чередующихся атомов обоих компонентов и близок к структурным типам дисилицидов хрома и титана.
 Слои чередуются в порядке …АВАВ…, причем слой В смещен в направлении оси z на 1/2 периода а. Атом металла окружен восемью атомами кремния, атом кремния — четырьмя атомами металла, ячейка содержит две формульные единицы MoSi2.
Слои чередуются в порядке …АВАВ…, причем слой В смещен в направлении оси z на 1/2 периода а. Атом металла окружен восемью атомами кремния, атом кремния — четырьмя атомами металла, ячейка содержит две формульные единицы MoSi2.Дисилицид является наиболее устойчивой фазой в системе Mo—Si, плавится без разложения, по тугоплавкости не уступает первым двум силицидам, при высокотемпературном взаимодействии компонентов образуется в течение нескольких минут, в то время как для получения Mo5Si3, и особенно Mo3Si, даже в низкокремнистых сплавах нужны многочасовые выдержки.
Силициды вольфрама. Значительно превосходя по тугоплавкости (следовательно, и по жаропрочности) даже молибден и ниобий, вольфрам имеет столь же низкую окалиностойкость и не в меньшей степени, чем другие тугоплавкие металлы, нуждается в силицировании для повышения сопротивляемости окислению в газовых средах.
 Хром имеет четыре силицида, молибден — три, вольфрам — только два: дисилицид WSi2 и фазу, содержащую около 9 вес. % Si и имеющую состав W3Si2 или W5Si3. Необходимо, впрочем, отметить, что вследствие тугоплавкости низкокремнистых сплавов левая сторона системы W—Si исследована недостаточно. В ранних работах имелись, например, указания на существование фазы W3Si, образующейся при 1700 °C во время отжига силицированного слоя на вольфраме (первоначально при силицировании образовывался лишь наиболее термодинамически устойчивый дисилицид). Авторы приписывали фазе W3Si структуру типа Cr3Si (P—W), аналогичную по строению первым силицидам хрома и молибдена. Однако те же авторы в более поздней работе утверждают, что фазы W3Si в системе не существует, а первый силицид вольфрама W5Si3 плавится при 2300 °C инконгруэнтно.
Хром имеет четыре силицида, молибден — три, вольфрам — только два: дисилицид WSi2 и фазу, содержащую около 9 вес. % Si и имеющую состав W3Si2 или W5Si3. Необходимо, впрочем, отметить, что вследствие тугоплавкости низкокремнистых сплавов левая сторона системы W—Si исследована недостаточно. В ранних работах имелись, например, указания на существование фазы W3Si, образующейся при 1700 °C во время отжига силицированного слоя на вольфраме (первоначально при силицировании образовывался лишь наиболее термодинамически устойчивый дисилицид). Авторы приписывали фазе W3Si структуру типа Cr3Si (P—W), аналогичную по строению первым силицидам хрома и молибдена. Однако те же авторы в более поздней работе утверждают, что фазы W3Si в системе не существует, а первый силицид вольфрама W5Si3 плавится при 2300 °C инконгруэнтно.Диаграмма состояния W—Si представлена на рис. 11. Электронное строение и физические свойства фаз структурного типа MoSi2 рассматриваются в работе. Дисилициды вольфрама и молибдена обладают металлической проводимостью.
Кристаллоструктурная характеристика силицидов вольфрама дана в табл. 3.
В работе со ссылкой на данные 1957 г. для первого силицида вольфрама указывается также структурный тип Mn5Si3, однако данных об условиях проявления полиморфизма этой фазы не приведено. Поскольку в других литературных источниках для W5Si3 указывается лишь его собственный структурный тип, следует, по-видимому, считать, что первый силицид вольфрама структурных изменений при нагреве не претерпевает.
Молибден и вольфрам имеют силициды, ни один из которых (в том числе и низкокремнистые) не изоструктурен силицидам железа. В то же время растворимость названнных элементов в феррите весьма велика. Это позволяет утверждать, что при силицировании легированной стали вольфрам и молибден должны ускорять рост слоя кремнистого феррита, но замедлять образование слоев силицидов железа, поскольку выделение последних сопровождалось бы значительным диффузионным перераспределением легирующих элементов, по-видимому, практически нерастворимых в силицидах железа, образующих наружную область слоя.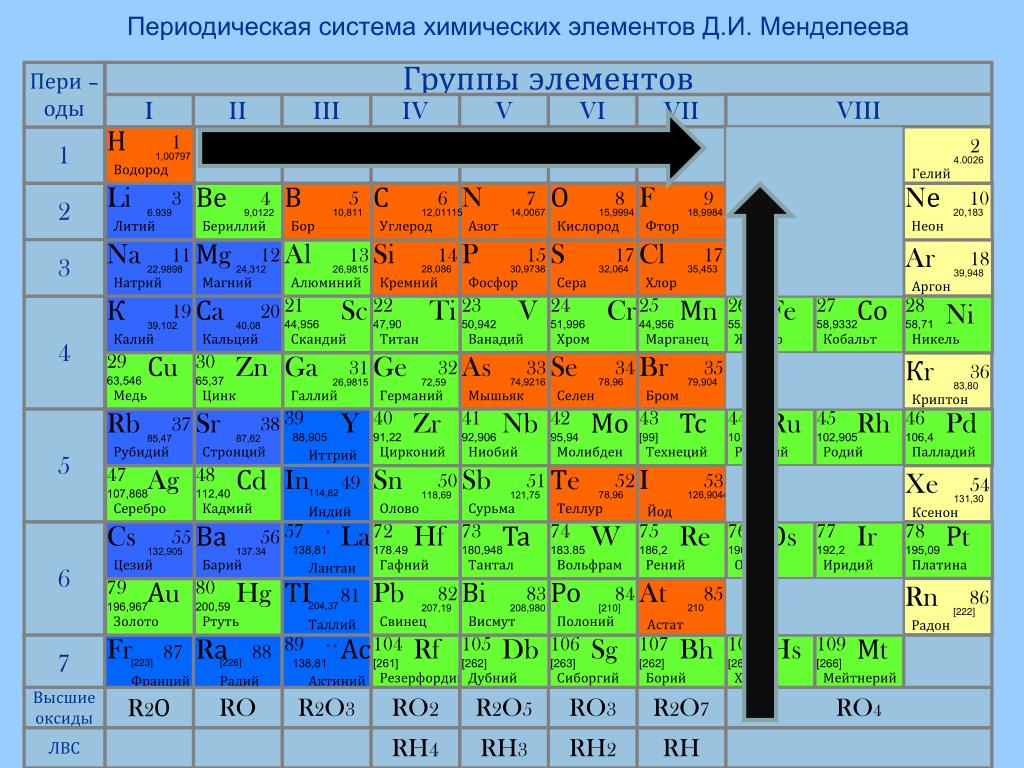
Силициды ниобия. Система ниобий—кремний, как и многие другие силицидные системы, хорошо изучена в области высоких содержаний кремния и значительно слабее в низкокремнистой области. Ниобийкремниевые сплавы дают типичную диаграмму состояния с тремя устойчивыми соединениями: Nb4Si, Nb5Si3 и NbSi2 (рис. 12).
Первый силицид ниобия принадлежит к мало распространенной группе силицидов со стехиометрией MeSi0,25 и, по современным данным, относится к структурному типу Fe3N (федоровская группа D6в6—С632) гексагональной сингонии. Металлическая подрешетка этой фазы представляет плотнейшую гексагональную упаковку, из шести имеющихся в ячейке октаэдрических пустот одна или две (в различных ячейках) заняты атомами кремния, причем расположение их в пустотах является упорядоченным. Ячейка содержит две формульные единицы силицида. Nb4Si относится, таким образом, к группе силицидов с изолированными атомами кремния, однако периоды его решетки (а = 3,59 A, с = 4,46 А, с/а = 1,24) не вполне удовлетворяют условию плотнейшей шаровой упаковки для ниобия, так как эффективный диаметр атома Nb для координационного числа 12 составляет менее ЗА.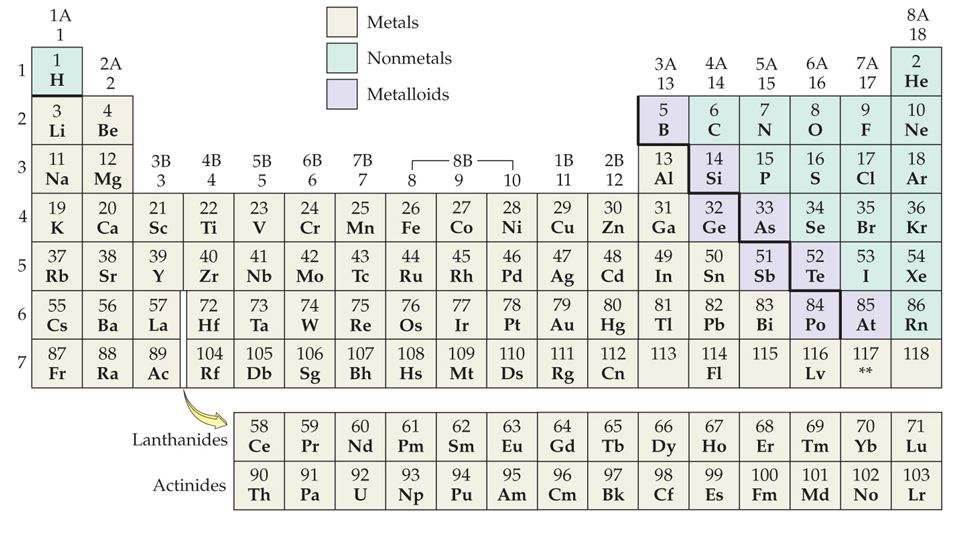
Второй силицид ниобия, как установлено Г. В. Самсоновым с сотрудниками, обладает полиморфизмом: кристаллизуясь при температуре несколько выше 2500 °С, он при 2000 °C претерпевает фазовый переход в твердом состоянии (табл. 4).
Структурный тип Cr5B3 по расположению атомов весьма близок к типу W5Si3: обе структуры принадлежат к одной федоровской группе, и фазовый переход не. требует значительных перемещений атомов (менее чем на один атомный диаметр металла). Ячейка структурного типа третьего борида хрома содержит четыре формульные единицы, атомы неметалла занимают «призматические» поры при расположении шести ближайших атомов металла в вершинах тригональной призмы. При правильном «призматическом» расположении атомов число пор должно быть равно общему числу атомов в вершинах призм, иначе говоря, число атомов металла и неметалла в ячейке должно быть одинаково.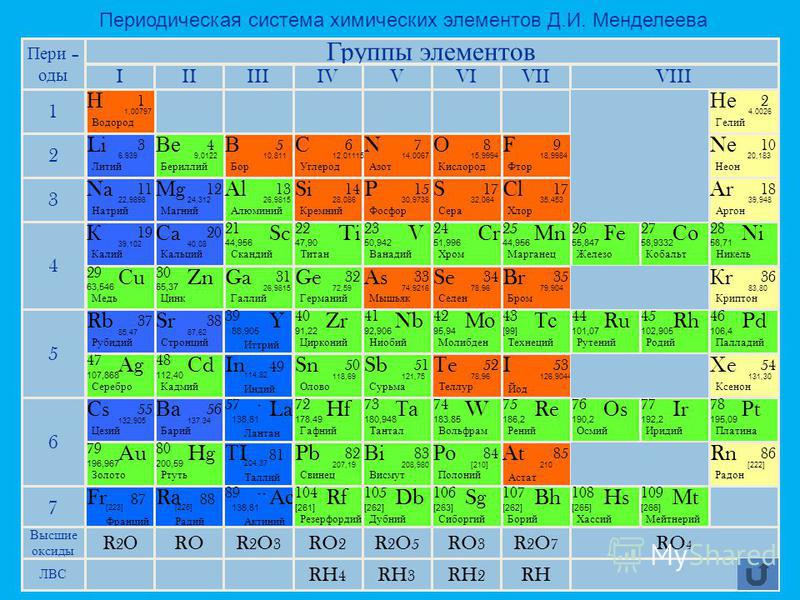
Структурный тип WsSi3, к которому принадлежит фаза β-Nb5Si3, описан ранее. Дисилицид ниобия (NbSi2) принадлежит к структурному типу CrSi2. Структура построена из плотноупакованных гексагональных слоев, в слое атом ниобия окружен шестью атомами кремния, атом кремния — тремя атомами ниобия. Слои одинаковой упаковки чередуются через три так, что над и под каждым атомом кремния находятся атомы ниобия и наоборот. Атом ниобия окружен 6+4 (шесть в слое и по два в выше- и нижележащих слоях) атомами кремния, атом кремния — 2+4 атомами ниобия.

Взаимодействие кремния с другими тугоплавкими металлами (Cr, W, Hf, Ta, Re) не рассматривается в связи с ограниченным объемом монографии. Это, на наш взгляд, оправдано следующими соображениями:
1) объем промышленного производства и использования гафния, рения, и тантала заметно уступает производству и использованию молибдена, вольфрама и ниобия;
2) силицирование хрома и ванадия значительно менее перспективно, чем остальных тугоплавких металлов.
По указанным выше причинам не рассматривается в настоящей главе и взаимодействие кремния с медью, никелем, кобальтом, титаном и цирконием. Данные по силицированию этих металлов весьма ограничены и не вышли в настоящее время за рамки лабораторных исследований.
В заключение следует коротко остановиться на тройных диаграммах состояния Fe—Л.
 Э.—Si (где Л. Э. — легирующий элемент: С, Mn, Cr, Ni, Mo, Ti и т. д.).
Э.—Si (где Л. Э. — легирующий элемент: С, Mn, Cr, Ni, Mo, Ti и т. д.).Имеющиеся к настоящему времени литературные данные, а также исследования авторов свидетельствуют о том, что легирование железокремнистых сплавов углеродом, хромом, никелем, молибденом, марганцем и т. д. в обычно принятых для сталей количествах не вносит радикальных изменений в кинетику формирования и фазовый состав диффузионных слоев. Эти изменения носят скорее количественный, чем качественный характер и будут рассмотрены ниже. Поэтому тройные системы Fe-JI. Э.—Si также в настоящей главе не описываются.
Весьма низкая растворимость углерода в силицидах железа и кремнистом феррите должна привести к перераспределению углерода в процессе формирования силицированного слоя и вытеснению его в подслойную, переходную зону.
 По этой же причине графитизация углерода в силицированном слое, по всей вероятности, исключена, а образование в слое железокремнистого карбида как в процессе насыщения, так и при охлаждении с различными скоростями маловероятно.
По этой же причине графитизация углерода в силицированном слое, по всей вероятности, исключена, а образование в слое железокремнистого карбида как в процессе насыщения, так и при охлаждении с различными скоростями маловероятно.Однако его образование не исключено в переходной зоне средне- и высокоуглеродистых сталей. Образование железокремнистого карбида в переходной зоне силицированного слоя не может оказать сколько-нибудь существенного влияния на свойства силицированных сталей.
Наконец, при анализе влияния углерода на строение и скорость формирования силицированного слоя необходимо учитывать их взаимное влияние на растворимость и скорость диффузии в аустените.
- Система железо – кремний
- Силициды переходных металлов
- Кремний
- Поведение сверхпластичного сплава при циклическом деформировании
- Железохромоникелевые сплавы со структурой «микродуплекс»
- Формирование изделий из листов сверхпластичных мелкозернистых сплавов
- Современное состояние практического применения сверхпластичности
- Теория диффузионного течения мелкозернистых материалов с неньютоновской вязкостью
- Роль границ зерен в процессе роста трещин
- Межзеренное разрушение
Тяжелые металлы и их влияние на организм
О масштабном загрязнении окружающей среды вредными и токсичными веществами сейчас знают все. Ведь ни для кого не секрет, что атмосфера промышленных городов загрязнена выбросами тяжелых металлов. Они присутствуют в воздухе, которым мы дышим, в воде, которую пьем, в почве, где аккумулируются корнями растений и попадают в круговорот веществ в природе. Именно поэтому токсичные вещества можно найти во всем, что нас окружает: в продуктах питания, в косметических средствах, предметах интерьера и т.д.
Ведь ни для кого не секрет, что атмосфера промышленных городов загрязнена выбросами тяжелых металлов. Они присутствуют в воздухе, которым мы дышим, в воде, которую пьем, в почве, где аккумулируются корнями растений и попадают в круговорот веществ в природе. Именно поэтому токсичные вещества можно найти во всем, что нас окружает: в продуктах питания, в косметических средствах, предметах интерьера и т.д.
А все ли металлы опасны?
Такие металлы, как железо, медь, цинк, молибден, в малых количествах играют физиологическую роль: участвуют в биологических процессах и являются необходимыми для правильного функционирования растений, животных и человека. Они участвуют в процессе фотосинтеза и усвоения растениями азота, способствует синтезу сахара, белков, крахмала, витаминов.
В чем заключается токсичность?
Тяжёлые металлы и их соединения оказывают токсическое воздействие на организм человека, вызывая ряд заболеваний. Некоторые металлы могут долго накапливаться в определенных органах и тканях.
Кадмий
Избыточное поступление кадмия в организм может приводить к анемии, поражению печени, нарушению функции легких, остеопорозу, деформации скелета, развитию гипертонии. Он накапливается в почках, может служить причиной образования в них камней.
Свинец
Свинец, наряду с мышьяком, кадмием, ртутью, относится к классу высокоопасных веществ. Свинец накапливается в костях, вызывая их постепенное разрушение, аккумулируется в печени и почках, может вызывать снижение работоспособности, ухудшение памяти и даже хронические заболевания мозга.
Ртуть
Ртуть оказывает токсическое воздействие на центральную нервную систему, вызывает тахикардию и приводит к эмоциональной неустойчивости, нарушению памяти, бессоннице, апатии и т.д. Человек постоянно чувствует усталость, быстро утомляется, становится рассеян и раздражителен. Его постоянно преследуют головные боли.
Что делать?
Поскольку развитие промышленности не стоит на месте, количество выбросов загрязнений в окружающую среду растёт, влияние экологии на здоровье человека на сегодняшний день составляет 25–50% от совокупности всех воздействующих факторов. Поэтому с уверенностью можно сказать, что жители мегаполисов в большей степени подвержены негативному воздействию окружающей среды. Именно для этого во все наши программы включена расширенная check-up диагностика, в рамках которой можно определить степень содержания тяжелых металлов в организме (14 металлов и 20 минералов). Основываясь на результатах диагностики можно определить:
Поэтому с уверенностью можно сказать, что жители мегаполисов в большей степени подвержены негативному воздействию окружающей среды. Именно для этого во все наши программы включена расширенная check-up диагностика, в рамках которой можно определить степень содержания тяжелых металлов в организме (14 металлов и 20 минералов). Основываясь на результатах диагностики можно определить:
- общую степень интоксикации организма тяжёлыми металлами, способность их элиминации из организма;
- количественное соотношение минерального баланса (20 минералов), наличие дефицита или избытка тех или иных минералов;
- степень окислительной агрессии и кислотности организма, его анти-оксидативный статус.
- степень предрасположенности к сахарному диабету, аллергиям, провести оценку регенеративного потенциала.
Необходимо уделить особое внимание питанию и естественной детоксикации организма. Один из самых эффективных способов – прием лечебной воды “Donat Mg” в рамках наших программ. Состав воды уникален по содержанию электрически-активного ионного магния (Mg++), количество которого превышает 1000мг/л. Прием курса рекомендуется после консультации с врачом.
Состав воды уникален по содержанию электрически-активного ионного магния (Mg++), количество которого превышает 1000мг/л. Прием курса рекомендуется после консультации с врачом.
Курорт Рогашка Слатина и лечебная вода «Donat Mg» широко известны в Европе с начала 19 века. Сюда приезжают со всех концов света, чтобы окунуться в атмосферу умиротворения и спокойствия, царящие в таком удивительно месте. Живописный ландшафт, единение с природой, медицинский центр с минеральным источником, комфортабельный отель с безукоризненным сервисом, разнообразие досуга и многое другое позволят вам зарядиться энергией, поправить здоровье, восстановить силы и просто отдохнуть вдали от шумного и загрязненного мегаполиса.
Посмотреть все статьи рубрики “Новости и статьи”
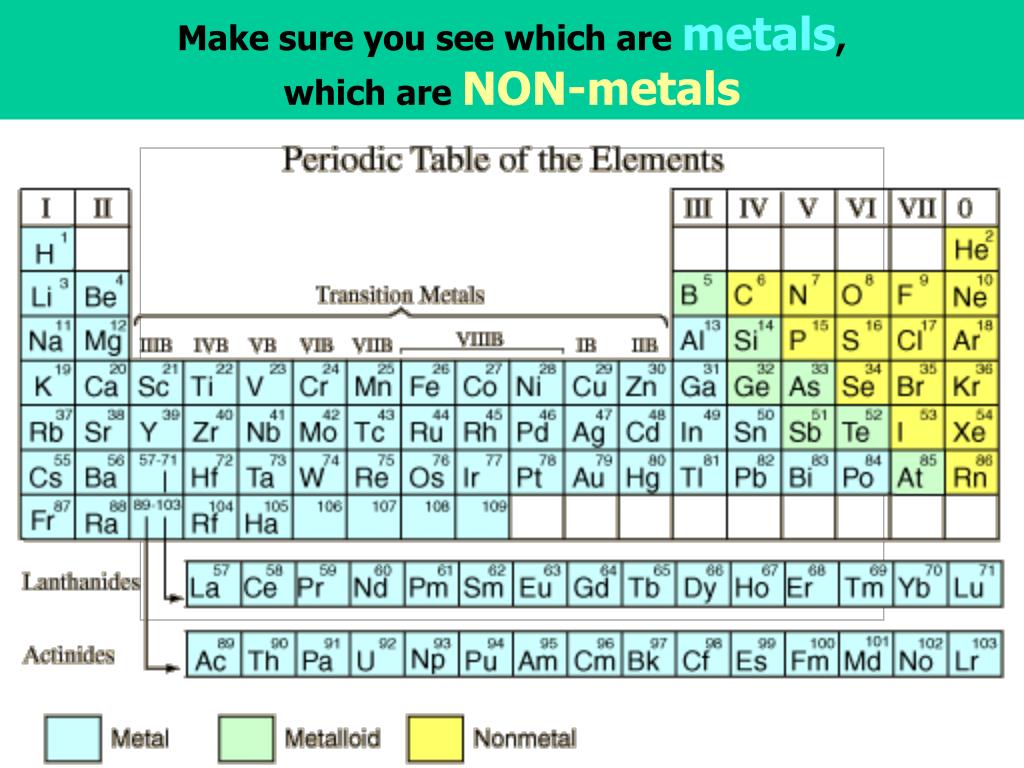
Металл, Символ, Свойства, Источники, Использование
Что такое молибден?
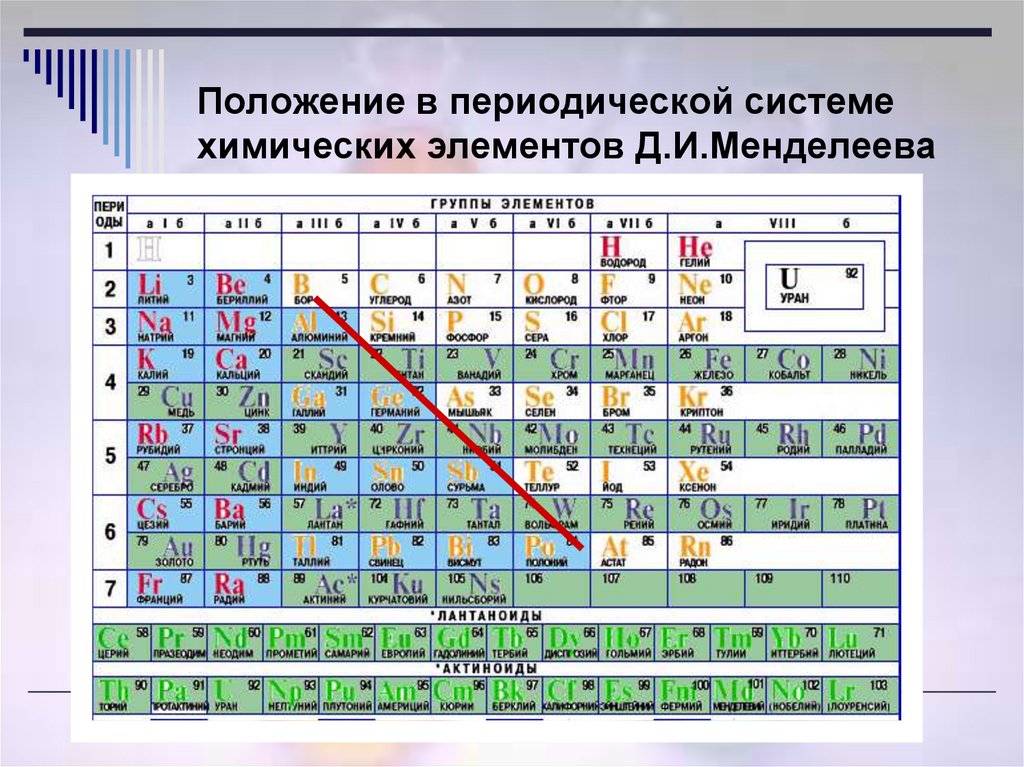
Молибден это химический элемент или прочный и серебристый переходный металл группы 6 (VIB) периодической таблицы с символом Mo и атомным номером 42. Он используется в основном для изготовления нержавеющей стали и легированной стали для высокоскоростных инструментов. .
Он используется в основном для изготовления нержавеющей стали и легированной стали для высокоскоростных инструментов. .
Название молибден происходит от греческого слова molybdos, означающего свинец. Это элемент второй серии переходов, в котором все d-электроны участвуют в металлической связи. Это элемент d-блока, помещенный в периодическую таблицу вместе с хромом и вольфрамом.
Кто открыл молибден?
Мягкий черный молибденит (MoS 2 ) является основной рудой молибдена, использовавшейся в старину для письма. Он был похож на свинцовую руду (галенит или PbS) и графит.
Впервые минерал был изучен в 1754 г. шведским минералогом А. Кронштедтом. Вслед за ним в 1778 году шведский химик Карл Вильгельм Шееле заметил, что это не галенит и не графит. Он получил оксид металлического молибдена.
Чистый металл был получен Берцелиусом в 1817 г. путем восстановления оксида водородом. Название металла происходит от греческого слова molybdos, означающего свинец.
Свойства молибдена
Атомный номер Мо 42 и электронная конфигурация валентной оболочки [Kr] 4d 5 5s 1 . Форма металла обычно представляет собой металлическую объемно-центрированную кубическую кристаллическую решетку. Он твердый и относительно нереакционноспособный из-за защитной поверхностной пленки оксида.
Наиболее распространенная степень окисления или состояние металлического молибдена +6 (VI). Степени окисления V и IV также стабильны. Сильные восстановительные свойства металлического молибдена не встречались до III и II состояний.
| Свойства молибдена | |||
| Атомный номер | 42 | ||
| Электрон на оболочку | 2, 8, 18, 13, 1 | ||
| Электронная конфигурация | [Кр] 4d 5 5s 1 | ||
| Блок | крестовина | ||
| Период | период 5 | ||
| Группа | группа 6 | ||
| Атомный вес | 95,94 | ||
| Температура плавления | 2896 К (2623 °С, 4753 °F) | ||
| Температура кипения | 4912 К (4639 °С, 8382 °F) | ||
| Кристаллическая структура | |||
| Плотность | 10,28 г/см 3 | ||
| Молярная теплоемкость | 24,06 Дж моль -1 К -1 | ||
| Удельное электрическое сопротивление | 53,40 нОм·м | ||
| Атомный радиус | 139 вечера | ||
| Ковалентный радиус | 154 ± 17:00 | ||
| Химические свойства | |||
| Общая степень окисления | +6 | ||
| Электроотрицательность | Шкала Полинга: 2,16 | ||
| Энергия ионизации (кДж/моль) | 1-й | 2-й | 3-й |
| 684,3 | 1560 | 2618 | |
Источник молибдена
Металлический молибден и вольфрам очень мало содержатся в земной атмосфере. Это 54-й по распространенности элемент в земной коре с содержанием 1,5 частей на миллион.
Это 54-й по распространенности элемент в земной коре с содержанием 1,5 частей на миллион.
Наиболее важной рудой Мо является молибденит (MoS 2 ). Встречается в основном в Колорадо (США), Канаде и Чили. Другими минералами металлического Мо являются вульфениты (PbMoO 4 ) и молибдит (МоО 3 ).
Продукты, содержащие молибден
Он также содержится в продовольственном зерне, овощах и продуктах животного происхождения. Самым богатым источником молибдена являются бобовые, цельнозерновые, орехи, молоко и говяжья печень. Это единственный элемент или металл второго переходного ряда, обладающий естественными биологическими функциями.
Молоко, сыр и яйца являются основными источниками металлического молибдена для детей, мальчиков и девочек-подростков. Наша ежедневная питьевая вода также содержит некоторое количество металлического молибдена.
Изотопы молибдена
Молибден имеет 35 известных изотопов с атомной массой от 83 до 113. Он имеет семь встречающихся в природе изотопов с атомной массой 92, 94, 95, 96, 97, 98 и 100.
Он имеет семь встречающихся в природе изотопов с атомной массой 92, 94, 95, 96, 97, 98 и 100.
Радиоактивные изотопы металла получают различными типами ядерных реакций. 93 Мо — самый стабильный радиоизотоп металла с периодом полураспада 4000 лет.
Производственный процесс
- Молибденит концентрировали пенной флотацией и обжигали до MoO 3 .
- Во-первых, он восстанавливается до MoO 2 при нагревании с водородом при 500 °C.
- На втором этапе MoO 2 восстанавливают водородом при 1100 °C с получением металла.
- Чистый металлический молибден получают восстановлением водородом молибдата аммония. Восстановление углерода MoO 3 дает в основном карбиды.
Ферромолибден получают восстановлением молибденита железом и коксом в электрической печи. Его также получают восстановлением смеси оксидов Мо и Fe алюминием (термитная реакция).
Металл имеет очень высокую температуру плавления и первоначально получается в виде порошка молибдена. Он переходит в массивное состояние при сжатии под водородом при высоких температурах.
Он переходит в массивное состояние при сжатии под водородом при высоких температурах.
Химические соединения
Химический состав переходных металлов молибдена и вольфрама очень похож. Металлы слабо подвергаются воздействию слабых кислот и оснований. Оба они растворяются в смеси азотной кислоты с фтористым водородом и в расплавленных щелочах. Оксидные соединения являются кислотными, но соли, полученные из кислот, представляют собой сложные полианионы.
Обычная и стабильная степень окисления этих металлов +6 (VI). Степени окисления V и IV также стабильны. Сильные восстановительные свойства молибдена не наблюдаются до III и II состояний. В состоянии VI металл образует оксиды, оксокислоты, гексафториды и гексахлориды.
Оксид молибдена
Молибден образует шестивалентный оксид, подобный MoO 3 . Его осаждают из молибдатов щелочных металлов добавлением кислот. Осажденный H 2 MoO 4 может воспламеняться с образованием оксидов.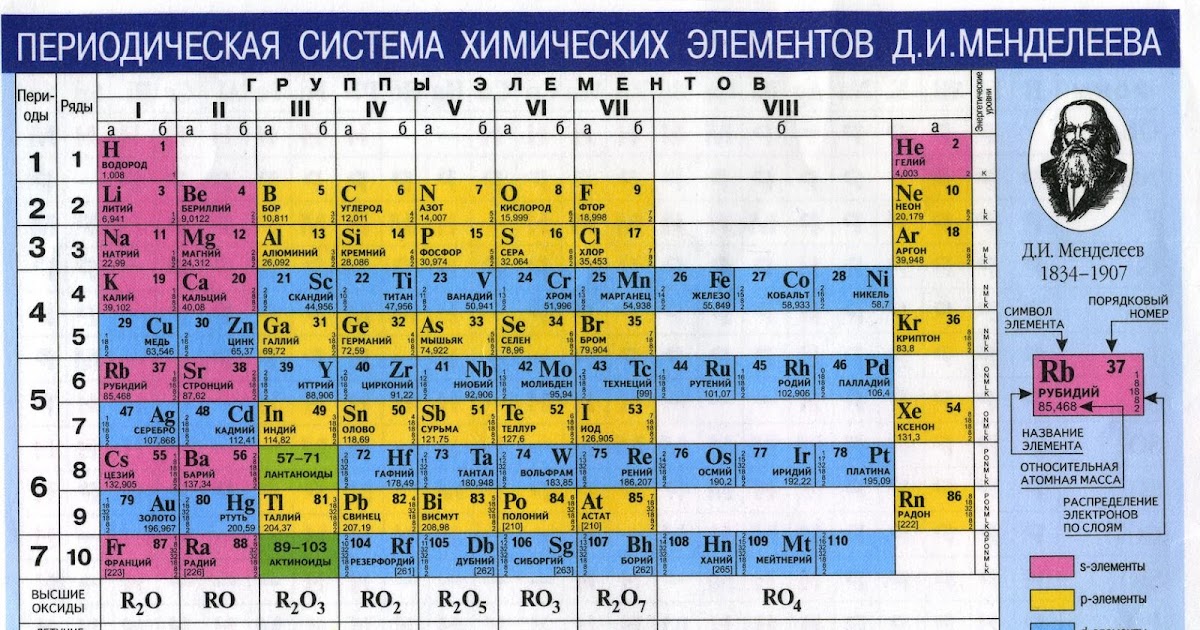 Оксид также может быть получен прокаливанием металла в воздухе или кислороде.
Оксид также может быть получен прокаливанием металла в воздухе или кислороде.
Все оксиды являются кислотными и растворяются в щелочи с образованием молибдатов. Оксид CrO 3 обладает сильным окислительным действием. Оксиды типа MoO 2 и WO 2 не обладают окисляющими свойствами.
Низший оксид MoO 2 получен восстановлением триоксида водородом. Кислотная природа оксида уменьшается с уменьшением степени окисления.
Галогениды молибдена
Галогениды молибдена с высокой степенью окисления, как ожидается, имеют ковалентную природу. Следовательно, MoF 6 является низкокипящим, неэлектролитным, диамагнитным и чрезвычайно растворимым для гидролиза. MoCl 5 является мономером в парообразном состоянии, но мостиковым димером в кристаллическом состоянии. Низшие галогениды представляют собой очень сложные структуры.
Высшие галогениды получают прямым галогенированием металла. Низшие галогениды получают восстановлением высших галогенидов металлом или водородом при оптимальной температуре и давлении.
Комплексы молибдена
Образует мономерные анионы МО 4 −2 в щелочной среде. При подкислении анионы полимеризуются с образованием поликислот. Они образуют комплекс, подобный диоксомолибдену (VI).
Пятивалентные комплексы в основном относятся к оксомолибденовому или ди-μ-оксодимолибденовому типу. Некоторыми распространенными примерами комплексов Mo (IV) являются [MoCl 5 O] -2 , [Mo(acac) 2 ClO] -2 и т. Д. Четырехвалентные комплексы бывают как оксо, так и неоксо типами.
В более низкой степени окисления молибден образует кластерные соединения Mo 6 X 12 (где X = хлор, бром и йод). В соединениях этого типа шесть атомов Мо образуют соединения кластерного типа, такие как (МоХ 8 ) +4 X 4 – . Цианокомплекс может быть получен восстановлением комплекса Мо(IV). Имеет пентагональную бипирамидальную структуру.
Использование молибдена
- Основное потребление молибдена используется в производстве нержавеющей стали и других типов стали, используемых в высокоскоростных инструментах.
 Оксид МоО 3 и ферромолибден непосредственно используются для этой цели.
Оксид МоО 3 и ферромолибден непосредственно используются для этой цели. - Молибден повышает механическую прочность, электрическую проводимость и коррозионную стойкость стали. Поэтому сталь Ni-Mo используется для изготовления стволов орудий и гребных валов. Сталь Cr-Mo используется для изготовления самолетов.
- Чистый металлический молибден используется для обработки сырой нефти газообразным водородом. Металл и водород превращают серосодержащие органические соединения в H 2 S. Металлический молибден
- используется в качестве химического катализатора. Соединение MoS 2 имеет слой кристаллической решетки и используется для изготовления высокотемпературных смазок.
Биологическая функция молибдена
Это единственный элемент или металл второго переходного ряда, обладающий естественными биологическими функциями. Известно, что более тридцати микроорганизмов, растений и животных содержат этот металл.
Фермент фиксации азота нитрогеназы содержат характерный полиметаллический кластер с железо-молибденовым кофактором. Другие функционирующие ферменты, такие как оксидаза, редуктаза и дегидрогеназа, имеют различные типы кофакторов металлического молибдена.
Другие функционирующие ферменты, такие как оксидаза, редуктаза и дегидрогеназа, имеют различные типы кофакторов металлического молибдена.
Молибден | Materials Hub
- Description
- Select CategoryAlloysCeramicsCompositesCompoundsGlassGreenMetalsNanoPolymersSemi-MetalsTop Materials
- Select Tag0.2% Proof stengthAbrasion ResistantAcousticActuatorsAerospaceAestheticAge hardenableAircraft bulkheadsAircraft componentsalloyed with platinum and iridiumAluminumAmmunitionAmorphousand lustrousand Magnesiumand Magnesium.Anti-corrosion Chrome-plating; изготовление нержавеющей стали; TanningAnti-inflammatoryAntimicrobialAttacked by oxygen and by water vapour at elevatedAutomotive/tubular grids in battery industryBacteriostaticBiocompatibleBiodegradableBoltsBreaker switch/fuseBrittleBulletproofBurns easilyburns easily when ignited.Castablecatalystcatalytic converters designed to clean vehicle emissionsCathode ray tubesCenterless ground rodsChemical ResistanceChemical resistantChemical StabilityChemically StableCircuit breaker terminalsCircuit breakersClampscoating optic fibersCombustion cansCommutator barsCompositesComputersConcentrated solar powerConductiveContactsControl resistorsCorrosion сопротивлениеКоррозионностойкийСтойкий к коррозииЭкономичныйСопротивление ползучестиОпасно для здоровья человекаДеоксидантыДекоративныеПлотныеДетекторыДиафрагмыСтабильность размеровДискиРастворяется как в разбавленных, так и в концентрированных кислотахМедленно растворяется в разбавленных минеральных кислотахНе легко реагирует на кислородПластичныйпластичныйНизкая температура плавленияДолговечныйДинамическийЛегко поддается обработкеЛегко формоватьЛегко к fabricateEasy to join and installEasy to machineElasticElastic solidElectric motors in cordless toolsElectrical ConductiveElectrical conductivityElectrical connectorselectrical contact materialElectrical elements in both industrial and domestic applicationsElectrical insulationElectrical InsulatorElectrical resistanceElectrical resistantElectrical switchesElectrical transformersElectrically conductiveElectrically resistantElectricity resistantElectro and Thermal ConductiveElectroconductiveElectronic and optical propertiesElectronic tubes (powerElectroresistantElectrosinsulatingEnergy harvestersEnhances high-temperature oxidation resistanceEnvironmental resistanceExcellent machinabilityExpansion управлениеСопротивление усталостиПредставленныйФерромагнитныйФильтрацияМелкозернистая структураОгнезамедлительОгнеупорныйОгнестойкийНегорючийОгнезащитный Поглотитель с низким содержанием влагиогнеопасныйFlatwireГибкостьГибкийПоковкиСтабильность формыФормуемыйПлавкийГаллий легко связывается с большинством металловГазовая турбина ponentsХорошая коррозионная стойкостьХорошая стойкость к кислородуХорошая конструкционная прочностьХорошая износостойкостьЗначительно улучшенная физическаяЗеленый материалЖесткие дискиЖесткие дискиТвердый термопластТвердостьТермостойкостьЖаростойкийТеплопередачаТеплообработкаОборудование для термообработкиНагревательные элементыНагревательные элементы как в бытовых, так и в промышленных приборахСверхмощные печи для термообработкиВысокотемпературные характеристикиГерметическое уплотнениеТрубы HHS®Высокая температура кипенияВысокая химическая реактивностьВысокая коррозионная стойкостьВысокая коррозионная стойкостьВысокая плотностьВысокая плотность пластичностьВысокая электрическаяВысокая электрическая и теплопроводностьВысокое удельное электрическое сопротивлениеВысокое поглощение энергииВысокая усталостная прочностьВысокая текучестьВысокая ударная вязкостьВысокие магнитные свойстваВысокая температура плавленияВысокая передача влагиВысокая производительностьВысокая пористостьПроволока высокой чистотыВысокое преломлениеВысокая прочностьВысокая прочность на разрывВысокая термостойкостьВысокая температурная стабильностьВысокая термостойкостьВысокая прочность на растяжениеВысокая теплопроводностьВысокая h поглощение тепловых нейтроновВысоковольтные линии электропередач и автоматические выключателиОчень красочные и разнообразные степени окисленияЛегковоспламеняющиесяСильно изолирующиеИнструменты для горячей обработкиГибридные кожухи цепейГидрофильныеГидрофобныеГипераллергенныеУдаропрочныеНепроницаемыеУлучшенные тепловые характеристикиПри контакте с водойИнертныеНедорогиеГорючиеНерастворимыеИзоляторРаздражающиеПовышает прочность полезных для здоровья сплавов металлов, таких как хром, вступает в реакцию с образованием гидроксида печиЛазерные соплаЛазерыСвинцовые рамыБез свинцаЛегкийЛегкийЛегкийОблицовка резервуаров.
 Жидкость при комнатной температуре или близкой к нейНагрузочный подшипникДолгий срок службыДолгий срок службы при высоких температурахНизкая стоимостьНизкая плотностьНизкая электропроводностьНизкое трениеНизкая термостойкостьНизкое техническое обслуживаниеНизкая температура плавленияНизкая проводимость металлаНизкое влагопоглощениеНизкая пористостьНизкая пористостьНизкая реактивность и низкая токсичностьНизкая относительная летучесть при большом объемеНизкая температураНизкая термостойкостьНизкая ermal resistanceLow ToxicityLow Water AbsorbingLustrousMachinableMagneticMagnetic fastenersMagnetic permabilityMagnetic SheildingMagnetron bodies and coolersMaintenance FreeMaleableMalleableMan madeMeasuring and positioning devicesmechanical and electrical propertiesMechanical assemblyMicrofluidic devicesMicroscale electromagnetsMicroscale electronicsMicrowave componentsMIG/MAG welding contact tipsMinimises wasteMinimum distortionMoldableMotorsMould and lay up tools for compositesMould resistantNatural resistance to corrosionnegligible porosityNon ReactiveNon toxicNon-ConductiveNon-FlammableNon-magneticNon -смачиваниеБез запахаOLEDOНепрозрачныйОптическая прозрачностьОптическое волокноКорпуса осцилляторовСтойкий к окислениюПроницаемый пигменты и красители; Блестящие поверхностные покрытияВыводыТрубы и оболочки силовых кабелейЭлектроды и сопла для плазменной резкиГибкиеПММАТочныеТочное и равномерное тепловое расширениеТочностьТочные лопатки конденсаторовПроизводство бумажной массыПроизводство транзисторов и диодов в электронной промышленностиЗащитныеПрототипыРадиальные стержни для роторов генераторовРадиальные стержни для роторов генераторов.
Жидкость при комнатной температуре или близкой к нейНагрузочный подшипникДолгий срок службыДолгий срок службы при высоких температурахНизкая стоимостьНизкая плотностьНизкая электропроводностьНизкое трениеНизкая термостойкостьНизкое техническое обслуживаниеНизкая температура плавленияНизкая проводимость металлаНизкое влагопоглощениеНизкая пористостьНизкая пористостьНизкая реактивность и низкая токсичностьНизкая относительная летучесть при большом объемеНизкая температураНизкая термостойкостьНизкая ermal resistanceLow ToxicityLow Water AbsorbingLustrousMachinableMagneticMagnetic fastenersMagnetic permabilityMagnetic SheildingMagnetron bodies and coolersMaintenance FreeMaleableMalleableMan madeMeasuring and positioning devicesmechanical and electrical propertiesMechanical assemblyMicrofluidic devicesMicroscale electromagnetsMicroscale electronicsMicrowave componentsMIG/MAG welding contact tipsMinimises wasteMinimum distortionMoldableMotorsMould and lay up tools for compositesMould resistantNatural resistance to corrosionnegligible porosityNon ReactiveNon toxicNon-ConductiveNon-FlammableNon-magneticNon -смачиваниеБез запахаOLEDOНепрозрачныйОптическая прозрачностьОптическое волокноКорпуса осцилляторовСтойкий к окислениюПроницаемый пигменты и красители; Блестящие поверхностные покрытияВыводыТрубы и оболочки силовых кабелейЭлектроды и сопла для плазменной резкиГибкиеПММАТочныеТочное и равномерное тепловое расширениеТочностьТочные лопатки конденсаторовПроизводство бумажной массыПроизводство транзисторов и диодов в электронной промышленностиЗащитныеПрототипыРадиальные стержни для роторов генераторовРадиальные стержни для роторов генераторов. с водой и воздухомРеагирует на сильные кислотыРеагирует с водой и воздухомлегко окисляетсяПерерабатываемыйПригодный для повторного использованияОтражающийОгнеупорныйАрмирующийОтносительно стабильный на воздухеОтносительно стабильный на воздухе и очень нестабильный при разделенииДетали релеУпругийСтойкий к высокотемпературной коррозииСтойкий к окислениюПриводит к меньшему количеству отходов при использованииСохраняет механические свойства до 950 FСтопорные кольцаРетросветоотражающиеУкрашения с родиевым покрытием.Кольцевая секцияНаучные приборыПолупроводниковые базыПолупроводникиДатчикиПамять формыФасонная проволокаОболочка электронагревательных элементовУдаропрочностьУдаропрочнаяСущественно повышает стойкость к высокотемпературному окислениюсеребристо-металлическийсеребристо-белый металлПроволока SLT®Мелкая бытовая техникаГладкаяРазъемные разъемыМягкая, достаточно мягкая, чтобы ее можно было разрезать ножомМягкая серебристая и плотнаяСолнечные элементыПайка и сварка tipsSound absorbingSphericalSpot welding electrodesSpring contactsSpringsStabilityStability against alkalis acids and salt waterStableSteam-generator tubingSterileStickyStrand and cablesStrengthStress resistantStribgStringStrongStructuralStructurally stableStub bases for power transmissionStudsSuited for high stresses in applicationsSuperconductiveSwitch blade jawsSwitch gear partsTarget foils for nuclear physicsTarnishes in air and reacts with waterTarnishes in moist airTechnicalTemperature ResistantTemperature sens itiveTemperature StabilityTensile StrengthThermal conductiveThermal conductivityThermal InsulatorThermal resistantThermal Shock ResistanceThermal shock resistantThermal stabilityThermally stableThermoconductivethermocouple elements and headlight reflectors.
с водой и воздухомРеагирует на сильные кислотыРеагирует с водой и воздухомлегко окисляетсяПерерабатываемыйПригодный для повторного использованияОтражающийОгнеупорныйАрмирующийОтносительно стабильный на воздухеОтносительно стабильный на воздухе и очень нестабильный при разделенииДетали релеУпругийСтойкий к высокотемпературной коррозииСтойкий к окислениюПриводит к меньшему количеству отходов при использованииСохраняет механические свойства до 950 FСтопорные кольцаРетросветоотражающиеУкрашения с родиевым покрытием.Кольцевая секцияНаучные приборыПолупроводниковые базыПолупроводникиДатчикиПамять формыФасонная проволокаОболочка электронагревательных элементовУдаропрочностьУдаропрочнаяСущественно повышает стойкость к высокотемпературному окислениюсеребристо-металлическийсеребристо-белый металлПроволока SLT®Мелкая бытовая техникаГладкаяРазъемные разъемыМягкая, достаточно мягкая, чтобы ее можно было разрезать ножомМягкая серебристая и плотнаяСолнечные элементыПайка и сварка tipsSound absorbingSphericalSpot welding electrodesSpring contactsSpringsStabilityStability against alkalis acids and salt waterStableSteam-generator tubingSterileStickyStrand and cablesStrengthStress resistantStribgStringStrongStructuralStructurally stableStub bases for power transmissionStudsSuited for high stresses in applicationsSuperconductiveSwitch blade jawsSwitch gear partsTarget foils for nuclear physicsTarnishes in air and reacts with waterTarnishes in moist airTechnicalTemperature ResistantTemperature sens itiveTemperature StabilityTensile StrengthThermal conductiveThermal conductivityThermal InsulatorThermal resistantThermal Shock ResistanceThermal shock resistantThermal stabilityThermally stableThermoconductivethermocouple elements and headlight reflectors. Thermocouple sheathsThermostatsToughToxicTransistor basesTransition ductsTranslucentTransparentTurbine bladesUsed for coatings on other metalsUV ResistantUV StabilityVacuum systems in chemistry and scientific researchVersatileVery DenseVery high melting pointVibration dampersWaste reductionWater insoluableWater resistantWaterproofWear ResistanceWear resistantWeather ResistanceWeather resistantWelded and brazed сотовые панелиРаботоспособныйX-Ray)
Thermocouple sheathsThermostatsToughToxicTransistor basesTransition ductsTranslucentTransparentTurbine bladesUsed for coatings on other metalsUV ResistantUV StabilityVacuum systems in chemistry and scientific researchVersatileVery DenseVery high melting pointVibration dampersWaste reductionWater insoluableWater resistantWaterproofWear ResistanceWear resistantWeather ResistanceWeather resistantWelded and brazed сотовые панелиРаботоспособныйX-Ray)
Вернуться домой
Шееле открыл молибден в 1778 году. Молибден представляет собой серебристо-белый металл, пластичный и очень устойчивый к коррозии. Он имеет одну из самых высоких температур плавления среди всех чистых элементов — только элементы тантал и вольфрам имеют более высокие температуры плавления. Из-за очень высокой температуры плавления он производится и продается в виде серого порошка. При прессовании порошка под очень высоким давлением образуется много изделий из молибдена. Молибден также мягче и пластичнее вольфрама. Его часто путали с графитом и свинцовой рудой. Молибден считается микроэлементом, необходимым для жизни.
Молибден также мягче и пластичнее вольфрама. Его часто путали с графитом и свинцовой рудой. Молибден считается микроэлементом, необходимым для жизни.
Основной молибденовой рудой является молибденит, но его также можно найти в вульфените и повеллите. Его получают как побочный продукт добычи меди или вольфрама. Молибден добывается в основном в США, Китае, Чили и Перу.
Как переходный металл молибден легко образует соединения с другими элементами. Молибден является ценным легирующим агентом, поскольку он способствует прокаливаемости и ударной вязкости закаленных сталей. Он также повышает прочность стали при высоких температурах. Немецкое артиллерийское орудие времен Второй мировой войны под названием «Большая Берта» содержит молибден в качестве основного компонента своей стали.
Он используется в некоторых сплавах на основе никеля, таких как Hastelloys(R), которые являются термостойкими и коррозионно-стойкими к химическим растворам. Молибден окисляется при повышенных температурах и при контакте с кислотой медленно подвергается коррозии.
Этот металл недавно нашел применение в качестве электродов для электрообогреваемых стекловаренных печей и шахт. Металл также используется в ядерной энергетике и для деталей ракет и самолетов. Молибден ценен как катализатор при переработке нефти. Он нашел применение в качестве материала накала в электронных и электрических приложениях. Порошки молибдена используются в печатных красках для печатных плат, а также в микроволновых устройствах и радиаторах для твердотельных устройств.
Молибден является важным микроэлементом в питании растений. Без молибдена в почве некоторые земли становятся бесплодными. Сульфид молибдена используется в качестве смазки, особенно при высоких температурах, когда масла разлагаются. Однако, как и в случае с другими микроэлементами, то, что необходимо в крошечных количествах, может быть высокотоксичным в больших дозах. Эксперименты на животных показали, что слишком много молибдена вызывает деформации плода.
Свойства
Маркировка продукта
Ковкий
Тэг продукта
Высокая точка плавления
Тэг продукта
Токсичные
Доступные формы
Доступные формы: 2Different Forms Доступны
Applications
- Alloys
- Petroleum Industry 29
- в основе
- Индустрия нефтяной 9
- в основе
- .



 Оксид МоО 3 и ферромолибден непосредственно используются для этой цели.
Оксид МоО 3 и ферромолибден непосредственно используются для этой цели. Жидкость при комнатной температуре или близкой к нейНагрузочный подшипникДолгий срок службыДолгий срок службы при высоких температурахНизкая стоимостьНизкая плотностьНизкая электропроводностьНизкое трениеНизкая термостойкостьНизкое техническое обслуживаниеНизкая температура плавленияНизкая проводимость металлаНизкое влагопоглощениеНизкая пористостьНизкая пористостьНизкая реактивность и низкая токсичностьНизкая относительная летучесть при большом объемеНизкая температураНизкая термостойкостьНизкая ermal resistanceLow ToxicityLow Water AbsorbingLustrousMachinableMagneticMagnetic fastenersMagnetic permabilityMagnetic SheildingMagnetron bodies and coolersMaintenance FreeMaleableMalleableMan madeMeasuring and positioning devicesmechanical and electrical propertiesMechanical assemblyMicrofluidic devicesMicroscale electromagnetsMicroscale electronicsMicrowave componentsMIG/MAG welding contact tipsMinimises wasteMinimum distortionMoldableMotorsMould and lay up tools for compositesMould resistantNatural resistance to corrosionnegligible porosityNon ReactiveNon toxicNon-ConductiveNon-FlammableNon-magneticNon -смачиваниеБез запахаOLEDOНепрозрачныйОптическая прозрачностьОптическое волокноКорпуса осцилляторовСтойкий к окислениюПроницаемый пигменты и красители; Блестящие поверхностные покрытияВыводыТрубы и оболочки силовых кабелейЭлектроды и сопла для плазменной резкиГибкиеПММАТочныеТочное и равномерное тепловое расширениеТочностьТочные лопатки конденсаторовПроизводство бумажной массыПроизводство транзисторов и диодов в электронной промышленностиЗащитныеПрототипыРадиальные стержни для роторов генераторовРадиальные стержни для роторов генераторов.
Жидкость при комнатной температуре или близкой к нейНагрузочный подшипникДолгий срок службыДолгий срок службы при высоких температурахНизкая стоимостьНизкая плотностьНизкая электропроводностьНизкое трениеНизкая термостойкостьНизкое техническое обслуживаниеНизкая температура плавленияНизкая проводимость металлаНизкое влагопоглощениеНизкая пористостьНизкая пористостьНизкая реактивность и низкая токсичностьНизкая относительная летучесть при большом объемеНизкая температураНизкая термостойкостьНизкая ermal resistanceLow ToxicityLow Water AbsorbingLustrousMachinableMagneticMagnetic fastenersMagnetic permabilityMagnetic SheildingMagnetron bodies and coolersMaintenance FreeMaleableMalleableMan madeMeasuring and positioning devicesmechanical and electrical propertiesMechanical assemblyMicrofluidic devicesMicroscale electromagnetsMicroscale electronicsMicrowave componentsMIG/MAG welding contact tipsMinimises wasteMinimum distortionMoldableMotorsMould and lay up tools for compositesMould resistantNatural resistance to corrosionnegligible porosityNon ReactiveNon toxicNon-ConductiveNon-FlammableNon-magneticNon -смачиваниеБез запахаOLEDOНепрозрачныйОптическая прозрачностьОптическое волокноКорпуса осцилляторовСтойкий к окислениюПроницаемый пигменты и красители; Блестящие поверхностные покрытияВыводыТрубы и оболочки силовых кабелейЭлектроды и сопла для плазменной резкиГибкиеПММАТочныеТочное и равномерное тепловое расширениеТочностьТочные лопатки конденсаторовПроизводство бумажной массыПроизводство транзисторов и диодов в электронной промышленностиЗащитныеПрототипыРадиальные стержни для роторов генераторовРадиальные стержни для роторов генераторов. с водой и воздухомРеагирует на сильные кислотыРеагирует с водой и воздухомлегко окисляетсяПерерабатываемыйПригодный для повторного использованияОтражающийОгнеупорныйАрмирующийОтносительно стабильный на воздухеОтносительно стабильный на воздухе и очень нестабильный при разделенииДетали релеУпругийСтойкий к высокотемпературной коррозииСтойкий к окислениюПриводит к меньшему количеству отходов при использованииСохраняет механические свойства до 950 FСтопорные кольцаРетросветоотражающиеУкрашения с родиевым покрытием.Кольцевая секцияНаучные приборыПолупроводниковые базыПолупроводникиДатчикиПамять формыФасонная проволокаОболочка электронагревательных элементовУдаропрочностьУдаропрочнаяСущественно повышает стойкость к высокотемпературному окислениюсеребристо-металлическийсеребристо-белый металлПроволока SLT®Мелкая бытовая техникаГладкаяРазъемные разъемыМягкая, достаточно мягкая, чтобы ее можно было разрезать ножомМягкая серебристая и плотнаяСолнечные элементыПайка и сварка tipsSound absorbingSphericalSpot welding electrodesSpring contactsSpringsStabilityStability against alkalis acids and salt waterStableSteam-generator tubingSterileStickyStrand and cablesStrengthStress resistantStribgStringStrongStructuralStructurally stableStub bases for power transmissionStudsSuited for high stresses in applicationsSuperconductiveSwitch blade jawsSwitch gear partsTarget foils for nuclear physicsTarnishes in air and reacts with waterTarnishes in moist airTechnicalTemperature ResistantTemperature sens itiveTemperature StabilityTensile StrengthThermal conductiveThermal conductivityThermal InsulatorThermal resistantThermal Shock ResistanceThermal shock resistantThermal stabilityThermally stableThermoconductivethermocouple elements and headlight reflectors.
с водой и воздухомРеагирует на сильные кислотыРеагирует с водой и воздухомлегко окисляетсяПерерабатываемыйПригодный для повторного использованияОтражающийОгнеупорныйАрмирующийОтносительно стабильный на воздухеОтносительно стабильный на воздухе и очень нестабильный при разделенииДетали релеУпругийСтойкий к высокотемпературной коррозииСтойкий к окислениюПриводит к меньшему количеству отходов при использованииСохраняет механические свойства до 950 FСтопорные кольцаРетросветоотражающиеУкрашения с родиевым покрытием.Кольцевая секцияНаучные приборыПолупроводниковые базыПолупроводникиДатчикиПамять формыФасонная проволокаОболочка электронагревательных элементовУдаропрочностьУдаропрочнаяСущественно повышает стойкость к высокотемпературному окислениюсеребристо-металлическийсеребристо-белый металлПроволока SLT®Мелкая бытовая техникаГладкаяРазъемные разъемыМягкая, достаточно мягкая, чтобы ее можно было разрезать ножомМягкая серебристая и плотнаяСолнечные элементыПайка и сварка tipsSound absorbingSphericalSpot welding electrodesSpring contactsSpringsStabilityStability against alkalis acids and salt waterStableSteam-generator tubingSterileStickyStrand and cablesStrengthStress resistantStribgStringStrongStructuralStructurally stableStub bases for power transmissionStudsSuited for high stresses in applicationsSuperconductiveSwitch blade jawsSwitch gear partsTarget foils for nuclear physicsTarnishes in air and reacts with waterTarnishes in moist airTechnicalTemperature ResistantTemperature sens itiveTemperature StabilityTensile StrengthThermal conductiveThermal conductivityThermal InsulatorThermal resistantThermal Shock ResistanceThermal shock resistantThermal stabilityThermally stableThermoconductivethermocouple elements and headlight reflectors.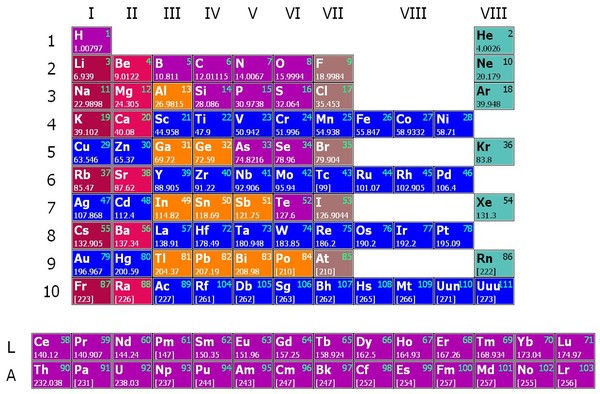 Thermocouple sheathsThermostatsToughToxicTransistor basesTransition ductsTranslucentTransparentTurbine bladesUsed for coatings on other metalsUV ResistantUV StabilityVacuum systems in chemistry and scientific researchVersatileVery DenseVery high melting pointVibration dampersWaste reductionWater insoluableWater resistantWaterproofWear ResistanceWear resistantWeather ResistanceWeather resistantWelded and brazed сотовые панелиРаботоспособныйX-Ray)
Thermocouple sheathsThermostatsToughToxicTransistor basesTransition ductsTranslucentTransparentTurbine bladesUsed for coatings on other metalsUV ResistantUV StabilityVacuum systems in chemistry and scientific researchVersatileVery DenseVery high melting pointVibration dampersWaste reductionWater insoluableWater resistantWaterproofWear ResistanceWear resistantWeather ResistanceWeather resistantWelded and brazed сотовые панелиРаботоспособныйX-Ray)