Ниобий электронное строение: Таблица менделеева – Электронный учебник K-tree
alexxlab | 05.05.2023 | 0 | Разное
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.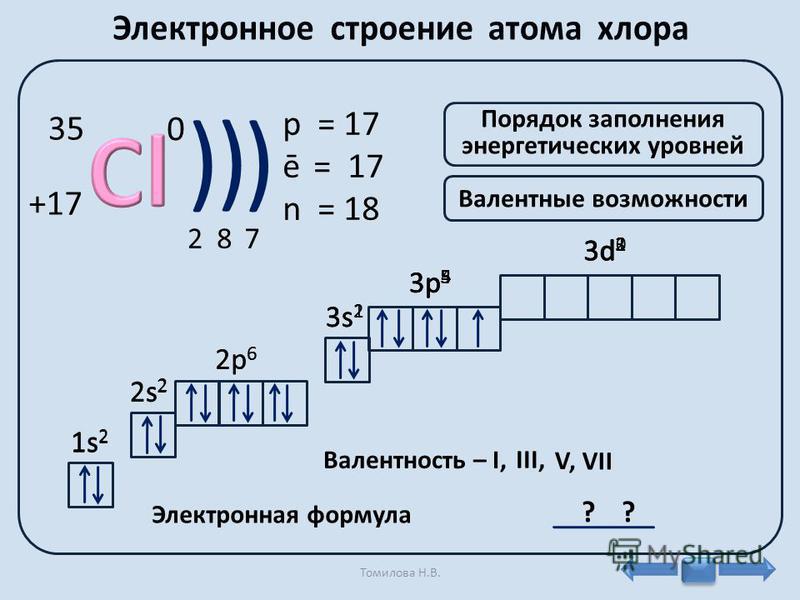
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
Общая химия
Общая химия
ОглавлениеВВЕДЕНИЕГлава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ 4. Закон сохранения массы. 5. Основное содержание атомно-молекулярного учения. 6. Простое вещество и химический элемент. 8. Закон объемных отношений. 9. Атомные и молекулярные массы. Моль. 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии. 11. Парциальное давление газа. 12. Эквивалент. Закон эквивалентов. 13. Определение атомных масс. Валентность. 14. Химическая символика. 15. Важнейшие классы и номенклатура неорганических веществ. 16. Химические расчеты. Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА 17. Периодический закон Д. И. Менделеева. 18. Периодическая система элементов. 19. Значение периодической системы.  Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА 20. Радиоктивность. 21. Ядерная модель атома. 22. Атомные спектры. 23. Квантовая теория света. 24. Строение электронной оболочки атома по Бору. 25. Исходные представления квантовой механики. 26. Волновая функция. 27. Энергетическое состояние электрона в атоме. 29. Орбитальное квантовое число. Формы электронных облаков. 30. Магнитное и спиновое квантовые числа. 31. Многоэлектронные атомы. 32. Принцип Паули. Электронная структура атомов и периодическая система элементов. 33. Размеры атомов и ионов. 34. Энергия ионизации и сродство к электрону. 35. Строение атомных ядер. Изотопы. 36. Радиоактивные элементы и их распад. 37. Искусственная радиоктивность. Ядерные реакции. Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ 38. Теория химического строения. 39. Ковалентная связь. Метод валентных связей. 40. Неполярная и полярная ковалентная связь. 41. Способы образования ковалентной связи.  42. Направленность ковалентной связи. 43. Гибридизация атомных электронных орбиталей. 44. Многоцентровые связи. 46. Ионная связь. 47. Водородная связь. Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ 48. Межмолекулярное взаимодействие. 49. Кристаллическое состояние вещества. 50. Внутреннее строение кристаллов. 51. Реальные кристаллы. 52. Аморфное состояние вещества. 53. Жидкости. Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ 54. Превращения энергии при химических реакциях. 55. Термохимия. 56. Термохимические расчеты. 57. Скорость химической реакции. 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ. 60. Катализ. 61. Скорость реакции в гетерогенных системах. 62. Цепные реакции. 63. Необратимые и обратимые реакции. Химическое равновесие. 64. Смещение химического равновесия. Принцип Ле Шателье. 65. Факторы, определяющие направление протекания химических реакций.  66. Термодинамические величины. Внутренняя энергия и энтальпия. 67. Термодинамические величины. Энтропия и энергия Гиббса. 68. Стандартные термодинамические величины. Химико-термодинамические расчеты. Глава VII. ВОДА, РАСТВОРЫ 69. Вода в природе. 70. Физические свойства воды. 71. Диаграмма состояния воды. 72. Химические свойства воды. 73. Характеристика растворов. Процесс растворения. 74. Способы выражения состава растворов. 75. Гидраты и кристаллогидраты. 76. Растворимость. 77. Пересыщенные растворы. 78. Осмос. 79. Давление пара растворов. 80. Замерзание и кипение растворов. Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ 81. Особенности растворов солей, кислот и оснований. 82. Теория электролитической диссоциации. 83. Процесс диссоциации. 84. Степень диссоциации. Сила электролитов. 85. Константа диссоциации. 86. Сильные электролиты. 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.  88. Ионно-молекулярные уравнения. 89. Произведение растворимости. 90. Диссоциация воды. Водородный показатель. 91. Смещение ионных равновесий. 92. Гидролиз солей. Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ 93. Окисленность элементов. 94. Окислительно-восстановительные реакции. 95. Составление уравнений окислительно-восстановительных реакций. 96. Важнейшие окислители и восстановители. 97. Окислительно-восстановительная двойственность. 98. Химические источники электрической энергии. 99. Электродные потенциалы. 100. Ряд напряжений металлов. 101. Электролиз. 102. Законы электролиза. 103. Электролиз в промышленности. 104. Электрохимическая поляризация. Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ 105. Дисперсное состояние вещества. 106. Состояние вещества на границе раздела фаз. 107. Коллоиды и коллоидные растворы. 108. Дисперсионный анализ. 109. Сорбция и сорбционные процессы.  110. Ионообменная адсорбция. 111. Хроматография. 112. Электрокинетические явления. 113. Устойчивость и коагуляция дисперсных систем. 114. Структурообразование в дисперсных системах. Глава XI. ВОДОРОД 115. Водород в природе. Получение водорода. 116. Свойства и применение водорода. 117. Пероксид водорода Глава XII. ГАЛОГЕНЫ 118. Галогены в природе. Физические свойства галогенов. 119. Химические свойства галогенов. 120. Получение и применение галогенов. 121. Соединения галогенов с водородом. 122. Кислородсодержащие соединения галогенов. Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ 124. Получение и свойства кислорода. 125. Озон. 126. Сера в природе. Получение серы. 127. Свойства и применение серы. 128. Сероводород. Сульфиды. 129. Диоксид серы. Сернистая кислота. 130. Триоксид серы. Серная кислота. 131. Получение и применение серной кислоты. 132. Пероксодвусерная кислота.  133. Тиосерная кислота. 134. Соединения серы с галогенами. 135. Селен (Selenium). Теллур (Tellurium). Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ 136. Азот в природе. Получение и свойства азота. 137. Аммиак. Соли аммония. 138. Фиксация атмосферного азота. Получение аммиака. 139. Гидразин. Гидроксиламин. Азидоводород. 140. Оксиды азота. 141. Азотистая кислота. 142. Азотная кислота. 143. Промышленное получение азотной кислоты. 144. Круговорот азота в природе. 145. Фосфор в природе. Получение и свойства фосфора. 146. Соединения фосфора с водородом и галогенами. 147. Оксиды и кислоты фосфора. 148. Минеральные удобрения. 149. Мышьяк (Arsenicum). 150. Сурьма (Stibium). 151. Висмут (Bismuthum). Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ 152. Углерод в природе. 153. Аллотропия углерода. 154. Химические свойства углерода. Карбиды. 155. Диоксид углерода. Угольная кислота. 156. Оксид углерода (II).  157. Соединения углерода с серой и азотом. 158. Топливо и его виды. 159. Газообразное топливо. 160. Общая характеристика органических соединений. 161. Отличительные особенности органических соединений. 162. Теория химического строения органических соединений. 163. Классификация органических соединений. 164. Предельные (насыщенные) углеводороды. 165. Непредельные (ненасыщенные) углеводороды. 166. Предельные циклические углеводороды. 167. Ароматические углеводороды. 168. Галогенпроизводные углеводородов. 169. Спирты и фенолы. 170. Простые эфиры. 171. Альдегиды и кетоны. 172. Карбоновые кислоты. 173. Сложные эфиры карбоновых кислот. Жиры. 174. Углеводы. 175. Амины. 176. Аминокислоты и белки. 177. Природные и синтетические высокомолекулярные соединения (полимеры). 178. Кремний в природе. Получение и свойства кремния. 179. Соединения кремния с водородом и галогенами. 180. Диоксид кремния. 181.  Кремниевые кислоты и их соли. Кремниевые кислоты и их соли.182. Стекло. 183. Керамика. 184. Цемент. 185. Кремнийорганические соединения. 186. Германий (Germanium). 187. Олово (Stannuin). 188. Свинец (Plumbum). 189. Свинцовый аккумулятор. Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников. 191. Кристаллическое строение металлов. 192. Добывание металлов из руд. 193. Получение металлов высокой чистоты. 194. Сплавы. 195. Диаграммы состояния металлических систем. 196. Коррозия металлов. Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 197. Щелочные металлы в природе. 198. Натрий (Natrium). 199. Калий (Kalium). ПОДГРУППА МЕДИ 200. Медь. (Cuprum). 201. Серебро (Argentum). 202. Золото (Aurum). Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ 203. Основные положения координационной теории. 204. Основные типы и номенклатура комплексных соединений.  205. Пространственное строение и изомерия комплексных соединений. 206. Природа химической связи в комплексных соединениях. 207. Диссоциация комплексных соединений в растворах. 208. Влияние координации на свойства лигандов и центрального атома. Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 209. Бериллий (Beryllium). 210. Магний (Magnesium). 211. Кальций (Calcium). 212. Жесткость природных вод и ее устранение. 213. Стронций (Strontium). Барий (Barium). 214. Цинк (Zincum). 215. Кадмий (Cadmium). 216. Ртуть (Hydrargyrum). Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 217. Бор (Borum). 218. Алюминий (Aluminium). 219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium). ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ 220. Подгруппа скандия. 221. Лантаноиды. 222. Актиноиды. Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП ПОДГРУППА ТИТАНА 224. Титан (Titanium). 225.  Цирконий (Zirconium). Гафний (Hafnium). Цирконий (Zirconium). Гафний (Hafnium).ПОДГРУППА ВАНАДИЯ 226. Ванадий (Vanadium). 227. Ниобий (Niobium). Тантал (Tantalum). ПОДГРУППА ХРОМА 228. Хром (Chromium). 229. Молибден (Mollbdenium). 230. Вольфрам (Wolfram). ПОДГРУППА МАРГАНЦА 231. Марганец (Manganum). 232. Рений (Rhenium). Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ 233. Общая характеристика благородных газов. 234. Гелий (Helium). 235. Неон. Аргон. ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ 236. Железо (Ferrum). 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР. 238. Физические свойства железа. Диаграмма состояния системы железо — углерод. 239. Производство чугуна и стали. 240. Термическая обработка стали. 241. Сплавы железа. 242. Химические свойства железа. Соединения железа. 243. Кобальт (Cobaltum). 244. Никель (Niccolum). 245. Общая характеристика платиновых металлов. 246. Платина (Platinum). 247.  Палладий (Palladium). Иридий (Iridium). Палладий (Palladium). Иридий (Iridium).ПРИЛОЖЕНИЕ Некоторые единицы СИ Множители и приставки для образования десятичных кратных и дольных единиц и их наименований Соотношения между некоторыми внесистемными единицами и единицами СИ Литература для углубленного изучения общей и неорганической химии |
7 фактов, которые вы должны знать! –
Нилой Бхаттачарья
В периодической таблице насчитывается около 118 признанных элементов. В этой статье мы обсуждаем один такой элемент.
NB Электронная конфигурация: 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 4D 4 5S 10009. Nb) представляет собой переходный металл, присутствующий в пятой группе таблицы, с мягким и пластичным характером и массовым числом-9.2. Он служит элементом в сверхпроводящих сплавах, используемых в различных отраслях промышленности. Степень окисления +5 наиболее известна у ниобия .
Степень окисления +5 наиболее известна у ниобия .
Давайте посмотрим на интересную электронную плотность и распределение электронов в Nb.
Как написать электронную конфигурацию ниобия?Число электронов равно 41, как и атомный номер. Электронная структура определяется определенными правилами. Это следующие:
Шаг 1: Перечислите энергетический порядок орбиталей
Электроны должны быть заполнены атомными орбиталями в порядке возрастания энергий, соблюдая правило (n+l) Принцип Ауфбау , где n= главное квантовое число и l= азимутальное квантовое число. Для ниобия энергетический порядок следующий: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d .
Шаг 2: Электроны заполняют каждую орбиталь в соответствии с правилом
Однако в случае 5s-4d правило (n+l) нарушается из-за более высокой обменной энергии и концепции стабильности наполовину заполненной. Стоимость сопряжения энергии в 5с 9Конфигурация 0008 2 отменена для достижения большей стабильности. Энергетические стойки после почти полного заполнения: 4d<5s.
Стоимость сопряжения энергии в 5с 9Конфигурация 0008 2 отменена для достижения большей стабильности. Энергетические стойки после почти полного заполнения: 4d<5s.
Шаг 3: Расположение электронов на всех наборах орбиталей
На каждой орбитали может быть только два электрона с разными спинами, согласно принципу запрета Паули . Если s-орбиталь удерживает два электрона, p-орбитали принимают шесть чистых электронов, а d-орбитали удерживают чистые десять электронов. При записи электроны помещаются в надстрочную позицию к орбитальному обозначению.
Этап 4: Аномалия энергетического порядка
Каждая орбиталь подуровня должна быть заполнена до спаривания электронов в соответствии с Правилом Хунда , но Nb показывает аномалии. После того, как два электрона заполнили 4d-орбитали, последний электрон достигает более высокой обменной энергии в конфигурации 4d 4 5s 1 , а не в конфигурации 4d 3 5s 2 .
Шаг 5: Окончательное заполнение электронами
Результирующая электронная конфигурация: 1s 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 4D 4 5S 10009
NIOB. Nb has the following orbital features:- Total orbitals of all sub-levels- 24
- Total sets of orbitals- 10
| Sub-shell | Number of Orbitals |
|---|---|
| s | 1 |
| p | 3 |
| d | 5 |
| f | 7 |
Nb 41 Электронная конфигурация- [Kr 36 ] 4d 4 5s 1
Nb представляет собой переходный элемент с меньшим обозначением электронной конфигурации, описанным по отношению к предыдущему элементу Нобелевского газа в таблице.
The unabbreviated form of Niobium’s electronic configuration is:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 4d 4 5s 1
Ground State Niobium Electron Configuration Electron configuration: 1s 2 2s 2 2p x 2 2p y 2 2p z 2 3s 2 3p x 2 3p y 2 3p z 2 4s 2 3d xy 2 3d yz 2 3d xz 2 3d 2 x2-y2 3d z2 2 4p x 2 4p y 2 4p z 2 4d xy 1 4D YZ 1 4D XZ 1 4D 1 x2-Y2 4D Z2 0 5S 1999. SIRED 9000.SIRED .RIDE 9008 .SIRED .SIRED .SIRED .SIRED . .
SIRED 9000.SIRED .RIDE 9008 .SIRED .SIRED .SIRED .SIRED . .
на захватывающем атом, Электронная конфигурация: 1S 2 2S 2 2P 6 2 3P 6 4S 2 3S 99999999999999999999999999999999999999999999999999999999999999999999999999999999. 9 9999999999999999999999999999999999999999999999999999999999999 6 4d xy 1 d yz 1 4d xz 1 4d 0 x2-y2 4d z2 0 5s 2
The electron поднимается с орбиты с более низкой энергией на орбиту с более высокой энергией. Другие конфигурации:
- 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 10 4P 6 4D XY 10 4P 6 4D XY8 6 4D XY8 10 6 4D XY8 10 6 4S xy8 10 6 4S xy 10 4S 9 10 6 4S 9 10 9 4d xz 0 4d 1 x2-y2 4d z2 0 5s 2
- 1s 2 2s 2 2p 6 3s 2 3p 6 4с 2 3d 10 4p 6 4d xy 1 d yz 0 4d xz 1 4d 1 x2-y2 4d z2 0 5s 2
- 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 100009 4P 6 4D XY 8 99998 6 4D XY 8 999998 6 4D xy 8 099998 6 4D XY 8 99998 6 4D xy 8 9 6 4D XY 8 08 6 4D xy 8 08.
 хз 1 4d 1 x2-Y2 4D Z2 0 5S 2
хз 1 4d 1 x2-Y2 4D Z2 0 5S 2
Основное наполнение. в порядке возрастания энергий. Орбитальное изображение Nb
ЗаключениеНиобий представляет собой голубоватый элемент с металлической текстурой, обладающий физическими свойствами, сходными с танталом. Из-за 5с 1 , он парамагнитен и склонен к реакциям. Электронная структура изображает аномальную электронную конфигурацию.
Подробнее о следующих конфигурациях:
Nb Информация об элементах ниобия: факты, свойства, тенденции, использование и сравнение – Периодическая таблица элементов
Кристаллическая структура ниобия
Структура твердого тела ниобия Объемно-центрированная кубическая .
Кристаллическая структура может быть описана с точки зрения ее элементарной ячейки. Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Единичные Клетки повторяются в трехмерном пространстве, образуя структуру.
Параметры элементарной ячейки
Элементарная ячейка представлена параметрами решетки, которые являются длинами ребер ячейки Постоянные решетки (a, b и c)
| a | b | c |
|---|---|---|
| 330,04 пм | 330,04 пм | 330,04 пм |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | Gamma |
|---|---|---|
| π/2 | π/2 | π/2 |
. y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможные симметричные расположения частиц в трехмерном пространстве описываются 230 пространственными группами (219различные типы или 230, если хиральные копии считаются различными.
| Space Group Name | Im_ 3m | |
| Oxidation States | Space Group Number | 229 |
| Crystal Structure | Body Centered Cubic |
Niobium Atomic and Orbital Properties
Атомы ниобия имеют 41 электрон и структуру электронной оболочки [2, 8, 18, 12, 1] с символом атомного термина (квантовые числа) 6 D 1/2 .
| Atomic Number | 41 |
| Number of Electrons (with no charge) | 41 |
| Number of Protons | 41 |
| Mass Number | 93 |
| Number нейтронов | 52 |
| Структура оболочки (электронов на энергетический уровень) | 2, 8, 18, 12, 1 |
| Электронная конфигурация | [Kr] 4d4 5s1 |
| Valence Electrons | 4d4 5s1 |
| Valence (Valency) | 5 |
| Main Oxidation States | 5 |
| Oxidation States | -3, – 1, 0, 1, 2, 3, 4, 5 |
| Символ атомного термина (квантовые номера) | 6 D 1/2 |
 уровень энергии
уровень энергии Электронная конфигурация основного состояния ниобия – нейтральный атом ниобия
Сокращенная электронная конфигурация ниобия
Сокращенная электронная конфигурация основного состояния нейтрального атома ниобия [Kr] 4d4 5s1. Часть конфигурации ниобия, эквивалентная благородному газу предыдущего периода, обозначается аббревиатурой [Kr]. Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используется сокращенное обозначение. Это важно, поскольку именно валентные электроны 4d4 5s1, электроны в самой внешней оболочке, определяют химические свойства элемента.
Полная электронная конфигурация нейтрального ниобия
Полная электронная конфигурация основного состояния атома ниобия, Полная электронная конфигурация
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d4 5s1 Принцип Ауфбау, принцип запрета Паули и правило Хунда.
 По этому принципу электроны заполняются в следующем порядке: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. …
По этому принципу электроны заполняются в следующем порядке: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p. …Атомная структура ниобия
Атомный радиус ниобия составляет 198 пм, а его ковалентный радиус составляет 137 пм.
| Расчетный атомный радиус | 198 пм (1,98 Å) |
| Atomic Radius Empirical | 145 pm (1.45 Å) |
| Atomic Volume | 10.841 cm3/mol |
| Covalent Radius | 137 pm (1.37 Å) |
| Van der Waals Radius | – |
| Neutron Cross Section | 1.15 |
| Neutron Mass Absorption | 0. 0004 0004 |
Atomic Spectrum of Niobium
Ниобий Химические свойства: Энергия ионизации ниобия и сродство к электрону
Сродство к электрону ниобия составляет 86,1 кДж/моль.
| Valence | 5 |
| Electronegativity | 1.6 |
| ElectronAffinity | 86.1 kJ/mol |
Ionization Energy of Niobium
Refer to table below for Ionization energies of Niobium
| Ionization energy number | Enthalpy – kJ/mol |
|---|---|
| 1st | 652.1 |
| 2nd | 1380 |
| 3rd | 2416 |
| 4th | 3700 |
| 5th | 4877 |
| 6th | 9847 |
| 7th | 12100 |
Niobium Physical Properties
Refer to below table for Niobium Physical Properties
| Density | 8. 57 g/cm3 57 g/cm3 |
| Molar Volume | 10.841 cm3/mol |
Elastic Properties
| Young Modulus | 105 |
| Модуль сдвига | 38 ГПа |
| Модуль объемного сжатия | 170 ГПа |
| Коэффициент Пуассона 4,6 9 95 4 41 |
Hardness of Niobium – Tests to Measure of Hardness of Element
| Mohs Hardness | 6 MPa |
| Vickers Hardness | 1320 MPa |
| Brinell Hardness | 736 MPa |
Ниобий Электрические свойства
Ниобий является проводником электричества. См. таблицу ниже для получения информации об электрических свойствах ниобия
| Электропроводность | 6700000 S/m |
| Resistivity | 1.5e-7 m Ω |
| Superconducting Point | 9. 25 25 |
Niobium Heat and Conduction Properties
| Thermal Conductivity | 54 W/ (м K) |
| Тепловое расширение | 0,00000729 /K |
Ниобий Магнитные свойства
| 6 Магнитный типParamagnetic | |
| Curie Point | – |
| Mass Magnetic Susceptibility | 2.76e-8 m3/kg |
| Molar Magnetic Susceptibility | 2.56e-9 m3/mol |
| Volume Magnetic Susceptibility | 0,000237 |
Оптические свойства ниобия
| Показатель преломления | – |
| Speed of Sound | 3480 m/s |
Niobium Thermal Properties – Enthalpies and thermodynamics
Refer to table below for Thermal properties of Niobium
| Melting Point | 2750 K (2476. |


 Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы
Оно может служить пособием для лиц, самостоятельно изучающих основы химии, и для учащихся химических техникумов и старших классов средней школы