Ниобий происхождение названия: Ниобий история — Знаешь как
alexxlab | 30.04.2019 | 0 | Разное
Ниобий история — Знаешь как
НИОБИЙ ИСТОРИЯ ЭЛЕМЕНТА
 С элементом, занимающим в менделеевской таблице 41-ю клетку, человечество знакомо давно. Возраст его нынешнего названия — ниобий — почти на полстолетия меньше. Случилось так, что элемент № 41 был открыт дважды. Первый раз — в 1801 г. английский ученый Чарльз Хатчет исследовал образец черного минерала, присланного в Британский музей из Америки. Из этого минерала он выделил окисел неизвестного прежде элемента. Новый элемент Хатчет назвал колумбием, отмечая тем самым его заокеанское происхождение. А черный минерал получил название колумбита.
С элементом, занимающим в менделеевской таблице 41-ю клетку, человечество знакомо давно. Возраст его нынешнего названия — ниобий — почти на полстолетия меньше. Случилось так, что элемент № 41 был открыт дважды. Первый раз — в 1801 г. английский ученый Чарльз Хатчет исследовал образец черного минерала, присланного в Британский музей из Америки. Из этого минерала он выделил окисел неизвестного прежде элемента. Новый элемент Хатчет назвал колумбием, отмечая тем самым его заокеанское происхождение. А черный минерал получил название колумбита.
Через год шведский химик Экеберг выделил из колумбита окисел еще одного нового элемента, названного танталом. Сходство соединений Колумбия и тантала было так велико, что в течение 40 лет большинство химиков считало: тантал и Колумбии — один и тот же элемент.
В 1844 г. немецкий химик Генрих Розе исследовал образцы колумбита, найденные в Баварии. Он вновь обнаружил окислы двух металлов. Один из них был окислом известного уже тантала. Окислы были похожи, и, подчеркивая их сходство, Розе назвал элемент, образующий второй окисел, ниобием по имени Ниобы, дочери мифологического мученика Тантала.
Впрочем, Розе, как и Хатчет, не сумел получить этот элемент в свободном состоянии.
Металлический ниобий был впервые получен лишь в 1866 г. шведским ученым Бломстрандом при восстановлении хлорида ниобия водородом. В конце XIX в. были найдены еще два способа получения этого элемента. Сначала Муассан получил его в электропечи, восстанавливая окись ниобия углеродом, а затем Гольдшмидт сумел восстановить тот же элемент алюминием.
А называть элемент ниобий в разных странах продолжали по-разному: в Англии и США — колумбием, в остальных странах — ниобием. Конец разноголосице положил Международный союз теоретической и прикладной химии (ИЮПАК) в 1950 г. Было решено повсеместно узаконить название элемента «ниобий», а за основным минералом ниобия так и закрепилось наименование «колумбит». Его формула (Fe, Mn) (Nb, Ta)2O6.
Ниобий химические свойства
Элементный ниобий — чрезвычайно тугоплавкий (2468° С) и высококипящий (4927° С) металл, очень стойкий во многих агрессивных средах. Все кислоты, за исключением плавиковой, не действуют на него. Кислоты-окислители «пассивируют» ниобий, покрывая его защитной окисной пленкой (Nb2О5). Но при высоких температурах химическая активность ниобия повышается! Если при 150—200° С окисляется лишь небольшой поверхностный слой металла, то при 900—1200° С толщина окисной пленки значительно увеличивается.
Ниобий! активно реагирует со многими неметаллами. С ним образуют соединения галогены, азот, водород, углерод, сера. При этом ниобий может проявлять разные валентности — от двух до пяти. Но главная валентность этого элемента 5+. Пятивалентный ниобий! может входить кв состав соли и как катион, и как один из элементов аниона, что свидетельствует об амфотерном характере элемента В 41.
Соли ниобиевых кислот называют ниобатами. Их получают в результате обменных реакций после сплавления пятиокиси ниобия с содой:
Nb2О5 + 3Na2CО3 → 2Na3NbО4 + 3CО2
Довольно хорошо изучены соли нескольких ниобиевых кислот, в первую очередь метаниобиевой HNbО3, а также диниобаты и пентаниобаты (K4Nb2О7, K7Nb5О16 • mH2O ). А соли, в которых элемент № 41 выступает как катион, обычно получают прямым взаимодействием простых веществ, например
2Nb + 5Cl2 → 2NbCl5
Ярко окрашенные игольчатые кристаллы пентагалогенидов ниобия (NbCl5 — желтого цвета, NbBr5 — пурпурно-красного) легко растворяются в органических растворителях — хлороформе, эфире, спирте. Но при растворении в воде эти соединения полностью разлагаются, гидролизуются с образованием ниобатов:
NbCl6 + 4Н2O → 5НСl + H3NbO4.
Гидролиз можно предотвратить, если в водный раствор добавить какую-либо сильную кислоту. В таких растворах пентагалогениды ниобия растворяются, не гидролизуясь.
Ниобий образует двойные соли и комплексные соединения, наиболее легко — фтористые. Фторниобаты — так называются эти двойные соли. Они получаются, если в раствор ниобиевой и плавиковой кислот добавить фторид какого-либо металла.
Состав комплексного соединения зависит от соотношения реагирующих в растворе компонентов. Рентгенометрический анализ одного из этих соединений показал строение, отвечающее формуле K2NbF7. Могут образоваться и оксосоединения ниобия, например оксофторниобат калия K2NbOF5 • H2О.
Химическая характеристика элемента не исчерпывается, конечно, этими сведениями. Сегодня самые важные из соединений элемента № 41 — это его соединения с другими металлами.
Статья на тему Ниобий история
Ниобий: особенности, где применяется, история
Ниобий (Nb) – 41-й элемент периодической таблицы, представляет собой мягкий серый кристаллический металл, используемый в самых разных областях — от производства стали до гипоаллергенных украшений. Первоначально он был обнаружен британским химиком Чарльзом Хэтчеттом в 1801 году, при исследовании коллекции американских минералов в Британском музее. Исследователь назвал этот элемент Колумбиум в честь Христофора Колумба. В Европе на протяжении многих лет использовали другое его название — ниобий.
Добыча и происхождение ниобия
Тантал и ниобий часто встречаются вместе, на протяжении многих лет их практически не отличали друг от друга. По предложению Королевского химического общества он стал называться в честь греческой богини слез Ниобе, дочери короля Тантала.
Nb имеет запутанную историю. Джон Уинтроп открыл руду в штате Массачусетс в 1734 году и отправил ее в Англию. Минерал хранился в коллекции Британского музея в течение многих лет, пока в 1801 году его не стал изучать Чарльз Хэтчетт. Он обнаружил новый элемент в руде и назвал его колумбием в честь Колумбии, самого поэтического звучания Америки. В 1809 году английский химик Уильям Хайд Волластон сравнил колумбит с другим минералом, танталитом. Эти металлические элементы очень похожи, всегда находятся вместе и их трудно выделить.
В 1844 году Генрих Роуз, работая с образцами колумбита и танталита, создал две новые отдельные, но очень похожие кислоты, которые он назвал соответственно ниобиевой и пелоповой и переименовал элемент в ниобий. Двадцать лет спустя швейцарский химик Жан Шарль Галиссар де Мариньяк выделил металлический Nb путем нагревания хлорида в атмосфере водорода.
 Как выглядит ниобий
Как выглядит ниобийВ Соединенных Штатах в течение примерно 100 лет изначальный элемент назывался колумбий (символ Cb), тогда как в Европе его называли ниобием. В 1949 году Международный союз теоретической и прикладной химии официально принял ниобий в качестве официального названия элемента. Однако многие металлургические общества США до сих пор называют его колумбием.
Свойства и особенности производства
Образец чистого металла был изготовлен в 1864 году Кристианом Бломстрандом, который восстановил хлорид ниобия, нагревая его газообразным водородом. Почти весь Nb добывается в Бразилии и Канаде. Предполагается, что промышленное его количество в земной коре сохранится в течение следующих пяти веков.
Согласно исследованиям, некоторые соединения ниобиевой пыли могут вызывать раздражение глаз и кожи, тем не менее, не зафиксированы какие-либо серьезные последствия при работе с Nb, так же как и негативного влияния его на экологию.
Элемент встречается в виде оксида и обладает сильной геохимической связью с танталом. Основные минералы — пирохлор [(Na, Ca) 2 Nb 2 O 6 F] и колумбит [(Fe, Mn) (Nb, Ta) 2 O 6], состоящий из ниобата, танталата, железа и марганца. Пирохлор встречается обычно в карбонатитах и пегматитах, полученных из щелочных пород, связанных с минералами циркония, титана, тория, урана и редкоземельных элементов. Колумбит содержится в интрузивных пегматитах и биотитах, а также в щелочных гранитах. Однако, поскольку большинство таких месторождений невелики и распределены неравномерно на земле, они получаются, как побочный продукт других металлов.
Металл добывают открытым способом, руда, делится на блоки и перерабатывается путем разрыва, с помощью бульдозера, погрузки и транспортировки. Добыча в Квебеке (Канада) идет подземными методами. Концентрация руды достигается путем дробления и измельчения, магнитного разделения для удаления магнетита, а затем обесшламливания и флотационного разделения.
Концентрат пирохлора обычно восстановлен до феррониобия через алюминотермический процесс. Он смешивается с гематитом, алюминиевым порошком и небольшим количеством флюорошпатового и известкового флюсов в роторном смесителе. Затем выгружается в стальные контейнеры, облицованные огнеупорным кирпичом из магнезита.
Здесь смесь помещается в круглые углубления, сделанные из смеси извести, плавикового шпата и кварцевого песка, и восстанавливается воспламенением смеси алюминиевого порошка и хлората натрия или пероксида бария. Экзотермическая реакция длится примерно от 15 до 30 минут, а температура процесса порядка 2400 C. Большая часть примесей из концентрата, включая все оксиды тория и урана, попадают в расплавленный шлак, Когда реакция заканчивается, он отводится, и сосуд поднимается, оставляя металл остывать в песке.
Сплав товарного феррониобия измельчают до размеров частиц с составом:
- Nb – 62–69%;
- железа – 29–30%;
- кремния – 2%;
- алюминия – 1–3%.
Область применения
По данным USGS (Геологическое обследование США), около 80 процентов Nb используется в сталелитейной промышленности для создания высокопрочных низколегированных сталей. Свойства ниобия позволяют применять его в сплавах, что повышает механическую и жаропрочность, ударную вязкость и коррозионную стойкость.
Другие области применения его включают строительство трубопроводов, суперсплавов для жаропрочного оборудования, а также реактивные двигатели и ювелирные изделия. Ниобий, вольфрам, молибден, тантал и рений известны как пять тугоплавких металлов. Все они обладают очень высокой устойчивостью к нагреву и износу.
 Ниобий используется в сталелитейной промышленности
Ниобий используется в сталелитейной промышленностиПромышленное использование Nb началось еще в начале 1900-х годов. Крупнейшим рынком ниобия (> 80%) является производство высокопрочной низколегированной стали, где он обеспечивает высокую жаропрочность и коррозионную стойкость для газопроводов, автомобильных компонентов и конструкционной стали.
Nb, как и тантал, позволяет переменному току проходить только в одном направлении через электролизер. Металл ниобий используется в дуговых сварочных стержнях для стабилизированных марок нержавеющей стали. Наиболее интересные его применения в области сверхпроводимости. Сверхпроводящие магниты изготовлены из проволоки Nb-Zr (ниобий и цирконий), которая сохраняет сверхпроводимость в сильных магнитных полях.
Сплавы с ниобием
Ниобий чаще всего используется для создания сплавов. Даже при содержании Nb всего 0,01% прочность стали заметно улучшается. Такие сплавы часто встречаются в нефтегазовых установках и трубопроводах. Суперсплавы Nb, такие, как никель-ниобий, обладают способностью сохранять стабильность, что делает их незаменимыми в ракетостроении и производстве энергетических турбин. Ниобий-титановые сплавы являются сверхпроводящими в определенном диапазоне низких температур. Эти сплавы используются для создания специальных магнитов, используемых в МРТ сканерах.
Использование сплавов Nb:
- Стержни для дуговой сварки стабилизированных марок нержавеющей стали.
- Стержень управления ядерным реактором из-за его высокой температуры плавления и коррозионной стойкости, а также низкого поглощения нейтронов в поперечном сечении.
- Тигли для производства синтетических алмазов.
- Ювелирные изделия, на поверхности Nb можно создать яркие цвета.
- Сверхпроводник, суперколлайдери ускоритель частиц с использованием сверхчистых металлов и сплавов.
- Оптическое покрытие и объектив камеры.
- Литий Nb для волновода в коммуникациях.
- Тонкопленочный солнечный элемент.
Цена ниобия
Поскольку элемент не имеет больших залежей на земле и имеет сложную технологию производства его цена всегда было очень высокой и сростом развития автомобилестроения, энергетики, самолетостроения и космической технологии его цена неуклонно росла. При этом были периоды, когда она оставалась низкой из-за кризисных явлениях в мировой экономики.
Цена Nb на мировом рынке в тыс. $ за метрическую тонну по годам:
- 1940 – 0.77162;
- 1950 -13.991;
- 2004 – 48.372;
- 2010 – 41.500;
- 2018 – 42.280.
Азиатско-Тихоокеанский регион в потреблении Nb начал доминировать на мировом рынке с 2017 года, что было вызвано ростом использования конструкционных сталей в автомобильной и аэрокосмической промышленности в таких странах, как Китай, Индия и Япония.
На мировом рынке Nb крупным производителем является CBMM (Бразилия), обладающая монополией на его поставки с 84% долей мирового рынка.
Другие известные компании:
- China Molybdenum Co. Ltd, Китай
NIOBEC (Magris Resources Company), Канада. - Alkane Resources Ltd, США.
- Современное российское предприятие-производитель Nb в концентрате — ООО «Ловозерский горно-обогатительный комбинат».
- Предприятия, которые остановили производство: Malyshevskoye mine department, ОАО «Забайкальский ГОК», ООО «Стальмаг», ОАО «Вишневогорский ГОК».\
 Цена ниобия – 42.280 тыс. $ за метрическую тонну
Цена ниобия – 42.280 тыс. $ за метрическую тоннуСегодня в России реализуются проекты с инвестициями по восстановлению редкоземельных месторождений и развитию ниобиевой отрасли:
- Томторпроект.
- Белозиминское месторождение.
- Катугинскоеместорождение.
- Чуктуконскоеместорождение.
- Зашихинскоеместорождение.
- Улуг-Танзекское месторождение.
Ожидается, что в 2019-2024 гг на мировом рынке ниобия будет среднегодовой темп роста в 5,90%. Основные факторы, влияющими на него – высокое потребление Nb в конструкционной стали и широкое использование сплавов при производстве авиационных двигателей.
Ниобий | История
Ниобий
Ниобий открыт в 1801 г. В Британский музей из Америки (штат Массачузетс) был прислан неизвестный минерал. Гатчет, который исследовал этот минерал, названный позднее колумбитом, вначале отождествлял его с сибирской хромовой рудой, но затем обнаружил, что кислота (окисел), образующаяся из щелочного сплава минерала, обладает совершенно иными свойствами, чем хромовая кислота Гатчету не удалось восстановить из окисла металл, однако он все же назвал его колумбием в честь Христофора Колумба и старинного названия Америки. Год спустя шведский химик Экеберг открыл в одной из финских руд новый элемент, названный им танталом (Tantalum), так как окисел этого металла оказался чрезвычайно устойчивым и не разрушался даже в избытке кислоты.
Он как бы не мог насытиться кислотой, подобно тому как мифический Тантал, наказанный Зевсом, стоя по горло в воде и терзаясь жаждой, не мог удовлетворить ее. Минерал, содержащий этот металл, был наименован танталитом. Однако в 1809 г. Волластон доказал, что колумбий Гатчета и тантал Экеберга представляют собой один и тот же металл, так как их окислы очень близки по удельному весу. Этот спорный вопрос разрешил Розе, который в 1844 г. в результате тщательного анализа колумбитов и танталитов различного происхождения установил, что в некоторых из них помимо тантала содержится еще один элемент, близкий по свойствам к танталу. Этот новый элемент Розе назвал ниобием (Niobium) по имени мифической Ниобы, дочери Тантала. Колумбий Гатчета оказался смесью ниобия и тантала. В России колумбий Гатчета заинтересовал химика-аналитика Т. Е. Ловиа, который начал исследование нового металла, но не успел его закончить, опубликовав о нем лишь заметку (1806). В русской литературе начала XIX в. колумбий Гатчета назывался колумб (Шерер, 1808), колумбий (Ловиц), тантал и ниобий (Гесс).
Только в 1950 ИЮПАК (Всемирная организация химиков) окончательно присвоила элементу №41 название ниобий. Металлический Nb первым получил в 1866 К. Бломстранд.
Совместное нахождение ниобия и тантала в природе, обусловленное их чрезвычайным химическим сходством, долгое время тормозило развитие промышленности этих металлов. Лишь в 1866 году швейцарский химик Жан Шарль Галиссар де Мариньяк сумел разработать первый промышленный способ разделения химических «близнецов». Он воспользовался различной растворимостью некоторых соединений этих металлов: комплексный фторид тантала не растворяется в воде, аналогичное соединение ниобия достаточно хорошо растворимо в ней. В усовершенствованном виде способ Мариньяка применяли до недавнего времени, однако в последние годы на смену ему пришли новые более эффективные способы — избирательная экстракция, ионный обмен, ректификация галогенов и др.
В конце XIX века французский химик Анри Муассан получил чистый ниобий электротермическим путем, восстанавливая окись ниобия углеродом в электропечи.
Ниобий № 41 химический элемент
С элементом, занимающим в менделеевской таблице 41-ю клетку, человечество знакомо давно. Возраст его нынешнего названия — ниобий — почти на полстолетия меньше. Случилось так, что элемент № 41 был открыт дважды. Первый раз — в 1801 г. английский ученый Чарльз Хатчет исследовал образец черного минерала, присланного в Британский музей из Америки. Из этого минерала он выделил окисел неизвестного прежде элемента. Новый элемент Хатчет назвал колумбием, отмечая тем самым его заокеанское происхождение. А черный минерал получил название колумбита.
Через год шведский химик Экеберг выделил из колумбита окисел еще одного нового элемента, названного танталом. Сходство соединений Колумбия и тантала было так велико, что в течение 40 лет большинство химиков считало: тантал и колумбий — один и тот же элемент.
В 1844 г. немецкий химик Генрих Розе исследовал образцы колумбита, найденные в Баварии. Он вновь обнаружил окислы двух металлов. Один из них был окислом известного уже тантала. Окислы были похожи, и, подчеркивая их сходство, Розе назвал элемент, образующий второй окисел, ниобием по имени Ниобы, дочери мифологического мученика Тантала.
Впрочем, Розе, как и Хатчет, не сумел получить этот элемент в свободном состоянии.
Металлический ниобий был впервые получен лишь в 1866 г. шведским ученым Бломстрандом при восстановлении хлорида ниобия водородом. В конце XIX в. были; найдены еще два способа получения этого элемента. Сначала Муассан получил его в электропечи, восстанавливая окись ниобия углеродом, а затем Гольдшмидт сумел восстановить тот же элемент алюминием.
А называть элемент № 41 в разных странах продолжали по-разному: в Англии и США — колумбием, в остальных странах — ниобием. Конец разноголосице положил Международный союз теоретической и прикладной химии (ИЮПАК) в 1950 г. Было решено повсеместно узаконить название элемента «ниобий», а за основным минералом ниобия так и закрепилось наименование «колумбит». Его формула (Fe, Mn) (Nb,
Та)2О6.
Элементный ниобий — чрезвычайно тугоплавкий (2468°C) и высококипящий (4927°C) металл, очень стойкий во многих агрессивных средах. Все кислоты, за исключением плавиковой, не действуют на него. Кислоты-окислители «пассивируют» ниобий, покрывая его защитной окисной пленкой (Nb2O5). Но при высоких температурах химическая активность ниобия повышается. Если при 150-200°C окисляется лишь небольшой поверхностный слой металла, то при 900-1200°C толщина окисной пленки значительно увеличивается.
Ниобий активно реагирует со многими неметаллами. С ним образуют соединения галогены, азот, водород, углерод, сера. При этом ниобий может проявлять разные валентности — от двух до пяти. Но главная валентность этого элемента 5+. Пятивалентный ниобий может входить в состав соли и как катион, и как один из элементов аниона, что свидетельствует об амфотерном характере элемента № 41.
Nb2O5 + 3Na2CO3 → 2Na3NbO4 + 3CO2.
Довольно хорошо изучены соли нескольких ниобиевых кислот, в первую очередь метаниобиевой HNbO3, а также диниобаты и пентаниобаты (K4Nb2O7, K7Nb5O16-rnH2O). А соли, в которых элемент № 41 выступает как катион, обычно получают прямым взаимодействием простых веществ, например 2Nb + 5Cl2 → 2NbCl5.
Ярко окрашенные игольчатые кристаллы пентагалогенидов ниобия (NbCl5 — желтого цвета, NbBr5 — пурпурно-красного) легко растворяются в органических растворителях — хлороформе, эфире, спирте. Но при растворении в воде эти соединения полностью разлагаются, гидролизуются с образованием ниобатов:
NbCl 5 + 4H2O → 5HCl + H3NbO4.
Гидролиз можно предотвратить, если в водный раствор добавить какую-либо сильную кислоту. В таких растворах пентагалогениды ниобия растворяются, не гидролизуясь.
Ниобий образует двойные соли и комплексные соединения, наиболее легко — фтористые. Фторниобаты — так называются эти двойные соли. Они получаются, если в раствор ниобиевой и плавиковой кислот добавить фторид какого-либо металла.
Состав комплексного соединения зависит от соотношения реагирующих в растворе компонентов. Рентгенометрический анализ одного из этих соединений показал строение, отвечающее формуле K2NbF7. Могут образоваться и оксосоединения ниобия, например оксофторниобат калия K2NbOF5*H2O.
Химическая характеристика элемента не исчерпывается, конечно, этими сведениями. Сегодня самые важные из соединений элемента № 41 — это его соединения с другими металлами.
Ниобий и сверхпроводимость
Практически важны две характеристики сверхпроводников: величина критической температуры, при которой происходит переход в состояние сверхпроводимости, и критического магнитного поля (еще Камерлинг-Оннес наблюдал утрату сверхпроводником сверхпроводимости при воздействии на него достаточно сильного магнитного поля).
Сейчас известно уже больше 2000 сверхпроводящих металлов, материалов и соединений, но подавляющее их большинство не пришло и видимо никогда не придет в технику либо из-за чрезвычайно низких величин критических параметров, о которых сказано выше, либо из-за неприемлемых технологических характеристик. Среди сверхпроводников, имеющих практическое значение, особенно популярны ниобий-титановые сплавы. Из них изготовлено большинство работающих в наши дни сверхпроводящих магнитов. Они пластичны, из них можно делать технические устройства и проводники сложных форм.
Как материал ленточных сверхпроводников ценен сплав ниобия с оловом Nb3Sn, станнид ниобия, открытый еще в 1954 г. Сверхпроводящий токонесущий элемент — шина со 150 000 жил — из станнида ниобия изготовлен в нашей стране. Подобные многожильные сверхпроводящие проводники намереваются использовать в новых термоядерных установках «Токомак-15».
Интерес для практики представляет еще одно интерметаллическое соединение ниобия — Nb3Ge. У тонкой пленки такого состава рекордно высокая критическая температура — 24,3 К. Правда, у литого Nb3Ge критическая температура — всего 6 К, да и технология приготовления сверхпроводящих элементов из этого материала достаточно сложна.
Довольно высокими значениями критической температуры обладают тройные сплавы: ниобий — германий — алюминий, а также некоторые интерметаллические соединения ванадия. И все же именно с ниобием и его соединениями связаны наибольшие надежды специалистов по сверхпроводникам.
Ниобий металл
Металлический ниобий можно получить восстановлением его соединений, например хлорида ниобия или фторниобата калия, при высокой температуре:
K2NbF7 + 5Na → Nb + 2KF + 5NaF.
Но прежде чем достигнуть этой в сущности последней стадии производства, ниобиевая руда проходит множество этапов переработки. Первый из них — обогащение руды, получение концентратов. Концентрат сплавляют с различными плавнями: едким натром или содой. Полученный сплав выщелачивают. Но растворяется он не полностью. Нерастворимый осадок и есть ниобий. Правда, он здесь еще в составе гидроокиси, не разделен со своим аналогом по подгруппе — танталом — и не очищен от некоторых примесей.
До 1866 г. не было известно ни одного пригодного для производственных условий способа разделения тантала и ниобия. Первым метод разделения этих чрезвычайно похожих элементов предложил Жан Шарль Галиссар де Мариньяк. Метод основан на разной растворимости комплексных соединений этих металлов и называется фторидным. Комплексный фторид тантала нерастворим в воде, а аналогичное соединение ниобия растворимо.
Фторидный метод сложен и не позволяет полностью разделить ниобий и тантал. Поэтому в наши дни он почти не применяется. На смену ему пришли методы избирательной экстракции, ионного обмена, ректификации галогенидов и др. Этими методами получают окисел и хлорид пятивалентного ниобия.
После разделения ниобия и тантала идет основная операция — восстановление. Пятиокись ниобия Nb2O5 восстанавливают алюминием, натрием, сажей или карбидом ниобия, полученным при взаимодействии Nb2O5 с углеродом; пентахлорид ниобия восстанавливают металлическим натрием или амальгамой натрия. Так получают порошкообразный ниобий, который нужно затем превратить в монолит, сделать пластичным, компактным, пригодным для обработки. Как и другие тугоплавкие металлы, ниобий – монолит получают методами порошковой металлургии, суть которой в следующем.
Из полученного металлического порошка под большим давлением (1 т/см2) прессуют так называемые штабики прямоугольного или квадратного сечения. В вакууме при 2300°C эти штабики спекают, соединяют в пруты, которые плавят в вакуумных дуговых печах, причем пруты в этих печах выполняют роль электрода. Такой процесс называется плавкой с расходуемым электродом.
Монокристаллический пластичный ниобий получают методом бестигельной зонной электроннолучевой плавки. Суть его в том, что на порошкообразный ниобий (операции прессования и спекания исключены!) направляют мощный пучок электронов, который плавит порошок. Капли металла стекают на ниобиевый слиток, который постепенно растет и выводится из рабочей камеры.
Как видите, путь ниобия от руды до металла в любом случае довольно долог, а способы производства сложны.
Рассказ о применении ниобия логичнее всего начать с металлургии, так как именно в металлургии он нашел наиболее широкое применение. И в цветной металлургии, и в черной.
Сталь, легированная ниобием, обладает хорошей коррозионной стойкостью. «Ну и что? — скажет иной искушенный читатель. — Хром тоже повышает коррозионную стойкость стали, и он намного дешевле ниобия». Этот читатель прав и неправ одновременно. Неправ потому, что забыл об одном.
В хромоникелевой стали, как и во всякой другой, всегда есть углерод. Но углерод соединяется с хромом, образуя карбид, который делает сталь более хрупкой. Ниобий имеет большее сродство к углероду, чем хром. Поэтому при добавлении в сталь ниобия обязательно образуется карбид ниобия. Легированная ниобием сталь приобретает высокие антикоррозионные свойства и не теряет своей пластичности. Нужный эффект достигается, когда в тонну стали добавлено всего 200 г металлического ниобия. А хромомарганцевой стали ниобий придает высокую износоустойчивость.
Ниобием легируют и многие цветные металлы. Так, алюминий, легко растворяющийся в щелочах, не реагирует с ними, если в него добавлено всего 0,05% ниобия. А медь, известную своей мягкостью, и многие ее сплавы ниобий словно закаляет. Он увеличивает прочность таких металлов, как титан, молибден, цирконий, и одновременно повышает их жаростойкость и жаропрочность.
Сейчас свойства и возможности ниобия по достоинству оценены авиацией, машиностроением, радиотехникой, химической промышленностью, ядерной энергетикой. Все они стали потребителями ниобия.
Уникальное свойство — отсутствие заметного взаимодействия ниобия с ураном при температуре до 1100°C и, кроме того, хорошая теплопроводность, небольшое эффективное сечение поглощения тепловых нейтронов сделали ниобий серьезным конкурентом признанных в атомной промышленности металлов — алюминия, бериллия и циркония. К тому же искусственная (наведенная) радиоактивность ниобия невелика. Поэтому из него можно делать контейнеры для хранения радиоактивных отходов или установки по их использованию.
Химическая промышленность потребляет сравнительно немного ниобия, но это объясняется только его дефицитностью. Из ниобийсодержащих сплавов и реже из листового ниобия иногда делают аппаратуру для производства высокочистых кислот. Способность ниобия влиять на скорость некоторых химических реакций используется, например, при синтезе спирта из бутадиена.
Потребителями элемента № 41 стали также ракетная и космическая техника. Не секрет, что на околоземных орбитах уже вращаются какие-то количества этого элемента. Из ниобийсодержащих сплавов и чистого ниобия сделаны некоторые детали ракет и бортовой аппаратуры искусственных спутников Земли.
МИНЕРАЛЫ НИОБИЯ. Колумбит (Fe, Mn)(Nb, Ta)2O6 был первым минералом ниобия, известным человечеству. И этот же минерал — самый богатый элементом № 41. На долю окислов ниобия и тантала приходится до 80% веса колумбита. Гораздо меньше ниобия в пирохлоре (Ca, Na)2(Nb, Ta, Ti)2O6(O, ОН, F) и допарите (Na, Ce, Ca)2(Nb, Ti)2O6. А всего известно больше 100 минералов, в состав которых входит ниобий. Значительные месторождения таких минералов есть в разных странах: США, Канаде, Норвегии, Финляндии, но крупнейшим поставщиком концентратов ниобия на мировой рынок стало африканское государство Нигерия. В России есть большие запасы лопарита, они найдены на Кольском полуострове.
РОЗОВЫЙ КАРБИД. Монокарбид ниобия NbC — пластичное вещество с характерным розоватым блеском. Это важное соединение довольно легко образуется при взаимодействии металлического ниобия с углеводородами. Сочетание хорошей ковкости и высокой термостойкости с приятными «внешними данными» сделало монокарбид ниобия ценным материалом для изготовления покрытии. Слои этого вещества толщиной всего 0,5 мм надежно защищает от коррозии при высоких температурах многие материалы, в частности графит, который другими покрытиями фактически незащитим. NbC используется и как конструкционный материал в ракетостроении и производстве турбин.
НЕРВЫ, СШИТЫЕ НИОБИЕМ. Высокая коррозионная стойкость ниобия позволила использовать его в медицине. Ниобиевые нити не вызывают раздражения живой ткани и хорошо сращиваются с ней. Восстановительная хирургия успешно использует такие нити для сшивания порванных сухожилии, кровеносных сосудов и даже нервов.
НАРУЖНОСТЬ HE ОБМАНЧИВА. Ниобий не только обладает комплексом нужных технике свойств, но и выглядит достаточно красиво. Этот белый блестящий металл ювелиры пытались использовать для изготовления корпусов ручных часов. Сплавы ниобия с вольфрамом или рением иногда заменяют благородные металлы: золото, платину, иридий. Последнее особенно важно, так как сплав ниобия с рением не только внешне похож на металлический иридий, но почти так же износостоек. Это позволило некоторым странам обходиться без дорогого иридия в производстве напаек для перьев авторучек.
НИОБИЙ И СВАРКА. В конце 20-х годов нашего века электро- и газосварка стали вытеснять клепку и другие способы соединения узлов и деталей. Сварка повысила качество изделий, ускорила и удешевила процессы их сборки. Особенно перспективной сварка казалась при монтаже крупных установок, работающих в коррозионно-активных средах или под большим давлением. Но тут выяснилось, что при сварке нержавеющей стали сварной шов имеет намного меньшую прочность, чем сама сталь. Чтобы улучшить свойства шва, в «нержавейку» стали вводить различные добавки. Лучшей из них оказался ниобий.
ЗАНИЖЕННЫЕ ЦИФРЫ. Ниобий не случайно считается редким элементом: он действительно встречается не часто и в небольших количествах, причем всегда в виде минералов и никогда в самородном состоянии. Любопытная деталь: в разных справочных изданиях кларк (содержание в земной коре) ниобия разный. Это объясняется главным образом тем, что в последние годы в странах Африки найдены новые месторождения минералов, содержащих ниобий. В «Справочнике химика», т. I (М., «Химия», 1963) приведены цифры: 3,2-10-5%, 1*10-3% и 2,4*10-3%. Но и последние цифры занижены: африканские месторождения, открытые в последние годы, сюда не вошли. Тем не менее подсчитано, что из минералов уже известных месторождений можно выплавить примерно 1,5 млн. т металлического ниобия.
Ниобий сверхпроводник — Знаешь как
Удивительное явление сверхпроводимости, когда при понижении температуры проводника в нем происходит скачкообразное исчезновение электрического сопротивления, впервые наблюдал голландский физик Г. Камерлинг-Оннес в 1911 г. Первым сверхпроводником оказалась ртуть, но не ей, а ниобию и некоторым интерметаллическим соединениям ниобия суждено было стать первыми технически важными сверхпроводящими материалами. Практически важны две характеристики сверхпроводников: величина критической температуры, при которой происходит переход в состояние сверхпроводимости, и критического магнитного поля (еще Камерлинг-Оннес наблюдал утрату сверхпроводником сверхпроводимости при воздействии на него достаточно сильного магнитного поля).Сейчас известно уже больше 2000 сверхпроводящих металлов, материалов и соединений, но подавляющее их большинство не пришло и видимо никогда не придет в технику либо из-за чрезвычайно низких величин критических параметров, о которых сказано выше, либо из-за неприемлемых технологических характеристик. Среди сверхпроводников, имеющих практическое значение, особенно популярны ниобий-титановые сплавы. Из них изготовлено большинство работающих в наши дни сверхпроводящих магнитов. Они пластичны, из них можно делать технические устройства и проводники сложных форм.
Как материал ленточных сверхпроводников ценен сплав ниобия с оловом Nb3Sn, станнид ниобия, открытый еще в 1954 г. Сверхпроводящий токонесущий элемент — шина со 150 ООО жил — из станнид а ниобия изготовлен в нашей стране. Подобные многожильные сверхпроводящие проводники намереваются использовать в новых термоядерных установках «Токомак-15».
Интерес для практики представляет еще одно интерметаллическое соединение ниобия — Nb3Ge. У тонкой пленки такого состава рекордно высокая критическая температура — 24,3 К. Правда, у литого Nb3Ge критическая температура — всего 6 К, да и технология приготовления сверхпроводящих элементов из этого материала достаточно сложна.
Довольно высокими значениями критической температуры обладают тройные сплавы: ниобий—германий—алюминий, а также некоторые интерметаллические соединения ванадия. И все же именно с ниобием и его соединениями связаны наибольшие надежды специалистов по сверхпроводникам.
Статья на тему Ниобий сверхпроводникНиобий — Мегаэнциклопедия Кирилла и Мефодия — статья
Нио́бий (лат. Niobium, от имени Ниобы), Nb (читается «ниобий»), химический элемент с атомным номером 41, атомная масса 92, 9064. Природный ниобий состоит из одного стабильного изотопа 93Nb. Конфигурация двух внешних электронных слоев 4s2p6d45s1. Cтепени окисления +5, +4, +3, +2 и +1 (валентности V IV, III, II и I). Расположен в группе VВ, в 5 периоде периодической системы элементов. Радиус атома 0, 145 нм, радиус иона Nb5+ — от 0, 062 нм (координационное число 4) до 0, 088 нм (8), иона Nb4+ — от 0, 082 до 0, 092 нм, иона Nb3+ — 0, 086 нм, иона Nb2+— 0, 085 нм. Энергии последовательной ионизации — 6, 88, 14, 32, 25, 05, 38, 3 и 50, 6 эВ. Работа выхода электронов 4, 01 эВ. Электроотрицательность по Полингу 1, 6.Открыт в 1801 Ч. Хатчетом. Исследуя черный минерал, присланный из Америки, он выделил оксид нового элемента, который он назвал колумбием, а содержащий его минерал — колумбитом. Через год из того же минерала А. Г. Экеберг выделил еще один оксид, который назвал танталом. Свойства колумбия и Ta были очень близки, и их очень долго рассматривали как один элемент. В 1844 Г. Розе доказал, что это два разных элемента. Он сохранил название тантал, а другой назвал ниобий. Только в 1950 ИЮПАК (Всемирная организация химиков) окончательно присвоила элементу №41 название ниобий. Металлический Nb первым получил в 1866 К. Бломстранд.Содержание в земной коре 2·10-3% по массе. В свободном виде ниобий не встречается, в природе сопутствует танталу. Из руд наиболее важны колумбит-танталит (Fe, Mn)(Nb, Ta)2O6, пирохлор и лопарит.Около 95% Nb получают из пирохлоровых, колумбит-танталитовых и лопаритовых руд. Руды обогащают гравитационнымми методами и флотацией. Концентраты с содержанием Nb2O5 до 60% перерабатывают до феррониобия (сплава железа и ниобия), чистого Nb2O5 или NbCl5. Восстанавливают ниобий из его оксида, фторида или хлорида алюмино- или карботермией. Особо чистый ниобий получают высокотемпературным восстановлением летучего NbCl5 водородом.Полученный порошок ниобия брикетируют, спекают в вакууме в электродуговых или электроннолучевых печах.
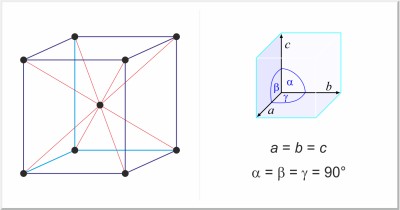
Ниобий — блестящий серебристо-серый металл с кубической объемно центрированной кристаллической решеткой типа α-Fe, а = 0, 3294 нм. Температура плавления 2477°C, кипения 4760°C, плотность 8, 57 кг/дм3.
Химически ниобий довольно устойчив. При прокаливании на воздухе окисляется до Nb2О5. Для этого оксида описано около 10 кристаллических модификаций. При обычном давлении стабильна β-форма Nb2О5. При сплавлении Nb2О5 с различными оксидами получают ниобаты: Ti2Nb10О29, FeNb49О124. Ниобаты могут рассматриваться как соли гипотетических ниобиевых кислот. Они делятся на метаниобаты MNbO3, ортониобаты M3NbO4, пирониобаты M4Nb2O7 или полиниобаты M2O·nNb2O5 (M — однозарядный катион, а n = 2-12). Известны ниобаты двух- и трехзарядных катионов. Ниобаты реагируют с HF, расплавами гидрофторидов щелочных металлов (KHF2) и аммония. Некоторые ниобаты с высоким отношением M2O/Nb2O5 гидролизуются:6Na3NbO4 + 5H2O = Na8Nb6O19 + 10NaOH
Ниобий образует NbО2, NbО и ряд оксидов, промежуточных между NbО2, 42 и NbО2, 50 и близких по структуре к β-форме Nb2О5.
С галогенами Nb образует пентагалогениды NbHal5, тетрагалогениды NbHal4 и фазы NbHal2, 67-NbHal3+x, в которых имеются группировки Nb3 или Nb2. Пентагалогениды ниобия легко гидролизуются водой. Температуры плавления пентахлорида, пентабромида и пентаиодида ниобия — 205, 267, 5 и 310°C. Выше 200-250°C эти пентагалогениды летучи.В присутствии паров воды и кислорода NbCl5 и NbBr5 образуют оксигалогениды NbOCl3 (NbOBr3) — рыхлые ватообразные вещества.
При взаимодействии Nb и графита образуются карбиды Nb2C и NbC, твердые жаропрочные соединения. В системе Nb — N существуют несколько фаз переменного состава и нитриды Nb2N и NbN. Сходным образом ведет себя Nb в системах с фосфором и мышьяком. При взаимодействии Nb с серой получены сульфиды: NbS, NbS2 и NbS3. Синтезированы двойные фториды Nb и K (Na) — K2[NbF7].
50% производимого ниобия используется для микролегирования сталей, 20-30% — для получения нержавеющих и жаропрочных сплавов. Интерметаллиды ниобия (Nb3Sn и Nb3Ge) применяют при изготовлении соленоидов сверхпроводящих устройств. Нитрид ниобия NbN используют при изготовлении мишеней передающих телевизионных трубок. Оксиды ниобия — компоненты огнеупорных материалов, керметов, стекол с высокими коэффициентами преломления. Двойные фториды — при выделении ниобия из природного сырья, при производстве металлического ниобия. Ниобаты используются в акусто- и оптоэлектронике, как лазерные материалы.
Соединения ниобия ядовиты. ПДК ниобия в воде 0, 01 мг/л.
- Горощенко Я. Г. Химия ниобия и тантала. Киев, 1965.
- Фейрбротер Ф. Химия ниобия и тантала. / Пер. с англ. М., 1968.
Ниобий – Информация об элементе, свойства и использование
Расшифровка:
Химия в ее элементе: ниобий
(Promo)
Вы слушаете Химию в ее элементе, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Meera Senthilingam
На этой неделе элемент с некоторым противоречием, поскольку его тезка плачет, но его химия бесстрастна.Вот Джон Стид:
Джон Стид
Ниобий. Какое вызывающее воспоминания имя! Элемент был назван в честь Ниобы, дочери Тантала в греческой мифологии. В честь Тантала также назван элемент; тантал, который находится непосредственно под ниобием в периодической таблице. Ниобе пришлось нелегко. Она была достаточно глупа, чтобы предположить, что вместо поклонения невидимым богам было бы неплохо ценить настоящих людей для разнообразия. Греческие боги не очень прощали подобного рода высокомерие и в качестве наказания убили всех или, по крайней мере, большую часть ее двенадцати детей; ниобиды.В результате Ниоба бежала на гору Сипил и была обращена в камень. По сей день в Эгейском регионе Турции существует скальное образование, называемое «плачущей скалой», которое напоминает женское лицо, предположительно, Ниобе. Вода просачивается сквозь пористый известняк плачущей скалы и, как говорят, напоминает непрекращающиеся слезы Ниобы о судьбе ниобидов. Очевидное окаменение Ниобы и последующее просачивание минеральной воды через скалу напоминает о реальном химическом явлении окаменевших колодцев, подобных тому, что находится в пещере Матери Шиптон в Кнаресборо в Северном Йоркшире.Испарение насыщенной солью воды и последующее отложение минералов означает, что эти колодцы действительно могут превращать обычные предметы в камень.
Размещение Ниобы и ее отца Тантала рядом друг с другом в таблице Менделеева не случайно. И ниобий, и тантал вместе находятся в минерале колумбите, смешанном оксиде, который также содержит железо и марганец, и они имеют схожие химические и физические свойства. Фактически, ниобий изначально был назван колумбием в честь Колумбии из-за его открытия в минерале, присланном из Америки в 1801 году.Следующие полвека были свидетелями большой путаницы в отношении того, какие именно возможные новые танталоподобные элементы присутствуют в этих видах минералов, и первоначально некоторые дети Тантала были увековечены как элементы с такими названиями, как пелопий, ильмений и диан. В конце концов выжил только ниобий. В США ниобий назывался колумбий, символ Cb, вплоть до его официального крещения Международным союзом чистой и прикладной химии в 1950 году. Последняя статья, опубликованная Американским химическим обществом, в которой упоминается колумбий, датируется 1953 годом. Неинтересное название «Фотометрическое определение колумбия, вольфрама и тантала в нержавеющих сталях».Как мы увидим, эта статья действительно намекает на одно из основных применений ниобия. В Каталоге чистых химикатов Олдрича 2010 года до сих пор есть подзаголовок Columbium в качестве пояснительного подзаголовка для всех сбитых с толку американцев.
На самом деле, в отличие от отважной Ниобы, ниобий – довольно бесстрастный элемент. Он даже не реагирует с очень окисляющей кислотой aqua regia и, как тантал, инертен к жидкостям организма. Эта бесстрастность в сочетании с тенденцией к окрашиванию при анодировании означает, что он иногда используется в ювелирных изделиях и чеканке монет.В результате процесса анодирования образуется тонкий оксидный слой, который за счет дифракции света создает ряд постоянных цветов. С 2003 года в Австрии выпускается серия серебряно-ниобиевых монет евро с ниобиевым центром, окрашенным в синий, зеленый, коричневый, фиолетовый, фиолетовый или желтый цвета. Как и более известный вольфрам, ниобий также образует ряд разноцветных оксидных «бронз» от темно-синего до красного в зависимости от степени восстановления.
Однако, пожалуй, самая захватывающая роль ниобия в наши дни – это сверхпроводящие волокна из ниобий-титанового сплава.Ниобий-титан является сверхпроводником при температурах ниже десяти Кельвинов и используется в ряде крупных сверхпроводящих магнитов, таких как ускоритель Тэватрон в Фермилабе и совсем недавно Большой адронный коллайдер, где ниобийсодержащие магниты охлаждаются до 1,9 Кельвина и работают при магнитные поля до 8,3 Тесла. Вы также можете найти его в сверхпроводящих магнитах в больничных МРТ сканерах.
Ниобий – полезный металл в ряде специальных сплавов. В суммах от 0.1% оказывает значительное упрочняющее действие на сталь, что делает его пригодным, например, для использования в газопроводах. Он также используется в некоторых термостойких суперсплавах, используемых для деталей двигателей в аэрокосмической промышленности.
Ниобий почти стал в буквальном смысле элементом домашнего обихода из-за его ранней роли в качестве нити накаливания в лампах накаливания. Его бесстрастность и высокая температура плавления 2468 градусов по Цельсию подходили для этого применения, но он был быстро заменен на еще более плавящийся вольфрам.Ниобий также является довольно плотным элементом, и именно эта плотность может объяснить его кажущуюся редкость. Имея всего двадцать частей на миллион, это 33 rd в зале славы самых обычных элементов земной коры. Это удивительно низкое значение могло быть результатом «недостающего» ниобия, оседающего в ядре Земли во время формирования планеты.
В литературе по неорганической химии, посвященной химии ниобия, вы не увидите большого количества публикаций, хотя этот металл не особенно дорогой, так что, возможно, все это изменится в эту кредитную эпоху.Классическая статья – это обзор химии алкилиденовых комплексов ниобия и тантала 1979 года Дика Шрока – соединений с двойной связью между металлом и углеродом. В этой статье содержится изображение одного из моих любимых металлоорганических соединений – на самом деле соединения тантала – в котором металл зажат между двумя органическими кольцами и связан с двумя восхитительно простыми углеродными фрагментами; CH 2 и CH 3 . Эта структура позволяет получить широкий спектр катализаторов на основе металлов сэндвич-типа.
С точки зрения пин-апов молекул ниобия, одним из самых элегантных является очень симметричный кластер, образованный октаэдром из шести ионов ниобия и восемнадцати хлоридов. Ион, который подчеркивает склонность ниобия к образованию больших экзотических мультиметаллических кластеров с галогенидами и оксидами.
Когда вы смотрите на огромную массу периодической таблицы Менделеева, ваш глаз легко потеряется в полосе экзотических и сбивающих с толку переходных металлов где-то около провала в середине.Я надеюсь, что вы позволите примеру ниобия напомнить вам, что плакать не о чем. Тонкости этих элементов не слишком пугающие, и проявив немного творчества, вы можете породить некую химию, которой могут гордиться даже мстительные древние боги.
Meera Senthilingham
Обеспечение цвета, сверхпроводящие способности и молекулярные пин-апы – определенно то, чем боги могут гордиться. Это был Джон Стид из Даремского университета с дразнящей химией элемента ниобия.
Теперь, на следующей неделе, элемент, основатель которого явно не верил в оценку рисков.
Lars Öhrström
Часто после более зрелищных демонстраций химии ученый на сцене предупреждает публику «не пробуйте это дома». Одним из тех, кто не прислушался к таким предупреждениям, был шведский химик Йонс Якоб Берцелиус. Вместо этого он и его сотрудники провели множество новаторских экспериментов на кухне его квартиры на углу Ниброгатан и Риддаргатан в Стокгольме.Например, в 1815 году Берцелиус выделил новый элемент из минерала, присланного ему из шведского шахтерского городка Фалун, и назвал его торий в честь скандинавского бога грома Тора. Только чтобы через несколько лет понять, что он ошибался и что то, что он считал новым элементом, на самом деле был фосфатом иттрия.
Однако в 1828 году, который к тому времени уже давно известен во всем мире и приписывают открытие трех других элементов, он получил странный образец минерала от преподобного Ханса Эсмарка из Норвегии. В своей новой лаборатории в Шведской королевской академии наук Берцелиус выделил еще один элемент – то, что мы теперь называем торием.
Meera Senthilingham
И теперь вы знаете об открытии. Присоединяйтесь к Ларсу Эрстрему из Chalmers tekniska högskola в Швеции, чтобы узнать о химии и применении тория в химии в его элементе на следующей неделе. А пока я Мира Сентилингма и благодарю вас за внимание.
(промо)
(конец промо)
,Ниобий | химический элемент | Britannica
Ниобий (Nb) , химический элемент, тугоплавкий металл группы 5 (Vb) периодической таблицы, используемый в сплавах, инструментах и штампах, а также в сверхпроводящих магнитах. Ниобий тесно связан с танталом в рудах и свойствах.
Британская викторина
118 символов и названий периодической таблицы викторины
H
Из-за большого химического сходства ниобия и тантала, установить индивидуальные идентичности этих двух элементов было очень трудно.Ниобий был впервые обнаружен (1801 г.) в образце руды из Коннектикута английским химиком Чарльзом Хэтчеттом, который назвал элемент колумбий в честь страны его происхождения, причем Колумбия была синонимом Соединенных Штатов. В 1844 году немецкий химик Генрих Роуз открыл то, что он считал новым элементом, встречающимся вместе с танталом, и назвал его ниобием в честь Ниобы, мифологической богини, дочери Тантала. После серьезных споров было решено, что колумбий и ниобий – это один и тот же элемент.В конце концов (около 1950 г.) было достигнуто международное соглашение о принятии названия ниобий, хотя колумбий сохранился в металлургической промышленности США.
Ниобия примерно в 10 раз больше в земной коре, чем тантала. Ниобий, которого в земной коре больше, чем свинца, и меньше, чем меди, встречается в рассредоточенном виде, за исключением относительно небольшого количества минералов. Среди этих минералов главным промышленным источником является серия колумбит-танталит, в которой колумбит (FeNb 2 O 6 ) и танталит (FeTa 2 O 6 ) встречаются в очень различных соотношениях.Пирохлор, ниобат кальция-натрия, также является основным коммерческим источником. Природный ниобий полностью состоит из стабильного изотопа ниобия-93.
Технологии производства ниобия сложны, основная проблема заключается в его отделении от тантала. При необходимости отделение тантала осуществляется экстракцией растворителем в жидко-жидкостном процессе; затем ниобий осаждают и обжигают до пятиокиси ниобия, которая восстанавливается до порошка ниобия с помощью процессов металлотермии и гидрирования.Порошок уплотняют и очищают электронно-лучевым плавлением. Для уплотнения также используется вакуумное спекание порошка. Ниобий также можно получить либо электролизом конденсированных солей, либо восстановлением фторокомплексов с очень реакционноспособным металлом, таким как натрий. (Для получения информации о добыче, извлечении и применении ниобия, см. переработка ниобия.)
Получите эксклюзивный доступ к контенту из нашего 1768 First Edition с подпиской. Подпишитесь сегодняЧистый металл мягкий и пластичный; он выглядит как сталь, а при полировке – как платина.Несмотря на превосходную коррозионную стойкость, ниобий подвержен окислению при температуре выше 400 ° C (750 ° F). Ниобий лучше всего растворить в смеси азотной и плавиковой кислот. Полностью смешиваемый с железом, он добавляется в виде феррониобия в некоторые нержавеющие стали для обеспечения стабильности при сварке или нагревании. Ниобий используется в качестве основного легирующего элемента в суперсплавах на основе никеля и в качестве второстепенной, но важной добавки к высокопрочным низколегированным сталям. Из-за его совместимости с ураном, устойчивости к коррозии от расплавленных щелочно-металлических теплоносителей и низкого поперечного сечения тепловых нейтронов он использовался отдельно или в сплаве с цирконием в оболочках активной зоны ядерных реакторов.Твердые сплавы, используемые в штампах и режущих инструментах для горячего прессования, становятся более твердыми и устойчивыми к ударам и эрозии из-за присутствия ниобия. Ниобий используется при создании криогенных (низкотемпературных) электронных устройств с низким энергопотреблением. Ниобий-олово (Nb 3 Sn) является сверхпроводником ниже 18,45 Кельвина (K), а сам ниобий – ниже 9,15 К.
Соединения ниобия имеют относительно второстепенное значение. Те, что встречаются в природе, имеют степень окисления +5, но были получены соединения с более низкими степенями окисления (от +2 до +4).Четырехзарядный ниобий, например, в форме карбида NbC, используется для изготовления цементированных карбидов.
| атомный номер | 41 |
|---|---|
| атомный вес | 92.906 |
| точка плавления | 2468 ° C (4474 ° F) |
| точка кипения | 4927 ° C (8,901 ° F) |
| удельный вес | 8,57 (20 ° C) |
| степени окисления | +2, +3, +4, +5 |
| электронная конфигурация. | [Kr] 4 d 4 5 s 1 |
XPS Интерпретация ниобия
Первичная область XPS: Nb3d
Перекрывающиеся области: Cl2p
Энергии связи общих химических состояний:
| Химическое состояние | Энергия связи Nb3d 5/2 / эВ |
|---|---|
| Nb металл | 202,4 |
| Nb 2 O 5 | 207,1 |
Nb 2 O 5 заряд относительно C1s в 284.8эВ
Экспериментальная информация
НЕТ
Интерпретация спектров XPS
- Металл
- Nb дает асимметричные формы пиков Nb3d, но оксиды Nb имеют симметричные формы пиков. Область
- Nb3d имеет значительно расщепленные спин-орбитальные компоненты (Δ = 2,78 эВ).
- Для оксидов Nb полуширина пиков Nb3d такая же, для металлического Nb пик Nb3d 3/2 намного шире, чем пик Nb3d 5/2 .
Символ: Nb
Дата открытия: 1801
Происхождение имени: Греческое Niobe
Внешний вид: серый металлик
Открыватель: Charles Hatchett
Получено от: columbite
Точка плавления: 2750 К
Точка кипения: 5017 К
Плотность [кг / м3]: 8570
Молярный объем: 10.83 × 10-6 м3 / моль
Протоны / электроны: 41
Нейтроны: 52
Структура оболочки: 2,8,18,12,1
Электронная конфигурация: [Kr] 4d45s1
Окисление Состояние: 5,3
Кристаллическая структура: Центрированное кубическое тело
Обычно блестящий серый ниобий при контакте с воздухом при комнатной температуре приобретает голубоватый оттенок. Этот цвет делает ниобий привлекательным для использования в украшениях для пирсинга. По химическому составу ниобий очень близок к танталу.Ниобий входит в состав некоторых нержавеющих сталей и представляет собой сплав других цветных металлов, таких как те, которые используются при строительстве трубопроводов. Этот элемент является сверхпроводником типа II, что означает, что он остается сверхпроводником даже в сильных магнитных полях. Ниобий получил свое название от смертной Ниобы из греческой мифологии, которая обратилась в камень после того, как оплакивала потерю своих детей и мужа.
Вернуться к таблице элементов
.EniG. Периодическая таблица элементов
ПЕРЕХОДНЫЙ ЭЛЕМЕНТ: ВАНАДИЕВАЯ ГРУППА
| Атомный номер: | 41 |
| Групповые номера: | 5 |
| Период: | 5 |
| Электронная конфигурация: | [Kr] 4d 4 5s 1 |
| Формальный номер степени окисления: | +3 +5 |
| Электроотрицательность: | 1.6 |
| Атомный радиус / пм: | 142,9 |
| Относительная атомная масса: | 92.906 37 (2) |
Ниобий был открыт Чарльзом Хэтчеттом (Великобритания) в 1801 году. Название происходит от греческого слова Niobe , означающего дочь Тантала в греческой мифологии (тантал тесно связан с ниобием в периодической таблице). Это блестящий белый, мягкий, пластичный металл. Открытые поверхности образуют оксидную пленку.Ниобий встречается в минерале колумбите. Он используется в сплавах нержавеющей стали для ядерных реакторов, реактивных двигателей и ракет. Он используется в виде сплава с железом и никелем. Он может использоваться в ядерных реакторах и известен своей сверхпроводимостью при легировании оловом, алюминием или цирконием. Цена на кусочки ниобия с чистотой 99,8% составляет 47,20 евро за 100 г.
| Плотность / г дм -3 : | 8570 | (293 K) |
| 7830 | (м.п.) | |
| Молярный объем / см 3 моль -1 : | 10,84 | (293 K) |
| 11,87 | (т.пл.) | |
| Удельное электрическое сопротивление / мкОм · см: | 12,5 | (20 ° C) |
| Теплопроводность / Вт · м -1 K -1 : | 53,7 |
| Точка плавления / ° C: | 2477 |
| Точка кипения / ° C: | 4744 |
| Теплота плавления / кДж моль -1 : | 27.2 |
| Теплота испарения / кДж моль -1 : | 680,19 |
| Теплота распыления / кДж моль -1 : | 722,819 |
| Энергия первой ионизации / кДж моль -1 : | 652,13 |
| Энергия второй ионизации / кДж моль -1 : | 1381,68 |
| Третья энергия ионизации / кДж моль -1 : | 2416.01 |
| в атмосфере / частей на миллион: | – |
| в земной коре / г / т: | 11 |
| в океанах / частей на миллион: | 0,00001 |
| Кристаллическая структура: | объемно-кубическая |
| Размеры элементарной ячейки / пм: | a = 329,86 |
| Космическая группа: | Im3m |
| Изотоп | Относительная атомная масса | Массовый процент (%) |
|---|---|---|
| 93 Nb | 92.906378 (2) | 100 |
| Сбалансированная полуреакция | E o / V | |
|---|---|---|
| Nb V + 2e – → Nb III | – 0,373 | (6 моль дм -3 H 2 SO 4 ) |
| Nb 3+ + 3e – → Nb (s) | – 1,1 | |
| Nb 2 O 5 (s) + 10H + + 10e – → 2Nb (s) + 5H 2 O | – 0.65 | |
| NbO 3+ + 2H + + 2e – → Nb 3+ + H 2 O | – 0,343 | |
| NbO (SO 4 ) 2 – + 2H + + 2e – → Nb 3+ + H 2 O + 2SO 4 2- | – 0,1 | |
| NbO (SO 4 ) 2 – + 2H + + 5e – → Nb (s) + H 2 O + 2SO 4 2- | – 0.63 |

