Образование ржавчины какое это явление – Образование ржавчины на гвозде, это химическое или физическое явление и почему?
alexxlab | 31.07.2019 | 0 | Разное
Ржавление железа образование ржавчины – Справочник химика 21
До сих пор при разработке рецептуры травильных паст основывались на немногочисленных качественных опытах. Было установлено, что при введении в пасту какой-либо одной кислоты (например, соляной, серной или фосфорной) применение травильных паст дает неудовлетворительные результаты. Так, поверхность металла, очищенного пастой, которая содержит только соляную кислоту, ржавеет настолько быстро, что рабочие, проводящие очистку, не успевают нанести на металл пассивирующий состав после удаления травильной пасты. Паста, содержащая только серную кислоту, растворяет ржавчину вдвое медленнее, чем пасты на основе соляной кислоты, и также вызывает интенсивное ржавление металла. Паста, содержаща5Г фосфорную кислоту, препятствует ржавлению металла вследствие образования на его поверхности слоя фосфата железа, однако растворение ржавчины в этом случае протекает втрое медленнее, чем при использовании пасты с соляной кислотой. [c.106]Всякому известно, что железо во влажном воздухе ржавеет и что, накаленное на воздухе, оно покрывается окалиною (окислом), которая, как ржавчина, представляет землистое вещество, подобное железным рудам, встречающимся в земле и служащим для добычи железа. Взвешивая железо до и после образования окалины или ржавчины, можно убедиться в том, что вес металла при этом увеличивается [12][ егко убедиться и в том, что это увеличение веса происходит, как показал Лавуазье, на счет той части воздуха, которая называется кислородом и которая служит для горения. Действительно, в безвоздушном пространстве и в газах, не содержащих кислорода воздуха, напр., в водороде и азоте, ни ржавления, ни образования окалины не происходит. Если бы взвешивание не производилось, можно было бы совершенно упустить из виду участие кислорода воздуха при переходе железа в землистые вещества, ему отвечающие, что до Лавуазье и упускали из виду, почему и не понимали сущности подобных явлений. При помощи закона вечности вещества очевидно из прибыли веса, что окалина сложнее железа и что при ее образовании происходит реакция соединения. На это химическое превращение можно было смотреть совершенно неправильно, считая, напр., окалину более простым телом, чем железо, и объясняя образование окалины удалением чего-либо из железа. Так в самом деле глядели до Лавуазье, считая железо содержащим особое неизвестное вещество, названное флогистоном, а окалину — лишенною этого воображаемого вещества.
Гидрат окиси железа Ре(ОН)з оранжевого цвета и по сравнению с Fe(OH)2 имеет гораздо меньшую растворимость (порядка 4,8- 10 г/л). Важно отметить, что вторичное образование нерастворимых продуктов коррозии железа Fe(0H)2 и Ре(ОН)з не тормозит в сколько-нибудь заметной степени процесс электрохимического ржавления. Образование ржавчины идет не непосредственно на анодных участках, а в коррозионном растворе в непосредственной близости от корродирующей поверхности. Поэтому адгезия к поверхности и защитные свойства ржавчины (в отличие от окалины) гораздо более слабые. По этой причине скорость коррозии железа в дистиллированной воде при доступе кислорода, а также в ряде природных вод, и в том числе в морской воде, практически мало меняется со временем.
Для защиты сталей от коррозии приобретают значение и принципиально другие методы. Один из них, как это ни парадоксально, состоит в том, что для него требуется не уменьшение ржавления путем образования защитного слоя, а совсем наоборот. В этом методе состав ржавчины регулируется таким образом, что образуется не пресловутый рыхлый оксид железа, способствующий дальнейшему разрушению материала, а полностью устойчивый к атмосферным воздействиям плотный слой. Иначе говоря, получается ржавчина, предохраняющая металл от дальнейшего окисления. В течение двух-трех лет ржавчина вообще прекращает образовываться. Первые сорта стали, обладающей таким замечательным свойством, содержали среди прочих компонентов 0,7-0,15% фосфора, 0,25-0,55% меди, 0,50-1,25% хрома и 0,65% никеля. В настоящее время в распоряжении имеется уже большое количество подобных сталей-свыше 50 сортов. В ГДР производство сталей-носителей коррозии (КТ8) началось с 1965 г. Новейшие типы базируются на никелевых сплавах. КТ8, как и обычные стали, можно формовать и сваривать, а стоимость их на 10-30% выше обычных. Однако такие материалы оправдьшают себя при сооружении конструкций, поскольку отпадает необходимость в дополнительной защите от коррозии. Из них можно делать вагоны, трубопроводы, цистерны и контейнеры, строительные машины, проволочные сетки одним словом, они представляют большой интерес везде, где необходима устойчивость к атмосферным воздействиям. Особенно высоки их шансы в высотном жилищном и промышленном строительстве, где благодаря им могут быть существенно снижены затраты на борьбу с коррозией. Пока еще в ГДР из КТ8 изготавливают только опоры воздушных линий электропередач, силосные башни, эстакады для труб и некоторые другие объекты. Ожидается,
Потенциалы железа и алюминия, контактирующих в электролите, различаются несущественно и могут изменяться при образовании пленок на их поверхностях. В связи с этим анодная защита стали алюминием незначительна, а в некоторых случаях сталь даже первоначально служит анодом по отношению к алюминию и, таким образом, сама подвергается коррозии. По этим причинам большая несплошность алюминиевых покрытий не может быть допущена во избежание появления ржавчины на основном слое стали. Однако следует отметить, что ржавления стали в мельчайших несплошностях покрытия или на срезанных кромках алюминированной стали почти не происходит (вероятно, из-за прекращения анодной реакции под действием поверхностных продуктов коррозии). [c.74]
Количественное соотношение образовавшихся продуктов коррозии может быть различным в зависимости от условий протекания реакций. Образование гидратированных оксидов железа на поверхности железа или железоуглеродистых сплавов обычно называется ржавлением, а продукты коррозии -ржавчиной. [c.38]
Образование гидратированных окислов железа на поверхности железа или стали обычно, называется ржавлением, а вышеописанные продукты коррозии — ржавчиной. [c.23]
Сталь. Ржавление. Ржавчина состоит из гидроокисей и безводных окислов железа разной степени окисления. При образовании в промышленной атмосфере она содержит также сульфат двухвалентного железа. Испытания, проведенные Майном , показали, что стальные образцы, экспонированные вне помещения в зимнее время, находятся при последующей окраске в худшем состоянии, чем образцы, экспонированные в д
www.chem21.info
Образование – ржавчина – Большая Энциклопедия Нефти и Газа, статья, страница 1
Образование – ржавчина
Cтраница 1
Образование ржавчины происходит в растворе в непосредственной близости от корродирующей поверхности. Ржавчина покрывает металл рыхлым слоем. Она обладает плохим сцеплением с металлической поверхностью и поэтому плохо защищает железо от коррозии. [1]
Образование ржавчины еще незаметно. Субактивное состояние характеризуется тем, что на поверхности металла имеется пленка, но пленка не гомогенная; в ней имеются поры, разрывы, вследствие чего возникают гальванические элементы и железо ржавеет. Субактивное состояние при воздействии окислителя на металл может смениться субпассивным, которое характеризуется наличием на поверхности металла пор с малыми размерами. [2]
Поскольку образование ржавчины на поверхности железа или углеродистой стали есть процесс взаимодействия ионизированного железа с водой терминологически в дисциплине Водоснабжение слой ржавчины принято называть коррозионными отложениями. [3]
Возможность образования ржавчины в полых профилях предотвращается путем заполнения полостей противокоррозионной мастикой и последующим их закупориванием, чем исключается возможность воздухообмена внутри лонжеронов. [4]
Жидкость должна предотвращать образование ржавчины. В гидравлических системах может присутствовать некоторое количество влаги, которая в присутствии кислорода вызывает ржавление железа. Наиболее уязвимы для ржавчины элементы гидравлических систем, неполностью погруженные в жидкость; в частности, ржавчину нередко можно обнаружить на внутренней поверхности резервуаров выше уровня жидкости. Поражение гидравлических систем ржавчиной крайне нежелательно, так как продукты коррозии способны служить катализатором, ускоряющим окисление жидкости, а также могут являться абразивами, вызывающими сильный износ и разрушение элементов гидравлической системы. Ржавчина сама по себе или вместе с продуктами окисления и другими загрязнениями может давать осадки, которые мешают работе клапанов, насосов, гидромоторов и др. и нередко являются причиной выхода системы из строя. [5]
Предлагается метод подавления образования ржавчины на нефтеперерабатывающей установке перед ее запуском, включающий такие операции, как циркуляцию газа, содержащего сульфидирующие соединения, нагрев до рабочей температуры зоны, где происходит конверсия углеводорода, и удаление свободно отслаивающейся ржавчины. Обработка катализаторных колонн и штуцеров заключается в удалении очагов ржавчины, пыли и шламов и пассивации металлической поверхности перед пуском установки. [6]
В связи с этим образование ржавчины происходит на некотором расстоянии от поверхности металла и торможение реакции не происходит. [7]
Внутренняя защита газопроводов предупреждает образование ржавчины, превращающейся в тонкую пыль. Для внутренней изоляции газопроводов не применяют битумы из-за возможности их растворения некоторыми составляющими газа. При транспортировании сухого газа используют покрытие на льняном масле, а в случае влажного газа – покрытие из свинцового сурика по фос-фатированной трубе. [8]
Оцинкованная поверхность практически исключает образование ржавчины. Покраску оцинкованной поверхности можно производить по мере необходимости в удобное время, так как цинк хорошо защищает от коррозии и без краски, в то время как нарушение лакокрасочного покрытия требует немедленного его восстановления. [9]
Оцинкованная поверхность практически исключает образование ржавчины. Окраску оцинкованных баллонов можно производить в любое время, так как цинк хорошо защищает поверхность от коррозии и без окраски, в то время как при нарушении лакокрасочного покрытия необходимо немедленное его восстановление. [10]
К химическим явлениям относятся: образование ржавчины на металлах под влиянием влаги или кислорода воздуха; гниение растительных и животных остатков, а также получение кислот, щелочей и солей. [11]
После работы для предохранения от образования ржавчины молотки следует опускать на ночь в керосин. [13]
В испарителях, обогреваемых водяным паром, образование ржавчины на трубах на 30 – 35 / 0 уменьшает величину коэфициента теплопередачи. [14]
Против ржавления – для защиты металла от образования ржавчины в циркуляционных системах в присутствии воды. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
помогите ответить на вопросы по химии!!!!
1)Ржавление, коррозия. Явление относится к химическим, так как образуется новое вещество – ржавчина. 2Процесс горение – химический процесс, так как в результате образуются новые вещества (продукты горения) . Примеры: горение метана применяют в быту для приготовления пищи, при движении автомобиля происходит горение бензина в двигателях внутреннего сгорания. 3)Синтетические моющие средства: стиральные порошки, пасты, мыло. Средства гигиены: шампуни, гели. Посуда, упаковочный материал, предметы мебели, созданные из пластика. 4)Химические реакции: сгорание бензина в двигателях внутреннего сгорания. Примеры веществ: различные металлы и сплавы, пластики, резина, стекло.
1. точно химическое. не помню почему, но нам на уроке это пример приводили и я запомнила 2. потому что выделяется тепло и свет
1) коррозия, к химическому. 2) горение есть окисление вещества с выделением тепла, например Ch4+O2=CO2+h3O+Q(тепло) 3)Моющие средства 4) Алюминий, резина, полимеры. горение бензина: 2C8h28 + 25O2 + 94N2 -> 16CO2 +18h3O + 94N2 + Q(10124кДж)
Посмотри как некоторые тужатся тебе “помочь”. Попробуй ответить сама, что знаешь, тогда легко можно будет дополнить, то чего не учла. А так какая это помощь? Это эксплуатация людей в Интернете. ЭКСПЛУАТАТОР …
touch.otvet.mail.ru
РЖАВЧИНА – это… Что такое РЖАВЧИНА?
РЖАВЧИНА — РЖАВЧИНА, ржавчины, мн. нет, жен. 1. Краснобурый налет на поверхности железа, образующийся вследствие медленного окисления его в воздухе. Ржавчина ест железо. На машинных частях ржавчина недопустима. 2. Места на болотах, покрытые бурой водой. 3.… … Толковый словарь Ушакова
ржавчина — коррозия; пятно, ржа, слой, налет, пленка, тля Словарь русских синонимов. ржавчина ржа (устар. и прост.) Словарь синонимов русского языка. Практический справочник. М.: Русский язык. З. Е. Александрова. 2011 … Словарь синонимов
РЖАВЧИНА — (её удаление). Металлические изделия смачивают керосином (мелкие изделия погружают в него), оставляют в таком виде на несколько часов, затем вытирают тряпкой. При чистке машинных частей к керосину добавляют 10% (по весу) парафина; применяют также … Краткая энциклопедия домашнего хозяйства
Ржавчина — – продукты коррозии железа и его сплавов, образующиеся при электрохимической коррозии и состоящие преимущественно из окислов. [ГОСТ 5272 68] Ржавчина – продукты коррозии стали, стальной арматуры, образующиеся при электрохимической… … Энциклопедия терминов, определений и пояснений строительных материалов
РЖАВЧИНА — см. Ржавчина поражает листья и стебли. На нижней стороне листьев и на стеблях появляются сперва бурые, потом темно коричневые образования (пустулы) … Энциклопедия семян. Овощные культуры
РЖАВЧИНА — слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии, вызванной действием кислорода и влаги. См. также Коррозия … Большой Энциклопедический словарь
Ржавчина — Ржавчина, красно бурый налет на железе, образующийся в результате окисления и ведущий к разрушению металла. В Иез 24:6,11 и след. Р. (евр. хэла; в Синод. пер. накипь ) является символом нечистоты, греха Иерусалима. Греч. слово иос (Иак 5:3)… … Библейская энциклопедия Брокгауза
РЖАВЧИНА — РЖАВЧИНА, ы, жен. 1. Красно бурый налёт на железе, образующийся вследствие окисления и ведущий к разрушению металла, а также след на чём н. от такого налёта. В душе появилась какая то р. (перен.: что то разъедающее, мучащее). 2. Бурая плёнка на… … Толковый словарь Ожегова
РЖАВЧИНА — «РЖАВЧИНА», Россия, Петербург 5 канал ГТРК, 1991. Детектив. В основе сценария фильма документальные материалы из архивов КГБ. Исследуется процесс возникновения организованной преступности, мафии. Картина повествует о событиях 1938 1987 годов. В… … Энциклопедия кино
Ржавчина — Ржавчина: видимые продукты коррозии, состоящие, в случае черных металлов, главным образом, из гидратированных оксидов железа… Источник: ГОСТ 9.402 2004. Единая система защиты от коррозии и старения. Покрытия лакокрасочные. Подготовка… … Официальная терминология
dic.academic.ru
Ржавчина википедия – википедия карта Ржавчины – информация из википедии на карте

Цвета ржавчины
Ржа́вчина является общим термином для определения окислов железа. В разговорной речи это слово применяется к красным окислам, образующимся в ходе реакции железа с кислородом в присутствии воды или влажного воздуха. Есть и другие формы ржавчины, например, продукт, образующийся в ходе реакции железа с хлором при отсутствии кислорода. Такое вещество образуется, в частности, в арматуре, используемой в подводных бетонных столбах, и называют его зелёной ржавчиной. Несколько видов коррозии различимы зрительно или с помощью спектроскопии, они образуются при разных внешних условиях. Ржавчина состоит из гидратированного оксида железа(III) Fe2O3·nH2O и метагидроксида железа (FeO(OH), Fe(OH)3). При наличии кислорода и воды и достаточном времени любая масса железа в конечном итоге преобразуется полностью в ржавчину и разрушается. Поверхность ржавчины не создаёт защиту для нижележащего железа, в отличие от образования патины на медной поверхности.
Ржавчиной, как правило, называют продукт коррозии только железа и его сплавов, таких как сталь. Многие другие металлы тоже подвергаются коррозии, но именно окислы железа обычно называют ржавчиной.
Химические реакции
Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.
Причины ржавления
Если железо, содержащее какие-либо добавки и примеси (например, углерод), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций. Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе (слой пассивации) защищает основную массу железа от дальнейшего окисления. Превращение же пассивирующего слоя оксида железа в ржавчину является результатом комбинированного действия двух реагентов, как правило, кислорода и воды. Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы.
Происходящие реакции
Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформация поверхности, вызванная сильным окислением.
Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду. Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановление кислорода:
- O2 + 4 e + 2 H2O → 4 OH
Поскольку при этом образуются гидроксид-анионы, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
- Fe → Fe + 2 e
Следующая окислительно-восстановительная реакция происходит в присутствии воды и имеет решающее значение для формирования ржавчины:
- 4 Fe + O2 → 4 Fe + 2 O
Кроме того, следующие многоступенчатые кислотно-щелочные реакции влияют на ход формирования ржавчины:
- Fe + 2 H2O ⇌ Fe(OH)2 + 2 H
- Fe + 3 H2O ⇌ Fe(OH)3 + 3 H
что приводит к следующим реакциям поддержания баланса дегидратации:
- Fe(OH)2 ⇌ FeO + H2O
- Fe(OH)3 ⇌ FeO(OH) + H2O
- 2 FeO(OH) ⇌ Fe2O3 + H2O
Из приведённых выше уравнений видно, что формирование продуктов коррозии обусловлено наличием воды и кислорода. С ограничением растворённого кислорода на передний план выдвигаются железо(II)-содержащие материалы, в том числе FeO и чёрный магнит (Fe3O4). Высокая концентрация кислорода благоприятна для материалов с трёхвалентным железом, с номинальной формулой Fe(OH)3-xOx/2. Характер коррозии меняется со временем, отражая медленные скорости реакций твёрдых тел.
Кроме того, эти сложные процессы зависят от присутствия других ионов, таких как Ca, которые служат в качестве электролита, и таким образом, ускоряют образование ржавчины, или в сочетании с гидроксидами и оксидами железа образуют различные осадки вида Ca-Fe-O-OH.
Более того, цвет ржавчины можно использовать для проверки наличия ионов Fe2+, которые меняют цвет ржавчины с жёлтого на синий.
Предотвращение ржавления
Отслаивающаяся краска обнажает участки ржавой поверхности листового металла.
Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали образуется пассивирующий слой оксида хрома(III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Гальванизация
Хорошим подходом к предотвращению ржавчины является метод гальванизации, который обычно заключается в нанесении на защищаемый объект слоя цинка либо методом горячего цинкования, либо методом гальванотехники. Цинк традиционно используется, потому что он достаточно дёшев, обладает хорошей адгезией к стали и обеспечивает катодную защиту на стальную поверхность в случае повреждения цинкового слоя. В более агрессивных средах (таких, как солёная вода), предпочтительнее кадмий. Гальванизация часто не попадает на швы, отверстия и стыки, через которые наносилось покрытие. В этих случаях покрытие обеспечивает катодную защиту металла, где оно выступает в роли гальванического анода, на который прежде всего и воздействует коррозия. В более современные покрытия добавляют алюминий, новый материал называется цинк-алюм. Алюминий в покрытии мигрирует, покрывая царапины и, таким образом, обеспечивая более длительную защиту. Этот метод основан на применении оксидов алюминия и цинка, защищающих царапины на поверхности, в отличие от процесса оксидизации, как в случае применения гальванического анода. В некоторых случаях при очень агрессивных средах или длительных сроках эксплуатации применяются одновременно и гальванизация цинком, и другие защитные покрытия, чтобы обеспечить надёжную защиту от коррозии.
Катодная защита
Катодная защита является методом, используемым для предотвращения коррозии в скрытых под землёй или под водой структурах путём подачи электрического заряда, который подавляет электрохимические реакции. Если её правильно применять, коррозия может быть остановлена полностью. В своей простейшей форме это достигается путём соединения защищаемого объекта с протекторным анодом, в результате чего на поверхности железа или стали происходит только катодный процесс. Протекторный анод должен быть сделан из металла с более отрицательным электродным потенциалом, чем железо или сталь, обычно это цинк, алюминий или магний.
Лакокрасочные и другие защитные покрытия
От ржавчины можно предохранять с помощью лакокрасочных и других защитных покрытий, которые изолируют железо из окружающей среды. История красок для нанесения на ржавчину насчитывает 50 лет, когда в Англии была изобретена краска Hammerite. Большие поверхности, поделённые на секции, как например, корпуса судов и современных автомобилей, часто покрывают продуктами на основе воска. Такие средства обработки содержат также ингибиторы от коррозии. Покрытие стальной арматуры бетоном (железобетон) обеспечивает некоторую защиту стали в среде с высоким рН. Однако коррозия стали в бетоне всё ещё является проблемой.
Покрытие слоем металла
Ржавчина может полностью разрушить железо. Обратите внимание на гальванизацию незаржавевших участков.
- Оцинковка (оцинкованное железо/сталь): железо или сталь покрываются слоем цинка. Может использоваться метод горячего цинкования или метод цинкового дутья.
- Лужение: мягкая листовая сталь покрывается слоем олова. В настоящее время практически не используется из-за высокой стоимости олова.
- Хромирование: тонкий слой хрома наносится электролитическим способом на сталь, обеспечивая как защиту от коррозии, так и яркий, полированный внешний вид. Часто используется в блестящих компонентах велосипедов, мотоциклов и автомобилей.
Воронение
Воронение — это способ, который может обеспечить ограниченную устойчивость к коррозии для мелких предметов из стали, таких как огнестрельное оружие и др. Способ состоит в получении на поверхности углеродистой или низколегированной стали или чугуна слоя окислов железа толщиной 1-10 мкм. Для придания блеска, а также для улучшения защитных свойств окисной плёнки, её пропитывают минеральным или растительным маслом.
Снижение влажности
Ржавчины можно избежать, снижая влажность окружающего железо воздуха. Этого можно добиться, например, с помощью силикагеля.
Ингибиторы
Ингибиторы коррозии, как, например, газообразные или летучие ингибиторы, можно использовать для предотвращения коррозии в закрытых системах. Некоторые ингибиторы коррозии чрезвычайно ядовиты. Одним из лучших ингибиторов выступают соли технециевой кислоты.
Экономический эффект
Разрушенный Серебряный мост, вид со стороны Огайо.
Ржавчина вызывает деградацию изделий и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстрому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое поеданием ржавчиной. Это явление стало причиной разрушения моста через реку Мианус (штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главной причиной разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту. Погибли 46 водителей и пассажиров, находившихся в то время на мосту.
Мост Кинзу после разрушения.
Мост Кинзу в штате Пенсильвания был снесён смерчем в 2003 году в значительной степени потому, что центральные опорные болты, соединяющие сооружение с землёй, проржавели, из-за чего мост держался лишь под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские трудности. Это один из наиболее распространённых отказов железобетонных мостов.
См. также
- Коррозия
- Нержавеющая сталь
- Сталь кортеновская
Примечания
- ↑ Interview, David Des Marais (недоступная ссылка — история). Архивировано 13 ноября 2007 года.
- ↑ Holleman, A. F.; Wiberg, E. “Inorganic Chemistry” Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Hubert Gräfen, Elmar-Manfred Horn, Hartmut Schlecker, Helmut Schindler «Corrosion» Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim, 2002. DOI: 10.1002/14356007.b01_08
Ссылки
- Corrosion Cost Сайт, посвященный изучению экономических последствий коррозии
- corrosion case studies Анализ коррозии
- Corrosion Doctors Статьи по коррозии
- Metal Corrosion Rust Что такое ржавчина
ru.gulliway.org
Ржавчина — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
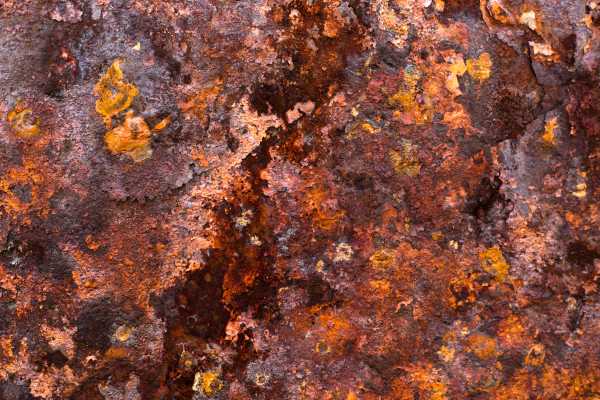
Ржа́вчина является общим термином для определения оксидов железа. В разговорной речи этот термин применяется к красным окислам, образующимся в результате реакции железа с кислородом в присутствии воды или влажного воздуха. Есть и другие формы ржавчины, например, продукт, образующийся в результате реакции железа с хлором при отсутствии кислорода. Такое вещество образуется, в частности, в арматуре, используемой в подводных бетонных столбах, и называют его зелёной ржавчиной. Несколько видов коррозии различимы визуально или с помощью спектроскопии, они формируются при разных внешних условиях.[1] Ржавчина состоит из гидратированного оксида железа(III) Fe2O3·nH2O и метагидроксида железа (FeO(OH), Fe(OH)3). При наличии кислорода и воды и достаточном времени любая масса железа в конечном итоге преобразуется полностью в ржавчину и разрушается. Поверхность ржавчины не создаёт защиту для нижележащего железа, в отличие от образования патины на медной поверхности.
Ржавчиной как правило называют продукт коррозии только железа и его сплавов, таких как сталь. Многие другие металлы тоже подвергаются коррозии, но именно оксиды железа обычно называют ржавчиной.
Химические реакции

Причины ржавления
Если железо, содержащее какие-либо добавки и примеси (например, углерод), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций. Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе (слой пассивации) защищает основную массу железа от дальнейшего окисления. Превращение же пассивирующего слоя оксида железа в ржавчину является результатом комбинированного действия двух агентов, как правило, кислорода и воды. Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы.[2]
Происходящие реакции
 Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду.[3] Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановление кислорода:
Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду.[3] Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановление кислорода:
- O2 + 4 e– + 2 H2O → 4 OH–
Поскольку при этом образуются ионы гидроксидов, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
- Fe → Fe2+ + 2 e−
Следующая окислительно-восстановительная реакция происходит в присутствии воды и имеет решающее значение для формирования ржавчины:
- 4 Fe2+ + O2 → 4 Fe3+ + 2 O2−
Кроме того, следующие многоступенчатые кислотно-щелочные реакции влияют на ход формирования ржавчины:
- Fe2+ + 2 H2O ⇌ Fe(OH)2 + 2 H+
- Fe3+ + 3 H2O ⇌ Fe(OH)3 + 3 H+
что приводит к следующим реакциям поддержания баланса дегидратации:
- Fe(OH)2⇌ FeO + H2O
- Fe(OH)3⇌ FeO(OH) + H2O
- 2 FeO(OH) ⇌ Fe2O3 + H2O
Из приведённых выше уравнений видно, что формирование продуктов коррозии обусловлено наличием воды и кислорода. С ограничением растворённого кислорода на передний план выдвигаются железо(II)-содержащие материалы, в том числе FeO и чёрный магнит (Fe3O4). Высокая концентрация кислорода благоприятна для материалов с трёхвалентным железом, с номинальной формулой Fe(OH)3-xOx/2. Характер коррозии меняется со временем, отражая медленные скорости реакций твёрдых тел.
Кроме того, эти сложные процессы зависят от присутствия других ионов, таких как Ca2+, которые служат в качестве электролита, и таким образом, ускоряют образование ржавчины, или в сочетании с гидроксидами и оксидами железа образуют различные осадки вида Ca-Fe-O-OH.
Более того, цвет ржавчины можно использовать для проверки наличия ионов Fe2+, которые меняют цвет ржавчины с жёлтого на синий.
Предотвращение ржавления
 Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали формируется пассивирующий слой оксида хрома(III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали формируется пассивирующий слой оксида хрома(III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Гальванизация
Хорошим подходом к предотвращению ржавчины является метод гальванизации, который обычно заключается в нанесении на защищаемый объект слоя цинка либо методом горячего цинкования, либо методом гальванотехники. Цинк традиционно используется, потому что он достаточно дёшев, обладает хорошей адгезией к стали и обеспечивает катодную защиту на стальную поверхность в случае повреждения цинкового слоя. В более агрессивных средах (таких, как солёная вода), предпочтительнее кадмий. Гальванизация часто не попадает на швы, отверстия и стыки, через которые наносилось покрытие. В этих случаях покрытие обеспечивает катодную защиту металла, где оно выступает в роли гальванического анода, на который прежде всего и воздействует коррозия. В более современные покрытия добавляют алюминий, новый материал называется цинк-алюм. Алюминий в покрытии мигрирует, покрывая царапины и, таким образом, обеспечивая более длительную защиту. Этот метод основан на применении оксидов алюминия и цинка, защищающих царапины на поверхности, в отличие от процесса оксидизации, как в случае применения гальванического анода. В некоторых случаях при очень агрессивных средах или длительных сроках эксплуатации применяются одновременно и гальванизация цинком, и другие защитные покрытия, чтобы обеспечить надёжную защиту от коррозии.
Катодная защита
Катодная защита является методом, используемым для предотвращения коррозии в скрытых под землёй или под водой структурах путём подачи электрического заряда, который подавляет электрохимические реакции. Если её правильно применять, коррозия может быть остановлена полностью. В своей простейшей форме это достигается путём соединения защищаемого объекта с протекторным анодом, в результате чего на поверхности железа или стали происходит только катодный процесс. Протекторный анод должен быть сделан из металла с более отрицательным электродным потенциалом, чем железо или сталь, обычно это цинк, алюминий или магний.
Лакокрасочные и другие защитные покрытия
От ржавчины можно предохранять с помощью лакокрасочных и других защитных покрытий, которые изолируют железо из окружающей среды. История красок для нанесения на ржавчину насчитывает 50 лет, когда в Англии была изобретена краска Hammerite. Большие поверхности, поделённые на секции, как например, корпуса судов и современных автомобилей, часто покрывают продуктами на основе воска. Такие средства обработки содержат также ингибиторы от коррозии. Покрытие стальной арматуры бетоном (железобетон) обеспечивает некоторую защиту стали в среде с высоким рН. Однако коррозия стали в бетоне всё ещё является проблемой.
Покрытие слоем металла

- Оцинковка (оцинкованное железо/сталь): железо или сталь покрываются слоем цинка. Может использоваться метод горячего цинкования или метод цинкового дутья.
- Лужение: мягкая листовая сталь покрывается слоем олова.
- Хромирование: тонкий слой хрома наносится электролитическим способом на сталь, обеспечивая как защиту от коррозии, так и яркий, полированный внешний вид. Часто используется в блестящих компонентах велосипедов, мотоциклов и автомобилей.
Воронение
Воронение — это метод, который может обеспечить ограниченную устойчивость к коррозии для мелких предметов из стали, таких как огнестрельное оружие и др. Метод состоит в получении на поверхности углеродистой или низколегированной стали или чугуна слоя окислов железа толщиной 1-10 мкм. Для придания блеска, а также для улучшения защитных свойств окисной плёнки, её пропитывают минеральным или растительным маслом.
Снижение влажности
Ржавчины можно избежать, снижая влажность окружающей железо атмосферы. Этого можно добиться, например, с помощью силикагеля.
Ингибиторы
Ингибиторы коррозии, как, например, газообразные или летучие ингибиторы, можно использовать для предотвращения коррозии в закрытых системах.
Экономический эффект
Ржавчина вызывает деградацию инструментов и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстрому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое «поеданием ржавчиной». Это явление стало причиной разрушения моста через реку Мианус (штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главным фактором разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту. Погибли 46 водителей и пассажиров, находившихся в то время на мосту.

Мост Кинзу в штате Пенсильвания был снесён смерчем в 2003 году в значительной степени потому, что центральные базовые болты, соединяющие конструкцию с землёй, проржавели, предоставив мосту возможность держаться просто под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские проблемы. Это один из наиболее распространённых отказов железобетонных мостов.
См. также
Напишите отзыв о статье “Ржавчина”
Примечания
- ↑ [nasa.gov/centers/ames/multimedia/audio/MER/mer13.html Interview, David Des Marais](недоступная ссылка — история). [web.archive.org/20071113202732/nasa.gov/centers/ames/multimedia/audio/MER/mer13.html Архивировано из первоисточника 13 ноября 2007].
- ↑ Holleman, A. F.; Wiberg, E. “Inorganic Chemistry” Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Hubert Gräfen, Elmar-Manfred Horn, Hartmut Schlecker, Helmut Schindler “Corrosion” Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim, 2002. DOI: 10.1002/14356007.b01_08
Ссылки
- [www.corrosioncost.com Corrosion Cost] Сайт, посвященный изучению экономических последствий коррозии
- [openlearn.open.ac.uk/mod/resource/view.php?id=233628 corrosion case studies] Анализ коррозии
- [www.corrosion-doctors.org/MatSelect/corrsteel.htm Corrosion Doctors] Статьи по коррозии
- [www.corrosionist.com/how_does_rust_form.htm Metal Corrosion Rust] Что такое ржавчина
Отрывок, характеризующий Ржавчина
– Отчего слишком?.. Ну, как вы думаете, как вы чувствуете по душе, по всей душе, буду я жив? Как вам кажется?– Я уверена, я уверена! – почти вскрикнула Наташа, страстным движением взяв его за обе руки.
Он помолчал.
– Как бы хорошо! – И, взяв ее руку, он поцеловал ее.
Наташа была счастлива и взволнована; и тотчас же она вспомнила, что этого нельзя, что ему нужно спокойствие.
– Однако вы не спали, – сказала она, подавляя свою радость. – Постарайтесь заснуть… пожалуйста.
Он выпустил, пожав ее, ее руку, она перешла к свече и опять села в прежнее положение. Два раза она оглянулась на него, глаза его светились ей навстречу. Она задала себе урок на чулке и сказала себе, что до тех пор она не оглянется, пока не кончит его.
Действительно, скоро после этого он закрыл глаза и заснул. Он спал недолго и вдруг в холодном поту тревожно проснулся.
Засыпая, он думал все о том же, о чем он думал все ото время, – о жизни и смерти. И больше о смерти. Он чувствовал себя ближе к ней.
«Любовь? Что такое любовь? – думал он. – Любовь мешает смерти. Любовь есть жизнь. Все, все, что я понимаю, я понимаю только потому, что люблю. Все есть, все существует только потому, что я люблю. Все связано одною ею. Любовь есть бог, и умереть – значит мне, частице любви, вернуться к общему и вечному источнику». Мысли эти показались ему утешительны. Но это были только мысли. Чего то недоставало в них, что то было односторонне личное, умственное – не было очевидности. И было то же беспокойство и неясность. Он заснул.
Он видел во сне, что он лежит в той же комнате, в которой он лежал в действительности, но что он не ранен, а здоров. Много разных лиц, ничтожных, равнодушных, являются перед князем Андреем. Он говорит с ними, спорит о чем то ненужном. Они сбираются ехать куда то. Князь Андрей смутно припоминает, что все это ничтожно и что у него есть другие, важнейшие заботы, но продолжает говорить, удивляя их, какие то пустые, остроумные слова. Понемногу, незаметно все эти лица начинают исчезать, и все заменяется одним вопросом о затворенной двери. Он встает и идет к двери, чтобы задвинуть задвижку и запереть ее. Оттого, что он успеет или не успеет запереть ее, зависит все. Он идет, спешит, ноги его не двигаются, и он знает, что не успеет запереть дверь, но все таки болезненно напрягает все свои силы. И мучительный страх охватывает его. И этот страх есть страх смерти: за дверью стоит оно. Но в то же время как он бессильно неловко подползает к двери, это что то ужасное, с другой стороны уже, надавливая, ломится в нее. Что то не человеческое – смерть – ломится в дверь, и надо удержать ее. Он ухватывается за дверь, напрягает последние усилия – запереть уже нельзя – хоть удержать ее; но силы его слабы, неловки, и, надавливаемая ужасным, дверь отворяется и опять затворяется.
Еще раз оно надавило оттуда. Последние, сверхъестественные усилия тщетны, и обе половинки отворились беззвучно. Оно вошло, и оно есть смерть. И князь Андрей умер.
Но в то же мгновение, как он умер, князь Андрей вспомнил, что он спит, и в то же мгновение, как он умер, он, сделав над собою усилие, проснулся.
«Да, это была смерть. Я умер – я проснулся. Да, смерть – пробуждение!» – вдруг просветлело в его душе, и завеса, скрывавшая до сих пор неведомое, была приподнята перед его душевным взором. Он почувствовал как бы освобождение прежде связанной в нем силы и ту странную легкость, которая с тех пор не оставляла его.
Когда он, очнувшись в холодном поту, зашевелился на диване, Наташа подошла к нему и спросила, что с ним. Он не ответил ей и, не понимая ее, посмотрел на нее странным взглядом.
Это то было то, что случилось с ним за два дня до приезда княжны Марьи. С этого же дня, как говорил доктор, изнурительная лихорадка приняла дурной характер, но Наташа не интересовалась тем, что говорил доктор: она видела эти страшные, более для нее несомненные, нравственные признаки.
С этого дня началось для князя Андрея вместе с пробуждением от сна – пробуждение от жизни. И относительно продолжительности жизни оно не казалось ему более медленно, чем пробуждение от сна относительно продолжительности сновидения.
Ничего не было страшного и резкого в этом, относительно медленном, пробуждении.
Последние дни и часы его прошли обыкновенно и просто. И княжна Марья и Наташа, не отходившие от него, чувствовали это. Они не плакали, не содрогались и последнее время, сами чувствуя это, ходили уже не за ним (его уже не было, он ушел от них), а за самым близким воспоминанием о нем – за его телом. Чувства обеих были так сильны, что на них не действовала внешняя, страшная сторона смерти, и они не находили нужным растравлять свое горе. Они не плакали ни при нем, ни без него, но и никогда не говорили про него между собой. Они чувствовали, что не могли выразить словами того, что они понимали.
Они обе видели, как он глубже и глубже, медленно и спокойно, опускался от них куда то туда, и обе знали, что это так должно быть и что это хорошо.
Его исповедовали, причастили; все приходили к нему прощаться. Когда ему привели сына, он приложил к нему свои губы и отвернулся, не потому, чтобы ему было тяжело или жалко (княжна Марья и Наташа понимали это), но только потому, что он полагал, что это все, что от него требовали; но когда ему сказали, чтобы он благословил его, он исполнил требуемое и оглянулся, как будто спрашивая, не нужно ли еще что нибудь сделать.
Когда происходили последние содрогания тела, оставляемого духом, княжна Марья и Наташа были тут.
– Кончилось?! – сказала княжна Марья, после того как тело его уже несколько минут неподвижно, холодея, лежало перед ними. Наташа подошла, взглянула в мертвые глаза и поспешила закрыть их. Она закрыла их и не поцеловала их, а приложилась к тому, что было ближайшим воспоминанием о нем.
«Куда он ушел? Где он теперь?..»
Когда одетое, обмытое тело лежало в гробу на столе, все подходили к нему прощаться, и все плакали.
Николушка плакал от страдальческого недоумения, разрывавшего его сердце. Графиня и Соня плакали от жалости к Наташе и о том, что его нет больше. Старый граф плакал о том, что скоро, он чувствовал, и ему предстояло сделать тот же страшный шаг.
Наташа и княжна Марья плакали тоже теперь, но они плакали не от своего личного горя; они плакали от благоговейного умиления, охватившего их души перед сознанием простого и торжественного таинства смерти, совершившегося перед ними.
Для человеческого ума недоступна совокупность причин явлений. Но потребность отыскивать причины вложена в душу человека. И человеческий ум, не вникнувши в бесчисленность и сложность условий явлений, из которых каждое отдельно может представляться причиною, хватается за первое, самое понятное сближение и говорит: вот причина. В исторических событиях (где предметом наблюдения суть действия людей) самым первобытным сближением представляется воля богов, потом воля тех людей, которые стоят на самом видном историческом месте, – исторических героев. Но стоит только вникнуть в сущность каждого исторического события, то есть в деятельность всей массы людей, участвовавших в событии, чтобы убедиться, что воля исторического героя не только не руководит действиями масс, но сама постоянно руководима. Казалось бы, все равно понимать значение исторического события так или иначе. Но между человеком, который говорит, что народы Запада пошли на Восток, потому что Наполеон захотел этого, и человеком, который говорит, что это совершилось, потому что должно было совершиться, существует то же различие, которое существовало между людьми, утверждавшими, что земля стоит твердо и планеты движутся вокруг нее, и теми, которые говорили, что они не знают, на чем держится земля, но знают, что есть законы, управляющие движением и ее, и других планет. Причин исторического события – нет и не может быть, кроме единственной причины всех причин. Но есть законы, управляющие событиями, отчасти неизвестные, отчасти нащупываемые нами. Открытие этих законов возможно только тогда, когда мы вполне отрешимся от отыскиванья причин в воле одного человека, точно так же, как открытие законов движения планет стало возможно только тогда, когда люди отрешились от представления утвержденности земли.
После Бородинского сражения, занятия неприятелем Москвы и сожжения ее, важнейшим эпизодом войны 1812 года историки признают движение русской армии с Рязанской на Калужскую дорогу и к Тарутинскому лагерю – так называемый фланговый марш за Красной Пахрой. Историки приписывают славу этого гениального подвига различным лицам и спорят о том, кому, собственно, она принадлежит. Даже иностранные, даже французские историки признают гениальность русских полководцев, говоря об этом фланговом марше. Но почему военные писатели, а за ними и все, полагают, что этот фланговый марш есть весьма глубокомысленное изобретение какого нибудь одного лица, спасшее Россию и погубившее Наполеона, – весьма трудно понять. Во первых, трудно понять, в чем состоит глубокомыслие и гениальность этого движения; ибо для того, чтобы догадаться, что самое лучшее положение армии (когда ее не атакуют) находиться там, где больше продовольствия, – не нужно большого умственного напряжения. И каждый, даже глупый тринадцатилетний мальчик, без труда мог догадаться, что в 1812 году самое выгодное положение армии, после отступления от Москвы, было на Калужской дороге. Итак, нельзя понять, во первых, какими умозаключениями доходят историки до того, чтобы видеть что то глубокомысленное в этом маневре. Во вторых, еще труднее понять, в чем именно историки видят спасительность этого маневра для русских и пагубность его для французов; ибо фланговый марш этот, при других, предшествующих, сопутствовавших и последовавших обстоятельствах, мог быть пагубным для русского и спасительным для французского войска. Если с того времени, как совершилось это движение, положение русского войска стало улучшаться, то из этого никак не следует, чтобы это движение было тому причиною.
Этот фланговый марш не только не мог бы принести какие нибудь выгоды, но мог бы погубить русскую армию, ежели бы при том не было совпадения других условий. Что бы было, если бы не сгорела Москва? Если бы Мюрат не потерял из виду русских? Если бы Наполеон не находился в бездействии? Если бы под Красной Пахрой русская армия, по совету Бенигсена и Барклая, дала бы сражение? Что бы было, если бы французы атаковали русских, когда они шли за Пахрой? Что бы было, если бы впоследствии Наполеон, подойдя к Тарутину, атаковал бы русских хотя бы с одной десятой долей той энергии, с которой он атаковал в Смоленске? Что бы было, если бы французы пошли на Петербург?.. При всех этих предположениях спасительность флангового марша могла перейти в пагубность.
В третьих, и самое непонятное, состоит в том, что люди, изучающие историю, умышленно не хотят видеть того, что фланговый марш нельзя приписывать никакому одному человеку, что никто никогда его не предвидел, что маневр этот, точно так же как и отступление в Филях, в настоящем никогда никому не представлялся в его цельности, а шаг за шагом, событие за событием, мгновение за мгновением вытекал из бесчисленного количества самых разнообразных условий, и только тогда представился во всей своей цельности, когда он совершился и стал прошедшим.
На совете в Филях у русского начальства преобладающею мыслью было само собой разумевшееся отступление по прямому направлению назад, то есть по Нижегородской дороге. Доказательствами тому служит то, что большинство голосов на совете было подано в этом смысле, и, главное, известный разговор после совета главнокомандующего с Ланским, заведовавшим провиантскою частью. Ланской донес главнокомандующему, что продовольствие для армии собрано преимущественно по Оке, в Тульской и Калужской губерниях и что в случае отступления на Нижний запасы провианта будут отделены от армии большою рекою Окой, через которую перевоз в первозимье бывает невозможен. Это был первый признак необходимости уклонения от прежде представлявшегося самым естественным прямого направления на Нижний. Армия подержалась южнее, по Рязанской дороге, и ближе к запасам. Впоследствии бездействие французов, потерявших даже из виду русскую армию, заботы о защите Тульского завода и, главное, выгоды приближения к своим запасам заставили армию отклониться еще южнее, на Тульскую дорогу. Перейдя отчаянным движением за Пахрой на Тульскую дорогу, военачальники русской армии думали оставаться у Подольска, и не было мысли о Тарутинской позиции; но бесчисленное количество обстоятельств и появление опять французских войск, прежде потерявших из виду русских, и проекты сражения, и, главное, обилие провианта в Калуге заставили нашу армию еще более отклониться к югу и перейти в середину путей своего продовольствия, с Тульской на Калужскую дорогу, к Тарутину. Точно так же, как нельзя отвечать на тот вопрос, когда оставлена была Москва, нельзя отвечать и на то, когда именно и кем решено было перейти к Тарутину. Только тогда, когда войска пришли уже к Тарутину вследствие бесчисленных дифференциальных сил, тогда только стали люди уверять себя, что они этого хотели и давно предвидели.
wiki-org.ru
подскажите почему появления ржавчины на стали это Химическое Явление?
А потому что идёт окисление 😀 А вот тебе ещё <a href=”/” rel=”nofollow” title=”6625:##:articles/506218/”>[ссылка заблокирована по решению администрации проекта]</a> , почитай. А ещё вот инфа: Происходит кислородная коррозия железа в воде: 4Fe + 2Н2О + ЗО2 = 2(Fe2O3•Н2О) . Вот этот гидратированный оксид железа (III) и есть ржавчина, но это нифига не пиши в тетрадке потому что тут про железо, а у тебя сталь, но мало ли, полезно будет 🙂
Соединение железа с кислородом
это реакция железа с водой при участии кислорода!
окисление потому что
потому что это реакция на кислород. Химию читай
ржавчина – это другое вещество. А преобразование веществ – это химическая реакция
touch.otvet.mail.ru

