Оксидация это: ОКСИДАЦИЯ | это… Что такое ОКСИДАЦИЯ?
alexxlab | 06.01.1987 | 0 | Разное
что это, технология хим оксидации стали на rocta
27Ноя
Содержание статьи
- В чем заключается метод оксидации
- Методы
- Что дает процесс
- Хим оксидирование стали: преимущества
- Термическое оксидирование
- Своими руками
Воздействие окружающей среды на сталь – одно из самых пагубных после естественного износа. Именно из-за влажности и взаимодействия с кислородом происходят коррозийные процессы, теряется прочность поверхности. Чтобы это предупредить, производители-металлурги одним из завершающих этапов проводят металлообработку различными защитными составами. В этой статье мы поговорим про химическое оксидирование металлов, расскажем, что это такое и как его проводить.
В чем заключается метод оксидации
Большинство металлических веществ вступает в активную фазу с различными химикатами. В ряде случаев она происходит с выделением стороннего вещества, которое может стать защитой для основного изделия. В рассматриваемом способе возникает оксидная пленка после нанесения на поверхность специального раствора.
В рассматриваемом способе возникает оксидная пленка после нанесения на поверхность специального раствора.
Жидкость под влиянием окислительно-восстановительной реакции приводит к созданию верхнего слоя, который увеличивает коррозийную стойкость, а также декорирует плоскость. Следует отметить, что разновидностей процесса несколько, они выбираются в зависимости от того, какого эффекта нужно добиться, а также – какой материал подвергается обработке. Посмотрим более внимательно за видами.
Методы
Каждый из них обладает определенной популярностью, большинство применяется на заводах в определенных условиях. Но есть возможность самостоятельного проведения металлообработки. При этом стоит помнить о возможном негативном воздействии на организм и средствах защиты.
Химическое оксидирование стали, технология
На поверхность металлического изделия наносится жидкий раствор, сухая смесь или расплав. Затем между этими элементами происходит реакция (в определенных условиях, например, с доступом кислорода, при выставленном температурном режиме). Ее результатом становится образование неактивного верхнего слоя – эту процедуру называют пассивацией, то есть верхний слой делают пассивным по отношению к некоторым средам. Чаще всего для этих целей применяются окислы хрома.
Ее результатом становится образование неактивного верхнего слоя – эту процедуру называют пассивацией, то есть верхний слой делают пассивным по отношению к некоторым средам. Чаще всего для этих целей применяются окислы хрома.
Заготовка закрепляется тем или иным образом и погружается в ванну с заготовленным раствором (это возможно при нескольких условиях – при соответствующих размерах объекта и резервуара и при стенках сосуда, которые не вступают в реакцию). Щелочной или кислотный состав создается заблаговременно и обладает определенным процентным соотношением. В зависимости от параметров определяется степень выдержки. Спустя необходимое время деталь достается, подвергается сушке, а затем проводятся финишные работы по металлообработке. При создании кислотной ванны с наибольшей вероятностью применяют такие кислоты, как соляная, азотная, ортофосфорная. Если добавить капсулы марганца, хрома или калия, то протекание будет ускорено. Обычно выбирается температурный режим в рамках от +30 до +100 градусов. Если в качестве основы соединения нитрата натрия и диоксида марганца, то можно говорить о применении щелочного раствора, который нагревается уже значительно сильнее – до 300 градусов. Также есть две разновидности, когда применяют дополнительные вещества, влияющие на качество полученного результата:
Если в качестве основы соединения нитрата натрия и диоксида марганца, то можно говорить о применении щелочного раствора, который нагревается уже значительно сильнее – до 300 градусов. Также есть две разновидности, когда применяют дополнительные вещества, влияющие на качество полученного результата:
- бихромат калия позволяет закрепить итоговые достижения;
- масло – такой процесс называют оксидацией с промасливанием или химоксидированием, при котором удается не только добиться высокой устойчивости к ржавлению, но и получить черный глянцевый цвет поверхности.
Термическое оксидирование
Это аналогичный способ, в ходе которого образуется защитная оксидная пленка, но он проходит при повышенной температуре при непосредственном контакте с водяным паром или с кислородом. Для данного действия требуются специальные печи, которые могут поддерживать режим работы вплоть до 1200 градусов – для различных материалов характерны свои показатели.
Если вы хотите улучшить эффект, рекомендуем предварительно погрузить деталь в мыльный раствор на несколько минут, а после этого высушить и залить ванночку машинным или трансформаторным маслом. Если произвести нагрев до 105 градусов и выше, то можно добиться равномерной, блестящей черной поверхности.
Анодная оксидация – что это
Ее также называют электрохимическим оксидированием или анодированием. Это еще один вариант, как можно достаточно быстро получить оксидную пленку в жидкости или сухой смеси. Основной процесс, который заложен в основе технологии – это электролиз, который, как известно, может проходить и в жидких, и в твердых средах.
Элемент помещается в раствор. Между ним и жидкостью образуется разница потенциалов – у верхних слоев он изначально положительный, а у смеси – отрицательный. Следует отметить, что подача напряжения, а также использование активных реагентов приводит к тому, что процедура считается небезопасной, по крайней мере для домашнего воплощения. При анодировании достигается две задачи – декоративное оформление и создание защитного слоя. Чаще всего этому подвергается алюминий, который по своей природе не обладает достаточными характеристиками жесткости, прочности, устойчивости к механическим воздействиям. В зависимости от того, какая кислота используется, а также какие параметры напряжения выставлены, можно добиться полученной пленки различной толщины. Тонкими они будут, если применять B(OH)₃ (борную) или H₃PO₄ (ортофосфорную). Но если нужно придать интересный оттенок оксидированной стали, то следует использовать органические кислоты, например, щавелевую, малеиновую, сульфосалициловую. Используют также и слабощелочные составы, чтобы погружать в них детали и пропускать слабый переменный или импульсный ток. Данный процесс называется микродуговой обработкой и отличается тем, что можно достичь хороших результатов. Поверхность не только хорошо смотрится и не ржавеет, но и становится более теплостойкой, приобретает изоляционные качества.
При анодировании достигается две задачи – декоративное оформление и создание защитного слоя. Чаще всего этому подвергается алюминий, который по своей природе не обладает достаточными характеристиками жесткости, прочности, устойчивости к механическим воздействиям. В зависимости от того, какая кислота используется, а также какие параметры напряжения выставлены, можно добиться полученной пленки различной толщины. Тонкими они будут, если применять B(OH)₃ (борную) или H₃PO₄ (ортофосфорную). Но если нужно придать интересный оттенок оксидированной стали, то следует использовать органические кислоты, например, щавелевую, малеиновую, сульфосалициловую. Используют также и слабощелочные составы, чтобы погружать в них детали и пропускать слабый переменный или импульсный ток. Данный процесс называется микродуговой обработкой и отличается тем, что можно достичь хороших результатов. Поверхность не только хорошо смотрится и не ржавеет, но и становится более теплостойкой, приобретает изоляционные качества. Особенный подход нужно применять к нержавеющей стали. Она является инертным, то есть нейтральным сплавом. Как можно понять, добиться разности потенциалов в таком случае достаточно сложно. Поэтому процедура становится двухступенчатой. Сперва проводится двойное анодирование – то есть в ванну с составом погружают не только нержавейку, но и еще один элемент, который по своим характеристикам больше подходит для процесса. Для этих целей годится никель, медь.
Особенный подход нужно применять к нержавеющей стали. Она является инертным, то есть нейтральным сплавом. Как можно понять, добиться разности потенциалов в таком случае достаточно сложно. Поэтому процедура становится двухступенчатой. Сперва проводится двойное анодирование – то есть в ванну с составом погружают не только нержавейку, но и еще один элемент, который по своим характеристикам больше подходит для процесса. Для этих целей годится никель, медь.
Второй этап – это уже самостоятельное оксидирование нержавеющей стали. Но чтобы повысить эффективность и ускорить достижение результата, рекомендовано наносить пассивирующие пасты. Их назначение – ускорение реакции.
Плазменный метод
Также его называют микродуговым. Его особенность в том, что создается плазма с большим содержанием кислорода. При этом она не нагревается, поддерживаются низкие температуры. Сама генерация потока происходит под воздействием зарядов, которые, в свою очередь, образуются под влиянием переменного или импульсного тока высокой или сверхвысокой частоты. Обычно способ применяется, когда нужно создать оксидную пленку с целью защиты на относительно небольшой поверхности изделия. Чаще всего используется технология в электронике и микроэлектронике, например, при производстве полупроводников, транзисторов, диодов, микросхем. Второе назначение – увеличение светочувствительности, поэтому применяют процедуру для повышения чувствительности в фотокатодах. Иногда все же более целесообразно делать плазму с повышенной температурой – до 430 градусов и выше. Качество при этом сильно повышается. К преимуществам микродугового оксидирования стоит отнести:
Сама генерация потока происходит под воздействием зарядов, которые, в свою очередь, образуются под влиянием переменного или импульсного тока высокой или сверхвысокой частоты. Обычно способ применяется, когда нужно создать оксидную пленку с целью защиты на относительно небольшой поверхности изделия. Чаще всего используется технология в электронике и микроэлектронике, например, при производстве полупроводников, транзисторов, диодов, микросхем. Второе назначение – увеличение светочувствительности, поэтому применяют процедуру для повышения чувствительности в фотокатодах. Иногда все же более целесообразно делать плазму с повышенной температурой – до 430 градусов и выше. Качество при этом сильно повышается. К преимуществам микродугового оксидирования стоит отнести:
- Слой оксида может достигать до 70% вглубь основной заготовки.
- Толщина около 200 – 250 мкм.
- Очень хорошо обрабатывать элементы, имеющие сложный рельеф.
- Отличное поведение на магниевых и алюминиевых сплавах.

Лазерное
С целью увеличения коррозийной стойкости можно добиться образования оксидной пленки на сталь, используя установку лазера. Особенность процесса в том, что для его совершения обязательно нужна специализированный станок. Наиболее эффективно зарекомендовало себя применение волоконного лазера в инфракрасном диапазоне свечения. Можно использовать три методики:
- импульсное излучение;
- непрерывный световой поток;
- точечный нагрев материала.
Отметим, что технология требует достаточно высоких затрат, а также не подходит для больших металлических элементов конструкций. Хорошо применять для ограниченных плоскостей, используя станки с ЧПУ.
Оксидирование своими руками
Если нужно сделать оксидную пленку дома, то для хорошего результата следует строго следовать последовательности действий, а также придерживаться правил безопасности.
Ниже мы более подробно расскажем о поэтапном проведении самостоятельной оксидации, но сперва обсудим – а зачем это делать?
Что дает процесс
Производители деталей из металла знают, что основная проблема, почему их продукция быстро выходит из строя, – это образование коррозии. Дело в том, что фактически любое вещество, обладающее металлическими свойствами, достаточно сильно подвергается влиянию внешней среды. Это влажность, температурные перепады, солнечное излучение, реакции с кислородом, а также загрязнения и естественный износ. Посмотрим, что дает оксидирование для производителей.
Дело в том, что фактически любое вещество, обладающее металлическими свойствами, достаточно сильно подвергается влиянию внешней среды. Это влажность, температурные перепады, солнечное излучение, реакции с кислородом, а также загрязнения и естественный износ. Посмотрим, что дает оксидирование для производителей.
Антикоррозийные свойства
Даже при постоянном нахождении на улице под дождем и при контакте с воздухом не происходит ржавления. Это очень актуально для элементов корпуса автомобилей и других предметов, которые преимущественно эксплуатируются вне помещения.
Ограничение воздействия внешней среды
Есть некоторые средства, которые являются агрессорами по отношению к металлу. Проще говоря, они разрушают его поверхность и даже проникают более глубоко в структуру, нарушая целостность. Это пары химикатов или жидкости, а также самый обыкновенный ультрафиолет.
Электроизоляционные характеристики
Ряд деталей должен стать диэлектриком, то есть не пропускать электричество. С такой задачей отлично справляется создаваемый диэлектрический слой.
С такой задачей отлично справляется создаваемый диэлектрический слой.
Придание оригинального декоративного вида
Это может быть черный глянцевый блеск или более экзотический перелив различных цветов. Смотрится очень красиво, причем практичность остается такой же высокой.
Хим оксидирование стали: преимущества
Теперь перечислим особенности, которых можно добиться, если использовать технологию создания оксидной пленки с помощью химикатов.
Надежное покрытие антикор
Стальная деталь фактически становится нержавейкой.
То есть ржавление хоть и не полностью исключено, но очень значительно заторможено.
Хорошие электрические изоляторы
После химической обработки можно ожидать, что поверхность совсем или частично перестает проводить ток. Все будет зависеть от того, какой раствор был взят, в какой концентрации и пр.
Тонкий, но стойкий поверхностный слой
Интересно, что может быть достигнута пленочка, толщиной всего в 200 мкм. Но это не делает ее более восприимчивой к механическим или иным вредителям.
Но это не делает ее более восприимчивой к механическим или иным вредителям.
Оригинальная цветовая гамма
Это больше признак анодирования.
Но мы отметим, что после процедуры можно получить не только черный цвет, но и переливчатые волны от желтого к темно-синему, как на фото.
Термическое оксидирование
Представим таблицу с некоторыми сплавами, которые наиболее часто подвергают оксидации:
| Название | Температура, °с | Особенности, назначение, использование |
| Низколегированные стали или железо | 300-350 | Второе название – воронение. Очень распространенный способ, основная его задача – декоративная металлообработка, так как деталь приобретает черный (вороной) цвет. Пример применения – создание стрелкового оружия. Еще одно преимущество – исходные размеры сохраняются, потому что оксидная пленка образуется очень тонкая, не более одного-полутора микрона. |
| Легированные стальные элементы | до 700 | Нанесение состава занимает продолжительный период – не менее 1 часа. |
| Железоникелевые магнитные сплавы | 400 – 800 | Процесс длится на протяжении 0,5 – 1,5 часов. Возникает слой, который считается диэлектриком, поэтому от просто необходим при создании электрических полупроводников. |
| Кремний | 800 – 1200 | Процедура имеет название термокомпрессионной. Она проходит под большим давлением до 107 па. Подвергаемые ей изделия необходимы в электронике. |
Импульсное лазерное излучение
Когда нагрев происходит не в печи, как при термическом методе, а с помощью лазера, то результат получается хороший, хоть и процесс – более трудный. До настоящего момента проводятся исследования, какие материалы как следует подвергать воздействию луча, но одним из вариантов является импульсы – то есть короткая подача потока на участок с постепенным смещением головки установки.
Непрерывное излучение
В таком случае обрабатываются только прочные стали, которые не боятся перегрева под постоянным воздействием. На зону направляется луч, который непрерывно перемещается по всей области оксидирования. Соответственно, нагрев получается очень значительный.
На зону направляется луч, который непрерывно перемещается по всей области оксидирования. Соответственно, нагрев получается очень значительный.
Своими руками
Представленные выше способы применяются только на производстве, но если вы готовы к самостоятельным экспериментам, то нужно создать небольшую домашнюю лабораторию.
Для эксперимента возьмите небольшую стальную деталь, которая без проблем поместится в трехлитровую банку.
Этапы работ
Выполняйте каждый из них последовательно и тщательно. Заранее подготовьте все необходимые инструменты.
Грубая зачистка
Возьмите щетку по стали или наждачку с крупным зерном. Вам нужно убрать всю ржавчину до основания, а также другие загрязнения. Лучше, если вы потом пройдетесь мелкозернистой наждачной бумаги для однородности поверхности.
Полировка
Отлично подойдут специальные пасты с мелким абразивом или диски на ручных шлифовальных машинках.
Снятие налета
Иными словам – избавьте элемент от жира, масляных следов, а также остатков полировальной пасты.
Обработка
Для этого наведите раствор серной кислоты с 5% содержанием вещества и поместите туда заготовку на 1 минуту.
Промывание
Сперва ополосните деталь в обычной проточной воде, а затем прокипятите ее в мыльном водном составе. Теперь в емкости сделайте 5% раствор едкого натра, поместите туда заготовку и нагрейте до 150 градусов, выдержите в течение 2 часов. Потом просто дайте ему остыть и оцените результат. У вас получилось оксидированное покрытие – это прекрасный эффект, достигнутый в домашних условиях. Чтобы уточнить интересующую вас информацию и приобрести ленточнопильные станки российского производства по металлу, свяжитесь с менеджерами компании «Рокта» по телефонам 8 (908) 135-59-82; (473) 239-65-79; 8 (800) 707-53-38. Они ответят на все ваши вопросы.
Оксидация и редукция в виноделии Винотурс
Термины оксидация и редукция или окисление и восстановление, используются для описания двух разных стилей винификации. То есть двух разных подходов к производству вина. Эти два процесса противоположны друг другу. И научно, и технологически. В статье объясняются оба стиля. И самое главное — их влияние на ароматы, вкусы и структуру вина.
Эти два процесса противоположны друг другу. И научно, и технологически. В статье объясняются оба стиля. И самое главное — их влияние на ароматы, вкусы и структуру вина.
Оксидация
Оксидация — это окисление. Это означает, что что-то соединяется с кислородом. И в результате этого окисляется.
Обычно в разговорах про вино мы употребляем это слово для обозначения дефекта вина. Это, кстати, одна из самых распространенных проблем. Она связана с чрезмерным воздействием кислорода на вино. Окисление — это преждевременное старение вина.
Редукция
Это слово происходит от латинского reductio. Дословно оно означает «возведение, приведение обратно». Приставка «ре» указывает на обратную направленность процесса.
В химии редукция означет восстановление из окисла. То есть, происходит «раскисление». Это означает, что редукция — процесс, противоположный окислению.
Для нудников и педантов добавим, что в результате процесса редукции молекула вещества теряет кислород. Который обычно замещается водородом. Желающие разобраться в химии процессов могут посмотреть в интернете тему «окислительно-восстановительные реакции».
Который обычно замещается водородом. Желающие разобраться в химии процессов могут посмотреть в интернете тему «окислительно-восстановительные реакции».
Из вступления должно быть понятно, что этими терминами, оксидация и редукция, грубо говоря описывается количество кислорода, участвующего в процессе.
Еще раз напомним, что сейчас мы будем говорить не о готовом вине. А о процессе его производства.
два стиля виноделия
Итак, уже понятно, что, оксидативный стиль означает большее присутствие кислорода в процессе. А редуктивное или восстановительное виноделие, соответственно, означает минимизацию воздействия кислорода на готовящееся вино.
Еще раз, схематично. Оксидативная винификация происходит в присутствии кислорода. А при редуктивной стараются избегать контакта сусла с воздухом.
оксидативный стиль
Основной смысл этого стиля заключается в развитии в вине вторичных ароматов и вкусов, добавление вину тельности, структуры, сложности. Химически это достигается путем ввода контролируемого количества кислорода в контакт с готовящимся вином. Здесь очень важен контроль, чтобы избежать переокисления.
Химически это достигается путем ввода контролируемого количества кислорода в контакт с готовящимся вином. Здесь очень важен контроль, чтобы избежать переокисления.
Технические приёмы
- ферментация в бочках-барриках
- батонаж — периодическое перемешивание осадка во время брожения
- ремонтаж — перекачивание сусла из нижней части бродильного чана в верхнюю с аэрацией или перекачивание сусла из одной бочки в другую
Редуктивный стиль
При использовании редуктивного стиля виноделы минимизируют контакт сусла с кислородом. Цель стиля — сохранить свежий фруктовый характер вина. Это проявляется и более бледным цветом, и легкой свежей ягодно-фруктовой ароматикой и вкусами.
технические приёмы
- ферментация с контролируемой температурой, как правило пониженной
- использование инертных газов
- использование диоксида серы
Риски и опасности
Окисление — это одна из самых больших опасностей процесса винификации. Или, для пользы объяснения, назовём её чрезмерно окисление. Нормальная, контролируемая оксидация позволяет виноделу развить в вине вторичные и третичные ароматы и вкусы. То есть ароматы, связанные с технологическими приёмами и выдержкой вина.
Или, для пользы объяснения, назовём её чрезмерно окисление. Нормальная, контролируемая оксидация позволяет виноделу развить в вине вторичные и третичные ароматы и вкусы. То есть ароматы, связанные с технологическими приёмами и выдержкой вина.
Однако при бесконтрольном воздействии кислорода вино окисляется. Такие вина легко заметить. Их отличает тусклый цвет с оранжевыми и коричневыми тонами. Аромат и вкус становятся плоскими. Они теряют все фруктовые ноты, скорее напоминают старый усталый херес. Как только вино окислилось, спасти его невозможно.
Самая главная опасность редуктивного стиля — это сульфиты. Вернее, их доза. Добавление слишком большого количества сульфитов в виноградное сусло (перед или во время ферментации) повышает вероятность образования летучих соединений серы, таких как сероводород или меркаптаны.
Обычно редукция как дефект вина проявляется в непривлекательных, мягко говоря, запахах. Таких как запах тухлых яиц, резины и моченой капусты.
Но с дефектами этого типа можно бороться. Декантация вина или энергичное взбалтывание, вращение в бокале, может помочь избавиться от этих нежелательных «ароматов».
Декантация вина или энергичное взбалтывание, вращение в бокале, может помочь избавиться от этих нежелательных «ароматов».
Примеры
Алиса из Страны Чудес в пересказе Бориса Заходера думала, что никому не нужны книжки без картинок или стишков. Точно так же никому не нужны статьи про вино без примеров. Для примера легче всего сравнить два «крайне противоположных» стиля белого вина — шардоне с ферментацией в дубовой бочке и новозеландский совиньон блан.
При ферментации шардоне в бочке-баррике сусло имеет контакт с определенным количеством кислорода. При этом еще периодически используют и батонаж, когда размешивают осадок с дна бочки. Зачастую проводят и молочно-яблочную (малолактическую) ферментацию (MLF).
Конечный результат — сливочные, маслянистые ароматы с насыщенным вкусом. То есть сливки, бриошь, тосты, жирное сливочное масло. Это классические ароматы вторичной группы. И классический пример окислительного стиля виноделия.
Очевидно, что в Новой Зеландии все происходит абсолютно наоборот. Виноград совиньон блан ферментируют в емкостях из нержавеющей стали. При постоянных низких температурах. Емкости закрыты. Контакт с воздухом минимален. О молочно-яблочной ферментации и речи быть не может.
Виноград совиньон блан ферментируют в емкостях из нержавеющей стали. При постоянных низких температурах. Емкости закрыты. Контакт с воздухом минимален. О молочно-яблочной ферментации и речи быть не может.
Получается свежее и очень ароматное вино с нотами грейпфрута, тропических фруктов и скошенной травы. Ароматика ярко выраженная, насыщенная и интенсивная. Почти как у духов. Классические первичные ароматы. И классический пример редуктивного стиля виноделия.
Реальная жизнь
Так что, все вина можно разделить на две группы по стилю изготовления? А вот и нет! В реальной жизни большинство вин изготавливаются с использованием комбинации обоих методов. Эта комбинация нужна для стабилизации вина.
Кислород, в контролируемых количествах, нужен для расщепления летучих соединений серы, образующихся во время ферментации. В красных винах кислород еще и способствует развитию цвета и терпкости. С другой стороны, добавление сульфитов предотвращает нежелательную вторичную ферментацию в бутылке. Без сульфитов вино вряд-ли проживет более полугода.
Без сульфитов вино вряд-ли проживет более полугода.
Пример Винотурс
Перед тем, как завершить статью, хотим привести пример из реальной жизни израильского виноделия. Речь пойдет о винодельне Сфера. Эта винодельня расположена в посёлке Гиват Ишиягу в Иудейских горах. И специализируется на производстве исключительно белых вин. Одно вино из портфолио винодельни — шардоне.
Это вино — сортовой бленд. Весь виноград поступает с одного и того же виноградника. Урожай с верхней части склона идет на бочковую ферментацию. Мы уже знаем, что это оксидативный стиль. Урожай с нижней части склона, на котором расположен виноградник, идет на ферментацию в ёмкости из нержавеющей стали. С контролируемой [низкой] температурой брожения. И мы опять-таки знаем, что это — стиль редуктивный.
В конце процесса вино купажируется. Год от года винодел меняет пропорцию, в зависимости от особенностей урожая и подготовки вин. Например, последнее вино было ассемблировано в пропорции примерно 30% оксидированного стиля и 70% — редуцированного.
Кредит
Тим Маккирди — Tim McKirdy — винный журналист. Бывший профессиональный шеф-повар. Работал в престижных ресторанах, на кухнях в Лондоне и Буэнос-Айресе. В Instagram известен как @timmckirdy. Мы узнали про него, когда готовили материал по старосветским вина из сорта совиньон блан. Он написал статью 7 of the Best Sancerre Blanc Wines for Less Than $30.
Просматривая другие его публикации мы и наткнулись на работу Reductive vs. Oxidative Winemaking, Explained. Прочитав ее, мы решили, что эта тема будет интересна и для наших читателей. И перевели её на русский язык. Так что все плюсы этой статьи принадлежат Тиму. А ошибки и недочеты — наши.
Что еще почитать
What is Oxidation Doing to My Wine?
Понравилось это:
Нравится Загрузка…
Могут ли быть дефекты вина хорошими и плохими – статья Strongwine.ru
Про вино12.09.2019Сразу определимся с терминологией, и под словом дефект не будем понимать что-то однозначно плохое. Для максимальной объективности определим это как отклонение от нормы. Ведь, если начистоту, то вино как таковое – это одно сплошное отклонение от «нормы» – виноградного сока. И вот с этой точки зрения уже становится интереснее.
Для максимальной объективности определим это как отклонение от нормы. Ведь, если начистоту, то вино как таковое – это одно сплошное отклонение от «нормы» – виноградного сока. И вот с этой точки зрения уже становится интереснее.
Несмотря на то, что крупные производители всё-таки стремятся к максимальному перфекционизму в отношение своей продукции, есть ряд дефектов вина, которые остаются актуальными по сей день. Проявляются они далеко не в каждом вине и в совершенно разной степени. И вот как раз эта самая степень и определяет, годится вино ещё в употребление, или уже безвозвратно утеряно. А может, в «гомеопатических дозах» проявление дефекта пойдёт даже на пользу. Рассмотрим каждый такой эффект с двух сторон по отдельности.
Оксидация
Оксидация вина – это, проще говоря, окисление. Происходит этот процесс из-за контакта вина с кислородом. Оксидации потенциально подвержено вино на любом этапе. И если процесс протекает в микромасштабах – например, кислород просачивается через микропоры в дубовой бочке, то это помогает снизить танинность и в целом содействует сбалансированности вкуса. Хуже, если контакт вина с кислородом более интенсивный.
Хуже, если контакт вина с кислородом более интенсивный.
Плохо
Значительное переокисление убивает фруктовую свежесть, в аромате и вкусе появляется что-то похожее на прелое яблоко, послевкусие становится горьковатым. Меняется даже цвет – вино темнеет раньше срока.
Хорошо
В производстве некоторых вин допускается некоторое окисление в пределах разумного, за счёт чего вино приобретает свой самобытный вкус и аромат. Это традиционные французские вина Баньюльс и Мори, некоторые креплёные портвейны, некоторые хересы. Даже мадейра – это яркий пример оксидативного вина.
Редукция
Противоположный окислению процесс – реакция восстановления. Некоторые виды винограда склонны к именно такому характеру нарушения кислотного баланса. И если говорить о редукции применительно к вину, то этот процесс неразрывно связан с применяемыми в производстве вина серными соединениями. Наиболее склонные к редукции сорта – совиньон блан и сира (шираз).
Плохо
Если с вином происходит такая реакция, и она протекает длительное время неконтролируемо, то результатом будет крайне неприятный запах – тухлых яиц или его «щадящий» вариант – варёной капусты.
Хорошо
Если редукция произошла аккуратно и контролируемо, это может дать легкую ароматическую особенность – чуть «дымные» нотки или «чиркнутая спичка». Такая индивидуальность находит множество поклонников. Характерный пример – многие известные вина из сорта совиньон блан имеют этот неповторимый «оружейно-кремневый» тон.
Бреттаномицес (бретт)
Это слово, произнося которое, можно сломать язык в пяти местах, означает всего лишь попадание в вино посторонней культуры дрожжей. Такое может произойти почти исключительно с изначально малокислотным вином.
Плохо
Когда «процесс пошёл» интенсивно и неконтролируемо, паразитные дрожжи произведут целый комплект органических соединений, которые сообща создадут совершенно сокрушительный «букет» в самом плохом смысле. Специалисты называют запахи пропотевшего седла, липкой ленты, копчёного бекона, даже (sic!) скотного двора.
Хорошо
Казалось бы, после вышеописанного у бретта нет никаких шансов на реабилитацию. Оказывается, отнюдь. Знатоки полагают, что в минимальных объёмах присутствие дрожжей бреттаномицеса и продуктов их пахучей жизнедеятельности придаёт вину комплексности. Этого мнения придерживаются многие специалисты, даже с мировым именем.
Оказывается, отнюдь. Знатоки полагают, что в минимальных объёмах присутствие дрожжей бреттаномицеса и продуктов их пахучей жизнедеятельности придаёт вину комплексности. Этого мнения придерживаются многие специалисты, даже с мировым именем.
Летучая кислотность
Отдельные кислоты из жидкого состояния быстро переходят в газообразное, издавая интенсивный запах. При производстве вин некоторые виды бактерий при определённых условиях могут стать виновниками образования таких кислот.
Плохо
Типичная летучая кислота, образующаяся в вине при нежелательном воздействии соответствующих бактерий – уксусная, а также её производное соединение – этилацетат. Первая «пахнет» сама собой – запах уксуса знает каждый, а второй – лаком для ногтей. Соотношение может быть самым разным.
Хорошо
Оказывается, что и здесь, если процесс образования летучих кислот не вышел из-под контроля, это может пойти вину на пользу. В первую очередь это касается ботритизированных вин, но и в ароматике некоторых красных вин летучая кислотность может сыграть положительную роль.
Болезнь пробки
Наконец, едва ли не самый известный или, во всяком случае, понятный дефект – пробковая болезнь вина. Здесь тоже всему виной микроскопическая живность, продукты жизнедеятельности которой выделяют не слишком ароматные органические соединения.
Плохо
Испорченная пробка может лишь немного повлиять на ароматику вина, а может убить её вовсе, если процесс был достаточно обильным. И если это произошло, вино может получить запах мокрой газеты, картона и, конечно же, плесени.
Хорошо
А вот здесь уже ничего хорошего нет. Даже в микроскопических концентрациях болезнь пробки попросту глушит ароматику вина.
Как видим, в дефектах вина действует тот же закон, что и в любых других сферах. Почти что угодно в разумных дозах может быть полезным за редкими исключениями. Но при превышении этого еле уловимого порога происходит эффект ложки дёгтя в бочке мёда.
Поделиться в соц.сетях
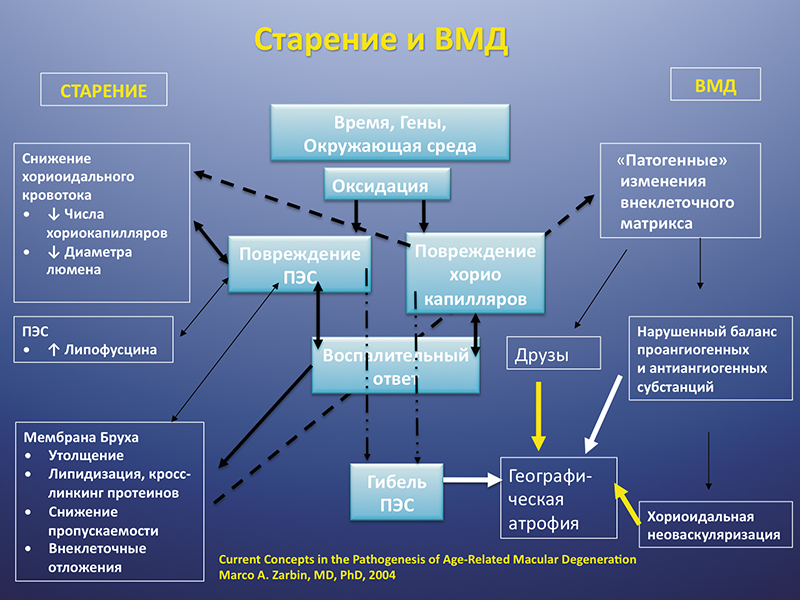
Окисление организма: как найти баланс?
16 Ноября 2020
1 Декабря 2020
5 минут
2655
ProWellness
Оглавление
- Окисление организма: как найти баланс?
- Результаты окислительных реакций
- Баланс окислительных и антиокислительных процессов – залог долголетия
- Факторы нарушения баланса окислительных процессов:
- Антиоксиданты – полноценная защита организма
- Сохраняйте баланс в организме, живите яркой, свободной жизнью!
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Многие разрушительные процессы в нашей жизни связаны с окислением, то есть происходят при участии кислорода. Однако окислительные реакции просто необходимы для нормальной жизнедеятельности организма. Они влияют на образование энергии, восстановление, процессы гомеостаза и другие жизненно важные функции. Главное здесь – сохранить баланс и не допустить перехода границы, когда окисление превращается в нашего врага.
Окисление организма: как найти баланс?
Процессы, происходящие в организме человека, неизменно связаны с реакцией окисления. При этом сложные вещества распадаются (окисляются) до более простых и выделяется энергия, необходимая для жизни.
При этом сложные вещества распадаются (окисляются) до более простых и выделяется энергия, необходимая для жизни.
Однако результаты подобных окислительных процессов могут иметь два итога: положительный и отрицательный.
Результаты окислительных реакций| ПОЛЕЗНОЕ ДЕЙСТВИЕ | ПОВРЕЖДАЮЩЕЕ ДЕЙСТВИЕ |
|
|
Баланс окислительных и антиокислительных процессов – залог долголетия
Необходимое условие нормального функционирования всех систем организма и здоровья человека – баланс между окислительными и антиокислительными процессами. Смещение этого явления в ту или другую сторону может являться как патологией, так и приспособительной реакцией.
Смещение этого явления в ту или другую сторону может являться как патологией, так и приспособительной реакцией.
Если окислительных процессов становится больше, то нашему организму приходится нелегко. Большое количество свободных радикалов (которые образуются в процессе окисления) вызывает оксидативный стресс, при котором поражаются здоровые клетки организма.
Это может привести к развитию злокачественных опухолей, преждевременному старению и серьезным заболеваниям. Различные вирусы активнее проникают в организм, так как он не защищен, а мы становимся более уязвимы для инфекционных заболеваний.
Когда организм ослаблен, вредное UV-А-излучение запускает процесс окисления, нанося непоправимый вред как коже, так и организму в целом. От этого страдают иммунная система и ДНК.
Факторы нарушения баланса окислительных процессов:
- Ионизирующее излучение.
- Химические препараты.

- Бактерии, вирусы.
- Алкоголь, курение.
- Загрязнение окружающей среды.
- Неправильное питание.
Одно из решений – восстановление или своевременное поддержание баланса между окислительными и антиокислительными процессами. Это возможно при регуляции процессов окисления с помощью рациона питания и качественного улучшения образа жизни.
Особенно об этом необходимо помнить жителям крупных городов, где выхлопные газы и неправильное питание разрушают антиоксидантную систему в организме. Внутри человека постепенно накапливаются вредные вещества, которые приводят к оксидативному стрессу и вызывают различные патологии.
Антиоксиданты – полноценная защита организма
На сегодня известно более 3000 разнообразных антиоксидантов. Обычно их подразделяют на 4 группы:
- Биофлавоноиды растений. Действуют как ловушка: захватывают свободные радикалы и токсины и выводят их из организма.
 С их помощью можно снизить риск возникновения сердечно-сосудистых и онкологических заболеваний. Источник: катехин, который содержится в зеленом чае, красном вине, цитрусовых.
С их помощью можно снизить риск возникновения сердечно-сосудистых и онкологических заболеваний. Источник: катехин, который содержится в зеленом чае, красном вине, цитрусовых. - Витамины. Поглощают излишнюю энергию агрессивных свободных радикалов, а также прекращают или затормаживают развитие цепной реакции. Бывают двух видов: жирорастворимые (защита жировой ткани) и водорастворимые (защита мышц и сосудов). Например, витамины А, Е, С, бета-каротин.
- Минеральные вещества, которые человек не способен вырабатывать сам. Поддерживают нормальный уровень витаминов в организме и защищают от инфекций. Пример: селен, марганец, кальций, цинк.
- Ферменты. Выступают в роли катализаторов, обеззараживая и ускоряя процесс вывода свободных радикалов. Пример: фермент коэнзим Q10.
В зависимости от происхождения можно выделить два вида антиоксидантов:
-
Природные (содержатся в продуктах питания и лучше всего усваиваются организмом).

- Синтетические (препараты, производящиеся фармацевтической промышленностью). Самый богатый источник антиоксидантов – растительная пища. Кстати, кожура, семечки и корневища наиболее богаты этими ценными элементами. Некоторые ученые предполагают, что самые эффективные антиоксиданты – это биофлавоноиды, которые находятся в кожуре ярко окрашенных растений, например в винограде, свекле, чернике, баклажанах, капусте фиолетового цвета.
Основными источниками сильнейших антиоксидантов являются:
- апельсины, абрикосы, папайя, арбузы, мандарины, нектарины, киви, манго, орехи;
- морковь, горчица, семена подсолнечника, тыква, шпинат;
- брокколи, свекла, кукуруза, томаты, спаржа, шпинат;
- тунец, птица, говядина, устрицы, зерновой хлеб, молочные продукты;
- красное мясо, устрицы, фасоль, красная рыба.
Баланс антиоксидантных и окислительных процессов является незаменимой профилактикой многих опасных заболеваний. Продлите свою молодость и отличное настроение с помощью регулярного приема антиоксидантов!
Продлите свою молодость и отличное настроение с помощью регулярного приема антиоксидантов!
Сохраняйте баланс в организме, живите яркой, свободной жизнью!
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.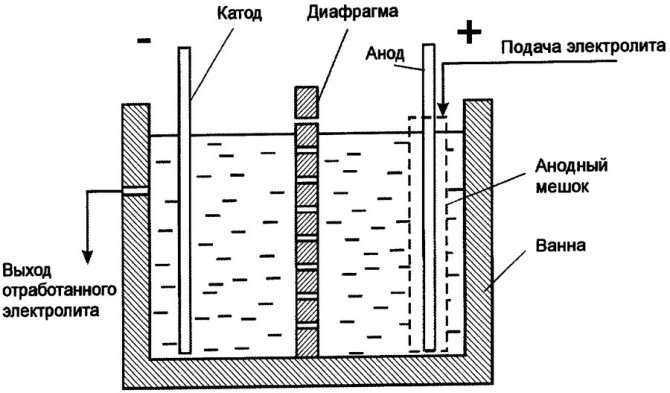
Эксперт: Екатерина Воробьева Адепт здорового и активного образа жизни
Рецензент: Екатерина Воробьева Адепт здорового и активного образа жизни
Читайте другие статьи по схожим темам
окисление организмабаланс окислительных и антиокислительных процессовфакторы нарушения баланса окислительных процессов
Оцените статью
(1 голосов, в среднем 5)
Поделиться статьей
Как проверить, хорошее ли вино
Автор винного сервиса Invisible.ru рассказывает, как по внешнему виду и вкусу понять, хорошее ли вино или с ним какие-то проблемы
Партнерский материал
Иллюстрация: Павел Лысцов
Личная оценка вина — штука субъективная. Тебе понравилось, а друга перекосило — кисло ему. Критики вино нахваливают, а тебе навозом пахнет и вообще странно. И каждый по-своему прав. Реально полезно тут другое: уметь с первого взгляда и глотка определять, что вино старое или, например, неправильно хранилось.
Смотрим
Зачем? Цвет — быстрый способ оценить форму вина. Если в ресторане принесут «Цезарь» с впавшими в тоску листьями салата, вы откажетесь, не пробуя. Так и с вином: иногда по цвету можно сразу понять, что с вином не все в порядке.
Как? Наливаем вино в прозрачный бокал, берем за ножку и наклоняем над чистым листом бумаги или белой салфеткой почти горизонтально — смотрим на все это сверху. Если света мало, выручит фонарик на телефоне.
Чего не должно быть:
- Вино не может быть рыжеватым или коричневым — это значит, оно уже не в кондиции. Причины тут могут быть разные, от неправильного хранения до почтенного возраста. Если вы не выбрались на дегустацию вин 90-х годов, а принесли бутылочку прошлого урожая из супермаркета, закрывайте ее и смело несите обратно.
Что может быть:
- Небольшая мутность — сейчас фильтровать вина становится немодно.
 Считается, что мутное, нефильтрованное вино сохраняет больше вкуса. Мутность особенно часто можно встретить в биодинамических и натуральных винах.
Считается, что мутное, нефильтрованное вино сохраняет больше вкуса. Мутность особенно часто можно встретить в биодинамических и натуральных винах. - Оранжевые оттенки во всех винах старше 5 лет. Еще это нормально для хересов и (вот сюрприз!) оранжевых вин: грузинских из квеври и vin jaune («желтых вин») из французского региона Жюра.
- Легкий прозрачный осадок в виде кристаллов — это соли винной кислоты, и это не дефект. Но, чтобы не смущать покупателей, виноделы часто перестраховываются и избавляются от такого осадка заранее. Для этого вино охлаждают и дополнительно фильтруют.
Лирика
Если эту проверку вино прошло, можно расслабиться и порассуждать, какого оно цвета. Если в голову ничего не приходит, поможет интернет — там много таблиц с подсказками. Хотя никто не мешает нам проявить независимость и вместо всяких марсал и сакур вспомнить про оттенки докторской колбасы или дедовской вишневой «девятки».
Нюхаем
Зачем? Эта проверка позволяет убедиться в том, что пробка вина не испортилась (это самый распространенный дефект, но касается только натуральных пробок), а винодел блюдет на производстве гигиену.
Как? Возьмите бокал за ножку и попробуйте раскрутить содержимое. Если на весу не выходит — поставьте на стол и подвигайте основание по кругу. Нужно, чтобы вино образовало маленькую воронку. После этого поднесите к носу и вдохните пару раз.
Чего не должно быть:
- Запаха, похожего на запах мокрого картона или старой затхлой тряпки, — это как раз проблемы с пробкой. Понюхайте ее саму — скорее всего, аромат тоже будет не очень. Изредка неприятный запах из вина может уйти, если перелить его в декантер и дать постоять. Но лучше всего отнести бутылку (полную) обратно в магазин и попросить заменить.
- Запаха оливок, грибов или серы, как будто пахнет горящей спичкой. В особо тяжелых случаях могут быть даже тухлые яйца или вареная капуста. Это редукция, вино задохнулось. Такое перелейте в декантер и дайте постоять, а лучше еще бросьте туда медную монетку. Медь свяжет серу, и аромат раскроется.
- Ждали ягод-специй, если это красное, или цветов и фруктов, если белое, а из бокала прут какие-то залежалые яблочки, старые орехи и тлен.
 Скорее всего, вино еще и с рыжиной, хотя молодое. Это оксидация, или перенасыщение вина кислородом, из-за чего оно слишком быстро стареет. Такое происходит, если вино неправильно хранилось или пробка пересохла и пустила слишком много воздуха. Пить можно, но далеко не всем винам такой эффект идет.
Скорее всего, вино еще и с рыжиной, хотя молодое. Это оксидация, или перенасыщение вина кислородом, из-за чего оно слишком быстро стареет. Такое происходит, если вино неправильно хранилось или пробка пересохла и пустила слишком много воздуха. Пить можно, но далеко не всем винам такой эффект идет.
Что может быть:
- Пахнет не романтично — навозом. Причина — дрожжи бретт, которые появляются в вине, если в нем мало кислоты или если серу, которая обычно используется как консервант, в вино не добавляли. Навозные ароматы часто можно встретить в винах модных виноделов, которые отказались от серы. Это можно считать дефектом, а можно нежно любить, но вот избавиться от этого точно не получится.
- Что-то кислое, пахнет бабушкиными соленьями, помидорами из трехлитровой банки. И опять то же самое — для большинства сомелье это дефект («уксусом пахнет»), а другие считают это изюминкой. На вкус и цвет…
- Легкая нота бензина или дизеля.
 Этот неожиданный запах бывает у вин из сорта Рислинг, его называют бензольной или керосиновой нотой, и это не дефект. Если хотите распробовать бензольную ноту, чтобы было ярко и понятно, берите рислинг из теплых стран — австралийский, например.
Этот неожиданный запах бывает у вин из сорта Рислинг, его называют бензольной или керосиновой нотой, и это не дефект. Если хотите распробовать бензольную ноту, чтобы было ярко и понятно, берите рислинг из теплых стран — австралийский, например. - Кошачий лоток. Не дефект, бывает в винах из сорта Совиньон блан. Запах на любителя, если вас пугает — не берите совиньоны из северных регионов. Сильнее холод — больше котов в вине.
- Запах сырого мяса или даже крови. Чаще всего встречается в насыщенных красных винах — австралийском ширазе, каберне совиньоне или риохе. И это не дефект. Таким вином стоит поднимать уровень железа в крови.
Лирика
Первое знакомство с человеком, вынюхивающим из бокала брюшко кролика и ноты деревенской АЗС, приводит в ужас. Но стоит попробовать самому — и быстро втягиваешься, особенно если найдется друг, который тоже готов заморочиться. Тем более что в одном и том же вине каждый чувствует что-то свое: один вспомнит яблочную жвачку, а другой — мамину шарлотку.
Пробуем
Зачем? Это как финальное подтверждение, что вино нормальное. Основные дефекты мы отсеиваем, когда проверяем цвет и запах, так что до этого этапа испорченная бутылка дойти не должна. К тому же на вкус мы ощущаем не так много: горькое, соленое, сладкое и кислое. Все эти ягоды, коты и прочее — все в аромате. Вкус должен быть приятным, но жестких требований к нему нет. Но лучше проговорим, что во вкусе нормально, а что должно насторожить.
Как? Наберите в рот немного больше вина, чем обычно. После этого аккуратно погоняйте его, как будто решили прополоскать рот после чистки зубов. Вино должно побывать везде: на деснах, на всей поверхности языка и т. д. После этого проглотите вино и обратите внимание, как долго вы ощущаете его вкус.
Чего не должно быть:
- Горечи. Если вино сильно горчит, это еще один признак оксидации или преждевременного старения, как и кирпич в цвете и орехи-яблоки в запахе.

- Винного уксуса. Если вину слишком тепло, оно вполне может превратиться в уксус. Это будет чувствоваться и в аромате, но если будут сомнения — вкус подтвердит. Такое случается, если вино неправильно хранилось в магазине или дома вы решили поставить его к батарее. Уксусные бактерии разрушают алкоголь, поэтому эффекта от такого вина тоже не будет.
Что может быть:
- Немного пузырьков. Наливаете вино в бокал, а на стенках бокала пузырьки, и во рту странно покалывает. Причина в том, что иногда в уже разлитом в бутылки вине остается немного сахара, и оно бродит, пока едет к нам. Это не всегда дефект — иногда такой ход даже помогает сделать вино более свежим на вкус, но это чаще касается белых.
Совет
Когда пробуете вино, взять от вкуса и ароматов больше поможет ретроназальная дегустация. Так по-умному называется «булькание» вином. Нужно набрать в рот чуть больше, чем обычно, вина и вдохнуть сквозь него воздух. Так мы делаем, когда случайно отхлебнули глоток горячего чая и пытаемся его остудить. Не стесняйтесь издавать громкие звуки — это нормально и выглядит очень профессионально.
Так мы делаем, когда случайно отхлебнули глоток горячего чая и пытаемся его остудить. Не стесняйтесь издавать громкие звуки — это нормально и выглядит очень профессионально.
- Пробуйте вино подходящей температуры. Слишком холодное вино просто не будет пахнуть. Этим пользуются рестораны, замораживая свои не лучшие вина. В слишком теплом вине (хранилось в шкафу на кухне) начнет выпирать алкоголь. Вкус будет не самым приятным, и в аромате, кроме спирта, сложно будет что-то найти. Ставьте красное вино в холодильник минут на 15 перед тем, как пробовать, а белое — часа за 2,5.
- Пейте вино из нормальных бокалов. Бокал должен быть без декора и цвета, достаточно большой (хотя бы 300 мл) и с сужающимися кверху стенками. Это поможет разглядеть вино, учуять все запахи и по полной его распробовать.
- Сначала попробуйте вино отдельно от еды. Это дает возможность не отвлекаться на ее запахи.
Углубляться в тона опавших листьев и спорить по поводу разновидности топлива в рислинге — вещь добровольная. Не хотите — не заморачивайтесь. Но отличать испорченное вино от просто необычного — полезный для всех навык. Сразу знаешь, когда бутылку возвращать в магазин, а когда сам можешь провести успешную реанимацию. Правда, надо понимать: все люди разные, вина тоже. Иногда дело не в дефектах, а в том, что вы с этим вином просто не подходите друг другу.
Не хотите — не заморачивайтесь. Но отличать испорченное вино от просто необычного — полезный для всех навык. Сразу знаешь, когда бутылку возвращать в магазин, а когда сам можешь провести успешную реанимацию. Правда, надо понимать: все люди разные, вина тоже. Иногда дело не в дефектах, а в том, что вы с этим вином просто не подходите друг другу.
Хорошим вином всегда обеспечит сервис Invisible. А чтобы вам было проще отличать хорошее от плохого, научит разбираться в вине и подарит с первым заказом пару правильных бокалов. Они помогают вину раскрыться и выдать максимум вкуса.
| Забрать бокалы |
Химическое оксидирование металлов и стали – технология, что это такое – термическая оксидация – rocta.ru
В чем заключается метод оксидации
Большинство металлических веществ вступает в активную фазу с различными химикатами. В ряде случаев она происходит с выделением стороннего вещества, которое может стать защитой для основного изделия. В рассматриваемом способе возникает оксидная пленка после нанесения на поверхность специального раствора.
В рассматриваемом способе возникает оксидная пленка после нанесения на поверхность специального раствора.
Жидкость под влиянием окислительно-восстановительной реакции приводит к созданию верхнего слоя, который увеличивает коррозийную стойкость, а также декорирует плоскость.
Следует отметить, что разновидностей процесса несколько, они выбираются в зависимости от того, какого эффекта нужно добиться, а также – какой материал подвергается обработке. Посмотрим более внимательно за видами.
Лазерное оксидирование
Эта технология достаточно сложна и требует специального оборудования. Для проведения оксидирования используют:
- импульсное лазерное излучение;
- непрерывное излучение.
В обоих случаях применяются лазерные установки инфракрасного диапазона. За счёт лазерного прогрева верхнего слоя материала удаётся получить достаточно стойкую защитную плёнку. Однако этот метод применяется только для поверхности небольшой площади.
Лазерное оксидирование
Методы
Каждый из них обладает определенной популярностью, большинство применяется на заводах в определенных условиях. Но есть возможность самостоятельного проведения металлообработки. При этом стоит помнить о возможном негативном воздействии на организм и средствах защиты.
Химическое оксидирование стали, технология
На поверхность металлического изделия наносится жидкий раствор, сухая смесь или расплав. Затем между этими элементами происходит реакция (в определенных условиях, например, с доступом кислорода, при выставленном температурном режиме). Ее результатом становится образование неактивного верхнего слоя – эту процедуру называют пассивацией, то есть верхний слой делают пассивным по отношению к некоторым средам. Чаще всего для этих целей применяются окислы хрома.
Заготовка закрепляется тем или иным образом и погружается в ванну с заготовленным раствором (это возможно при нескольких условиях – при соответствующих размерах объекта и резервуара и при стенках сосуда, которые не вступают в реакцию). Щелочной или кислотный состав создается заблаговременно и обладает определенным процентным соотношением. В зависимости от параметров определяется степень выдержки. Спустя необходимое время деталь достается, подвергается сушке, а затем проводятся финишные работы по металлообработке.
Щелочной или кислотный состав создается заблаговременно и обладает определенным процентным соотношением. В зависимости от параметров определяется степень выдержки. Спустя необходимое время деталь достается, подвергается сушке, а затем проводятся финишные работы по металлообработке.
При создании кислотной ванны с наибольшей вероятностью применяют такие кислоты, как соляная, азотная, ортофосфорная. Если добавить капсулы марганца, хрома или калия, то протекание будет ускорено. Обычно выбирается температурный режим в рамках от +30 до +100 градусов.
Если в качестве основы соединения нитрата натрия и диоксида марганца, то можно говорить о применении щелочного раствора, который нагревается уже значительно сильнее – до 300 градусов.
Также есть две разновидности, когда применяют дополнительные вещества, влияющие на качество полученного результата:
- бихромат калия позволяет закрепить итоговые достижения;
- масло – такой процесс называют оксидацией с промасливанием или химоксидированием, при котором удается не только добиться высокой устойчивости к ржавлению, но и получить черный глянцевый цвет поверхности.

Термическое оксидирование
Это аналогичный способ, в ходе которого образуется защитная оксидная пленка, но он проходит при повышенной температуре при непосредственном контакте с водяным паром или с кислородом. Для данного действия требуются специальные печи, которые могут поддерживать режим работы вплоть до 1200 градусов – для различных материалов характерны свои показатели.
Если вы хотите улучшить эффект, рекомендуем предварительно погрузить деталь в мыльный раствор на несколько минут, а после этого высушить и залить ванночку машинным или трансформаторным маслом. Если произвести нагрев до 105 градусов и выше, то можно добиться равномерной, блестящей черной поверхности.
Анодная оксидация – что это
Ее также называют электрохимическим оксидированием или анодированием. Это еще один вариант, как можно достаточно быстро получить оксидную пленку в жидкости или сухой смеси. Основной процесс, который заложен в основе технологии – это электролиз, который, как известно, может проходить и в жидких, и в твердых средах.
Элемент помещается в раствор. Между ним и жидкостью образуется разница потенциалов – у верхних слоев он изначально положительный, а у смеси – отрицательный. Следует отметить, что подача напряжения, а также использование активных реагентов приводит к тому, что процедура считается небезопасной, по крайней мере для домашнего воплощения.
При анодировании достигается две задачи – декоративное оформление и создание защитного слоя. Чаще всего этому подвергается алюминий, который по своей природе не обладает достаточными характеристиками жесткости, прочности, устойчивости к механическим воздействиям.
В зависимости от того, какая кислота используется, а также какие параметры напряжения выставлены, можно добиться полученной пленки различной толщины.
Тонкими они будут, если применять B(OH)₃ (борную) или H₃PO₄ (ортофосфорную). Но если нужно придать интересный оттенок оксидированной стали, то следует использовать органические кислоты, например, щавелевую, малеиновую, сульфосалициловую.
Используют также и слабощелочные составы, чтобы погружать в них детали и пропускать слабый переменный или импульсный ток. Данный процесс называется микродуговой обработкой и отличается тем, что можно достичь хороших результатов. Поверхность не только хорошо смотрится и не ржавеет, но и становится более теплостойкой, приобретает изоляционные качества.
Особенный подход нужно применять к нержавеющей стали. Она является инертным, то есть нейтральным сплавом. Как можно понять, добиться разности потенциалов в таком случае достаточно сложно. Поэтому процедура становится двухступенчатой.
Сперва проводится двойное анодирование – то есть в ванну с составом погружают не только нержавейку, но и еще один элемент, который по своим характеристикам больше подходит для процесса. Для этих целей годится никель, медь.
Второй этап – это уже самостоятельное оксидирование нержавеющей стали. Но чтобы повысить эффективность и ускорить достижение результата, рекомендовано наносить пассивирующие пасты. Их назначение – ускорение реакции.
Их назначение – ускорение реакции.
Плазменный метод
Также его называют микродуговым. Его особенность в том, что создается плазма с большим содержанием кислорода. При этом она не нагревается, поддерживаются низкие температуры. Сама генерация потока происходит под воздействием зарядов, которые, в свою очередь, образуются под влиянием переменного или импульсного тока высокой или сверхвысокой частоты.
Обычно способ применяется, когда нужно создать оксидную пленку с целью защиты на относительно небольшой поверхности изделия. Чаще всего используется технология в электронике и микроэлектронике, например, при производстве полупроводников, транзисторов, диодов, микросхем. Второе назначение – увеличение светочувствительности, поэтому применяют процедуру для повышения чувствительности в фотокатодах.
Иногда все же более целесообразно делать плазму с повышенной температурой – до 430 градусов и выше. Качество при этом сильно повышается.
К преимуществам микродугового оксидирования стоит отнести:
- Слой оксида может достигать до 70% вглубь основной заготовки.

- Толщина около 200 – 250 мкм.
- Очень хорошо обрабатывать элементы, имеющие сложный рельеф.
- Отличное поведение на магниевых и алюминиевых сплавах.
Лазерное
С целью увеличения коррозийной стойкости можно добиться образования оксидной пленки на сталь, используя установку лазера. Особенность процесса в том, что для его совершения обязательно нужна специализированный станок. Наиболее эффективно зарекомендовало себя применение волоконного лазера в инфракрасном диапазоне свечения. Можно использовать три методики:
- импульсное излучение;
- непрерывный световой поток;
- точечный нагрев материала.
Отметим, что технология требует достаточно высоких затрат, а также не подходит для больших металлических элементов конструкций. Хорошо применять для ограниченных плоскостей, используя станки с ЧПУ.
Оксидирование своими руками
Если нужно сделать оксидную пленку дома, то для хорошего результата следует строго следовать последовательности действий, а также придерживаться правил безопасности.
Ниже мы более подробно расскажем о поэтапном проведении самостоятельной оксидации, но сперва обсудим – а зачем это делать?
Химическое оксидирование
Этот процесс предполагает обработку металлов растворами, смесями, расплавами химических элементов (такие окислы как окислы хрома). Данное оксидирование позволяет провести так называемую пассивацию поверхности металла. Он предполагает создание в близком к поверхности слое металла неактивного (пассивного) образования. Создаётся тонкий поверхностный слой, защищающий основную часть конструкции.
Технологически этот процесс реализовывается посредством опускания подготовленной металлической детали в раствор щёлочи или кислоты, заданного процентного соотношения.
Выдерживают его там определённое время, которое позволяет полностью провести окислительно — восстановительную реакцию. Затем деталь тщательно промывают, подвергают естественной сушке, окончательной обработке.
Химическое оксидирование стали
Для создания кислотной ванны применяют три вида химически активных кислот: соляную, азотную, ортофосорную. Ускорение протекания химической реакции стимулируют добавлением в раствор кислоты соединений марганца, калия, хрома. Реакция окисления протекает при температуре раствора в интервале от 30 °С до 100 °С.
Ускорение протекания химической реакции стимулируют добавлением в раствор кислоты соединений марганца, калия, хрома. Реакция окисления протекает при температуре раствора в интервале от 30 °С до 100 °С.
Применение растворов на основе щелочных соединений позволяет использовать добавки соединений нитрата натрия и диоксида марганца. В этом случае температура раствора необходимо повышать до 180 °С, а с добавками и до 300 °С.
После проведенной процедуры деталь промывают и просушивают. Иногда для закрепления процесса химической реакции применяют бихромат калия. Для увеличения срока сохранения образованной плёнки проводят химическое оксидирование с промасливанием. Иногда такой процесс называют химоксидирование. При окончательном покрытии маслом получается надёжное покрытие от коррозии, обладающее эффектным высоко декоративным чёрным цветом.
Что дает процесс
Производители деталей из металла знают, что основная проблема, почему их продукция быстро выходит из строя, – это образование коррозии. Дело в том, что фактически любое вещество, обладающее металлическими свойствами, достаточно сильно подвергается влиянию внешней среды. Это влажность, температурные перепады, солнечное излучение, реакции с кислородом, а также загрязнения и естественный износ. Посмотрим, что дает оксидирование для производителей.
Дело в том, что фактически любое вещество, обладающее металлическими свойствами, достаточно сильно подвергается влиянию внешней среды. Это влажность, температурные перепады, солнечное излучение, реакции с кислородом, а также загрязнения и естественный износ. Посмотрим, что дает оксидирование для производителей.
Антикоррозийные свойства
Даже при постоянном нахождении на улице под дождем и при контакте с воздухом не происходит ржавления. Это очень актуально для элементов корпуса автомобилей и других предметов, которые преимущественно эксплуатируются вне помещения.
Ограничение воздействия внешней среды
Есть некоторые средства, которые являются агрессорами по отношению к металлу. Проще говоря, они разрушают его поверхность и даже проникают более глубоко в структуру, нарушая целостность. Это пары химикатов или жидкости, а также самый обыкновенный ультрафиолет.
Электроизоляционные характеристики
Ряд деталей должен стать диэлектриком, то есть не пропускать электричество. С такой задачей отлично справляется создаваемый диэлектрический слой.
С такой задачей отлично справляется создаваемый диэлектрический слой.
Придание оригинального декоративного вида
Это может быть черный глянцевый блеск или более экзотический перелив различных цветов. Смотрится очень красиво, причем практичность остается такой же высокой.
Оксидирование стали
Одной из важных задач по сохранению металлических конструкций является борьба с вредным воздействием окружающей среды. Повышенная влажность, наличие в воздухе химически активных элементов, способных разрушать целостность металла, особенно стали, приводит к ухудшению таких показателей как надёжность и прочность.
Для решения этой задачи готовые изделия покрывают различными видами защитных покрытий.
Хим оксидирование стали: преимущества
Теперь перечислим особенности, которых можно добиться, если использовать технологию создания оксидной пленки с помощью химикатов.
Надежное покрытие антикор
Стальная деталь фактически становится нержавейкой.
То есть ржавление хоть и не полностью исключено, но очень значительно заторможено.
Хорошие электрические изоляторы
После химической обработки можно ожидать, что поверхность совсем или частично перестает проводить ток. Все будет зависеть от того, какой раствор был взят, в какой концентрации и пр.
Тонкий, но стойкий поверхностный слой
Интересно, что может быть достигнута пленочка, толщиной всего в 200 мкм. Но это не делает ее более восприимчивой к механическим или иным вредителям.
Оригинальная цветовая гамма
Это больше признак анодирования.
Но мы отметим, что после процедуры можно получить не только черный цвет, но и переливчатые волны от желтого к темно-синему, как на фото.
Преимущества оксидирования стали и методы обработки
Оксидирование стали – это один из наиболее эффективных способов защиты поверхности металла от негативных внешних воздействий. В результате на металле образуется защитное покрытие в виде специфической пленки. Особенности и функции такой пленки напрямую зависят от метода оксидирования. Рассмотрим подробнее каждый из способов такой обработки, но сначала узнаем, какими вообще характеристиками обладает оксидированный металл.
Особенности и функции такой пленки напрямую зависят от метода оксидирования. Рассмотрим подробнее каждый из способов такой обработки, но сначала узнаем, какими вообще характеристиками обладает оксидированный металл.
Преимущества оксидирования
Металл считается наиболее популярным строительным материалом, который обладает массой преимуществ: дешевизна, прочность, долговечность и доступность. Но есть и недостатки: часто происходят окисления, коррозия, появляется ржавчина, и внешний вид металла портится в худшую сторону.
Окисление при оксидировании полностью исключается, так как на поверхности формируется стойкая защитная пленка. Именно защита металла от разрушения является основной функцией этой пленки. Оксидировать можно, в принципе, любой метал: сталь, алюминий, драгоценные сплавы. Часто к такой процедуре прибегают в ювелирном деле, но и производственное предприятие требует такой оксидной обработки.
В результате оксидирования или воронения проявляются такие особенности:
- оксидное покрытие однозначно меняет первоначальный цвет изделия;
- при обработке алюминиевых деталей увеличивается их прочность;
- в процессе обработки нержавейки тоже происходит изменение цвета;
- исключается проявление коррозий и ржавчины.

Термическое оксидирование
Представим таблицу с некоторыми сплавами, которые наиболее часто подвергают оксидации:
| Название | Температура, °с | Особенности, назначение, использование |
| Низколегированные стали или железо | 300-350 | Второе название – воронение. Очень распространенный способ, основная его задача – декоративная металлообработка, так как деталь приобретает черный (вороной) цвет. Пример применения – создание стрелкового оружия. Еще одно преимущество – исходные размеры сохраняются, потому что оксидная пленка образуется очень тонкая, не более одного-полутора микрона. |
| Легированные стальные элементы | до 700 | Нанесение состава занимает продолжительный период – не менее 1 часа. |
| Железоникелевые магнитные сплавы | 400 – 800 | Процесс длится на протяжении 0,5 – 1,5 часов. Возникает слой, который считается диэлектриком, поэтому от просто необходим при создании электрических полупроводников. |
| Кремний | 800 – 1200 | Процедура имеет название термокомпрессионной. Она проходит под большим давлением до 107 па. Подвергаемые ей изделия необходимы в электронике. |
Импульсное лазерное излучение
Когда нагрев происходит не в печи, как при термическом методе, а с помощью лазера, то результат получается хороший, хоть и процесс – более трудный. До настоящего момента проводятся исследования, какие материалы как следует подвергать воздействию луча, но одним из вариантов является импульсы – то есть короткая подача потока на участок с постепенным смещением головки установки.
Непрерывное излучение
В таком случае обрабатываются только прочные стали, которые не боятся перегрева под постоянным воздействием. На зону направляется луч, который непрерывно перемещается по всей области оксидирования. Соответственно, нагрев получается очень значительный.
Плазменное оксидирование
Такое оксидирование проводят в среде с высокой концентрацией кислорода с помощью низкотемпературной плазмы. Плазма создаётся благодаря разрядам, возникающим при подаче токов высокой или сверхвысокой частоты.
Плазма создаётся благодаря разрядам, возникающим при подаче токов высокой или сверхвысокой частоты.
Плазменное оксидирование используют для формирования оксидированных плёнок на достаточно небольших поверхностях.
В основном его применяют в электронике и микроэлектронике. С его помощью образуют слои на поверхности полупроводниковых соединений, так называемых p-n переходах. Такие плёнки используют в транзисторах, диодах (в том числе в туннельных диодах), интегральных микросхемах. Кроме этого она используется для повышения светочувствительного эффекта в фотокатодах.
Плазменное оксидирование
Разновидностью плазменного оксидирования является оксидирование с применением высокотемпературной плазмы. Иногда её заменяют на дуговой разряд с повышением температуры до 430 °С и выше. Применение этой технологии позволяет значительно повысить качество образуемых покрытий.
Своими руками
Представленные выше способы применяются только на производстве, но если вы готовы к самостоятельным экспериментам, то нужно создать небольшую домашнюю лабораторию.
Для эксперимента возьмите небольшую стальную деталь, которая без проблем поместится в трехлитровую банку.
Этапы работ
Выполняйте каждый из них последовательно и тщательно. Заранее подготовьте все необходимые инструменты.
Грубая зачистка
Возьмите щетку по стали или наждачку с крупным зерном. Вам нужно убрать всю ржавчину до основания, а также другие загрязнения. Лучше, если вы потом пройдетесь мелкозернистой наждачной бумаги для однородности поверхности.
Полировка
Отлично подойдут специальные пасты с мелким абразивом или диски на ручных шлифовальных машинках.
Снятие налета
Иными словам – избавьте элемент от жира, масляных следов, а также остатков полировальной пасты.
Обработка
Для этого наведите раствор серной кислоты с 5% содержанием вещества и поместите туда заготовку на 1 минуту.
Процесс оксидирования черных и цветных металлов
Оксидирование — это процесс получения на поверхности обрабатываемого металла (обработке подвержены черные и цветные металлы) пленки, состоящей в основном из оксидов самого металла. Результатом такой обработки является повышенная коррозионная стойкость, улучшенные декоративные и специальные свойства. Оксидирование может быть химическим, электрохимическим, термическим и термохимическим.
Результатом такой обработки является повышенная коррозионная стойкость, улучшенные декоративные и специальные свойства. Оксидирование может быть химическим, электрохимическим, термическим и термохимическим.
Детали после оксидирования
При оксидировании черных металлов – воронении, на поверхности образуется темная пленка, состоящая в основном из магнитного окисла Fe3O4 толщиной примерно 2-3 мкм. Цвет такой пленки зависит от технологии оксидирования, толщины пленки, а также марки материала. При оксидировании черных металлов и сплавов наиболее распространен метод химического оксидирования в щелочных или кислых растворах.
Щелочные растворы состоят в основном из щелочи и окислителей – нитратов и нитритов натрия или калия, а также специальных добавок. Часто используется оксидирование в несколько стадий (в основном в 3 стадии), что значительно повышает защитные и декоративные свойства покрытия (насыщенный черный цвет).
При оксидировании в кислых растворах получают оксидно-фосфатные темно-серые покрытия. Это промежуточный процесс, находящийся на стыке оксидирования и фосфатирования. Растворы для данного процесса содержат первичные фосфаты железа, цинка и ортофосфорную кислоту, а также окислители – нитраты бария, кальция, пироксид марганца. Оксидно-фосфатные покрытия обладают рядом преимуществ перед оксидными, полученными в щелочных растворах: антикоррозионные свойства выше в 2-3 раза, время процесса обработки снижено в 3 раза, механическая прочность пленки значительно увеличена, антифрикционные характеристики увеличены, термостойкость также выше. Недостатками такого процесса является низкая стабильность раствора и низкие декоративные качества пленок.
Это промежуточный процесс, находящийся на стыке оксидирования и фосфатирования. Растворы для данного процесса содержат первичные фосфаты железа, цинка и ортофосфорную кислоту, а также окислители – нитраты бария, кальция, пироксид марганца. Оксидно-фосфатные покрытия обладают рядом преимуществ перед оксидными, полученными в щелочных растворах: антикоррозионные свойства выше в 2-3 раза, время процесса обработки снижено в 3 раза, механическая прочность пленки значительно увеличена, антифрикционные характеристики увеличены, термостойкость также выше. Недостатками такого процесса является низкая стабильность раствора и низкие декоративные качества пленок.
Цвет получаемых в процессе оксидирования окисных пленок: золотисто-желтый фиолетовый, темно-серый, черный с синим отливом и просто черный цвет.
Состав раствора и режим оксидирования черных металлов:
- Каустическая сода – 650-700 г/л.
- Нитрит натрия – 250 г/л.
- Нитрат натрия – 150-200 г/л.
- Температура – 135-1450С.

- Продолжительность оксидирования углеродистых сталей – 1,5 ч.
- Продолжительность оксидирования легированных и высокоуглеродистых сталей – 2-2,5 ч.
При приготовлении раствора для оксидирования следует избегать одновременной загрузки крупных порций каустической соды, твердые куски необходимо дробить на малые части и погружать в раствор в сетчатых корзинах. Корректировка раствора в процессе оксидирования необходима из-за того, что часть раствора уносится из ванны на поверхности извлекаемых деталей, часть раствора выкипает. В раствор доливают воду до исходного уровня и контролируют температуру кипения. Снижение температуры кипения раствора указывает на понижение концентрации раствора, повышение – на повышение концентрации.
Перед оксидированием (воронением) поверхность деталей обезжиривают в щелочном растворе и тщательно промывают в теплой воде. Затем детали декапируют в 5-10% растворе серной кислоты в течение 0,5-1 минуты и промывают в проточной холодной воде.
Загружать детали в ванну необходимо медленно и осторожно – возможно разбрызгивание горячего раствора. В процессе раствор должен свободно покрывать всю поверхность деталей и все время кипеть. Каждые полчаса изделия извлекают из ванны и ополаскивают в холодной воде, затем опять погружают в ванну. Мелкие детали и метизы для оксидирования загружают в корзинки, изготовленные из перфорированного металлического листа.
В процессе оксидирования могут возникать следующие отклонения:
- Неоднородность оттенков окисной пленки на поверхности деталей указывает на недостаточное время выдержки.
- Налет похожий на ржавчину на поверхности деталей возникает из-за недостаточной концентрации окислителя – нитрита натрия.
- Образование зеленоватого налета свидетельствует о недостатке в растворе каустической соды.
- Пятна разного цвета и отсутствие окисной пленки на отдельных участках свидетельствует о некачественной обработке поверхности деталей. Если проблема возникает при оксидировании метизов – необходимо усилить встряхивания (встряхивать 2-3 раза во время процесса).

- Полное отсутствие окисной пленки свидетельствует о высокой концентрации раствора и соответственно высокой температуры кипения раствора. Необходимо осторожно, при перемешивании разбавить раствор водой, доводя температуру кипения до 1400С.
Дефекты по покрытию
Основные дефекты, как правило, вызваны наличием в изделиях глухих отверстий, щелей и полостей, которые не поддаются хорошей промывке и продувке. В результате, вокруг данных мест образуются разводы, отсутствие покрытия или другие дефекты. Также причиной отклонения качества покрытия может возникнуть несоблюдение параметров процесса и нарушения в рецептуре электролита.
В качестве дефектов может быть матовость и пятнистость покрытия, неравномерный блеск в результате некачественного изготовления изделия (плохая механическая обработка поверхностей).
Определения окисления и восстановления
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3658
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице обсуждаются различные определения окисления и восстановления (редокс) с точки зрения переноса кислорода, водорода и электронов. Это также объясняет термины окислитель и восстановитель.
Это также объясняет термины окислитель и восстановитель.
Окисление и восстановление с точки зрения переноса кислорода
Термины окисление и восстановление могут быть определены с точки зрения добавления или удаления кислорода к соединению. хотя это не самое надежное определение, как обсуждается ниже, его легче всего запомнить.
Окисление и восстановление по отношению к переносу кислорода
- Окисление — это прирост кислорода.
- Восстановление – это потеря кислорода.
Например, при извлечении железа из руды:
Поскольку и восстановление, и окисление происходят одновременно, это называется окислительно-восстановительной реакцией.
Окислитель – это вещество, которое окисляет что-то другое. В приведенном выше примере оксид железа (III) является окислителем. Восстановитель уменьшает что-то еще. В уравнении окись углерода является восстановителем.
- Окислители дают кислород другому веществу.
- Восстановители удаляют кислород из другого вещества.
Окисление и восстановление с точки зрения переноса водорода
Это старые определения, которые больше не используются, за исключением некоторых случаев в органической химии.
Окисление и восстановление в отношении переноса водорода
- Окисление – это потеря водорода.
- Восстановление – это усиление водорода.
Обратите внимание, что это полная противоположность определения кислорода (#1).
Например, этанол можно окислить до этаналя:
Для удаления водорода из этанола требуется окислитель. Обычно в качестве окислителя используют раствор бихромата калия(VI), подкисленный разбавленной серной кислотой. Этаналь также можно восстановить до этанола путем добавления водорода. Возможным восстановителем является тетрагидроборат натрия, NaBH 9. 0094 4 . Опять же, уравнение слишком сложное, чтобы рассматривать его в данный момент.
0094 4 . Опять же, уравнение слишком сложное, чтобы рассматривать его в данный момент.
Более точное определение окислителей и восстановителей:
- Окислители добавляют кислорода к другому веществу или удаляют из него водорода.
- Восстановители удаляют кислород из другого вещества или добавляют к нему водород.
Окисление и восстановление с точки зрения переноса электрона
Окисление и восстановление с точки зрения переноса электрона
- Окисление потеря электронов
- Уменьшение Прирост электронов
Очень важно помнить эти определения, и это легко сделать, используя эту удобную аббревиатуру:
Пример 1
Уравнение ниже показывает очевидный пример переноса кислорода в простой окислительно-восстановительной реакции:
\[ \ce{CuO + Mg \rightarrow Cu + MgO} \nonumber\]
Оксид меди(II) и оксид магния являются ионными соединениями. Если вышеизложенное записать в виде ионного уравнения, становится очевидным, что ионы оксида являются ионами-спектаторами. Их исключение дает:
Если вышеизложенное записать в виде ионного уравнения, становится очевидным, что ионы оксида являются ионами-спектаторами. Их исключение дает:
В приведенной выше реакции магний восстанавливает ион меди(II), передавая электроны иону и нейтрализуя его заряд. Следовательно, магний является восстановителем. Другими словами, ион меди(II) отбирает электроны у магния, создавая ион магния. Ион меди(II) действует как окислитель.
Резюме
Путаница может возникнуть в результате попытки выучить как определения окисления и восстановления с точки зрения переноса электронов, так и определения окислителей и восстановителей в одних и тех же терминах. Может быть полезен следующий образ мыслей:
- Окислитель окисляет что-то другое.
- Окисление – это потеря электронов (НЕФТЕБУШКА).
- Следовательно, окислитель забирает электроны у этого другого вещества.
- Следовательно, окислитель должен получить электроны.
Вот еще одно умственное упражнение:
- Окислитель окисляет что-то другое.

- Следовательно, окислитель необходимо уменьшить.
- Восстановление – приобретение электронов (НЕФТЕБУШКА).
- Следовательно, окислитель должен получить электроны.
Эта страница под названием «Определения окисления и восстановления» распространяется по незаявленной лицензии, автором, ремиксом и/или куратором которой является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джим Кларк
- Показать страницу TOC
- № на стр.
- Теги

Окисление и восстановление
Окисление и сокращение
| Окислительно-восстановительный Реакции | Роль окисления Числа в окислительно-восстановительных реакциях | Число окисления по сравнению с Истинный заряд ионов |
| Окислители и Восстанавливающие агенты | Конъюгат окисляющий Пары агент/восстановитель | Родственник Сильные стороны металлов как восстановителей |
Окислительно-восстановительный Реакции
Термин окисление первоначально использовался для описания
реакции, в которых элемент соединяется с кислородом.
Пример: Реакция между металлическим магнием и кислородом с образованием образование оксида магния включает окисление магния.
Термин сокращение происходит от латинской основы, означающей «вернуть назад». Все, что ведет обратно к поэтому металлический магний включает восстановление.
Реакция между оксидом магния и углеродом при 200°С до из металлического магния и монооксида углерода является примером восстановление оксида магния до металлического магния.
После открытия электронов химики убедились что окислительно-восстановительные реакции связаны с переносом электронов от одного атома к другому. С этой точки зрения, реакция между магнием и кислородом записывается следующим образом.
2 Мг + О 2 2 [Mg 2+ ][O 2- ]
В ходе этой реакции каждый атом магния теряет два электронов с образованием иона Mg 2+ .
Mg Mg 2+ + 2 e –
Каждая молекула O 2 получает четыре электрона, образуя
пара ионов O 2-.
О 2 + 4 e – 2 О 2-
Поскольку электроны не создаются и не разрушается в результате химической реакции окисления и восстановления. связаны. Одно без другого невозможно, как показано на рисунке ниже.
Роль окисления Числа в окислительно-восстановительных реакциях
Химики со временем расширили идею окисления и сведение к реакциям, формально не связанным с переносом электронов.
Рассмотрим следующую реакцию.
CO( г ) + H 2 O( г ) CO 2 ( г ) + H 2 ( г )
Как видно на рисунке ниже, общее количество электронов на валентной оболочке каждого атома остается постоянным в эта реакция.
В этой реакции изменяется степень окисления этих
атомы. Степень окисления углерода увеличивается с +2 до +4,
а степень окисления водорода уменьшается с +1 до 0,
Степень окисления углерода увеличивается с +2 до +4,
а степень окисления водорода уменьшается с +1 до 0,
Поэтому лучше всего подходят окисление и восстановление определяется следующим образом. Окисление происходит, когда степень окисления атома становится больше. Переходник происходит, когда степень окисления атома становится меньше.
| Интерактивный
учебник по присвоению степеней окисления из требует Макромедиа Шоквейв |
Числа окисления в сравнении Истинный заряд ионов
Термины ионный и ковалентный описывают
крайности континуума связи. есть какая-то ковалентная
характер даже в самых ионных соединениях и наоборот.
Полезно подумать о соединениях основной группы металлов, как если бы они содержали положительные и отрицательные ионы. химия оксида магния, например, легко понять если предположить, что MgO содержит Mg 2+ и О 2- ионы. Но никакие соединения не являются на 100% ионными. Есть экспериментальный доказательства, например, что истинный заряд магния и атомов кислорода в MgO +1,5 и -1,5.
Степени окисления обеспечивают компромисс между мощной моделью окислительно-восстановительных реакций, основанных на предположении, что эти соединения содержат ионы и наши знания о том, что истинные заряд ионов в этих соединениях не так велик, как этот модель предсказывает. По определению, степень окисления атома заряд, который нес бы атом, если бы соединение было чисто ионный.
Для активных металлов групп IA и IIA разница
между степенью окисления атома металла и зарядом на
этот атом достаточно мал, чтобы им можно было пренебречь. Металлы основной группы в
Однако группы IIIA и IVA образуют соединения, которые имеют
значительное количество ковалентного характера. Это заблуждение, ибо
например, предположить, что бромид алюминия содержит Al 3+ ионы Br – . На самом деле существует как Al 2 Br 6 молекулы.
Это заблуждение, ибо
например, предположить, что бромид алюминия содержит Al 3+ ионы Br – . На самом деле существует как Al 2 Br 6 молекулы.
Эта проблема становится еще более серьезной, когда мы обращаемся к химия переходных металлов. MnO, например, является ионным достаточно, чтобы считаться солью, содержащей Mn 2+ и O 2- ионы. Мн 2 О 7 , с другой стороны, представляет собой ковалентное соединение, которое кипит при комнатной температуре. Это Поэтому полезнее думать об этом соединении так, как если бы оно содержал марганец в степени окисления +7, а не Mn 7+ ионы.
Окислители и Восстанавливающие агенты
Рассмотрим роль, которую играет каждый элемент в реакция, в которой определенный элемент приобретает или теряет электроны.
Когда магний реагирует с кислородом, атомы магния отдают
электронов на молекулы O 2 и тем самым уменьшить
кислород. Таким образом, магний действует как восстановитель в
эта реакция.
Таким образом, магний действует как восстановитель в
эта реакция.
| 2 мг | + О 2 | 2 MgO | |
| восстановитель агент |
Молекулы O 2 , с другой стороны, получить электроны от атомов магния и тем самым окислить магний. Кислород, следовательно, окислитель .
| 2 мг + | О 2 | 2 MgO | |
| окислитель агент |
Таким образом, окислители и восстановители можно определить как
следует. Окислители получить электроны. Сокращение
агенты теряют электроны.
Окислители получить электроны. Сокращение
агенты теряют электроны.
В таблице ниже указаны восстановитель и окислитель для некоторых реакций, обсуждаемых в этой сети страница. Сразу бросается в глаза одна тенденция: Металлы основной группы действуют как восстановители во всех своих химических реакциях.
Типичные реакции металлов основной группы
| Реакция | Сокращение Агент | Окислитель Агент | ||
| 2 Na + Cl 2 2 NaCl | На | Класс 2 | ||
| 2 К + Н 2 2 КН | К | Н 2 | ||
| 4 Li + O 2 2 Li 2 O | Ли | О 2 | ||
| 2 Na + O 2 Na 2 O 2 | На | О 2 | ||
| 2 Na + 2 H 2 O 2 Na + + 2 OH – + H 2 | На | Н 2 О | ||
| 2 К + 2 NH 3 2 К + + 2 NH 2 – + Н 2 | К | НХ 3 | ||
| 2 Mg + O 2 2 MgO | мг | О 2 | ||
| 3 Mg + N 2 Mg 3 N 2 | мг | Н 2 | ||
| Ca + 2 H 2 O Ca 2+ + 2 OH – + H 2 | Са | Н 2 О | ||
| 2 Al + 3 Br 2 Al 2 Br 6 | Ал | Бр 2 | ||
| Мг + 2 Н + Мг 2+ + Н 2 | мг | Н + | ||
| Mg + H 2 O MgO + H 2 | мг | Н 2 О |
Конъюгат окисляющий Пары агент/восстановитель
Металлы действуют как восстановители в своих химических реакциях. Например, при нагревании меди над пламенем поверхность
медленно чернеет, так как металлическая медь восстанавливает кислород в
атмосфере с образованием оксида меди(II).
Например, при нагревании меди над пламенем поверхность
медленно чернеет, так как металлическая медь восстанавливает кислород в
атмосфере с образованием оксида меди(II).
Если мы выключим пламя и продуем H 2 газом над поверхность горячего металла, черный CuO, образовавшийся на поверхности металл медленно превращается обратно в металлическую медь. В ходе этой реакции CuO восстанавливается до металлической меди. Таким образом, Н 2 является восстановителем в этой реакции, а CuO действует как окислитель.
Важной особенностью окислительно-восстановительных реакций может быть
определяется путем изучения того, что происходит с медью в этой паре
реакций. Первая реакция превращает металлическую медь в CuO,
тем самым превращая восстановитель (Cu) в окислитель
агент (CuO). Вторая реакция превращает окислитель
(CuO) в восстановитель (Cu). Каждый восстановитель
следовательно, связанный или связанный с сопряженным окислителем, и
наоборот.
Каждый раз, когда восстановитель теряет электроны, он образует окислитель, который мог бы получить электроны, если бы реакция была перевернутый.
И наоборот, каждый раз, когда окислитель получает электроны, он образует восстановитель, который может потерять электроны, если реакция пошел в обратном направлении.
Идея о том, что окислители и восстановители связаны, или спаренные, поэтому их называют сопряженными окисляющими агенты и восстановители. Сопряжение происходит от латинского основа, означающая «соединяться вместе». Поэтому используется для описания вещей, которые связаны или связаны, например, окисление агенты и восстановители.
Все металлы основной группы являются восстановителями. Они, как правило, «сильные» восстановители. Активные металлы в группе ИА, например, лучше любых других элементов отдают электроны в периодической таблице.
Тот факт, что активный металл, такой как натрий, является сильным
восстановитель должен рассказать нам что-то об относительном
сила Na 9Ион 0280 + в качестве окислителя. Если
металлический натрий относительно хорошо отдает электроны, Na + ионы должны быть необычно плохо улавливают электроны. Если На является
сильным восстановителем, ион Na + должен быть слабым
окислитель.
Если
металлический натрий относительно хорошо отдает электроны, Na + ионы должны быть необычно плохо улавливают электроны. Если На является
сильным восстановителем, ион Na + должен быть слабым
окислитель.
И наоборот, если O 2 имеет такое высокое сродство к электронов, что он необычайно хорошо принимает их от других элементы, он должен иметь возможность цепляться за эти электроны, как только он подбирает их. Другими словами, если O 2 сильный окислителем, то ион O 2- должен быть слабым Восстановитель.
В целом взаимосвязь между сопряженным окислением и
восстановители можно описать следующим образом. Каждый сильный
восстановитель (например, Na) имеет слабый сопряженный окислитель
(например, ион Na + ). Каждый сильный
окислитель (такой как O 2 ) имеет слабую
сопряженный восстанавливающий агент (такой как O 2- ион).
Относительная сила металлов как восстановителей
Мы можем определить относительную силу пары металлов как восстановители, определяя, происходит ли реакция, когда один одного из этих металлов смешивается с солью другого. Рассмотрим относительная прочность железа и алюминия, например. Ничего такого происходит, когда мы смешиваем порошкообразный металлический алюминий с оксидом железа (III). Однако если мы поместим эту смесь в тигель и получим реакция начинается с приложения небольшого количества тепла, бурная реакция происходит с образованием оксида алюминия и расплавленного металлического железа.
2 Al( s ) + Fe 2 O 3 ( s ) Al 2 O 3 ( s ) + 2 Fe( l )
Присвоив степени окисления, мы можем определить степень окисления и восстановление половин реакции.
Алюминий окисляется до Al 2 O 3 в этом
реакции, а это значит, что Fe 2 O 3 должен быть
окислитель. И наоборот, Fe 2 О 3 есть
восстанавливается до металлического железа, а это означает, что алюминий должен быть
Восстановитель. Потому что восстановитель всегда превращается
в сопряженный с ним окислитель в окислительно-восстановительной
реакция, продукты этой реакции включают новый окислитель
агент (Al 2 O 3 ) и новый восстановитель
(Фе).
И наоборот, Fe 2 О 3 есть
восстанавливается до металлического железа, а это означает, что алюминий должен быть
Восстановитель. Потому что восстановитель всегда превращается
в сопряженный с ним окислитель в окислительно-восстановительной
реакция, продукты этой реакции включают новый окислитель
агент (Al 2 O 3 ) и новый восстановитель
(Фе).
Поскольку реакция идет в этом направлении, кажется разумно предположить, что исходные материалы содержат более сильный восстановитель и более сильный окислитель.
Другими словами, если алюминий восстанавливает Fe 2 O 3 для формирования Al 2 O 3 и металлического железа, алюминий должен быть более сильным восстановителем, чем железо.
Из того факта, что алюминий не может восстанавливать
хлорид натрия с образованием металлического натрия, который исходные материалы
в этой реакции более слабый окислитель и более слабый
Восстановитель.
Мы можем проверить эту гипотезу, спросив: что происходит, когда мы попробовать запустить реакцию в обратном направлении? (Натрий достаточно прочный металл, чтобы восстановить соль алюминия до алюминия металл?) При проведении этой реакции мы обнаруживаем, что металлический натрий может, фактически восстанавливают хлорид алюминия до металлического алюминия и натрия хлорида, когда реакцию проводят при температурах, достаточно высоких для расплавить реагенты.
3 Na( l ) + AlCl 3 ( l ) 3 NaCl( l ) + Al( l )
Если натрий достаточно силен, чтобы восстановить Al 3+ соли к металлическому алюминию, а алюминий достаточно прочен, чтобы восстановить солей Fe 3+ к металлическому железу, относительная сила эти восстановители можно резюмировать следующим образом.
Na > Al > Fe
| Практическая задача 4: Использование
следующие уравнения для определения относительного
сильные стороны натрия, магния, алюминия и кальция
металл как восстановитель.
Нажмите здесь, чтобы проверить свой ответ на практическое задание 4 |
Определение и примеры окисления — Биологический онлайн-словарь
Окисление
сущ. , множественное число: окисления
, множественное число: окисления
[ˌɒksɪˈdeɪʃən]
Определение: процесс, акт или результат окисления
Содержание
Определение окисления
Как мы определяем окисление? Существует несколько определений процесса окисления. Окисление можно рассматривать как присоединение атома кислорода к соединению. Противоположность этому процессу называется восстановлением, при котором происходит удаление электрона.
Посмотрите на рисунок-1. Когда железная руда (Fe 2 O 3 ) реагирует с монооксидом углерода (CO) с образованием железа (Fe) и газообразного диоксида углерода (CO 2 ).
Где добавляется кислород? Добавляется в CO для получения CO 2 . Таким образом, можно сказать, что СО окисляется. Какой окисленный CO? Fe 2 O 3 окисляет CO, отдавая кислород; таким образом. Fe 2 O 3 называется «окислителем» .
Рисунок 1: Окисление CO до CO 2 . Предоставлено: Джим Кларк – Определения окисления и восстановления.
Предоставлено: Джим Кларк – Определения окисления и восстановления.Что CO сделал с Fe 2 O 3 ?
CO восстановленный Fe 2 O 3 путем удаления из него кислорода . Таким образом, мы можем сказать, что CO является « восстановителем» , который восстанавливает Fe 2 O 3 до чистого Fe (железа).
Хорошо, добавление или удаление кислорода является одним из определений окисления и восстановления соответственно .
Биологическое определение:
Биологическое окисление — это биологический процесс, который включает потерю электронов, в отличие от процесса восстановления, при котором электроны приобретаются. Окисление и восстановление, однако, связаны вместе как окислительно-восстановительная реакция , которая является реакцией с выработкой энергии внутри клетки.
Этимология: от французского, от «оксидер», что означает «окислять», от оксида. Вариант: окисление. Сравните: уменьшение.
Существует более четкое определение этих процессов:
Окисление определяется как процесс, при котором электрон удаляется из молекулы во время химической реакции.
Что происходит при окислении? При окислении происходит перенос электронов . Другими словами, при окислении происходит потеря 90 250 электронов 90 253 . Существует обратный процесс окисления, известный как восстановление, в котором прирост электронов .
Давайте поймем химию окисления, наблюдая за приведенной ниже реакцией:
CuO + Mg → MgO + Cu
В приведенной выше реакции ион Mg теряет электроны с образованием оксида магния . Точно так же CuO получает электрон, чтобы стать чистой Cu ( медь ).
Окисление происходит, когда молекула, атом или ион повышают свою степень окисления. Реверсивный механизм известен как редукция 9.0037 , что происходит по мере уменьшения количества электронов или степени окисления атома, молекулы или иона.
Реверсивный механизм известен как редукция 9.0037 , что происходит по мере уменьшения количества электронов или степени окисления атома, молекулы или иона.
Еще одним хорошим примером является то, что фтористоводородная кислота образуется в результате реакции газообразного водорода и фтора:
h3 + F2 → 2HF
Вышеупомянутая реакция окисляет водород и восстанавливает фтор. Если описаны две полуреакции, реакцию можно лучше всего понять.
h3 → 2H+ + 2e-
F2 + 2e- → 2F-
Окисление с участием кислорода
Кислород был добавлен к соединению как старый метод окисления. Это произошло потому, что первым известным окислителем был газообразный кислород (O 2 ). Хотя кислород обычно добавляют к соединению в соответствии с потребностью в потере электронов и увеличением степени окисления, концепция окисления была расширена за счет включения дополнительных химических реакций.
Старая концепция окисления железа в сочетании с кислородом для получения оксида железа является классическим примером реакции окисления. Железо окислилось до ржавчины. Химическая реакция следующая:
Железо окислилось до ржавчины. Химическая реакция следующая:
2Fe + O 2 → Fe 2 O 3
Оксид железа, известный как ржавчина , образуется в результате окисления оксида железа.
Окисление с участием водорода
Окисление с участием кислорода — это современное значение термина окисление. Также есть другое описание водорода, которое можно использовать в органической химии. Это противоположно концепции кислорода и, таким образом, может создать путаницу. Все равно приятно помнить об этом. Окисление – это потеря водорода, согласно описанию, тогда как восстановление – получение водорода.
Примером этого является образование этанола путем окисления этанола.
CH 3 CH 2 OH → CH 3 CHO
Известно, что этанол окисляется при потере водорода. Изменив уравнение и добавив водород к этанолу, можно уменьшить содержание этанола.
Химия «Нефтяная вышка»
Нефтяная вышка может быть использована для понимания современной концепции окисления и восстановления. Он имеет дело только с электронами, а не с кислородом или водородом. Это простая техника, позволяющая распознать и запомнить, какой элемент окисляется, а какой восстанавливается. Oil rig расшифровывается как O xidation I s L oss, R eduction i s g ain o 90slectron.7 e f f
Он имеет дело только с электронами, а не с кислородом или водородом. Это простая техника, позволяющая распознать и запомнить, какой элемент окисляется, а какой восстанавливается. Oil rig расшифровывается как O xidation I s L oss, R eduction i s g ain o 90slectron.7 e f f
Это удобное сокращение для обозначения потери или притока электронов. Атом становится ионом, если он получает или теряет электрон. Термин, используемый для объяснения этого механизма, зависит от того, потерял ли атом (окисление) или приобрел (восстановление) электрон.
Например, если атом водорода (H) теряет электрон, он становится положительно заряженным ионом (H+). Итак, можно сказать, что атом водорода окислился и произошла реакция окисления. И наоборот, если атом хлора (Cl) получает электрон, он становится отрицательно заряженным ионом (Cl – ). Поэтому говорят, что атом хлора восстановился и произошла реакция восстановления.
Поэтому говорят, что атом хлора восстановился и произошла реакция восстановления.
Процесс окисления
Процессы окисления и восстановления происходят одновременно и не могут осуществляться независимо друг от друга. Отдельные реакции окисления и восстановления принимают за полуреакции, затем две полуреакции объединяются, образуя полную реакцию. Полученные или потерянные электроны явно используются, так что полуреакция с электрическим зарядом уравновешивается. Комбинация этих полуреакций, формирующая чистое химическое уравнение, имеет тенденцию уравновешивать электроны.
Окислители и восстановители
Восстановитель передает электроны окислителю во время окислительно-восстановительного процесса. Таким образом, в реакции электроны теряются и окисляются восстановителем, а восстанавливаются за счет приобретения электронов окислителем.
Окислители
Окислители – это вещества, которые могут терять электроны из другого вещества, считаются окислителями или окислителями и называются окислителями. Другими словами, окислитель отбирает электроны у другого материала и, таким образом, восстанавливается. Окислитель также можно назвать акцептор электронов , потому что он принимает электрон. Химические вещества с высокой степенью окисления, такие как H 2 O 2 , MnO – 4 , или элементы с высокой электроотрицательностью, такие как O 2 , F 2 , являются хорошими примерами окислителей.
Другими словами, окислитель отбирает электроны у другого материала и, таким образом, восстанавливается. Окислитель также можно назвать акцептор электронов , потому что он принимает электрон. Химические вещества с высокой степенью окисления, такие как H 2 O 2 , MnO – 4 , или элементы с высокой электроотрицательностью, такие как O 2 , F 2 , являются хорошими примерами окислителей.
Восстановители
Восстановители – это те вещества, которые обладают потенциалом восстанавливать другие вещества, заставляя их приобретать электроны, считаются восстановителями или восстановителями и называются «восстановителями» . Они окисляются и передают электроны другим веществам. Кроме того, восстановитель также известен как донор электронов , поскольку он отдает электрон другому веществу. Натрий, магний, железо, и т. д., , которые являются электроположительными металлами, являются хорошими примерами восстановителей.
Окислительно-восстановительные реакции (окислительно-восстановительные реакции)
Давайте теперь разберемся с концепцией окислительно-восстановительных реакций и их основных типов.
Что такое окислительно-восстановительная реакция?
Окислительно-восстановительная реакция , также известная как окислительно-восстановительная реакция , представляет собой реакцию, в которой изменяется степень окисления вовлеченных атомов. Понятие охватывает широкий спектр процессов. Многие реакции восстановления и окисления столь же естественны, как горение, ржавление и растворение металлов, потемнение фруктов и дыхание, а также фотосинтез, являющийся основным механизмом жизни.
Основные классификации
Окислительно-восстановительные процессы в основном требуют переноса атомов кислорода и водорода или электронов. Все три процесса имеют две общие черты: Во-первых, они связаны, что означает, что за реакцией окисления следует взаимная реакция восстановления. Во-вторых, речь идет о чистом химическом изменении, которое означает переход электрона или атома из одного вещества в другое.
Во-вторых, речь идет о чистом химическом изменении, которое означает переход электрона или атома из одного вещества в другое.
В окислительно-восстановительных реакциях примеры трех типичных форм окислительно-восстановительных реакций приведены ниже, взаимность и результирующий сдвиг хорошо описаны.
Перенос атома кислорода
Происходит реакция между оксидами углерода и ртути с образованием диоксида углерода и металлической ртути. Связывающая способность оксида ртути считается равной +2, и изменение степени окисления можно увидеть ниже.
C + 2HgO → CO 2 + Hg
Углерод окисляется при получении кислорода; в ртути удаляется оксид-кислород и снижается комплементарность. Чистое изменение включает переход от звеньев оксида ртути с двумя атомами кислорода к атому углерода.
Перенос атома водорода
В следующей реакции атомы водорода переходят на кислород из гидразина, соединения азота и водорода:
N 2 H 4 + O 2 → N 2 + 2H 2 O
Гидразин окисляется до молекулярного азота, теряет водород, тогда как кислород восстанавливается до воды, приобретая водород.
Электронный перенос
Металлический цинк и ион меди реагируют в водном растворе с образованием металлической меди и водного иона цинка.
Zn + Cu 2+ → Zn 2+ + Cu[a]
Металлический цинк окисляется, когда два его электрона переходят и становятся водным ионом цинка. Кроме того, ион меди получил электроны и был восстановлен до металлической меди. Перенос двух электронов – это чистое изменение, которое потерял цинк и приобрел медь.
Стехиометрическая основа
Никакая информация о механизме, посредством которого происходит изменение, не может быть получена, если окислительно-восстановительные процессы определяются, как указано выше. Общее объяснение известно как стехиометрия реакции, которая дает характерные пропорции сочетающихся элементов и соединений. Реакции известны как стехиометрические окислительно-восстановительные и неокислительно-восстановительные; стехиометрические группы включают атом кислорода, атом водорода и перенос электрона.
Изменение степени окисления
Новая теория молекулярной структуры сделала возможным полное описание процессов окисления и восстановления. Каждый атом содержит положительное ядро, окруженное отрицательными электронами, которые определяют характеристики связывания каждого элемента. Атомы отдают, приобретают или обмениваются электронами при образовании химических связей. Это позволяет присвоить каждому атому степень окисления, определяющую количество электронов, которые могут образовывать связи с другими атомами. Тенденция связывания внутри молекулы определяется конкретными атомами в молекуле и ее конкретной связывающей способностью, и каждый атом следует рассматривать как находящийся в определенной степени окисления, описываемой как степень окисления.
Окислительно-восстановительные процессы характеризуются как реакции, за которыми следуют изменения степени окисления: увеличение степени окисления атома коррелирует с окислением; уменьшаться, уменьшаться. Реакции, сопровождающиеся изменением степени окисления, известны как окислительно-восстановительные процессы, в которых увеличение степени окисления атома соответствует окислению, а уменьшение степени окисления соответствует восстановлению. Примером степени окисления элемента является Fe3+, что означает железо в степени окисления +3.
Примером степени окисления элемента является Fe3+, что означает железо в степени окисления +3.
Примеры окисления
Очень эффективным окислителем является молекулярный кислород, который непосредственно окисляет почти все металлы и многие неметаллы. Эти прямые окисления приводят к нормальным оксидам, таким как литий, цинк, фосфор и сера.
- 4Li + O 2 → 2Li 2 O (lithium oxide)
- 2Zn + O 2 → 2ZnO (zinc oxide)
- 4P + 5O 2 → P 4 O 10 (пятиокись фосфора)
- S + O 2 → SO 2 (двуокись серы)
Что такое окисление в химии?
Хорошим примером окисления в химии является замещение металла. В соединении или растворе атом металла замещает другой атом металла. Медь, например, образуется при реакции металлического цинка в растворе сульфата меди (II):
Zn(т) + CuSO 4 (водн.) → ZnSO 4 (водн. ) + Cu( s)
) + Cu( s)
В приведенном выше примере окислительно-восстановительной реакции в растворе сульфата меди ион меди (II) замещается металлическим цинком и образуется свободная металлическая медь. Реакция протекает самопроизвольно и дает 213 кДж на 65 г цинка, поскольку по сравнению с цинком низкая энергия металлической меди обусловлена связью через ее d-орбитали, которые частично заполнены.
Реакция для ионного уравнения:
Zn + Cu 2+ → Zn 2+ + Cu
В результате двух полуреакций цинк окисляется:
Zn → Zn 81 + 2+ 90e –
А медь восстановлена:
Cu 2+ + 2e – → Cu
электрод, погруженный в CuSO 4 9раствор 0095. Кредит: штат Огайо — схема гальванического элемента, CC BY-SA 4.0Еще одним примером является восстановление нитратов до азота в присутствии кислоты, известное как денитрификация. The reaction can be written as:
2NO – 3 + 10e – + 12H + → N 2 + 6H 2 O
Hydrocarbon combustion, like internal combustion engines, produces H 2 O, CO, некоторые частично окисленные источники CO 2 и тепловая энергия. Полное окисление углеродсодержащих материалов создает CO 2 .
Полное окисление углеродсодержащих материалов создает CO 2 .
Окисление углеводородов в органической химии кислородом приводит к образованию воды, а затем спирта, альдегида или карбоновой кислоты, кетона, а затем перекиси.
Что такое окисление в биологии?
Многочисленные важные процессы требуют окислительно-восстановительных реакций. Клеточное дыхание, например, в биологии — это окисление глюкозы до углекислого газа и кислорода до восстановления воды. Уравнение клеточного дыхания резюмируется следующим образом:
C[b] 6 H[c] 12 O[d] 6 + 6O[e] 2 → 6CO[f] 2 + 6H[g] 2 O[h]
Дыхание клетки Механизм также в значительной степени зависит от восстановления НАД+ до НАДН и обратной реакции (окисление НАДН до НАД+). И фотосинтез, и клеточное дыхание связаны между собой; однако при клеточном дыхании фотосинтез не является обратным окислительно-восстановительной реакции.
6CO 2 + 6H 2 O + энергия света → C 6 H 12 O 6 + 6O 2
В ходе окислительно-восстановительных реакций часто собирается и высвобождается биологическая энергия.
Рисунок 4: Цикл Кребса клеточного дыхания. Источник
Фотосинтез требует восстановления углекислого газа до сахаров, а также окисления воды молекулярным кислородом. Вода и CO 2 производятся путем окисления сахаров посредством обратной реакции дыхания. Молекулы восстановленного углерода используются в качестве промежуточных стадий для восстановления NAD+ (никотинамидадениндинуклеотида) до NADH, что затем помогает создать градиент протонов, который активирует синтез аденозинтрифосфата (АТФ) и сохраняет восстановление кислорода. Функции митохондрий сопоставимы.
youtube.com/embed/eL0BH5O9Sdo?autoplay=1;base64,PGJvZHkgc3R5bGU9J3dpZHRoOjEwMCU7aGVpZ2h0OjEwMCU7bWFyZ2luOjA7cGFkZGluZzowO2JhY2tncm91bmQ6dXJsKGh0dHBzOi8vaW1nLnlvdXR1YmUuY29tL3ZpL2VMMEJINU85U2RvLzAuanBnKSBjZW50ZXIvMTAwJSBuby1yZXBlYXQnPjxzdHlsZT5ib2R5ey0tYnRuQmFja2dyb3VuZDpyZ2JhKDAsMCwwLC42NSk7fWJvZHk6aG92ZXJ7LS1idG5CYWNrZ3JvdW5kOnJnYmEoMCwwLDApO2N1cnNvcjpwb2ludGVyO30jcGxheUJ0bntkaXNwbGF5OmZsZXg7YWxpZ24taXRlbXM6Y2VudGVyO2p1c3RpZnktY29udGVudDpjZW50ZXI7Y2xlYXI6Ym90aDt3aWR0aDoxMDBweDtoZWlnaHQ6NzBweDtsaW5lLWhlaWdodDo3MHB4O2ZvbnQtc2l6ZTo0NXB4O2JhY2tncm91bmQ6dmFyKC0tYnRuQmFja2dyb3VuZCk7dGV4dC1hbGlnbjpjZW50ZXI7Y29sb3I6I2ZmZjtib3JkZXItcmFkaXVzOjE4cHg7dmVydGljYWwtYWxpZ246bWlkZGxlO3Bvc2l0aW9uOmFic29sdXRlO3RvcDo1MCU7bGVmdDo1MCU7bWFyZ2luLWxlZnQ6LTUwcHg7bWFyZ2luLXRvcDotMzVweH0jcGxheUFycm93e3dpZHRoOjA7aGVpZ2h0OjA7Ym9yZGVyLXRvcDoxNXB4IHNvbGlkIHRyYW5zcGFyZW50O2JvcmRlci1ib3R0b206MTVweCBzb2xpZCB0cmFuc3BhcmVudDtib3JkZXItbGVmdDoyNXB4IHNvbGlkICNmZmY7fTwvc3R5bGU+PGRpdiBpZD0ncGxheUJ0bic+PGRpdiBpZD0ncGxheUFycm93Jz48L2Rpdj48L2Rpdj48c2NyaXB0PmRvY3VtZW50LmJvZHkuYWRkRXZlbnRMaXN0ZW5lcignY2xpY2snLCBmdW5jdGlvbigpe3dpbmRvdy5wYXJlbnQucG9zdE1lc3NhZ2Uoe2FjdGlvbjogJ3BsYXlCdG5DbGlja2VkJ30sICcqJyk7fSk7PC9zY3JpcHQ+PC9ib2R5Pg==”>
Окисление в геологии
Окислительно-восстановительная реакция играет важную роль в геологии наряду с химией и биологией. Окислительно-восстановительный потенциал важен для добычи и мобилизации полезных ископаемых, а также важен при определенных условиях отложения. Как правило, цвет породы определяется окислительно-восстановительным состоянием большинства минералов. В окислительных условиях порода приобретает форму и окрашивается в красный цвет. Затем появляется зеленый или иногда белый цвет, когда через породу протекает восстановительная жидкость. Восстановленный флюид также может сопровождать минералы, содержащие уран. Месторождения урана и мрамор Моки являются известными примерами окислительно-восстановительных реакций, влияющих на геологические процессы.
Окислительно-восстановительный потенциал важен для добычи и мобилизации полезных ископаемых, а также важен при определенных условиях отложения. Как правило, цвет породы определяется окислительно-восстановительным состоянием большинства минералов. В окислительных условиях порода приобретает форму и окрашивается в красный цвет. Затем появляется зеленый или иногда белый цвет, когда через породу протекает восстановительная жидкость. Восстановленный флюид также может сопровождать минералы, содержащие уран. Месторождения урана и мрамор Моки являются известными примерами окислительно-восстановительных реакций, влияющих на геологические процессы.
Возможно, вам будет интересно узнать больше об окислении как крупном геологическом событии, сформировавшем Землю. Посмотрите видео ниже. Предоставлено: Европейский союз наук о Земле (EGU).
youtube.com/embed/0Py5HIFjdbg?autoplay=1;base64,PGJvZHkgc3R5bGU9J3dpZHRoOjEwMCU7aGVpZ2h0OjEwMCU7bWFyZ2luOjA7cGFkZGluZzowO2JhY2tncm91bmQ6dXJsKGh0dHBzOi8vaW1nLnlvdXR1YmUuY29tL3ZpLzBQeTVISUZqZGJnLzAuanBnKSBjZW50ZXIvMTAwJSBuby1yZXBlYXQnPjxzdHlsZT5ib2R5ey0tYnRuQmFja2dyb3VuZDpyZ2JhKDAsMCwwLC42NSk7fWJvZHk6aG92ZXJ7LS1idG5CYWNrZ3JvdW5kOnJnYmEoMCwwLDApO2N1cnNvcjpwb2ludGVyO30jcGxheUJ0bntkaXNwbGF5OmZsZXg7YWxpZ24taXRlbXM6Y2VudGVyO2p1c3RpZnktY29udGVudDpjZW50ZXI7Y2xlYXI6Ym90aDt3aWR0aDoxMDBweDtoZWlnaHQ6NzBweDtsaW5lLWhlaWdodDo3MHB4O2ZvbnQtc2l6ZTo0NXB4O2JhY2tncm91bmQ6dmFyKC0tYnRuQmFja2dyb3VuZCk7dGV4dC1hbGlnbjpjZW50ZXI7Y29sb3I6I2ZmZjtib3JkZXItcmFkaXVzOjE4cHg7dmVydGljYWwtYWxpZ246bWlkZGxlO3Bvc2l0aW9uOmFic29sdXRlO3RvcDo1MCU7bGVmdDo1MCU7bWFyZ2luLWxlZnQ6LTUwcHg7bWFyZ2luLXRvcDotMzVweH0jcGxheUFycm93e3dpZHRoOjA7aGVpZ2h0OjA7Ym9yZGVyLXRvcDoxNXB4IHNvbGlkIHRyYW5zcGFyZW50O2JvcmRlci1ib3R0b206MTVweCBzb2xpZCB0cmFuc3BhcmVudDtib3JkZXItbGVmdDoyNXB4IHNvbGlkICNmZmY7fTwvc3R5bGU+PGRpdiBpZD0ncGxheUJ0bic+PGRpdiBpZD0ncGxheUFycm93Jz48L2Rpdj48L2Rpdj48c2NyaXB0PmRvY3VtZW50LmJvZHkuYWRkRXZlbnRMaXN0ZW5lcignY2xpY2snLCBmdW5jdGlvbigpe3dpbmRvdy5wYXJlbnQucG9zdE1lc3NhZ2Uoe2FjdGlvbjogJ3BsYXlCdG5DbGlja2VkJ30sICcqJyk7fSk7PC9zY3JpcHQ+PC9ib2R5Pg==”>
Попробуйте ответить на приведенный ниже тест и посмотреть, что вы уже узнали об окислении.
Викторина
Выберите лучший ответ.
1. Что из следующего является окислением?
Присоединение атома кислорода к соединению
Removal of an electron from a compound
A gain of electrons
2. A substance that undergoes reduction in redox reactions
Oxidizing agent
Reducing agent
Redox agent
3. Electron acceptor
Oxidizing agent
Восстановитель
Окислительно-восстановительный агент
4. Вещество, которое подвергается окислению в окислительно-восстановительной реакции
Окислитель
Восстановитель
Окислительно-восстановительный агент
5. Электронный донор
Окислительный агент
РЕЗЕМЕНТАЦИОННЫЙ АВЕТ
ОКРЕДИВАНИЕ
Отправить свои результаты (опционально)
Ваше имя
– по электронной почте
следующее
.
Самый ранний взгляд на окисление и восстановление заключается в добавлении кислорода с образованием оксида (окисление) или удалении кислорода (восстановление). Они всегда происходят вместе. Например, при сжигании водорода водород окисляется, а кислород восстанавливается. Сочетание азота и кислорода, возникающее при высоких температурах, происходит по той же схеме. Это образование оксида азота окисляет азот и восстанавливает кислород. В некоторых реакциях наиболее заметно окисление. Например, при сжигании метана и углерод, и водород окисляются (приобретают кислород). Сопутствующее восстановление кислорода, возможно, легче увидеть, когда вы описываете восстановление как получение водорода. С другой стороны, реакция двуокиси свинца при высоких температурах представляется просто восстановительной. Восстановление двуокиси свинца понятно, но связанное с ним окисление кислорода легче увидеть, когда вы описываете окисление как потерю электронов. | INDEX Окисление/ Ссылка | ||||||||||||||||||||||||||
|




 С их помощью можно снизить риск возникновения сердечно-сосудистых и онкологических заболеваний. Источник: катехин, который содержится в зеленом чае, красном вине, цитрусовых.
С их помощью можно снизить риск возникновения сердечно-сосудистых и онкологических заболеваний. Источник: катехин, который содержится в зеленом чае, красном вине, цитрусовых.
 Считается, что мутное, нефильтрованное вино сохраняет больше вкуса. Мутность особенно часто можно встретить в биодинамических и натуральных винах.
Считается, что мутное, нефильтрованное вино сохраняет больше вкуса. Мутность особенно часто можно встретить в биодинамических и натуральных винах. Скорее всего, вино еще и с рыжиной, хотя молодое. Это оксидация, или перенасыщение вина кислородом, из-за чего оно слишком быстро стареет. Такое происходит, если вино неправильно хранилось или пробка пересохла и пустила слишком много воздуха. Пить можно, но далеко не всем винам такой эффект идет.
Скорее всего, вино еще и с рыжиной, хотя молодое. Это оксидация, или перенасыщение вина кислородом, из-за чего оно слишком быстро стареет. Такое происходит, если вино неправильно хранилось или пробка пересохла и пустила слишком много воздуха. Пить можно, но далеко не всем винам такой эффект идет. Этот неожиданный запах бывает у вин из сорта Рислинг, его называют бензольной или керосиновой нотой, и это не дефект. Если хотите распробовать бензольную ноту, чтобы было ярко и понятно, берите рислинг из теплых стран — австралийский, например.
Этот неожиданный запах бывает у вин из сорта Рислинг, его называют бензольной или керосиновой нотой, и это не дефект. Если хотите распробовать бензольную ноту, чтобы было ярко и понятно, берите рислинг из теплых стран — австралийский, например.