Описать физические свойства меди воды соли: Опишите физические свойства: а)Меди;б)Воды;в)Соли – ответ на Uchi.ru
alexxlab | 03.04.2023 | 0 | Разное
Фізичні та хімічні властивості води
Вода – це справжнє джерело життя на землі, вона приймає участь у безлічі біологічних процесів і є невід’ємним їх компонентов. Це можливо завдяки її унікальним властивостям.
Фізичні властивості води
Хімічні властивості води
Взаємодія води з простими речовинами
Реакції з оксидами неметалів
Фотосинтез
Вода – ідеальний розчинник
У блозі ми часто посилаємося на певні властивості води, але рідко розкриваємо їх суть. Сьогодні спробуємо побути Вікіпедією і зануритися в курс фізики та хімії води, простою мовою розповісти про те, чому ж вона не тільки “джерело життя на землі”, а й воістину особлива хімічна речовина.
Фізичні властивості води
Чиста вода не має смаку і запаху, за нормальної температури (20 оС) знаходиться в рідкому вигляді.
“Вода” – це тривіальна назва, хімічну сполуку називають оксидом водню.
Атом водню має валентність (здатність утворювати зв’язки) 1, а атом кисню – 2. Завдяки цьому формула води саме H2O.
Також кожна молекула води здатна утворювати до чотирьох водневих зв’язків (2 з них водень, 2 кисень). Всі аномалії фізичних властивостей води пов’язані саме з ними — у води досить висока температура кипіння (100°C). Якби не існувало водневих зв’язків, то вода кипіла б при температурі -80°C, а замерзала б при -100°C. Така будова дозволяє нам бачити воду в трьох агрегатних станах (лід, рідина, газ) в навколишньому природному середовищі. Тут коротко описані фізичні властивості води, а ось детальніше про те, як кипить і замерзає вода , як та чим відрізняється важка вода , ми писали раніше.
Хімічні властивості води
Тут ми детальніше поговоримо про те, які хімічні властивості може проявляти вода, і як вони пов’язані з показниками води на Землі.
Якщо розглядати воду, як компонент реакцій, то основні хімічні властивості H2O, які потрібно знати, щоб розуміти процеси в навколишньому середовищі, можна описати невеликим списком.
Взаємодія води з простими речовинами
З лужними та лужноземельними металами взаємодія відбувається досить бурхливо з виділенням тепла, а іноді навіть світла, наприклад, натрій, калій, кальцій здатні рухатися і навіть “стрибати” по воді.
2Na + 2H2O = H2 + 2NaOH.
Менш активні метали реагують або при нагріванні, або не реагують зовсім, наприклад залізо:
3Fe + 4H2O = 4H2+ Fe3O4 (лише при нагріванні)
Ці реакції в природному середовищі не відбуваються, а ось реакція корозії, коли до води приєднується повітря, дуже навіть поширена:
4Fe + 3O2 + 6H2O ➝ 4Fe(OH)3.
Це рівняння описує формування іржі на залізних поверхнях. Подібні процеси можуть відбуватися також з міддю, цинком і їх сплавами.
Подібні процеси можуть відбуватися також з міддю, цинком і їх сплавами.
Реакції з неметалами відбуваються виключно при нагріванні або інших типах впливу. Вони також не принципові для вивчення властивостей води.
Реакції з оксидами неметалів
Дуже часто вода в природі зустрічається з вуглекислим газом, а також оксидами сірки та азоту, які є компонентами вихлопних газів, за таким механізмом:
SO2 + H2O = H2SO4.
В результаті саме цих процесів утворюються кислотні дощі.
Фотосинтез
Ця унікальна реакція дозволяє рослинам під впливом сонячного випромінювання з вуглекислого газу і води синтезувати поживні речовини: крохмаль і глюкозу.
6nCO2 + 5nH2O = (C6H10O5)n + 6nO2
Це, мабуть, все реакції, які можуть бути цікаві щодо води, як окремого елемента.
Вода – ідеальний розчинник
Вода є ідеальним розчинником, тому багато процесів відбувається невидимо для нашого ока. Ось вони — якраз, і найцікавіші. У природі не існує води, яка не містить домішок. У воді завжди розчинені неорганічні солі, гази, а при антропогенному впливі ще й величезний асортимент органічних речовин.
Наприклад, природна твердість води обумовлена тим, що під час її руху через породи, вона насичується мінералами. Залежно від складу порід, їх розчинності, температури навколишнього середовища певні їх концентрації здатні розчинятися у воді. Переважно такі породи представлені карбонатами, сульфатами, нітратами кальцію, магнію, натрію, калію та ін. катіонів. Мабуть, основними мінералами, які становлять базис жорсткості, є гіпс (CaSO
Що стосується розчиненого заліза і марганцю, то вони характерні переважно для природних свердловинних вод, оскільки розчинні солі заліза зазвичай “мешкають” в просторі з недостачею повітря. Джерелами їх є переважно магнітний, бурий, червоний залізняки, магнезит та ін.
Джерелами їх є переважно магнітний, бурий, червоний залізняки, магнезит та ін.
Сірководень також зберігається глибше ґрунтових вод, як продукт хімічних процесів серед органічних речовин. На повітрі теж схильний окиснюватися до елементарної сірки й випадати в осад (зазвичай невидимий людському оку).
У природних поверхневих водах завжди міститься розчинений кисень і азотовмісні компоненти, які виходять як наслідок життєдіяльності мікроорганізмів — це амоній, нітрити, нітрати, які з легкістю перетворюються один в одного. Також у водоймах завжди є білки й амінокислоти.
Що ж стосується антропогенного навантаження, то саме завдяки йому в воду вносяться найтоксичніші забруднювачі:
- солі важких металів;
- промислові органічні продукти;
- нітрати й фосфати застосовуються як добрива.
У воді постійно відбуваються якісь реакції. Це й обмінні процеси, які викликають, наприклад, осадження накипу, що складається з карбонату кальцію. І окислювально-відновні, через які у свердловинній воді з’являється рудувата залізна муть або осад на стінках. Вода — це складна хімічна система, і кожен елемент завжди має своє джерело.
І окислювально-відновні, через які у свердловинній воді з’являється рудувата залізна муть або осад на стінках. Вода — це складна хімічна система, і кожен елемент завжди має своє джерело.
СВОЙСТВА ПОВАРЕННОЙ СОЛИ
- Главная
- Список секций
- Химия
- СВОЙСТВА ПОВАРЕННОЙ СОЛИ
- Авторы
- Руководители
- Файлы работы
- Наградные документы
Магафурова К.И. 1
1
Бартова Н.Г. 1
1
Автор работы награжден дипломом победителя III степени
Диплом школьникаСвидетельство руководителя
Текст работы размещён без изображений и формул.
Полная версия работы доступна во вкладке “Файлы работы” в формате PDF
Сегодня в 21 веке для людей созданы все условия для комфортной жизни – роботы, компьютеры, машины и многое другое. Почти в каждом доме есть большое количество разнообразной техники и приборов, которые облегчают жизнь людей. Но в жизни есть и простые вещи, которые мы не замечаем ( вода, сахар, зубная щетка), тем не менее они очень нужны и важны. Сюда же относится и соль. Она имеет большое значение для человека и во все времена ценилась очень дорого. Именно по этой причине мне бы хотелось рассказать вам о соли и ее видах, познакомить вас с ее физическими свойствами, на примере поваренной соли.
Почти в каждом доме есть большое количество разнообразной техники и приборов, которые облегчают жизнь людей. Но в жизни есть и простые вещи, которые мы не замечаем ( вода, сахар, зубная щетка), тем не менее они очень нужны и важны. Сюда же относится и соль. Она имеет большое значение для человека и во все времена ценилась очень дорого. Именно по этой причине мне бы хотелось рассказать вам о соли и ее видах, познакомить вас с ее физическими свойствами, на примере поваренной соли.
Свойства поваренной соли
-
Характеристика и виды соли
Поваренная соль является минеральным природным веществом и важной добавкой к человеческой пище. Она имеет форму кристалла. Без нее еда не только не вкусная, но и не полезная, однако чрезмерное употребление соли может навредить организму.
В природе соль встречается в виде минерала галита – каменной соли. Слово «галит» происходит от греческого «галос», означающего и «соль», и «море». Природный галит редко бывает чисто белого цвета. Чаще он буроватый или желтоватый из-за примесей соединений железа.
По способу добывания соль делится на несколько видов:• каменная, добывается горным способом, с помощью подземных разработок.• озёрная, добывается из пластов на дне соляных озёр;• садочная соль получается выпариванием или вымораживанием из воды.• выварочная соль получается выпариванием из подземных вод.
Чистая поваренная соль(NaCl), которую мы каждый день употребляем в пищу, это бесцветное кристаллическое вещество, способное раствориться в воде. На вкус соль – соленая, а также способна со временем разъедать кожу и некоторые твердые вещества.
2. Физические свойства соли
Физические свойства – это любые характеристики, которыми обладают все вещества, в том числе и поваренная соль.
Эксперимент и выводы
Чтобы наглядно можно было увидеть физические свойства соли, мы дома провели небольшой эксперимент. Для этого взяли стакан с простой водой, положили в нее три ложки поваренной соли и все перемешали до полного растворения соли в воде. После этого привязали нитку на карандаш и опустили свободный конец нитки в стакан с соляным раствором и оставили на несколько дней.
Вывод: Через несколько дней мы увидели, что нитка покрылась соляными кристаллами. Проведенный опыт показал, что:
К слову, когда я со своей семьей отдыхала на соляных озерах в г. Соль–Илецке, то на мне и на всех отдыхающих можно было увидеть белый налет на теле, после купания в любом из соляных озер.
Соль–Илецке, то на мне и на всех отдыхающих можно было увидеть белый налет на теле, после купания в любом из соляных озер.
Список использованных источников литературы
http://fb.ru
https://ru.wikipedia.org
http://obovsemponemnogu.ru
Приложение 1
Пословицы и поговорки.
– Без соли, что без воли: жизни не проживешь.
– Без соли, без хлеба – половина обеда.
– Без соли хлеб не естся.
– Из пресного сделаешь соленое, а соленого не опреснишь.
– За хлебом-солью всякая шутка хороша.
– Без соли невкусно, а без хлеба несытно.
Приложение 2
Про соль
Гласит народная молва,
Что хлеб – всему голова!
Без соли, однако, не вкусны хлеба,
Ни выпечка, ни другая еда!
Соль организму очень нужна,
В нужных количествах полезна она.
Соли разные бывают:
Одной дорогу посыпают,
Другие медикам нужны,
Чтоб вылечить больных могли.
В промышленности тоже не заменима она!
Очень полезна соль и важна!
Автор: Магафурова К. И.
Просмотров работы: 10430
3.2: Физические и химические свойства
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 177346
Цели обучения
Отделить физические свойства от химических.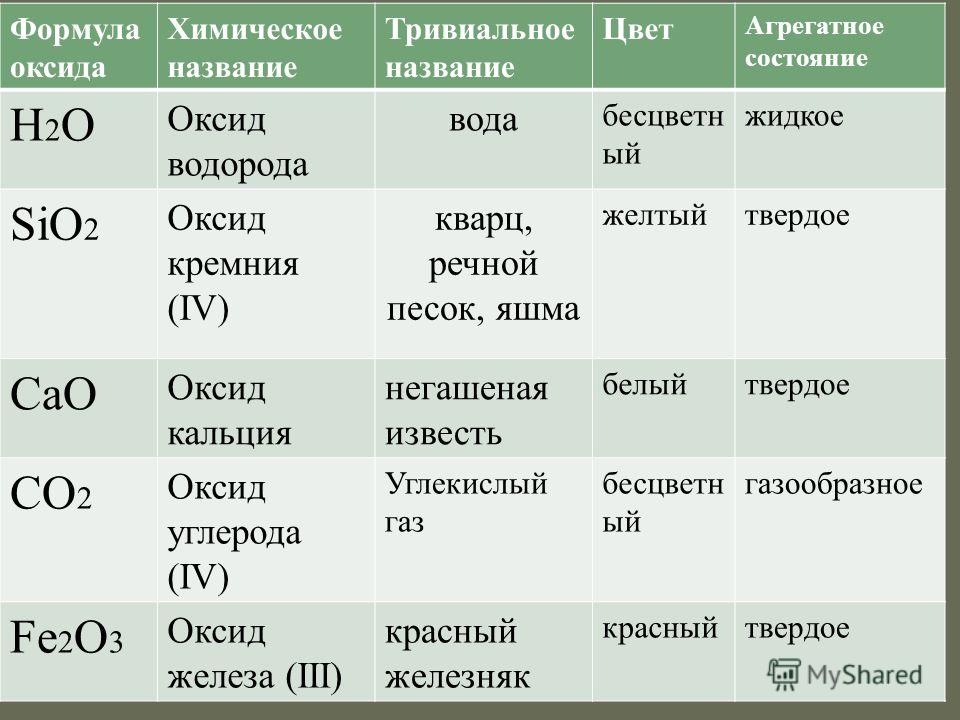
Вся материя имеет физические и химические свойства. Физические свойства — это характеристики, которые ученые могут измерить без изменения состава исследуемого образца, такие как масса, цвет и объем (объем пространства, занимаемый образцом). Химические свойства описывают характерную способность вещества реагировать с образованием новых веществ; они включают его воспламеняемость и подверженность коррозии. Все образцы чистого вещества обладают одинаковыми химическими и физическими свойствами. Например, чистая медь всегда представляет собой красновато-коричневое твердое вещество (физическое свойство) и всегда растворяется в разбавленной азотной кислоте с образованием синего раствора и коричневого газа (химическое свойство).
Физическое свойство
Физическое свойство — это характеристика вещества, которую можно наблюдать или измерять без изменения идентичности вещества. Серебро — это блестящий металл, который очень хорошо проводит электричество. Из него можно формовать тонкие листы, это свойство называется ковкостью. Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. Физические свойства вещества включают цвет, твердость, ковкость, растворимость, электропроводность, плотность, температуры плавления и температуры кипения.
Соль тусклая и ломкая и проводит электричество, когда она растворена в воде, что она делает довольно легко. Физические свойства вещества включают цвет, твердость, ковкость, растворимость, электропроводность, плотность, температуры плавления и температуры кипения.
Для элементов цвет не сильно отличается от одного элемента к другому. Подавляющее большинство элементов бесцветные, серебристые или серые. Некоторые элементы имеют отличительные цвета: сера и хлор — желтые, медь (разумеется) медного цвета, а элементарный бром — красный. Однако плотность может быть очень полезным параметром для идентификации элемента. Из материалов, существующих в твердом состоянии при комнатной температуре, йод имеет очень низкую плотность по сравнению с цинком, хромом и оловом. Золото имеет очень высокую плотность, как и платина. Чистая вода, например, имеет плотность 0,998 г/см 3 при 25°C. Средние плотности некоторых распространенных веществ приведены в таблице \(\PageIndex{1}\). Обратите внимание, что кукурузное масло имеет более низкое отношение массы к объему, чем вода. Это означает, что при добавлении в воду кукурузное масло будет «плавать».
Это означает, что при добавлении в воду кукурузное масло будет «плавать».
| Вещество | Плотность при 25°C (г/см3) |
|---|---|
| кровь | 1,035 |
| жировые отложения | 0,918 |
| цельное молоко | 1,030 |
| масло кукурузное | 0,922 |
| майонез | 0,910 |
| мед | 1,420 |
- Твердость помогает определить, как можно использовать элемент (особенно металл).
 Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Точки плавления и кипения являются уникальными идентификаторами, особенно для соединений. Помимо получения некоторого представления об идентичности соединения, можно получить важную информацию о чистоте материала.
Химические свойства
Химические свойства вещества описывает его «потенциал» подвергаться некоторым химическим изменениям или реакциям в силу своего состава. Какие элементы, электроны и связи присутствуют, чтобы дать потенциал для химических изменений. Довольно сложно определить химическое свойство, не используя слово «изменение». В конце концов вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. В настоящее время это очень трудно сделать, и от вас не ожидается, что вы сможете это сделать. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
В конце концов вы сможете взглянуть на формулу соединения и указать некоторые химические свойства. В настоящее время это очень трудно сделать, и от вас не ожидается, что вы сможете это сделать. Например, водород может воспламениться и взорваться при определенных условиях — это химическое свойство. Металлы вообще имеют химическое свойство реагировать с кислотой. Цинк реагирует с соляной кислотой с образованием газообразного водорода — это химическое свойство.
Химическое свойство железа заключается в том, что оно способно соединяться с кислородом с образованием оксида железа, химическое название ржавчины (Рисунок \(\PageIndex{2}\)). Более общим термином для ржавчины и других подобных процессов является коррозия. Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
Другими терминами, которые обычно используются при описании химических изменений, являются горение, гниение, взрыв, разложение и брожение. Химические свойства очень полезны при идентификации веществ. Однако, в отличие от физических свойств, химические свойства можно наблюдать только тогда, когда вещество находится в процессе превращения в другое вещество.
| Физическая собственность | Химические свойства |
|---|---|
| Металлический галлий плавится при 30 o C | Железный металл ржавеет. |
| Ртуть — очень плотная жидкость. | Зеленый банан при созревании становится желтым. |
| Золото блестит. | Горит сухой лист бумаги. |
Пример \(\PageIndex{1}\)
Какое из следующих химических свойств железа?
- Железо разъедает во влажном воздухе
- Плотность = 7,874 г/см 3
- Железо в чистом виде мягкое.
- Железо плавится при 1808 К.
РАСТВОР
Железо разъедается на воздухе — единственное химическое свойство железа из списка.
Упражнение \(\PageIndex{1A}\)
Какое из перечисленных ниже физических свойств материи?
- коррозионная активность
- рН (кислотность)
- плотность
- воспламеняемость
- Ответ:
- с
Упражнение \(\PageIndex{1B}\)
Какое из следующих свойств является химическим?
- воспламеняемость
- температура плавления
- точка кипения
- плотность
- Ответ:
- и
Резюме
Физическое свойство – это характеристика вещества, которую можно наблюдать или измерять без изменения свойств вещества. Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Физические свойства включают цвет, плотность, твердость, температуры плавления и кипения. Химическое свойство описывает способность вещества подвергаться определенному химическому изменению. Чтобы идентифицировать химическое свойство, мы ищем химическое изменение. Химическое изменение всегда производит один или несколько типов материи, которые отличаются от материи, существовавшей до изменения. Образование ржавчины — это химическое изменение, потому что ржавчина — это вещество, отличное от железа, кислорода и воды, существовавших до образования ржавчины.
Авторы
Мариса Альвиар-Агню (Городской колледж Сакраменто)
Генри Эгнью (Калифорнийский университет в Дэвисе)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- химическая замена
- Химические свойства
- компаунд
- элемент
- гетерогенная смесь
- гомогенная смесь
- материя
- металл
- смеси
- неметалл
- фаза
- Физическое изменение
- Физические свойства
- полуметаллы
- источник-хим-156311
- источник-хим-171900
- источник-хим-64003
- состояние
- вещество
Свойства ионных, ковалентных и металлических соединений.



 Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.
Многие элементы довольно мягкие (например, серебро и золото), в то время как другие (например, титан, вольфрам и хром) намного тверже. Углерод — интересный пример твердости. В графите («грифеле» карандашей) углерод очень мягкий, в то время как углерод в алмазе примерно в семь раз твёрже.