Опишите физические свойства меди воды соли: а) меди; б) воды; в) соли.
alexxlab | 01.06.2023 | 0 | Разное
Химические свойства солей — реакции, определение и примеры
Поможем понять и полюбить химию
Начать учиться
107.6K
Впервые школьники знакомятся с химическими свойствами солей в 8 классе, и для понимания дальнейшего материала без этой темы никуда. Наша статья поможет освежить знания перед контрольной или экзаменом: вспомним, какие бывают соли и как они образуются, рассмотрим типичные реакции с ними.
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.

Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
KAl(SO4)2 — сульфат калия-алюминия.
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:Металл + неметалл:
2Na + Cl2 = 2NaCl
Fe + S =FeS
Так получают только соли бескислородных кислот.
Металл, стоящий левее h3 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + h3
Металл с раствором соли менее активного металла:
Fe + CuCl2 = FeCl2 + Cu
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3
Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O
Основание с кислотным оксидом:
2NaOH + SO3 = Na2SO4 + H2O
Основание с кислотой (реакция нейтрализации):
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.

Реакция раствора основания с раствором соли:
2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
- Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O
Гидроксидов металлов с кислотами:
Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы.
 Средние соли диссоциируют сразу:
Средние соли диссоциируют сразу:NaCl → Na+ + Cl–
Термическое разложение:
CaCO3 = CaO + CO2
Нитраты разлагаются в зависимости от активности металла соли:
Получение комплексных солей
Реакции солей с лигандами:
AgCl + 2Nh4 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO
Химические свойства солей
Химические свойства средних солей
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства.

NH4Cl = NH3 + HCl
Взаимодействие солей с металлами:
Fe + CuSO4 = FeSO4 + Cu
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Na2CO3 + H2O = NaOH + NaHCO3
FeCl3+ H2O = Fe(OH)Cl2 + HCl
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
K2CO3 + 2HCl = 2KCl + CO2+H2O
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
AgCl + 2Na2S2O3 = Nа3[Ag(S2O3)2] + NaCl
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
10FeSO4 + 2KMnO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Химические свойства кислых солей
Диссоциация.
 Кислые соли диссоциируют ступенчато:
Кислые соли диссоциируют ступенчато:NaHCO3 → Na+ +HCO3−
HCO3− → H+ + CO32−
Термическое разложение с образованием средней соли:
Ca(HCO3)2 = CaCO3 + CO2 + H2O
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Химические свойства основных солей
Термическое разложение:
[Cu(OH)]2CO3 = 2CuO + CO2 + H2O
Реакции солей с кислотами — образование средней соли:
Sn(OH)Cl + HCl = SnCl2 + H2O
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.

Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Na[Al(OH)4] + 4HCl(изб.) = NaCl + AlCl3 + 4H2O,
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Na[Al(OH)4] + HCl = NaCl + Al(OH)3 + H2O,
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
Na[Al(OH)4] + H2S = NaHS + Al(OH)3 + H2O,
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
K3[Cr(OH)6] + 3SO2 = 3KHSO3 + Cr(OH)3,
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза.
 Продукты реакции — два амфотерных гидроксида и соль активного металла:
Продукты реакции — два амфотерных гидроксида и соль активного металла:K3[Cr(OH)6] +Al(NO3)3 = Al(OH)3 + Cr(OH)3 + 3KNO3
Разлагаются при нагревании:
K3[Cr(OH)6] =KCrO2 + 2H2O + 2KOH
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Формула какого вещества пропущена в уравнении реакции:
MgO + … → MgCl2 + Н2O
HCl
Cl2
Cl2O7
HClO3
Татьяна Сосновцева
К предыдущей статье
Изомеры
К следующей статье
Качественные реакции
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Пятигорский медико-фармацевтический институт – филиал Волгоградского государственного медицинского университета
Согласно Приказу Министерства здравоохранения и социального развития Российской Федерации № 434 от 28 апреля 2012 года 1 октября 2012 года завершилась реорганизация государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации и государственного бюджетного образовательного учреждения высшего профессионального образования «Пятигорская государственная фармацевтическая академия» Министерства здравоохранения и социального развития Российской Федерации в форме присоединения второго учреждения к первому с последующим образованием на основе присоединённого учреждения обособленного подразделения (филиала).
Определено, что полное наименование филиала вуза (бывшей Пятигорской государственной фармацевтической академии), с учетом разделения Министерства здравоохранения и социального развития Российской Федерации на два министерства, следующее:
Пятигорский филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации
Сокращённое наименование: «Пятигорский филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Согласно Приказу Министерства здравоохранения Российской Федерации № 51 от 04 февраля 2013 года указаны изменения, которые вносятся в устав государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации.
В пункте 1.10 абзацы третий и четвёртый изложить в следующей редакции:
«полное наименование: Пятигорский медико-фармацевтический институт — филиал государственного бюджетного образовательного учреждения высшего профессионального образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации»,
сокращённое наименование:
«Пятигорский медико-фармацевтический институт — филиал ГБОУ ВПО ВолгГМУ Минздрава России».
Переименование произведено с 14.03.2013.
В соответствии с приказом по Университету от «15» июля 2016 г. №1029-КМ “О введение в действие новой редакции Устава и изменении наименования Университета” с 13.07.2016 г. в связи с переименованием Университета считать:
– полным наименованием Университета: федеральное государственное бюджетное образовательное учреждение высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
– сокращенным наименованием Университета: ФГБОУ ВО ВолгГМУ Минздрава России;
– полным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал федерального государственного бюджетного образовательного учреждения высшего образования «Волгоградский государственный медицинский университет» Министерства здравоохранения Российской Федерации;
– сокращенным наименованием филиала Университета: Пятигорский медико-фармацевтический институт – филиал ФГБОУ ВО ВолгГМУ Минздрава России.
Переименование произведено с 13.07.2016.
Узнать больше о вузе
Противодействие коррупции
Платежные реквизиты вуза
Как и почему сульфат меди описывается как соль
Чтобы определить, почему сульфат меди описывается как соль, необходимо знать основные характеристики соединения, считающегося солью, в данном случае сульфата меди, из чего он состоит. , какие химические элементы входят в его состав, физико-химические свойства этих элементов и самого соединения, с другой стороны, необходимо знать, каким требованиям должно удовлетворять соединение, чтобы оно было отнесено к соли.
Что такое соль?
Чтобы точно знать, почему сульфат меди называют солью, сначала определим, что такое соль с химической точки зрения.
Соли – это соединения, образующиеся в результате ионных связей. Эти связи возникают, когда катионы, которые представляют собой не что иное, как положительно заряженные частицы, связываются с анионами, которые представляют собой другие типы частиц, обладающих особенностью быть отрицательно заряженными.
В общем, соли являются продуктом реакций между веществами, называемыми кислотами, и другими веществами, известными как основания, при том понимании, что, говоря о кислоте, имеются в виду соединения, которые представляют водород в молекулах, из которых они состоят, и которые растворяются в воды и выделяют ионы водорода, в то время как когда мы говорим об основаниях, мы говорим о других типах соединений, которые также растворимы, но выделяют ионы гидроксила в форме ОН-.
Свойства солей
Чтобы понять, почему сульфат меди описывается как соль, мы рассмотрим соответствующие аспекты характеристик, которые представляют соли.
Это кристаллические соединения, которые имеют ионную структуру, если мы сравним сульфат меди с этой характеристикой солей, этот сульфат в своей основной форме имеет вид прозрачного твердого вещества.
Соли имеют очень высокую температуру плавления – еще одну характеристику медного купороса , поскольку эта температура составляет 110 градусов Цельсия.
Еще одной отличительной чертой солей является их растворимость в воде. Сульфат меди имеет растворимость в воде 20,7 г/100 мл при температуре 20 ℃.
Соли имеют цвета, такие как в случае пентагидрата сульфата меди, который имеет ярко-синий цвет, они также имеют металлический запах, который испускает это соединение.
Еще один способ определить соли – это то, что они реагируют с кислотами и основаниями, образуя газ, твердые вещества или воду. В случае сульфата меди ионы, которые гидратируют, образуют безводную соль этого сульфата, образованную серной кислотой и основанием, подобным оксиду меди.
Соли имеют особенность разлагаться при повышении температуры, еще одна характеристика, которой обладает пентагидрат сульфата меди, поскольку, не достигнув точки плавления, он разлагается, это происходит при температуре 63 градуса Цельсия, когда две молекулы воды теряются, а при достижении температуры 109 градусов по Цельсию теряются еще две молекулы воды, она разлагается, не достигнув точки полного плавления при 110 градусах по Цельсию.
Почему сульфат меди называют солью
Чтобы подтвердить, что это соединение является солью, мы покажем некоторые данные о различных типах, на которые классифицируются соли.
По составу
Они могут быть:
Основные, также называемые гидроксильными солями.
Кислоты
Нейтральные
Смешанные
Гидратированные
По числу элементов является металлическим, один – неметаллическим, а третий – кислородным, это случай сульфата меди, медь – металлический элемент, сера – неметаллический, а кислород – третий элемент.
Четвертичный, с 4-мя металлическими и неметаллическими элементами
Образование солей
Существует несколько способов, один из них называется нейтрализацией, атомы элемента водорода замещаются в кислоте атомами металла.
Образование соли происходит, когда металл реагирует с кислотой, это еще одна характеристика, которая проясняет, почему сульфат меди описывается как соль, поскольку медь, металл, реагирует с серной кислотой с образованием сульфата меди.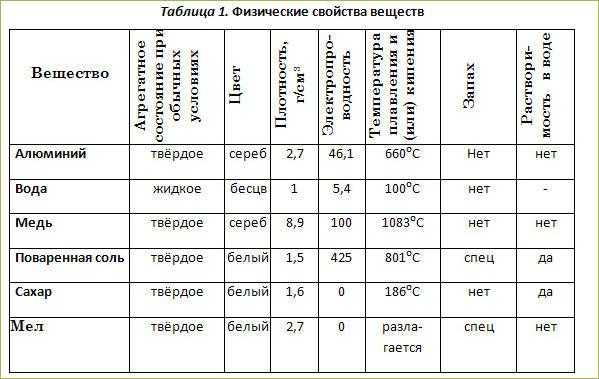
Полезные свойства и функции солей
Что касается полезности солей, компания Echemi предлагает ассортимент продуктов для удовлетворения потребностей продаж, таких как:
Сульфат меди 98%
https://www.echemi.com /produce/pr2108101155-copper-sulfate-98.html
Это соединение очень универсально в различных отраслях промышленности, выдающейся функцией является предотвращение болезней бактериального типа в сельском хозяйстве, защита урожая различных овощей для потребления человеком.
В качестве фунгицида используется как дезинфицирующее средство, уничтожающее популяции грибков, паразитов и плесени.
Помимо прочего, сульфат меди используется для приготовления пигментов при обработке кожи, в различных типах красителей для производства плитки, в производстве синтетического каучука, в производстве гальванизированных материалов, при обработке дерева, в производстве клеев, литографии, текстиле, канцелярских принадлежностях и других областях промышленности.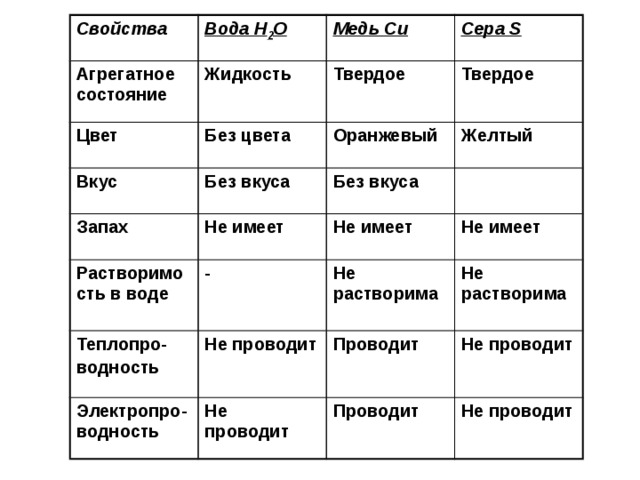
Отказ от ответственности: ECHEMI оставляет за собой право окончательного объяснения и пересмотра всей информации.
5 Физические свойства меди
28 января 2023 г. 28 января 2023 г. | 17:09
Медь — один из наиболее широко используемых элементов на земле. Это важный элемент, который можно найти во всем: от электропроводки и сантехники до ювелирных изделий и монет. Медь обладает различными физическими свойствами, которые делают ее такой полезной и универсальной. Давайте рассмотрим пять свойств, которые делают медь неотъемлемой частью нашего современного мира.
Ковкость
Одним из самых уникальных физических свойств меди является ее ковкость. Это означает, что меди можно легко придавать различные формы, не ломая и не трескаясь. Это делает медь идеальной для изготовления тонких листов, проводов и труб для сантехнических систем, электропроводки и других целей. Это свойство также облегчает работу при создании украшений или монет.
Это свойство также облегчает работу при создании украшений или монет.
Гибкость
Медь также очень гибкая, ее можно сгибать или скручивать, не ломая и не трескаясь. Это свойство хорошо подходит для использования в сантехнических системах, электропроводке и кабелях. Его гибкость позволяет легко огибать углы или преодолевать узкие места.
Коррозионная стойкость
Еще одним важным физическим свойством меди является ее коррозионная стойкость. Он не ржавеет, как другие металлы, под воздействием погодных условий, таких как ветер, дождь, снег и соленый воздух. Это делает медь идеальной для наружных работ, таких как кровельные материалы, желоба и водосточные трубы, скульптуры и т. д., поскольку они не подвержены коррозии со временем, как другие металлы.
Электропроводность
Благодаря своей химической структуре медь обладает отличной электропроводностью, что означает, что электричество проходит через нее легко и эффективно без потери мощности или накопления тепла.

