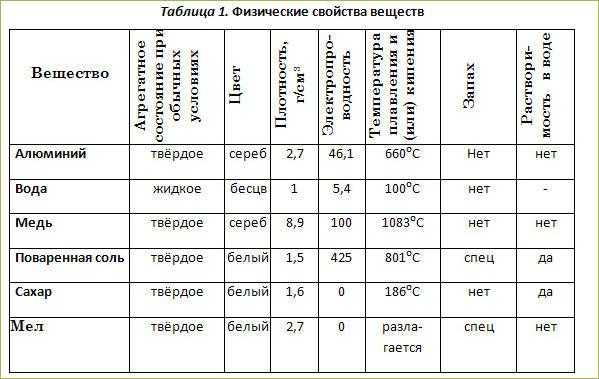
Опишите физические свойства следующих веществ алюминия: ГДЗ к учебнику ХИМИЯ 8 КЛАСС Еремина и др. §1 Вещества РЕШЕБНИК ОТВЕТЫ » Крутые решение для вас от GDZ.cool
alexxlab | 19.07.2023 | 0 | Разное
|
|
Алюминий.
 Железо.Зачет. – Татьяна Шленкова
Железо.Зачет. – Татьяна ШленковаУченикам > Самостоятельные работы > 9 класс > Алюминий.Железо.Зачет.
|
Каковы физические свойства алюминия?
Что такое алюминий?
Алюминий (или алюминий в американском английском и канадском английском) — это химический элемент с символом Al и атомным номером 13. Алюминий имеет плотность ниже, чем у других распространенных металлов, примерно на одну треть плотности стали.
Имеет большое сродство к кислороду и образует защитный слой оксида на поверхности при контакте с воздухом. Алюминий визуально напоминает серебро как по цвету, так и по способности отражать свет. Он мягкий, немагнитный и пластичный.
Алюминиевый лист 3 мм aa1050 h24
Алюминий — мягкий и легкий металл с умеренными химическими свойствами. Он имеет тусклый серебристый вид, потому что быстро образует тонкий слой оксида при воздействии воздуха. Алюминий не токсичен (как и сталь), не магнитится и не искрит.
История алюминия
Об открытии алюминия было объявлено в 1825 году датским физиком Гансом Христианом Эрстедом.
Первое промышленное производство алюминия было начато французским химиком Анри Этьеном Сент-Клер Девилем в 1856 году.
Алюминий стал гораздо более доступным для общественности благодаря процессу Холла-Эру, независимо разработанному французским инженером Полем Эру и американским инженером Чарльзом Мартином Холлом в 1886 году, а массовое производство алюминия привело к его широкому использованию в промышленности и повседневной жизни.
Во время Первой и Второй мировых войн алюминий был важнейшим стратегическим ресурсом для авиации. В 1954 году алюминий стал самым производимым цветным металлом, обогнав медь. В 21 веке большая часть алюминия потреблялась в транспорте, машиностроении, строительстве и упаковке в США, Западной Европе, Китае и Японии.
Мировое производство алюминия с 1900 г.
На протяжении 20 века производство алюминия быстро росло: в то время как мировое производство алюминия в 1900 г. составляло 6 800 метрических тонн, годовое производство впервые превысило 100 000 метрических тонн в 1916 г.; 1 000 000 тонн в 1941 году; 10 000 000 тонн в 1971 году. В 1970-х годах возросший спрос на алюминий сделал его биржевым товаром; она вышла на Лондонскую биржу металлов, старейшую в мире биржу промышленных металлов, в 1978.[86] Объем производства продолжал расти: в 2013 году годовой объем производства алюминия превысил 50 000 000 метрических тонн.
Чистый алюминий
Алюминий используется во многих отраслях промышленности для производства десятков миллионов различных продуктов и играет очень важную роль в мировой экономике. Благодаря использованию многочисленных комбинаций его ключевых свойств, включая электрическую мощность, легкий вес, коррозионную стойкость, восстанавливаемость и формуемость, алюминий используется во все большем числе приложений. Этот класс товаров варьируется от структурных материалов до тонкой упаковочной пленки.
Благодаря использованию многочисленных комбинаций его ключевых свойств, включая электрическую мощность, легкий вес, коррозионную стойкость, восстанавливаемость и формуемость, алюминий используется во все большем числе приложений. Этот класс товаров варьируется от структурных материалов до тонкой упаковочной пленки.
Алюминиевые пластины из различных сплавов:
1050 Алюминиевый лист
1060 Алюминиевый лист
1100 Алюминиевый лист
3003 Алюминиевый лист
3004 Алюминиевый лист
3105 Алюминиевый лист
5005 Алюминиевый лист
5 052 Алюминиевый лист
5083 Алюминиевый лист
5754 Алюминий листовая пластина
6061 алюминиевый лист
6082 алюминиевый лист
5 бар алюминиевая пластина в шахматном порядке
алюминиевая алмазная пластина
5X10 алюминиевый лист и пластина
4X8 алюминиевый лист
Физические свойства алюминия
Каковы физические свойства алюминия? Физический дом обычно представляет собой характеристику, которую можно определить с помощью наших органов чувств, включая цвет, плотность, твердость, коррозионную стойкость, теплопроводность, электропроводность и т. д. Физические свойства алюминия следующие.
д. Физические свойства алюминия следующие.
| Свойства | Описание |
| Цвет | Алюминий представляет собой серебристо-белый металл без запаха. |
| Плотность | Плотность алюминия составляет примерно одну треть плотности стали или меди, что делает его одним из самых легких коммерческих металлов. |
| Прочность | Чистый алюминий не обладает очень высокой прочностью на растяжение. Однако легирующие элементы, в том числе марганец, кремний, медь и магний, могут повышать прочность алюминия и производить сплавы для конкретных применений. Алюминий хорошо подходит для холодных условий. Он имеет преимущество перед металлами в том, что его прочность на растяжение увеличивается при понижении температуры, сохраняя при этом свою долговечность. Опять же металл хрупкий при низких температурах. |
| Коррозионная стойкость | При контакте с воздухом алюминий с небольшой задержкой образует на своей поверхности оксид алюминия.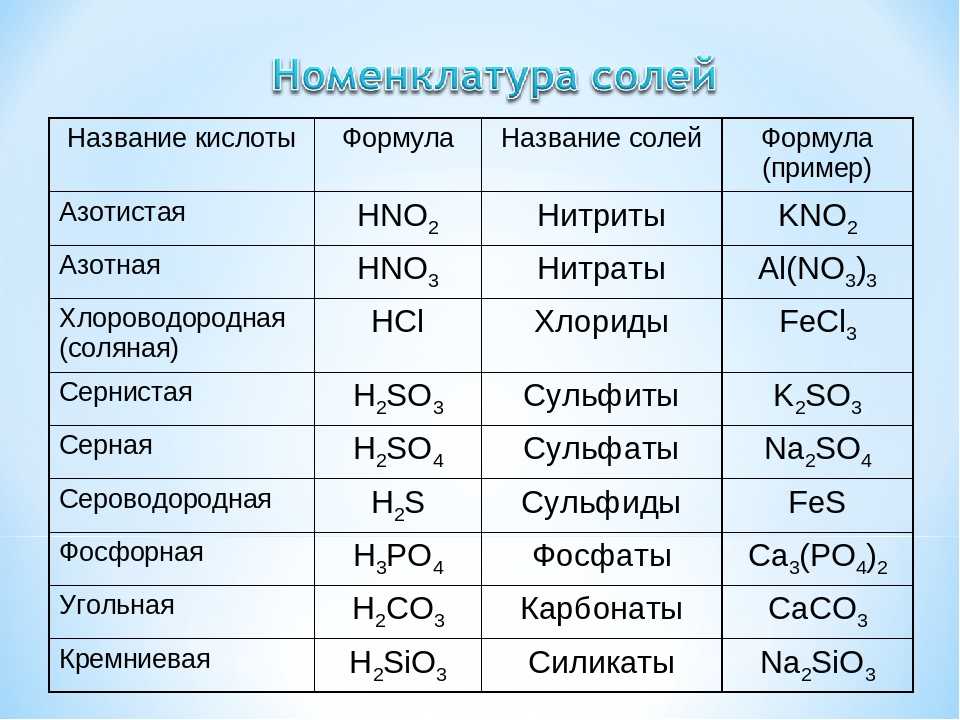 Это покрытие обладает отличной коррозионной стойкостью. Обладает широкой стойкостью к большинству кислот, но слабо устойчив к щелочам. Это покрытие обладает отличной коррозионной стойкостью. Обладает широкой стойкостью к большинству кислот, но слабо устойчив к щелочам. |
| Теплопроводность | Теплопроводность алюминия примерно в три раза выше, чем у стали. Это приводит к тому, что алюминий является ключевой тканью для охлаждения и обогрева (наряду с теплообменниками). В сочетании с его нетоксичностью этот выбор привел к тому, что алюминий широко используется в кухонной посуде и кухонной утвари. |
| Проводимость | Алюминийобладает достаточно высокой электропроводностью и может использоваться в качестве электрических проводников. |
| Отражающая способность | От ультрафиолетового до инфракрасного, алюминий является исключительным отражателем лучистой энергии. Те же свойства отражательной способности делают алюминий изоляционной тканью, которая блокирует солнечный свет летом и даже останавливает потерю тепла при замерзании. |
Алюминий является превосходным тепловым и электрическим проводником, его проводимость примерно на 60 % меньше, чем у меди, как тепловая, так и электрическая, при этом плотность меди составляет всего 30 %.
Химическое свойство – это реакция вещества с другими веществами, т.е. одного вещества в другое. В стандартных случаях химические вещества легче всего идентифицировать в какой-то момент химической реакции. Реакцией вещества может быть изменение вследствие горения, ржавчины, нагревания, взрыва, изменения цвета и т. д. Ниже приведены химические свойства алюминия.
| Свойства | Описание |
| Окисление | Обычно алюминиевые металлы не реагируют на воздух, потому что их поверхность покрыта тонким слоем оксидов, которые помогают защитить металл от воздушной эрозии. Однако, если оксидный слой поврежден и оголен металлический алюминий, он снова вступит в реакцию с образованием амфотерного оксида. |
| Реакция с кислотой | Алюминий легко реагирует с неорганической кислотой с образованием раствора, содержащего гидратированные ионы алюминия, при этом выделяется водород. В случае реакции с азотной кислотой она пассивно реагирует, образуя защитный оксидный слой на поверхности оксида алюминия |
| Реакция с щелочью | Алюминий вступает в реакцию с основанием, образуя алюминат с выделением водорода. |
| Реакция с водой | Реагирует с горячей водой. |
| Соединение | Смеси алюминия, кислорода и других элементов производят алюминиевые рудники, алюминиевый рудник является основным источником алюминия. |
| Сплав | В сочетании с такими элементами, как медь, кремний или магний, образует сплавы с высокой прочностью. |
Благодаря своим физическим и химическим свойствам алюминий можно смешивать с другими металлами для получения алюминиевых сплавов, которые используются в различных областях. Алюминиевые сплавы имеют свойства, отличные от свойств одного металла, и алюминиевые сплавы классифицируются в соответствии с другими элементами, которые они содержат. Ниже приводится ряд алюминиевых сплавов и их основные области применения:
Ниже приводится ряд алюминиевых сплавов и их основные области применения:
| Серия | Элемент из сплава | Применение |
| 1ххх | Почти чистый алюминий | Декорация, химическое оборудование, теплоотражатель |
| 2ххх | Медь | Панель грузовика, детали самолета |
| 3ххх | Марганец | Посуда, дорожный знак, холодильник |
| 4ххх | Кремний | Корабль, мостик |
| 5ххх | Магний | Топливный бак самолета |
| 6ххх | Магний + кремний | Оружие низкого давления, авиационный разъем |
| 7ххх | Цинк | Конструкция самолета |
| 8ххх | Прочие элементы являются главными элементами сплава | Алюминиевая фольга, радиатор |
Алюминий не теряет своих свойств после сильной деформации. Это позволяет превращать алюминий в различные формы алюминиевых изделий, таких как алюминиевые трубы, пластины, диски и фольга, с помощью механических процессов, таких как прокатка, экструзия, волочение и механическая обработка. Легирование, холодная обработка и термическая обработка могут использоваться для настройки свойств алюминия.
Это позволяет превращать алюминий в различные формы алюминиевых изделий, таких как алюминиевые трубы, пластины, диски и фольга, с помощью механических процессов, таких как прокатка, экструзия, волочение и механическая обработка. Легирование, холодная обработка и термическая обработка могут использоваться для настройки свойств алюминия.
3.4: Классификация вещества по составу
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47456
Цели обучения
- Объяснить разницу между чистым веществом и смесью.
- Объясните разницу между элементом и соединением.
- Объясните разницу между гомогенной смесью и гетерогенной смесью.

Один из полезных способов организации нашего понимания материи состоит в том, чтобы представить себе иерархию, простирающуюся от самых общих и сложных до самых простых и фундаментальных (рис. \(\PageIndex{1}\)). Материю можно разделить на две широкие категории: чистые вещества и смеси. A чистое вещество — это форма материи, которая имеет постоянный состав (это означает, что она везде одинакова) и свойства, которые являются постоянными для всей пробы (это означает, что существует только один набор свойств, таких как температура плавления, цвет, температура кипения и т. д. по всему делу). Материал, состоящий из двух или более веществ, представляет собой смесь . Элементы и соединения являются примерами чистых веществ. Вещество, которое нельзя разложить на химически более простые компоненты, — элемент 9.0057 . Алюминий, который используется в банках с газировкой, является элементом. Вещество, которое можно разложить на химически более простые компоненты (поскольку оно состоит из более чем одного элемента), представляет собой соединение . Например, вода представляет собой соединение, состоящее из элементов водорода и кислорода. На сегодняшний день в известной Вселенной насчитывается около 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
Например, вода представляет собой соединение, состоящее из элементов водорода и кислорода. На сегодняшний день в известной Вселенной насчитывается около 118 элементов. Напротив, на сегодняшний день ученые идентифицировали десятки миллионов различных соединений.
Обыкновенная поваренная соль называется хлоридом натрия. Он считается веществом , потому что имеет однородный и определенный состав. Все образцы хлорида натрия химически идентичны. Вода также является чистым веществом. Соль легко растворяется в воде, но соленую воду нельзя отнести к веществу, так как ее состав может быть разным. Вы можете растворить небольшое количество соли или большое количество в заданном количестве воды. Смесь — это физическая смесь двух или более компонентов, каждый из которых сохраняет свою идентичность и свойства в смесь . Меняется только форма соли, когда она растворяется в воде. Он сохраняет свой состав и свойства.
Он сохраняет свой состав и свойства.
Однородная смесь представляет собой смесь, в которой состав однороден по всей смеси. Описанная выше соленая вода является однородной, поскольку растворенная соль равномерно распределена по всей пробе соленой воды. Часто гомогенную смесь легко спутать с чистым веществом, потому что они оба однородны. Отличие в том, что состав вещества всегда одинаков. Количество соли в соленой воде может варьироваться от одного образца к другому. Все растворы считаются гомогенными, поскольку растворенный материал присутствует в одинаковом количестве во всем растворе.
гетерогенная смесь представляет собой смесь, состав которой неоднороден по всей смеси. Овощной суп представляет собой неоднородную смесь. Любая данная ложка супа будет содержать различное количество различных овощей и других компонентов супа.
Фаза
Фаза – это любая часть образца, которая имеет однородный состав и свойства. По определению чистое вещество или гомогенная смесь состоит из одной фазы. Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а вместо этого образуют два отдельных слоя. Каждый из слоев называется фазой.
Гетерогенная смесь состоит из двух или более фаз. Когда масло и вода смешиваются, они не смешиваются равномерно, а вместо этого образуют два отдельных слоя. Каждый из слоев называется фазой.
Пример \(\PageIndex{1}\)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- фильтрованный чай
- свежевыжатый апельсиновый сок
- компакт-диск
- оксид алюминия, белый порошок, содержащий атомы алюминия и кислорода в соотношении 2:3
- селен
Подарено : химическое вещество
Просили : его классификация
- Определите, является ли вещество химически чистым. Если оно чистое, то вещество является либо элементом, либо соединением. Если вещество можно разделить на элементы, оно является соединением.
- Если вещество не является химически чистым, оно представляет собой либо гетерогенную смесь, либо гомогенную смесь.
 Если его состав везде однороден, то это однородная смесь.
Если его состав везде однороден, то это однородная смесь.
Раствор
- A) Чай представляет собой раствор соединений в воде, поэтому он не является химически чистым. Обычно его отделяют от чайных листьев фильтрованием.
B) Поскольку состав раствора везде однороден, это гомогенная смесь . - A) Апельсиновый сок содержит как твердые частицы (мякоть), так и жидкость; он не является химически чистым.
B) Поскольку его состав неоднороден, апельсиновый сок представляет собой гетерогенную смесь . - A) Компакт-диск представляет собой твердый материал, содержащий более одного элемента, по краям которого видны области разного состава. Следовательно, компакт-диск не является химически чистым.
B) Области разного состава указывают на то, что компакт-диск представляет собой гетерогенную смесь.
- A) Оксид алюминия представляет собой отдельное, химически чистое соединение .
- А) Селен является одним из известных элементов .
Упражнение \(\PageIndex{1}\)
Определите каждое вещество как соединение, элемент, гетерогенную смесь или гомогенную смесь (раствор).
- белое вино
- ртуть
- Заправка для салата в стиле ранчо
- сахар столовый (сахароза)
- Ответ а:
- гомогенная смесь (раствор)
- Ответ б:
- элемент
- Ответ c:
- гетерогенная смесь
- Ответ д:
- компаунд
Пример \(\PageIndex{2}\)
Как бы химик классифицировал каждый пример материи?
- морская вода
- почва
- вода
- кислород
Раствор
- Соленая вода действует так, как если бы она была одним веществом, даже если она содержит два вещества — соль и воду.
 Соленая вода представляет собой однородную смесь или раствор.
Соленая вода представляет собой однородную смесь или раствор. - Почва состоит из мелких кусочков различных материалов, поэтому представляет собой неоднородную смесь.
- Вода — это вещество. В частности, поскольку вода состоит из водорода и кислорода, она представляет собой соединение.
- Кислород, вещество, является элементом.
Упражнение \(\PageIndex{2}\)
Как бы химик классифицировал каждый образец вещества?
- кофе
- водород
- яйцо
- Ответ а:
- однородная смесь (раствор), если это фильтрованный кофе
- Ответ б:
- элемент
- Ответ c:
- гетерогенная смесь
Резюме
Вещество можно разделить на две широкие категории: чистые вещества и смеси. Чистое вещество – это форма материи, которая имеет постоянный состав и свойства, постоянные во всем образце. Смеси представляют собой физические комбинации двух или более элементов и/или соединений. Смеси можно разделить на гомогенные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения – это вещества, состоящие из более чем одного типа атомов. Элементы — это простейшие вещества, состоящие только из атомов одного типа.
Смеси представляют собой физические комбинации двух или более элементов и/или соединений. Смеси можно разделить на гомогенные и гетерогенные. Элементы и соединения являются примерами чистых веществ. Соединения – это вещества, состоящие из более чем одного типа атомов. Элементы — это простейшие вещества, состоящие только из атомов одного типа.
Словарь
- Элемент: вещество, состоящее только из атомов одного типа.
- Соединение: вещество, состоящее из более чем одного типа атомов, связанных вместе.
- Смесь: комбинация двух или более элементов или соединений, которые не прореагировали, чтобы связать друг друга; каждая часть смеси сохраняет свои свойства.
Взносы и ссылки
3.4: Классификация материалов в соответствии с их составом распространяется по лицензии CK-12, авторами, ремиксами и/или кураторами являются Мариса Альвиар-Агнью, Генри Агнью, Стивен Лоуэр и Стивен Лоуэр.
ПОД ЛИЦЕНЗИЕЙ
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Лицензия
- СК-12
- Показать страницу TOC
- нет на стр.



 Педагогический (научно-педагогический) состав
Педагогический (научно-педагогический) состав
 Сколько граммов сульфата железа (II) можно приготовить при растворении 140 г железа в разбавленной
серной кислоте?
Сколько граммов сульфата железа (II) можно приготовить при растворении 140 г железа в разбавленной
серной кислоте? С какими из перечисленных веществ: NaOH, Na2O,
SO3, H2SO4, Na2SO4 – реагируют с Al2O3 и Al(OH)3? Напишите уравнения
реакций в молекулярном и ионном виде.
С какими из перечисленных веществ: NaOH, Na2O,
SO3, H2SO4, Na2SO4 – реагируют с Al2O3 и Al(OH)3? Напишите уравнения
реакций в молекулярном и ионном виде.