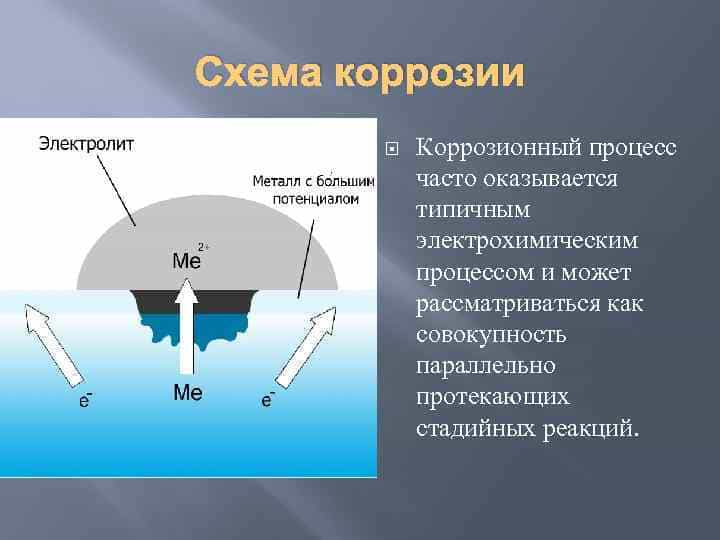
Опишите процессы происходящие в случае контактной коррозии: Электрохимическая коррозия
alexxlab | 28.05.2023 | 0 | Разное
Задачи к разделу Коррозия металлов
В данном разделе вы найдете задачи по теме Коррозия металлов. Приведены уравнения реакций, протекающих при электрохимической коррозии металлов, а также примеры задач на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов.
Задача 1. В каком случае цинк корродирует быстрее: в контакте с никелем, железом или с висмутом? Ответ поясните. Напишите для всех случаев уравнение электрохимической коррозии в серной кислоте. Будет ли оксидная пленка, образующаяся на кальции, обладать защитными свойствами?
Показать решение »
Решение.
В месте контакта двух металлов корродирует более активный металл. Происходит отток электронов от более активного металла к менее активному. Металл тем активнее, чем более отрицателен его электродный потенциал. В таблице электродных потенциалов найдем:
EZn2+/Zn = — 0,763 В
EFe2+/Fe = — 0,440 В
ENi2+/Ni = — 0,250 В
EBi3+/Bi = + 0,215 В
В данном случае, цинк корродирует быстрее в контакте с висмутом, так как из перечисленных металлов, Bi является самым неактивным. В образовавшейся паре роль анода выполняет цинк.
В образовавшейся паре роль анода выполняет цинк.
Запишем уравнения электрохимической коррозии в серной кислоте:
Zn—Bi
К: 2H+ +2e— = H2
А: Zn — 2e— = Zn2+
Zn + 2H+ = Zn2++ H2
Zn + H2SO4 = ZnSO4 + H2
Fe-Bi
К: 2H+ +2e— = H2
А: Fe — 3e— = Fe3+
2Fe + 6H+ = Fe3++ 3H2
2Fe + 3H2SO4 = Fe2(SO4)3 + 3H2
Ni-Bi
К: 2H+ +2e— = H2
А: Ni — 2e— = Ni2+
Ni + 2H+ = Ni2++ H2
Ni + H2SO4 = NiSO4 + H2
Будет ли оксидная пленка, образующаяся на кальции, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Мок = 40+16=56 г/моль
AMe = 40 г/моль
n = 1
ρМе = 1,55 г/см3
ρок = 3,37 г/см3
α = Vок/VМе =56·1,55/(40·1·3,37)
α = 0,64
т.е α, а это значит, что оксидная пленка, образующаяся на Ca, не обладает защитными свойствами.
Задача 2. Приведите примеры двух металлов, пригодных для протекторной защиты железа. Для обоих случаев напишите уравнение электрохимической коррозии во влажной среде, насыщенной кислородом. Будет ли оксидная пленка, образующаяся на алюминии, обладать защитными свойствами?
Показать решение »
Решение.
Протекторная защита заключается в присоединении к защищаемому металлическому изделию, металла с более отрицательным значением стандартного электродного потенциала E0, т. е. более активного металла. Для защиты железа подойдут, например, цинк и бериллий:
е. более активного металла. Для защиты железа подойдут, например, цинк и бериллий:
EFe2+/Fe = — 0,440 В
EZn2+/Zn = — 0,763 В
EBe2+/Be = — 1,850 В
Запишем уравнения электрохимической коррозии во влажной среде, насыщенной кислородом:
Fe—Zn
К: O2 + 2H2O + 4e— = 4OH—
А: Zn — 2e—= Zn2+
2Zn + O2 + 2H2O = 2Zn2++ 4OH—
2Zn + O2 + 2H2O = 2Zn(OH)2
Fe-Be
К: O2 + 2H2O + 4e— = 4OH—
А: Be — 2e— = Be2+
2Be + O2 + 2H2O = 2Be2++ 4OH—
2Be + O2 + 2H2O = 2Be(OH)2
Будет ли оксидная пленка, образующаяся на алюминии, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Мок = 27·2+16·3 = 102 г/моль
AMe = 27 г/моль
n = 2
ρМе = 2,7 г/см3
ρок = 3,99 г/см3
α = Vок/VМе = 102·2,7/(27·2·3,99)
α = 1,3
т.е 2,5>α>1, а это значит, что оксидная пленка, образующаяся на Al, является сплошной и обладает защитными свойствами.
Задача 3. Деталь сделана из сплава, в состав которого входит магний и марганец. Какой из компонентов сплава будет разрушаться при электрохимической коррозии? Ответ подтвердите уравнениями анодного и катодного процесса коррозии: а) в кислой среде; б) в кислой среде, насыщенной кислородом. Будет ли оксидная пленка, образующаяся на олове, обладать защитными свойствами?
Показать решение »
Решение.
При электрохимической коррозии сплава, в первую очередь будет разрушаться более активный металл, т.е. металл, имеющий более отрицательное значение стандартного электродного потенциала. В таблице электродных потенциалов найдем:
EMg2+/Mg = — 2,37 В
EMn2+/Mn = — 1,18 В
По значениям E видно, что магний является более активным металлом, чем марганец, вследствие чего при коррозии Mg будет разрушаться в первую очередь.
Запишем уравнения электрохимической коррозии магния а) в кислой среде; б) в кислой среде, насыщенной кислородом:
а) в кислой среде
К: 2H+ +2e— = H2
А: Mg — 2e— =Mg2+
Mg + 2H+ = Mg 2++ H2
Mg + H2SO4 = MgSO4 + H2
б) в кислой среде, насыщенной кислородом
К: O2 + 2H2O + 4e— = 4OH—
А: Mg — 2e— =Mg+
2Mg + O2 + 2H2O = 2Mg2++ 4OH—
2Mg + O2 + 2H2O = 2Mg(OH)2
Будет ли оксидная пленка, образующаяся на олове, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Олово может образовать два оксида SnO и SnO2, поэтому рассчитаем значение α для каждого случая
МSnO = 119+16 = 135 г/моль
МSnO2 = 119+16·2 = 151 г/моль
ASn = 119 г/моль
n = 1
ρSn = 7,31 г/см3
ρSnO = 6,45 г/см3
ρSnO2 = 6,95 г/см3
α = VSnO/VSn = 135·7,31/(119·1·6,45) = 1,3
α = 1,3
α = VSnO2/VSn = 151·7,31/(119·1·6,95) = 1,4
α = 1,3
т.е для всех оксидных пленок α лежит в интервале 2,5>α>1, т.е. они являются сплошными и обладают защитными свойствами.
Задача 4. С целью защиты от коррозии цинковое изделие покрыли оловом. Какое это покрытие: анодное или катодное? Напишите уравнение атмосферной коррозии данного изделия при нарушении целостности покрытия. Оценить коррозионную стойкость алюминия в серной кислоте, если убыль массы алюминиевой пластины размером 70х20х1 мм составила после 8 суток испытания 0,0348 г.
Какое это покрытие: анодное или катодное? Напишите уравнение атмосферной коррозии данного изделия при нарушении целостности покрытия. Оценить коррозионную стойкость алюминия в серной кислоте, если убыль массы алюминиевой пластины размером 70х20х1 мм составила после 8 суток испытания 0,0348 г.
Показать решение »
Решение.
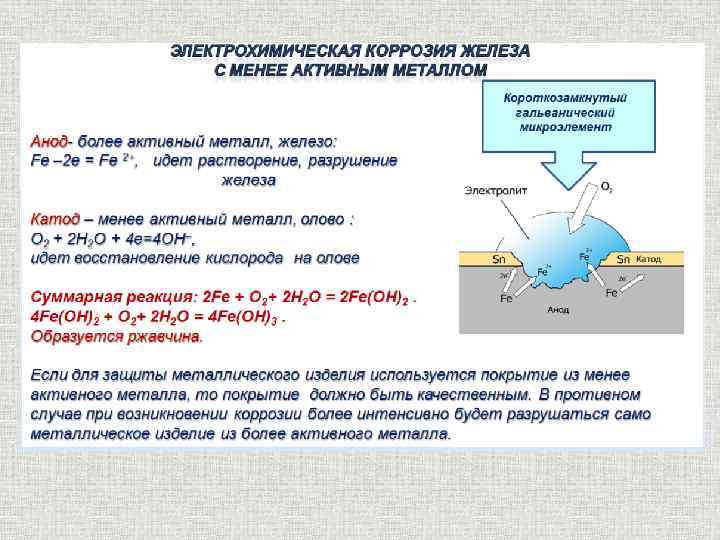
Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный), чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
В таблице электродных потенциалов найдем:
EZn2+/Zn = — 0,763 В
ESn2+/Sn = — 0,136 В
Олово будет выполнять роль катода и покрытие из него – катодное. При нарушении целостности покрытия, корродировать будет цинк, как более активный металл. При атмосферной коррозии протекают следующие уравнения реакций:
При нарушении целостности покрытия, корродировать будет цинк, как более активный металл. При атмосферной коррозии протекают следующие уравнения реакций:
К: O2 + 2H2O + 4e— = 4OH—
А: Zn — 2e—= Zn2+
2Zn + O2 + 2H2O = 2Zn2++ 4OH—
2Zn + O2 + 2H2O = 2Zn(OH)2
Оценить коррозионную стойкость алюминия в серной кислоте, если убыль массы алюминиевой пластины плотностью ρ = 2,7 г/см3, размером 70х20х1 мм составила после 8 суток испытания 0,0348 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(7·2) + 2·(7·0,1) + 2·(2·0,1) = 29,8 см2
h = 0,0348/(29,8·2,7) = 0,00043см = 0,0043 мм
Kн = 365·0,0043/8 = 0,02 мм/год
По десятибалльной шкале коррозионной стойкости металлов, алюминий соответствует 4 баллам и относится к стойким металлам.
Задача 5. Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. Чем это можно объяснить? Какой участок металла, находящийся под влиянием капли, является анодным, а какой катодным? Составьте электронные уравнения соответствующих процессов. Будет ли оксидная пленка, образующаяся на никеле, обладать защитными свойствами?
Показать решение »
Решение.
При нанесении на стальной предмет капли воды, наибольший доступ воздуха будет по краям капли, где протекает процесс восстановления кислорода. Т.е. края капли выступают в качестве катода. Для окисления железа остается центр капли, где доступ воздуха минимален. Здесь центр капли является анодом. В этом случае протекают следующие реакции:
А: Fe – 2e— = Fe2+
K: O2 + 2H2O + 4e— = 4OH—
2Fe + O2 + 2H2O = 2Fe2++ 4OH—
2Fe + O2 + 2H2O = 2Fe(OH)2
Будет ли оксидная пленка, образующаяся на никеле, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Мок = 59+16 = 75 г/моль
AMe = 59 г/моль
n = 1
ρМе = 8,9 г/см3
ρок = 6,7 г/см3
Подставим значения в формулу:
α = 75·8,9/(59·1·6,7) = 1,7
т.е α лежит в интервале 2,5>α>1, т.е. оксидная пленка является сплошной и обладает защитными свойствами.
Задача 7. Сплав содержит железо и никель. Какой из названных компонентов будет разрушаться при атмосферной коррозии? Приведите уравнение анодного и катодного процессов. Оценить коррозионную стойкость цинка на воздухе при высоких температурах. Образец цинка размером 50х30х1 мм после 180 часов окисления и снятия продуктов коррозии весил 10,6032 г.
Показать решение »
Решение.
Исходя из положения металлов в электрохимическом ряду напряжения металлов, находим, что железо более активный металл, чем никель:
EFe2+/Fe = — 0,440 В
ENi2+/Ni = — 0,250 В
Поэтому в первую очередь при атмосферной коррозии будет разрушаться железо. В этом случае протекают следующие реакции:
А: Fe – 2e— = Fe2+
K: O2 + 2H2O + 4e— = 4OH—
2Fe + O2 + 2H2O = 2Fe2++ 4OH—
2Fe + O2 + 2H2O = 2Fe(OH)2
Далее Fe(OH)2 переходит в Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = Fe(OH)3
Оценить коррозионную стойкость цинка на воздухе при высоких температурах. Образец цинка плотностью ρ = 7,14 г/см3, размером 50х30х1 мм после 180 часов окисления и снятия продуктов коррозии весил 10,6032 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(5·3) + 2·(5·0,1) + 2·(3·0,1) = 31,6 см2
Масса металла до коррозии равна:
m1 = V·ρ = 5·3·0,1·7,14 = 10,71г.
Убыль массы:
Δm = m1 – m2 = 10,71 — 10,6032 = 0,1068
h = 0,1068/(31,6·7,14) = 0,00047 см = 0,0047 мм
Kн = 365·0,0047/7,5 = 0,23 мм/год
По десятибалльной шкале коррозионной стойкости металлов, цинк соответствует 6 баллам и относится к пониженностойким металлам.
Задача 8. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в азотной кислоте. Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами?
Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами?
Показать решение »
Решение.
Техническое железо содержит примеси, которые, как правило, выполняют роль катода. Либо, если это углерод, который не передает в раствор положительно заряженных ионов и не имеет заградительного барьера от ионов водорода в кислой среде. Само железо будет служить анодом и подвергаться разрушению.
В химически чистом железе нет примесей, которые образовали бы гальванопару с железом, где бы оно окислялось.
При коррозии технического железа протекают следующие реакции:
Во влажном воздухе
А: Fe – 2e— = Fe2+
K: O2 + 2H2O + 4e— = 4OH—
2Fe + O2 + 2H2O = 2Fe2++ 4OH—
2Fe + O2 + 2H2O = 2Fe(OH)2
Далее Fe(OH)2 переходит в Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = Fe(OH)3
В азотной кислоте
А: Fe – 2e— = Fe2+
K: 2H+ + NO3— + e— = NO2 + H2O
Fe + 4H+ + 2NO3— = Fe2++ 2NO2 + 2H2O
Fe + 4HNO3 = Fe(NO3)2 + 2NO2 + 2H2O
Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Мы рассчитаем значение α по формуле:
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок)
Свинец может образовать оксиды состава PbO и PbO2, поэтому рассчитаем значение α для каждого случая
МPbO = 207+16 = 223 г/моль
МPbO2 = 207+16·2 = 239 г/моль
APb = 207 г/моль
n = 1
ρPb = 11,34 г/см3
ρPbO = 9,63 г/см3
ρPbO2 = 9,38 г/см3
α = VPbO/VPb = 223·11,34/(207·1·9,63) = 1,3
α = 1,3
α = VPbO2/VPb = 239·11,34/(207·1·9,38) = 1,4
α = 1,3
т.е для всех оксидных пленок α лежит в интервале 2,5>α>1, т.е. они являются сплошными и обладают защитными свойствами.
Задача 9. Приведите примеры двух металлов, пригодных для протекторной защиты никеля. Для обоих случаев напишите уравнение электрохимической коррозии в среде азотной кислоты. Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия плотностью ρ = 8,65 г/см3, размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Для обоих случаев напишите уравнение электрохимической коррозии в среде азотной кислоты. Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия плотностью ρ = 8,65 г/см3, размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Показать решение »
Решение.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Для протекторной защиты никеля подойдут, например, железо и цинк:
ENi2+/Ni = — 0,250 В
EFe2+/Fe = — 0,440 В
EZn2+/Zn = — 0,763 В
При электрохимической коррозии в среде азотной кислоты протекают следующие реакции:
Ni — Fe
А: Fe – 2e— = Fe2+
K: 2H+ + NO3— + e— = NO2 + H2O
Fe + 4H+ + 2NO3— = Fe2++ 2NO2 + 2H2O
Fe + 4HNO3 = Fe(NO3)2 + 2NO2 + 2H2O
Ni — Zn
А: Zn – 2e— =Zn+
K: 2H+ + NO3— + e— = NO2 + H2O
Zn + 4H+ + 2NO3— = Zn 2++ 2NO2 + 2H2O
Zn + 4HNO3 = Zn(NO3)2 + 2NO2 + 2H2O
Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия плотностью ρ = 8,65 г/см3, размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Образец кадмия плотностью ρ = 8,65 г/см3, размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(4,5·2,5) + 2·(4,5·0,1) + 2·(2,5·0,1) = 23,9 см2
Масса металла до начала коррозии равна:
m1 = V·ρ = 4,5·2,5·0,1·8,65 = 9,7313 г
Убыль массы:
Δm = m1 – m2 = 10,0031 – 9,7313 = 0,2718
h = 0,2718/(23,9·8,65) = 0,0013 см = 0,013 мм
Kн = 365·0,013·24/150 = 0,76 мм/год
По десятибалльной шкале коррозионной стойкости металлов, определяем, что в данных условиях, кадмий соответствует 7 баллам и относится к пониженностойким металлам.
Урок по теме “Коррозия”. 9-й класс
Цель: Дать понятия о коррозии металлов, классификации коррозионных процессов и способах защиты металлов от коррозии.
Задачи
Образовательные
- Изучить сущность химической и электрохимической коррозии металлов;
- Закрепить представления об окислительно-восстановительных реакциях;
- Научить использовать приобретённые знания для объяснения явлений окружающей среды;
- Научить грамотному использованию металлических изделий.
Развивающее
- Развить умения проведения химического эксперимента с соблюдением правил Техники безопасности;
- Развить умение проектирования химического
эксперимента с учётом его наглядности и
доказательства характера образующихся
продуктов реакции.

Воспитательные
- Логического и образного мышления;
Тип урока: Изучение нового материала.
Методы и приёмы
- Элементы проблемно-модульного обучения;
- Проектная деятельность;
Химический эксперимент
- Ученический демонстрационный эксперимент;
- Решение экспериментальных задач 1-4 типа;
- Лабораторные опыты.
Оборудование
- Таблицы “Коррозия металлов”;
- Оборудования для лабораторных опытов:
- пластинка для капельного анализа,
- гранулы Zn, проволока Cu, раствор HCl, растворы CuCl2, FeCl3, железная скрепка на медной проволочке, пробирка.
I. Вводное слово учителя
31 января 1951 г. обрушился железнодорожный мост в
Квебеке (Канада), введенный в эксплуатацию в 1947 г.
обрушился железнодорожный мост в
Квебеке (Канада), введенный в эксплуатацию в 1947 г.
В 1964 г. рухнуло одно из самых высотных сооружений в мире – 400-метровая антенная мачта в Гренландии.
Из-за повреждений нефтепроводов в реки и на грунт выливается нефть.
У металлов есть и враг, который приводит к огромным безвозвратным потерям металлов, ежегодно полностью разрушается около 10% производимого железа. По данным Института физической химии РАН, каждая шестая домна в России работает впустую – весь выплавляемый металл превращается в ржавчину. А как по другому называется этот процесс? – Коррозия.
II. Изучение нового материала
Итак, тема нашего урока: “Коррозия”
Слово коррозия происходит от латинского corrodere,
что означает разъедать. Хотя коррозию чаще всего
связывают с металлами, но ей подвергаются также
камни, пластмассы и другие полимерные материалы
и дерево. Например, в настоящее время мы являемся
свидетелями большого беспокойства широких слоев
людей в связи с тем, что от кислотных дождей
катастрофически страдают памятники (здания и
скульптуры), выполненные из известняка или
мрамора.
Хотя коррозию чаще всего
связывают с металлами, но ей подвергаются также
камни, пластмассы и другие полимерные материалы
и дерево. Например, в настоящее время мы являемся
свидетелями большого беспокойства широких слоев
людей в связи с тем, что от кислотных дождей
катастрофически страдают памятники (здания и
скульптуры), выполненные из известняка или
мрамора.
Таким образом, коррозией называют самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды.
Ржавлением называют только коррозию железа и его сплавов. Другие металлы корродируют, но не ржавеют. Хотя корродируют практически все металлы, в повседневной жизни человек чаще всего сталкивается с коррозией железа.
В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3
В природе, хотя и очень редко, но встречается
самородное железо. Его происхождение считают
метеоритным, т.е. космическим, а не земным.
Поэтому первые изделия из железа (они
изготавливались из самородков) ценились очень
высоко – гораздо выше, чем из серебра и даже
золота.
Его происхождение считают
метеоритным, т.е. космическим, а не земным.
Поэтому первые изделия из железа (они
изготавливались из самородков) ценились очень
высоко – гораздо выше, чем из серебра и даже
золота.
Химическая (или газовая) коррозия – это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды.
Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах. Ей подвергаются арматура печей, детали двигателей внутреннего сгорания, аппаратура химических производств и т.д. При химической коррозии происходит взаимодействие металла с газами, находящимися в составе среды. Чаще всего это кислород. Металл окисляется, и на его поверхности образуются различные соединения:
4Fe0 + 3O2 —> 2Fe+32O3
2Fe0 + 3O2 + 3SO2 —> Fe2+3(SO4)3
2Zn0 + O2 —> 2Zn+2O
Большинство металлов окисляется кислородом
воздуха, образуя на поверхности оксидные пленки,
Если эта пленка прочная, плотная, хорошо связана
с металлом, то она защищает металл от дальнейшего
разрушения.
Однако наибольший вред приносит электрохимическая коррозия.
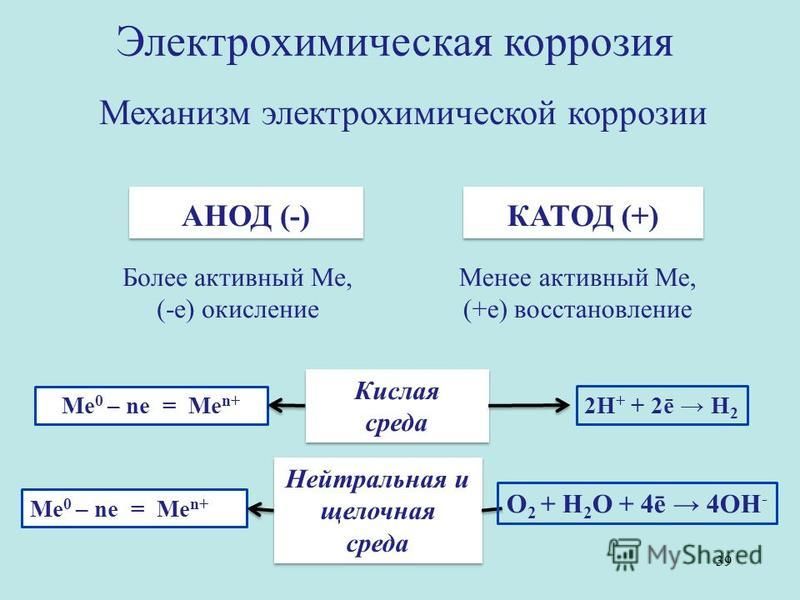
Электрохимическая коррозия – это разрушение металлов в среде электролита с возникновением в системе электрического тока.
Как правило, металлы и сплавы неоднородны, содержат различные примеси. При их контакте с электролитами одни участки поверхности начинают выполнять роль анода, а другие роль катода. В этом случае образуется гальванический элемент, электродами которого и являются металлы, находящиеся в растворе электролита. Возникает электрохимический процесс, т.е. наряду с химическими процессами (отдача электронов), протекают и электрические (перенос электронов от одного участка к другому).
Электрохимическая коррозия протекает в
присутствии влаги. Ей подвергаются подводные
части судов в морской и пресной воде, паровые
котлы, металлические сооружения и конструкции
под водой и в атмосфере.
Ей подвергаются подводные
части судов в морской и пресной воде, паровые
котлы, металлические сооружения и конструкции
под водой и в атмосфере.
Проблемная ситуация: Колосс Родосский и затонувшая яхта миллионера.
В III до нашей эры на острове Родос был построен маяк в виде огромной статуи Гелиоса. Колосс Родосский считался одним из семи чудес света, однако просуществовал всего 66 лет и рухнул во время землетрясения.
В 20 годы ХХ в. один из американских миллионеров,
не жалея денег, решил построить самую шикарную
яхту. Ее днище было обшито дорогим металлом
(сплав 70% никеля и 30% меди), а киль и раму руля
изготовили из стали. В морской воде в подводной
части яхты образовался гальванический элемент с
катодом из металла, а анодом из стали. Он
настолько энергично работал, что яхта еще до
завершения отделочных работ вышла из строя, ни
разу не побывав в море. Ученые считают, что в
обоих случаях причиной произошедших событий
были окислительно-восстановительные процессы.
Ответ: Причиной была контактная коррозия. У Колосса Родосского бронзовая оболочка была смонтирована на железном каркасе. Под действием влажного, насыщенного солями средиземноморского воздуха железный каркас разрушился.
Днище яхты было обшито медно-никелевым сплавом, а рама руля, киль и другие детали изготовлены из стали. Когда яхта была спущена на воду. Возник гигантский гальванический элемент, состоящий из катода- днища, стального анода и электролита – морской воды. В результате судно затонуло, ни сделав ни одного рейса.
При возникновении гальванической пары сила
возникающего электрического тока тем больше, чем
дальше стоят металлы друг от друга в ряду
напряжений. При этом поток электронов от более
активного металла идет к менее активному
металлу. Более активный металл (железо),
расположенный в ряду напряжений левее, будет
разрушаться (т.к. является анодом), предохраняя
тем самым менее активный металл от коррозии
(медь).
Коррозионные процессы весьма разнообразны, рассмотрим их протекание в различных средах электролита.
В кислотной среде атомы железа отдают электроны, которые переходят к меди и на ее поверхности соединяются с ионами водорода, выделившимися из компонентов среды. На катоде идет процесс восстановления ионов водорода с образованием газообразного водорода.
В щелочной или нейтральной среде идет восстановление кислорода, растворенного в воде с образованием OH–. Далее катионы железа и гидроксид-ионы соединяются с образованием неустойчивого гидроксида железа (II), который далее окисляется до оксида железа (III).
При использовании металлических материалов очень важен вопрос о скорости их коррозии. От чего зависит скорость коррозии?
Перед вами 5 пронумерованных стаканов.
- В 1-м стакане железный гвоздь находится в воде.

- В 3-м стакане к железному гвоздю прикрепили медную проволоку и они находятся в растворе хлорида натрия.
- В 4-м стакане железный гвоздь находится в контакте с цинком, и они помещены в раствор хлорида натрия.
- В 5-м стакане железный гвоздь находится в растворах хлорида и гидроксида натрия.
Давайте сравним полученные результаты и объясним результаты эксперимента (демонстрация приготовленного за несколько дней опыта по коррозии).
Проблема: Почему в одних случаях коррозия усиливается, а в других замедляется? Объясните процессы, происходящие в каждом стакане.
Объяснения учеников:
- В стакане №1 – железо прокорродировало слабо, в
чистой воде коррозия идет медленно. Мы наблюдаем
химическую коррозию.
- В стакане №2 – идет химическая коррозия, но здесь скорость коррозии выше, чем в 1-ом стакане, следовательно, хлорид натрия – увеличивает скорость коррозии.
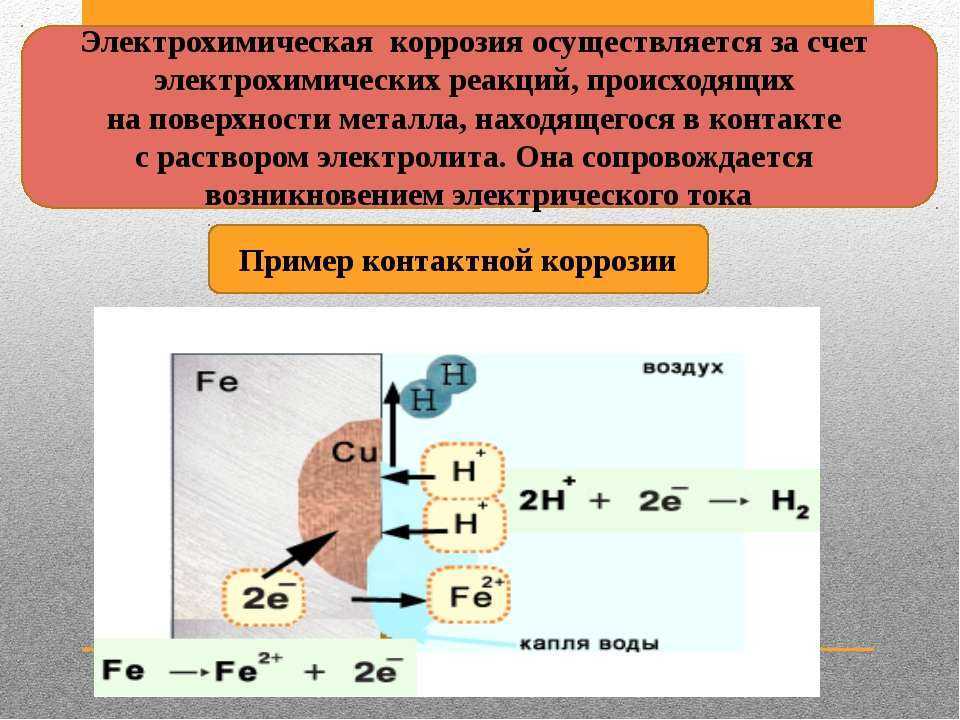
- В стакане №3– мы наблюдаем электрохимическую коррозию (железо находится в контакте с медью). Скорость коррозии высока, т.к. раствор хлорида натрия – сильный электролит.
Суммарное уравнение: Fe0 + 2H+ > Fe2+ + H2 0
- В стакане №4– также идет коррозия, но не железа, а цинка, т.к. железо менее активный металл является катодом, а цинк анодом:
- В стакане №5 – железо практически не подвергается коррозии, следовательно, гидроксид натрия – замедляет коррозию, гидроксид-ионы являются ингибиторами, т.е. замедляют коррозию.
Вывод: Катионы водорода и растворенный в воде
кислород – важнейшие окислители, вызывающие
электрохимическую коррозию. Скорость коррозии
тем больше, чем сильнее отличаются металлы по
своей активности (т.е. чем дальше друг от друга
они расположены в ряду напряжений металлов).
Скорость коррозии
тем больше, чем сильнее отличаются металлы по
своей активности (т.е. чем дальше друг от друга
они расположены в ряду напряжений металлов).
Способы защиты от коррозии.
Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и, прежде всего, легкоплавким оловом (лужением). В трудах древнегреческого историка Геродота (V в. до н.э.) уже имеется упоминание о применении олова для защиты железа от коррозии.
Задачей химиков было и остается выяснение
сущности явлений коррозии, разработка мер,
препятствующих или замедляющих ее протекание.
Коррозия металлов осуществляется в соответствии
с законами природы и потому ее нельзя полностью
устранить, а можно лишь замедлить. Одним из
наиболее распространенных способов защиты
металлов от коррозии является нанесение на их
поверхность защитных пленок: лака, краски, эмали.
Ребята, а что является символом Парижа? – Эйфелева башня. Она неизлечимо больна, ржавеет и разрушается, и только постоянная “терапия” помогает бороться с этим смертельным недугом: Её красили 18 раз, отчего её масса 9000 т каждый раз увеличивается на 70 т.
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой: например 3CrCl2 + 2Fe – [1000°C] —> 2FeCl3 + 3Cr
Металлические покрытия делят на две группы:
коррозионностойкие и протекторные. Например, для
покрытия сплавов на основе железа в первую
группу входят никель, серебро, медь, свинец, хром.
В электрохимическом ряду напряжений металлов
они стоят правее железа. Во вторую группу входят
цинк, кадмий, алюминий. По отношению к железу они
более электроотрицательны, т.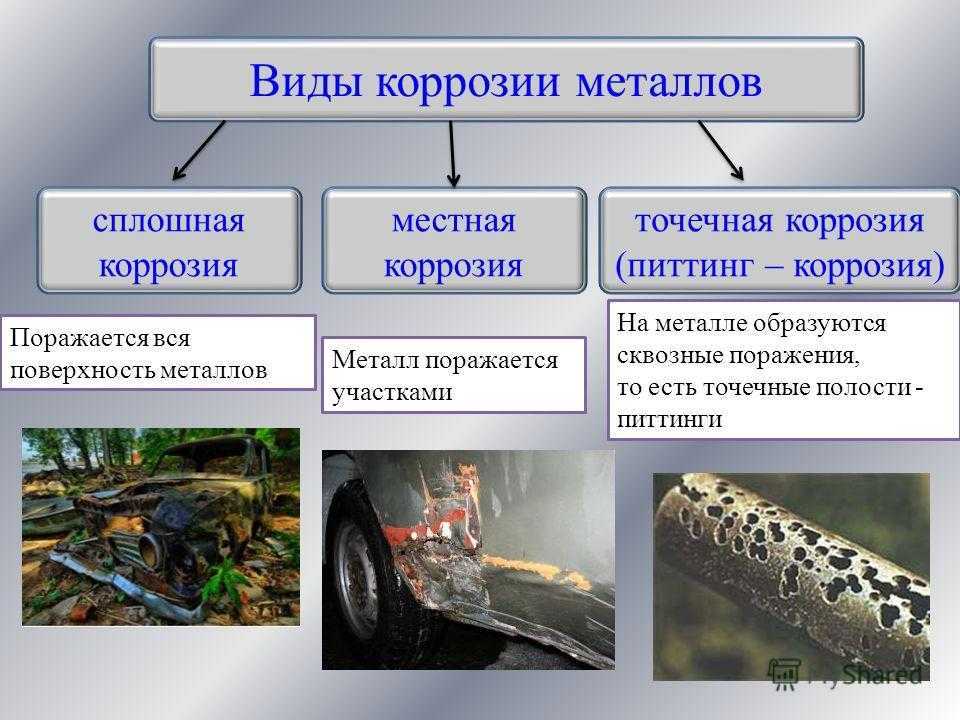 е. в ряду напряжений
находятся левее железа.
е. в ряду напряжений
находятся левее железа.
В повседневной жизни человек чаще всего встречается с покрытиями железа цинком и оловом. Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое оловом – белой жестью. Первое в больших количествах идет на кровли домов, а из второго изготавливают консервные банки. И то и другое получают главным образом протягиванием листа железа через расплав соответствующего металла. Для большей стойкости водопроводные трубы и арматуру из стали и серого чугуна часто подвергают оцинковыванию также окунанием в расплав данного металла. Это резко повышает срок их службы в холодной воде. Интересно, что в теплой и горячей воде срок службы оцинкованных труб может быть даже меньше, чем неоцинкованных.
Пассивация металлов.
Вероятно, многие обратили внимание на то, что
серную и азотную кислоты перевозят по железной
дороге в стальных цистернах. Об этом
свидетельствуют надписи, например “Осторожно,
серная кислота”. Как это согласуется с теми
знаниями, которые отражены в школьных учебниках?
Все дело в том, что по железной дороге перевозят
не разбавленные, а концентрированные кислоты.
Зачем же перевозить воду? Разбавить кислоту
можно и на месте потребления.
Об этом
свидетельствуют надписи, например “Осторожно,
серная кислота”. Как это согласуется с теми
знаниями, которые отражены в школьных учебниках?
Все дело в том, что по железной дороге перевозят
не разбавленные, а концентрированные кислоты.
Зачем же перевозить воду? Разбавить кислоту
можно и на месте потребления.
Оказывается, что в отличие от разбавленных
концентрированная серная, так же как и
концентрированная азотная кислоты, не
взаимодействует с железом. Правильнее сказать,
что кратковременное взаимодействие происходит,
но оно быстро прекращается. Специалисты говорят,
что в крепких растворах этих кислот железо
пассивируется. Еще в 1836 г. знаменитый
английский химик М. Фарадей высказал
предположение, что причиной пассивации является
образование на поверхности металла плотной
оксидной пленки. В свое время на это
предположение не обратили должного внимания.
Лишь через 100 лет эти взгляды возродил и развил
известный русский ученый В. А. Кистяковский.
После него этот взгляд на пассивацию оформился в
виде теории. Согласно ей при пассивации на
поверхности металла образуется сплошная и
плотная оксидная (реже хлоридная, сульфатная,
фосфатная) пленка толщиной в несколько десятков
нанометров.
А. Кистяковский.
После него этот взгляд на пассивацию оформился в
виде теории. Согласно ей при пассивации на
поверхности металла образуется сплошная и
плотная оксидная (реже хлоридная, сульфатная,
фосфатная) пленка толщиной в несколько десятков
нанометров.
Ингибиторы коррозии металлов.
Применение ингибиторов – один из
эффективных способов борьбы с коррозией
металлов в различных агрессивных средах (в
атмосферных, в морской воде, в охлаждающих
жидкостях и солевых растворах, в окислительных
условиях и т.д.). Ингибиторы – это вещества,
способные в малых количествах замедлять
протекание химических процессов или
останавливать их. Название ингибитор происходит
от лат. inhibere, что означает сдерживать,
останавливать. Известно, что дамасские мастера
для снятия окалины и ржавчины пользовались
растворами серной кислоты с добавками пивных
дрожжей, муки, крахмала. Эти примеси были одними
из первых ингибиторов. Они не позволяли кислоте
действовать на оружейный металл, в результате
чего растворялись лишь окалина и ржавчина.
Эти примеси были одними
из первых ингибиторов. Они не позволяли кислоте
действовать на оружейный металл, в результате
чего растворялись лишь окалина и ржавчина.
Для предупреждения коррозии и защиты от нее применяются разнообразные методы.
- Шлифование поверхностей изделия – чтобы на них не задерживалась влага.
- Приготовление химически стойких сплавов (сплавы, содержащие хром, никель, которые при высокой температуре на поверхности металла образуют оксидный слой), нержавеющие стали, из которых изготавливают детали машин, инструменты, посуду (ножи, вилки…).
- Нанесение защитных покрытий.
- Неметаллические – неокисляющиеся масла,
специальные лаки, краски, эмали.
Ребята, а что является символом Парижа? – Эйфелева башня. Она неизлечимо больна, ржавеет и разрушается, и только постоянная “терапия” помогает бороться с этим смертельным недугом: Её красили 18 раз, отчего её масса 9000 т каждый раз увеличивается на 70 т.
- Химические – искусственно создаваемые поверхностные пленки: оксидные, нитратные, фосфатные, полимерные и другие. Например, железо пассивируют погружением в концентрированную азотную кислоту.
- Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол. Наносят их двумя способами: нагретое изделие помещают в порошок полимера, который плавится и приваривается к металлу, или поверхность металла обрабатывают раствором полимера в низкокипящем растворителе, который быстро испаряется, а полимерная пленка остается на изделии.
- Неметаллические – неокисляющиеся масла,
специальные лаки, краски, эмали.
- Металлические.
- Электрохимические методы
- Протекторная (анодная) – к защищаемой
металлической конструкции, присоединяют кусок
более активного металла (протектор), который
служит анодом и разрушается в присутствии
электролита, В качестве протектора при защите
корпусов судов, трубопроводов, кабелей и других
металлических изделий используют магний,
алюминий, цинк.

- Катодная – металлоконструкцию подсоединяют к катоду внешнего источника тока. Происходит электрозащита – нейтрализация тока, возникающего при коррозии, постоянным током, пропускаемым в противоположном направлении.
- Подавление влияния коррозионной среды.
- Введение веществ – ингибиторов, замедляющих коррозию (нитрит натрия, хромат и дихромат калия, фосфаты натрия и другие). Защитное действие этих веществ обусловлено тем, что они адсорбируются на поверхности металла и каталитически снижают скорость коррозии, а некоторые из них (хроматы и дихроматы) переводят металл в пассивное состояние.
- Удаление растворенного в воде кислорода (деаэрация).
Таким образом, металлы и сплавы можно
защищать от коррозии двумя способами: изоляцией
поверхности металла от среды и искусственным
повышением коррозионной стойкости путем
замедления процессов коррозии.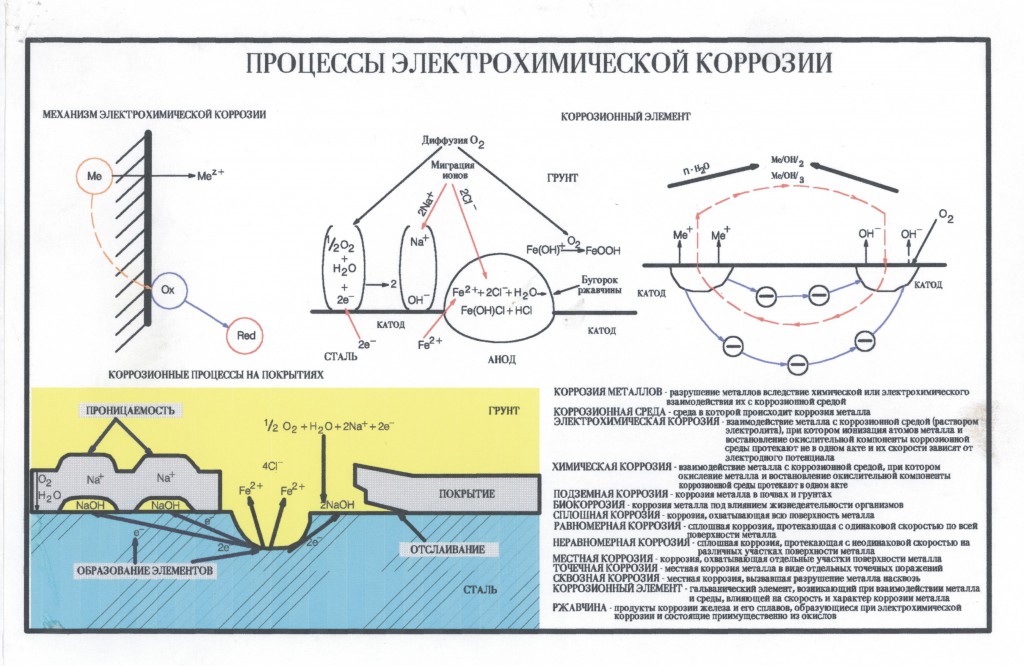
Закрепление (фронтальное обсуждение)
- Требуется скрепить железные детали. Какими заклепками следует пользоваться медными или цинковыми, чтобы замедлить коррозию железа? Ответ обоснуйте.
- Как называются вещества, замедляющие коррозию?
- Введение каких элементов в сталь повышает ее коррозионную стойкость?
- К стальному днищу машины была предложена протекторная защита. Какой металл для этого лучше применить: Zn, Cu или Ni?
- Почему многие детали быстрее корродируют вблизи предприятий?
- Лист железа, покрытый цинком, и лист железа, покрытый оловом, процарапали до железа. Будет ли подвергаться коррозии железо в обоих случаях?
РЕФЛЕКСИЯ
Чтобы предотвратить глобальные катастрофы на
судах, фабриках и заводах, нужно упорно изучать
методы защиты от этой проблемы. И в то же время
необходимо найти применение коррозии металлов.
Одним из направлений может быть ее применение
для разрушения конструкций в труднодоступных
местах. Разрушение металлов и сплавов можно
применить как один из способов борьбы с
космическим мусором. Если бы железо, подобно
серебру и золоту, не ржавело, то мы не
существовали бы, и ни одно растение не зеленело
бы на Земле. Растворённая в воде его ржавчина
составляет часть пищи растений и придаёт
им зеленый цвет. Та же “ржавчина” снабжает
железом нашу кровь и придаёт ей красный цвет.
И в то же время
необходимо найти применение коррозии металлов.
Одним из направлений может быть ее применение
для разрушения конструкций в труднодоступных
местах. Разрушение металлов и сплавов можно
применить как один из способов борьбы с
космическим мусором. Если бы железо, подобно
серебру и золоту, не ржавело, то мы не
существовали бы, и ни одно растение не зеленело
бы на Земле. Растворённая в воде его ржавчина
составляет часть пищи растений и придаёт
им зеленый цвет. Та же “ржавчина” снабжает
железом нашу кровь и придаёт ей красный цвет.
20.8: Коррозия — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21797
Цели обучения
- Понять процесс коррозии.
Коррозия — это гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. Например, на воздухе железо ржавеет, серебро тускнеет, а медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной. Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Коррозия – это окислительно-восстановительный процесс.
В условиях окружающей среды окисление большинства металлов термодинамически самопроизвольно, за заметным исключением золота и платины. Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение. Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
В отличие от этих металлов, железо при коррозии образует красно-коричневый гидратированный оксид металла (\(\ce{Fe2O3 \cdot xh3O}\)), широко известный как ржавчина, который не образует плотной защитной пленки (рис. \(\PageIndex{1}\)). Вместо этого ржавчина постоянно отслаивается, обнажая свежую металлическую поверхность, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
\(\PageIndex{1}\)). Вместо этого ржавчина постоянно отслаивается, обнажая свежую металлическую поверхность, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
 Ржавчина (Fe 9o_{cell}\) для процесса коррозии (уравнение \(\ref{Eq3}\)) указывают на то, что существует сильная движущая сила для окисления железа O 2 в стандартных условиях (1 M H + ) . В нейтральных условиях движущая сила несколько меньше, но все же заметна (Е = 1,25 В при рН 7,0). Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотные дожди. Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис.
Ржавчина (Fe 9o_{cell}\) для процесса коррозии (уравнение \(\ref{Eq3}\)) указывают на то, что существует сильная движущая сила для окисления железа O 2 в стандартных условиях (1 M H + ) . В нейтральных условиях движущая сила несколько меньше, но все же заметна (Е = 1,25 В при рН 7,0). Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотные дожди. Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)). Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.
\(\PageIndex{ 2}\)). Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.Профилактическая защита
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется. Например, смесители и некоторые внешние детали автомобилей часто покрывают тонким слоем хрома с помощью электролитического процесса. Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле состоят из стального контейнера, покрытого тонким слоем олова. Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
Например, смесители и некоторые внешние детали автомобилей часто покрывают тонким слоем хрома с помощью электролитического процесса. Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле состоят из стального контейнера, покрытого тонким слоем олова. Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
 Гальваническая коррозия, вероятно, возникает всякий раз, когда два разнородных металла соединяются напрямую, позволяя электронам передаваться от одного к другому. 9{2+}}\) (E° = -0,14 В) и Fe 2 + (E° = -0,45 В) в таблице P2 показывают, что \(\ce{Fe}\) легче окисляется, чем \(\ce{Sn}\). В результате более устойчивый к коррозии металл (в данном случае олово) ускоряет коррозию железа, действуя как катод и обеспечивая большую площадь поверхности для восстановления кислорода (рис. \(\PageIndex{3}\)) . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]
Гальваническая коррозия, вероятно, возникает всякий раз, когда два разнородных металла соединяются напрямую, позволяя электронам передаваться от одного к другому. 9{2+}}\) (E° = -0,14 В) и Fe 2 + (E° = -0,45 В) в таблице P2 показывают, что \(\ce{Fe}\) легче окисляется, чем \(\ce{Sn}\). В результате более устойчивый к коррозии металл (в данном случае олово) ускоряет коррозию железа, действуя как катод и обеспечивая большую площадь поверхности для восстановления кислорода (рис. \(\PageIndex{3}\)) . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \] Более активный металл реагирует с кислородом и в конечном итоге растворяется, «жертвуя» себя, чтобы защитить железный предмет. Катодная защита – это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
Катодная защита – это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
В аналогичной стратегии расходуемые электроды с использованием магния, например, используются для защиты подземных резервуаров или труб (Рисунок \(\PageIndex{4}\)). Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Рисунок \(\PageIndex{4}\): Использование жертвенного электрода для защиты от коррозии. Присоединение магниевого стержня к подземному стальному трубопроводу защищает трубопровод от коррозии. Поскольку магний (E ° = -2,37 В) окисляется гораздо легче, чем железо (E ° = -0,45 В), стержень Mg действует как анод в гальваническом элементе.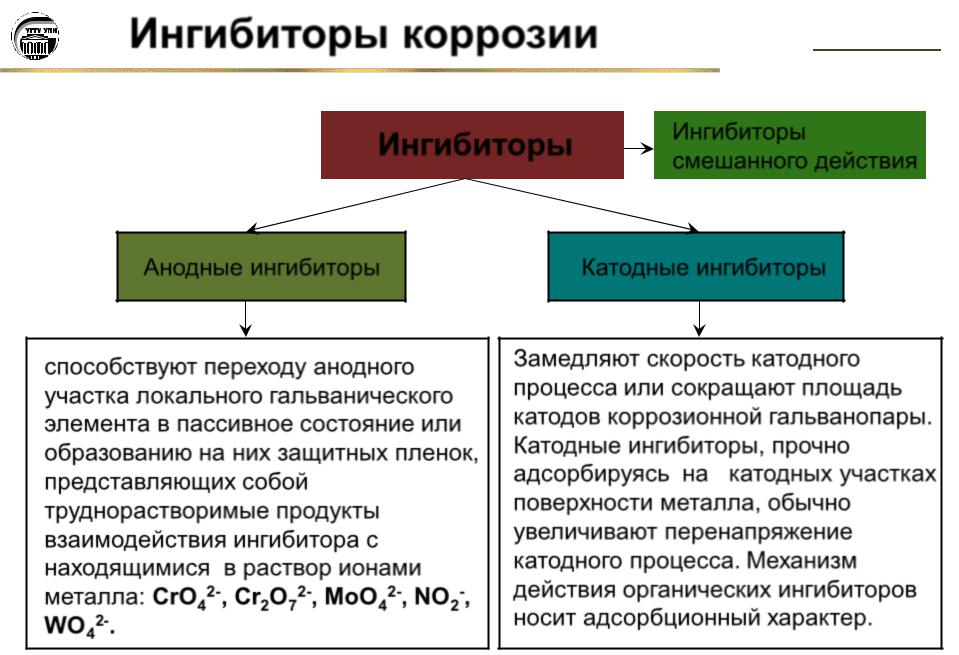 Таким образом, трубопровод вынужден действовать как катод, на котором восстанавливается кислород. Почва между анодом и катодом действует как солевой мост, который замыкает электрическую цепь и поддерживает электрическую нейтральность. Поскольку Mg(s) окисляется до Mg 2 + на аноде, анионы в почве, такие как нитраты, диффундируют к аноду, чтобы нейтрализовать положительный заряд. Одновременно катионы в почве, такие как H + или NH 4 + , диффундируют к катоду, где они восполняют протоны, потребляемые при восстановлении кислорода. Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Таким образом, трубопровод вынужден действовать как катод, на котором восстанавливается кислород. Почва между анодом и катодом действует как солевой мост, который замыкает электрическую цепь и поддерживает электрическую нейтральность. Поскольку Mg(s) окисляется до Mg 2 + на аноде, анионы в почве, такие как нитраты, диффундируют к аноду, чтобы нейтрализовать положительный заряд. Одновременно катионы в почве, такие как H + или NH 4 + , диффундируют к катоду, где они восполняют протоны, потребляемые при восстановлении кислорода. Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.Пример \(\PageIndex{1}\)
Предположим, старый деревянный парусник, скрепленный железными винтами, имеет бронзовый гребной винт (напомним, что бронза — это сплав меди, содержащий около 7–10 % олова). 9\circ_{\textrm{overall}} =\textrm{1,68 В}
\end{align*} \nonumber \]
Со временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии, в порядке снижения затрат и неудобств, следующие: разборка лодки и ее сборка с помощью бронзовых винтов; снятие лодки с воды и хранение ее в сухом месте; или прикрепление недорогого куска металлического цинка к гребному валу в качестве жертвенного электрода и замена его один или два раза в год. Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение \(\ref{Eq7}\)).
Упражнение \(\PageIndex{1}\)
Предположим, что водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме – из железа. Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Что еще нужно сделать сантехнику в вашем доме?
- Ответить на
Нет, если только вы не планируете продать дом в ближайшее время, потому что соединения труб \(\ce{Cu/Fe}\) приведут к быстрой коррозии.
- Ответ б
Любые существующие соединения \(\ce{Pb/Fe}\) должны быть тщательно проверены на наличие коррозии железных труб из-за соединения \(\ce{Pb–Fe}\); менее активный \(\ce{Pb}\) будет служить катодом для восстановления \(\ce{O2}\), способствуя окислению более активного \(\ce{Fe}\) поблизости.
Резюме
Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты. Ухудшение металлов в результате окисления представляет собой гальванический процесс, называемый коррозией. Защитные покрытия состоят из второго металла, который труднее окисляется, чем защищаемый металл. В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
Защитные покрытия состоят из второго металла, который труднее окисляется, чем защищаемый металл. В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
20.8: Коррозия распространяется под лицензией CC BY-NC-SA 3.0 и была создана, изменена и/или курирована LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- коррозия
- Профилактическая защита
- протекторный анод
- жертвенный электрод
Введение в коррозию и процесс
Что такое коррозия?
Коррозия – это разрушение материалов в результате химического взаимодействия с окружающей средой.
Большинство металлов подвержены коррозии при контакте с водой (и влагой в воздухе), кислотами, основаниями, солями, маслами, агрессивными полиролями для металлов и другими твердыми и жидкими химическими веществами. Металлы также подвергаются коррозии при воздействии газообразных материалов, таких как пары кислот, формальдегид газ, газообразный аммиак и серосодержащие газы.
Термин «коррозия» иногда также применяется к разложению пластмасс, бетона и дерева, но обычно относится к металлам.
Как возникает коррозия?
Коррозия представляет собой электрохимическую реакцию. Для реакции необходимы четыре условия:
- Анод
- Катод А
- Электронный путь
- Электролит (ионный путь)
Электрохимия коррозии
Процесс коррозии (анодная реакция) металла, растворяющегося в виде ионов, генерирует некоторое количество электронов, как показано здесь, которые потребляются вторичным процессом (катодная реакция).
Эти два процесса должны сбалансировать свои расходы.
Участки, в которых происходят эти два процесса, могут быть расположены близко друг к другу на поверхности металла или далеко друг от друга в зависимости от обстоятельств.
Электроны (e- на этом рисунке), образующиеся в результате реакции коррозии, должны быть поглощены катодной реакцией в непосредственной близости от самой реакции коррозии.
Железо в деаэрированном нейтральном растворе
Анодная реакция
- площадь поверхности = 1 см2
- Fe -> Fe2+ + 2 e-
- E0 = -0,44 В по сравнению с SHE
- для корродирующего металла можно принять, что Eeq = E0 · i0 = 10-6 А см-2
- I0 = 1×10-6 А
- ба = 0,120 В декада-1
Катодная реакция
- площадь поверхности = 1 см2
- [Н+] = 10-5 (pH = 5)
- 2 Н+ + 2 е- –> h3
- Eeq = E0 + 0,059 log10 [H+] = 0,0 – 0,059x(-5) = -0,295 В по сравнению с SHE
- i0 = 10-6 А см-2
- I0 = 1×10-6 А
- bc = -0,120 В декада-1
Последовательность коррозии (питтинг)
Типы коррозии
Типы коррозии делятся на три основные группы. Группа 1 – это те, которые легко идентифицировать при обычном визуальном осмотре. Группа 2 — это особые состояния, при которых могут потребоваться дополнительные средства обследования. Наконец, группа 3 подвергается проверке и обычно требуется микроскопией (оптической, электронной микроскопией и т. д.). Это также выделяет атмосферную коррозию и высокотемпературную коррозию.
Группа 1 – это те, которые легко идентифицировать при обычном визуальном осмотре. Группа 2 — это особые состояния, при которых могут потребоваться дополнительные средства обследования. Наконец, группа 3 подвергается проверке и обычно требуется микроскопией (оптической, электронной микроскопией и т. д.). Это также выделяет атмосферную коррозию и высокотемпературную коррозию.
Группа 1 — это типы коррозии, легко идентифицируемые при обычном визуальном осмотре. Сюда входят равномерная коррозия, точечная коррозия, щелевая коррозия (под которой подразумеваются: щелевая модель, нитевидная коррозия и пакетная ржавчина), гальваническая коррозия, пластинчатая коррозия.
Для типов группы 2 обычно могут потребоваться дополнительные средства проверки. Эрозионная коррозия, кавитация, фреттинг-коррозия, межкристаллитная коррозия, расслоение и расслаивание (выборочное выщелачивание или селективная атака) определяют глубину определенной коррозии в этой категории.
Группа 3 — это место, где коррозия проверяется и обычно требуется с помощью микроскопии (оптической, электронной микроскопии и т. д.). Определенные типы могут относиться к растрескиванию под воздействием окружающей среды, коррозионному растрескиванию под напряжением (SCC), коррозионной усталости и водородному охрупчиванию.
Равномерная коррозия
Этот тип коррозии происходит на большей части поверхности металла с постоянной и часто предсказуемой скоростью. Как наиболее распространенная форма коррозии, она обычно характеризуется химической или электрохимической реакцией, которая протекает равномерно по всей открытой поверхности или на большой площади.
Точечная коррозия
Точечная коррозия возникает в материалах, имеющих защитную пленку, например, в продуктах коррозии, или при разрушении покрытия. Это локальная форма коррозии, при которой в материале образуются полости или «отверстия».
Желобовые ямы
Боковые ямы
Щелевая коррозия
Щелевая коррозия представляет собой локальную форму коррозии, обычно застойное решение на уровне микросреды.
Щелевая коррозия инициируется изменениями местного химического состава в щели:
- Истощение ингибитора в щели
- Истощение кислорода в расщелине
- Переход к кислотным условиям в расщелине
- Накопление агрессивных ионов (например, хлорида) в щели
Нитевидная коррозия
Особая форма щелевой коррозии, при которой накопление агрессивных химических веществ происходит под прорванной защитной пленкой.
Обычно начинается с небольших, иногда микроскопических дефектов покрытия. Наиболее подвержены этой проблеме лаки и «быстросохнущие» краски. Их использования следует избегать, если отсутствие неблагоприятного воздействия не доказано полевым опытом. Там, где требуется покрытие, оно должно обладать низкими характеристиками паропроницаемости и отличной адгезией. Покрытия с высоким содержанием цинка также следует рассматривать для покрытия углеродистой стали из-за их качества катодной защиты.
Пакетная ржавчина
Пакетная ржавчина представляет собой форму локализованной коррозии, типичную для стальных компонентов, которая образует трещину в открытой атмосферной среде. Это выражение часто используется при осмотре мостов для описания сборных элементов стальных мостов, на которых видны следы ржавчины между стальными пластинами.
Это выражение часто используется при осмотре мостов для описания сборных элементов стальных мостов, на которых видны следы ржавчины между стальными пластинами.
Гальваническая коррозия
Это происходит, когда два разных металла соприкасаются друг с другом, и вызвано большей готовностью одного из них отдавать электроны, чем другим.
Это одна из наиболее распространенных форм коррозии, а также одна из самых разрушительных. Вот классический пример гальванической коррозии; винт из нержавеющей стали, контактирующий с шайбой из стали, покрытой кадмием.
Чемодан со статуей Свободы
Первоначально гальваническая реакция между железом и медью была смягчена путем изоляции меди от железного каркаса с помощью асбестовой ткани, пропитанной шеллаком. Однако целостность и герметизирующие свойства этого импровизированного изолятора нарушились в течение многих лет воздействия высоких уровней влажности, обычных для морской среды.
Пластинчатая коррозия или расслоение
Расслаивающая коррозия представляет собой особую форму межкристаллитной коррозии, связанную с высокопрочными алюминиевыми сплавами. Сплавы, подвергшиеся экструдированию или другой интенсивной обработке, с микроструктурой удлиненных, сплющенных зерен, особенно подвержены этому повреждению.
В сплавах черных металлов расслоение характеризуется чрезмерным внутренним ростом оксида, объем которого примерно в семь раз превышает объем стали. Чрезмерный внутренний рост оксида может повысить температуру, а отслоившийся материал может повредить турбины. Расслоение происходит в ферритных материалах, когда происходит многослойный рост.
Напряжения вызваны температурными циклами и разницей теплового расширения шкалы и трубки. Расслоение также может происходить в аустенитных нержавеющих сталях, опять же из-за разницы в тепловом расширении между металлом и оксидом.
Эрозионная коррозия
Эрозионная коррозия – это ускорение скорости коррозионного воздействия на металл из-за относительного движения агрессивной жидкости и поверхности металла.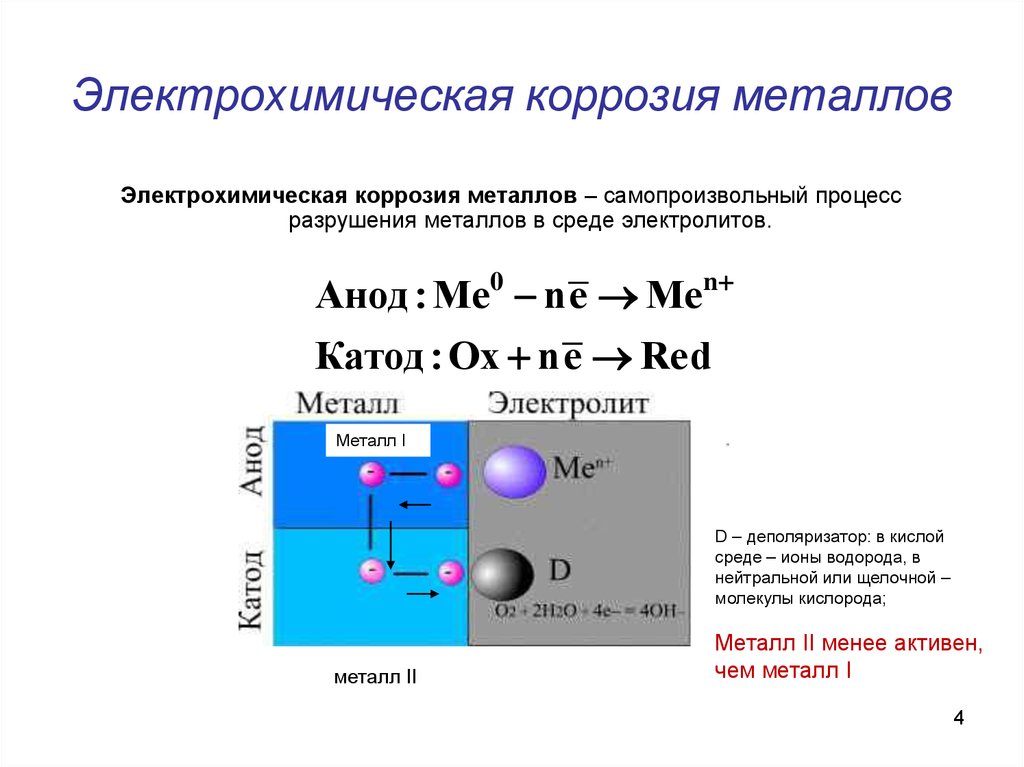
Повышенная турбулентность, вызванная изъязвлением внутренней поверхности трубы, может привести к быстрому увеличению скорости эрозии и, в конечном итоге, к утечке.
Эрозионная коррозия также может усугубляться некачественной работой.
Кавитационная эрозия
Кавитация возникает, когда рабочее давление жидкости падает ниже давления пара, вызывая образование и разрушение газовых карманов и пузырьков.
Эта форма коррозии разъедает улитки и рабочие колеса центробежных насосов сверхчистой воды, поскольку жидкость разъедает седла клапанов.
Он будет способствовать другим формам эрозионной коррозии, например, в отводах и тройниках.
Фреттинг-коррозия
Фреттинг-коррозия относится к коррозионным повреждениям на неровностях контактных поверхностей.
Это повреждение возникает под нагрузкой и при наличии повторяющихся относительных движений поверхности, например, вызванных вибрацией.
Ямы или канавки и оксидные частицы характеризуют это повреждение, обычно встречающееся в машинах, болтовых соединениях и шариковых или роликовых подшипниках.
Межкристаллитная коррозия
Межкристаллитная коррозия представляет собой локализованное воздействие вдоль границ зерен или непосредственно рядом с границами зерен, в то время как основная масса зерен остается практически незатронутой.
Делегирование (выборочное выщелачивание) Избранное воздействие
Это происходит в таких сплавах, как латунь, когда один компонент или фаза более восприимчивы к коррозии, чем другие, и корродирует преимущественно, оставляя пористый материал, который крошится.
Делегирование или селективное выщелачивание относится к селективному удалению одного элемента из сплава в результате процессов коррозии.
Растрескивание под воздействием окружающей среды
Растрескивание под воздействием окружающей среды относится к коррозионному растрескиванию, вызванному сочетанием условий, которые могут привести к одной из следующих форм коррозионного повреждения:
- Коррозионное растрескивание под напряжением
- Коррозионная усталость
- Водородное охрупчивание
Коррозионное растрескивание под напряжением
(SCC) – это растрескивание, вызванное комбинированным воздействием растягивающего напряжения и агрессивной среды.
Коррозионная усталость
Коррозионная усталость является результатом совместного действия переменных или циклических напряжений и коррозионной среды.
Считается, что процесс усталости вызывает разрыв защитной пассивной пленки, что ускоряет коррозию.
Если металл одновременно подвергается воздействию агрессивной среды, разрушение может произойти при еще меньших нагрузках и по истечении более короткого времени.
Водородное охрупчивание
Включает проникновение водорода в компонент, событие, которое может серьезно снизить пластичность и несущую способность, вызвать растрескивание и катастрофические хрупкие разрушения при напряжениях ниже предела текучести восприимчивых материалов.
Атмосферная коррозия
Металлы могут подвергаться коррозии при воздействии атмосферного воздуха на открытом воздухе в результате чередования влажных и сухих циклов, вызванных дождями и конденсацией.
Коррозия более значительна, когда в атмосфере присутствуют загрязняющие вещества, такие как диоксид серы или хлорид.
Факторы, способствующие атмосферной коррозии
- Ощутимая влага
- Высокая относительная влажность (выше 70-80%)
- Соляной туман
- Поверхностные загрязнения (пыль, остатки пота, паяльные флюсы и т.д.)
- Атмосферные загрязнители (SO2, HCl, органические кислоты)
- Высокая температура
Высокотемпературная коррозия
Это форма коррозии, не требующая присутствия жидкого электролита. Этот тип повреждения называется «сухой коррозией» или «шелушением». Окисление металла/сплава произошло в результате воздействия высокой температуры.
Коррозионная высокотемпературная среда
- Коррозионно-активные газы
- Ясень
- Расплавленные соли
- Расплавленные металлы
Последствия коррозии
- Уменьшение толщины металла, ведущее к потере механической прочности и разрушению или разрушению конструкции.
 Когда металл теряется в локализованных зонах, образуя структуру, похожую на трещину, очень значительное ослабление может быть результатом весьма незначительной потери металла.
Когда металл теряется в локализованных зонах, образуя структуру, похожую на трещину, очень значительное ослабление может быть результатом весьма незначительной потери металла. - Опасности или травмы людей в результате разрушения или поломки конструкции (например, мостов, автомобилей, самолетов)
- Потеря времени наличия профильного производственного оборудования.
- Снижение стоимости товара из-за ухудшения внешнего вида.
- Загрязнение жидкостей в сосудах и трубах (например, пиво мутнеет, когда небольшое количество тяжелых металлов выделяется в результате коррозии)
- Перфорация сосудов и труб, позволяющая вытекать их содержимому и причиняющая вред окружающей среде. Например, протекающий бытовой радиатор может привести к дорогостоящему повреждению ковров и украшений, а вызывающая коррозию морская вода может попасть в котлы электростанции, если трубки конденсатора продырявятся.
Другие факторы, ускоряющие коррозию
- Кислотный дождь
- Прибрежный фактор
- Противообледенительные средства – например, дорожная соль, MgCl
- Эффект зеленого дома
Воздействие кислотных дождей на окрашенную поверхность
Скорость коррозии чугуна в слитках (координатное расстояние и содержание солей)
| Приблизительное расстояние от прибоя (м) | Содержание солей в воздухе (мг NaCl/дм2) | Скорость коррозии (мм/год) |
50 | 11. |



