Плотность аргона при нормальных условиях: Аргон — свойства и сферы применения
alexxlab | 23.05.1987 | 0 | Разное
Теплофизические свойства аргона
Аргон является инертным одноатомным газом без цвета, вкуса и запаха. После азота и кислорода аргон – третий по распространённости элемент в земной атмосфере— 0,93 % по объёму и 1,29 % по массе. Температура кипения аргона при нормальном давлении составляет -185,9°C, температура плавления -189,4°С. Известно только два химических соединения аргона – гидрофторид аргона и CU(Ar)O. Получают аргон в процессе разделения воздуха на кислород и азот как побочный продукт.
В ядерном реакторе радионуклиды аргона образуются наряду с радионуклидами криптона и ксенона в качестве газообразных химически инертных продуктов деления ядерного топлива.
Кроме того, аргон может использоваться в ядерных реакторах в качестве газовой подушки для заполнения пространства между теплоносителем и крышкой корпуса, как это имеет место, например, в реакторах БН-600 (первый блок Белоярской АЭС) и БРЕСТ-ОД-300, что служит дополнительным барьером для предотвращения контакта теплоносителя с воздухом.
Расчет теплофизических свойств аргона произведен для температур в диапазоне Т от 300 K до 2000 К и давления Р от 0,1 MПa до 4 МПа. При таких параметрах аргон по своим свойствам подобен разреженному газу. При описании характеристик необходимо учитывать их зависимость от давления. Раздел составлен по результатам, представленным в работах [10, 11, 21, 23]. Указаны пределы применимости соотношений и погрешности аппроксимации табличных данных.
Фундаментальные константы для аргона:
Атомный вес А = 39,944 [1]
Удельная газовая постоянная R = 212 Дж/(кг·K) [5]
Температура кипения при нормальном давлении Tк = 87,29 K [2].
Критическая температура Tкр = 150,86 K, [2].
Критическое
давление Pкр = 50 бар, [2].
Критическая плотность rкр = 536 кг/м3 [2].
Плотность, удельный объем
Плотность при давлении Р = 0,1 МПа и температурах Т от 300 К до 2000 К в г/см3:
r0,1 = 3,937 – 11,9 T/(1000) + 17,58 (T/1000)2 – 13,41 (T/1000)3 +
5,082 (T/1000)4 + 7,543 (T / 1000)5 (1)
Точность аппроксимации не более ± 1 %.
Для давления Р от 0,1 МПа до 6 МПа и в диапазоне температур T = 300 ÷ 2000 К
Точность аппроксимации при температуре Т >500 К не более ±5 %.
Удельный объем, м3/кг:
v = 1 / r (3)
Точность аппроксимации не более ± 5 %.
Теплоемкость
Удельная изобарная теплоемкость (кДж/(кг·К)) при давлении Р в диапазоне от 0,1 до 6,0 МПа и в диапазоне температур Т от 300 К до 2000 К:
H0,1 = 0,52 (4)
Точность аппроксимации не превышает ± 0,7 %.
Энтальпия (кДж/кг) в диапазоне температур T 300 ÷ 2000 К (температура отсчета 300 К) и при давлениях Р в диапазоне от 0,1 МПа до 6 МПа:
D Э = Э(T) – Э(300) = 0,52T – 156 (5)
Энтропия (кДж/(кг·K) при давлениях Р в диапазоне от 0,1 МПа до 6 Мпа, за точку отсчета принята температура T = 300 К):
DS = S(T) – S(300) = 0,52 – 156/T (6)
Точность аппроксимации рассчитывается по погрешностям применяемых соотношений.
Теплопроводность
Коэффициент теплопроводности при давлении Р = 0,1 МПа и температурах в диапазоне от 300 К до 2000 К в Вт/(м К),:
при давлении Р = 0,1 МПа и температурах Т = 300 ÷ 2000 К,
α0,1 = (4,923 + 0,0465T – 8,028 10–6T2)10–3 (7)
Точность
аппроксимации не более ± 0,5 %.
При давлениях Р в диапазоне от 0,1 до 6,0 МПа и температурах в диапазоне T = 300 ÷ 2000 К:
α = α0,1{1 + 0,022(P – 0,1) exp [1 − 0,004 (T – 300)]} (8)
где давление Р дано в МПа.
Точность аппроксимации не более ± 1 %.
Вязкость
Коэффициент динамической вязкости (Па с) при давлении Р = 0,1 МПа и температурах T в диапазоне от 300 К до 2000 К:
β0,1 = (85,084 + 0,537T – 7,061×10–5 T2 ) 10–7 (9)
Точность аппроксимации не выше ± 1 %.
При давлениях Р в диапазоне от 0,1 до 6 МПа и температурах в диапазоне T = 300÷2000 К:
β = β0,1{1 + 0,012 (P – 0,1) exp [1 − 0,005 (T – 300)]} (10)
Точность аппроксимации не более ± 0.5 %.
Скорость звука
при давлении Р = 0,1 МПа и температурах T в диапазоне от 300 К до 2000 К (м/с):
w0,1 = 201,91 + 0,457T – 7,192×10-5T2 (11)
Точность аппроксимации не более ± 1 %.
При давлениях в диапазоне Р от 0,1 до 6 МПа и температурах в диапазоне T = 300 ÷ 2000 К,
w = w0,1{1 + 0,002 (p – 0,1) exp [1 − 0,005(T – 300)]} (12)
Точность аппроксимации не более ± 0,5 %.
Прочие характеристики
Данные, приведенные в таблице ниже, рассчитаны по приведенным выше соотношениям. Кроме того, соотношение δ = β/r используется для расчета коэффициента кинематической вязкости; γ = α/(Hpr) – для коэффициента температуропроводности, и ε = δ/γ – для числа Прандтля.
Погрешности для δ, γ , ε вычисляются на основе погрешностей исходных величин, с применением propagation law.
Значения теплоемкости Н в таблице ниже не приводятся, поскольку в исследуемом интервале температур она постоянная и равна 0,52 Дж/(г·К).
плотность, формула, газ, атомная, молекулярная масса
Аргон – это химический элемент, занимающий в периодической таблице Д. И. Менделеева место под номером 18. Инертный, по-другому благородный, одноатомный газ аргон, который, при нормальных условиях не вступает в химические реакции и является чистым веществом, незаменим во многих сферах человеческой деятельности.
И. Менделеева место под номером 18. Инертный, по-другому благородный, одноатомный газ аргон, который, при нормальных условиях не вступает в химические реакции и является чистым веществом, незаменим во многих сферах человеческой деятельности.
В данной статье рассказывается о его физических и химических свойствах, областях применения, технике безопасности при использовании.
Содержание
- Происхождение названия
- Распространенность
- Во вселенной
- Распространение в природе
- Физические свойства
- Химические свойства
- Атомная и молекулярная масса
- Изотопы
- Ионы
- Молекула и атом
- Молярная масса
- Получение
- Биологическая роль
- Область применения
- Окраска баллона
- Зависимость давления аргона в баллоне от температуры
- Техника безопасности при работе с аргоном
Происхождение названия
Впервые с аргоном во второй половине XVIII века столкнулся английский ученый Кавендиш при изучении состава воздуха.
Во время проведения эксперимента после удаления с помощью химических реакций кислорода и азота в трубке оставался небольшой пузырек газа, который не реагировал на внешние воздействия. Его размер составлял около 1/120 первоначального объема. Понять причину этого Кавендишу не удалось.
И только более чем через столетие, на исходе XIX века, совместные усилия ученых Рэлея и Рамзая, также англичан, привели к ликвидации белого пятна в периодической таблице.
Они заинтересовались разницей в весе двух объемов азота, равных 1 л, один из которых был получен из воздуха, другой – в результате химической реакции. Эта разница составляла 1,6 мг и не могла быть отнесена на счет погрешности измерения.
Ученые предположили, что в первом случае, кроме азота, присутствует неизвестный газ, что и подтвердил последующий спектральный анализ. Поскольку этот газ оказался химически неактивным, то есть не вступал в какие-либо реакции, то и название он получил соответствующее.
В переводе с древнегреческого языка ἀργός (читается как «аргос») – медленный, ленивый.
Несколько позднее, также с помощью спектрального анализа, были открыты и другие инертные газы, присутствующие в составе атмосферы, хотя и в значительно меньших, чем аргон, количествах.
Распространенность
Температура кипения аргона при атмосферном давлении очень низка, поэтому на Земле его можно встретить лишь в виде газа.
По количеству в составе атмосферного воздуха, которое составляет около 1%, элемент уступает лишь азоту и кислороду, и это в несколько десятков раз больше, чем общее количество других инертных газов – ксенона, криптона, гелия, неона.
Поэтому он наиболее популярен. А такого содержания в воздухе вполне достаточно для промышленной добычи, тем более что после использования газ практически полностью возвращается в атмосферу, не вступая в какие-либо реакции по причине своей инертности.
Чтобы понять, как добывают аргон, необходимо учесть, что температуры кипения кислорода и азота различны и равны, соответственно, 90 °К (-183 °С) и 77 °К (-196 °С). В то же время аргон закипает при температуре, большей, чем азот, и меньшей, чем кислород.
Данную физическую особенность и используют инженеры, чтобы получить газ в чистом виде. Происходит это при низкотемпературной ректификации воздуха, то есть разделения его на азот и кислород путем многократного ожижения и испарения. Аргон в этом процессе появляется в качестве побочного продукта.
Во вселенной
В окружающей наш мир материи аргона немного – всего 0,02% от общей массы.
Ученые обнаружили его входящим вместе с еще одним инертным газом – неоном в состав некоторых звезд, а также планетарных туманностях – оболочках ионизированных газов, образующихся вокруг звезд на исходе их существования.
Рис. 1. Планетарная туманностьРаспространение в природе
На нашей планете, кроме атмосферы, аргон содержится в земной коре и морской воде, но в значительно меньшей степени – его количество составляет лишь тысячные доли процента от общей массы.
Физические свойства
1 см3 аргона в газообразном состоянии при стандартных условиях весит 1,78×10-3г, что означает, что его плотность равна 1,78×10-3г/см3.
То есть аргон тяжелее, чем воздух, который имеет плотность 1,2×10-3г/см3. Поэтому при попадании в атмосферу из какой-либо емкости, например, газового баллона, аргон будет занимать объем в нижней части помещения, вытесняя оттуда воздух и постепенно с ним смешиваясь.
Температура конденсации аргона, то есть его кипения, в условиях атмосферного давления равна 87,3 °К (-185,9 °С). При температуре 83,8 °К (– 189,3 °С) жидкость отвердевает. Плотность аргона в жидком состоянии при давлении в одну атмосферу равна 1,39х103 кг/м3.
Химические свойства
Рис. 2.Аргон в таблице Менделеева и его формула.Аргон является инертным газом, не имеющим ни запаха, ни вкуса, ни цвета и в периодической таблице занимает место среди других неметаллов в столбце с прочими благородными газами. Его химическая формула – Ar (первые две буквы латинского слова argon).
Атомная и молекулярная масса
Атомной массой называется средняя масса существующих в земных условиях изотопов с учетом их распространенности. Для аргона она составляет 39,948. Его молекулярная масса равна атомной.
Изотопы
Изотопы – это разновидности атомов с одинаковым зарядом ядра и различной массой. На Земле существуют следующие изотопы аргона:
- 40Ar с ядром, состоящим из 18 протонов и 22 нейтронов в земной атмосфере представлен наиболее всего – 99,6% от общего количества газа;
- 36Ar (18 нейтронов) – 0,337%;
- 38Ar (20 нейтронов) – 0,063%.
Источником изотопа 40Ar является изотоп калия 40К, являющийся радиоактивным и попадающий на поверхность земли вместе с продуктами извержения вулканов.
Также существуют изотопы, создаваемые искусственно. Их масса может иметь значение от 30 до 55 атомных единиц, но они нестабильны. Наиболее устойчивым является 39Ar с периодом полураспада, составляющим 269 лет, самые неустойчивые существуют в течение десятков наносекунд.
Ионы
Для того чтобы оторвать от атома электрон, необходимо потратить энергию, которая называется энергией ионизации.
Для создания катиона (положительно заряженного иона) Ar+ потребуется 1520 кДж/моль. Это можно осуществить с помощью пропускания через газ электрических разрядов.
Молекула и атом
Атом имеет положительно заряженное ядро, в состав которого входит 18 протонов. Вокруг ядра по трем орбитам вращаются 18 электронов – 2 на первой, на второй и третьей – по 8.
Рис. 3. Планетарная модель атома ArТаким образом, внешняя орбита заполнена электронами полностью. Именно этим объясняется отсутствие каких-либо химических соединений с участием аргона – при нормальных условиях он существует только в свободном виде.
Такое свойство присуще всем остальным инертным газам – у каждого из них внешняя электронная орбита заполнена полностью.
Молекула по этой же причине состоит из одного атома и так же, как и атом, обозначается – Ar.
Читать также: Виды аттестации сварщиков
Молярная масса
Один моль – это 6,02х1023 молекул данного вещества. Величина 6,02х1023 называется числом Авогадро и обозначается как NA. Молярная масса, определяющая свойства аргона, как и любого газа – это масса одного моля. Для аргона она равна 39,948 г/моль.
Величина 6,02х1023 называется числом Авогадро и обозначается как NA. Молярная масса, определяющая свойства аргона, как и любого газа – это масса одного моля. Для аргона она равна 39,948 г/моль.
Получение
Чаще всего аргон получают с помощью криогенной ректификации воздуха. Для этого воздух сначала тщательно очищают от частиц пыли, прогоняя через несколько фильтров, осушают, затем сжимают при помощи компрессоров до перехода в состояние жидкости.
Последнюю отправляют в ректификационную колонну – устройство, в котором при различных температурах происходит последовательное испарение азота, аргона и кислорода.
Аргонная фракция, содержащая 12%, аргона, подвергается еще одной ректификации, в результате чего доля газа в смеси доходит до 85%, остальное приходится на кислород с небольшим количеством азота.
Рис. 4. Оборудование для разделения воздухаТакой газ называют сырым аргоном и уже из него получают чистый аргон, который в зависимости от количества оставшихся примесей в соответствии с ГОСТ 10157-62 может быть трех марок:
- марка А – объемный процент содержания аргона, не менее 99,99%.
 Применяется при сварке титановых сплавов, нержавеющей стали, конструкционной стали – при повышенных требованиях к прочности;
Применяется при сварке титановых сплавов, нержавеющей стали, конструкционной стали – при повышенных требованиях к прочности; - марка Б – не менее 99,96%. Используется во время сварки алюминия, менее активных, чем титан, цветных металлов;
- марка В – не менее 99,90%. Востребована при работе с жаростойкими сплавами, алюминиевыми материалами, конструкционными сталями. Часто используется совместно с углекислым газом и кислородом.
Еще один способ получения аргона – при синтезировании аммиака. Побочным продуктом реакции является продувочный газ, содержащий до 20% аргона, причем стоимость его получения заметно ниже.
Читать также: реестр НАКС поиск сварщиков по фамилии
Биологическая роль
Под биологической ролью элемента подразумевается его участие в жизнедеятельности каких-либо организмов. Аргон в таких процессах участия не принимает, следовательно, этой роли не выполняет.
Область применения
Аргон применяется в самых различных областях деятельности человека. В первую очередь востребовано отсутствие его химическая активности.
В первую очередь востребовано отсутствие его химическая активности.
Наиболее широко газ используется при сварке – для создания вокруг дуги газового слоя, оттесняющего атмосферные кислород и азот. Поскольку этот газ тяжелее воздуха, то применять его лучше при использовании нижнего положения.
Аргон растекается над поверхностью материала, вытесняя вверх кислород с азотом, и прикрывает не только область расплава, но также и нагретую часть поверхности.
Это важно во время работы с металлами, отличающимися активностью при высокой температуре, например, такими как титан. Аргон также используют во время сварки высоколегированных и нержавеющих сталей. Неметаллы обычно соединяют с использованием газовой сварки.
Использование инертного газа дает возможность увеличить температуру дуги, а это сказывается на проплавлении шва, который приобретает форму кинжала и позволяет в один проход соединять куски металла большой толщины.
В связи с тем, что в отсутствие кислорода шов получается значительно более ровным и прочным, аргон востребован при изготовлении ответственных конструкций в строительстве: высоких зданий, железнодорожных и автомобильных мостов.
Швы высокого качества востребованы в химическом и пищевом машиностроении, атомной промышленности, аэрокосмической сфере. Нефте- и газопроводы также сооружаются с применением аргонной сварки.
В электронике инертность аргона также находит применение. Его закачивают в колбы осветительных и радиоламп – для защиты, соответственно, нити накаливания или электродов, используют при выращивании полупроводниковых кристаллов.
В сфере производства продуктов питания газ применяется в качестве вытеснителя (в первую очередь, присутствующего в воздухе кислорода). Его закачивают в герметичные упаковки с продуктами с целью увеличения срока хранения.
Низкое значение теплопроводности аргона дает возможность применять его в качестве теплоизолятора – в оконных рамах, гидрокостюмах.
Способность излучать фиолетовый свет при нагревании находит применение в рекламных афишах и надписях.
Рис. 5. Свечение аргонаДругие области применения:
- пожаротушение;
- лазеры;
- хирургические операции
и многое другое.
Полезная стать — Технология ручной дуговой сварки
Окраска баллона
При использовании баллонов для хранения газов за каждым из них закреплен цвет, в который окрашена сама емкость, а также цвет полосы, нанесенной по окружности на ее образующую вблизи горловины. Баллон, предназначенный для аргона, окрашен в серый цвет, при этом цвет полоса и надпись – зеленые.
Рис. 6. 40-литровый баллон с аргономДля транспортировки жидкого аргона применяются специальные емкости типа сосуда Дьюара и цистерны.
Полезная статья — Технология сварки труб
Зависимость давления аргона в баллоне от температуры
При заправке давление аргона в баллоне составляет порядка 150 атм. Однако в соответствии с законами физики все газы при нагревании расширяются. Если отсутствует возможность для расширения, что и наблюдается в замкнутом объеме, то при повышении температуры давление внутри него будет нарастать. В случае идеального газа соблюдается следующая зависимость:
где P – давление внутри замкнутого объема;
Т – абсолютная температура газа по шкале Кельвина, которая выше температуры по шкале Цельсия на 273°, то есть
где t – температура по шкале Цельсия.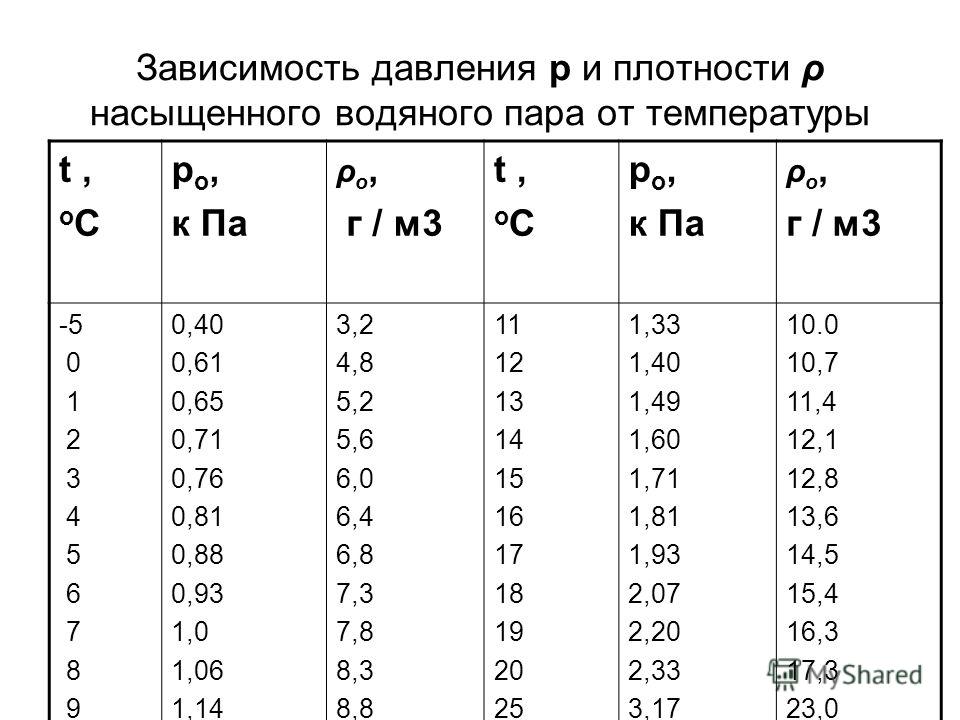
Зависимость давления реального газа в баллоне от температуры приведена в таблице:
| Температура, °С | Давление, атм |
| -30 | 111,8 |
| -20 | 120,5 |
| -10 | 127,5 |
| 0 | 135,6 |
| +10 | 144,3 |
| +20 | 151,3 |
| +30 | 158,2 |
Таким образом, при увеличении температуры на 60 ° (от -30 °С до +30 °С) давление аргона в баллоне растет более чем на 40%.
ДЛЯ СПРАВКИ: аргон в 40-литровом баллоне при давлении 150 атм и комнатной температуре весит около 7,5 кг. При этом вес баллона, изготовленного из углеродистой стали, составляет 58,5 кг.
Техника безопасности при работе с аргоном
Газ не является ни токсичным, ни взрывоопасным, тем не менее, попадание излишнего количества аргона в воздух ведет к уменьшению в нем процентной доли кислорода, а это уже опасно для здоровья и жизни человека и может привести к кислородной недостаточности.
В обычном атмосферном воздухе содержится 20,9% кислорода, уменьшение его доли до 18% ведет к появлению головной боли и сонливости, при значении менее 15–16% человек теряет сознание.
В случае вдыхания аргона, так же как и других инертных газов, возникает мгновенное удушье и потеря сознания, чреватые летальным исходом.
Поэтому во время работы в замкнутом пространстве должны отсутствовать какие-либо утечки газа через уплотнения в соединениях трубопроводов или трещины в шлангах.
С особым вниманием за этим нужно следить при проведении сварки в слабопроветриваемых помещениях, а также приямках, где газ может скапливаться, поскольку тяжелее воздуха. Перед началом работы следует проверить содержание кислорода в окружающем пространстве – оно должно быть не менее 19%.
Читать также: Как настроить полуавтомат для сварки
В противном случае необходимо надеть изолирующий противогаз, который предотвращает какой-либо контакт органов дыхания с окружающим воздухом. Работы в таких условиях проводят два человека.
Работы в таких условиях проводят два человека.
Первая помощь в случае отравления газообразным аргоном заключается в эвакуации пострадавшего на свежий воздух, проведении искусственного дыхания, использовании кислородной подушки.
Жидкий аргон при попадании на тело человека может вызвать ожоги, поэтому, работая с ним, необходимо надевать защитные очки и спецодежду, способную предохранить поверхность тела от контакта с ним.
Да
78.08%
Нет
21.92%
Проголосовало: 73
Свои вопросы вы можете оставить в комментариях, и наши специалисты Вам помогут найти ответ.
Аргон: температура, состояния, сварка
История открытия
Предыстория открытия Ar началась в 1785 году. Выдающийся ученый и естествоиспытатель из Великобритании Генри Кэвендиш исследовал состав воздуха. Он подвергал азот окислению и взвешивал получившиеся окислы. По окончании опыта в сосуде оставался газ. Кэвендиш определил его объем в 0,8% от начального объема воздуха.
Состав этого газа ученый определить не смог. Спустя столетие к проблеме вернулись сэры Джон Рэлей и Уильям Рэмзи. В ходе проведенных опытов они обнаружили, что азот, выделенный из воздуха, имеет большую плотность, нежели азот, получаемый в ходе реакции разложения нитрита аммония.
в 1884 году им удалось выделить из воздуха некий газ, более плотный, чем азот. Это вещество имело одноатомную молекулярную структуру и было крайне инертным — т.е. не реагировало с другими веществами.
На заседании Королевского Общества новому газу было присвоено название «аргон», что в переводе с древнегреческого значило «спокойный, ленивый»
История[ | ]
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. В течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались всё новые порции бурых оксидов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырёк газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[4][5][6]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил своё исследование и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Через некоторое время образование окислов прекратилось, но после связывания оставшегося кислорода остался пузырёк газа, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[4][5][6]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил своё исследование и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (масса первого была равна 1,2521 г, а второго — 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счёт ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота[4].
Эта разница была не так уж мала, чтобы можно было её отнести на счёт ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота[4].
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос[4][5].
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею своё сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжёлого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы)[5].
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошёл своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней[4].
Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода. Опыт длился несколько дней[4].
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удалён кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 мл нового газа[4].
Итак, был открыт новый газ. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество[4].
Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество[4].
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества[4].
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов[4].
Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов[4].
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном
. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 % по массе)[4][5]. Слишком невероятен был тот факт, что несколько поколений учёных не заметили составной части воздуха, да ещё и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон[4].
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии[4].
Происхождение названия[ | ]
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от др.-греч. ἀργός — ленивый, медленный, неактивный). Это название подчёркивало важнейшее свойство элемента — его химическую неактивность[4].
Аргон в природе
Ввиду практически полной инертности Ar представлен в естественной среде исключительно в несвязанном виде. Его процентная доля в различных частях Земли равна приблизительно:
- земная кора — 0,00012%;
- морская вода — 0,00045%;
- атмосфера — 0,926%.
Доля Ar в воздухе выше, чем суммарная доля всех остальных инертных газов. Основным источником для его добычи служит наша атмосфера.
Содержание газов в атмосфере
В коре Земли аргон содержится также в виде радиоактивного изотопа Аргон-40 и появляется в ходе реакции распада изотопов Калия.
Современная наука вместе с остальными инертными газообразными элементами относит Ar к VIII группе периодической системы.
Что нужно для сварки аргоном
Метод сварки металла с использованием инертного газа подразумевает большие возможности в плане выбора оборудования и материалов. Иногда начинающих сварщиков это сбивает с толку. Но на самом деле их опасения сделать неправильный совершенно напрасны. Большинство представленного на потребительском рынке оборудования и принадлежностей универсальны и пригодны для выполнения широкого спектра работ.
Установки, предназначенные для аргонно-дуговой сварки, делится на три группы:
- Специализированное. Разработано специально для выполнения однотипной работы. Чаще всего востребовано в промышленности, когда нужно быстро и точно обрабатывать однотипные заготовки.
- Специальное. Еще один вид востребованного на промышленных предприятиях оборудования, которое предназначено для работы с заготовками одного размера.
- Универсальное. Получило наиболее широкое распространение и востребовано среди самых разных категорий пользователей – от профессионалов до начинающих сварщиков.

Кроме аппарата нужна и дополнительная оснастка:
- горелка и расходники вольфрамовые;
- контактор – применяется для подключения питания к горелке;
- баллон с редуктором для инертного газа;
- реле – отвечает за подключение осциллятора или контактора;
- выпрямитель – преобразует напряжение в постоянное 24В;
- таймер – используется для контроля периода времени обдува рабочей зоны аргоном;
- амперметр – измеряет силу тока;
- клапан подачи электропитания;
- аккумулятор для стабилизации цепи переменного тока;
- фильтр – контролирует импульсы высокого напряжения.
Для работы потребуется два трансформатора: основной и вспомогательный. Осциллятор подключается в цепь параллельно с источником питания. Он требуется для подачи импульса высокой частоты, с помощью которого поджигается дуга между металлом и неплавящимся вольфрамовым стержнем. В бытовой сети напряжение составляет 220 В, а частота – 50 Гц. После осциллятора эти показатели составляют 6 000 вольт и 500 000 Гц.
Чтобы работать с заготовками большой толщины или с целью повышения производительности сварочного оборудования, необходима дополнительная оснастка:
- специальная горелка, в которую вставляется несколько электродов одновременно. В результате шов хорошего качества получается на большей скорости перемещения горелки;
- приспособление предварительного разогрева присадочной проволоки.
Пульсирующая подача тока дает возможность делать микропаузы в работе, которые способствуют кристаллизации расплава и улучшению качества шва.
Как добывают аргон
Благодаря значительному с промышленной точки зрения содержанию аргона в воздухе его получают в качестве дополнительного продукта криогенной ректификации O2 и N2.
Технология основана на том факте, что температура кипения (или сжижения) Ar лежит между температурами N2 и O2.
Перед началом процесса воздух подвергается тщательной очистке от пыли в многоступенчатых фильтрах, осушается от водяных паров, а далее мощными компрессорами сжимается до тех пор, пока не перейдет в жидкое состояние. Жидкость перегоняют в ректификационной колонне, чтобы разделить ее на отдельные вещества.
Жидкость перегоняют в ректификационной колонне, чтобы разделить ее на отдельные вещества.
Установка для добычи аргона
Первым испаряется азот при -195 °С, его пары собираются на соответствующей тарелке ректификатора и отводятся в отдельный резервуар. Следующим по высоте (и при температуре кипения -185 °С) отбирается аргонная фракция, содержащая 12% Ar, менее полпроцента азота и кислород. Она подается в следующую ректификационную колонну, в которой процентная доля Ar доводится до 85, оставшееся приходится на кислород со следами азота. Такое вещество называется сырым аргоном, исходным материалом для получения очищенного газа.
В промышленности применяется несколько методов очистки сырого аргона от примесей.
Водород, добавляемый в состав сырья, окисляется на катализаторе и нагреве до 500 °С, таким образом, из состава смеси выводится кислород. Образовавшийся на катализаторе водяной пары удаляют при посредстве влагоотделителя. Газ после этого осушают. Аргон с оставшимся в нем азотом вновь ректифицируют.
Аргон с оставшимся в нем азотом вновь ректифицируют.
Применяются и альтернативные методы получения Ar. Во время синтеза аммиака из азота и водорода в химических реакторах Ar получают как сопутствующий продукт производства. Технологический компонент это синтеза — продувочный газ — содержит до 20% Ar. Из этого газа и извлекают самый спокойный элемент. Стоимость производства, складывающаяся в основном из затрат на охлаждение и нагрев компонентов, делится между аммиаком и аргоном, и получается существенно ниже.
Качество газа, получаемого любым методом, определяется технологией очистки его от небольших количеств остаточного N2, O2, водяных паров и h3.
Аппарат, получающий ионные пучки аргона
Где применяется аргон
Аргон получил большое распространение в промышленности. Инертные свойства этого газа особенно востребованы в различных производственных процессах, где необходимо вытеснить один из самых активных элементов – кислород. Использование аргона очень дёшево, в сравнении с другими инертными летучими веществами, поэтому газ незаменим в том случае, когда требуется защитная среда при сваривании металлов, а также вытеснение влаги и кислорода в ёмкостях, где хранятся пищевые продукты.
Наполнение колб ламп накаливания инертным газом, позволяет значительно увеличить ресурс работы осветительного прибора. Кроме повышенного срока использования такие элементы обладают большей яркостью. Используется инертный газ и при производстве люминесцентных ламп. Применение аргона позволяет облегчить запуск разряда электрической дуги, а также значительно увеличить ресурс электродов.
При изготовлении стеклопакетов, инертным газом заполняются полости между стёклами, что позволяет значительно улучшить теплоизоляционные свойства. Учитывая тот факт, что аргон является абсолютно прозрачным, использование его никак не ограниченно даже при изготовлении многослойных конструкций.
Инертный газ аргон используется также в установках плазменной резки металлов. Преимущество использования этого газа заключается в том, что для возникновения дуги не требуется слишком высокого напряжения, поэтому такие установки могут иметь очень простую конструкцию. При генерации плазмы с использованием аргона образуется минимальное количество вредных газообразных веществ во время выполнения резки, поэтому этот метод идеально подходит для ручных приборов.

Благодаря возможности образовывать плазму при относительно невысоком напряжении, этот благородный газ используется в медицине для проведения аргоновой коагуляции. Такой метод успешно используется для удаления новообразований, а также для остановки кровотечений.
Аргон применяется и в химической промышленности. Благодаря отсутствию взаимодействия с другими элементами этот газ используется для получения сверхчистых веществ, а также для их анализа. В металлургической промышленности благородный газ позволяет обрабатывать такие металлы, как: титан, тантал, ниобий, бериллий, цирконий и др. Кроме этого, газ используется для перемешивания расплавленных веществ и снижения окисления хрома при производстве хромированной стали.
Общая характеристика Ar
Ar входит в группу инертных газов. Заряд его ядра — 18, под таким же номером элемент располагается в таблице Менделеева.
Из всех участников VIIIA группы он является наиболее часто встречающимся в природе. Объемная доля Ar в атмосфере -0,93%, массовая доля составляет 1,28%. Элемент является газом без цвета, вкуса и запаха. Химически не активен – аргон не вступает в реакцию и практически не соединяется ни с какими элементами или веществами, за исключением CU(Ar)O, и гидрофторида аргона.
Элемент является газом без цвета, вкуса и запаха. Химически не активен – аргон не вступает в реакцию и практически не соединяется ни с какими элементами или веществами, за исключением CU(Ar)O, и гидрофторида аргона.
Весьма плохо растворим водой, чуть большая растворимость наблюдается при взаимодействии с органическими растворителям.
Свойства аргона (таблица): температура, плотность, давление и пр.
| 100 | Общие сведения | |
| 101 | Название | Аргон |
| 102 | Прежнее название | |
| 103 | Латинское название | Argon |
| 104 | Английское название | Argon |
| 105 | Символ | Ar |
| 106 | Атомный номер (номер в таблице) | 18 |
| 107 | Тип | Неметалл |
| 108 | Группа | Инертный (благородный) газ |
| 109 | Открыт | Уильям Рамзай, Джон Уильям Стретт (лорд Рэлей), Великобритания, 1894 г. |
| 110 | Год открытия | 1894 г. |
| 111 | Внешний вид и пр. | Инертный газ без цвета, вкуса и запаха |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 1,292 % |
| 119 | Содержание в земной коре (по массе) | 0,00015 % |
| 120 | Содержание в морях и океанах (по массе) | 0,000045 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,02 % |
| 122 | Содержание в Солнце (по массе) | 0,007 % |
| 123 | Содержание в метеоритах (по массе) | |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 39,948(1) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 |
| 203 | Электронная оболочка | K2 L8 M8 N0 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 71 пм |
| 205 | Эмпирический радиус атома | |
| 206 | Ковалентный радиус* | 106 пм |
| 207 | Радиус иона (кристаллический) | |
| 208 | Радиус Ван-дер-Ваальса | 188 пм |
| 209 | Электроны, Протоны, Нейтроны | 18 электронов, 18 протонов, 22 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 18-ая группа (по старой классификации – главная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | |
| 302 | Валентность | |
| 303 | Электроотрицательность | 4,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1520,57 кДж/моль (15,7596117(5) эВ) |
| 305 | Электродный потенциал | |
| 306 | Энергия сродства атома к электрону | 0 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 0,001784 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – газ), 1,3954 г/см3 (при температуре кипения -185,848 °C и иных стандартных условиях, состояние вещества – жидкость), 1,65 г/см3 (при -233 °C и иных стандартных условиях, состояние вещества – твердое тело) |
| 402 | Температура плавления* | -189,34 °C (83,81 K, -308,81 °F) |
| 403 | Температура кипения* | -185,848 °C (87,302 K, -302,526 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 1,18 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 6,53 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость* | 20,85 Дж/(K·моль) |
| 411 | Молярный объём | 24,2 см³/моль |
| 412 | Теплопроводность | 17,72·10-3 Вт/(м·К) (при стандартных условиях), 0,0164 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 5,260 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 85 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-37-1 |
Примечание:
206* Ковалентный радиус аргона согласно составляет 106±10 пм.
401* Плотность аргона согласно и составляет 0,0017839 г/см3 (при 0 °C /20 °C и иных стандартных условиях, состояние вещества – газ).
402* Температура плавления аргона согласно и составляет -189,35 °C (83,8 K, -308,83 °F) и -189,6 °C (83,55 K, -309,28 °F) соответственно.
403* Температура кипения аргона согласно и составляет -185,85 °C (87,3 K, -302,53 °F) и -185,9 °C (87,25 K, -302,62 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) аргона согласно и составляет 7,05 кДж/моль и 1,19 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) аргона согласно и составляет 6,45 кДж/моль и 6,51 кДж/моль соответственно.
410* Молярная теплоемкость аргона составляет 20,79 Дж/(K·моль).
Виды аргона
Говоря о видах, или сортах Ar, надо понимать, что это одно и то же химическое вещество. Виды различаются по степени очистки от примесей.
- Высший сорт. Содержание Ar не менее 99,99% . Этот сорт особо высокой чистоты применяется для ответственных сварочных работ, таких, как сварка материалов, химически активных в нагретом состоянии: некоторые цветные сплавы, прежде всего титановые, нержавеющая сталь и др.
 Используется также для сварки высоконагруженных изделий из конструкционной стали.
Используется также для сварки высоконагруженных изделий из конструкционной стали. - Первый сорт. Содержание Ar не менее 99,98%, Применяется при сварке сплавов на основе алюминия с другими металлами и сплавами, для менее активных цветных металлов.
- Второй сорт. Содержание Ar не менее 99,95%. Используется при сваривании деталей из жаростойких стальных сплавов, алюминия и конструкционных сталей. Применение чистого Ar в этих случаях нежелательно, поскольку приводит к повышенной пористости материала шва и не позволяет защитить сварочную ванну от повышенной влажности и других загрязнений. Во избежание возникновения такого дефекта в состав смеси защитных газов добавляют углекислый газ и кислород, связывающие выделяющийся при сварке водород и другие примеси. Образующиеся в ходе этих реакций шлаки всплывают на поверхность сварочной ванны и после застывания удаляются вместе с окалиной.
[править] Применение
Используется в газоразрядных трубках и аргоновых лазерах.
Аргон используют для наполнения ламп накаливания, электронных приборов и др. Как радиоактивный индикатор используют 37 Ar, период полураспада которого 34 дня.
Также распространено использование аргона в качестве защитного слоя при сварке цветных металлов и нержавеющих сталей . Для этого используются как сам аргон, так и его смесь с углекислым (82 % Ar, 18 % CO2; 82 % Ar, 16 % CO2, 2 % O2) и другими газами.
Физические и химические свойства
Свойства аргона типичны для члена VIII группы.
При обычной температуре Ar пребывает в газообразном состоянии. Молекула включает в себя единственный атома, химическая формула весьма простая: Ar. Температура кипения весьма низка : -185,8 °С при атмосферном уровне давления.
Растворимость в воде низкая — всего 3,29 мл на 100 мл жидкости
Плотность аргона при нормальных условиях составляет 1,78 кг/м3. Молярная теплоемкость газа- 20,7 Дж/Кмоль.
Характеристики аргона и других инертных газов
Газ практически полностью инертен. На сегодняшний день ученым удалось получить лишь два его соединения — CU(Ar)O, и гидрофторид аргона. Соединения существуют лишь при сверхнизких температурах. Предполагается, что Ar может входить в состав неустойчивых в нормальном состоянии молекул эксимерного типа. Такие молекулы могут существовать лишь в возбужденном состоянии, например, в ходе электроразряда высокой интенсивности. Такие соединения возможны с ртутью, кислородом и фтором.
На сегодняшний день ученым удалось получить лишь два его соединения — CU(Ar)O, и гидрофторид аргона. Соединения существуют лишь при сверхнизких температурах. Предполагается, что Ar может входить в состав неустойчивых в нормальном состоянии молекул эксимерного типа. Такие молекулы могут существовать лишь в возбужденном состоянии, например, в ходе электроразряда высокой интенсивности. Такие соединения возможны с ртутью, кислородом и фтором.
Электроотрицательность по шкале Полинга равна 4,3.
Как степень окисления, так и электродный потенциал имеют нулевое значение, что характерно для инертного газа.
Ионный радиус составляет 154, радиус ковалентности — 106 Пм. Ионизационный порог- 1519 кдж/моль
Атомная и молекулярная масса
Такие важные параметры, как атомная и молекулярная массы, показывают, насколько масса молекулы вещества и масса его атома соответственно превышают значение, равное одной двенадцатой доле массы атома водорода.
Ввиду того, что молекула Ar состоит из единственного атома, молекулярная и атомная масса аргона идентичны и составляют 39,984.
Структура аргона и его свойства
Изотопы
В природных условиях Ar встречается в качестве трех устойчивых изотопов
- 36Ar– процентная доля этого изотопа составляет 0,337% в ядре 18 протонов и 18 нейтронов;
- 38Ar- его доля всего 0,063%, в ядре 18 протонов и 20 нейтронов;
- 40Ar – наиболее распространен, его доля составляет 99,6%, в ядре так же 18 протонов, но уже 22 нейтрона.
Искусственным путем удавалось получать изотопы с массовым индексом от 32 до 55, наиболее стабильным из них оказался 39Ar, период полураспада которого составляет 268 лет.
Большая процентная доля 40Ar среди изотопов, встречающихся в природе, вызвана постоянным образованием его в ходе реакции распада изотопа калий-40. На 1000 кг калия в ходе таких реакций за год образуется не более 3100 атомов 40Ar. Но, поскольку эти реакции идут постоянно в течение сотен миллионов лет, изотоп накопился в природе в существенных объемах.
Доминирование тяжелого изотопа в природе обуславливает тот факт, что атомный вес Ar превышает атомный вес калия, находящегося в таблице следом за ним.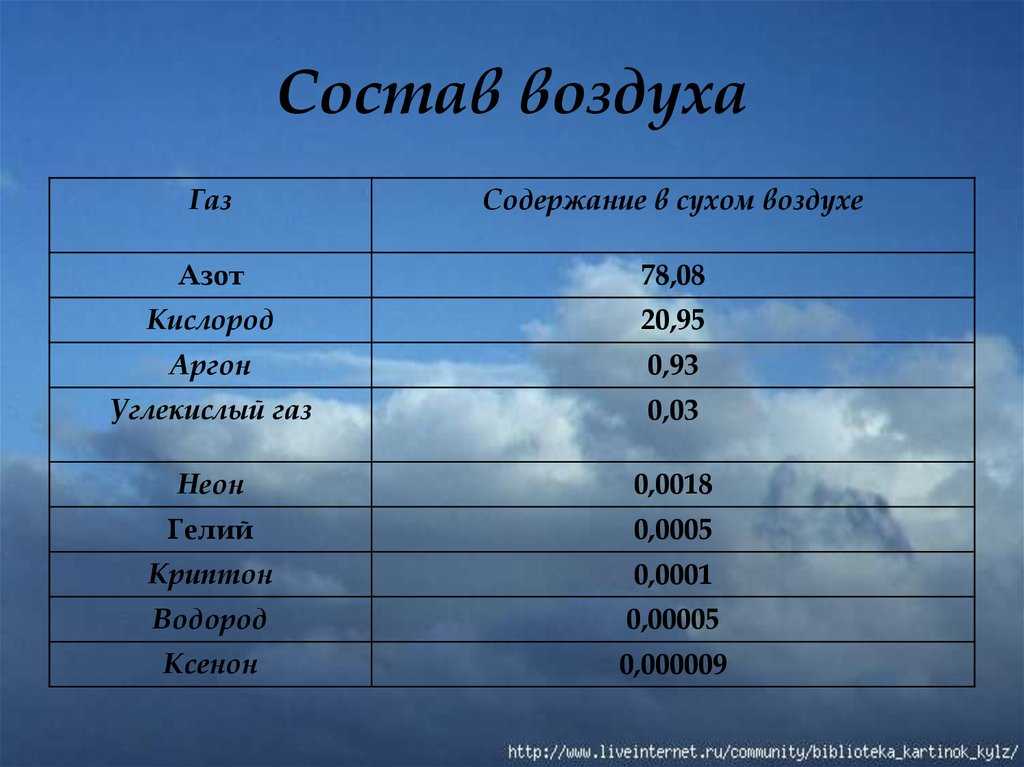 При создании Периодической системы такого противоречия не было, поскольку аргон был обнаружен и свойства его были исследованы значительно позже, в первом десятилетии XX века. Первоначально Ar был помещен в первую группу таблицы, восьмая группа была выделена позднее.
При создании Периодической системы такого противоречия не было, поскольку аргон был обнаружен и свойства его были исследованы значительно позже, в первом десятилетии XX века. Первоначально Ar был помещен в первую группу таблицы, восьмая группа была выделена позднее.
Ионы
Как и другие инертные газы (такие, как He и Ne), Ar подвержен ионизации. При возбуждении атомов и сообщении им высоких энергий возникают молекулярные ионы Ar2+.
Молекула и атом
Для инертных газов эти понятия идентичны, поскольку эти элементы не желают вступать в химическую связь даже с себе подобными. Молекула включает в себя один атом, химическая формула газа не отличается от обозначения элемента: Ar.
Молярная масса
Молярная масса аргона составляет 39,95 г/моль.
Существуют несколько методов ее вычисления:
- С применением относительной атомной массы M и коэффициента пропорциональности к, выражающего соотношение между относительной массой и молярной. Этот коэффициент является универсальной константой и равен для всех элементов.
 Молярная масса M выражается как произведение коэффициента пропорциональности на относительную массу.
Молярная масса M выражается как произведение коэффициента пропорциональности на относительную массу. - С использованием молярного объема. Потребуется найти объем, занимаемый при обычных условиях некоторой массой газа, далее рассчитать массу 22,4 литров вещества при таких же условиях.
- С применением уравнения Менделеева-Клапейрона, моделирующего идеальный газ.
pV = mRT / M,
проведя преобразования, получим выражение для молярной массы:
M=mRT/pV
где
- p – давление в паскалях,
- V –объем в кубометрах
- m – масса в граммах,
- Т — температура в Кельвинах,
- R – константа, значение которой 8,314 Дж/(моль×К).
Химический элемент Ar
Ar – 18-й элемент периодической таблицы Менделеева, относящийся к благородным инертным газам. Данное вещество является третьим после N (азота) и O (кислорода) по содержанию в атмосфере Земли. В обычных условиях – бесцветен, не горюч, не ядовит, без вкуса и запаха.
Другие свойства газа аргона:
- атомная масса: 39,95;
- содержание в воздухе: 0,9% объема и 1,3% массы;
- плотность в нормальных условиях: 1,78 кг/м³;
- температура кипения: -186°С.
На рисунке название химического элемента и его свойства
Данный элемент был открыт Джоном Стреттом и Уильямом Рамзаем при исследовании состава воздуха. Несовпадение плотности при различных химических испытаниях натолкнуло ученых на мысль, что в атмосфере помимо азота и кислорода присутствует инертный тяжелый газ. В итоге в 1894 г. было сделано заявление об открытии химического элемента, доля которого в каждом кубометре воздуха составляет 15 г.
Область применения
Шире всего аргон применяется при сварочных работах. Он используется для создания защитной атмосферы вокруг сварочной ванны, вытесняя из рабочей зоны O2 и N2, содержащиеся в атмосфере. Особенно важно это для сварки цветных металлов, многие из которых, к примеру, Ti, отличаются высокой химической активностью в нагретом состоянии. Незаменим инертный газ также для неразъемного соединения нержавеющих и высоколегированных сплавов.
Незаменим инертный газ также для неразъемного соединения нержавеющих и высоколегированных сплавов.
Также широко применяется при монтаже высоконагруженных строительных конструкций, таких, как каркасы высотных зданий, фермы мостов и многих других. Здесь его применение обеспечивает высокое качество, однородность и долговечность ответственных соединений. В строительной индустрии аргонная сварка доминирует среди других методов.
Сварка аргоном
Аргонно-дуговая сварка
Не менее широко применяется аргонная сварка в машиностроении, прежде всего химическом и пищевом. Швы получаются долговечные и надежные, даже в условиях воздействия агрессивных сред.
Нефтяная и газовая отрасли также применяют аргонная сварку при монтаже трубопроводов, газоперекачивающих станций и нефтеперегонных комбинатов.
Используется метод также в атомной промышленности, в транспортном машиностроении и в аэрокосмической отрасли.
В домохозяйствах аргонная сварка распространена не так широко. Это объясняется:
Это объясняется:
- высокой стоимостью оборудования и расходных материалов;
- необходимостью достаточной квалификации сварщика;
- меньшими нагрузками, испытываемыми домашними конструкциями;
- более низкими требованиями к прочности и долговечности сварных соединений.
Если в домохозяйстве возникает эпизодическая потребность в таких сварочных работах, то дешевле, быстрее и надежнее пригласить сварщика-специалиста.
Стеклопакет с аргоном
Принцип действия стеклопакета с аргоном
Характерным свойством Ar является его более высокая плотность по сравнению с воздухом. Поэтому максимальная эффективность аргонной сварки достигается при нижнем сварочном положении. В этом случае инертный раз растекается по поверхности детали и образует защитное облако значительной протяженности, позволяя вести сварку, как большими токами, так и на большой скорости. При сварке в наклонном и верхнем положении приходится учитывать «проваливание» аргона сквозь воздух. Чтобы компенсировать это явление, либо увеличивают подачу газа, либо проводят работы в герметичном помещении, заполненным инертным газом. В обоих случаях себестоимость работ возрастает.
Чтобы компенсировать это явление, либо увеличивают подачу газа, либо проводят работы в герметичном помещении, заполненным инертным газом. В обоих случаях себестоимость работ возрастает.
Поскольку потенциал ионизации Ar невысок, его использование обеспечивает идеальные геометрических характеристик сварочного шва, прежде всего, профиля. Возбужденная электродуга в аргоновой атмосфере также отличается высокой стабильностью своих параметров. С другой стороны, низкое значение потенциала ионизации обуславливает и более низкое напряжение розжига и поддержания дуги. Это сокращает ее тепловыделение и усложняет провар толстых листов металла.
Более высокая температура дуги в аргоновой атмосфере существенно повышает проплав сварочного шва. Это позволяет проводить сварку за один проход при условии точного соблюдения параметров зазора между заготовками.
В случае применения TIG-метода сварочных работ аргоновая атмосфера защищает от коррозионного влияния не только зону сварки, но и окончание неплавкого электрода.
В ряде специфических случаев в состав защитной газовой смеси добавляют гелий.
Кроме применения при сварочных работах, аргон используется:
- Как плазмоообразующее веществона установках плазменного раскроя металла.
- Для создания инертной среды в упаковках пищевых продуктов. Он вытесняет из пакетов и контейнеров кислород воздуха и водяные пары, пагубно влияющие на срок годности продуктов. Продукты в защитной атмосфере хранятся в несколько раз дольше, чем в обычной упаковке. Применяется этот метод и для упаковки медицинских изделий и препаратов, позволяя сохранить их в должной стерильности и химической чистоте.
- В качестве активного агента в противопожарных установках. Аргон вытесняет кислород (или другой газ) из очага горения, прекращая его.
- Для создания защитной среды в технологических установках при обработке полупроводниковых устройств, создании микросхем и других электронных компонентов или материалов высоких степеней чистоты.
- Наполнитель электроламп.

- В рекламных люминесцентных трубках.
Меры предосторожности при эксплуатации
Данный химический элемент не представляет абсолютно никакой опасности для окружающей среды, но при большой концентрации оказывает удушающее воздействие на человека. Он нередко скапливается в районе пола в недостаточно проветриваемых помещениях, а при значительном уменьшении содержание кислорода может привести к потере сознания и даже смертельному исходу. Поэтому важно следить за концентрацией кислорода в закрытом помещении, которая не должна падать ниже 19%.
Читать также: Сравнить стиральные машинки по характеристикам
Еще мы советуем посмотреть третью часть обучения сварке в защитной среде аргона:
Жидкий Ar способен вызвать обморожение участков кожи и повредить слизистую оболочку глаз, поэтому в процессе работы важно использовать спецодежду и защитные очки. При работе в атмосфере этого газа с целью предотвращения удушения необходимо применять изолирующий кислородный прибор или шланговый противогаз.
Заправить баллоны аргоном можно в , где соблюдается правильная технология заправки и предоставляется качественное обслуживание.
Если вы интересуетесь другими техническими газами, информацию можете найти здесь.
В атмосфере содержится около 0,9% аргона. Аргон, который, как и азот, представляет собой нейтральный бесцветный газ, существует в природе только в составе атмосферного воздуха. Он не пригоден для поддержания жизни, однако незаменим в некоторых технологических процессах благодаря высокому уровню химической инертности и относительной простоте извлечения.
Зависимость давления аргона в баллоне от температуры
По мере нагрева давление газообразного вещества в замкнутом объеме повышается. В таблице приведены примерные значения давления в баллоне в зависимости от температуры окружающего воздуха.
| T, °C | P, Мегапаскаль |
| -40 | 10,45 |
| -30 | 11,33 |
| -20 | 12,21 |
| -10 | 12,92 |
| 0 | 13,74 |
| +10 | 14,62 |
| +20 | 15,33 |
| +30 | 16,03 |
Следует учитывать, что баллонное давление изменяется не мгновенно, а по мере его прогрева или охлаждения.
Распространённость[ | ]
Во Вселенной[ | ]
Содержание аргона
в мировой материи мало́ и оценивается приблизительно в 0,02 % по массе[7].
Аргон (вместе с неоном) наблюдается на некоторых звёздах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения[8].
Распространение в природе[ | ]
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объёму и 1,288 % по массе[5][8], его запасы в атмосфере оцениваются в 4⋅1014 т[3][5]. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м3 воздуха содержится 9,34 аргона (для сравнения: в том же объёме воздуха содержится 18,2 мл неона, 5,2 мл гелия, 1,1 мл криптона, 0,09 мл ксенона)[5][8].
Содержание аргона в литосфере — 4⋅10−6 % по массе[3]. В каждом литре морской воды растворено 0,3 мл аргона, в пресной воде его содержится (5,5—9,7)⋅10−5 %. Его содержание в Мировом океане оценивается в 7,5⋅1011 т, а в изверженных породах земной оболочки — 16,5⋅1011 т[8].
Его содержание в Мировом океане оценивается в 7,5⋅1011 т, а в изверженных породах земной оболочки — 16,5⋅1011 т[8].
Кристаллическая решётка аргона:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 5,260 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 85 К |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
Процесс получения аргона
Схематично процесс добычи аргона описывается следующим образом. Вначале воздух очищается от пыли и сжимается до сжижения. Жидкий воздух подвергается ректификации с целью разделения его на составные части. Получающаяся аргоно-азотно-кислородная смесь (сырой аргон) затем очищается от кислорода и азота.
Разделение воздуха и попутное извлечение из него аргона в промышленном масштабе осуществляется путем сжижения и ректификации при низкой температуре.
Жидкий кислород под давлением 101 кПа кипит при температуре -182,9°С, а жидкий азот — при температуре -195,8°С. Поэтому пары жидкого воздуха при кипении обогащаются легкокипящим азотом, температура кипения которого почти на 13°С ниже, чем у кислорода. Одновременно происходит обогащение кипящей жидкости кислородом. Благодаря этому, в ректификационной разделительной колонке, где непрерывно кипит жидкий воздух и конденсируются его пары, удается получить одновременно кислород (в нижней части) и азот — (в верхней части). Большая часть жидкого аргона, температура кипения которого -185,3°С, скапливается в средней части колонки, откуда в смеси с кислородом и азотом отводится (так называемая аргонная фракция) в специальную аргонную колонну, смонтированную вместе с воздухораспределительным аппаратом. Здесь аргонная фракция (содержащая 8-12% аргона, 0,2-0,3% азота, остальное — кислород) подвергается дополнительной ректификации и обогащается аргоном до 85-95% (остальные 15-5% составляет смесь азота и кислорода). Этот продукт называют сырым аргоном, из него на последующих этапах очистки получают чистый Ar.
Этот продукт называют сырым аргоном, из него на последующих этапах очистки получают чистый Ar.
Применение аргона:
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47.
 Серебро
Серебро - 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99.
 Эйнштейний
Эйнштейний - 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Примечание: Фото https://www.pexels.com, https://pixabay.com
Как возможно научиться писать тексты и зарабатывать на этом удаленно? Например, можете пройти курс «Копирайтинг от А до Я», который подойдет даже начинающим авторам.
Другие записи:
карта сайта
аргон атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решеткаатом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома электронные формулы сколько атомов в молекуле аргонасколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 092
ГОСТ 10157-2016 | Стр.
 12
12Приложение А
(справочное)
ВЫЧИСЛЕНИЕ КОЛИЧЕСТВА ГАЗООБРАЗНОГО И ЖИДКОГО АРГОНА
А.1 Объем газообразного аргона в баллоне Vn, м3, при нормальных условиях вычисляют по формуле
Vn = KVб, (А.1)
где K – коэффициент для вычисления объема газа в баллоне, приведенный в таблице А.1, учитывающий сжимаемость аргона, давление и температуру газа в баллоне;
Vб – среднестатистическая вместимость баллона, дм3.
Таблица А.1
Коэффициент K для вычисления объема газа в баллоне в м3
при нормальных условиях 20 °C и 101,3 кПА (760 мм рт. ст.)
Температура газа в баллоне, °C | Избыточное давление газа в баллоне, МПа (кгс/см2) | |||||||||||
9,8 (100) | 11,8 (120) | 13,7 (140) | 14,2 (145) | 14,7 (150) | 15,2 (155) | 15,7 (160) | 16,2 (165) | 16,7 (170) | 17,7 (180) | 19,6 (200) | 21,6 (220) | |
Минус 50 | 0,157 | 0,193 | 0,231 | 0,240 | 0,249 | 0,258 | 0,267 | 0,276 | 0,284 | 0,300 | 0,331 | 0,363 |
Минус 40 | 0,145 | 0,178 | 0,211 | 0,219 | 0,227 | 0,236 | 0,243 | 0,251 | 0,259 | 0,274 | 0,303 | 0,333 |
Минус 35 | 0,140 | 0,171 | 0,203 | 0,211 | 0,218 | 0,226 | 0,234 | 0,241 | 0,248 | 0,263 | 0,291 | 0,319 |
Минус 30 | 0,135 | 0,165 | 0,195 | 0,203 | 0,210 | 0,217 | 0,224 | 0,232 | 0,239 | 0,253 | 0,280 | 0,307 |
Минус 25 | 0,131 | 0,159 | 0,188 | 0,195 | 0,202 | 0,209 | 0,216 | 0,223 | 0,230 | 0,243 | 0,269 | 0,296 |
Минус 20 | 0,127 | 0,154 | 0,181 | 0,188 | 0,195 | 0,202 | 0,209 | 0,215 | 0,222 | 0,235 | 0,259 | 0,285 |
Минус 15 | 0,123 | 0,149 | 0,175 | 0,182 | 0,189 | 0,195 | 0,202 | 0,208 | 0,215 | 0,227 | 0,252 | 0,276 |
Минус 10 | 0,120 | 0,145 | 0,170 | 0,177 | 0,183 | 0,189 | 0,195 | 0,202 | 0,208 | 0,220 | 0,243 | 0,267 |
Минус 5 | 0,116 | 0,141 | 0,165 | 0,171 | 0,178 | 0,184 | 0,190 | 0,196 | 0,202 | 0,213 | 0,236 | 0,260 |
0 | 0,113 | 0,137 | 0,161 | 0,167 | 0,173 | 0,178 | 0,184 | 0,190 | 0,196 | 0,207 | 0,229 | 0,252 |
5 | 0,110 | 0,134 | 0,157 | 0,162 | 0,168 | 0,174 | 0,179 | 0,185 | 0,190 | 0,201 | 0,223 | 0,245 |
10 | 0,108 | 0,132 | 0,153 | 0,158 | 0,164 | 0,169 | 0,175 | 0,180 | 0,185 | 0,196 | 0,217 | 0,238 |
15 | 0,105 | 0,128 | 0,149 | 0,154 | 0,159 | 0,165 | 0,170 | 0,175 | 0,181 | 0,191 | 0,212 | 0,232 |
20 | 0,103 | 0,124 | 0,145 | 0,150 | 0,155 | 0,161 | 0,166 | 0,171 | 0,176 | 0,186 | 0,206 | 0,227 |
25 | 0,101 | 0,121 | 0,142 | 0,147 | 0,152 | 0,157 | 0,162 | 0,167 | 0,172 | 0,182 | 0,201 | 0,221 |
30 | 0,099 | 0,119 | 0,139 | 0,144 | 0,149 | 0,154 | 0,158 | 0,163 | 0,168 | 0,178 | 0,196 | 0,216 |
35 | 0,097 | 0,116 | 0,136 | 0,140 | 0,145 | 0,150 | 0,155 | 0,160 | 0,164 | 0,174 | 0,192 | 0,211 |
40 | 0,095 | 0,114 | 0,133 | 0,137 | 0,142 | 0,147 | 0,152 | 0,156 | 0,161 | 0,170 | 0,188 | 0,206 |
50 | 0,091 | 0,109 | 0,128 | 0,132 | 0,137 | 0,141 | 0,146 | 0,150 | 0,154 | 0,163 | 0,180 | 0,198 |
За среднестатистическую принимают среднеарифметическое значение вместимостей не менее 100 баллонов.
, (А.2)
где P – давление газа в баллоне, измеренное манометром, кгс/см2;
0,968 – коэффициент пересчета технических атмосфер (кгс/см2) в физические атмосферы;
t – температура газа в баллоне при измерении давления, °C;
Z – коэффициент сжимаемости аргона при температуре t.
Например, при поставке газообразного аргона в баллонах по ГОСТ 949 вместимостью 40 дм3 объем газа в баллоне составляет:
при давлении 150 кгс/см2 при температуре 20 °C
0,155·40 = 6,20 м3;
при давлении 200 кгс/см2 при температуре 20 °C
0,206·40 = 8,24 м3.
А.2 Количество жидкого аргона в цистернах измеряют в тоннах или килограммах.
При переводе массы или объема жидкого аргона в м3 газообразного аргона при нормальных условиях пользуются формулами, указанными ниже.
или , (А. 3)
3)
где m – масса жидкого аргона, т;
Vж – объем жидкого аргона, дм3;
1,662 – плотность газообразного аргона при нормальных условиях, кг/м3;
1,392 – плотность жидкого аргона при нормальном давлении, кг/дм3.
Газы для защиты сварочной ванны . Сварочные работы. Практическое пособие
Защита плавящегося металла и расплавленной сварочной ванны от вредного воздействия окружающего воздуха при дуговой сварке является одной из главных задач обеспечения определенного качества шва. Такая защита обеспечивается истекающей из сопла горелки направленной струей защитного газа. Широко применяют в качестве защитных инертные (аргон, гелий) и активные (углекислый газ и азот) газы, а также их смеси.
Аргон – при обычных условиях бесцветный, неядовитый, невзрывоопасный газ без запаха и вкуса (может накапливаться в слабопроветриваемых помещениях у пола и в приямках; при этом снижается содержание кислорода в воздухе, что приводит к кислородной недостаточности, а при значительном понижении содержания кислорода – к удушью, потере сознания и смерти человека). С большинством элементов аргон не образует химических соединений. В металлах как в жидком, так и в твердом состоянии аргон нерастворим.
С большинством элементов аргон не образует химических соединений. В металлах как в жидком, так и в твердом состоянии аргон нерастворим.
Идея защиты переплавляемого дугой металла от воздействия воздуха путем подачи в зону сварки специально подобранного газа принадлежит русскому изобретателю Н. Н. Бенардосу, предложившему еще в 1883 г. сварку в струе газа.
Промышленность выпускает жидкий и газообразный аргон двух сортов в соответствии с ГОСТ 10157–79: высший (объемная доля аргона не менее 99,993 %) и первый (объемная доля аргона не менее 99,987 %). Газообразный аргон хранят и транспортируют в стальных 40-литровых баллонах под давлением 150 кг/см2 (15 МПа). Объем газообразного аргона можно приближенно определять как произведение вместимости баллона на давление газа в баллоне. Баллон для аргона окрашен в серый цвет, надпись зеленого цвета. Иногда используют жидкий аргон, который подвергают газификации. Жидкий аргон – бесцветная жидкость без запаха с температурой кипения при атмосферном давлении –185,7 °C и плотностью 1,784 кг/м3; хранится в сосудах Дьюара. Газообразный аргон в 1,4 раза тяжелее воздуха, поэтому его струя надежно и длительно удерживается в зоне сварки и хорошо защищает сварочную ванну. Плотность газообразного аргона – 1,662 кг/м3 при нормальных условиях. Расход аргона при сварке зависит от диаметра электрода и обычно составляет от 100 до 500 л/ч.
Жидкий аргон – бесцветная жидкость без запаха с температурой кипения при атмосферном давлении –185,7 °C и плотностью 1,784 кг/м3; хранится в сосудах Дьюара. Газообразный аргон в 1,4 раза тяжелее воздуха, поэтому его струя надежно и длительно удерживается в зоне сварки и хорошо защищает сварочную ванну. Плотность газообразного аргона – 1,662 кг/м3 при нормальных условиях. Расход аргона при сварке зависит от диаметра электрода и обычно составляет от 100 до 500 л/ч.
Гелий не имеет цвета и запаха, плотность 0,18 кг/м3, т. е. в 10 раз легче аргона. Газ неядовит, хорошо диффундирует через твердые тела (гелиевые течеискатели используются при проверке плотности швов), значительно легче воздуха и аргона. Не образует химических соединений с большинством элементов.
В соответствии с ТУ 0271–135–31323949–2005 промышленностью поставляется гелий для сварки двух марок: А и Б. Условия поставки регламентируются ГОСТ 20461–75. Чаще всего транспортируют и хранят гелий в газообразном состоянии в стальных баллонах под давлением 15 МПа (150 кг/см2).
Чаще всего транспортируют и хранят гелий в газообразном состоянии в стальных баллонах под давлением 15 МПа (150 кг/см2).
Стоимость гелия значительно выше, чем аргона, поэтому для сварки он применяется редко, обычно в виде добавки к аргону. Благодаря высокому значению потенциала ионизации, что повышает проплавление, гелий применяют в тех случаях, когда требуется получить большую глубину проплавления или специальную форму шва, а также при сварке сплавов на основе алюминия и магния, химически чистых и активных материалов и сплавов.
Баллоны для гелия окрашены в коричневый цвет, имеют белую надпись «Гелий». Расход гелия на 1 м шва на 50 % больше, чем аргона, при сварочном токе 300 А он составляет примерно от 200 до 900 л/ч, так как этот газ в 10 раз легче аргона и быстро улетучивается из зоны сварки в атмосферу, поэтому для поддержания надежной зашиты сварочной ванны необходимо увеличивать подачу (расход) гелия.
Азот – бесцветный газ, не имеющий запаха и вкуса, нетоксичен и не взрывоопасен. Он немного легче воздуха, плотность 1,2506 кг/м3 при нормальных условиях (температура 0 °C, атмосферное давление 101325 ПА). Температура кипения –195,8 °C, критическая температура –148,15 °C, критическое давление – 3,39 МПа (33,9 кг/см2). По отношению к стали и другим металлам азот является активным газом, часто вредным, и его концентрацию в зоне сварки стремятся ограничить. По отношению к меди и ее сплавам является инертным газом и применяется для сварки и наплавки, а также для плазменной резки. Например, вибродуговая наплавка бронзовой проволокой КМЦ3–1 на стальную поверхность поршней и штоков выполняется в защитной среде азота. Он поставляется в газообразном состоянии в соответствии с ГОСТ 9293–74 «Азот газообразный и жидкий. Технические условия» следующих сортов (объемная доля азота в %, не менее): газообразный и жидкий азот особой чистоты (1-й сорт – 99,999; 2-й сорт – 99,996), повышенной чистоты (1-й сорт – 99,99, 2-й сорт – 99,95), технический (1-й сорт – 99,6, 2-й сорт – 99,0).
Он немного легче воздуха, плотность 1,2506 кг/м3 при нормальных условиях (температура 0 °C, атмосферное давление 101325 ПА). Температура кипения –195,8 °C, критическая температура –148,15 °C, критическое давление – 3,39 МПа (33,9 кг/см2). По отношению к стали и другим металлам азот является активным газом, часто вредным, и его концентрацию в зоне сварки стремятся ограничить. По отношению к меди и ее сплавам является инертным газом и применяется для сварки и наплавки, а также для плазменной резки. Например, вибродуговая наплавка бронзовой проволокой КМЦ3–1 на стальную поверхность поршней и штоков выполняется в защитной среде азота. Он поставляется в газообразном состоянии в соответствии с ГОСТ 9293–74 «Азот газообразный и жидкий. Технические условия» следующих сортов (объемная доля азота в %, не менее): газообразный и жидкий азот особой чистоты (1-й сорт – 99,999; 2-й сорт – 99,996), повышенной чистоты (1-й сорт – 99,99, 2-й сорт – 99,95), технический (1-й сорт – 99,6, 2-й сорт – 99,0). Хранится в газообразном состоянии в стальных 40-литровых баллонах под давлением 15 МПа (150 кг/см2).
Хранится в газообразном состоянии в стальных 40-литровых баллонах под давлением 15 МПа (150 кг/см2).
Углекислый газ, или двуокись углерода (СO2), высший оксид углерода, может находиться в газообразном, сжиженном и твердом (в виде сухого льда) состоянии. Он бесцветен и неядовит, но при концентрации более 5 % (92 г/м3) отрицательно влияет на здоровье человека. Имеет слабый кисловатый запах и вкус, хорошо растворяется в воде и придает ей кислый вкус; хорошо растворяет машинное масло. Плотность при атмосферном давлении и 20 °C – 1,98 кг/м3; температура сжижения при атмосферном давлении – 78,5 °C; выход газа из 1 кг жидкой углекислоты при нормальных условиях – 509 литров.
Углекислый газ тяжелее воздуха в 1,6 раза. Вступает в химические реакции (взаимодействия) с расплавленным металлом ванны и растворяется в нем. Окисление металла шва нейтрализуется раскислителями, содержащимися в проволоке.
Двуокись углерода определяют и продают по массе. Жидкая двуокись углерода превращается в газ при подводе к ней теплоты. При чрезмерно быстром отборе газа, понижении давления в баллоне и недостатке теплоты углекислота охлаждается, скорость ее испарения снижается.
Жидкая двуокись углерода превращается в газ при подводе к ней теплоты. При чрезмерно быстром отборе газа, понижении давления в баллоне и недостатке теплоты углекислота охлаждается, скорость ее испарения снижается.
В состав двуокиси углерода, согласно ГОСТ 8050–85, входит еще водяной пар в количестве не более 0,037 г/м3 для высшего сорта и не более 0,184 г/м3 для 1-го сорта (в 5 раз больше). Содержание водяных паров в двуокиси углерода 2-го сорта не нормируется. Об этом нужно помнить при сварке швов высокого качества, применяя для уменьшения влаги силикагелевые осушители[8].
Транспортируется и хранится углекислота в стальных 40-литровых баллонах под давлением от 60 до 70 кг/см2. В такой баллон вмещается 25 кг жидкой углекислоты, занимающей неполный объем (до 80 %) баллона, остальной объем занят испарившимся газом. Объем газообразного СО2 в баллоне составляет около 13 м3. Цвет баллона черный, надпись желтого цвета.
Достоинства сварки в защитных газах: визуальный контроль процесса, широкий диапазон рабочих режимов сварки, сварка широкой номенклатуры металлов, в том числе цветных и их сплавов, доступность механизации процесса, улучшение гигиенических условий труда сварщиков. Сварка может вестись с дополнительной подачей присадочной проволоки в зону дуги при сварке неплавящимся вольфрамовым электродом.
Смеси газов нередко применяются в производстве для получения швов повышенного качества. В ряде случаев они обладают лучшими технологическими свойствами, чем остальные газы. Смесь CO2 и O2 (2–5 %) обеспечивает мелкокапельный перенос металла, уменьшает разбрызгивание на 30 % и улучшает формирование шва.
Смесь 70 % гелия и 30 % аргона повышает производительность сварки алюминия, увеличивает глубину проплавления, улучшает формирование шва. Смесь газов аргона (88 %) и СO2 (12 %) повышает стабильность дуги при сварке стали, заметно уменьшает и измельчает разбрызгивание металла, улучшает формирование шва за счет существенного снижения поверхностного натяжения жидкого металла из электродной проволоки. Благодаря добавке окислительного газа улучшаются форма и глубина провара, уменьшается количество брызг. При увеличении СO2 до 25–30 % стабильность процесса заметно снижается, а при содержании СO2 до 40–50 % сварка в смеси с аргоном практически мало отличается по электрофизическим характеристикам от сварки в чистом СO2.
Благодаря добавке окислительного газа улучшаются форма и глубина провара, уменьшается количество брызг. При увеличении СO2 до 25–30 % стабильность процесса заметно снижается, а при содержании СO2 до 40–50 % сварка в смеси с аргоном практически мало отличается по электрофизическим характеристикам от сварки в чистом СO2.
ГОСТ 10157-79. Аргон газообразный и жидкий. Технические условия (65335)
1. Объем газообразного аргона в баллоне (Vn) в м3 при нормальных условиях вычисляют по формуле
Vn = K × Vб,
где К – коэффициент для вычисления объема газа в баллоне, приведенный в таблице, учитывающий сжимаемость аргона, давление и температуру газа в баллоне;
Vб – среднестатистическая вместимость баллона, дм3. За среднестатистическую принимают среднее арифметическое вместимостей не менее 100 баллонов.
За среднестатистическую принимают среднее арифметическое вместимостей не менее 100 баллонов.
Значение коэффициента (К) вычисляют по формуле
где Р – давление газа в баллоне, измеренное манометром, кгс/см2;
0,968 – коэффициент пересчета технических атмосфер (кгс/см2) в физические атмосферы;
t – температура газа в баллоне при измерении давления, °С;
Z – коэффициент сжимаемости аргона при температуре t.
Например, при поставке газообразного аргона в баллонах по ГОСТ 949 вместимостью 40 дм3, объем газа в баллоне составляет:
при давлении 150 кгс/см2 при 20 °С
0,155 ´ 40 = 6,20 м3;
при давлении 200 кгс/см2 при 20 °С
0,206 ´ 40 = 8,24 м3.
(Измененная редакция, Изм. № 2).
2. Количество жидкого аргона в цистернах измеряют в тоннах или килограммах.
При переводе массы или объема жидкого аргона в м3 газообразного аргона при нормальных условиях пользуются формулами, указанными ниже.
или ,
где m – масса жидкого аргона, т;
Vж – объем жидкого аргона, дм3.
1,662 – плотность газообразного аргона при нормальных условиях, кг/м3;
1,392 – плотность жидкого аргона при нормальном давлении, кг/дм3.
Коэффициент (К) для вычисления объема газа в баллоне в м3
при нормальных условиях 20 °С и 101,3 кПА (760 мм. рт. ст.)
Температура газа в баллоне, °С | Избыточное давление газа в баллоне, МПа (кгс/см2) | |||||||||||
9,8 | 11,8 | 13,7 | 14,2 | 14,7 | 15,2 | 15,7 | 16,2 | 16,7 | 17,7 | 19,6 | 21,6 | |
(100) | (120) | (140) | (145) | (150) | (155) | (160) | (165) | (170) | (180) | (200) | (220) | |
-50 | 0,157 | 0,193 | 0,231 | 0,240 | 0,249 | 0,258 | 0,267 | 0,276 | 0,284 | 0,300 | 0,331 | 0,363 |
-40 | 0,145 | 0,178 | 0,211 | 0,219 | 0,227 | 0,236 | 0,243 | 0,251 | 0,259 | 0,274 | 0,303 | 0,333 |
-35 | 0,140 | 0,171 | 0,203 | 0,211 | 0,218 | 0,226 | 0,234 | 0,241 | 0,248 | 0,263 | 0,291 | 0,319 |
-30 | 0,135 | 0,165 | 0,195 | 0,203 | 0,210 | 0,217 | 0,224 | 0,232 | 0,239 | 0,253 | 0,280 | 0,307 |
-25 | 0,131 | 0,159 | 0,188 | 0,195 | 0,202 | 0,209 | 0,216 | 0,223 | 0,230 | 0,243 | 0,269 | 0,296 |
-20 | 0,127 | 0,154 | 0,181 | 0,188 | 0,195 | 0,202 | 0,209 | 0,215 | 0,222 | 0,235 | 0,259 | 0,285 |
-15 | 0,123 | 0,149 | 0,175 | 0,182 | 0,189 | 0,195 | 0,202 | 0,208 | 0,215 | 0,227 | 0,252 | 0,276 |
-10 | 0,120 | 0,145 | 0,170 | 0,177 | 0,183 | 0,189 | 0,195 | 0,202 | 0,208 | 0,220 | 0,243 | 0,267 |
-5 | 0,116 | 0,141 | 0,165 | 0,171 | 0,178 | 0,184 | 0,190 | 0,196 | 0,202 | 0,213 | 0,236 | 0,260 |
0 | 0,113 | 0,137 | 0,161 | 0,167 | 0,173 | 0,178 | 0,184 | 0,190 | 0,196 | 0,207 | 0,229 | 0,252 |
+5 | 0,110 | 0,134 | 0,157 | 0,162 | 0,168 | 0,174 | 0,179 | 0,185 | 0,190 | 0,201 | 0,223 | 0,245 |
+10 | 0,108 | 0,132 | 0,153 | 0,158 | 0,164 | 0,169 | 0,175 | 0,180 | 0,185 | 0,196 | 0,217 | 0,238 |
+15 | 0,105 | 0,128 | 0,149 | 0,154 | 0,159 | 0,165 | 0,170 | 0,175 | 0,181 | 0,191 | 0,212 | 0,232 |
+20 | 0,103 | 0,124 | 0,145 | 0,150 | 0,155 | 0,161 | 0,166 | 0,171 | 0,176 | 0,186 | 0,206 | 0,227 |
+25 | 0,101 | 0,121 | 0,142 | 0,147 | 0,152 | 0,157 | 0,162 | 0,167 | 0,172 | 0,182 | 0,201 | 0,221 |
+30 | 0,099 | 0,119 | 0,139 | 0,144 | 0,149 | 0,154 | 0,158 | 0,163 | 0,168 | 0,178 | 0,196 | 0,216 |
+35 | 0,097 | 0,116 | 0,136 | 0,140 | 0,145 | 0,150 | 0,155 | 0,160 | 0,164 | 0,174 | 0,192 | 0,211 |
+40 | 0,095 | 0,114 | 0,133 | 0,137 | 0,142 | 0,147 | 0,152 | 0,156 | 0,161 | 0,170 | 0,188 | 0,206 |
+50 | 0,091 | 0,109 | 0,128 | 0,132 | 0,137 | 0,141 | 0,146 | 0,150 | 0,154 | 0,163 | 0,180 | 0,198 |
Справочное
Значение коэффициента К2 для приведения объема газа к нормальным условиям
Температура, °С | Показания барометра, кПа (мм рт. | |||||||
93,3 | 94,6 | 96,0 | 97,2 | 98,6 | 100,0 | 101.3 | 102,6 | |
(700) | (710) | (720) | (730) | (740) | (750) | (760) | (770) | |
К2 | ||||||||
10 | 0,953 | 0,967 | 0,980 | 0,993 | 1,007 | 1,021 | 1,035 | 1,049 |
12 | 0,946 | 0,960 | 0,974 | 0,985 | 1,000 | 1,014 | 1,028 | 1,042 |
14 | 0,940 | 0,954 | 0,967 | 0,979 | 0,993 | 1,007 | 1,021 | 1,035 |
16 | 0,934 | 0,947 | 0,960 | 0,972 | 0,986 | 1,000 | 1,014 | 1,028 |
18 | 0,927 | 0,940 | 0,954 | 0,966 | 0,979 | 0,993 | 1,007 | 1,021 |
20 | 0,921 | 0,934 | 0,947 | 0,959 | 0,973 | 0,987 | 1,000 | 1,014 |
22 | 0,915 | 0,928 | 0,941 | 0,952 | 0,966 | 0,980 | 0,993 | 1,007 |
24 | 0,908 | 0,921 | 0,934 | 0,946 | 0,960 | 0,973 | 0,986 | 1,000 |
26 | 0,903 | 0,915 | 0,928 | 0,940 | 0,953 | 0,966 | 0,979 | 0,993 |
28 | 0,896 | 0,909 | 0,922 | 0,933 | 0,947 | 0,960 | 0,973 | 0,987 |
30 | 0,890 | 0,903 | 0,916 | 0,927 | 0,941 | 0,954 | 0,967 | 0,980 |
32 | 0,885 | 0,897 | 0,910 | 0,921 | 0,934 | 0,947 | 0,961 | 0,974 |
34 | 0,879 | 0,891 | 0,904 | 0,915 | 0,928 | 0,941 | 0,954 | 0,967 |
35 | 0,876 | 0,889 | 0,901 | 0,912 | 0,925 | 0,938 | 0,951 | 0,964 |
ПРИЛОЖЕНИЕ 2. (Измененная редакция, Изм. № 1).
(Измененная редакция, Изм. № 1).
ПРИЛОЖЕНИЕ 3. (Исключено, Изм. № 2).
Обязательное
ОПРЕДЕЛЕНИЕ ОБЪЕМНОЙ ДОЛИ ВОДЯНЫХ ПАРОВ КОНДЕНСАЦИОННЫМ МЕТОДОМ
Объемную долю водяных паров определяют приборами конденсационного типа с пороговой чувствительностью не выше 1,5 млн-1 (pmm).
Относительная погрешность прибора не должна превышать 10 %.
Метод основан на измерении температуры насыщения газа водяными парами при появлении росы на охлажденной зеркальной поверхности.
Анализ проводят по инструкции, приложенной к прибору.
Объемную долю водяных паров в соответствии с найденной температурой насыщения определяют по табл. 1.
Таблица 1
Объемная доля водяных паров, млн-1(ppm) | Температура насыщения, oС | Объемная доля водяных паров, млн-1(ppm) | Температура насыщения, oС |
2,55 | -70 | 23,4 | -54 |
3,44 | -68 | 31,1 | -52 |
4,60 | -66 | 39,4 | -50 |
6,10 | -64 | 49,7 | -48 |
8,07 | -62 | 63,2 | -46 |
10,6 | -60 | 80 | -44 |
14,0 | -58 | 101 | -42 |
18,3 | -56 | 127 | -40 |
Примечание. Объемная доля, равная 1 млн-1, соответствует 1 ´ 10-4 %.
Объемная доля, равная 1 млн-1, соответствует 1 ´ 10-4 %.
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, относительное расхождение между которыми не превышает допускаемое расхождение, равное 10 %.
Допускаемая относительная суммарная погрешность результата анализа ±25 % при доверительной вероятности Р = 0,95.
ПРИЛОЖЕНИЕ 4. (Измененная редакция, Изм. № 3).
Рекомендуемое
ОПРЕДЕЛЕНИЕ ОБЪЕМНОЙ ДОЛИ СУММЫ УГЛЕРОДСОДЕРЖАЩИХ СОЕДИНЕНИЙ ГАЗОХРОМАТОГРАФИЧЕСКИМИ МЕТОДАМИ
А. Определение объемной доли двуокиси углерода, получаемой при окислении углеродсодержащих соединений окисью меди (по п. 4.6.2 настоящего стандарта).
1. Аппаратура, материалы и реактивы
Хроматограф с детектором по теплопроводности с порогом чувствительности по пропану при газе-носителе гелии не выше 2 ´ 10-5 мг/см3 и газохроматографической колонкой длиной 1,4 м, внутренним диаметром 4 мм, наполненной активным углем.
Концентратор – U-образный. Для изготовления берется трубка из нержавеющей стали 6 ´ 1 мм, длиной 500 мм. Концентратор наполняется измельченным лабораторным стеклом. К концентрату присоединяют стеклянный переходник (черт. 1) с отростком и пробкой для ввода пробы.
Сосуд Дьюара стеклянный, вместимостью около 0,5 дм3.
Счетчик газовый барабанный (с жидкостным затвором) типа РГ-700.
Оборудование вспомогательное для хроматографического анализа:
лупа измерительная по ГОСТ 25706 16х увеличением с ценой деления 0,1 мм;
линейка металлическая по ГОСТ 427;
Стеклянный переходник с пробкой
Черт. 1
набор сит «Физприбор» или сита аналогичного типа; шприцы медицинские инъекционные типа Рекорд по ГОСТ 22967, вместимостью 2, 5, 10 см3;
секундомер механический;
расходомер пенный.
Кислород жидкий технический по ГОСТ 6331.
Гелий газообразный очищенный с объемной долей двуокиси углерода не более 0,0001 %.
Смесь поверочная газовая с объемной долей двуокиси углерода в азоте 0,50 % – ГСО № 3765-87 по Госреестру.
Уголь активный марки СКТ, фракция с частицами размером 0,2 – 0,5 мм высушенный при 150 °С в течение 4 ч.
Стекло лабораторное, измельченное в фарфоровой ступке. Фракцию с частицами размером 0,2 – 0,5 мм промывают горячей дистиллированной водой и высушивают при 150 °С в течение 4 ч.
Сетка медная с размером ячейки 0,1-0,15 мм или волокно стеклянное по ГОСТ 10727.
2. Подготовка к анализу
Газохроматографическую колонку наполняют активным углем; поверх слоя угля укладывают слой стеклянного волокна толщиной 8 – 12 мм. Затем колонку укрепляют в термостате хроматографа и, не присоединяя к детектору, дополнительно высушивают при 150 °С в течение 8 ч в токе газа-носителя при расходе 30 см3/мин.
Скачать бесплатно
Аргон – Плотность и удельный вес
Плотность , ρ, обычно имеет единицы измерения [кг/м3] или [фунт/фут3] и определяется отношением массы к объему вещества:
ρ = m/v [1]
, где m = масса, единицы обычно [кг] или [фунт]
V = объем, единицы обычно [M 3 ] или [FT 3 ]
Специфический вес , γ , обычно имеет единицы измерения [Н/м 3 ] или [фунт f /фут 3 ] определяется отношением веса к объему вещества:
γ = (m * g)/V = ρ * g [2]
, где g = ускорение свободного падения, единицы измерения обычно [ м/с 2 ] и значение на Земле, обычно задаваемое как 9,80665 [м/с 2 ] или 32,17405 [фут/с 2 ]
Табулированные значения плотности аргона при данной температуре и давлении (SI и Имперские единицы), а также конвертация единиц плотности приведены под рисунками.
Фазовая диаграмма аргона
Онлайн-калькулятор плотности аргона
Приведенный ниже калькулятор можно использовать для оценки плотности и удельного веса аргона при заданных температуре и давлении.
Выходная плотность выражается в кг/м 3 , фунтах/футах 3 , фунтах/галлонах (жидких США) и л/футах 3 . Удельный вес указан как Н/м 3 и фунт f / фут 3 .
Температура
Выберите фактическую единицу измерения температуры: °C °F K °R
Выберите фактическое давление: 1 бар абс. / 14,5 фунтов на кв. дюйм; 10 бар абс. / 145 фунтов на кв. дюйм абс.; 50 бар абс. / 725 фунтов на кв. дюйм абс.;
См. также Аргон Теплофизические свойства при стандартных условиях, а также плотность и удельный вес ацетона, воздуха, аммиака, бензола, бутана, углекислого газа, монооксида углерода, этанола, этана этилен, гелий, водород, метан, метанол, азот, кислород, пентан, пропан, толуол и вода.
Плотность сырой нефти , Плотность жидкого топлива , Плотность смазочного масла и Плотность топлива для реактивных двигателей как функция температуры.
Плотность и удельный вес газообразного аргона при различной температуре и атмосферном давлении, СИ и британские единицы:
Плотность аргона при различной температуре и давлении, СИ и британские единицы:
6 Плотность аргон при различной температуре и равновесном давлении, единицы СИ и имперские единицы:
Наверх
Плотность и удельный вес аргона при заданных температурах и давлениях:
Для полной таблицы с плотностью и удельным весом- поверните экран!
State Temperature Pressure Density Specific weight [K] [° C] [° F] [BARA] [PSIA] [MOL/DM 3 ] [MOL/DM 3 ] [MOL/DM 3 ] [MOL/DM 3 ] ,
[kg/m 3 ][lb/ft 3 ] [sl/ft 3 ] [N/m 3 ] [lb f /ft 3 ] Liquid at
equilibrium
83. 81
-187.68 -305.82 0.689 9.99 35.47 1417 88.46 2.749 13896 88.46 90 -183 -298 1.34 19.4 34.52 1379 86.09 2.676 13523 86.09 100 -173 -280 3.24 47.0 32.89 1314 82.03 2.550 12886 82.03 110 -163 -262 6.65 96.5 31.12 1243 77.60 2.412 12190 77.60 120 -153 -244 12.1 176 29.11 1163 72.60 2. 257
11405 72.60 130 -143 -226 20.3 294 26.73 1068 66,67 2,072 10474 66,67 140 -13333333333333333333333333333333333333333333333333333333333333333333333 н.
23.62 943.7 58.91 1.831 9255 58.91 145 -128 -199 38.9 564 21.39 854.3 53.33 1.658 8378 53.33 150 -123 -190 47.4 687 17.03 680.4 42.48 1.320 6672 42.48 150.69 -122.46 -188.43 48.6 705 13. 41
535.6 33.44 1.039 5252 33.44 Gas at
equilibrium
83.81 -187.68 -305.82 0.689 9.99 0.1015 4.055 0.2531 0.008 39.77 0.2531 90 -183 -298 1.34 19.4 0.1861 7.436 0.4642 0.01443 72.92 0.4642 100 -173 -280 3.24 47.0 0.4220 16.86 1.053 0.03271 165.3 1.053 110 -163 -262 6.65 96.5 0.8333 33.29 2.078 0. 06459
326.5 2.078 120 -153 -244 12.1 176 1.505 60.14 3.754 0.1167 589.8 3.754 130 -143 -226 20.3 294 2.593 103.6 6.468 0.2010 1016 6.468 140 -133 -208 31,7 459 4,478 178,9 11,17 0,3471 1754449999127 0,3471 1754449 0,3471 17544499 .0127-128 -199 38.9 564 6.119 244.4 15.26 0.4743 2397 15.26 150 -123 -190 47. 4
687 9.875 394.5 24.63 0.7655 3869 24.63 150.69 -122.46 -188.43 48.6 705 13.41 535.6 33.44 1.039 5252 33.44 Liquid 83.81 -189.34 -308,81 1 14,5 35,47 1417 88,46 2,76 88.46 87.18 -185.97 -302.75 1 14.5 34.95 1396 87.15 2.709 13690 87.15 Gas 87.18 – 185.97 -302. 75
1 14.5 0.1428 5.704 0.3561 0.01107 55.94 0.3561 100 -173 -280 1 14.5 0.1230 4.915 0.3068 0.00954 48.20 0.3068 120 -153 -244 1 14.5 0.1016 4.058 0.2533 0.00787 39.80 0.2533 140 -133 -208 1 14.5 0.08664 3.461 0.2161 0.00672 33.94 0.2161 160 -113 -172 1 14.5 0.07560 3,020 0,1885 0,00586 29,62 0,1885 180 -93. 2
180 -93.2 180 -93,2 180 -93,2 180 -93.2 180 -93.2180 –.0146 14.5 0.06709 2.680 0.1673 0.00520 26.28 0.1673 200 -73.2 -99.7 1 14.5 0.06030 2.409 0.1504 0.00467 23.62 0.1504 220 -53.2 -63.7 1 14.5 0.05480 2.189 0.1367 0.00425 21.47 0.1367 240 -33.2 -27.7 1 14.5 0.05019 2.005 0.1252 0.00389 19.66 0.1252 260 -13. 2
8.3 1 14.5 0.04631 1.850 0.1155 0.00359 18.14 0.1155 280 6.9 44.3 1 14.5 0.04298 1.717 0.1072 0.00333 16.84 0.1072 300 26.9 80.3 1 14.5 0.04013 1.603 0.1001 0.00311 15.72 0.1001 320 46.9 116 1 14.5 0.03760 1.502 0.0938 0.00291 14.73 0.094 340 66.9 152 1 14,5 0,03540 1,414 0,08827 0,00274 13,87 0,083936 13,87 0,08393 7747777777777777777777777777777777777777777777777777777777749н. 0127
86.9 188 1 14.5 0.03342 1.335 0.08334 0.00259 13.09 0.0833 400 127 260 1 14.5 0.03006 1.201 0.07498 0.00233 11.78 0.0750 500 227 440 1 14.5 0.02405 0.9608 0.05998 0.00186 9.422 0.0600 600 327 620 1 14.5 0.02004 0.8006 0.04998 0.00155 7.851 0.0500 700 427 800 1 14.5 0.01718 0.6862 0.04284 0. 00133
6.729 0.0428 800 527 980 1 14.5 0.01503 0.6004 0.03748 0.00116 5.888 0.0375 900 627 1160 1 14,5 0,01336 0,5377777777 6 0,537777777777 6 0,537777777777779696 360,5377 70127 6 0,537777777777777769676 .0127 0.00104 5.234 0.0333 1000 727 1340 1 14.5 0.01202 0.4803 0.02998 0.00093 4.710 0.0300 Жидкость 84,04 -189,11 -908,110127 10 145 35. 50
1418 88.52 2.751 13906 88.52 100 -173 -280 10 145 32.94 1316 82.16 2.553 12906 82.16 116.6 -156.55 -249.79 10 145 29.81 1191 74.35 2.311 11680 74.35 Gas 116.6 -156.55 -249.79 10 145 1.240 49.55 3.093 0.09614 485.9 3.093 120 -153 -244 10 145 1.182 47.20 2.947 0.09158 462.9 2.947 140 -133 -208 10 145 0. 9450
37.75 2.357 0.07325 370.2 2.357 160 -113 -172 10 145 0,7993 31.93 1,9 11111111111111 1911 1 1 119999999999999999999999999999999999999999999999999999999999999999999999979а 31, 1,9999 .0146 313.1 1.993 180 -93.2 -136 10 145 0.6967 27.83 1.737 0.05400 272.9 1.737 200 – 73.2 -99.7 10 145 0.6193 24.74 1.544 0.04800 242.6 1.544 220 -53.2 -63.7 10 145 0.5585 22. 31
1.393 0.04329 218.8 1.393 240 -33.2 -27.7 10 145 0.5089 20.33 1.269 0.03945 199.4 1.269 260 -13.2 8.3 10 145 0.4679 18.69 1.167 0.03626 183.3 1.167 280 6.9 44.3 10 145 0.4331 17.30 1.080 0.03357 169.7 1.080 300 26.9 80.3 10 145 0.4033 16.11 1.006 0.03126 158.0 1.006 320 46.9 116 10 145 0. 3775
15.08 0.9414 0.02926 147.9 0.9414 340 66.9 152 10 145 0.3547 14.17 0.8846 0.02749 139.0 0.8846 360 86.9 188 10 145 0.3347 13.37 0.8347 0.02594 131.1 0.8347 400 127 260 10 145 0.3006 12.01 0.7498 0.02330 117.8 0.7498 500 227 440 10 145 0.2401 9.593 0.5989 0.01861 94.08 0.5989 600 327 620 10 145 0. 2000
7.988 0.4987 0.01550 78.34 0.4987 700 427 800 10 145 0.1714 6.846 0.4274 0.01328 67.14 0.4274 800 527 980 10 145 0.1499 5.990 0.3739 0.01162 58.74 0.3739 900 627 1160 10 145 0.1333 5.325 0.3324 0.01033 52.22 0.3324 1000 727 1340 10 145 0.1200 4.793 0.2992 0.00930 47.00 0.2992 Liquid 100 -173 -280 50 725 33. 34
1332 83.15 2.584 13062 83.15 Supercritical
phase
200 -73.2 -99.7 50 725 3.534 141.2 8.814 0.2739 1385 8.814 300 26.9 80.3 50 725 2.060 82.28 5.136 0.1596 806.9 5.136 400 127 260 50 725 1,502 60,01 3,746 0,1164 588,5 3,746 7777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777779н.0127227 440 50 725 1.191 47.59 2. 971
0.09235 466.7 2.971 600 327 620 50 725 0.9899 39.54 2.469 0.07673 387.8 2.469 700 427 800 50 725 0.8477 33.87 2.114 0.06571 332.1 2.114 Liquid 86.27 -187 – 304 100 1450 35,75 1428 89,15 2,771 14004 89.15 77777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777777r770144100 -173 -280 100 1450 33. 77
1349 84.22 2.617 13229 84.22 120 -153 -244 100 1450 30,59 1222 76,29 2,371 11984 76,299 7777777777777777777777777777777777777777777777777777777777777777777777779нP.0146 -208100 1450 26.68 1066 66.55 2.068 10454 66.55 Supercritical
phase160 -113 -172 100 1450 20.87 833.6 52.04 1.617 8175 52.04 180 -93.2 -136 100 1450 12.31 491.9 30.71 0.9544 4824 30. 71
200 -73.2 -99.7 100 1450 8.453 337.7 21.08 0.6552 3312 21.08 220 -53.2 -63.7 100 1450 6.781 270.9 16.91 0.5256 2657 16.91 240 -33.2 -27.7 100 1450 5.788 231.2 14.43 0.4486 2267 14.43 260 -13.2 8.3 100 1450 5.107 204.0 12.74 0.3958 2001 12.74 280 6.9 44.3 100 1450 4.596 183. 6
11.46 0.3562 1801 11.46 300 26.9 80.3 100 1450 4.195 167.6 10.46 0.3252 1644 10.46 320 46.9 116 100 1450 3.870 154.6 9.651 0.3000 1516 9.651 340 66.9 152 100 1450 3.597 143.7 8.971 0.2788 1409 8.971 360 86.9 188 100 1450 3.364 134.4 8.390 0.2608 1318 8.390 400 127 260 100 1450 2. 989
119.4 7.454 0.2317 1171 7.454 500 227 440 100 1450 2.355 94.09 5.874 0.1826 922.7 5.874 600 327 620 100 1450 1.953 78.03 4.871 0.1514 765.2 4.871 700 427 800 100 1450 1450 1450 1450 1450 .01274.170 0.1296 655.1 4.170 800 527 980 100 1450 1.464 58.47 3.650 0. 1135
573.4 3.650 900 627 1160 100 1450 1,302 52,03 3,248 .01127 3,248 .101111111111127 3,248 0,101127 3,248 0,101127 3,248 0,10127 .0146 510.23.248 1000 727 1340 100 1450 1.174 46.88 2.927 0.09096 459.7 2.927 Сверхкритическая
фаза200 -73,2 -100 9 1012714500 30.37 1213.1 75.73 2.354 11897 75.73 300 26. 9
80.3 1000 14500 24.15 964.8 60.23 1.872 9462 60.23 400 127 260 1000 14500 19.71 787.4 49.15 1.528 7722 49.15 500 227 440 1000 14500 16.61 663.4 41.42 1.287 6506 41.42 600 327 .0127 5630 35.84 700 427 800 1000 14500 12.70 507.1 31.66 0.9840 4973 31.66 Back to top
Преобразование единиц плотности:
Преобразователь плотности
килограмм/кубический метр [кг/м 3 ] = грамм/литр [г/л], килограмм/литр [кг/л] = грамм/кубический сантиметр [ г/см 3 ]= тонна (метрическая)/кубический метр [т/м 3 ], раз/галлон (жидкость США) [унция/галлон (жидкость США)] фунт/кубический дюйм [фунт/дюйм 3 ], фунт/кубический фут [фунт/фут 3 ], фунт/галлон (Великобритания) [фунт/галлон (Великобритания)], фунт/галлон (жидкость США) [фунт/галлон (жидкость США)], порция/кубический фут [ л/фут 3 ], тонна (короткая)/куб.
ярд [тонна (короткая)/ярд 3 ], тонна (длинная)/куб. = 1 кг/л = 1000 кг/м 3 = 62,428 фунт/фут 3 = 0,03613 фунт/дюйм 3 = 1,9403 sl/ft 3 = 10,0224 фунта/галлона (Великобритания) = 8,3454 фунта/галлона (US liq) = 0,5780 унций/дюйм G/L = 1 кг/м 3 = 0,001 кг/л = 0,000001 кг/см 3 = 0,001 г/см 3 = 0,99885 унции/фут 3 = 0,0005780 унции/в 3 = 0,16036. унция/гал (Великобритания) = 0,1335 унции/гал (жидкость США) = 0,06243 фунт/фут 3 = 3,6127×10-5 фунт/дюйм 3 = 1,6856 фунт/ярд 3 = 0,010022 фунт/галлон (Великобритания) = 0,0083454 фунта/галлона (жидких США) = 0,0007525 тонны (длинной)/ярд 3 = 0,0008428 тонн (короткий)/YD 3
1 кг/л = 1 г/см 3 = 1000 кг/м 3 = 62,428 фунт/фут 3 = 0,03613 фунт/в 3 = 1,9403 SL/FT 3 = 8,3454 фунт/галлон (US LIQ) = 0,5780 унции/в 3 = 0,7525 тонны (длину)/YR 3 1 KG/M 3 = 1.
G/L = 0,001 кг/л = 0,000001 кг/см 3 = 0,001 г/см 3 = 0,99885 унции/фут 3 = 0,0005780 унции/в 3 = 0,16036 унции/гал (Великобритания) = 0,1335 унция/гал (жидкость США) = 0,06243 фунта/фут 3 = 3,6127×10-5 фунтов/дюйм 3 = 1,6856 фунтов/ярд 3 = 0,010022 фунтов/галлон (Великобритания) = 0,008345 фунтов/галлон (США жидких) = 0,0010 1 0007525 тонны (1 0007525 длинных) = 0,0008428 тонна (короткая)/YD 3
1 фунт/фут 3 = 27 фунтов/я. 3 = 0,01602 г/см 3 = 0,1605 фунта/галлона (Великобритания) = 0,1349 фунта/галлона (жидкости США) = 2,5687 унций/галлона (Великобритания) = 2,1389 унций/галлона (жидкости США) = 0,01205 тонны (длинная )/ярд 3 = 0,0135 тонны (короткая)/ярд 3 1 фунт/галлон (Великобритания) = 0,8327 фунта/галлон (жидкость США) = 16 унций/галлон (Великобритания) = 13,323 унции/галлон (жидкость США) = 168. 179 lb/yd 3 = 6.2288 lb/ft 3 = 0.003605 lb/in3 = 0.05767 oz/in 3 = 99.7764 kg/m 3 = 0.09977 g/cm 3 = 0.07508 ton( длинная)/ярд 3 = 0,08409 тонны (короткая)/ярд 3
1 фунт/галлон (США, жидк.) = 1,2009 фунт/галлон (Великобритания) = 19,215 унций/галлон (Великобритания) = 16 унций/гал( США жидк.) = 201,97 фунтов/яд 3 = 7,4805 фунт/фут 3 = 0,004329 фунт/дюйм = 0,06926 унции/в 3 = 119,826 кг/м 3 = 0,1198 г/см 3 = 0,09017 3 = 0,1198 г/см 3 = 0,09017 3 -й. Long)/YD 3 = 0,1010 тонн (коротко)/YD 3 1 фунт/в 3 = 1728 фунтов/фут 3 = 46656 фунтов/я. = 27680 кг/м 3 = 27,680 г/см 3 = 277,419 фунтов/гал (Великобритания) = 231 фунт/галлон (США, жидк.) = 4438,7 унций/гал (Великобритания) = 3696 унций/гал (США, жидк. ) = 20,8286 тонн (длинных)/ярд 3 = 23,3280 тонна (короткая)/YD 3
1 унция/галлон (Великобритания) = 0,8327 унции/галлон (US LIQ) = 6,2360 кг/м 3 = 6,2288 унции/FT 3 = 0,3893. LB/FT 3 = 10,5112 фунт/YD 3 1 унция/галлон (LIQ) = 1,2009 унции/Гал (Великобритания) = 7,4892 кг/м 3 = 7,4805 унции/FT 3 = 0,4675. фунт/фут 3 = 12,6234 фунт/ярд 3 1 узл/фут 3 = 515,3788 кг/м79 унций/дюйм 3 = 32,1741 фунт/фут 3 = 82,645 унций/гал (Великобритания) = 68,817 унций/галлон (США, жидк.) 1 тонна (длинная)/ярд 3 900,11 2 = 1 /yd 3 = 1328,94 кг/м 3 = 0,7682 унции/в 3 = 82,963 фунт/фут 3 = 2240 фунт/я. (Великобритания) = 11,0905 фунта/галлона (жидкость США) 1 тонна (короткая)/ярд 3 = 0,8929 тонна (длинная)/ярд 3 = 1186,55 кг/м 3 5 = 9 унций/дюйм0010 3 = 74,074 фунт/фут 3 = 2000 фунт/яв. Формула газообразного аргона. Структура, свойства, использование, примеры вопросов
Аргон — химический элемент с атомным номером 18. Он принадлежит к 18-й группе периодической таблицы и является третьим по величине газом аргоном. Газ, используемый в люминесцентных лампах, представляет собой одноатомный аргон. Он имеет молекулярную формулу Ar. Аргон — негорючий газ, не имеющий цвета и запаха и имеющий более высокую плотность, чем воздух. Когда он подвергается сильному нагреванию или огню, материал сильно разрывается. Аргон — первый обнаруженный нобелевский газ. Его признали английский физик лорд Рэлей и шотландский ученый Уильям Рамсей в 189 г.4. Аргон происходит от греческого слова «аргос», что означает «ленивый» или «неактивный». Он имеет место с респектабельным газом и составляет около 0,93% земного воздуха. Это третий по распространенности газ в воздухе.
Формула газа аргона
Его химическая формула – Ar. Он имеет молекулярную массу 39,948 г/моль.
Это стабильный газ, он не имеет цепной структуры. Однако существует газовая структура аргона, показывающая орбиты,
Наличие аргона
Мировой климат устанавливается на уровне около 0,934% по объему и 1,288% по массе. Кроме того, воздух является важным современным источником дезинфицирующих аргоновых изделий. С помощью фракционирования предприятия отделяют аргон от воздуха, и чаще всего криогенная частичная очистка представляет собой взаимодействие, при котором образуются другие чистые газы, такие как азот, неон, ксенон и кислород. Морская вода содержит 0,45 частей на миллион аргона, а окружающая среда содержит около 1,2 частей на миллион аргона.
Производство аргона
Механически они производят его путем частичной очистки жидкого воздуха. Аргон — это инертный защитный газ, который мы по большей части используем при сварке и других современных циклах, требующих высокой температуры, при которой нормальные безжизненные вещества становятся чувствительными, как в графитовых электрических нагревателях, которые используют его, чтобы предотвратить потребление графита.
Свойства газообразного аргона
Аргон как элемент обладает набором свойств, которые отличают его от других элементов периодической таблицы и даже от других благородных газов. Эти свойства включают его атомные свойства, физические свойства и химические свойства.
Атомные свойства аргона
Атомные свойства аргона относятся к качествам одного атома аргона. К ним относятся:
- Атомный номер: 18
- Атомная масса: 39,948
- Число электронов: 18
- Валентность (степени окисления): 0
- Распространенные изотопы: аргон-36, аргон-803 9, аргон-803, 38, 38
Физические свойства газообразного аргона
- Температура плавления аргона составляет -189 °С, а температура кипения -185,7 °С. Это означает, что он существует в виде газа при стандартных условиях.
- Газообразный аргон бесцветен, не имеет вкуса и запаха
- Как неметалл, агрон имеет очень низкую металличность и является плохим проводником тепла и электричества
- Плотность аргона составляет 0,00178 г на кубический сантиметр
- Аргон в 2,5 раза более растворим в воде, чем азот, и имеет одинаковую растворимость в воде с кислородом.
Химические свойства газообразного аргона
- Известно, что аргон химически неактивен. В некоторых редких случаях и в экстремальных условиях он образует слабые, сложные структуры.
- Поскольку этот элемент не проявляет никакой химической активности, его называют инертным газом.
Использование аргона
- Он используется при сварке для предотвращения возгорания графита.
- Используется в люминесцентных лампах и других газоразрядных лампах.
- Аргоноплазменная коагуляция использует проводящую электричество аргоновую плазму в качестве среды для подачи высокочастотного тока для коагуляции ткани. Бесконтактная функция обеспечивает быструю коагуляцию с минимальными манипуляциями и травмами ткани-мишени.
Примеры вопросов
Вопрос 1. Является ли аргон металлом или неметаллом?
Ответ:
Аргон — неметаллический элемент.
Он находится в группе 18 (VIIIa) периодической таблицы элементов, которую также называют группой благородных газов.
Вопрос 2: Какова химическая формула аргона?
Ответ:
Аргон (Ar) — химический элемент, относящийся к группе 18 (благородные газы) периодической таблицы. Это самый распространенный и широко используемый благородный газ на планете.
Вопрос 3: Каковы 5 применений аргона?
Answer:
Five Uses of argon in human society include the following:
- Inside light bulbs
- Semiconductor manufacturing
- Welding
- Medical lasers
- Geological dating
Question 4: Вреден ли аргон для человека?
Ответ:
Аргон естественным образом присутствует в окружающей среде и обычно считается нетоксичным.
Однако воздействие высоких концентраций аргона может снизить доступность кислорода в воздухе и, таким образом, вызвать удушье. Жидкий аргон также очень холодный и может вызвать обморожение при контакте.
Вопрос 5: Как рассчитать молярную массу аргона?
Ответ:
Масса аргона (Ar) составляет 39,948 г/моль. Формула расчета молярной массы заключается в делении массы конкретного химического элемента или химического соединения (г) на количество вещества (моль). В результате молярная масса аргона (Ar) становится равной 39,948 г/моль.
Вопрос 6: Используется ли аргон в медицине?
Ответ:
Аргон также использовался как надежный инструмент в клинической практике. Аргоноплазменная коагуляция (APC) — это бесконтактная стратегия, в которой используется часто повторяющееся ощущение аргоновой плазмы для закрытия окружающих тканей и контроля дренирования вокруг важных мест посредством коагуляции.
Судьба субдуцируемого аргона в глубокой мантии
Abstract
Исследованы физические свойства аргона (Ar) до 382 ГПа и 3000 K с использованием экспериментов с алмазной наковальней и первых принципов молекулярной динамики. Расчетная плотность Ar меньше плотности мантии Предварительной эталонной модели Земли (PREM), что указывает на то, что пересечение плотности не происходит на дне нижней мантии. Выявлена большая объемная зависимость теплового давления Ar при давлениях выше 200 ГПа, а также подтверждена значительная температурная зависимость рассчитанных эффективных параметров Грюнайзена при высоких давлениях. По данным расчета оценена температура плавления Ar и подтверждена существенная зависимость от давления. Если траектория давление-температура субдуцируемой плиты ниже критического состояния, ~750 K и ~7,5 ГПа, твердый Ar может быть унесен в глубокие слои мантии. Плавление твердого Ar в восходящем мантийном плюме происходит на дне переходной зоны.
Таким образом, твердый Ar играет важную роль в рециркуляции Ar в недрах Земли.
Введение
Известно, что благородные газы являются ключевыми индикаторами для понимания эволюции Земли из-за их инертной природы и вариаций изотопов. Однако вопрос о механизме рециркуляции благородных газов в глубинной мантии остается открытым. Поскольку благородные газы инертны, не ожидается, что какие-либо вмещающие фазы благородных газов будут переноситься в глубокие слои мантии. Поэтому обсуждалась роль границ зерен в хранении инертных газов 9.0010 1,2 . Недавно экспериментальное исследование показало высокую растворимость инертных газов в амфиболе 3 . Амфибол обычно наблюдается в измененной океанической коре со значительным количеством инертных газов, измеренным в образцах природных пород с участков 4 Программы океанического бурения. Амфибол имеет минералогическую А-позицию, энергетически выгодную для инертных газов. Решетчатые структуры некоторых водосодержащих минералов, таких как серпентин и хлорит, аналогичны А-сайту амфибола.
Это указывает на то, что эти водосодержащие минералы являются кандидатами на роль фаз-хозяев благородных газов. На самом деле, Кендрик и др. . 5 измерил концентрацию изотопов инертных газов в метаморфических породах и обнаружил, что сигнатура инертных газов в серпентинитах отражает сигнатуру морской воды. Поскольку разрушение серпентина заканчивается в верхней части верхней мантии (глубина ~200 км), его трудно транспортировать на большие глубины в глубокой мантии.
Аргон является благородным газом и имеет три изотопа: 36 Ar, 38 Ar и 40 Ar. Холланд и Баллентайн 6 предположил, что Ar из мантии идентичен компоненту морской воды, используя изотопный анализ. Это указывает на то, что рециркуляция морской воды доминирует в поведении Ar в мантии. Напротив, систематический анализ изотопов инертных газов показывает, что базальт океанических островов имеет первичную подпись, отличную от атмосферного компонента 7 .
Циркуляция Ar между поверхностью Земли и глубокой мантией обсуждалась с использованием изотопных данных благородных газов. Однако понять механизм рециркуляции Ar сложно из-за недостатка знаний о физико-химических свойствах Ar при высоких давлениях и температурах.
Экспериментальные и теоретические исследования благородных газов представляют большой интерес для физики и химии из-за их электронной конфигурации с замкнутой оболочкой и инертной природы. Известно, что твердые вещества инертных газов являются подходящими кандидатами в качестве эталона внутреннего давления в исследованиях рентгеновской дифракции при высоком давлении с использованием ячеек с алмазными наковальнями. Твердые частицы благородных газов также оказались превосходной средой гидростатического давления в экспериментах с алмазными наковальнями. Ar затвердевает при ~1 ГПа, и известно, что Ar является хорошим материалом стандарта внутреннего давления по двум причинам стабильности гранецентрированной кубической структуры Ar в широком диапазоне, по крайней мере, до 114 ГПа 8 , и его высокая температура плавления по сравнению с большинством других металлов 9 .
Уравнение состояния (УС) Ar было исследовано в предыдущих экспериментальных исследованиях 10,11,12,13,14,15,16 , а кривая плавления Ar была определена до 750 K в экспериментах 17 . Однако надежные данные при более высоких температурах до сих пор отсутствуют из-за трудностей стабильного нагрева и измерения температуры в экспериментах при высоких давлениях. В последнее время первопринципные расчеты используются для исследования физических свойств материалов при высоких давлениях и температурах. Таким образом, расчеты молекулярной динамики из первых принципов, используемые в этом исследовании, имеют значительные преимущества для высокотемпературных исследований для изучения теплофизических свойств материалов.
В этом исследовании мы используем теорию функционала плотности для изучения температуры плавления и термических свойств Ar. Мы также проводим эксперименты при высоком давлении, чтобы определить отношение давления к объему Ar при комнатной температуре.
Сочетание экспериментов при высоком давлении и расчетов молекулярной динамики из первых принципов позволяет нам определить надежные физические свойства, такие как уравнение состояния и температура плавления, в широком диапазоне давлений и температур.
Экспериментальные результаты
Данные об объемном давлении для Ar были получены при сжатии и декомпрессии (дополнительная таблица 1). Гистерезиса между сжатием и разжатием не наблюдалось, поскольку измерения проводились после лазерного отжига для уменьшения дифференциального напряжения образца при изменении давления (рис. 1). Подгонка данных объемного давления с использованием Vinet EOS 18 дала значения объемного модуля B T 0 = 1,07 (±1,33) ГПа и B ′ T 0 = 8,02(±0,95), как показано в дополнительной таблице 2. Ar со структурой ГЦК, полученной при сжатии и разжатии соответственно. Синие кружки указаны Россом и др. . 12 . Пунктирная линия обозначает аппроксимированную кривую с использованием Vinet EOS.
Изображение в полный размер
Параметры упругости Ar при комнатной температуре неоднократно исследовались в предыдущих исследованиях (дополнительная таблица 3). Однако заметное несоответствие, особенно громкости в условиях окружающей среды ( V 0 ), среди предыдущих исследований было подтверждено. Возможная причина этого несоответствия заключается в том, что Ar не является твердым в условиях окружающей среды. Это указывает на то, что кривая объемного давления должна быть экстраполирована из данных высокого давления для оценки параметров упругости в условиях окружающей среды. Следовательно, параметры упругости, о которых сообщалось в предыдущих исследованиях, могут иметь значительные погрешности. Преимуществом нашего исследования было то, что экспериментальные условия имели широкий диапазон давлений до 137 ГПа. Наши значения в целом согласуются с теми, о которых сообщил Росс 9.0061 и др. . 12 .
Результаты расчетов
Расчеты проводились при 1–382 ГПа и 300–3000 К (рис.
Рисунок 22). При высоких температурах ГЦК-структура твердого Ar не была стабильной (кружки и треугольники на рис. 2). Это указывало на то, что жидкий Ar стабилен при высоких температурах. Данные объемного давления и температуры твердого аргона использовались для анализа уравнения состояния (квадраты на рис. 2).
Условия давление-температура, в которых выполнялась ab initio молекулярная динамика (AIMD). Синие квадраты и красные кружки обозначают условия, при которых ГЦК-структура была стабильной и нестабильной соответственно. Оранжевые треугольники обозначают промежуточные состояния между стабильным и нестабильным состояниями. Штриховая и сплошная линии обозначают кривую плавления, полученную из AIMD в этом исследовании, и экспериментальные данные из Datchi 9.0061 и др. . 17 . На вставке показаны все условия, при которых выполнялась AIMD.
Изображение полного размера
На рис. 3 показана взаимосвязь между тепловым давлением и объемом.
Рисунок 3При низких температурах зависимость теплового давления от объема была малой. Напротив, объемная зависимость была значительной при температурах выше 2000 К. Значительная зависимость теплового давления от температуры указывает на то, что параметр Грюнайзена имеет большую температурную зависимость при более высоких температурах, подобно поведению металлов и ионных кристаллов 19,20 . Рассчитанный коэффициент теплового расширения показан на рис. 4. Коэффициент и его зависимость от температуры уменьшаются с увеличением давления, что соответствует общему поведению твердых веществ.
График теплового давления, рассчитанный AIMD. Сплошные кружки обозначают рассчитанные тепловые давления от 500 K до 3000 K. Результаты показаны для 10, 20, 50, 100 и 400 ГПа.
Изображение полного размера
Традиционный анализ уравнения состояния твердого тела часто исключает ангармонический эффект. Однако известно, что ангармоническим эффектом нельзя пренебречь при высоких температурах.
Поэтому мы исследуем параметр Грюнайзена для оценки ангармонического эффекта. Параметр Грюнайзена может быть получен в наших расчетах из
$$\gamma =\frac{V{P}_{th}}{{E}_{th}}$$
(1)
, где E -й – разность внутренней энергии. Эффективный параметр Грюнайзена можно записать следующим образом
$${\gamma}_{eff}(V,T)={\gamma}_{qh}(V)-a(V,T)$$
(2)
где γ qh (V) и a(V, T) — квазигармонический параметр Грюнайзена и член внутреннего ангармонизма соответственно. Если ангармоническим эффектом можно пренебречь, то эффективный параметр Грюнайзена не меняется при высоких температурах. Поэтому мы рассчитали эффективный параметр Грюнайзена при различных объемах и температурах. На рис. 5 показана температурная зависимость эффективного параметра Грюнайзена. Ангармонический эффект был значительным при низких давлениях и уменьшался с увеличением давления. Это указывает на то, что традиционный анализ уравнения состояния, такой как квазигармоническое приближение, имеет значительную неопределенность в определении уравнения состояния Ar при высоких температурах.
Рисунок 5Влияние ангармонизма на параметр Грюнайзена. Сплошные кружки обозначают рассчитанный эффективный параметр Грюнайзена при 1000, 2000 и 3000 K из расчетов AIMD. Сплошные линии обозначают подобранные кривые с использованием логарифмической функции.
Полноразмерное изображение
Обсуждение
На рисунке 6 показано сравнение плотностей Ar и PREM 21 . Разница плотностей между Ar и PREM значительна в верхней мантии и переходной зоне. Напротив, разность плотностей уменьшается по мере увеличения глубины нижней мантии. Однако плотность Ar меньше, чем плотность PREM в мантийном состоянии. Джефкоут 13 сообщил, что переход плотности между Ar и PREM ожидался на дне нижней мантии, что не согласуется с нашим исследованием. Это несоответствие может быть связано с объемным модулем, использованным в предыдущем исследовании 13 . Значение 3,03 ГПа, указанное в Anderson and Swenson 10 , использовалось для оценки плотности Ar.
Рисунок 6Напротив, недавние исследования показали, что это значение составляет ~ 1 ГПа (дополнительная таблица 3). Поэтому Jephcoat 13 завысил плотность Ar в нижней мантии.
Плотность твердой мантии Ar и PREM. Синие, черные и красные линии обозначают плотности ГЦК-Ar, ГПУ-Fe 32 и эталонной модели мантии, предложенной Дзиевонски и Андерсоном 21 . Погрешность ГЦК-Ar составляет ~0,01 г/см 3 на глубине подошвы нижней мантии.
Увеличить
Температура плавления Ar быстро возрастает по сравнению с мантийной геотермой (рис. 7). Поскольку переход между температурой плавления Ar и мантийной геотермой находится на дне переходной зоны, Ar может находиться в твердом состоянии в нижней мантии. В случае погружаемой плиты температура в плите ниже, чем в мантийной геотерме. Следовательно, глубина стабильности твердого Ar распространяется на более мелкие области мантии. В соответствии с соотношением между температурой плавления Ar, траекторией P-T плиты и полем стабильности серпентина ожидается механизм переноса Ar в глубокую мантию.
Рисунок 7Критическое условие P-T составляет ~ 750 K и ~ 7,5 ГПа, что является пересечением между температурой плавления Ar и пределом стабильности серпентина.
Сравнение с кривой плавления Ar, P-T пределом серпентина, мантийной геотермой и P-T путями погружающихся плит. Змеевидные и геотермальные линии получены от Ulmer и Trommsdort 33 и Ono 34 соответственно. Штриховые линии — гипотетические траектории Т-П холодных и горячих плит.
Изображение в полный размер
На рис. 8 схематически показан глубокий аргоновый цикл. Значительное количество Ar удерживается водными минералами, такими как амфибол, в измененной океанической коре. Вмещающей фазой для Ar может быть серпентин на глубине средней части верхней мантии. Происходит реакция дегидратации серпентина, и большая часть обезвоженного флюида отделяется от погружаемой плиты. В случае высокотемпературного плитного P-T-тракта Ar, выделяющийся из серпентина, находится в жидком состоянии и выходит из плиты, сопровождаемой миграцией обезвоженной жидкости.
Рисунок 8Это указывает на то, что поведение Ar является несовместимым элементом. Затем Ar циркулирует в более мелководной части верхней мантии в зоне субдукции. В случае низкотемпературного плитного P-T пути высвобождающийся Ar находится в твердом состоянии и остается в породе после дегидратации серпентина. Твердый Ar может переноситься в глубинную мантию, даже если температура плиты приближается к мантийной геотерме, поскольку температура плавления Ar выше, чем геотерма в нижней мантии (рис. 7). После циркуляции субдуктированных плит в нижней мантии часть их выносится из нижней мантии в переходную зону восходящим мантийным потоком, например, под горячие точки. Когда восходящий поток проходит через границу между нижней мантией и переходной зоной, твердый Ar может расплавиться и отделиться от породы. Если силикат плавится или существует водная жидкость, жидкий Ar растворяется в них. Поэтому Ar не может оставаться в породе, а перенос Ar контролируется миграцией расплава или флюида в переходной зоне и верхней мантии.
Глубокая циркуляция аргона. (1) Гидротермальная циркуляция на морском дне вызывает образование амфибола, включающего Ar, в А-сайтах. (2) Разрушение серпентина дает водный флюид. (3) Вертикальный перенос жидкого аргона, сопровождающего водную жидкость, если температура плиты выше, чем критическое условие P-T. (4) Твердый аргон мигрирует в глубокую мантию в субдуктивной плите, если температура плиты ниже критического P-T условия. 5. Плавление твердого Ar происходит в восходящем потоке на глубине, соответствующей границе между переходной зоной и нижней мантией.
Изображение в полный размер
Методы
Эксперименты по дифракции рентгеновских лучей под высоким давлением проводились с использованием аппарата высокого давления с алмазной наковальней, нагреваемой лазером. В качестве исходных материалов использовали чистый газ Ar (чистота 99,999%) и порошок золота (чистота 99,5%). Сначала в камеру для образцов помещали небольшое количество тонкодисперсного порошка золота для поглощения лазерного излучения и создания источника тепла, а золото также использовали в качестве калибранта внутреннего давления.
Затем в камеру для образцов криогенно загружали Ar. Исходный материал прессовали при комнатной температуре с помощью симметричных или автоматических ячеек с алмазными наковальнями 9.0010 22,23 . Поскольку дифференциальное напряжение при сжатии при комнатной температуре вызывает значительное систематическое смещение взаимосвязи между давлением и структурными свойствами, образцы нагревали после каждого изменения давления с помощью инфракрасного лазера, чтобы уменьшить любое дифференциальное напряжение в образце (дополнительный рисунок S1). Температура и продолжительность отжига составляли 1000–2000 К и 3–5 мин соответственно. Образцы исследовались методом порошковой дифракции рентгеновских лучей с угловой дисперсией на линиях синхротронного пучка AR-NE1A на Фотонной фабрике или BL10XU на SPring-8. Экспериментальные установки для синхротронных рентгеновских измерений описаны в другом месте 9.0010 24,25 . В обеих линиях синхротронного пучка использовался монохроматический падающий рентгеновский пучок.
Рентгеновские лучи коллимировались до диаметра 20–30 мкм при давлении ниже 60 ГПа и <10 мкм при более высоком давлении. Мы отслеживаем распределение интенсивности рентгеновского луча, прошедшего через ЦАП, сканируя предметный столик ЦАП, чтобы точно отрегулировать положение образца в соответствии с положением рентгеновского луча. Изображение образца и отверстия прокладки отражаются на полученной двумерной карте интенсивности прошедшего рентгеновского излучения. Эта рентгеновская карта использовалась для установки образца в положение рентгеновского луча. Угловые рентгеновские дифрактограммы получали на фотопластинках. Наблюдаемые интенсивности на фотопластинках интегрировали как функцию 2θ для получения обычных одномерных дифракционных профилей. Для определения объемов элементарных ячеек Ar и золота для расчета использовали 3–5 линий (111), (200), (220), (311), (222). Давление определялось по объему элементарной ячейки золотого порошка в ячейке с алмазной наковальней с использованием уравнения уравнения состояния, описанного Дорогокупцом и Деваэле 9.
0010 26 . Параметры уравнения состояния для твердого аргона были получены методом наименьших квадратов с данными давления-объема Vinet EOS 18 .
Основные расчеты, выполненные в этом исследовании, были основаны на теории функционала плотности с использованием Венского пакета моделирования Ab initio (VASP) 27 . Для обменно-корреляционного потенциала функционал PBE-sol использовался в расчетах приближения обобщенного градиента (GGA) 28 . Электронные волновые функции были разложены в базисе плоских волн с энергией отсечки 600 эВ, а электрон-ионные взаимодействия были описаны с использованием метода проекционных присоединенных волн (PAW). Потенциал PAW Ar имел крайние радиусы отсечки валентной орбитали 0,953 Å, с валентной конфигурацией 3 s 2 3p 6 . Мы использовали 108-атомную суперячейку с гамма-точечной выборкой зоны Бриллюэна и временным шагом 1 fs для моделирования молекулярной динамики из первых принципов при постоянном объеме.
Моделирование проводилось в постоянном ансамбле NVT с термостатом Nosé 29 5–10 пс после уравновешивания. Детали нашей методологии были даны в другом месте 30 . Время вычислений, необходимое для достижения равновесия, варьировалось в зависимости от конфигурации и зависело от начального положения атомов, скорости, температуры и давления. Расчеты молекулярной динамики из первых принципов были выполнены при 65 условиях давление-объем в этом исследовании. Диапазоны давлений и температур составляли 1–382 ГПа и 300–3000 К соответственно. Тепловое давление рассчитывалось для каждого объема. Полное давление в условиях высоких температур и давлений оценивалось по УРС при комнатной температуре из экспериментальных данных, а тепловое давление из первых принципов молекулярно-динамических расчетов. Известно, что теория функционала плотности имеет погрешность в несколько %, зависящую от приближения 30 . Поэтому значения теплового давления, рассчитанные в данной работе, имеют погрешность ~несколько %.
{2} $ $ 9{2}}\right)}_{V}(T-300)\right](T-300)\end{array}$$
(6)
Уравнение (4) использовалось для подбора давления- объемно-температурные данные наших экспериментов и расчетов. Типичная неопределенность расчетного давления, включая погрешности экспериментов при высоком давлении и расчетов из первых принципов, составляет менее 1 ГПа около 100 ГПа.
Ссылки
Baxter, E.F., Asimow, P.D. & Farley, K.A. Зернограничное разделение Ar и He. Геохим. Космохим. Acta 71 , 434–451 (2007).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
- “>
Бернард, П. Г. и др. . Роль границ зерен в страте и транспорте инертных газов в мантии. Планета Земля. науч. лат. 430 , 206–270 (2015).
Артикул Google ученый
Джексон, Ч.Р.М., Парман, С.В., Келли, С.П. и Купер, Р.Ф. Транспорт благородных газов в мантию облегчается благодаря высокой растворимости в амфиболе. Природа Геофизика. 6 , 562–565 (2013).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Чаврит, Д. и др. . Вклад гидротермально измененной океанической коры в мантийные циклы галогенов и благородных газов. Геохим. космохими. Acta 183 , 106–124 (2016).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
- “>
Кендрик, М. А., Скамбеллури, М., Хонда, М. и Филлипс, Д. Высокое содержание инертных газов и хлора поступает в мантию в результате серпентинитовой субдукции. Природа Геофизика. 4 , 807–812 (2011).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Holland, G. & Ballentine, CJ. Субдукция морской воды контролирует состав тяжелых инертных газов в мантии. Природа 441 , 186–191 (2006).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Mukhopadhyay, S. Ранняя дифференциация и аккреция летучих веществ зарегистрированы в глубокомантийном неоне и ксеноне. Природа 486 , 101–104 (2012).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Errandpnea, D., Boehler, R., Japel, S., Mezouar, M. & Benedetti, L.R. Структурная трансформация сжатого твердого аргона: исследование дифракции рентгеновских лучей до 114 ГПа. Физ. B 73 , 0 (2006).
ОБЪЯВЛЕНИЕ Статья Google ученый
Джефкоат А.П., Беседин С.П. Измерение температуры и определение плавления в нагреваемой лазером ячейке с алмазной наковальней.
Фил. Транс. Р. Соц. Лонд. А 354 , 1333–1360 (1996).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Андерсон, М.С. и Свенсон, К.А. Экспериментальные уравнения состояния твердых тел инертных газов. J. Phys. хим. Твердые вещества 36 , 145–162 (1975).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Фингер, Л. В., Хазен, Р. М., Цзоу, Г., Мао, Х. К. и Белл, П. М. Структура и сжатие кристаллического аргона и неона при высоком давлении и комнатной температуре. Заяв. физ. лат. 39 , 892–894 (1981).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Росс М., Мао Х.К., Белл П.М. и Сюй Дж.А. Уравнение состояния плотного аргона: сравнение ударных и статических исследований. J. Chem, Phys. 85 , 1028–1033 (1986).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Джефкоут, А. П. Твердые газы в недрах Земли. Природа 393 , 355–358 (1998).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Симидзу Х., Таширо Х., Куме Т. и Сасаки С. Упругие свойства твердого аргона при высоком давлении до 70 ГПа. Физ. Преподобный Летт. 86 , 4568–4571 (2001).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Чен Б. и др. . Упругость, прочность и показатель преломления аргона при высоких давлениях. Физ. B 81 , 144110 (2010).
ОБЪЯВЛЕНИЕ Статья Google ученый
Марквардт, Х. и др. . Бриллюэновское рассеяние и рентгеновская дифракция твердого аргона до 65 ГПа и 700 К: Прочность аргона на сдвиг при HP/HT.
J. Appl. физ. 114 , 0
(2013).
ОБЪЯВЛЕНИЕ Статья Google ученый
Дачи, Ф., Лубейр, П. и ЛеТуллек, Р. Расширенное и точное определение кривых плавления аргона, гелия, льда (H 2 O) и водорода (H 2 ). Физ. B 61 , 6535–6546 (2000).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Винет П., Ферранте Дж., Роуз Дж. и Смит Дж. Р. Сжимаемость твердых тел. Ж. Геофиз. Рез. Б 92 , 9319–9325 (1987).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
“> Оно, С. Расчет уравнения состояния тантала методом молекулярной динамики из первых принципов. Междунар. Дж. Мол. науч. 10 , 4342–4351 (2009).
КАС Статья Google ученый
Оно, С. Уравнение состояния NaCl типа B2. J. Phys. конф. сер. 2015 , 012196 (2010).
Артикул Google ученый
Дзиевонски А. М. и Андерсон Д. Л. Предварительная эталонная модель Земли. Физ. Планета Земля. Интер. 25 , 297–356 (1981).
ОБЪЯВЛЕНИЕ Статья Google ученый
Оно С., Кикегава Т. и Охиши Ю. Синтез карбида платины при высоких давлениях и температурах. Твердотельный коммуник. 133 , 55–59 (2005).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
“> Оно, С., Охиши, Ю. и Кикегава, Т. Исследование ромбоэдрического оксида железа FeO под высоким давлением при давлении от 41 до 142 ГПа. J. Phys. Конденс. Материя 19 , 036205 (2007).
ОБЪЯВЛЕНИЕ Статья Google ученый
Оно, С., Фунакоси, К., Охиши, Ю. и Такахаши, Э. In situ Рентгеновское наблюдение фазового превращения Fe 2 O 3 . J. Phys. Конденс. Matter 17 , 269–276 (2005).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Оно, С. и Кикегава, Т. Определение фазовой границы GaP с использованием in situ дифракции рентгеновских лучей при высоком давлении и высокой температуре. Высокое давление. Рез. 37 , 28–35 (2017).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
“> Дорогокупец П.И. и Деваэле А. Уравнения состояния MgO, Au, Pt, NaCl-B1 и NaCl-B2: Внутренне согласованные высокотемпературные шкалы давления. Высокий пресс. Рез. 27 , 431–446 (2007).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Крессе, Г. и Фуртмюллер, Дж. Эффективные итерационные схемы для неэмпирических расчетов полной энергии с использованием базисного набора плоских волн. Физ. B 54 , 11169 (1996).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Perdew, J. P. и др. . Восстановление расширения градиента плотности для обмена в твердых телах и поверхностях. Физ. Преподобный Летт. 100 , 136406 (2008 г.).
ОБЪЯВЛЕНИЕ Статья Google ученый
Носе, С. Метод молекулярной динамики для моделирования в каноническом ансамбле. Молекуляр. физ. 52 , 255–268 (1984).
ОБЪЯВЛЕНИЕ Статья Google ученый
Оно, С. Синергия между вычислениями из первых принципов и экспериментом в изучении наук о Земле.
In Некоторые приложения квантовой механики . Пахлавани, MR Ed. стр. 91–108 (InTech, Вена, Австрия, 2012 г.).
Google ученый
Джексон И. и Ригден С. М. Анализ данных P-V-T: ограничения термоупругих свойств минералов высокого давления. Физ. Планета Земля. Междунар. 96 , 85–112 (1996).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Дорогокупец П. И., Дымшиц А. М., Литасов К. Д., Соколова Т. С. Термодинамика и уравнения состояния железа до 350 ГПа и 6000 К. Науч. 7 , 41863 (2017).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
“> Ульмер, П. и Троммсдорф, В. Устойчивость серпентина к глубинам мантии и магматизм, связанный с субдукцией. Природа 268 , 858–861 (1995).
КАС Google ученый
Оно, С. Экспериментальные ограничения на профиль температуры в нижней мантии. Физ. Планета Земля. Интер. 170 , 267–273 (2008).
ОБЪЯВЛЕНИЕ КАС Статья Google ученый
Ссылки на скачивание
Благодарности
В этой работе использовалась система DA JAMSTEC. Автор благодарит Т. Ханью за плодотворное обсуждение и Т. Кикегава и Н. Хирао за помощь в экспериментах. Эксперименты по синхротронному излучению выполнены в ОФ КЭК (предложения №№ 2011G507, 2013G079, и 2017G056) и на SPring-8, JASRI (предложение № 2019A1099). Эта работа была частично поддержана грантами JSPS KAKENHI с номерами JP18K03792 и JP16H02742.
Информация об авторе
Авторы и организации
Центр изучения вулканов и недр Земли, Научно-исследовательский институт морской геодинамики, Японское агентство морских и земных наук и технологий, 2-15 Нацусима-тё, Йокосука, Канагава, 237-0061 , Япония
Шигеаки Оно
Авторы
- Shigeaki Ono
Посмотреть публикации автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Шигеаки Оно.
Заявление об этике
Конкурирующие интересы
Автор не заявляет об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Дополнительная информация
Дополнительная информация
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате. , при условии, что вы укажете первоначальных авторов и источник, предоставите ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons для статьи, если иное не указано в кредитной строке материала.
Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/.
Перепечатка и разрешения
Об этой статье
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Свойства и применение – StudiousGuy
В 1785 году английский философ и ученый Генри Кавендиш обнаружил нереакционноспособный газ при фракционной перегонке воздуха. К сожалению, в то время не было доступных спектроскопических методов, поэтому не было другого пути для дальнейшего изучения этого газа. Спустя столетие в 189 г.4, английский физик лорд Рэлей и шотландский химик Уильям Рамзи пытались выяснить, почему плотность азота, извлеченного при фракционной перегонке жидкого воздуха, отличается от плотности азота, извлеченного при разложении аммиака.
Когда Рамзи выделил весь азот в виде твердого нитрида магния, у него остался газ, который не вступал в реакцию ни с каким другим соединением даже в экстремальных условиях. С помощью спектроскопии они обнаружили новую группу синих, красных и зеленых линий в спектре газа. Они выделили этот первый благородный газ и назвали его аргоном.
Слева вверху спектральная трубка, возбуждаемая трансформатором на 5000 вольт. Справа показан спектр, видимый через дифракционную решетку 600 штрихов/мм. 18. Это третий по распространенности газ в земной атмосфере с содержанием почти 9340 частей на миллион по объему. В космическом масштабе Аргон занимает 12-е место в рейтинге изобилия. Как и многие другие химические элементы, название аргон также происходит от греческого слова (ἀργός), что означает «ленивый» или «неактивный», в связи с его нереактивной природой. Благодаря достаточному количеству аргона в атмосфере Земли, аргон имеет широкий спектр применения в различных отраслях промышленности. 9{ 40 }{ Ar } в процессе захвата электронов или испускания позитронов.
Промышленным методом производства аргона является криогенная фракционная перегонка воздуха, которая также используется для производства очищенного азота, кислорода, неона, криптона и ксенона.
Промышленная криогенная газовая установка
Около 50 триллионов тонн аргона циркулирует в нашей атмосфере. При производстве около «700 000 тонн» аргона в год мир имеет неограниченные запасы аргона. 9{38} {Ар}.
Свойства аргона. Физические свойства. Эти свойства аргона остаются одинаковыми во всех его фазах. Однако он излучает фиолетовый свет в газоразрядной трубке. Его растворимость в воде аналогична растворимости кислорода, но растворимость в воде в 2,5 раза выше, чем у азота. Плотность аргона составляет 1,784 г на кубический литр, что очень похоже на плотность воздуха (1,20 г на кубический литр). Температура кипения аргона составляет -185,7°С, а температура плавления -189°С.{ 6 }. Благодаря полностью заполненной валентной оболочке аргон в большинстве условий инертен и не образует стабильных соединений при комнатной температуре.Хотя аргон является благородным газом, и ученые более века не могли соединить его с каким-либо другим элементом, в 2000 году Маркку Рясянен, химик из Хельсинкского университета в Финляндии, вместе со своими учеными-исследователями сумел образуют соединение, называемое фторгидридом аргона (HArF).
Они сделали это путем конденсации смеси аргона и фтористого водорода на йодиде цезия при температуре -265°C и облучении ультрафиолетовым светом. При нагревании чуть выше -246 ° C он снова превращается в аргон и фтористый водород. Также известно, что аргон образует клатраты с водой, когда атомы аргона захватываются внутри решетки молекулы воды.
Использование аргонаВ качестве химически ленивого газа аргон оказался чрезвычайно пригодным для использования.
1. Промышленное применениеАргон обладает многими практическими свойствами, такими как инертность, распространенность, низкая теплопроводность и ионизация, что делает его очень выгодным для различных применений. Самым важным из этих свойств является его недорогая доступность, которая выгодно отличает его от других благородных газов. Давайте обсудим некоторые из его применений в различных областях.
Благодаря своему изобилию, недорогой и действительно инертной природе аргон имеет широкий спектр применений в различных отраслях промышленности. Он используется всякий раз, когда требуется полностью нереактивная атмосфера.
а. СваркаАргон используется в качестве защитного газа для предотвращения реакции горячей сварки с кислородом, присутствующим в воздухе. Чистый аргон или аргон, смешанный с другими газами, обычно используется при сварке TIG (вольфрамовый инертный газ), который используется для сварки подающих электродов вместе, тогда как при сварке MIG (металлический инертный газ) для сварки используется смесь углерода и аргона.
компоненты из обычной стали.
При плазменно-дуговой резке и плазменно-дуговой сварке используется плазменный газ (аргон и водород), который обеспечивает очень высокую температуру при использовании специальной горелки.
б. Производство металлов
Большая часть аргона идет на производство стали, где он продувается через расплавленное железо вместе с кислородом. Аргон помогает уменьшить потери хрома, тогда как кислород снижает содержание углерода, образуя CO2. Аргон также помогает предотвратить образование нитридов при производстве стали высшего качества.
Он также используется в производстве алюминия для обеспечения дегазации и удаления растворенного водорода из расплавленного алюминия. Чтобы избежать окисления и реакции с азотом, аргон используется в качестве инертной атмосферы при производстве титана.
г. Электронная промышленностьДля снижения скорости сублимации вольфрамовой нити в лампах накаливания и люминесцентных лампах в качестве газа-наполнителя используется аргон.
Он обеспечивает более высокую температурную стабильность нити накала.
В смеси с метаном аргон используется в качестве газа-наполнителя и в качестве защитного инертного газа высокой чистоты при производстве кремниевых и германиевых кристаллов, используемых в полупроводниковой промышленности.
2. Исследования и медицинаСцинтилляционные устройства на основе аргона используются для обнаружения взаимодействий между аргоном и слабо взаимодействующими массивными частицами (WIMPs), которые являются главными кандидатами в текущих исследованиях темной материи. Аргон также используется в качестве газа-носителя в газовой хроматографии и масс-спектрометрии с ионизацией электрораспылением.
Моделирование обнаружения слабаков
Аргон используется для проведения точной криохирургии, то есть использования экстремального холода для избирательного разрушения небольших участков пораженной или аномальной ткани, в частности на коже. Очень холодный аргон создается на месте за счет контролируемого расширения газообразного аргона и направляется в точку лечения с помощью криоиглы.
Это обеспечивает лучший контроль над процессом, чем более ранние методы, использующие жидкий азот. Похожая методика, криоаблация, используется для лечения аритмии сердца путем разрушения клеток, препятствующих нормальному распределению электрических импульсов.
Здравоохранение также использует аргоновые лазеры на красителях для лечения некоторых кожных заболеваний и дефектов зрения. Он также использовался для удаления азота из кровеносных сосудов в больницах вместе с кислородом.
3. КонсервантыАргон — это безопасный газ, который использовался для сохранения почти всего, от вина до Декларации независимости США. Это также лучший консервант для пищевых продуктов, так как он может вымывать любой остаточный кислород, который может окислять пищу. Аргон также используется в качестве консерванта для химических веществ, таких как лак, полиуретан и краска, путем вытеснения воздуха для подготовки контейнера для хранения.
Контейнер для хранения Декларации Независимости, наполненный аргоном
4.Разное применение
Одним из самых экзотических применений аргона являются шины роскошных автомобилей. Он не только защищает резину шины от кислорода, но и помогает снизить уровень шума при движении автомобиля на высокой скорости.
Тайлеры гоночных автомобилей заполняют аргоном
Поскольку аргон имеет более низкую теплопроводность, чем воздух, он используется в качестве газа-наполнителя внутри оконных стекол. Он также используется в костюмах для подводного плавания, поскольку обеспечивает теплозащиту, когда температура может резко упасть под водой.
Метод радиометрического датирования, используемый археологами и геохронологами, основан на калий-аргоновом датировании.
Аспекты для здоровья
Аргон в основном инертен и поэтому не обладает токсичными свойствами, но он может действовать как удушающий агент, вытесняя кислород в закрытой и замкнутой среде ниже требуемой точки для поддержания жизни.
Будучи газом без запаха, цвета, вкуса и не вызывающим раздражения, он не имеет никаких предупредительных индикаторов, и у людей нет органов чувств, которые могли бы обнаружить утечку аргона в воздухе. Вдыхание аргона в чрезмерных количествах может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть. Смерть может наступить в результате ошибочных суждений, спутанности сознания или потери сознания, препятствующих самоспасению.
Физические свойства газа
- Ацетилен
Формула C₂H₂ Молекулярный вес (фунт/моль) 26,04 Критическая темп. (° F) 96,0 Критическое давление (PSIA) 906,0 .0127 –113.4 Psat @ 70°F (psia) 586.2 Liquid Density @ 70°F (lb/ft³) 23. 61
Gas Density @ 70°F 1 atm ( LB/FT³) 0,0677 Специфический объем при 70 ° F 1 атм (FT³/LB) 14,76 Специфичная гравита –°F) 10,53 - Воздух
Формула — Молекулярная масса (фунт/моль) 28,96 Критическая темп. (°F) Н/Д Критическое давление (psi) Н/Д 0127 N/A Psat @ 70°F (psia) (note 1) Liquid Density @ 70°F (lb/ft³) (note 1) Gas Density @ 70°F 1 atm (lb/ft³) 0.075 Specific Volume @ 70°F 1 atm (ft³/lb) 13. 3
Specific Gravity 1.000 Specific Heat @ 70°F (БТЕ/фунтмоль–°F) 6,96 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Аммиак
Формула NH₃ Молекулярный вес (фунт/моль) 17.03 Критическая темп. (°F) 270.1 Critical Pressure (psia) 1636.0 Boiling Point (°F) -28.2 Melting Point (°F) –107.9 Psat при 70°F (psi) 129,0 Плотность жидкости при 70°F (фунт/фут³) 38,55 Плотность газа при 70°F 0127 0. 0445
Specific Volume @ 70°F 1 atm (ft³/lb) 22.48 Specific Gravity 0.604 Specific Heat @ 70°F (Btu/lbmol–°F) 8,69 - Аргон
Формула Ar Молекулярная масса (фунт/моль) 39.95 Критическая темп. (°F) –188.4 Critical Pressure (psia) 705.8 Boiling Point (°F) –302.6 Melting Point (°F) –308.8 Psat @ 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут³) (примечание 1) Плотность газа при 10 м фунт/фут³) 0,1034 Специфический объем при 70 ° F 1 атм (FT³/LB) 9,67 8 . Специфическая тяжесть
1,38 . 4,98 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Арсин
Формула AsH₃ Молекулярный вес (фунт/моль) 77,95 Критическая темп. (° F) 211,8 Критическое давление (PSIA) 957 .4115 –178.5 Psat @ 70°F (psia) 217.9 Liquid Density @ 70°F (lb/ft³) 92.59 Gas  Density @ 70°F 1 atm (lb /ft³) 0,2038 Специфический объем при 70 ° F 1 атм (FT³/LB) 4,91 Специфический гравита °F) 9,23
- Трихлорид бора
Формула BCl₃ Молекулярный вес (фунт/моль) 117,17 Критическая темп. (°F)
353,8 Критическое давление (psi) 561,3 Температура кипения (°F) 54,6 Melting Point (°F) –160.6 Psat @ 70°F (psia) 19.9 Liquid Density @ 70°F (lb/ft³) 84.44 Gas Density @ 70°F 1 atm (lb/ft³) 0.3141 Specific Volume @ 70°F 1 atm (ft³/lb) 3.18 Specific Gravity 4.267 Specific Тепло при 70°F (БТЕ/фунтмоль–°F) 15.11 - Трехфтористый бор
Формула BF₃ Молекулярный вес (фунт/моль) 67,81 Критическая темп. (°F)
10,0 Критическое давление (psi) 723,0 Температура кипения (°F) –148,5 Точка плавления (° F) –199,7 PSAT @ 70 ° F (PSIA) (примечание 1) (примечание 1) . 1) Плотность газа при 70 ° F 1 атм (фунт/фут. 2.320 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 12,10 Примечания:
1 = Означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Бутан
Формула C₄H₁₀ Молекулярная масса (фунт/моль) 58,12 Критическая темп. (°F)
305.9 Critical Pressure (psia) 549.9 Boiling Point (°F) 31.0 Melting Point (°F) —217.0 Psat при 70°F (psi) 31,3 Плотность жидкости при 70°F (фунт/фут³) 36,05 Gas Density @ 70°F 1 atm (lb/ft³) 0.1551 Specific Volume @ 70°F 1 atm (ft³/lb) 6.45 Specific Gravity 2.108 Удельная теплоемкость при 70°F (БТЕ/фунтмоль—°F) 23,87
- Двуокись углерода
Формула CO₂ Молекулярный вес (фунт/моль) 44,01 Критическая темп. (°F)
87.9 Critical Pressure (psia) 1071.0 Boiling Point (°F) –109.2 Melting Point (°F) –69.9 Psat при 70°F (psi) 852,8 Плотность жидкости при 70°F (фунт/фут³) 47,64 Плотность газа @ 70 ° F 1 атм (фунт/фт -) 0,1144 Специфический объем при 70 ° F 1 атм (Ft=/LB) . 1,555 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 8,92 - Окись углерода
Формула CO Молекулярный вес (фунт/моль) 28,01 Критическая темп. (°F)
–220.4 Critical Pressure (psia) 485.6 Boiling Point (°F) –312.7 Melting Point (°F) –337.1 Psat при 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут³) (примечание 1) Плотность газа при 70°F 1 атм (фунт/фут³) 0,0725 атм. Удельный объем при 1 атм. (ft³/lb) 13.80 Specific Gravity 0.985 Specific Heat @ 70°F (Btu/lbmol–°F) 6.97 Notes:
1 = Signifies при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Хлор
Формула Cl₂ Молекулярная масса (фунт/моль) 70,91 Критическая темп. (°F) 291,2 Критическое давление (psi) 1118.4 Boiling Point (°F) –29.3 Melting Point (°F) –149.8 Psat @ 70°F (psia) 98.4 Liquid Плотность при 70°F (фунт/фут³) 88,83 Плотность газа при 70°F 1 атм (фунт/фут³) 0,1858 Удельный объем 5,38 Удельный вес 2,524 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 8,16
- Дейтерий
Формула D₂ Молекулярная масса (фунт/моль) 4,03 Критическая темп. (°F)
–390,8 Критическое давление (psi) 241,5 точка кипячения (° F) –417,0 44444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444н. (° F) –426,0 77Плотность жидкости при 70°F (фунт/фут³) (примечание 1) Плотность газа при 70°F 1 атм (фунт/фут³) 0,0104 Удельный объем при 70124 9014 9014 1 атм (фут³/фунт) 95.97 Specific Gravity 0.142 Specific Heat @ 70°F (Btu/lbmol–°F) 6.95 Notes:
1 = Signifies at 70°F, the температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Диборан
Формула B₂H₆ Молекулярная масса (фунт/моль) 27,67 Критическая темп. (°F) 62.1 Critical Pressure (psia) 580.8 Boiling Point (°F) –135.1 Melting Point (°F) –264.8 Psat при 70°F (пси) (примечание 1) Плотность жидкости @ 70 ° F (фунт/ft³) (примечание 1) Плотность газа при 70 ° F 1 Атм (LB/FT=6 111141114141414111411141114141414141141411141414141414141417 . . . . . Специфический объем при 70 ° F 1 атм (FT³/LB) 14,05 Специфический вес 0,950 Определенный жар @ 70 ° F (BTU/LB – Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Дихлорсилан
Формула SiH₂Cl₂ Молекулярная масса (фунт/моль) 101,01 Критическая темп. (°Ф) 348.8 Critical Pressure (psia) 678.2 Boiling Point (°F) 49.9 Melting Point (°F) –187. 6
Psat @ 70° F (psia) 24.2 Liquid Density @ 70°F (lb/ft³) 75.19 Gas Density @ 70°F 1 atm (lb/ft³) 0.2602 Специфический объем при 70 ° F 1 атм (FT³/LB) 3,84 Специфический вес 3,470 . - Дисилан
Формула Si₂H₆ Молекулярный вес (фунт/моль) 62,22 Критическая темп. (°F) 303.5 Critical Pressure (psia) 746.9 Boiling Point (°F) 6.3 Melting Point (°F) –206. 7
Psat при 70°F (psi) 49,3 Плотность жидкости при 70°F (фунт/фут³) Н/Д Плотность газа при 70°F 1 атм (909/фут³)4115 Н/Д Удельный объем при 70°F 1 атм (фут³/фунт) Н/Д Удельный вес фунт-моль–°F) Н/Д
- Этан
Формула C₂H₆ Молекулярный вес (фунт/моль) 30,07 Критическая темп. (°F) 90.4 Critical Pressure (psia) 707.9 Boiling Point (°F) –127.5 Melting Point (°F) –297.9 Psat при 70°F (psi) 559,6 Плотность жидкости при 70°F (фунт/фут³) 20,98 Плотность газа при 70°F 0127 0. 0784
Specific Volume @ 70°F 1 atm (ft³/lb) 12.76 Specific Gravity 1.065 Specific Heat @ 70°F (Btu/lbmol–°F) 12,67 - Этилхлорид
Формула C₂H₅Cl Молекулярная масса (фунт/моль) 64,52 Критическая темп. (°F) 369.0 Critical Pressure (psia) 764.2 Boiling Point (°F) 54.0 Melting Point (°F) –217.0 Psat при 70°F (psi) 20,3 Плотность жидкости при 70°F (фунт/фут³) 55,78 Плотность газа при 70°F/9фут³ 1 атм (фунт/9фут³)0127 0,1720 Специфический объем при 70 ° F 1 атм (FT³/LB) 5,82 8 8 8 Специфический вес 2,336 8 8 8 8 . 15,41 - Этилен
Формула C₂H₄ Молекулярный вес (фунт/моль) 28,05 Критическая темп. (°F) 49.1 Critical Pressure (psia) 742.7 Boiling Point (°F) –154.8 Melting Point (°F) –272.5 Psat при 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут³) (примечание 1) Плотность газа при 70°F (фунт/фут³) /фут³) 0.0730 Specific Volume @ 70°F 1 atm (ft³/lb) 13.70 Specific Gravity 0. 992
Specific Heat @ 70°F (Btu/lbmol–°F) 10,28 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.
- Фтор
Формула F₂ Молекулярная масса (фунт/моль) 38,00 Критическая темп. (° F) –199,9 Критическое давление (PSIA) 754,6 .0127 –363.4 PSAT @ 70 ° F (PSIA) (примечание 1) Плотность жидкости @ 70 ° F (LB/FT³) (Note 1) 777777777777777777777777777777777777777777777777777777777777777777777777777777.777777777777777777777777777777777 (nate 1). 70°F 1 atm (lb/ft³)
0.0983 Specific Volume @ 70°F 1 atm (ft³/lb) 10.17 Specific Gravity 1.336 Specific Heat @ 70 °F (БТЕ/фунтмоль–°F) 7.49 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.
- Хлоруглерод-116
Формула C2F6 Молекулярная масса (фунт/моль) 138.01 Критическая темп. (°F) 67.5 Critical Pressure (psia) 432. 2
Boiling Point (°F) -108.7 Melting Point (°F) -149.3 Psat при 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут3) (примечание 1) Gas Density @ 70°F 1 atm (lb/ft3) 0.3616 Specific Volume @ 70°F 1 atm (ft3/lb) 2.77 Specific Gravity 4.913 Удельная теплоемкость при 70°F (БТЕ/фунтмоль-°F) 25,25 Примечания:
1 = Означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Хладон-23
Формула CHF₃ Молекулярный вес (фунт/моль) 70,01 Критическая темп. (° F) 78,7 Критическое давление (PSIA) 701,4 .0127 –247.3 Psat @ 70°F (psia) 626.0 Liquid Density @ 70°F (lb/ft³) 48.67 Gas Density @ 70°F 1 atm ( LB/FT³) 0,1827 Специфический объем при 70 ° F 1 атм (FT³/LB) 5,47 . Специфическая гравита 9415 2,4442,48 2 . –°F) 12,25 - Гелий
Формула He Молекулярный вес (фунт/моль) 4,00 Критическая темп. (° F)
–450,3 Критическое давление (PSIA) 33,0 .0127 – PSAT @ 70 ° F (PSIA) (примечание 1) Жидкости @ 70 ° F (LB/FT³) (note 1) 9014 9014 9014 4014 4014 4014 4. 70 ° F 1 атм (фунт/шттр) 0,0103 Специфический объем при 70 ° F 1 атм (FT³/LB) 96,65 96,65 96,65 . °F (БТЕ/фунтмоль–°F) 4,97 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Водород
Формула H₂ Молекулярная масса (фунт/моль) 2,02 Критическая темп. (°F)
–400.0 Critical Pressure (psia) 187.5 Boiling Point (°F) –423.0 Melting Point (°F) –434.5 Psat при 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут³) (примечание 1) Gas Density @ 70°F 1 atm (lb/ft³) 0.0052 Specific Volume @ 70°F 1 atm (ft³/lb) 191.90 Specific Gravity 0.069 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 6,87 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Хлороводород
Формула HCl Молекулярная масса (фунт/моль) 36,46 Критическая темп. (° F) 124,5 Критическое давление (PSIA) 1199,2 .0127 –173.6 Psat @ 70°F (psia) 629.1 Liquid Density @ 70°F (lb/ft³) 51.28 Gas Density @ 70°F 1 atm ( LB/FT³) 0,0948 Специфический объем при 70 ° F 1 атм (FT³/LB) 10,54 . Специфическая гравита 1499 . –°F)
7,29 - Фторид водорода
Формула HF Молекулярная масса (фунт/моль) 20,01 Критическая темп. (°F) 370,4 Критическое давление (psi) 940,5 7 Температура кипения (°F) 67,14 точка плавления (° F) –118,4 PSAT @ 70 ° F (PSIA) 15,54 DENGIN Плотность при 70°F 1 атм (фунт/фут³) (примечание 2) Удельный объем при 70°F 1 атм (фут³/фунт) (примечание 2) Удельный вес 94 (1117 906) примечание 2) Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) (примечание 2) Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Сероводород
Формула H₂S Молекулярная масса (фунт/моль) 34.08 Критическая темп. (°F) 212.8 Critical Pressure (psia) 1306.5 Boiling Point (°F) –74.9 Melting Point (°F) –122.0 Psat при 70°F (psi) 263,6 Плотность жидкости при 70°F (lb/ft³) 48,52 Gas Density @ 70°F 1 atm (lb/ft³) 0.0888 Specific Volume @ 70°F 1 atm (ft³/lb) 11. 26
Specific Gravity 1.207 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 8,29
- Криптон
Формула Кр Молекулярная масса (фунт/моль) 83,80 Критическая темп. (°F) –82.8 Critical Pressure (psia) 798.0 Boiling Point (°F) –244.1 Melting Point (°F) –251.3 Psat при 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут³) (примечание 1) Плотность газа @ 70 ° F 1 атм (фунт/фт -) 0,2172 Специфический объем при 70 ° F 1 ATM (FT=/LB) . Удельный вес
2,951 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 4,99 Примечания: 7°F выше критической температуры соединения, 1
.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.
- Метан
Формула CH₄ Молекулярная масса (фунт/моль) 16,04 Критическая темп. (°F) –116,2 Критическое давление (psi) 673,0 Температура кипения (°F) –258,7 7 40146 Температура плавления (°F) –296,5 Psat @ 70°F (psi) (примечание 1) Плотность жидкости при 70°F (lb/ft17) 1 ( ) Gas Density @ 70°F 1 atm (lb/ft³) 0. 0416
Specific Volume @ 70°F 1 atm (ft³/lb) 24.06 Specific Gravity 0.565 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 8.53 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.
- Неон
Формула Ne Молекулярный вес (фунт/моль) 20.18 Критическая темп. (°F) –379.8 Critical Pressure (psia) 384.9 Boiling Point (°F) –410. 9
Melting Point (°F) –415.5 Psat при 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут³) (примечание 1) Плотность газа @ 70 ° F 1 атм (фунт/шт/фут. Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 4,97 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Азот
Формула N₂ Молекулярная масса (фунт/моль) 28,01 Критическая темп. (° F) –232,5 Критическое давление (PSIA) 492,3 . 0127
–345.9 PSAT @ 70 ° F (PSIA) (примечание 1) Плотность жидкости @ 70 ° F (LB/FT=) (Note 1)77777777 9115 (Note 1)777 (Note 1) (Note 1). 70°F 1 atm (lb/ft³)0.0725 Specific Volume @ 70°F 1 atm (ft³/lb) 13.80 Specific Gravity 0.967 Specific Heat @ 70 °F (БТЕ/фунтмоль–°F) 6,97 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Трифторид азота
Формула NF₃ Молекулярная масса (фунт/моль) 71. 00
Критическая темп. (°F) –38.5 Critical Pressure (psia) 646.9 Boiling Point (°F) –200.2 Melting Point (°F) –340.2 Psat при 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут³) (примечание 1) Плотность газа @ 70 ° F 1 атм (фунт/шт/фут. Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 12,66 Примечания:
1 = Означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Закись азота
Формула N₂O Молекулярная масса (фунт/моль) 44,01 Критическая темп. (°F)
97.6 Critical Pressure (psia) 1053.3 Boiling Point (°F) –128.3 Melting Point (°F) –131,6 PSAT @ 70 ° F (PSIA) 751,3 Плотность жидкости при 70 ° F (LB/FT=) @2.10 27012. 7012. 9012 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48 48. lb/ft³) 0.1145 Specific Volume @ 70°F 1 atm (ft³/lb) 8.74 Specific Gravity 1.555 Specific Heat @ 70°F (Btu/lbmol –°F) 9,17
- Октафторпропан
Формула C₃F₈ Молекулярный вес (фунт/моль) 188,02 Критическая темп. (°F)
161,4 Критическое давление (psi) 386,1 Температура кипения (°F) –34,3 Melting Point (°F) –233.8 Psat @ 70°F (psia) 112.8 Liquid Density @ 70°F (lb/ft³) 84.66 Gas Density @ 70°F 1 atm (lb/ft³) 0.4956 Specific Volume @ 70°F 1 atm (ft³/lb) 2.02 Specific Gravity 6.734 Specific Тепло при 70°F (БТЕ/фунтмоль–°F) 35,48 - Кислород
Формула O₂ Молекулярная масса (фунт/моль) 32,00 Критическая темп. (°F)
–181,8 Критическое давление (psi) 729,1 Температура кипения (°F) –297,3440146 Температура плавления (°F) –361,9 Psat @ 70°F (psi) (примечание 1) Плотность жидкости при 70°F (lb/ft17) 1 (9примечание 4 90 фут17) Плотность газа при 70 ° F 1 атм (LB/FT³) 0,0828 Специфический объем @ 70 ° F 1 Атм (FT³/LB) 12,08 777777777.44411111111111111111111111111111111111111111111111111111111111111111111111111111111111111111н.Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 7.03 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.
- Фосфин
Формула PH₃ Молекулярная масса (фунт/моль) 34.00 Критическая темп. (°F) 124.9 Critical Pressure (psia) 947.9 Boiling Point (°F) –126.0 Melting Point (°F) –208.8 Psat при 70°F (psi) 493,2 Плотность жидкости при 70°F (lb/ft³) 35,50 Плотность газа при 70 ° F 1 атм (фунт/фут. Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 8,93 - Пентафторид фосфора
Формула PF₅ Молекулярная масса (фунт/моль) 125,97 Критическая темп. (°F)
66.1 Critical Pressure (psia) 492.3 Boiling Point (°F) –120.1 Melting Point (°F) –136.8 Psat при 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут³) (примечание 1) Плотность газа @ 70 ° F 1 атм (фунт/фтА) 0,3230 Специфический объем при 70 ° F 1 Атм (FT³/LB) . Удельный вес 4,310 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 20,27 .
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Пропан
Формула C₃H₈ Молекулярный вес (фунт/моль) 44,10 Критическая темп. (° F)
206,6 Критическое давление (PSIA) 617,6 .0127 –305.8 Psat @ 70°F (psia) 124.9 Liquid Density @ 70°F (lb/ft³) 31.12 Gas Density @ 70°F 1 atm ( LB/FT³) 0,1160 Специфический объем при 70 ° F 1 атм (FT³/LB) 8,62 . Специфическая гравита 9415 1,576. –°F) 17,71 - Пропилен
Формула C₃H₆ Молекулярный вес (фунт/моль) 42,08 Критическая темп. (° F) 197,5 Критическое давление (PSIA) 666,3 . 0127
–301,4 PSAT @ 70 ° F (PSIA) 152,2 Плотность жидкости @ 70 ° F (LB/FT³). LB/FT³) 0,1105 Специфический объем при 70 ° F 1 атм (FT³/LB) 9.05 Специфическая гравита 1444 . –°F) 15,56
- Тетрахлорид кремния
Формула SiCl₄ Молекулярная масса (фунт/моль) 169,90 Критическая темп. (°F) 453,0 Критическое давление (psi) 543,8 Температура кипения (°F) 136.6 Melting Point (°F) –94.0 Psat @ 70°F (psia) 4. 0
Liquid Density @ 70°F (lb/ft³) 92.13 Плотность газа при 70°F 1 атм (фунт/фут³) (примечание 2) Удельный объем при 70°F 1 атм (фут³/фунт) (примечание 2) 9014 9014 Гравитация (примечание 2) Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) (примечание 2) Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Тетрафторид кремния
Формула SiF₄ Молекулярный вес (фунт/моль) 104,08 Критическая темп. (°F)
6.5 Critical Pressure (psia) 539.3 Boiling Point (°F) –138.6 Melting Point (°F) –124.2 Psat при 70°F (psi) (примечание 1) Плотность жидкости при 70°F (фунт/фут³) (note 1) Gas Density @ 70°F 1 atm (lb/ft³) 0.2711 Specific Volume @ 70°F 1 atm (ft³/lb) 3.69 Удельный вес 3,683 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 17,50 .
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Двуокись серы
Формула SO₂ Молекулярная масса (фунт/моль) 64,06 Критическая темп. (°F) 315.5 Critical Pressure (psia) 1142.0 Boiling Point (°F) 14.3 Melting Point (°F) –103.9 Psat @ 70°F (psia) 49.3 Liquid Density @ 70°F (lb/ft³) 85.98 Gas Density @ 70°F 1 atm ( LB/FT³) 0,1682 Специфический объем при 70 ° F 1 атм (FT³/LB) 5,94 . Специфическая гравита 9415 2,2844. –°F) 9,58 - Гексафторид серы
Формула SF₆ Молекулярная масса (фунт/моль) 146,05 Критическая темп. (°F)
114,0 Критическое давление (psi) 545,2 Температура кипения (°F) –8946 Точка плавления (° F) –58,9 PSAT @ 70 ° F (PSIA) 314,4 . @ 70°F 1 atm (lb/ft³) 0.3824 Specific Volume @ 70°F 1 atm (ft³/lb) 2.61 Specific Gravity 5.196 Specific Heat @ 70°F (БТЕ/фунтмоль–°F) 22,91 - Тетрафторид серы
Формула SF₄ Молекулярная масса (фунт/моль) 108,06 Критическая темп. (°F) 195,6 Критическое давление (psi) — Температура кипения (°F) –40,7 Melting Point (°F) –186 Psat @ 70°F (psia) 154. 7
Liquid Density @ 70°F (lb/ft³) — Gas Density @ 70°F 1 atm (lb/ft³) 0.278 Specific Volume @ 70°F 1 atm (ft³/lb) 3.59 Specific Gravity 3.71 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) —
- Тетрафторметан
Формула CF₄ Молекулярная масса (фунт/моль) 88,00 Критическая темп. (°F) –50,2 Критическое давление (psi) 543,6 Температура кипения (°F) –198,5 Печата плавления (° F) –298,5 4 PSAT @ 70 ° F (PSIA) (примечание 1) 4 (примечание 1) (примечание 1) (примечание 1) (примечание 1) 4. (note 1)
Gas Density @ 70°F 1 atm (lb/ft³) 0.2285 Specific Volume @ 70°F 1 atm (ft³/lb) 4.38 Specific Gravity 3.104 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 14,43 Примечания:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.- Гексафторид вольфрама
Формула WF₆ Молекулярная масса (фунт/моль) 297,84 Критическая темп. (°F) 337.7 Critical Pressure (psia) 619. 3
Boiling Point (°F) 62.7 Melting Point (°F) 35.6 Psat при 70°F (psi) 17,1 Плотность жидкости при 70°F (фунт/фут³) 216.13 Gas Density @ 70°F 1 atm (lb/ft³) 0.7951 Specific Volume @ 70°F 1 atm (ft³/lb) 1.26 Specific Gravity 10,803 Удельная теплоемкость при 70°F (БТЕ/фунтмоль–°F) 28,37
- Ксенон
Формула Xe Молекулярная масса (фунт/моль) 131,3 Критическая темп. (°F) 61. 9
Critical Pressure (psia) 847.1 Boiling Point (°F) –162.6 Melting Point (°F) –169.4 Psat при 70°F (psi) (примечание 1) Плотность жидкости @ 70 ° F (фунт/фт -) (примечание 1) Плотность газа при 70 ° F 1 атм (LB/FTваю) 0,3414 774444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444444н. F 1 atm (ft³/lb)2.93 Specific Gravity 4.639 Specific Heat @ 70°F (Btu/lbmol–°F) 5.02 Notes:
1 = означает, что при 70°F температура соединения выше критической.
2 = означает, что при 70°F температура кипения соединения ниже нормальной, и при 1 атмосфере присутствует только равновесный пар.Аргон: «ленивый» благородный газ
Рон Б. Дэвис-младший, Джорджтаунский университет
В 1892 году лорд Рэли заметил, что азот в воздухе отличается от азота, содержащегося в химических соединениях. Предыдущие образцы азота содержали ранее необнаруженный элемент. И поскольку этот новый элемент был настолько инертным, что его не удалось обнаружить химическими методами, сэр Уильям Рамсей решил назвать этот элемент аргоном, от греческого слова «аргос», означающего «праздный», «ленивый» или «бездействующий».
Аргон — это благородный газ, который используется всякий раз, когда необходимо заменить обычный воздух чем-то менее химически активным. (Изображение: Алексей Марк/Shutterstock)Новый, неоткрытый газ
После открытия физика лорда Рэли шотландский химик сэр Уильям Рамзи предложил сотрудничество для исследования этого необычного наблюдения.
Рамзи вспомнил, как читал отчеты Генри Кавендиша, который химически удалил азот и кислород из образцов воздуха, но осталась небольшая доля газа, чуть менее 1% от исходного образца. Рамзи пришел к выводу, что эта небольшая часть атмосферы представляет собой новый, неизведанный газ с плотностью выше азота.
Рамзи оказался прав. Он доказал свою теорию, используя сжиженный воздух — воздух, охлажденный до такой низкой температуры, что содержащиеся в нем газы конденсировались в жидкости. Медленно нагревая сжиженный воздух, он собирал один за другим чистые газы по мере того, как они достигали точки кипения. При этом ему удалось собрать чистый азот из воздуха, который на самом деле имел ту же плотность, что и азот из других источников.
Если мы обратим внимание на периодическую таблицу, то легко понять, почему образцы атмосферного азота Рэли оказались немного более плотными.
Эта статья взята непосредственно из серии видео Understanding the Periodic Table .
Смотрите прямо сейчас на Wondrium .
Аргон
Сообщается, что средняя атомная масса аргона составляет около 40, в то время как молекула диазота содержит два атома азота по 14 а.е.м. каждый, что в сумме составляет 28 а.е.м. Следовательно, если заменить небольшую долю молекул азота в образце более тяжелыми атомами аргона, то общая масса системы увеличится, увеличив ее плотность.
Аргон отличался от всех остальных элементов своей инертностью. Рэли задался вопросом: может быть, аргон является членом совершенно новой группы ленивых элементов, которые просто не реагируют на окружающую среду?
Гелий
Гелий уже был замечен и назван гораздо раньше, еще в 1868 году, но только в короне Солнца.
Поскольку предполагалось, что любой такой элемент является расплавленным металлом, астроном Норман Локьер дал ему имя, похожее на металл — хел-IUM, что сделало это имя похожим на sod-IUM, титан-IUM и так далее.
Но на протяжении десятилетий здесь, на Земле, никто не мог найти гелий.
Но открытие Рамзи аргона заставило ученых переосмыслить предположение Локьера. Возможно, гелий был связан с открытием Рэли нереакционноспособного газа аргона.
Эта догадка также подтвердилась, когда Рамзи и вторая группа в Швеции обнаружили гелий, выделяющийся из газообразного метана, связанного с урановыми рудами здесь, на Земле.
Процесс «Дистилляция воздуха»
В течение следующих нескольких лет Рамзи усовершенствовал методы жидкого воздуха, которые он использовал для выделения аргона из воздуха, более тщательно изучая аргон.
При этом он определил, что неон, криптон и ксенон также скрываются в воздухе, хотя и в гораздо более низких концентрациях, чем аргон.
Он добился этого, охладив каждый образец газа до точки, при которой он сжижался, затем медленно нагревая образец, собирая газы, когда они один за другим достигали точки кипения и испарялись. Это процесс «перегонки воздуха».
Благородные газы
Он обнаружил в воздухе газ, который кипел при еще более низкой температуре, чем азот, и назвал этот «новый» газ неоном.
Кроме того, после перегонки образцов очищенного аргона остался более тяжелый газ, названный криптоном, что означает «скрытый».
При повторной перегонке очищенного криптона Рэли обнаружил, что после него остается еще один газ с еще более высокой температурой кипения, названный «ксенон», что означает «чужой».
Немецкий химик Хьюго Эрдман, узнав об этой группе новых элементов, назвал их «благородными газами». Их неактивность казалась похожей на уже известную неактивность так называемых «благородных металлов».
Зачем называть их «благородными» газами?
Правило октетов дает нам веский аргумент в пользу того, почему группа 18 считается «благородными» элементами. Но почему благородные газы? Что такого в этой группе, что делает их все газообразными элементами при комнатной температуре?
Что ж, когда речь идет, в частности, о неметаллах, фазовое поведение материала — когда и как он переходит из твердого состояния в жидкое и в газообразное — во многом зависит от того, насколько хорошо отдельная единица этого элемента прилипает к другим.
Чем «липче» атом или молекула, тем легче их перевести в жидкое состояние из газообразного состояния. И наоборот, чем менее липкими являются атомы или молекулы, тем шире диапазон температур, при которых они обладают достаточной энергией, чтобы разлететься и остаться газом.
Проще говоря, благородные газы — одни из наименее липких атомов на столе. И это дает им одни из самых низких температур плавления и кипения.
Изобилие аргона
Что касается аргона, то это самый распространенный из благородных газов в нашей атмосфере. Это происходит главным образом потому, что он сочетает универсальное изобилие с плотностью, которая позволяет ему улавливаться нашей атмосферой, а не улетать в космическое пространство, как его меньшие родственники, гелий и неон.
Аргон хорошо подходит для наполнения ламп накаливания. (Изображение: Genky/Shutterstock)Изобилие аргона и плотность, подобная воздуху, сделали его популярным газом-наполнителем везде, где требуется инертная атмосфера, а плотность не является проблемой.
Аргон хорошо подходит для заполнения изолированных окон и ламп накаливания, потому что он не имеет тенденции к оседанию со временем.
Интересно, что аргон, наряду с йодом и никелем, является одним из тех редких элементов, которые противоречат тенденции изменения атомного номера, увеличиваясь синхронно с увеличением атомной массы. Атомная масса аргона 39,95 прыгает вперед, чтобы быть тяжелее калия с массой 39,10, то есть элемент 18 тяжелее элемента 19!
В заключение можно сказать, что аргон — это тот благородный газ, который всегда находится в начале списка всякий раз, когда обычный воздух нужно заменить чем-то менее реактивным. Таким образом, к нему часто обращаются, когда нужны инертные атмосферы с плотностью, близкой к нашей.
Общие вопросы об аргоне
В: Почему азот, выделенный из нашей атмосферы, остается примерно на 1% тяжелее ?
Азот, выделенный из нашей атмосферы, оставался примерно на 1% тяжелее в предыдущих образцах, потому что ученым не удалось выделить чистый азот.


 Применяется при сварке титановых сплавов, нержавеющей стали, конструкционной стали – при повышенных требованиях к прочности;
Применяется при сварке титановых сплавов, нержавеющей стали, конструкционной стали – при повышенных требованиях к прочности;
 Используется также для сварки высоконагруженных изделий из конструкционной стали.
Используется также для сварки высоконагруженных изделий из конструкционной стали. Молярная масса M выражается как произведение коэффициента пропорциональности на относительную массу.
Молярная масса M выражается как произведение коэффициента пропорциональности на относительную массу.

 Серебро
Серебро Эйнштейний
Эйнштейний ст.)
ст.) 81
81 257
257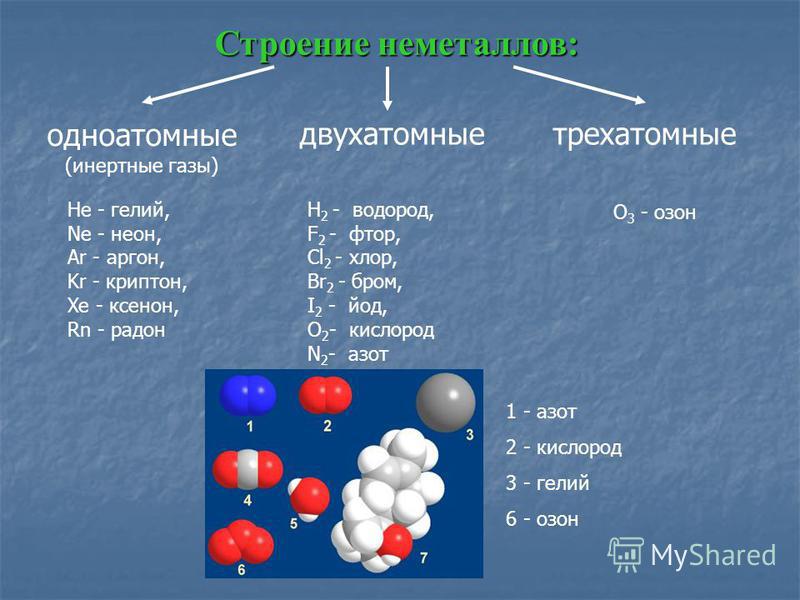 41
41 06459
06459 4
4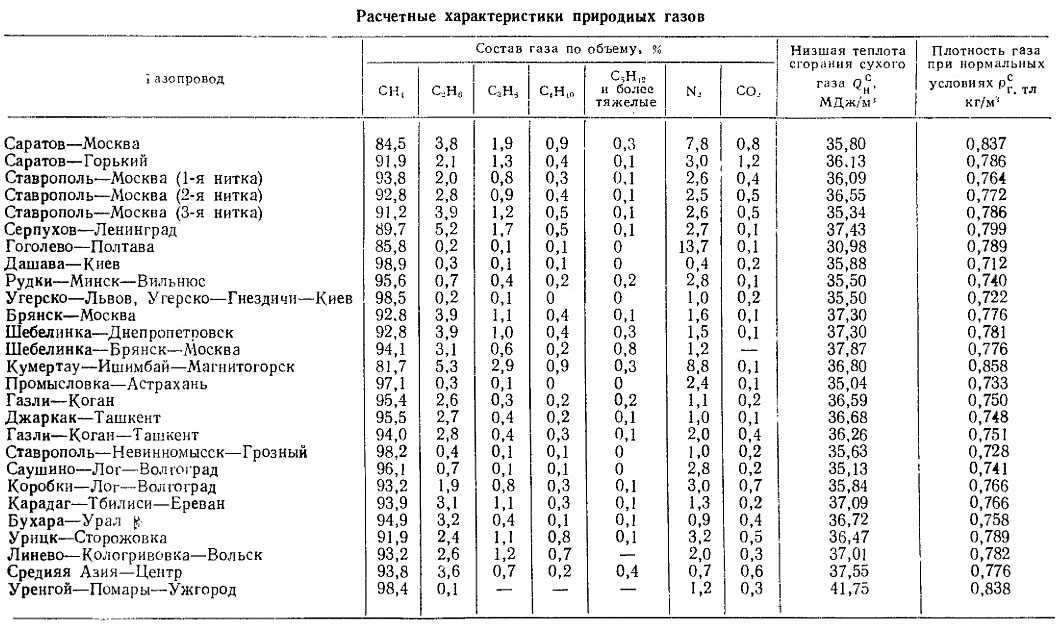 75
75 2
2 2
2 0127
0127 00133
00133 50
50 9450
9450 31
31 3775
3775 2000
2000 34
34 971
971 77
77 71
71 6
6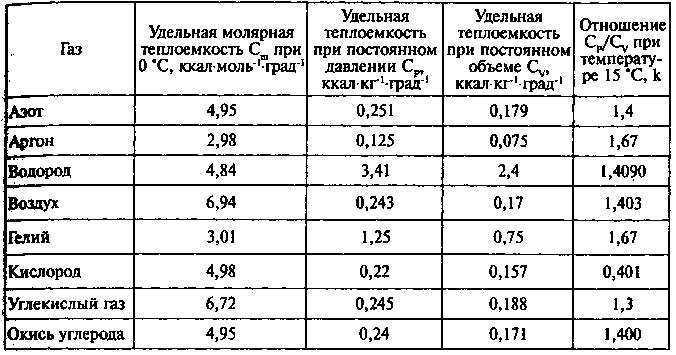 989
989 1135
1135 9
9 ярд [тонна (короткая)/ярд 3 ], тонна (длинная)/куб. = 1 кг/л = 1000 кг/м 3 = 62,428 фунт/фут 3 = 0,03613 фунт/дюйм 3 = 1,9403 sl/ft 3 = 10,0224 фунта/галлона (Великобритания) = 8,3454 фунта/галлона (US liq) = 0,5780 унций/дюйм G/L = 1 кг/м 3 = 0,001 кг/л = 0,000001 кг/см 3 = 0,001 г/см 3 = 0,99885 унции/фут 3 = 0,0005780 унции/в 3 = 0,16036. унция/гал (Великобритания) = 0,1335 унции/гал (жидкость США) = 0,06243 фунт/фут 3 = 3,6127×10-5 фунт/дюйм 3 = 1,6856 фунт/ярд 3 = 0,010022 фунт/галлон (Великобритания) = 0,0083454 фунта/галлона (жидких США) = 0,0007525 тонны (длинной)/ярд 3 = 0,0008428 тонн (короткий)/YD 3
ярд [тонна (короткая)/ярд 3 ], тонна (длинная)/куб. = 1 кг/л = 1000 кг/м 3 = 62,428 фунт/фут 3 = 0,03613 фунт/дюйм 3 = 1,9403 sl/ft 3 = 10,0224 фунта/галлона (Великобритания) = 8,3454 фунта/галлона (US liq) = 0,5780 унций/дюйм G/L = 1 кг/м 3 = 0,001 кг/л = 0,000001 кг/см 3 = 0,001 г/см 3 = 0,99885 унции/фут 3 = 0,0005780 унции/в 3 = 0,16036. унция/гал (Великобритания) = 0,1335 унции/гал (жидкость США) = 0,06243 фунт/фут 3 = 3,6127×10-5 фунт/дюйм 3 = 1,6856 фунт/ярд 3 = 0,010022 фунт/галлон (Великобритания) = 0,0083454 фунта/галлона (жидких США) = 0,0007525 тонны (длинной)/ярд 3 = 0,0008428 тонн (короткий)/YD 3  G/L = 0,001 кг/л = 0,000001 кг/см 3 = 0,001 г/см 3 = 0,99885 унции/фут 3 = 0,0005780 унции/в 3 = 0,16036 унции/гал (Великобритания) = 0,1335 унция/гал (жидкость США) = 0,06243 фунта/фут 3 = 3,6127×10-5 фунтов/дюйм 3 = 1,6856 фунтов/ярд 3 = 0,010022 фунтов/галлон (Великобритания) = 0,008345 фунтов/галлон (США жидких) = 0,0010 1 0007525 тонны (1 0007525 длинных) = 0,0008428 тонна (короткая)/YD 3
G/L = 0,001 кг/л = 0,000001 кг/см 3 = 0,001 г/см 3 = 0,99885 унции/фут 3 = 0,0005780 унции/в 3 = 0,16036 унции/гал (Великобритания) = 0,1335 унция/гал (жидкость США) = 0,06243 фунта/фут 3 = 3,6127×10-5 фунтов/дюйм 3 = 1,6856 фунтов/ярд 3 = 0,010022 фунтов/галлон (Великобритания) = 0,008345 фунтов/галлон (США жидких) = 0,0010 1 0007525 тонны (1 0007525 длинных) = 0,0008428 тонна (короткая)/YD 3  179 lb/yd 3 = 6.2288 lb/ft 3 = 0.003605 lb/in3 = 0.05767 oz/in 3 = 99.7764 kg/m 3 = 0.09977 g/cm 3 = 0.07508 ton( длинная)/ярд 3 = 0,08409 тонны (короткая)/ярд 3
179 lb/yd 3 = 6.2288 lb/ft 3 = 0.003605 lb/in3 = 0.05767 oz/in 3 = 99.7764 kg/m 3 = 0.09977 g/cm 3 = 0.07508 ton( длинная)/ярд 3 = 0,08409 тонны (короткая)/ярд 3 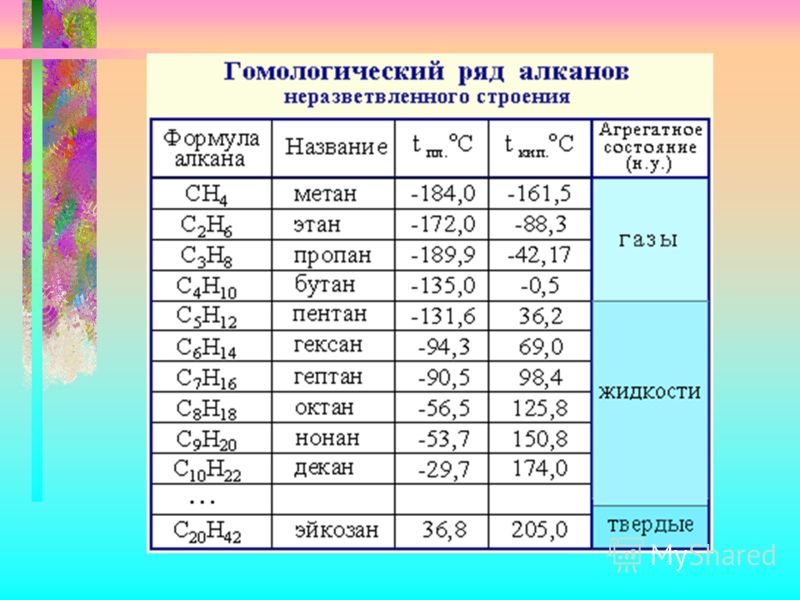 ) = 20,8286 тонн (длинных)/ярд 3 = 23,3280 тонна (короткая)/YD 3
) = 20,8286 тонн (длинных)/ярд 3 = 23,3280 тонна (короткая)/YD 3 
 Это стабильный газ, он не имеет цепной структуры. Однако существует газовая структура аргона, показывающая орбиты,
Это стабильный газ, он не имеет цепной структуры. Однако существует газовая структура аргона, показывающая орбиты,