Почему коррозия это химическое явление: Химическая коррозия
alexxlab | 01.07.1986 | 0 | Разное
Коррозия металла.
Коррозия металла.
Хроники одной московской школы середины 80-х.
Это не рассказ про известную в эпоху «Перестройки» метал рок-группу и её лидера – Паука. Это рассказ именно про коррозию, как химическое явление в школьной интерпретации. Шёл 1984 или 1985 год нашего десятого класса в московской школе N 557. В моде тогда было всё новое, в том числе и в процессе школьного обучения. В то время одним из лидеров нестандартного преподавания школьного предмета у нас была «химичка» – Голикова Галина Михайловна. В тот раз ей пришло в голову устроить необычный открытый урок, при этом сильно не отходя от текущей темы по химии. Только начали тогда изучать коррозию металлов. «Химичка» решила устроить настоящий суд над этой самой враждебной железу и народному хозяйству коррозией, пригласив на открытый урок директора школы и районное учебное начальство.
Любой суд в любой стране должен иметь характерные особенности. Должен присутствовать не только судья, но и свидетели, судебный эксперт и, конечно, адвокат.
 Так как намечался приход на урок и районного начальства, то предварительно (за счет других тем) на уроках химии начали проводить репетиции открытого суда над коррозией. Свидетели и судья всё заучивали назубок обвинения, эксперт апофигично рассказывал что-то, что простым смертным понять было сложно. Я же каждую тренировку выдавал новую версию защиты, изменяя текст по собственному усмотрению. Мне всегда нравилось выступать на публике, если тема была и мне интересна, и допускалась возможность импровизации. Галина Михайловна позволяла в тот раз говорить мне всё, что можно.
Так как намечался приход на урок и районного начальства, то предварительно (за счет других тем) на уроках химии начали проводить репетиции открытого суда над коррозией. Свидетели и судья всё заучивали назубок обвинения, эксперт апофигично рассказывал что-то, что простым смертным понять было сложно. Я же каждую тренировку выдавал новую версию защиты, изменяя текст по собственному усмотрению. Мне всегда нравилось выступать на публике, если тема была и мне интересна, и допускалась возможность импровизации. Галина Михайловна позволяла в тот раз говорить мне всё, что можно. Подготовились, отрепетировали, но комиссия из района долго не шла. И явилась, когда уже многие стали слова подзабывать. Но тот день наступил! На задних партах разместились директор школы Карсавина Т.И. и кто-то из района. Класс гужевался ближе к середке комнаты. Выступающие – ближе к столу «химички» перед «сценой» (была у нас как бы сцена перед доской в химклассе). Вёл суд, судил, засуживал тогда эту коррозию Шура К.

Я втянул воздуха побольше в грудь и начал. Начал с того, что коррозия – это естественный природный процесс, против которого не попрёшь, который сильно не исправишь, как ни старайся. А природа мудра, зачем её действия полностью изничтожать. Тут ходил на грани – ещё немного и выпал бы из принятого тогда материализма в религию, что тогда совсем не приветствовалось. Но остановился и перешел на загнивающий уже тогда Запад и экологию. Не знаю, как сейчас, но в то время особенно Южная Европа, как сообщалось, активно загрязняла Средиземноморье использованными консервными банками.
 И кто-то из европейцев подсчитал, что если бы не коррозия, то горы бы выброшенного на побережье железа показались бы над поверхностью воды. Это был сильный аргумент в пользу обиженной многими коррозии, которая активно «боролась» за экологию во всем мире, не смотря на общественный строй в государстве. Хотя могла бы – и это её минус – активнее бороться только на нашей территории. Плакаты я тогда не подготовил, поэтому носился около школьной доски с мелом, зарисовывая ужасающие картинки моря с консервными банками и неблагополучные по экологии пляжи Средиземноморья. Зря старался! Коррозия уже была заранее осуждена, и теперь предстояло вынести только формальный приговор. Что Шура К. и сделал. А мне от этого, как помню, как то стало обидно даже: уж как я старался, оправдывал! Но против любой системы не попрёшь! Через пару дней Галина Михайловна успокоила немного меня, сказав, что районной комиссии и директору очень нравились: и моё раскованное своеобразное выступление, и легкость в подаче материала.
И кто-то из европейцев подсчитал, что если бы не коррозия, то горы бы выброшенного на побережье железа показались бы над поверхностью воды. Это был сильный аргумент в пользу обиженной многими коррозии, которая активно «боролась» за экологию во всем мире, не смотря на общественный строй в государстве. Хотя могла бы – и это её минус – активнее бороться только на нашей территории. Плакаты я тогда не подготовил, поэтому носился около школьной доски с мелом, зарисовывая ужасающие картинки моря с консервными банками и неблагополучные по экологии пляжи Средиземноморья. Зря старался! Коррозия уже была заранее осуждена, и теперь предстояло вынести только формальный приговор. Что Шура К. и сделал. А мне от этого, как помню, как то стало обидно даже: уж как я старался, оправдывал! Но против любой системы не попрёшь! Через пару дней Галина Михайловна успокоила немного меня, сказав, что районной комиссии и директору очень нравились: и моё раскованное своеобразное выступление, и легкость в подаче материала.
Что касается меня, то после такого погружения в химические и биологические процессы нашей матушки-природы, я стал более трепетно относиться к её потребностям и действиям. И даже плесени порой перепадает от меня лишний кусочек хлеба на пропитание. А та, в свою очередь, помогает мне порой маркировать плохой хлебушек, который заполонил прилавки современной Москвы. А, возможно даже, что наш урок прослушали и западные шпионы: с тех пор пляжи в Южной Европе стали гораздо чище!
18.04.2020
265 © Батарин Владислав
Теги:
При выполнении скрипта возникла ошибка. Включить расширенный вывод ошибок можно в файле настроек .settings.php
Чем отличается ржавчина от коррозии
Главная » Разное » Чем отличается ржавчина от коррозии
Ржавчина и коррозия – VECFORT
Многие, не очень осведомленные в делах короззии граждане считают, что коррозия и ржавчина – это одно и то же. Но, на самом деле, это два совсем разных понятия, и отличаются они во многом.
Но, на самом деле, это два совсем разных понятия, и отличаются они во многом.
Начнем с того, что коррозия может быть не только у металла, а и у многих других материалов (например, бетона или пластмассы). Конечно, чаще всего мы встречаемся именно с коррозией металла, но в других случаях нужно уточнять, говоря «коррозия металла»; коррозия, – это процесс разрушения материалов, который вызван разнообразными химическими (а также и электрохимическими) процессами
Конечно, коррозией это считается в тех случаях, если данные процессы вызваны воздействием окружающей среды. Но не обязательно этим материалом должен быть металл.
Также коррозия металла подразумевает не только ржавление. Согласно международным стандартам, коррозия металла это химическое (в некоторых случаях физико-химическое) явление, возникающее между металлом и средой, которой приводит к тому, что свойства металла и его структура понемногу ухудшаются и разрушаются. Но не всегда результатом коррозии является ржавчина.
Под ржавчиной следует понимать слой оксидов железа, которые прошли частичное гидратирование, и образовали на поверхности металла этот самый слой. Обычно он имеет красно-желтые оттенки, сначала образуется в форме крупинок, а потом – в форме больших пятен, при длительном ржавлении с слоях металла могут появляться отверстия.
Поэтому необходимо постоянно следить даже за малейшими проявлениями ржавчины, проводить профилактику, очистку фасадов и оборудования.
Одно из наиболее важных отличий коррозии от ржавчины: коррозия это процесс, а ржавчина это его результат. Коррозию предотвращают, пытаются обезопасить металлические конструкции от ее проявления.
А вот ржавчина – это результаты проявления коррозии, которой не удалось избежать, либо если для профилактики коррозии не принималось никаких необходимых мер. Для избавления от ржавчины используют бластинг, пескоструйную очистку, или другие методы.
Не стоит также путать коррозию с эрозией – это похожие по звучанию, но совсем разные по сути термины. Эрозия – разрушение металла под влиянием механических и других воздействий, таких как дождь, ветер, пыль и тому подобные явлений. Общее между коррозией и эрозией только то, что обе являются термином для обозначение физического разрушения материала.
Эрозия – разрушение металла под влиянием механических и других воздействий, таких как дождь, ветер, пыль и тому подобные явлений. Общее между коррозией и эрозией только то, что обе являются термином для обозначение физического разрушения материала.
Разница между ржавчиной и коррозией – это то же самое, что коррозия и ржавчина
- БЕСПЛАТНАЯ ЗАПИСЬ КЛАСС
- КОНКУРСНЫЕ ЭКЗАМЕНА
- BNAT
- Классы
- Класс 1-3
- Класс 4-5
- Класс 6-10
- Класс 110003 CBSE
- Книги NCERT
- Книги NCERT для класса 5
- Книги NCERT, класс 6
- Книги NCERT для класса 7
- Книги NCERT для класса 8
- Книги NCERT для класса 9
- Книги NCERT для класса 10
- NCERT Книги для класса 11
- NCERT Книги для класса 12
- NCERT Exemplar
- NCERT Exemplar Class 8
- NCERT Exemplar Class 9
- NCERT Exemplar Class 10
- NCERT Exemplar Class 11 9plar
- RS Aggarwal
- RS Aggarwal Решения класса 12
- RS Aggarwal Class 11 Solutions
- RS Aggarwal Решения класса 10
- Решения RS Aggarwal класса 9
- Решения RS Aggarwal класса 8
- Решения RS Aggarwal класса 7
- Решения RS Aggarwal класса 6
- RD Sharma
- RD Sharma Class 6 Решения
- RD Sharma Class 7 Решения
- Решения RD Sharma Class 8
- Решения RD Sharma Class 9
- Решения RD Sharma Class 10
- Решения RD Sharma Class 11
- Решения RD Sharma Class 12
- PHYSICS
- Механика
- Оптика
- Термодинамика
- Электромагнетизм
- ХИМИЯ
- Органическая химия
- Неорганическая химия
- Периодическая таблица
- MATHS
- Статистика
- 9000 Pro Числа
- Числа
- 9000 Pro Числа Тр Игонометрические функции
- Взаимосвязи и функции
- Последовательности и серии
- Таблицы умножения
- Детерминанты и матрицы
- Прибыль и убытки
- Полиномиальные уравнения
- Деление фракций
- Microology
- 0003000
- Книги NCERT
- FORMULAS
- Математические формулы
- Алгебраные формулы
- Тригонометрические формулы
- Геометрические формулы
- КАЛЬКУЛЯТОРЫ
- Математические калькуляторы 0003000
- 000 CALCULATORS
- 000
- 000 Калькуляторы по химии 900 Образцы документов для класса 6
- Образцы документов CBSE для класса 7
- Образцы документов CBSE для класса 8
- Образцы документов CBSE для класса 9
- Образцы документов CBSE для класса 10
- Образцы документов CBSE для класса 1 1
- Образцы документов CBSE для класса 12
- Вопросники предыдущего года CBSE
- Вопросники предыдущего года CBSE, класс 10
- Вопросники предыдущего года CBSE, класс 12
- HC Verma Solutions
- HC Verma Solutions Класс 11 Физика
- HC Verma Solutions Класс 12 Физика
- Решения Лакмира Сингха
- Решения Лакмира Сингха класса 9
- Решения Лахмира Сингха класса 10
- Решения Лакмира Сингха класса 8
9000 Класс
- Примечания CBSE класса 7 Примечания
- Примечания CBSE класса 8
- Примечания CBSE класса 9
- Примечания CBSE класса 10
- Примечания CBSE класса 11
- Примечания 12 CBSE
- Дополнительные вопросы по математике класса 8 CBSE
- Дополнительные вопросы по науке 8 класса CBSE
- Дополнительные вопросы по математике класса 9 CBSE
- Дополнительные вопросы по науке
- CBSE Вопросы
- CBSE Class 10 Дополнительные вопросы по математике
- CBSE Class 10 Science Extra questions
- Class 3
- Class 4
- Class 5
- Class 6
- Class 7
- Class 8 Класс 9
- Класс 10
- Класс 11
- Класс 12
- Решения NCERT для класса 11
- Решения NCERT для класса 11 по физике
- Решения NCERT для класса 11 Химия
- Решения NCERT для биологии класса 11
- NCERT Solutions Class 11 Accountancy
- NCERT Solutions Class 11 Business Studies
- NCERT Solutions Class 11 Economics
- NCERT Solutions Class 11 Statistics
- NCERT Solutions Class 11 Commerce
- NCERT Solutions for Class 12
- Решения NCERT для физики класса 12
- Решения NCERT для химии класса 12
- Решения NCERT для биологии класса 12
- Решения NCERT для математики класса 12
- Решения NCERT, класс 12, бухгалтерский учет
- Решения NCERT, класс 12, бизнес-исследования
- NCERT Solutions Class 12 Economics
- NCERT Solutions Class 12 Accountancy Part 1
- NCERT Solutions Class 12 Accountancy Part 2
- NCERT Solutions Class 12 Micro-Economics
- NCERT Solutions Class 12 Commerce
- NCERT Solutions Class 12 Macro-Economics
- NCERT Solut Ионы Для класса 4
- Решения NCERT для математики класса 4
- Решения NCERT для класса 4 EVS
- Решения NCERT для класса 5
- Решения NCERT для математики класса 5
- Решения NCERT для класса 5 EVS
- Решения NCERT для класса 6
- Решения NCERT для математики класса 6
- Решения NCERT для науки класса 6
- Решения NCERT для класса 6 по социальным наукам
- Решения NCERT для класса 6 Английский
- Решения NCERT для класса 7
- Решения NCERT для математики класса 7
- Решения NCERT для науки класса 7
- Решения NCERT для социальных наук класса 7
- Решения NCERT для класса 7 Английский язык
- Решения NCERT для класса 8
- Решения NCERT для математики класса 8
- Решения NCERT для науки 8 класса
- Решения NCERT для социальных наук 8 класса ce
- Решения NCERT для класса 8 Английский
- Решения NCERT для класса 9
- Решения NCERT для класса 9 по социальным наукам
- Решения NCERT для математики класса 9
- Решения NCERT для математики класса 9 Глава 1
- Решения NCERT для математики класса 9, глава 2 Решения NCERT
- для математики класса 9, глава 3
- Решения NCERT для математики класса 9, глава 4
- Решения NCERT для математики класса 9, глава 5 Решения NCERT
- для математики класса 9, глава 6
- Решения NCERT для математики класса 9 Глава 7 Решения NCERT
- для математики класса 9 Глава 8
- Решения NCERT для математики класса 9 Глава 9
- Решения NCERT для математики класса 9 Глава 10 Решения NCERT
- для математики класса 9 Глава 11 Решения
- NCERT для математики класса 9 Глава 12 Решения NCERT
- для математики класса 9 Глава 13
- NCER Решения T для математики класса 9 Глава 14
- Решения NCERT для математики класса 9 Глава 15
- Решения NCERT для науки класса 9
- Решения NCERT для науки класса 9 Глава 1
- Решения NCERT для науки класса 9 Глава 2
- Решения NCERT для науки класса 9 Глава 3
- Решения NCERT для науки класса 9 Глава 4
- Решения NCERT для науки класса 9 Глава 5
- Решения NCERT для науки класса 9 Глава 6
- Решения NCERT для науки класса 9 Глава 7
- Решения NCERT для науки класса 9 Глава 8
- Решения NCERT для науки класса 9 Глава 9
- Решения NCERT для науки класса 9 Глава 10
- Решения NCERT для науки класса 9 Глава 12
- Решения NCERT для науки класса 9 Глава 11
- Решения NCERT для науки класса 9 Глава 13 Решения NCERT
- для науки класса 9 Глава 14
- Решения NCERT для класса 9 по науке Глава 15
- Решения NCERT для класса 10
- Решения NCERT для класса 10 по социальным наукам
- Решения NCERT для математики класса 10
- Решения NCERT для математики класса 10 Глава 1
- Решения NCERT для математики класса 10, глава 2
- Решения NCERT для математики класса 10, глава 3
.
Разница между ржавчиной и коррозией
Ржавчина и коррозия
Хотя рост – это естественный процесс, влияющий на все на Земле, его противоположность, смерть и распад, также очевидна, как и все происходящие изменения. Это очевидно во всем, особенно в живых существах.
Возьмем, к примеру, человека. Он существует в тот момент, когда его зачала мать, а затем он рождается в этом мире и вырастает в ребенка, подростка и взрослого.Через какое-то время он постареет, и его функции организма нарушатся. Со временем его тело больше не сможет жить, и он умрет.
Подобно живым существам, даже неживые материалы со временем распадаются. Это может быть вызвано химическими реакциями или естественными реакциями на элементы окружающей среды. Ржавчина и коррозия – это два процесса, которые вызывают разрушение материалов.
Коррозия – это химическая или электрохимическая реакция, которая приводит к распаду искусственного материала в результате реакции с окружающей средой. Металлы – это обычные материалы, подверженные коррозии. Это постепенный процесс, в котором элементы разъедают материалы, заставляя их разрушаться и разрушаться из-за окисления металлов в результате химической реакции с окислителем, обычно кислородом.
Металлы – это обычные материалы, подверженные коррозии. Это постепенный процесс, в котором элементы разъедают материалы, заставляя их разрушаться и разрушаться из-за окисления металлов в результате химической реакции с окислителем, обычно кислородом.
Хотя это обычное явление для металлов, это также может происходить с другими материалами, такими как керамика и полимеры, но это называется другим названием – разложением. Открытые материалы склонны к коррозии, и это может быть просто трещина на небольшой площади, или они могут быть сосредоточены в большей части.Изменение цвета окрашенных материалов, когда краска выцветает из-за небрежного обращения, является примером коррозии. Даже без видимого окислителя материалы могут подвергаться коррозии, если их оставить на открытом воздухе.
Ржавчина, с другой стороны, представляет собой тип коррозии, которая случается с железом и его сплавами. Когда железо вступает в реакцию с водой или влажным воздухом, образуются оксиды железа, вызывающие коррозию материала. Это вызвано окислением и влажностью, а не химическими веществами. Это происходит, когда нечистое железо вступает в контакт с водой или влажным воздухом, кислородом или другими окислителями, такими как кислоты, и образует ржавчину.
Это вызвано окислением и влажностью, а не химическими веществами. Это происходит, когда нечистое железо вступает в контакт с водой или влажным воздухом, кислородом или другими окислителями, такими как кислоты, и образует ржавчину.
Другими факторами или окислителями, которые могут вызвать ржавчину, являются соль, оксид серы и диоксид углерода. Ржавчина бывает разных форм, наиболее распространенной из которых является красная ржавчина, образованная красными оксидами. Хлор в воде вызывает образование зеленой ржавчины. Как и большинство коррозионных процессов, ржавление происходит постепенно. Через некоторое время, если материал не обрабатывать, он распадется, и все превратится в ржавчину, сделав его непригодным для использования.
Резюме:
1. Коррозия – это разрушение материалов в результате химических или электрохимических реакций, а ржавчина – это один из видов коррозии.
2. Коррозия – это разложение всех типов металлов, а также таких материалов, как полимеры и керамика, а ржавчина – это коррозия железа и его сплавов.
3. Коррозия возникает в результате реакции материала на химические вещества, а ржавчина – в результате воздействия воды или влаги и окисления.
: Если вам понравилась эта статья или наш сайт. Пожалуйста, расскажите об этом. Поделитесь им с друзьями / семьей.
Cite
Емельда М. «Различие между ржавчиной и коррозией.”DifferenceBetween.net. 27 октября 2011 г.
.
Разница между ржавчиной и коррозией
×
Извините !, эта страница сейчас недоступна для добавления в закладки.
Ржавчина и коррозия являются реакциями окисления. Коррозия возникает на широком диапазоне объектов, в то время как ржавление ограничено, поскольку возникает только на железе.Мы можем сказать, что ржавчина – это тип коррозии или наиболее распространенный пример коррозии, поскольку ржавление металлических предметов встречается очень часто.
Что такое ржавчина?
Ржавчина – это окисление железа или железных предметов. Это происходит в присутствии воздуха и влаги. Это медленный процесс. Из-за ржавчины на железных предметах образуется ржавчина. Это оксид железа красно-оранжевого цвета, который образуется при окислении железа в присутствии кислорода, влаги или воды.
Это происходит в присутствии воздуха и влаги. Это медленный процесс. Из-за ржавчины на железных предметах образуется ржавчина. Это оксид железа красно-оранжевого цвета, который образуется при окислении железа в присутствии кислорода, влаги или воды.
Вовлеченные реакции можно записать следующим образом –
4Fe + 3O2 🡪 2Fe2O3
2Fe2O3 + xh4O 🡪 Fe2O3.xh4O
Ржавчина
Что такое коррозия?
Коррозия – это окисление металлов и неметаллов, которое приводит к разрушению и непреднамеренной деградации материалов окружающей средой. Он образует оксиды, гидроксиды и сульфиды элементов, присутствующих в материале.
Разница между коррозией и ржавчиной
Коррозия | Ржавчина |
Коррозия – это процесс разрушения металлов и неметаллов в результате окисления. | Ржавчина – это окисление железа (или стали) в присутствии воздуха и влаги. |
Коррозия может возникать как на металлах, так и на неметаллах. Это может также произойти на коже и дереве. | Ржавчина возникает только на металлах, таких как железо и сталь. |
Коррозия включает ржавчину. | Ржавчина – это один из видов коррозии. |
Требуется воздействие воздуха или химикатов на поверхность. | Требуется и воздух, и влага. |
Могут потребоваться коррозионные химические вещества, такие как HCl, h4SO4 и другие сильные кислоты и основания. | Не требует химикатов. |
Смесь (или слой), образовавшаяся в результате коррозии, может иметь разные цвета, такие как синий, зеленый и т. Д. | Ржавчина образует ржавчину красно-оранжевого цвета. |
Что такое прогорклость?
Обычно студенты путают понятия коррозии и прогорклости.Прогорклость отличается от коррозии, хотя это также реакция окисления. Прогорклость – это окисление жиров и масел, присутствующих в пищевых материалах, из-за которого изменяется запах и вкус пищевого материала.
Мы можем предотвратить это, добавляя антиоксиданты и храня продукты в герметичных контейнерах.
Предотвращение коррозии, ржавчины и прогорклости
Путем нанесения барьерных покрытий, таких как краска, пластмассы и т. Д., На поверхность материалов.
Можно использовать процесс горячего цинкования.
Мы можем формировать сплавы, чтобы предотвратить их коррозию.
Можно использовать катодную защиту.

Содержите стальные и железные предметы в чистоте и сухости, вдали от влаги и воздуха.
Путем нанесения защитного покрытия.
За счет использования сплавов железа вместо чистого железа.
Путем гальванизации.
Путем формирования слоя оксида железа с использованием нитрата калия и гидроксида натрия.
При использовании инертных газов в упаковке.
Используя поглотители кислорода.
При охлаждении пищевых продуктов.
При хранении пищевых продуктов в темном месте.

Используя герметичные контейнеры.
При использовании вакуумной упаковки.
С использованием антиоксидантов.
Мы надеемся, что это поможет вам понять разницу между коррозией и прогорклостью.Тем не менее, если у вас есть сомнения, не стесняйтесь присоединиться к классу сомнений по Веданту. Вы также можете зарегистрироваться на Vedantu или загрузить учебное приложение Vedantu для 6-10 классов, IITJEE и NEET, чтобы получить доступ к бесплатным PDF-файлам с решениями NCERT, учебными материалами и многим другим.
.
Разница между ржавчиной и коррозией
Переключить навигацию
- Дом
- Темы
- ПОСМОТРЕТЬ ВСЕ ТЕМЫ
- Аэрограф
- Американский
- Арт.

- Искусство и дизайн
- Статьи и новости
- Искусство и архитектура
- Искусство и идеи
- Автомобили
- Бейсбол
- Векселя
- Биография
- Биография и мемуары
- Забронировать
- Отрывки из книг
- Книги
- Книги – Художественная литература
- Книги – Научная литература
- Брошюры
- Бизнес и экономика
- Бизнес и лидерство
- Бизнес / право
- Календари
- Калифорния
- Chick Lit
- Детская литература
- Кристиан
- Комическая фантастика и сатиры
- Комиксы
- Компьютеры и технологии
- Современная фантастика
- Современные женщины
- Кулинария и еда
- Корпоративные финансы
- Судебные документы
- Протоколы судебных заседаний
- Ремесла
- Творческое письмо
- Уголовно-процессуальный
- Кроссворды
- Текущая экономика
- Базы данных
- Диета и питание
- Документы
- Экономические условия
- Экономическая история и теория
- Образование
- Эмиграционные и иммиграционные исследования
- Энергия
- Экономика окружающей среды
- Очерки
- Эссе и тезисы
- Этнические исследования и исследования меньшинств
- Этническая принадлежность, раса и пол
- Вера и духовность
- Семейные саги
- Фанфики
- Фантазия
- Художественная литература
- Пленка
- Финансы
- Еда и вино
- Гаджеты
- Игры и головоломки
- Генеалогия
- Жанр Художественная литература
- Правительство и политика
- Правительственные документы
- Графика
- Здоровье и образ жизни
- Здоровье и медицина
- Здоровье и благополучие
- Исторический
- История
- История, критика и теория
- Домашнее задание
- Ужас
- Юмор
- Отрасли промышленности
- Информационные технологии и теория
- Инструкции по эксплуатации
- Интернет и технологии
- Японский
- Еврей
- Журналы
- Закон
- Юридический
- Юридические формы
- Письма
- Литература
.
Урок “Коррозия металлов”
Тема урока: «Коррозия металлов».
Цель урока: создание условий для восприятия и первичного закрепления нового учебного материала, осмысление связей и отношений в объектах изучения.
Планируемые результаты
Готовность и способность обучающихся к саморазвитию и самообразованию на основе мотивации к обучению и познанию;
сформированность ценности здорового и безопасного образа жизни;
эмоционально-ценностное видение окружающего мира;
осознанное, уважительное отношение к ценностям Родины;
наличие опыта экологически ориентированной рефлексивно-оценочной и практической деятельности в жизненных ситуациях (готовность к исследованию природы, знания значения коррозии при выборе материала для конструкции сооружений, изготовления деталей техники и быта).
Метапредметные результаты
Межпредметные понятия: овладение обучающимися основами читательской компетенции, приобретение навыков работы с информацией.
Регулятивные УУД
Умение самостоятельно определять цели обучения, ставить и формулировать новые задачи в учебе и познавательной деятельности;
обучающиеся смогут: ставить цель деятельности на основе определенной проблемы и существующих возможностей, выдвигать версии решения проблемы, формулировать гипотезы, предвосхищать конечный результат;
формулировать учебные задачи как шаги достижения поставленной цели деятельности; обосновывать целевые ориентиры и приоритеты ссылками на ценности, указывая и обосновывая логическую последовательность шагов.
обучающиеся научатся определять совместно с учителем и сверстниками критерии планируемых результатов и критерии оценки своей учебной деятельности
Познавательные УУД
Умение определять понятия, создавать обобщения, устанавливать аналогии. выявлять причины и следствия явлений; строить рассуждение от частных явлений к общим закономерностям;
выявлять причины и следствия явлений; строить рассуждение от частных явлений к общим закономерностям;
строить рассуждение на основе сравнения явлений, выделяя при этом общие признаки; излагать полученную информацию;
объяснять явления, процессы, связи и отношения, выявляемые в ходе познавательной и исследовательской деятельности.
Коммуникативные УУД
Умение организовывать учебное сотрудничество и совместную деятельность с учителем и сверстниками;
работать индивидуально и в группе: находить общее решение и разрешать конфликты на основе согласования позиций и учета интересов; формулировать, аргументировать и отстаивать свое мнение.
Предметные результаты
научится:
соблюдать правила безопасности и охраны труда при работе с учебным оборудованием и веществами;
понимать смысл основных химических терминов: химическое и физическое явление электрический ток, строение атома, химическая реакция, коррозия;
распознавать проблемы, которые можно решить при помощи химических методов; анализировать этапы проведения исследований и интерпретировать результаты наблюдений и опытов проводить опыт и формулировать выводы;
проводить исследование зависимостей протекания химических реакций методом наблюдений и имеющихся знаний по предмету, при этом фиксировать результаты полученной зависимости физических величин в виде устных отчетов, делать выводы по результатам исследования.
Тип урока: комбинированный.
Методы и приемы обучения: метод проблемного изложения материала, метод поисковой беседы, исследовательский метод.
Оборудование: компьютер, проектор, презентация «Коррозия. Защита металлов от коррозии», лабораторное оборудование и реактивы.
Ход урока
Учитель: Вспомним, какую тему, какие вещества мы с вами изучаем.
Ученики: Мы изучаем тему: «Металлы».
Учитель: Для того чтобы изучать дальше, мы повторим свойства металлов.
Учащимся предлагается тестовое здание.
1. В химических реакциях металлы играют роль:
а) окислителей;
б) восстановителей;
в) окислителей и восстановителей.
2. Неактивные металлы с водой:
а) реагируют при нагревании;
б) не реагируют;
в) реагируют при нормальных условиях.
3. К активным металлам относятся:
а) Cu, Ag, Hg, Pb;
б) Ca, Be, Ni, Ba;
в) Ca, Na, Li, Ba.
4. С кислородом воздуха легко взаимодействуют:
а) железо, цинк, медь;
б) золото, ртуть, платиновые металлы;
в) калий, кальций, франций.
5. С хлороводородной кислотой взаимодействуют при н.у.:
а) литий, кальций, железо;
б) серебро, магний, медь;
в) цинк, ртуть, никель.
6. Какие из указанных металлов являются более активными, чем железо:
а) Ba, Al, Zn;
б) Cu, Hg, Ag;
в) Al, Zn, Cu.
7 С водой с образованием растворимого гидроксида взаимодействует:
а) К; б)Zn; в)Pb; г)Ag.
8.В электротехнике используют следующее физическое свойство меди и алюминия:
а) теплопроводность; б) ковкость;
в) пластичность; г) электропроводность.
9 С раствором серной кислотой не будет взаимодействовать:
а) Сu; б) Fe; в) Al; г)Zn.
10.С соляной кислотой взаимодействуют при н.у.
а) алюминий, кальций, железо;
б) серебро, магний, медь;
в) цинк, ртуть, никель.
11. Способы получения металлов:
а) гидрометаллургия; б) пирометаллургия;
в).электрометаллургия; г)все ответы верны
После выполнения задания, поменялись листочками и проверяем
Один ученик решает задачу у доски.
II. Актуализация знаний.
Вопрос учителя. Почему металлы в природе чаще встречаются не в чистом виде, а в форме химических соединений?
(При образовании химического соединения, атом металла завершает свой внешний энергетический уровень.)
Учитель. Стремление металла к завершению энергетического уровня может причинить ущерб хозяйственной деятельности человека. В качестве примера я приведу историю, случившуюся с одним американским миллионером.
Стремление металла к завершению энергетического уровня может причинить ущерб хозяйственной деятельности человека. В качестве примера я приведу историю, случившуюся с одним американским миллионером.
III. Изучение новой темы.
Задача. В 20-е годы ХХ в. с одним американским миллионером произошла неприятная история. По его заказу была построена роскошная яхта “Зов моря”. Для обшивки корпуса яхты использовался сплав никеля с медью, известный под названием монель-металл. Этот сплав отличался чрезвычайно высокой стойкостью во многих агрессивных средах, в том числе и в морской воде. Другие детали корпуса судна были изготовлены из специальных нержавеющих сталей, т.е. материалов, содержащих железо. Но когда яхту спустили на воду, она полностью вышла из строя. Объясните, что послужило причиной гибели яхты.
Молодцы! Сегодня на уроке мы остановимся только на самопроизвольном разрушении металлов в результате взаимодействия их с окружающей средой, то есть с явлениями, изображенными на слайде.
Учитель: Как часто вы встречаетесь с явлением разрушения металлов?
Ученики: Приводят примеры.)
Учитель: А как называется это явление?
Ученики: ржавление, коррозия
Учитель: Итак, мы сегодня изучаем процесс коррозии металлов.
Постановка учебной задачи
У меня для вас еще одно задание. Составьте, пожалуйста, вопросы к теме, для этого используйте вопросы, написанные на доске. (Каждой группе по вопросу, которые у них написаны на листах, которые лежат на столах)
Учащиеся записывают вопросы, они вывешиваются на доске.
что?, почему?, как?, какая?, для чего? Составьте, пожалуйста, вопросы к теме «Коррозия металлов и способы защиты от неё» используя данные вопросительные слова.
– Что такое коррозия металлов?
– Почему возникает коррозия металлов?
– Как возникает коррозия металлов? (Как защитить металл от коррозии?)
– Какая бывает коррозия?
– Для чего надо изучать коррозию?
Учитель: Скажите, пожалуйста, какова будет цель нашего урока?
Ученики: Получить ответы на поставленные вопросы.
Мы должны выяснить:
1) Что такое коррозия металлов?
2) Какова роль коррозии в жизни человеческого общества и зачем ее изучать?
3) Какие виды коррозии бывают?
4) Как протекает этот процесс?
5) Какие способы защиты от нее существуют?
Изучение нового материала.
1. Определение коррозии
Одна группа по словарю.
Вторая работает с учебником.
Учитель: Коррозия представляет собой разрушение металлов вследствие взаимодействия их с внешней (коррозионной) средой. Этот термин происходит от латинского слова corrosio – разъедание. Коррозия – страшный бич промышленности, строительства, транспорта. Ежегодно из-за коррозии безвозвратно теряется 10… 12 % черных металлов. Ржавчина, которая появляется на поверхности стальных и чугунных изделий, – это яркий пример коррозии. Ржавлением называют только коррозию железа и его сплавов. Другие металлы коррозируют, но не ржавеют. Многие металлические предметы, которые мы используем в быту, не подвергаются видимой коррозии, в то время как потерянный ключ быстро ржавеет. Понятно, что с коррозией надо бороться. Но, чтобы победить ее, нужно знать причины и механизмы ее протекания. Как вы думаете, почему металлы коррозируют? Что может происходить с металлом при коррозии? Коррозия причиняет огромный ущерб, и мы повседневно замечаем следы ее опустошительного действия. Только потери стали из-за коррозии во всем мире оцениваются в сотни миллиардов долларов в год. Помимо этого коррозия причиняет огромный не поддающийся учету ущерб, связанный с выходом из строя коррозирующих деталей, машин, оборудования и сооружений. А загрязнения окружающей среды, вызванные утечкой газа, нефти и других опасных веществ из трубопроводов из-за коррозии, что отрицательно воздействует на здоровье и жизнь людей.
Ржавлением называют только коррозию железа и его сплавов. Другие металлы коррозируют, но не ржавеют. Многие металлические предметы, которые мы используем в быту, не подвергаются видимой коррозии, в то время как потерянный ключ быстро ржавеет. Понятно, что с коррозией надо бороться. Но, чтобы победить ее, нужно знать причины и механизмы ее протекания. Как вы думаете, почему металлы коррозируют? Что может происходить с металлом при коррозии? Коррозия причиняет огромный ущерб, и мы повседневно замечаем следы ее опустошительного действия. Только потери стали из-за коррозии во всем мире оцениваются в сотни миллиардов долларов в год. Помимо этого коррозия причиняет огромный не поддающийся учету ущерб, связанный с выходом из строя коррозирующих деталей, машин, оборудования и сооружений. А загрязнения окружающей среды, вызванные утечкой газа, нефти и других опасных веществ из трубопроводов из-за коррозии, что отрицательно воздействует на здоровье и жизнь людей.
В ноябре 2007 года в Керченском заливе во время сильного шторма затонуло 12 судов. Все они были насквозь проржавевшими. Один из них – танкер “Волгонефть-139” разломился пополам. В море вылилось 2000 т мазута. В результате погибло 35000 птиц, несколько десятков километров береговой линии оказались загрязненными. Предварительный ущерб равен 30 млрд. рублям. Самое страшное, что погибли люди. Причиной этого экологического бедствия явился не только шторм, но и человеческий фактор: такие суда нельзя допускать к эксплуатации!
Все они были насквозь проржавевшими. Один из них – танкер “Волгонефть-139” разломился пополам. В море вылилось 2000 т мазута. В результате погибло 35000 птиц, несколько десятков километров береговой линии оказались загрязненными. Предварительный ущерб равен 30 млрд. рублям. Самое страшное, что погибли люди. Причиной этого экологического бедствия явился не только шторм, но и человеческий фактор: такие суда нельзя допускать к эксплуатации!
Все осознают, что с коррозией надо бороться. А чтобы ее победить нужно, знать причины и механизмы ее протекания. Как вы думаете, почему металлы корродируют?
Ученики: Вероятно, металлы переходят в стабильное состояние, переходя в состав химических соединений, т.е. превращаются в ионы.
Учитель: Вы абсолютно правы, с химической точки зрения коррозией называют самопроизвольный процесс разрушения металлов и изделий из них под химическим воздействием окружающей среды, при этом металлы окисляются и переходят в устойчивые формы существования.
Учитель: Продолжит рассказ по теме, привлекая детей работать с рисунком учебника.
Учитель: Сделайте вывод об условии возникновения коррозии.
Ученики: Первое условие возникновения коррозии – это наличие окислителя в окружающей среде.
Учитель: Железо под воздействием O2 , H2О постепенно корродирует. Этот процесс является окислительно-восстановительным, где металл является восстановителем. Коррозия железа может быть описана упрощенным уравнением
4Fe + 3O2 + 6H2О = 4 Fe(OH) 3
Fe0-3е= Fe+3 восстановитель
O02+4 е=2O-2 окислитель
Учитель: В этих опытах мы выяснили роль кислорода воздуха в коррозии железа.
Реакция с медью (демонстрационный опыт)
Учитель: Во влажном воздухе поверхность меди покрывается зеленоватым налетом (патиной) в результате образования основной гидрооксид меди
Запишем вывод: Кислород является одним из агрессивных факторов коррозии. При этом происходит химическая коррозия.
При этом происходит химическая коррозия.
Давайте дадим определение понятию “химическая коррозия”.
Обратитесь к записям, почему медь, железо корродируют?
Ученики: Окисляются кислородом. Вступают в химическую реакцию
Учитель: Какой процесс лежит в основе этого типа коррозии?
Ученики: Химическая реакция
Учитель: А теперь соедините все вместе, и получится понятие – химическая коррозия
Химическая коррозия – это разрушение металлов в результате их химического взаимодействия с веществами окружающей среды .
Учитель: А подвергается ли коррозии алюминий? И каково значение этого процесса?
Многие металлы, в том числе и довольно активные (например, алюминий) при коррозии покрываются плотной, хорошо скрепленной с металлами оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха. Значит, этот процесс коррозии полезен.
При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха. Значит, этот процесс коррозии полезен.
4Al + 3O2 → 2 Al2O3
Учитель: Во влажном воздухе поверхность меди покрывается зеленоватым налетом (патиной) в результате образования основной гидрооксид меди
Не потвергается коррозии химически чистое железо.
Более полутора тысяч лет назад в Индии была изготовлена железная колонна весом в 6,5 т, высотой 7,3 м, диаметром у основания 41,6 см, у верха 29,5 см, стоящая ныне на одной из площадей индийской столицы. Она стоит на тропическом солнце, под дождями 15 столетий, но не подверглась ни малейшей коррозии.
Ученики: Металлы – восстановители. Они могут только отдавать электроны. Значит Me0 – ne = Me+n
По характеру взаимодействия металла и среды коррозия бывает химическая и электрохимическая.
В обоих случаях протекает окислительно-восстановительная реакция, в ходе которой металл окисляется, а окислитель внешней среды – восстанавливается. Различие заключается в том, что при химической коррозии электроны переходят от металла к окислителю непосредственно, а при электрохимической коррозии окислительно-восстановительная реакция разбивается на полуреакции окисления и восстановления. Электроны переходят по металлу от восстановителя к окислителю. Поток электронов направлен от более активного металла (анод (+)) к менее активному металлу (катод (-)) и коррозии подвергается, более активный металл. Чем левее в ряду напряжений стоят металлы, тем выше скорость коррозии.
Разрушение металла без появления электрического тока, под действием среды – химическая коррозия.
К электрохимической относятся все случаи коррозии в среде электролита, она встречается значительно чаще
Выполнение лабораторного опыта (работав парах). ТБ.
ТБ.
Опыт 1. Коррозия в условии контакта разных металлов.
а) В две пробирки налейте по 2-3 мл 2н раствора соляной кислоты и внесите по одной грануле цинка. Наблюдайте выделение газа в пробирках.
б) В одну из пробирок введите медную проволоку, не касаясь кусочка цинка. Взаимодействует ли медь с кислотой?
В) Приведите медную проволоку в соприкосновение с цинком. Как изменилась скорость реакции? Обратите внимание на накопление пузырьков газа на поверхности медной проволоки. Объясните наблюдаемые явления.
Опыт 2. Влияние поверхности металла на скорость коррозии.
2) В две пробирки налейте по 1 мл раствора серной кислоты (1:5). Опустите в одну пробирку новую гранулу цинка, в другую – гранулу цинка, смоченную предварительно раствором медного купороса, т.е. загрязненную. Убедитесь, что металлы чистые и загрязненные корродируют с разной скоростью.
Опыт 3. Коррозия в среде электролита.
Налейте в пробирку 2 мл 2н раствора соляной кислоты и опустите в неё алюминиевую проволочку. Идёт реакция? Добавьте в пробирку небольшое количество кристаллического хлорида натрия. Запишите наблюдения. Сделайте вывод о влиянии стимулятора коррозии на скорость процесса.
А теперь давайте мы с вами вернемся к рассказу « Зов моря». И объясним причину разрушения корабля.
Итак, мы выяснили, что такое коррозия, в чем ее сущность, от чего зависит, знаем, что она приносит громадный ущерб человечеству. Осталось познакомиться со способами защиты от коррозии. Защита металлов от коррозии – очень важная задача.
Великий Гете сказал: «Просто знать – еще не все, знания нужно уметь использовать». Как защитить металлы от коррозии?
Способы защиты металлов от коррозии.
Учащимся даны задания. Необходимо представить способы защиты металла от коррозии, предоставленные на выставке.
Необходимо представить способы защиты металла от коррозии, предоставленные на выставке.
Задание группе:
Задание первой группе:
Рассмотрите образцы выданных вам металлических изделий, определите: какой основной способ защиты металла от коррозии применялся в этих случаях. (Изделия, покрытые неметаллической защитной пленкой).
Прочитайте в учебнике и приложении описание этого способа, определите его эффективность, с точки зрения экономиста и технолога.
Встречали ли вы этот способ защиты металлов у себя дома, в школе, на улице?
Приготовьте короткий рассказ об этом способе защиты для класса.
Рассмотрите образцы выданных вам металлических изделий, определите: какой основной способ защиты металла от коррозии применялся в этих случаях. (Изделия покрытые металлическими покрытиями)
Прочитайте в учебнике и приложении описание этого способа, определите его эффективность, с точки зрения экономиста и технолога.
Встречали ли вы этот способ защиты металлов у себя дома, в школе, на улице?
Приготовьте короткий рассказ об этом способе защиты для класса.
Все способы защиты металлов необходимо записать в конспект
Ученики: Записывают в опорный конспект
Нанесение на поверхность металлов защитных пленок: лака, краски, эмали,
Покрытие их слоем других металлов.
Использование нержавеющих сталей
Создание контакта с более активным металлом – протектором
Применение ингибиторов
Катодная защита
3 этап. Первичная проверка усвоения знаний.
Разбираем результаты демонстрационных опытов, записываем уравнения, рассматривая их как окислительно-восстановительные процессы (работа в группах), предоставляем результаты работы в группах. По окончании работы еще раз делаются выводы.
По окончании работы еще раз делаются выводы.
4 этап. Контроль знаний.
Что такое «коррозия»? Какие факторы способствуют замедлению коррозии металлов?
На стальной крышке поставлена медная заклепка. Что разрушится раньше – крышка или заклепка? Почему?
Какие виды коррозии вам известны?
Почему луженный (покрытый оловом) железный бак на месте повреждения защитного слоя быстро разрушается?
Какие факторы, способствуют усилению коррозии?
Какие металлы при взаимном контакте в присутствии электролита быстрее разрушаются Cu или Zn, Al или Fe? Почему?
Перечислите способы борьбы с коррозией?
Почему на оцинкованном баке на месте царапины цинк разрушается, а железо не ржавеет?
3. В домашней мастерской всегда много инструментов, запчастей и материалов, которые в основном изготовлены из металлов и их сплавов. Но вот беда — при хранении металлические изделия подвергаются коррозии. Укажите условия хранения металлических изделий, которые продлят срок их службы.
В домашней мастерской всегда много инструментов, запчастей и материалов, которые в основном изготовлены из металлов и их сплавов. Но вот беда — при хранении металлические изделия подвергаются коррозии. Укажите условия хранения металлических изделий, которые продлят срок их службы.
4.Требуется скрепить железные детали. Какими заклепками следует пользоваться медными или цинковыми, чтобы замедлить коррозию железа? Ответ обоснуйте.
5.Как называются вещества, замедляющие коррозию?
6.Введение, каких элементов в сталь повышает ее коррозионную стойкость?
7.К стальному днищу машины была предложена протекторная защита. Какой металл для этого лучше применить: Zn, Cu или Ni?
8.Почему многие изделия быстрее корродирует вблизи предприятий?
9.Лист железа, покрытый цинком, и лист железа, покрытый оловом, процарапали до железа. Будет ли подвергаться коррозии железо в обоих случаях?
10. В стихотворении Вадима Шефнера « Пустырь» есть такие строчки:
В стихотворении Вадима Шефнера « Пустырь» есть такие строчки:
«Коррозия – рыжая крыса. Грызет металлический лом»
Что это за рыжая крыса? Всегда ли результат коррозии имеет рыжий цвет?
11.Как вы думаете, какие процессы могли привести к разрушению одно из «Семи чудес Света» Колосса Родосского, если он представлял собою гигантскую статую бога Солнца (Гелиоса), простоявшую всего 66 лет. Известно, что при создании его отпечатанные бронзовые листы были укреплены на железном каркасе? Почему следует учитывать местоположение Колосса (он был установлен на острове Родос в Средиземном море).
IV. Подведение итога урока
Итак, на сегодняшнем уроке мы с вами изучили один из важнейших вопросов химической промышленности – коррозию металлов. Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих ее протекание. Коррозия металлов осуществляется в соответствии с законами природы и потому ее нельзя полностью устранить, а можно лишь замедлить, на что и направлена современная химическая наука.
Рефлексия
Что нового вы узнали сегодня на уроке?
Где могут понадобиться полученные вами знания?
Что ещё Вы хотели бы узнать по этой теме?
Спасибо за урок. До свидания
IV. Подведение итогов урока, домашнее задание – 2 мин.
Д/з: §13, упр.1, 2,.
Коррозия металлов. Почему ржавеют автомобильные кузова?
Коррозия металлов, как известно, приносит много бед. Уж не вам ли, уважаемые автовладельцы, объяснять, чем она грозит: дай ей волю, так от машины одни покрышки останутся. Поэтому, чем раньше начнется борьба с этим бедствием, тем дольше проживет автомобильный кузов.
Чтобы быть успешными в борьбе с коррозией, необходимо выяснить, что же это за «зверь» и понять причины ее возникновения.
Содержание
- Есть ли надежда?
- Что такое коррозия?
- Коррозия и ржавчина — не одно и то же
- Механизм протекания коррозионных процессов
- Виды коррозии
- Химическая коррозия
- Электрохимическая коррозия
- Олово и цинк.
 «Опасные» и «безопасные покрытия
«Опасные» и «безопасные покрытия - Факторы, влияющие на коррозию автомобильного кузова
- Металл: химический состав и структура
- Заводские кузовные технологии
- Влияние окружающей среды при эксплуатации
- Влажность и температура
- Доступ воздуха
- Ржавеют… все!
- Оцинковка — не панацея
Есть ли надежда?
Ущерб, наносимый человечеству коррозией, колоссален. По разным данным коррозия «съедает» от 10 до 25% мировой добычи железа. Превращаясь в бурый порошок, оно безвозвратно рассеивается по белу свету, в результате чего не только мы, но и наши потомки остаемся без этого ценнейшего материала.
Но беда не только в том, что теряется металл как таковой, нет — разрушаются мосты, машины, крыши, памятники архитектуры. Коррозия не щадит ничего.
Неизлечимо больна та же Эйфелева башня — символ Парижа. Изготовленная из обычной стали, она неизбежно ржавеет и разрушается. Башню приходится красить каждые 7 лет, отчего ее масса каждый раз увеличивается на 60-70 тонн.
К сожалению, полностью предотвратить коррозию металлов невозможно. Ну, разве что полностью изолировать металл от окружающей среды, например поместить в вакуум. 🙂 Но какой смысл от таких «консервированных» деталей? Металл должен работать. Поэтому единственным способом защиты от коррозии является поиск путей ее замедления.
В незапамятные времена для этого применяли жир, масла, позднее начали покрывать железо другими металлами. Прежде всего, легкоплавким оловом. В трудах древнегреческого историка Геродота (V в. до н.э.) и римского ученого Плиния-старшего уже есть упоминания о применении олова для защиты железа от коррозии.
Интересный случай произошел в 1965 году на Международном симпозиуме по борьбе с коррозией. Некий индийский ученый рассказал об обществе по борьбе с коррозией, которое существует около 1600 лет и членом которого он является. Так вот, полторы тысячи лет назад это общество принимало участие в постройке храмов Солнца на побережье у Конарака. И несмотря на то, что эти храмы некоторое время были затоплены морем, железные балки прекрасно сохранились. Так что и в те далекие времена люди знали толк в борьбе с коррозией. Может быть, не все так безнадежно?
Так что и в те далекие времена люди знали толк в борьбе с коррозией. Может быть, не все так безнадежно?
Что такое коррозия?
Слово «коррозия» происходит от латинского «corrodo – грызу». Встречаются ссылки и на позднелатинское «corrosio – разъедание». Но так или иначе:
Коррозия – это процесс разрушения металла в результате химического и электрохимического взаимодействия с окружающей средой.
Хотя коррозию чаще всего связывают с металлами, ей также подвергаются бетон, камень, керамика, дерево, пластмассы. Применительно к полимерным материалам, правда, чаще используется термин деструкция или старение.
Коррозия и ржавчина — не одно и то же
В определении коррозии абзацем выше не зря выделено слово «процесс». Дело в том, коррозию частенько приравнивают к термину «ржавчина». Однако это не синонимы. Коррозия — это именно процесс, в то время как ржавчина — один из результатов этого процесса.
Коррозия — это именно процесс, в то время как ржавчина — один из результатов этого процесса.
Также стоит отметить, что ржавчина — продукт коррозии исключительно железа и его сплавов (таких как сталь или чугун). Поэтому, когда говорим «ржавеет сталь», то подразумеваем, что ржавеет железо в ее составе.
Если ржавчина относится только к железу, значит другие металлы не ржавеют? Не ржавеют, но это не значит, что они не корродируют. Просто продукты коррозии у них другие.
Например, медь, корродируя, покрывается красивым по цвету зеленоватым налетом (патиной). Серебро на воздухе тускнеет — это на его поверхности образуется налет сульфида, чья тонкая пленка придает металлу характерную розоватую окраску.
Патина — продукт коррозии меди и ее сплавовМеханизм протекания коррозионных процессов
Разнообразие условий и сред, в которых протекают коррозионные процессы, очень широко, поэтому сложно дать единую классификацию встречающихся случаев коррозии. Но, несмотря на это, все коррозионные процессы имеют не только общий результат — разрушение металла, но и единую химическую сущность — окисление.
Упрощенно окисление можно назвать процессом обмена веществ электронами. Когда одно вещество окисляется (отдает электроны), другое, наоборот, восстанавливается (получает электроны).
Например, в реакции…
… атом цинка теряет два электрона (окисляется), а молекула хлора присоединяет их (восстанавливается).
Частицы, которые отдают электроны и окисляются, называются восстановителями, а частицы, которые принимают электроны и восстанавливаются, называются окислителями. Два этих процесса (окисление и восстановление) взаимосвязаны и всегда протекают одновременно.
Такие вот реакции, которые в химии называются окислительно-восстановительными, лежат в основе любого коррозионного процесса.
Склонность к окислению у разных металлов неодинакова. Чтобы понять, у каких она больше, а у каких меньше, вспомним школьный курс химии. Было там такое понятие как электрохимический ряд напряжений (активности) металлов, в котором все металлы расположены слева направо в порядке повышения «благородности».
Так вот, металлы, расположенные в ряду левее, более склонны к отдаче электронов (а значит и к окислению), чем металлы, стоящие правее. Например, железо (Fe) больше подвержено окислению, чем более благородная медь (Cu). Отдельные металлы (например, золото), могут отдавать электроны только при определенных экстремальных условиях.
К ряду активности вернемся немного позже, а сейчас поговорим об основных видах коррозии.
Виды коррозии
Как уже говорилось, критериев классификация коррозионных процессов существует множество. Так, различают коррозию по виду распространения (сплошная, местная), по типу коррозионной среды (газовая, атмосферная, жидкостная, почвенная), по характеру механических воздействий (коррозионное растрескивание, явление Фреттинга, кавитационная коррозия) и так далее.
Но основным способом классификации коррозии, позволяющим наиболее полно объяснить все тонкости этого процесса, является классификация по механизму протекания.
По этому критерию различают два вида коррозии:
- химическую
- электрохимическую
Химическая коррозия
Химическая коррозия отличается от электрохимической тем, что протекает в средах, не проводящих электрический ток. Поэтому при такой коррозии разрушение металла не сопровождается возникновением электрического тока в системе. Это обычное окислительно-восстановительное взаимодействие металла с окружающей средой.
Поэтому при такой коррозии разрушение металла не сопровождается возникновением электрического тока в системе. Это обычное окислительно-восстановительное взаимодействие металла с окружающей средой.
Наиболее типичным примером химической коррозии является газовая коррозия. Газовую коррозию еще называют высокотемпературной, поскольку обычно она протекает при повышенных температурах, когда возможность конденсации влаги на поверхности металла полностью исключена. К такому виду коррозии можно отнести, например, коррозию элементов электронагревателей или сопел ракетных двигателей.
Скорость химической коррозии зависит от температуры — при ее повышении коррозия ускоряется. Из-за этого, например, в процессе производства металлического проката, во все стороны от раскаленной массы разлетаются огненные брызги. Это с поверхности металла скалываются частички окалины.
Окалина — типичный продукт химической коррозии, — оксид, возникающий в результате взаимодействия раскаленного металла с кислородом воздуха.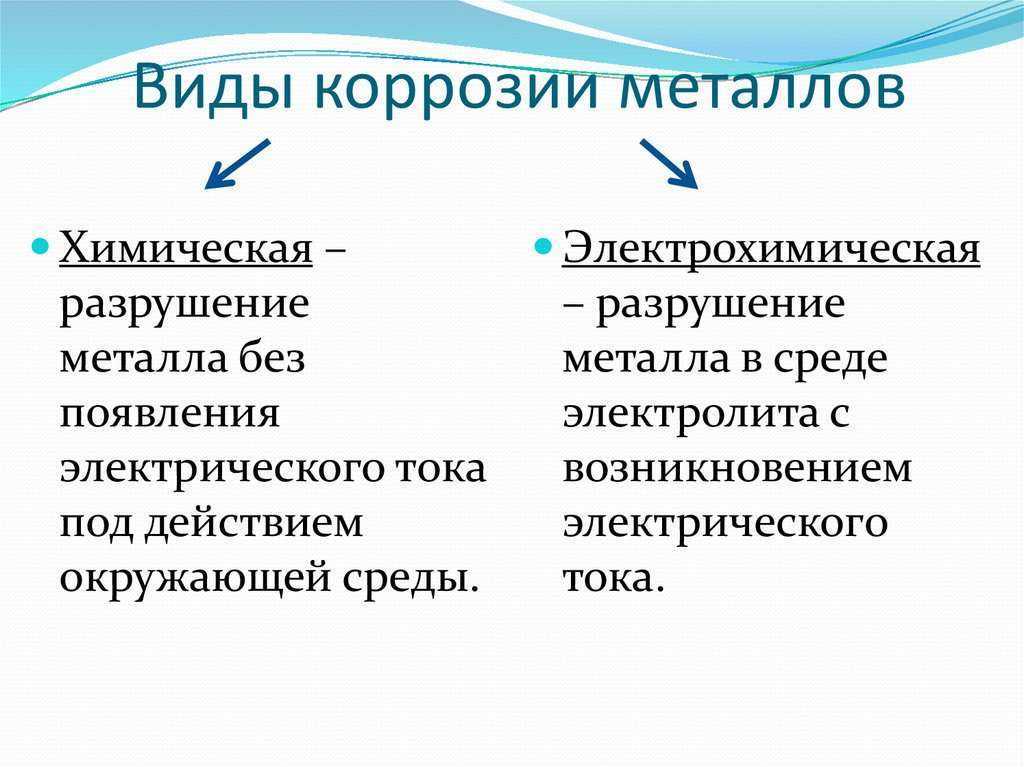
Помимо кислорода и другие газы могут обладать сильными агрессивными свойствами по отношению к металлам. К таким газам относятся диоксид серы, фтор, хлор, сероводород. Так, например, алюминий и его сплавы, а также стали с высоким содержанием хрома (нержавеющие стали) устойчивы в атмосфере, которая содержит в качестве основного агрессивного агента кислород. Но картина кардинально меняется, если в атмосфере присутствует хлор.
В документации к некоторым антикоррозионным препаратам химическую коррозию иногда называют «сухой», а электрохимическую — «мокрой». Однако химическая коррозия может протекать и в жидкостях. Только в отличие от электрохимической коррозии эти жидкости — неэлектролиты (т.е. не проводящие электрический ток, например спирт, бензол, бензин, керосин).
Примером такой коррозии является коррозия железных деталей двигателя автомобиля. Присутствующая в бензине в качестве примесей сера взаимодействует с поверхностью детали, образуя сульфид железа. Сульфид железа очень хрупок и легко отслаивается, освобождая свежую поверхность для дальнейшего взаимодействия с серой. И так, слой за слоем, деталь постепенно разрушается.
И так, слой за слоем, деталь постепенно разрушается.
Электрохимическая коррозия
Если химическая коррозия представляет собой не что иное, как простое окисление металла, то электрохимическая — это разрушение за счет гальванических процессов.
В отличие от химической, электрохимическая коррозия протекает в средах с хорошей электропроводностью и сопровождается возникновением тока. Для «запуска» электрохимической коррозии необходимы два условия: гальваническая пара и электролит.
В роли электролита выступает влага на поверхности металла (конденсат, дождевая вода и т.д.). Что такое гальваническая пара? Чтобы понять это, вернемся к ряду активности металлов.
Смотрим. Cлева расположены более активные металлы, справа — менее активные.
Если в контакт вступают два металла с различной активностью, они образуют гальваническую пару, и в присутствии электролита между ними возникает поток электронов, перетекающих от анодных участков к катодным. При этом более активный металл, являющийся анодом гальванопары, начинает корродировать, в то время как менее активный коррозии не подвергается.
При этом более активный металл, являющийся анодом гальванопары, начинает корродировать, в то время как менее активный коррозии не подвергается.
Для наглядности рассмотрим несколько простых примеров.
Допустим, стальной болт закреплен медной гайкой. Что будет корродировать, железо или медь? Смотрим в ряд активности. Железо более активно (стоит левее), а значит именно оно будет разрушаться в месте соединения.
Стальной болт — медная гайка (корродирует сталь)А если гайка алюминиевая? Снова смотрим в ряд активности. Здесь картина меняется: уже алюминий (Al), как более активный металл, будет терять электроны и разрушаться.
Таким образом, контакт более активного «левого» металла с менее активным «правым» усиливает коррозию первого.
В качестве примера электрохимической коррозии можно привести случаи разрушения и затопления кораблей, железная обшивка которых была скреплена медными заклепками. Также примечателен случай, который произошел в декабре 1967 года с норвежским рудовозом «Анатина», следовавшим из Кипра в Осаку.
В Тихом океане на судно налетел тайфун и трюмы заполнились соленой водой, в результате чего возникла большая гальваническая пара: медный концентрат + стальной корпус судна. Через некоторое время стальной корпус судна начал размягчаться и оно вскоре подало сигнал бедствия. К счастью, экипаж был спасен подоспевшим немецким судном, а сама «Анатина» кое-как добралась до порта.
Олово и цинк. «Опасные» и «безопасные покрытия
Возьмем еще пример. Допустим, кузовная панель покрыта оловом. Олово — очень стойкий к коррозии металл, кроме того, оно создает пассивный защитный слой, ограждая железо от взаимодействия с внешней средой. Значит, железо под слоем олова находится в целости и сохранности? Да, но только до тех пор, пока слой олова не получит повреждение.
А когда такое случается, между оловом и железом тут же возникает гальваническая пара, и железо, являющееся более активным металлом, под воздействием гальванического тока начнет корродировать.
Кстати, в народе до сих пор ходят легенды о якобы «вечных» луженых кузовах «Победы».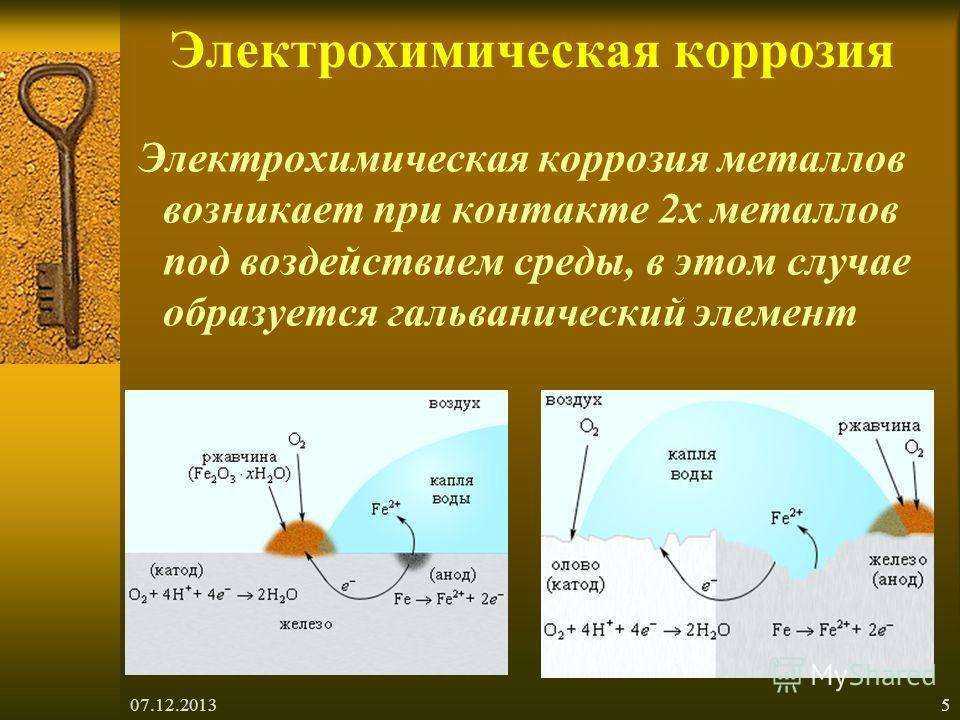 Корни этой легенды таковы: ремонтируя аварийные машины, мастера использовали паяльные лампы для нагрева. И вдруг, ни с того ни с сего, из-под пламени горелки начинает «рекой» литься олово! Отсюда и пошла молва, что кузов «Победы» был полностью облужен.
Корни этой легенды таковы: ремонтируя аварийные машины, мастера использовали паяльные лампы для нагрева. И вдруг, ни с того ни с сего, из-под пламени горелки начинает «рекой» литься олово! Отсюда и пошла молва, что кузов «Победы» был полностью облужен.
На самом деле все гораздо прозаичнее. Штамповая оснастка тех лет была несовершенной, поэтому поверхности деталей получались неровными. Вдобавок тогдашние стали не годились для глубокой вытяжки, и образование морщин при штамповке стало обычным делом. Сваренный, но еще не окрашенный кузов приходилось долго готовить. Выпуклости сглаживали наждачными кругами, а вмятины заполняли оловяным припоем, особенно много которого было вблизи рамки ветрового стекла. Только и всего.
Ну, а так ли «вечен» луженый кузов, вы уже знаете: он вечен до первого хорошего удара острым камешком. А их на наших дорогах более чем достаточно.
А вот с цинком картина совсем другая. Здесь, можно сказать, мы бьем электрохимическую коррозию ее же оружием. Защищающий металл (цинк) в ряду напряжений стоит левее железа. А значит при повреждении будет разрушаться уже не сталь, а цинк. И только после того, как прокорродирует весь цинк, начнет разрушаться железо. Но, к счастью, корродирует он очень и очень медленно, сохраняя сталь на долгие годы.
А значит при повреждении будет разрушаться уже не сталь, а цинк. И только после того, как прокорродирует весь цинк, начнет разрушаться железо. Но, к счастью, корродирует он очень и очень медленно, сохраняя сталь на долгие годы.
Покрытия, выполненные из более активных металлов называются «безопасными«, а из менее активных — «опасными«. Безопасные покрытия, в частности оцинковка, давно и успешно применяются как способ защиты от коррозии автомобильных кузовов.
Почему именно цинк? Ведь помимо цинка в ряду активности относительно железа более активными являются еще несколько элементов. Здесь подвох вот в чем: чем дальше в ряду активности находятся друг от друга два металла, тем быстрее разрушение более активного (менее благородного). А это, соответственно, сокращает долговечность антикоррозионной защиты. Так что для автомобильных кузовов, где помимо хорошей защиты металла важно достичь и продолжительного срока действия этой защиты, оцинковка подходит как нельзя лучше. Тем более, что цинк доступен и недорог.
Так что для автомобильных кузовов, где помимо хорошей защиты металла важно достичь и продолжительного срока действия этой защиты, оцинковка подходит как нельзя лучше. Тем более, что цинк доступен и недорог.
Кстати, а что будет, если покрыть кузов, например, золотом? Во-первых, будет ох как дорого! 🙂 Но даже если золото стало бы самым дешевым металлом, такого делать нельзя, поскольку оно окажет нашей «железке» плохую услугу.
Золото ведь стоит очень далеко от железа в ряду активности (дальше всего), и при малейшей царапине железо вскоре превратится в груду ржавчины, покрытую золотой пленкой.
Автомобильный кузов подвергается воздействию как химической, так электрохимической коррозии. Но главная роль все же отводится электрохимическим процессам.
Ведь, чего греха таить, гальванических пар в автомобильном кузове много: это и сварные швы, и контакты разнородных металлов, и посторонние включения в листовом прокате. Не хватает только электролита, чтобы «включить» эти гальванические элементы.
А электролит тоже найти легко — хотя бы влага, содержащаяся в атмосфере.
Кроме того, в реальных условиях эксплуатации оба вида коррозии усиливаются множеством других факторов. Поговорим о главных из них поподробнее.
Факторы, влияющие на коррозию автомобильного кузова
Металл: химический состав и структура
Конечно, если бы автомобильные кузова изготавливались из технически чистого железа, их коррозионная стойкость была бы безупречной. Но к сожалению, а может быть и к счастью, это невозможно. Во-первых, такое железо для автомобиля слишком дорого, во-вторых (что важнее) — недостаточно прочно.
Но не будем о высоких идеалах, а вернемся к тому, что имеем. Возьмем, к примеру, сталь марки 08КП, широко применяемую в России для штамповки кузовных деталей. При изучении под микроскопом эта сталь представляет собой следующее: мелкие зерна чистого железа перемешаны с зернами карбида железа и другими включениями.
Как вы уже догадались, подобная структура порождает множество микрогальванических элементов, и как только в системе появится электролит, коррозия потихоньку начнет свою разрушительную деятельность.
Интересно, что процесс коррозии железа ускоряется под действием серосодержащих примесей. Обычно она попадает в железо из каменного угля при доменной выплавке из руд. Кстати, в далеком прошлом для этой цели использовался не каменный, а древесный уголь, практически не содержащий серы.
В том числе и по этой причине некоторые металлические предметы древности за свою многовековую историю практически не пострадали от коррозии. Взгляните, к примеру, на эту железную колонну, которая находится во дворе минарета Кутуб-Минар в Дели.
Она стоит уже 1600 (!) лет и хоть бы что. Наряду с низкой влажностью воздуха в Дели, одной из причин такой поразительной коррозионной стойкости индийского железа является, как раз-таки, низкое содержание в металле серы.
Так что в рассуждениях по типу «раньше металл был чище и кузов долго не ржавел», все же есть доля правды, и немалая.
Кстати, почему же тогда не ржавеют нержавеющие стали? А потому, что хром и никель, используемые в качестве легирующих компонентов этих сталей, стоят в электрохимическом ряду напряжений рядом с железом. Кроме того, при контакте с агрессивной средой они образуют на поверхности прочную оксидную пленку, предохраняющую сталь от дальнейшего корродирования.
Кроме того, при контакте с агрессивной средой они образуют на поверхности прочную оксидную пленку, предохраняющую сталь от дальнейшего корродирования.
Хромоникелевая сталь — наиболее типичная нержавейка, но кроме нее есть и другие марки нержавеющих сталей. Например, легкие нержавеющие сплавы могут включать алюминий или титан. Если вы были во Всероссийском выставочном центре, вы наверняка видели перед входом обелиск «Покорителям космоса». Он облицован пластинками из титанового сплава и на его блестящей поверхности нет ни единого пятнышка ржавчины.
Заводские кузовные технологии
Толщина листовой стали, из которой изготавливаются кузовные детали современного легкового автомобиля, составляет, как правило, менее 1 мм. А в некоторых местах кузова эта толщина — и того меньше.
Особенностью процесса штамповки кузовных элементов, да и вообще, любой пластической деформации металла, является возникновение в ходе деформации нежелательных остаточных напряжений. Эти напряжения незначительны, если шпамповочное оборудование не изношено, и скорости деформирования настроены правильно.
В противном случае в кузовную панель закладывается своеобразная «часовая бомба»: порядок расположения атомов в кристаллических зернах меняется, поэтому металл в состоянии механического напряжения корродирует интенсивнее, чем в нормальном состоянии. И, что характерно, разрушение металла происходит именно на деформированных участках (изгибах, отверстиях), играющих роль анода.
Кроме того, при сварке и сборке кузова на заводе в нем образуется множество щелей, нахлестов и полостей, в которых скапливается грязь и влага. Не говоря уже о сварных швах, образующих с основным металлом все те же гальванические пары.
Влияние окружающей среды при эксплуатации
Среда, в которой эксплуатируются металлические конструкции, в том числе и автомобили, с каждым годом становится все более агрессивной. В последние десятилетия в атмосфере повысилось содержание сернистого газа, оксидов азота и углерода. А значит, автомобили омываются уже не просто водичкой, а кислотными дождями.
Коль уж зашла речь о кислотных дождях, вернемся еще раз к электрохимическому ряду напряжений. Наблюдательный читатель подметил, что в него включен также и водород. Резонный вопрос: зачем? А вот зачем: его положение показывает, какие металлы вытесняют водород из растворов кислот, а какие — нет. Например, железо расположено левее водорода, а значит вытесняет его из растворов кислот, в то время как медь, стоящая правее, на подобный подвиг уже не способна.
Наблюдательный читатель подметил, что в него включен также и водород. Резонный вопрос: зачем? А вот зачем: его положение показывает, какие металлы вытесняют водород из растворов кислот, а какие — нет. Например, железо расположено левее водорода, а значит вытесняет его из растворов кислот, в то время как медь, стоящая правее, на подобный подвиг уже не способна.
Отсюда следует, что кислотные дожди для железа опасны, а для чистой меди — нет. А вот о бронзе и других сплавах на основе меди этого сказать нельзя: они содержат алюминий, олово и другие металлы, находящиеся в ряду левее водорода.
Замечено и доказано, что в условиях большого города кузова живут меньше. В этой связи показательны данные Шведского института коррозии (ШИК), установившего, что:
- в сельской местности Швеции скорость разрушения стали составляет 8 мкм в год, цинка — 0,8 мкм в год;
- для города эти цифры составляют 30 и 5 мкм в год соответственно.
Немаловажны и климатические условия, в которых эксплуатируется автомобиль. Так, в условиях морского климата коррозия активизируется примерно в два раза.
Так, в условиях морского климата коррозия активизируется примерно в два раза.
Влажность и температура
Насколько велико влияние влажности на коррозию мы можем понять на примере ранее упомянутой железной колонны в Дели (вспомним сухость воздуха, как одну из причин ее коррозионной стойкости).
Поговаривают, что один иностранец решил раскрыть тайну этого нержавеющего железа и каким-то образом отколол небольшой кусочек от колонны. Каково же было его удивление, когда еще на корабле по пути из Индии этот кусочек покрылся ржавчиной. Оказывается, на влажном морском воздухе нержавеющее индийское железо оказалось не таким уж и нержавеющим. Кроме того, аналогичную колонну из Конарака, расположенного поблизости моря, коррозия поразила очень сильно.
Скорость коррозии при относительной влажности до 65% сравнительно невелика, но когда влажность возрастает выше указанного значения — коррозия резко ускоряется, поскольку при такой влажности на металлической поверхности образуется слой влаги. И чем дольше поверхность остается влажной, тем быстрее распространяется коррозия.
И чем дольше поверхность остается влажной, тем быстрее распространяется коррозия.
Вот почему основные очаги коррозии всегда обнаруживаются в скрытых полостях кузова: cохнут-то они гораздо медленнее открытых частей. Как результат — в них образуются застойные зоны, — настоящий рай для коррозии.
Кстати, применение химических реагентов для борьбы с гололедом коррозии тоже на руку. Вперемешку с подтаявшими снегом и льдом антигололедные соли образуют очень сильный электролит, способный проникнуть куда угодно, в том числе и в скрытые полости.
Что касается температуры, то мы уже знаем, что ее повышение активизирует коррозию. По этой причине вблизи выхлопной системы следов коррозии всегда будет больше.
Доступ воздуха
Интересная все-таки вещь эта коррозия. К примеру, не удивляйтесь, что блестящий стальной трос, с виду абсолютно не тронутый коррозией, внутри может оказаться проржавевшим. Так происходит из-за неравномерного доступа воздуха: в тех местах, где он затруднен, угроза коррозии больше. В теории коррозии это явление называется дифференциальной аэрацией.
В теории коррозии это явление называется дифференциальной аэрацией.
Принцип дифференциальной аэрации: неравномерный доступ воздуха к разным участкам металлической поверхности приводит к образованию гальванического элемента. При этом участок, интенсивно снабжаемый кислородом, остается невредимым, а участок хуже снабжаемый им, корродирует.
Яркий пример: капля воды, попавшая на поверхность металла. Участок, находящийся под каплей и потому хуже снабжаемый кислородом, играет роль анода. Металл на этом участке окисляется, а роль катода выполняют края капли, более доступные влиянию кислорода. В результате на краях капли начинает осаждаться гидроксид железа — продукт взаимодействия железа, кислорода и влаги.
Кстати, гидроксид железа (Fe2O3·nH2O) и является тем, что мы называем ржавчиной. Поверхность ржавчины, в отличие от патины на медной поверхности или оксидной пленки алюминия, не защищает железо от дальнейшего корродирования. Изначально ржавчина имеет структуру геля, но затем постепенно происходит ее кристаллизация.
Изначально ржавчина имеет структуру геля, но затем постепенно происходит ее кристаллизация.
Кристаллизация начинается внутри слоя ржавчины, при этом внешняя оболочка геля, который в сухом состоянии очень рыхлый и хрупкий, отслаивается, и воздействию подвергается следующий слой железа. И так до тех пор, пока все железо не будет уничтожено или в системе не закончится весь кислород с водой.
Вспоминая принцип дифференциальной аэрации, можно представить, сколько существует возможностей для развития коррозии в скрытых, плохо проветриваемых участках кузова.
Ржавеют… все!
Выше в статье упоминался такой известный центр борьбы с коррозией, как Шведский институт коррозии (ШИК) — одна из наиболее авторитетных организаций в данной области.
Раз в несколько лет ученые института проводят интересное исследование: берут кузова хорошо потрудившихся автомобилей, вырезают из них наиболее подверженные коррозии «фрагменты» (участки порогов, колесных арок, кромок дверей и т. д.) и оценивают степень их коррозионного поражения.
д.) и оценивают степень их коррозионного поражения.
Важно отметить, что среди исследуемых кузовов есть как защищенные (оцинковкой и/или антикором), так и кузова без какой либо дополнительной антикоррозионной защиты (просто окрашенные детали).
Так вот, ШИК утверждает, что наилучшей защитой автомобильного кузова является лишь сочетание «цинк плюс антикор». А вот все остальные варианты, включая «просто оцинковку» или «просто антикор», по словам ученых — плохи.
Оцинковка — не панацея
Сторонники отказа от дополнительной антикоррозионной обработки часто ссылаются на заводскую оцинковку: с ней, мол, никакая коррозия автомобилю не грозит. Но, как показали шведские ученые, это не совсем так.
Действительно, цинк может служить в качестве самостоятельной защиты, но только на ровных и плавных поверхностях, к тому же не подверженных механическим атакам. А на кромках, краях, стыках, а также местах, регулярно подвергающихся «обстрелу» песком и камнями, оцинковка перед коррозией пасует.
К тому же, далеко не у всех автомобилей кузова оцинкованы полностью. Чаще всего цинком покрыто лишь несколько панелей.
Ну и не нужно забывать, что цинк хоть и защищает сталь, но в процессе защиты неизбежно расходуется сам. Поэтому толщина цинкового «щита» со временем будет постепенно снижаться.
Так что легенды о долгожительстве оцинкованных кузовов правдивы лишь в тех случаях, когда цинк становится частью общей защиты, дополнением к регулярной дополнительной антикоррозионной обработке кузова.
Пора заканчивать, но на этом тема коррозии далеко не исчерпана. О борьбе с ней мы продолжим говорить в следующих статьях рубрики «Антикоррозионная защита».
Коррозия «в жизни» автотехники
В химии есть понятие «скорость коррозии». Это глубина проникновения коррозии в металл за единицу времени. Для железа наиболее характерным является показатель 0,05-0,2 мм/год. Это значит, что при нарушении лакокрасочного покрытия за 5 лет толщина металла кузова автомобиля уменьшится, если не принимать соответствующих мер, на 0,25-1 мм. Другими словами, в отдельных местах проржавеет насквозь.
Другими словами, в отдельных местах проржавеет насквозь.
Разложим по полочкам
Проблема защиты металла от коррозии предстала перед человечеством с того момента, как только оно узнало о существовании железной руды. Есть документы V века до н. э., где Геродот описывает процесс защиты железного изделия покрытием его поверхности слоем олова. А о борьбе с действием коррозии с помощью смазывания поверхностей жиром или различными маслами имеются свидетельства более древних времен.
Слово «коррозия» происходит от латинского «corrodo», что значит «грызу». Определение, надо заметить, яркое и точное.
Коррозия – явление очень сложное. Это процесс самопроизвольного разрушения металла в результате окисления, которое является следствием химического или электрохимического контактирования с окружающей средой. Коррозия действует на детали транспортного средства постоянно, работает ли техника, или стоит «на приколе». В последнем случае коррозирование идет даже значительно активней. Появление коррозии всегда сопровождается повышением влагоудерживающей способности металла, и разрушительный процесс только ускоряется. Прежде всего, коррозия поражает металл кабины, поверхности рам, корпусные детали, особенно металл выпускного коллектора и выхлопной системы.
Появление коррозии всегда сопровождается повышением влагоудерживающей способности металла, и разрушительный процесс только ускоряется. Прежде всего, коррозия поражает металл кабины, поверхности рам, корпусные детали, особенно металл выпускного коллектора и выхлопной системы.
В результате коррозии на поверхности металла образуется окисленный слой. Некоторые металлы, например алюминий, при коррозии покрываются плотной, хорошо скрепленной с металлом оксидной пленкой. Она является отличной защитой от дальнейшего распространения коррозии в более глубокие слои металла, образуя своего рода щит.
Другое дело железо. Оно в результате коррозии ржавеет. Процесс этот довольно сложен и имеет несколько стадий. Образующийся на поверхности металла гидрооксид железа – очень неустойчивое химическое соединение. Теряя воду, оно быстро превращается в оксид железа. А это соединение не является препятствием к дальнейшему окислению. Поэтому детали из железа, незащищенные от коррозии, достаточно быстро могут полностью разрушаться.
При химической коррозии разрушение металла вызывается действием сухих газов, а также контактом с отдельными видами смазок и органических теплоносителей. Этот вид коррозии можно наблюдать на зеркале цилиндров карбюраторных и дизельных двигателей, на рабочих поверхностях выпускных клапанов, на стенках камер сгорания. Явление химической коррозии, вызванное контактом металла с ГСМ, проявляется на внутренних стенках топливных баков.
Электрохимическая коррозия возникает в местах контакта металла с влажными газами, в том числе с атмосферным воздухом. Также этот вид коррозии возникает в месте контакта двух разнородных металлов, создающих своего рода гальваническую пару. Под воздействием кислот и растворов солей возникает электролитический процесс, при этом более активный металл быстро разрушается.
Существует разделение видов коррозии с точки зрения коррозионных сред.
Газовая коррозия представляет собой химическую коррозию в газовой среде при высокой температуре без присутствия влаги. При контакте с химически активным газом на поверхности металла появляется пленка из продуктов реакции. При высоких температурах процесс убыстряется, пленка утолщается, не давая контактировать металлу и газу, и поверхность металла интенсивно коррозирует. Этот вид коррозии представляет большую проблему для металлургии и других отраслей промышленности, где в технологии участвуют высокие температуры и активные газы.
При контакте с химически активным газом на поверхности металла появляется пленка из продуктов реакции. При высоких температурах процесс убыстряется, пленка утолщается, не давая контактировать металлу и газу, и поверхность металла интенсивно коррозирует. Этот вид коррозии представляет большую проблему для металлургии и других отраслей промышленности, где в технологии участвуют высокие температуры и активные газы.
Подземная коррозия подразумевает коррозию металла при контакте его с почвой, биокоррозия характеризуется воздействием на металл микроорганизмов.
Существует также радиационная коррозия, возникающая под действием радиоактивного излучения. Выделяют коррозию, вызываемую внешними и блуждающими токами.
Существует коррозия, возникающая вследствие одновременного воздействия коррозионной среды и механического напряжения. Такое воздействие очень активизирует происходящие коррозионные процессы. В этом случае могут нарушаться оксидные пленки на поверхности металла, усиливаются электрохимические процессы в местах неоднородного состава металла, образуются микротрещины. Коррозия, возникающая при одновременном ударном и коррозионном воздействии на металл, называется кавитационной.
Коррозия, возникающая при одновременном ударном и коррозионном воздействии на металл, называется кавитационной.
Все вышеперечисленные виды коррозии в той или иной мере присутствуют «в жизни» автотехники, но явления электрохимической коррозии преобладают.
Коррозирует днище кузова, внутренние поверхности крыльев. Вообще, все детали, контактирующие с воздухом и не имеющие защитного покрытия.
Дело в том, что в кузовных деталях после штамповки, сварки возникают фрагменты с неоднородной структурой. Основной металл и примеси образуют множество короткозамкнутых микроскопических гальванических элементов. Включения шлаков, отдельные раковинки на поверхности также способствуют образованию гальванических пар, поэтому стальные детали кузова интенсивно коррозируют.
С другой стороны снегопады, дожди, перепады температур способствуют возникновению на наружных и внутренних стенках кузова пленки водного конденсата толщиной от нескольких молекулярных слоев до 1 мм. При относительной влажности более 60% конденсат образуется особенно «продуктивно», а такой уровень влажности в средней полосе России присутствует почти постоянно. При контакте с атмосферным воздухом в конденсат проникают кислоты и щелочи, попадающие туда из выхлопных газов транспорта и вредных выбросов в атмосферу различных предприятий. А зимой еще и добавляется возможность соединения с солевой смесью, которой посыпают наши дороги. Из конденсата образуется электролит со всеми вытекающими для металла машины последствиями.
При контакте с атмосферным воздухом в конденсат проникают кислоты и щелочи, попадающие туда из выхлопных газов транспорта и вредных выбросов в атмосферу различных предприятий. А зимой еще и добавляется возможность соединения с солевой смесью, которой посыпают наши дороги. Из конденсата образуется электролит со всеми вытекающими для металла машины последствиями.
Кстати, в том числе, и из-за «антикоррозионных» мероприятий в Швеции и Норвегии не пользуются какой-либо «химией» в зимний период, а убирают заносы снегоуборочной техникой, а в Финляндии зимой посыпают дороги в основном мраморной и гранитной крошкой.
Электрохимическую коррозию еще называют «атмосферной». Наука сегодня определяет более 35 факторов, влияющих на скорость атмосферной коррозии, таких как степень увлажнения металла, состояние поверхности металла (пористость, загрязненность), химсостав атмосферы (наличие агрессивных и гигроскопичных продуктов) и т. д.
Если коррозия распространяется на всей поверхности металла, то тогда ее называют сплошной. Причем различают равномерную коррозию, когда процесс коррозии идет с одной скоростью по всей поверхности, и неравномерную. Сплошная коррозия распространяется, начиная с внешней поверхности днища, захватывая крылья, к деталям кабины.
Причем различают равномерную коррозию, когда процесс коррозии идет с одной скоростью по всей поверхности, и неравномерную. Сплошная коррозия распространяется, начиная с внешней поверхности днища, захватывая крылья, к деталям кабины.
Локальная коррозия затрагивает отдельные участки поверхности металла. Это могут быть пятна ржавчины, неглубоко проникающие в металл, а могут быть точки (питтинги) очень глубоко уходящие в структуры металла. Такая коррозия обычно возникает в местах сварного соединения листов, в местах завальцовки кромок капота, по периметру дверей.
При избирательной коррозии в металле, представляющем собой сплав нескольких элементов, коррозирует только один компонент, остальные же не страдают.
Явления щелевой коррозии возникают в местах резьбовых соединений, в зазорах между неплотно подогнанными деталями, в местах неплотного прилегания прокладок.
Но наиболее опасными, пожалуй, являются подповерхностная (подпленочная) и межкристаллическая коррозии. Подповерхностная коррозия вызывает расслаивание металлических листов и изделий, в этом случае продукты коррозии оказываются сосредоточенными в полостях металла, образовавшихся при распространении коррозии вглубь металла. А межкристаллическая коррозия выражается в разрушении металла по границам зерен. Металл теряет прочность, пластичность, становится хрупким, хотя внешний вид поверхности вполне нормальный.
А межкристаллическая коррозия выражается в разрушении металла по границам зерен. Металл теряет прочность, пластичность, становится хрупким, хотя внешний вид поверхности вполне нормальный.
Практические действия в борьбе с коварным явлением
При сборке современных транспортных средства детали и узлы защищены от коррозии с помощью лакокрасочных, пластмассовых, гальванических и химических покрытий, а также консервационных масел.
Также для повышения коррозионной устойчивости поверхность железных и стальных изделий покрывают осадками других металлов. Кроме просто механической изоляции базовой поверхности изменяются электрохимические свойства.
Чтобы снизить скорость коррозии, сталь покрывают медью, никелем, родием, используя метод анодной защиты. С этой же целью уменьшения скорости «ржавления» металл покрывают свинцом, оловом, цинком, и происходит увеличение поляризации катодной реакции.
Кузовные детали чаще всего оцинковывают. Возникает электропара Цинк-Сталь, где цинк, интенсивно окисляясь, но несравнимо медленнее, чем железо, защищает сталь.
При обработке методом горячего цинкования, заключающимся в погружении детали или конструкции в ванну с расплавом цинка, обеспечивается срок бескоррозионной службы стальных конструкций, в зависимости от толщины слоя покрытия, от 10 до 50 лет. До полувека бескоррозионной службы изделию дает термодиффузионное цинкование. В этом случае при нагреве до 350-420° С происходит внедрение цинка в поверхностный слой металла с образованием химсоединений – интерметаллидов Zn-Fe различного состава.
Наиболее эффективно защищает конструкцию от коррозии применение легированных материалов. Коррозионная стойкость стали резко возрастает при введении в сплав всего нескольких процентов хрома. Для повышения, в том числе и коррозионной стойкости, рамы грузовиков Ford Cargo турецкого производства изготавливают из высокопрочной стали с добавками ниобия.
Вообще же, если говорить о грузовиках иностранного производства (только не китайских), обращают на себя внимание высокое качество покраски, пайки, обработки швов. Все соединения отдельных элементов герметизированы, аккуратно промазаны специальными составами. Кузов и днище, как правило, обрабатываются методом катафорезного грунтования. Такая заводская защита от коррозии вселяет уверенность в долгую «жизнь» металла машины. Далеко не всегда отечественная техника, выходя с завода, столь тщательно подготовлена и проблема защиты от коррозии перекладывается на потребителей.
Все соединения отдельных элементов герметизированы, аккуратно промазаны специальными составами. Кузов и днище, как правило, обрабатываются методом катафорезного грунтования. Такая заводская защита от коррозии вселяет уверенность в долгую «жизнь» металла машины. Далеко не всегда отечественная техника, выходя с завода, столь тщательно подготовлена и проблема защиты от коррозии перекладывается на потребителей.
Противостоять все-таки можно!
Содержание, как коммерческого автомобиля, так и спецтехники в чистоте – одно из обязательных условий борьбы с коррозией. Грязный автомобиль подвергается усиленной коррозии и разрушению лакокрасочного покрытия. Именно под слоем грязи создается идеальная для ржавчины влажная атмосфера. И никакие антикоррозийные средства не помогут, когда техника не чистится, т. е. постоянно находится под воздействием агрессивной среды, состоящей из смеси пыли, песка, воды, воздуха, нефтепродуктов и реагентов. Применять при эксплуатации следует масла и техжидкости только качественные, известных производителей. В автомаслах, как моторных, так и трансмиссионных и гидравлических, обязательно должны присутствовать в достаточном объеме антикоррозионные добавки. В охлаждающей жидкости также обязательно должны присутствовать антикоррозирующие компоненты, причем рассчитанные на длительный срок эксплуатации. Современные технологии, основанные на использовании в качестве антикоррозионных присадок алифатических кислот, обеспечивают долговременную защиту от разрушения всех металлов, включая алюминий и сплавы, присутствующих в двигателе, причем свойства ингибирующих (замедляющих процессы коррозии) присадок действуют не менее 5 лет. Учитывая огромное количество контрафактной продукции на автотранспортном рынке, охлаждающую жидкость следует покупать только у «проверенных» поставщиков.
В автомаслах, как моторных, так и трансмиссионных и гидравлических, обязательно должны присутствовать в достаточном объеме антикоррозионные добавки. В охлаждающей жидкости также обязательно должны присутствовать антикоррозирующие компоненты, причем рассчитанные на длительный срок эксплуатации. Современные технологии, основанные на использовании в качестве антикоррозионных присадок алифатических кислот, обеспечивают долговременную защиту от разрушения всех металлов, включая алюминий и сплавы, присутствующих в двигателе, причем свойства ингибирующих (замедляющих процессы коррозии) присадок действуют не менее 5 лет. Учитывая огромное количество контрафактной продукции на автотранспортном рынке, охлаждающую жидкость следует покупать только у «проверенных» поставщиков.
(окончание следует)
Николай Днепров
Автор: ТЕХНОmagazine
Поделиться
Физические и химические явления в химии
Содержание:
Физические и химические явления:
Сравните картинки. В результате какого явления гвозди ржавеют, черешня сгнивает, а вода превращается из жидкого состояния в твёрдое или газообразное состояния. Чем отличаются эти явления друг от друга? Как это можно объяснить? Какие признаки имеют химические реакции?
В результате какого явления гвозди ржавеют, черешня сгнивает, а вода превращается из жидкого состояния в твёрдое или газообразное состояния. Чем отличаются эти явления друг от друга? Как это можно объяснить? Какие признаки имеют химические реакции?
Каждому из нас в повседневной жизни доводилось наблюдать, как нагретая вода, превратившись в пар, «исчезает» (переходит в состояние невидимого газа), и как этот пар при соприкосновении с холодной поверхностью предмета вновь превращается в капельки воды. Точно так же все видели превращение воды в лед в выставленной наружу в холодный морозный день посуде и обратный переход его в жидкое состояние при внесении в помещение. Образуется ли новое вещество при этих превращениях?
Возьмите две миски небольшой ёмкости. В одной из мисок смешайте небольшое количество соли с водой, а в другой – сахара с водой и поставьте на слабый огонь. Что вы наблюдаете? Запишите свои мысли в тетради.
Из курса физики нам известно, что все происходящие в природе изменения называются явлением. Например, выпадение дождя, восход солнца, удар грома, землетрясение, таяние ледников и др. (рис.1).
Например, выпадение дождя, восход солнца, удар грома, землетрясение, таяние ледников и др. (рис.1).
Все происходящие в природе явления делятся на 2 группы (схема 1)
Схема 1
Во время физических явлений изменяются лишь агрегатное состояние, форма, размеры, объём, давление, температура и скорочть движения вещества (рис.2). Например, замерзание воды, таяние льда, кипение воды и др.
1. Нагрейте медную проволку. 2. В отстоявшуюся известковую воду с помощью трубочки вдуньте воздух или же добавьте немного раствора соды. 3. Подожгите кусочек серы размером с горошину. Что вы наблюдаете в каждом случае?
Во время химических явлений из исходного вещества образуются новые вещества. Например, такие химические явления, как горение, брожение, гниение, электролиз, разложение на составные части, ржавление (коррозия) и др. называют химическими реакциями.
Химические реакции имеют несколько признаков. Эти признаки показывают протекание химических реакций (рис. 3).
Эти признаки показывают протекание химических реакций (рис. 3).
Химические явления всегда сопровождаются физическими явлениями. Например, при горении природного газа, наряду с образованием углекислого газа и воды (химическое явление), также выделяются свет и теплота (физическое явление).
Из курса «Познание мира» вам известно, какое значение имеют физические явления, происходящие вокруг нас. Так, например, испарение воды, конденсация водяных паров и выпадение дождя составляют круговорот воды в природе. В промышленном производстве, придавая металлам, пластмассам и другим материалам определенную форму (штамповка, прокатка), получают разнообразные предметы.
Химические реакции имеют огромное значение. Ими пользуются для получения различных металлов (железа, алюминия, меди, цинка, свинца, олова и др.), а также пластмасс, минеральных удобрений, лекарственных препаратов и т.д. Выделяемая при сгорании топлива энергия используется в быту и в промышленности.
Условия начала и хода химических реакций бывают разными. Для протекания ряда реакций (например, реакций горения) достаточно соприкосновения (трения) частиц веществ и подогревания до определенной температуры. Доведение реакции до конца обеспечивается за счет выделяемой тепловой энергии.
Для протекания ряда реакций (например, реакций горения) достаточно соприкосновения (трения) частиц веществ и подогревания до определенной температуры. Доведение реакции до конца обеспечивается за счет выделяемой тепловой энергии.
Некоторые же реакции (например, разложение воды на кислород и водород) требуют подачи дополнительной энергии до конца.
В природе физические и химические явления (реакции) протекают непрерывно, постоянно, обеспечивая этим циркуляцию веществ, климатические изменения, условия жизни для живых организмов.
Химические уравнения. Знаки сохранения массы веществСмочите в пробирке около 2-х г хлорида натрия небольшим количеством воды. Влив в пробирку до четверти её объёма концентрированной серной кислоты, закройте её горлышко пробкой, через которую проходит газоотводная трубка. При этом кислота должна быть концентрированной, а соль – в виде кристаллов. Пробирку с содержащимися в ней солью и серной кислотой слегка подогрейте. Что вы наблюдаете? Происходят ли изменения в массах веществ в результате реакции? Запишите уравнение реакции.
Что вы наблюдаете? Происходят ли изменения в массах веществ в результате реакции? Запишите уравнение реакции.
Происходящие в природе химические превращения в письменном виде выражают посредством химических уравнений. Условная запись химической реакции посредством формул, знаков и коэффициентов называется химическим уравнением.
Химическое уравнение составляется на основе нижеприведённых правил:
- Записываются химические формулы веществ, вступающих в реакцию.
- Если число вступающих в реакцию веществ два и больше, между ними ставится знак « + ».
- Затем ставится знак
- После знака стрелки записываются химические формулы полученных веществ.
- При получении двух и более продуктов между ними ставится знак
Например, составим уравнение реакции горения водорода в кислороде:
Здесь количество атомов в правой и левой частях неодинаковое. Такую запись называют схемой реакции. Для того, чтобы превратить данную схему в уравнение, следует уравнять число атомов в левой и правой частях уравнения.
Уравнивание количества атомов элементов в правой и левой частях уравнения называют коэффицированием уравнения. Определим число атомов элементов, входящих в состав веществ в реакции образования воды.
Если обратим внимание на реакцию, то увидим, что количество атомов водорода в обеих частях одинаковое. А количество атомов кислорода в правой части на единицу меньше количества атомов кислорода в левой части. Вследствие этого, вначале уравним число атомов кислорода. Для этого число атомов в правой части реакции умножается на 2, и на основе этого определяется коэффициент веществ на левой стороне.
В результате количество атомов водорода и кислорода в левой и правой частях уравнивается и получается уравнение химической реакции. 2 молекулы водорода, вступая в реакцию с 1 молекулой кислорода, образуют 2 молекулы воды.
Впервые в 1748-ом году знаменитым русским учёным М.В.Ломоносовым, и независимо от него, в 1789-ом году французским учёным А. Лавуазье был открыт закон о том, что во время химических реакций сумма масс, вступающих в реакцию веществ, равна сумме масс, полученных в результате реакции веществ.
Лавуазье был открыт закон о том, что во время химических реакций сумма масс, вступающих в реакцию веществ, равна сумме масс, полученных в результате реакции веществ.
Закон сохранения массы веществ выражается следующим образом: Сумма масс веществ, вступивших в химическую реакцию, равна сумме масс веществ, полученных в результате реакции.
В колбу насыпают небольшое количество серы, после этого её закупоривают пробкой и взвешивают на весах (1). Затем колбу вместе с серой осторожно нагревают (2). На основе появления в колбе дыма, состоящего из частиц оксида серы (IV), можно определить протекание химической реакции.
При повторном взвешивании обнаруживается, что в результате реакции масса вещества осталась неизменной (3).
Поместите в керамический тигель немного бихромата аммония и поставьте на большую асбестовую плитку. Нагрев стеклянную палочку, прикоснитесь ею к веществу.
Что вы видите? Изложите свои соображения относительно происходящего процесса и запишите уравнение реакции. Почему эту реакцию называют «химическим вулканом»?
Химические реакции классифицируются по различным признакам. По количеству веществ, вступивших в реакцию и полученных в результате реакции, химические реакции подразделяются на 4 типа (схема 1):
Реакции соединенияРеакции, при которых из двух и более простых или сложных веществ получают одно сложное вещество, называют реакциями соединения.
Для протекания химических реакций иногда требуется нагревание. В таком случае в уравнениях реакций над стрелкой ставится
знак t.
Реакции, при которых из одного сложного вещества получают два и более простых или сложных веществ, называют реакциями разложения.
Если во время реакции выделяется газ, в таком случае, рядом с её химической формулой проставляется стрелка, направленная вверх
Если в реакциях, протекающих между простым и сложным веществом, атомы одного из элементов сложного вещества замещаются атомами простого вещества, то такие реакции называются реакциями замещения.
Опустите в раствор сульфата меди (II) голубого цвета очищенный железный гвоздь или железную пластинку. Что вы наблюдаете?
Если во время реакции выпадает осадок, в таком случае, рядом с химической формулой полученного вещества проставляется стрелка, направленная вниз
Реакции обменаЕсли в реакциях, протекающих между двумя сложными веществами, составные части сложных веществ, меняясь местами, образуют новые сложные вещества, то такие реакции называются реакциями обмена.
Тепловой эффект химических реакцийНаблюдаете ли вы за тем, какие изменения происходят в вашем организме во время занятий спортом, приготовления уроков и приёма пищи? Как в это время изменяется ваша энергия?
В жизни мы постоянно принимаем пищу, а также занимаемся определённой деятельностью (умственной и физической). Вначале мы, приняв пищу, увеличиваем свою энергию, а занимаясь различной деятельностью, тратим ту энергию, которую получили благодаря приёму пищи (т. е. наша энергия уменьшается), и в результате мы чувствуем себя усталыми и утомлёнными. Как и человек, каждое химическое вещество обладает определённым запасом энергии. Химические реакции веществ сопровождаются выделением или поглощением теплоты.
е. наша энергия уменьшается), и в результате мы чувствуем себя усталыми и утомлёнными. Как и человек, каждое химическое вещество обладает определённым запасом энергии. Химические реакции веществ сопровождаются выделением или поглощением теплоты.
Количество выделяемой или поглощаемой в ходе химической реакции теплоты называется тепловым эффектом.
Тепловой эффект обозначается буквой Q, а единица его измерения — кДж. В зависимости от выделения или поглощения теплоты химические реакции делятся на 2 группы (схема 1)
Химические реакции, протекающие с выделением теплоты, называются экзотермическими реакциями. В уравнениях экзотермических реакций выделяемая теплота (Q) указывается в правой стороне реакции знаком «+» (Q>0).
Все реакции горения – экзотермические. Реакция между азотом и кислородом – эндотермическая. (Это не реакция горения).
Химические реакции, протекающие с поглощением теплоты, называются эндотермическими реакциями. В уравнениях эндотермических реакций поглощённая теплота указывается в правой стороне реакции знаком «— ». То есть Q
В уравнениях эндотермических реакций поглощённая теплота указывается в правой стороне реакции знаком «— ». То есть Q
Большинство реакций разложения и некоторые реакции соединения – эндотермические. Реакция разложения монооксида азота – экзотермическая.
Уравнения химических реакций, в которых указаны агрегатное состояние и тепловой эффект вступающих в реакцию и полученных веществ, называются термохимическими уравнениями. В термохимических уравнениях вместо стрелки проставляется знак .
Количество тепла, выделяемого или поглощаемого во время образования 1 моля сложного вещества из простых веществ, называется теплотой образования. Теплота образования обозначается в виде и измеряется в кДж/моль. Для вычисления теплоты образования полученного продукта в термохимическом уравнении, следует тепловой эффект реакции поделить на коэффициент продукта. Например:
Например:
Процесс отрыва электрона от того или иного атома является эндотермическим, а присоединение к атому электрона – экзотермическим процессом. Например:
Горение. Рациональное сжигание топливаОбратите внимание на картинки. Что вы наблюдаете, разжигая костёр?
Реакции, протекающие с выделением теплоты и света при взаимодействии веществ с кислородом, называются реакциями горения или просто горением.
Реакции горения – это процесс окисления, протекающий с большой скоростью.
Теплота, выделяемая во время полного сгорания 1 моля того или иного вещества, называется теплотой горения (измеряется в к Дж/моль). При вычислении теплоты горения тепловой эффект реакции делится на коэффициент сгорающего вещества.
Для горения веществ нужны два условия:
- а) нагревание вещества до температуры возгорания – каждое вещество имеет свою температуру возгорания.
 Например, белый фосфор воспламеняется при 40, сера и древесина – при 270, древесный уголь при 350 и т. д.
Например, белый фосфор воспламеняется при 40, сера и древесина – при 270, древесный уголь при 350 и т. д. - б) соприкосновение кислорода с частицами вещества – реакции горения веществ в чистом кислороде протекают во много раз быстрее реакций горения в воздухе. Это объясняется тем, что кислород составляет лишь 1/5 часть воздуха.
Для получения тепловой энергии используют различные виды топлива в природе. По своему агрегатному состоянию топливо подразделяется на 3 вида (схема 1)
Газообразное топливо имеет ряд преимуществ по сравнению с твердым и жидким топливом: его добыча и транспортировка экономически более выгодны; упрощается регулирование процесса горения; достигается более полное сжигание топлива; устраняется загрязнение окружающей среды. Качество топлива определяется его теплотворной способностью, т.е. количеством теплоты (в кДж), выделяемой при сжигании 1 кг топлива.
А теплотворная способность топлива определяется количеством углерода в составе топлива.
Как следует поступить, если произойдёт пожар?
Для предотвращения процесса горения следует: 1) охладить температуру горящего материала с доведением её до более низкой, чем при его воспламенении, температуры; 2) предотвратить соприкосновение кислорода (или воздуха) с горящим материалом.
При погашении огня водой горящий материал одновременно и остывает и в то же время образующийся от нагрева воды пар в достаточной степени устраняет соприкосновение материала с кислородом (с воздухом). Кроме воды, соприкосновение воздуха с горящим материалом предотвращается при помощи песка, грунта, огнетушителей и некоторых взрывчатых веществ. Если огонь охватил малую площадь, то горящую часть вещества следует накрыть одеялом, паласом, плотной тканью и т.д., не пропускающими воздух (рис. 1). Если загорелась ваша одежда, следует незамедлительно принять меры, указанные выше.
Вычисления по химическим уравнениямВычисления по химическим уравнениям производятся в следующей последовательности:
- Вначале следует составить уравнение соответствующей реакции и проставить коэффициенты;
- Указанные в условии задачи данные (х) (вместе с единицей измерения) записать над соответствующей формулой вещества;
- Отметить количество веществ (v, N, m, V) под химическими формулами, учитывая соответствующие единицы измерения и их коэффициенты;
- Составив пропорцию, производить вычисления.

I. Вычисление массы и количества полученного вещества (или вступающего в реакцию другого вещества) при указании в условии задачи массы одного из вступающих в реакцию веществ (или наоборот).
Задача 1. Вычислите массу (в граммах) и количество вещества (моль) углекислого газа, полученного при полном сгорании 24 г угля:
Решение:
б) Находим количество вещества по формуле
II. Вычисление количества и массы полученного вещества (или вступающего в реакцию другого вещества) при указании в условии задачи количества одного из вступающих в реакцию веществ (или наоборот).
Задача 2. Какое количество (моль) и сколько граммов кислорода необходимо для вступления в реакцию с 8 молями водорода?
Решение:
III. Правила решения задач по закону сохранения массы веществ в химических реакциях. Определение относительной атомной массы неизвестного химического элемента.
Задача 3. Определите относительную атомную массу металла, если 4,6 г одновалентного металла, вступая в реакцию с водородом, образует 4,8 г гидрида этого металла.
Решение: 4,8—4,6=0,2 г вступает в реакцию.
IV. Правило вычисления теплового эффекта по теплоте образования.
Тепловой эффект химической реакции равен разнице между суммой теплоты образования продуктов реакции и суммой теплоты образования исходных веществ.
Задача 4. Вычислите тепловой эффект реакции
Решение:
V. Закон Гесса и решение задач по данному закону.
Тепловой эффект реакции зависит не от путей протекания и количества этапов реакции, а только от природы и физического состояния вступающих в реакцию и получаемых в результате реакции веществ. Т.е. тепловой эффект общей реакции равен сумме тепловых эффектов её этапов.
Задача 5. I этап:
Общая реакция Вычислите Решение:
VI. Вычисление выхода продукта
Вычисление выхода продукта
Здесь называется – эта, а – тета.
Понимание явлений коррозии: процесс, механизм и метод
На этой странице
Авторское право Статьи по теме
Явления коррозии материалов очень сложны, поскольку коррозионные реакции и/или процессы в значительной степени зависят от систем материал/окружающая среда. Повреждение материалов, вызванное коррозионными явлениями, привело к потере энергии и ресурсов, нестабильности жизни людей, снижению надежности инфраструктуры и так далее. Чтобы преодолеть их, были введены последние достижения в понимании явлений и механизмов коррозии для новых аспектов и перспектив изучения роли анионных частиц и пленок, образующихся в коррозионном поведении, факторов, влияющих на восприимчивость к SCC (коррозионное растрескивание под напряжением), проникновение водорода поведение, связанное с водородным охрупчиванием, и так далее. Это привело к разработке материала с более высокой коррозионной стойкостью, более подходящего ингибитора и метода предотвращения коррозии, а также к разумному выбору материала в данной коррозионной среде. Поэтому этот специальный выпуск был посвящен последним разработкам в области коррозионного растрескивания под напряжением, достижениям в области коррозионно-стойких материалов, роли атомарного водорода в водородном охрупчивании, стабильности и прочности образующихся пленок, новым аспектам локальной коррозии (точечная коррозия и щелевая коррозия). , последние разработки в области ингибиторов, новые методы изучения коррозионного поведения и т.д.
Это привело к разработке материала с более высокой коррозионной стойкостью, более подходящего ингибитора и метода предотвращения коррозии, а также к разумному выбору материала в данной коррозионной среде. Поэтому этот специальный выпуск был посвящен последним разработкам в области коррозионного растрескивания под напряжением, достижениям в области коррозионно-стойких материалов, роли атомарного водорода в водородном охрупчивании, стабильности и прочности образующихся пленок, новым аспектам локальной коррозии (точечная коррозия и щелевая коррозия). , последние разработки в области ингибиторов, новые методы изучения коррозионного поведения и т.д.
В нескольких статьях описаны защита от коррозии, атомное моделирование явлений коррозии, продукты коррозии, подвергающиеся длительному воздействию атмосферной среды, и коррозионное поведение усовершенствованного материала (интерметаллическое соединение на основе никеля). Т. Оцука рассмотрел защиту стали от коррозии путем покрытия проводящими полимерами, такими как полианилин, полипиррол и политиофен. Он описал, что они действуют как сильный окислитель, вызывая потенциальный сдвиг в благородном направлении. К. Д. Тейлор рассмотрел и рассмотрел атомистическое моделирование процессов коррозии, таких как граница раздела металл-вода, реакция воды, конкурентная адсорбция, структура металлической поверхности и т. д. F. Q-Li и соавт. исследовал множество бронзовых изделий династии Цинь, извлеченных из гробниц в городе Синьфэн, с помощью SEM / EDS, XRD и RM и получил ценную информацию о сохранении бронзовых изделий. С. О. Адеосун и соавт. исследовал коррозионное поведение сплавов Al-Mg в литом состоянии и после регрессии в растворах NaCl, FeCl 3 и так далее. Они указали, что кристаллы Mg 2 Si, являющиеся анодными по отношению к матрице, влияют на коррозионное поведение. Коррозионное поведение двухфазных интерметаллидов Ni 3 Al/Ni 3 V было исследовано в различных кислых растворах с использованием иммерсионного теста и СЭМ G. Priyotomo et al.
Он описал, что они действуют как сильный окислитель, вызывая потенциальный сдвиг в благородном направлении. К. Д. Тейлор рассмотрел и рассмотрел атомистическое моделирование процессов коррозии, таких как граница раздела металл-вода, реакция воды, конкурентная адсорбция, структура металлической поверхности и т. д. F. Q-Li и соавт. исследовал множество бронзовых изделий династии Цинь, извлеченных из гробниц в городе Синьфэн, с помощью SEM / EDS, XRD и RM и получил ценную информацию о сохранении бронзовых изделий. С. О. Адеосун и соавт. исследовал коррозионное поведение сплавов Al-Mg в литом состоянии и после регрессии в растворах NaCl, FeCl 3 и так далее. Они указали, что кристаллы Mg 2 Si, являющиеся анодными по отношению к матрице, влияют на коррозионное поведение. Коррозионное поведение двухфазных интерметаллидов Ni 3 Al/Ni 3 V было исследовано в различных кислых растворах с использованием иммерсионного теста и СЭМ G. Priyotomo et al. Они обнаружили, что преимущественное растворение фазы (L1 2 + D0 22 ) имело место, и коррозионное поведение в значительной степени зависело от анионов.
Они обнаружили, что преимущественное растворение фазы (L1 2 + D0 22 ) имело место, и коррозионное поведение в значительной степени зависело от анионов.
В других статьях описывалось локальное коррозионное поведение, такое как межкристаллитная коррозия, точечная коррозия и SCC M.E. Arikan et al. определили подверженность межкристаллитной коррозии дуплексной нержавеющей стали типа UNS 31803, которая подвергалась старению в разное время при 725°C, с использованием метода электрохимической реактивации и испытания на потерю веса. Они обнаружили, что степень сенсибилизации была связана с областями, обедненными хромом и молибденом. Н. Хара и соавт. изучали стойкость к точечной коррозии нержавеющей стали марки 316 L. Они пришли к выводу, что повышение стойкости к точечной коррозии было связано с положительным эффектом удаления включений MnS с поверхности стали, а не с эффектом модификации химического состава пассивных пленок. SCC стали для сосудов высокого давления A516 исследовали испытаниями на медленную скорость деформации в H 2 O-CO-CO 2 растворы J. W. van der Merwe. Установлено, что компонент СО играет важную роль в инициировании КРР, то есть торможении коррозионной реакции. Х. Накано и соавт. исследовали свойство SCC сплава Al-Mg, обработанного равноканальным угловым прессованием (ECAP) методом медленной деформации в 3% NaCl с pH 4 при 303 K. Они обнаружили, что снижение восприимчивости к SCC было связано с улучшением коррозионная стойкость, обеспечиваемая ECAP. О. М. Алюсиф и соавт. исследовали влияние приложенного напряжения на индуцированное окружающей средой растрескивание (EIC) алюминиевого сплава (5052) в 0,5 M растворе NaCl с использованием метода постоянной нагрузки. Они пришли к выводу, что стационарная скорость удлинения стала параметром для прогнозирования времени до разрушения, а EIC был вызван SCC, а не HE (водородное охрупчивание).
W. van der Merwe. Установлено, что компонент СО играет важную роль в инициировании КРР, то есть торможении коррозионной реакции. Х. Накано и соавт. исследовали свойство SCC сплава Al-Mg, обработанного равноканальным угловым прессованием (ECAP) методом медленной деформации в 3% NaCl с pH 4 при 303 K. Они обнаружили, что снижение восприимчивости к SCC было связано с улучшением коррозионная стойкость, обеспечиваемая ECAP. О. М. Алюсиф и соавт. исследовали влияние приложенного напряжения на индуцированное окружающей средой растрескивание (EIC) алюминиевого сплава (5052) в 0,5 M растворе NaCl с использованием метода постоянной нагрузки. Они пришли к выводу, что стационарная скорость удлинения стала параметром для прогнозирования времени до разрушения, а EIC был вызван SCC, а не HE (водородное охрупчивание).
Рокуро Нисимура
Тору Цуру
Тошиаки Оцука
Нобуёси Хара
Эн-Хоу Хан
Осама Алюсиф
Авторское право
Авторское право © 2012 Rokuro Nishimura et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
19.9: Коррозия – нежелательные окислительно-восстановительные реакции
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 47065
Цели обучения
- Понять процесс коррозии.
Коррозия — это гальванический процесс, при котором металлы разрушаются в результате окисления — обычно, но не всегда, до их оксидов. Например, на воздухе железо ржавеет, серебро тускнеет, а медь и латунь приобретают голубовато-зеленую поверхность, называемую патиной. Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Из различных металлов, подверженных коррозии, железо является наиболее важным с коммерческой точки зрения. По оценкам, только в Соединенных Штатах ежегодно тратится 100 миллиардов долларов на замену железосодержащих объектов, разрушенных коррозией. Следовательно, разработка методов защиты металлических поверхностей от коррозии представляет собой весьма активное направление промышленных исследований. В этом разделе мы опишем некоторые химические и электрохимические процессы, ответственные за коррозию. Мы также изучаем химическую основу некоторых распространенных методов предотвращения коррозии и обработки корродированных металлов.
Коррозия – это окислительно-восстановительный процесс.
В условиях окружающей среды окисление большинства металлов термодинамически самопроизвольно, за исключением золота и платины. Поэтому на самом деле несколько удивительно, что какие-либо металлы вообще полезны во влажной, богатой кислородом атмосфере Земли. Однако некоторые металлы устойчивы к коррозии по кинетическим причинам. Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение. Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
Например, алюминий в банках для безалкогольных напитков и в самолетах защищен тонким слоем оксида металла, который образуется на поверхности металла и действует как непроницаемый барьер, предотвращающий дальнейшее разрушение. Алюминиевые банки также имеют тонкий пластиковый слой для предотвращения реакции оксида с кислотой в безалкогольном напитке. Хром, магний и никель также образуют защитные оксидные пленки. Нержавеющие стали удивительно устойчивы к коррозии, поскольку они обычно содержат значительную долю хрома, никеля или того и другого.
В отличие от этих металлов железо при коррозии образует красно-коричневый гидратированный оксид металла (\(\ce{Fe2O3 \cdot xh3O}\)), известный как ржавчина, который не образует плотной защитной пленки ( Рисунок \(\PageIndex{1}\)). Вместо этого ржавчина постоянно отслаивается, обнажая свежую металлическую поверхность, уязвимую для реакции с кислородом и водой. Поскольку для образования ржавчины необходимы и кислород, и вода, железный гвоздь, погруженный в деоксигенированную воду, не заржавеет даже в течение нескольких недель. Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
Точно так же гвоздь, погруженный в органический растворитель, такой как керосин или минеральное масло, не заржавеет из-за отсутствия воды, даже если растворитель насыщен кислородом.
 Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотные дожди. Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)). Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн.
Обычно реакция атмосферного CO 2 с водой с образованием H + и HCO 3 − обеспечивает достаточно низкий pH для увеличения скорости реакции, как и кислотные дожди. Производители автомобилей тратят много времени и денег на разработку красок, которые плотно прилегают к металлической поверхности автомобиля, чтобы предотвратить контакт насыщенной кислородом воды, кислоты и соли с металлом под ним. К сожалению, даже самая лучшая краска подвержена царапинам или вмятинам, а электрохимическая природа процесса коррозии означает, что две царапины, относительно удаленные друг от друга, могут работать вместе как анод и катод, что приводит к внезапному механическому повреждению (рис. \(\PageIndex{ 2}\)). Рисунок \(\PageIndex{2}\): Небольшие царапины на защитном лакокрасочном покрытии могут привести к быстрой коррозии железа. Отверстия в защитном покрытии позволяют восстанавливать кислород на поверхности с большим воздействием воздуха (катод), в то время как металлическое железо окисляется до Fe 2 + (водн. ) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.
) на менее открытом участке (анод). Ржавчина образуется, когда Fe 2 + (водн.) диффундирует в место, где он может реагировать с атмосферным кислородом, часто удаленным от анода. Электрохимическое взаимодействие между катодными и анодными участками может привести к образованию большой ямки под окрашенной поверхностью, что в конечном итоге приведет к внезапному отказу с небольшим видимым предупреждением о возникновении коррозии.Профилактическая защита
Одним из наиболее распространенных методов предотвращения коррозии железа является нанесение защитного покрытия из другого металла, который труднее окисляется. Например, смесители и некоторые внешние детали автомобилей часто покрывают тонким слоем хрома с помощью электролитического процесса. Однако с увеличением использования полимерных материалов в автомобилях использование хромированной стали в последние годы сократилось. Точно так же «жестяные банки», в которых хранятся супы и другие продукты, на самом деле состоят из стального контейнера, покрытого тонким слоем олова. Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
Хотя ни хром, ни металлы олова по своей природе не устойчивы к коррозии, они оба образуют защитные оксидные покрытия, которые препятствуют доступу кислорода и воды к основной стали (железному сплаву).
 \(\PageIndex{3}\)) . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]
\(\PageIndex{3}\)) . Этот процесс наблюдается в некоторых старых домах, где медные и железные трубы были напрямую соединены друг с другом. Менее легко окисляемая медь действует как катод, вызывая быстрое растворение железа вблизи соединения, что иногда приводит к катастрофическому отказу водопровода. 9{2+}_{(водн.)} + 2H_2O_{(l)} }_{\text{общий}}\label{Eq7} \]Более активный металл вступает в реакцию с кислородом и в конечном итоге растворяется, «жертвуя» себя, чтобы защитить железный предмет. Катодная защита – это принцип, лежащий в основе оцинкованной стали, которая представляет собой сталь, защищенную тонким слоем цинка. Оцинкованная сталь используется в различных предметах, от гвоздей до мусорных баков.
Кристаллическая поверхность горячеоцинкованной стальной поверхности. Это служило как профилактической защите (защита нижележащей стали от кислорода воздуха), так и катодной защите (после воздействия цинк окисляется раньше, чем нижележащая сталь). В аналогичной стратегии расходуемые электроды с использованием магния, например, используются для защиты подземных резервуаров или труб (Рисунок \(\PageIndex{4}\)). Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
Замена жертвенных электродов более рентабельна, чем замена железных предметов, которые они защищают.
 Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.
Аналогичная стратегия использует многие мили несколько менее реактивной цинковой проволоки для защиты нефтепровода на Аляске.Пример \(\PageIndex{1}\)
Предположим, старый деревянный парусник, скрепленный железными винтами, имеет бронзовый гребной винт (напомним, что бронза — это сплав меди, содержащий около 7–10 % олова). 9\circ_{\textrm{overall}} =\textrm{1,68 В}
\end{align*} \nonumber \]
Со временем железные винты растворятся, и лодка развалится.
- B Возможные способы предотвращения коррозии, в порядке снижения затрат и неудобств, следующие: разборка лодки и ее сборка с помощью бронзовых винтов; снятие лодки с воды и хранение ее в сухом месте; или прикрепление недорогого куска металлического цинка к гребному валу в качестве жертвенного электрода и замена его один или два раза в год. Поскольку цинк является более активным металлом, чем железо, он будет действовать как расходуемый анод в электрохимической ячейке и растворяться (уравнение \(\ref{Eq7}\)).

Упражнение \(\PageIndex{1}\)
Предположим, что водопроводные трубы, ведущие в ваш дом, сделаны из свинца, а остальная сантехника в вашем доме – из железа. Чтобы исключить возможность отравления свинцом, вы вызываете сантехника для замены свинцовых труб. Он назовет вам очень низкую цену, если он сможет использовать свой существующий запас медных труб для выполнения этой работы.
- Вы принимаете его предложение?
- Что еще нужно сделать сантехнику в вашем доме?
- Ответить на
Нет, если только вы не планируете продавать дом в ближайшее время, потому что соединения труб \(\ce{Cu/Fe}\) приведут к быстрой коррозии.
- Ответ б
Любые существующие соединения \(\ce{Pb/Fe}\) должны быть тщательно проверены на наличие коррозии железных труб из-за соединения \(\ce{Pb–Fe}\); менее активный \(\ce{Pb}\) будет служить катодом для восстановления \(\ce{O2}\), способствуя окислению более активного \(\ce{Fe}\) поблизости.

Резюме
Коррозия — это гальванический процесс, который можно предотвратить с помощью катодной защиты. Ухудшение металлов в результате окисления представляет собой гальванический процесс, называемый коррозией. Защитные покрытия состоят из второго металла, который труднее окисляется, чем защищаемый металл. В качестве альтернативы на металлическую поверхность можно нанести более легко окисляющийся металл, что обеспечит катодную защиту поверхности. Тонкий слой цинка защищает оцинкованную сталь. Жертвенные электроды также могут быть прикреплены к объекту для его защиты.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- нет на странице
- Теги

Ржавление железа – объяснение, химическая реакция, предотвращение
Металл – это материал, который имеет глянцевый вид, когда он только что изготовлен, отполирован или разрушен, и достаточно хорошо проводит электричество и тепло. Металлы либо ковкие, либо пластичные (их можно ковать в тонкие листы) (можно вытягивать в проволоку). Металлы могут быть химическими элементами, такими как железо, сплавами, такими как нержавеющая сталь, или молекулярными соединениями, такими как полимерный нитрид серы.
Термин «металл» используется в астрофизике в более широком смысле для обозначения всех химических элементов в звезде, которые тяжелее гелия, а не только классических металлов. В этом смысле первые четыре «металла», которые накапливаются в ядрах звезд посредством нуклеосинтеза, — это углерод, азот, кислород и неон, которые все являются химически неметаллами. За время своего существования звезда сплавляет более легкие элементы, прежде всего водород и гелий, в более тяжелые атомы. В этом контексте металличность астрономического объекта относится к доле его массы, состоящей из более тяжелых химических элементов.
В этом контексте металличность астрономического объекта относится к доле его массы, состоящей из более тяжелых химических элементов.
Ржавчина железа
Ржавчина – это явление образования красновато-коричневого налета на поверхности железа под действием влажного воздуха, красновато-коричневый налет называется ржавчиной. Проще говоря, ржавчина — это красно-коричневое хлопьевидное вещество, которое образуется, когда железный предмет подвергается воздействию влажного воздуха в течение длительного периода времени. Ржавление — термин для этого явления.
Ржавление железа и стали является наиболее распространенным примером коррозии металлов. Ржавчина выхлопных систем и кузова автомобиля, водопроводных труб и многих видов конструкционных стальных конструкций — все это хорошо известные примеры. Совместное воздействие воздуха и воды на железо вызывает его ржавчину. Ржавчина не возникает в полностью сухом воздухе или в воздухе, полностью лишенном воды. Атмосферные условия и относительный вклад компонентов, регулирующих ржавчину, определяют особый состав ржавчины. Он в основном состоит из гидратированного оксида железа, поэтому химическая формула ржавчины Fe 9.0010 2 O 3 .xh 2 o. Следующий ответ может примерно охарактеризовать его формирование:
Атмосферные условия и относительный вклад компонентов, регулирующих ржавчину, определяют особый состав ржавчины. Он в основном состоит из гидратированного оксида железа, поэтому химическая формула ржавчины Fe 9.0010 2 O 3 .xh 2 o. Следующий ответ может примерно охарактеризовать его формирование:
4FE + 3O 2 + 2XH 2 O → 2FE 2 O 3 .XH O → 2FE 2 O 3 .XH O → 2FE 2 O 3 .XH O → 2FE 2 . 2 O
Внешняя поверхность железа сначала ржавеет в присутствии влажного воздуха, и на поверхности осаждается слой гидратированного оксида железа (ржавчина). Этот слой нежный и пористый, и если он станет слишком толстым, то может отвалиться. Самые нижние слои железа подвергаются воздействию окружающей среды, вызывая их ржавчину. Железо в конечном итоге теряет свою прочность по мере продолжения процесса.
Что такое процесс ржавления железа?
Ржавление железа является реакцией окисления.
Во время коррозии железо соединяется с кислородом воздуха в присутствии воды с образованием Fe 2 O 3 .xH 2 O, гидратированного оксида железа (III).
Этот гидратированный оксид железа (III) называют ржавчиной. В результате ржавчина представляет собой в значительной степени гидратированный оксид железа (III), Fe 2 O 3 .xH 2 O. Цвет ржавчины красновато-коричневый. Все мы замечали красновато-коричневую ржавчину на железных гвоздях, шурупах, трубах и перилах. Под воздействием влажного воздуха ржавеет не только железо, но и сталь. Сталь, с другой стороны, более устойчива к ржавчине, чем железо.
Ржавление железа является химическим изменением
Ржавчина образуется, когда железо (или сплав железа) подвергается воздействию кислорода в присутствии влаги. Эта реакция не мгновенна; скорее, это происходит в течение длительного периода времени. Оксиды железа образуются при соединении атомов кислорода с атомами железа. В результате ослабевают связи между атомами железа в объекте/структуре.
В результате ослабевают связи между атомами железа в объекте/структуре.
Степень окисления железа увеличивается в результате реакции ржавления, за которой следует потеря электронов. Ржавчина в основном состоит из двух типов оксидов железа, которые различаются степенью окисления атома железа. Это оксиды:
- Оксид железа (II) также известен как оксид железа. Это вещество имеет степень окисления +2 и химическую формулу FeO.
- Оксид железа (III), часто известный как оксид железа, представляет собой соединение, в котором атом железа имеет степень окисления +3. Fe2O3 — химическая формула этого вещества.
Железо является восстановителем, но кислород является отличным окислителем. При воздействии кислорода атом железа легко отдает электроны. Химическая реакция описывается следующим образом:
Fe → Fe 2+ + 2e –
В присутствии воды атом кислорода увеличивает степень окисления железа.
4Fe 2+ + O 2 → 4Fe 3+ + 2O 2-
Теперь катионы железа и молекулы воды вступают в следующие кислотно-основные реакции.
Fe 2+ + 2H 2 O ⇌ Fe(OH) 2 + 2H +
Fe 3+ + 3H 2 O ⇌ Fe(OH) 3 + 3H +
В результате прямой реакции между катионами железа и гидроксид-ионами также образуются гидроксиды железа.
O 2 + H 2 O + 4e – → 4OH –
Fe 2+ + 2OH – → Fe(OH) 2
Fe 3+ + 3OH – → Fe(OH) 3
Образующиеся гидроксиды железа обезвоживаются, образуя оксиды железа, образующие ржавчину. В этот процесс вовлечено множество химических процессов, некоторые из которых приведены ниже.
- Fe (OH) 2 ⇌ Feo + H 2 O
- 4FE (OH) 2 + O 2 + XH 2 O → 2FE 2 O 3 .
 +4)H 2 O
+4)H 2 O - Fe(OH) 3 ⇌ FeO(OH) + H 2 O
- FeO(OH) ⇌ Fe 2 O 3 H1
Все перечисленные выше химические реакции имеют одну общую черту: все они требуют присутствия воды и кислорода. В результате количество кислорода и воды, окружающих металл, может быть ограничено для предотвращения коррозии.
Условия, необходимые для коррозии железа:
Ржавлению железа способствуют многие факторы, в том числе количество влаги в воздухе и рН окружающей среды. Ниже приведены некоторые из этих элементов.
- Влажность: Наличие воды в окружающей среде ограничивает коррозию железа. Наиболее распространенной причиной ржавчины является воздействие дождя.
- Процесс ржавчины ускоряется, если рН среды вокруг металла низкий. Когда железо подвергается воздействию кислотных дождей, оно ржавеет быстрее. Коррозия железа замедляется за счет более высокого pH.

- Из-за наличия в воде различных солей железо быстрее ржавеет. Многие ионы в соленой воде ускоряют процесс ржавчины посредством электрохимических процессов.
- Примесь: По сравнению с железом, состоящим из различных металлов, чистое железо ржавеет медленнее.
Размер железного предмета также может влиять на скорость его коррозии. Например, огромный железный предмет, скорее всего, будет иметь незначительные дефекты из-за процесса плавки. Эти недостатки обеспечивают платформу для экологических атак на металл.
Эксперимент, доказывающий, что воздух и влага необходимы для образования ржавчины:
Процедура, подтверждающая, что для образования ржавчины необходимы влага и воздух.
- Чистые железные гвозди следует поместить в каждую из трех пробирок, обозначенных A, B и C.
- Наполните пробирку A водопроводной водой и закупорьте ее.
- Наполните пробирку B горячей дистиллированной водой, затем добавьте примерно 1 мл масла и закупорьте ее.
 Масло будет плавать на поверхности воды, препятствуя испарению воздуха.
Масло будет плавать на поверхности воды, препятствуя испарению воздуха. - Наполните пробирку С безводным хлоридом кальция и закупорьте ее. Любая влага в воздухе будет поглощаться безводным хлоридом кальция.
- Подождите несколько дней, пока эти пробирки не осядут перед наблюдением.
Наблюдение: Железные гвозди ржавеют в пробирке А, но не в пробирках В и С, согласно результатам. Гвозди в пробирке А подверглись коррозии, потому что они подвергались воздействию как воздуха, так и воды. Ногти из пробирки B подвергаются воздействию только воды, но ногти из пробирки C подвергаются воздействию сухого воздуха.
Заключение: Этот эксперимент показывает, что для образования ржавчины необходимы как воздух (кислород), так и влага.
Какие повреждения вызывает ржавление железных предметов?
Ржавчина проницаема и мягка, и когда она соскальзывает с поверхности ржавого железного предмета, железо под ним ржавеет.
В результате железная ржавчина — это постоянный процесс, который со временем разъедает железные предметы, делая их бесполезными. Ржавление железа со временем наносит значительный ущерб, поскольку оно используется для создания широкого спектра конструкций и товаров, включая мосты, решетки, перила, ворота и кузова автомобилей, автобусов, грузовиков и кораблей. Само собой разумеется, что у нас должен быть способ уберечь железо от ржавчины.
Предотвращение ржавчины железа
Утрата железных предметов из-за ржавчины оказывает огромное экономическое воздействие на страну, и этого следует избегать. Чтобы железные вещи не ржавели, используются различные методы. Чтобы не допустить проникновения воздуха и воды, большинство способов требуют покрытия железной части чем-либо. Ниже приведены некоторые из наиболее распространенных способов предохранения железа от ржавчины:
- Ржавление железа можно предотвратить путем покраски: Покрытие поверхности железа краской является наиболее популярным способом защиты от ржавчины.
 Когда краска наносится на поверхность железного предмета, она предотвращает контакт воздуха и влаги с предметом, предотвращая ржавление. Для предотвращения ржавчины оконные решетки, перила, железные мосты, стальная фурнитура, железнодорожные вагоны, кузова автомобилей, автобусов и грузовиков, среди прочего, регулярно окрашиваются.
Когда краска наносится на поверхность железного предмета, она предотвращает контакт воздуха и влаги с предметом, предотвращая ржавление. Для предотвращения ржавчины оконные решетки, перила, железные мосты, стальная фурнитура, железнодорожные вагоны, кузова автомобилей, автобусов и грузовиков, среди прочего, регулярно окрашиваются. - Ржавление железа можно предотвратить, нанеся на него смазку или масло: Когда смазку или масло наносят на поверхность железного предмета, воздух и влага не соприкасаются с ним, предотвращая коррозию. Железные и стальные инструменты и детали машин, например, натирают смазкой или маслом для предотвращения коррозии.
- Ржавчину железа можно предотвратить с помощью гальванического покрытия: Гальваническое покрытие защищает от коррозии изделия, подвергающиеся чрезмерному воздействию влаги, такие как кровельные листы и трубопроводы. Гальванизация — это метод нанесения тонкого слоя цинка на сталь и железо для предотвращения ржавчины.
 Оцинкованное железо – это железо, оцинкованное. Цинк более реакционноспособен, чем железо, поэтому в присутствии влаги он взаимодействует с кислородом, образуя невидимый слой оксида цинка, защищающий его от дальнейшего ржавления. Стоит отметить, что даже при нарушении цинкового покрытия на изделиях из оцинкованного железа они остаются без ржавчины. Поскольку цинк более реактивен, чем железо, это так.
Оцинкованное железо – это железо, оцинкованное. Цинк более реакционноспособен, чем железо, поэтому в присутствии влаги он взаимодействует с кислородом, образуя невидимый слой оксида цинка, защищающий его от дальнейшего ржавления. Стоит отметить, что даже при нарушении цинкового покрытия на изделиях из оцинкованного железа они остаются без ржавчины. Поскольку цинк более реактивен, чем железо, это так. - Ржавчину железа можно предотвратить с помощью гальванического покрытия: Гальванопокрытие — еще один метод защиты предметов от ржавчины. В этой процедуре на железо наносятся некорродирующие металлы, включая олово, никель и хром. Этот прием не только предохраняет изделия от ржавчины, но и улучшает их внешний вид. Оснащение ванных комнат и элементы транспортных средств, такие как велосипедные рули, автомобильные бамперы и т. д., являются примерами хромированных изделий.
- Ржавчину железа можно предотвратить, легируя его для получения нержавеющей стали: Нержавеющая сталь получается при сплаве железа с хромом и никелем.
 Нержавеющая сталь не подвержена ржавчине. Кухонная утварь из нержавеющей стали, ножницы и медицинское оборудование, например, не подвержены коррозии. С другой стороны, нержавеющая сталь слишком дорога, чтобы ее можно было использовать в больших количествах.
Нержавеющая сталь не подвержена ржавчине. Кухонная утварь из нержавеющей стали, ножницы и медицинское оборудование, например, не подвержены коррозии. С другой стороны, нержавеющая сталь слишком дорога, чтобы ее можно было использовать в больших количествах. - Ржавление железа можно предотвратить лужением: Олово нетоксично, и его реакционная способность ниже, чем у железа. Пищевые банки консервированы, что означает, что на них есть тонкий слой олова. В результате, когда гальваническое тонкое покрытие металлического олова наносится на изделия из железа и стали, изделия из железа и стали защищены от ржавчины. Используются луженые коробки для тиффина, потому что они нетоксичны и не загрязняют пищу внутри.
- Ржавчину железа можно предотвратить путем эмалирования: Эмалирование — это высокотемпературная процедура, при которой порошковое стекло вплавляется в металлическую основу. Эмали можно использовать на различных поверхностях, в том числе на стекле и керамике.

Примеры задач
Вопрос 1: Как происходит процесс ржавления железа?
Ответ:
Ржавление железа является реакцией окисления. В присутствии воды металлическое железо взаимодействует с кислородом воздуха с образованием гидратированного оксида железа (III) Fe 9.0010 2 O 3 .xH 2 O. Этот гидратированный оксид железа (III) называют ржавчиной. В результате ржавчина представляет собой в значительной степени гидратированный оксид железа (III), Fe 2 O 3 .xH 2 O. Ржавчина красновато-коричневого оттенка
Вопрос 2: Как называется ржавление железа?
Ответ:
Ржавчина – это явление образования красновато-коричневого налета на поверхности железа под действием влажного воздуха, красновато-коричневый налет называется ржавчиной.
Вопрос 3. Как можно предотвратить ржавление железа?
Как можно предотвратить ржавление железа?
ОТВЕТ:
Ржастчинг из железа можно предотвратить с помощью
- Применение краски
- Применение смазки или масла
- с помощью Galvanisation
- .
- , используя Allying
- ,
- , используя Allying
- .
- с помощью Allying
- , используя Allying
- .
- Использование эмали
Вопрос 4: Что такое ржавчина? Приведите уравнение образования ржавчины?
Ответ:
Когда железо находится на воздухе в течение длительного периода времени, оно окисляется и образует на поверхности красновато-коричневый оксид железа. Ржавчина — название этого красновато-коричневого материала.
ржавчина образуется через следующее уравнение:
4fe + 3o 2 + 2xh 2 O → 2fe 2 O 3 .
xh 2 O
Вопрос 5: Как урон. железные предметы?
Ответ:
Ржавчина проницаема и мягка, и когда она соскальзывает с поверхности ржавого железного предмета, железо под ним ржавеет. В результате железная ржавчина — это постоянный процесс, который со временем разъедает железные предметы, делая их бесполезными. Ржавление железа со временем наносит значительный ущерб, поскольку оно используется для создания широкого спектра конструкций и товаров, включая мосты, решетки, перила, ворота и кузова автомобилей, автобусов, грузовиков и кораблей. Само собой разумеется, что у нас должен быть способ уберечь железо от ржавчины.
Вопрос 6: Какие условия необходимы для образования ржавчины?
Ответ:
Ржавлению железа способствуют многие факторы, в том числе количество влаги в воздухе и рН окружающей среды. Ниже приведены некоторые из этих элементов.
- Влажность: Наличие воды в окружающей среде ограничивает коррозию железа. Наиболее распространенной причиной ржавчины является воздействие дождя.
- Процесс ржавчины ускоряется, если pH среды вокруг металла низкий. Когда железо подвергается воздействию кислотных дождей, оно ржавеет быстрее. Коррозия железа замедляется за счет более высокого pH.
- Из-за наличия в воде различных солей железо быстрее ржавеет. Многие ионы в соленой воде ускоряют процесс ржавчины посредством электрохимических процессов.
- Примесь: По сравнению с железом, состоящим из различных металлов, чистое железо ржавеет медленнее.
Вопрос 7: Как ржавчина железа является химическим изменением?
Ответ:
Ржавчина состоит из оксида железа (Fe2O3). В результате ржавчина и железо не являются синонимами. Ржавчина — это не то же самое, что железо, на котором она образовалась.
Поскольку при ржавлении железа образуется новый компонент, называемый «оксидом железа», он представляет собой химическое изменение.
Метод исследования явлений коррозии
Метод исследования явлений коррозии
Скачать PDF
Скачать PDF
- Опубликовано:
- К. ЭДЕЛЯНУ 1
Природа том 173 , страница 739 (1954)Цитировать эту статью
615 доступов
48 цитирований
Сведения о показателях
Abstract
МНОГИЕ металлы и сплавы проявляют пассивность в растворах сильных кислот, хотя с точки зрения термодинамики можно было бы ожидать, что их оксиды растворимы в таких растворах 1 . Группа сплавов, известных как нержавеющие стали, проявляет этот тип «кинетической» пассивности в заметной степени. Чтобы лучше понять поведение таких сплавов, были проведены эксперименты по коррозии при постоянном потенциале в различных растворах. Потенциал поддерживался с помощью потенциостата, описанного в другом месте 2 .
Группа сплавов, известных как нержавеющие стали, проявляет этот тип «кинетической» пассивности в заметной степени. Чтобы лучше понять поведение таких сплавов, были проведены эксперименты по коррозии при постоянном потенциале в различных растворах. Потенциал поддерживался с помощью потенциостата, описанного в другом месте 2 .
Ссылки
Pourbaix, M.J.N., « Термодинамика разбавленных водных растворов » (Эдвард Арнольд и Ко, Лондон, 1949).
Google ученый
Roberts, M.H., J. Sci. Инстр. (в печати).
Corrosion Group Выставка, Соц. хим. Индустр. (Лондон, 1954).
Ссылки на скачивание
Информация об авторе
Авторы и организации
Исследовательские лаборатории Брауна-Ферта, Принцесс-стрит, Шеффилд, 4
C.
 EDELEANU
EDELEANU
Авторы
- C. EDELEANU
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Коррозионное действие растворителей твэлов на конструкционные материалы
- Куртенов М.М.
- Е. Н. Миролюбов
Советская атомная энергия (1964)
Определяющие факторы защиты металлов от коррозии
- Томашов Н.
 Д.
Д.
Вестник АН СССР Отделение химических наук (1961)
- Томашов Н.
Изучение коррозионного и электрохимического поведения нержавеющих сталей при катодной поляризации в растворах азотной кислоты
- Е. Н. Миролюбов
- М. М. Куртепов
- Томашов Н.Д.
Вестник АН СССР Отделение химических наук (1960)
Электрохимия нержавеющей стали в серной кислоте
- Г.
 Х. КАРТЛЕДЖ
Х. КАРТЛЕДЖ
Природа (1956)
- Г.
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Скачать PDF
Коррозия и ее предотвращение — Javatpoint
следующий → ← предыдущая Коррозия – обычное явление, которое легко наблюдать в повседневной жизни. Например, вы наверняка видели различные железные предметы, покрытые красновато-коричневым налетом. Этот слой указывает на ржавление железа, которое является разновидностью коррозии. При коррозии чистый металл естественным образом превращается в более стабильную форму , такую как его оксидное, гидроксидное или сульфидное состояние, что приводит к ухудшению состояния металла. Коррозия представляет собой электрохимический процесс, при котором происходят окислительно-восстановительные реакции между металлом и водой, кислородом и диоксидом серы и т. д. Это спонтанный и необратимый процесс, при котором металл превращается в химические соединения, такие как оксиды, сульфиды и гидроксиды. и т. д. Например, из-за коррозии или ржавчины железо превращается в красный оксид железа (ржавчину) в присутствии влаги и кислорода, присутствующих в воздухе. Коррозия является нежелательным явлением, так как влияет на качество металлов. Хотя железо известно своей прочностью на растяжение и долговечностью, из-за ржавчины оно со временем начинает портиться и становится хрупким и слабым. Таким образом, он повреждает свойства, связанные с использованием железа. Проще говоря, мы можем определить коррозию как естественный процесс, в котором чистые металлы, такие как железо, превращаются в нежелательные вещества, когда металлы реагируют с водой и воздухом. Корродируют ли все металлы?Металлы, расположенные выше в ряду реактивности, такие как цинк и железо, имеют тенденцию легко подвергаться коррозии, тогда как менее реакционноспособные или нереакционноспособные металлы, такие как золото, платина, не подвергаются коррозии. Это связано с тем, что при коррозии происходит окисление металлов, и склонность к окислению уменьшается по мере продвижения вниз по ряду реактивности. Итак, все металлы не подвержены коррозии. Исключением является алюминий. Это химически активный металл, но тем не менее он не подвергается коррозии. Это потому, что на его поверхности уже есть слой оксида алюминия. Этот слой не позволяет ему подвергаться дальнейшей коррозии. Причины коррозии
Факторы, влияющие на коррозию
Примеры коррозии
Типы коррозииi) Щелевая коррозия Этот тип коррозии возникает, когда существует разница в концентрации ионов между любыми двумя локальными участками металла. Эта разница возникает, когда кислород ограничен в некоторых областях, например, под поверхностью шайб и головок болтов. Это локальный тип коррозии, поскольку он затрагивает определенные части, а не всю поверхность. Кроме того, щелевая коррозия может возникать при низкой температуре и может быть сведена к минимуму за счет правильной конструкции соединения. ii) Коррозионное растрескивание под напряжением Возникает из-за агрессивной среды и действия растягивающих напряжений на металл. iii) Гальваническая коррозия Возникает при электрическом контакте двух металлов с разными электрохимическими свойствами, помещенных в электролитическую среду. При этой коррозии один из металлов разрушается в месте соединения или соединения. Например, когда алюминий и сталь соприкасаются и погружаются в морскую воду, алюминий подвергается коррозии, а сталь остается защищенной. iv) Питтинговая коррозия Этот тип коррозии трудно обнаружить, а также он непредсказуем. Так что это может быть опасно. Это происходит в локальной точке и прогрессирует с образованием очага коррозии, окруженного нормальной поверхностью металла. Яма продолжает расти и принимает различные формы. Ямка постепенно увеличивается от поверхности к металлу по вертикали и может привести к разрушению конструкции, если ее не остановить. Например, если капля воды находится на стальной поверхности, точечная коррозия начнется в центре капли воды, а затем медленно распространится в металл (вертикально вниз). v) Межкристаллитная коррозия Этот тип коррозии возникает в области зерен, однако эта коррозия не влияет на зерна. Это происходит, когда зерна и границы зерен по-разному реагируют с примесями. Разница в реактивности вызвана дефектами сварки, термической обработки и т.п. vi) Равномерная коррозия Как следует из названия, при этом виде коррозии образуется равномерный слой ржавчины по всей поверхности металла. Это происходит на металлах, на поверхности которых отсутствует защитное покрытие. Обычные металлы, на которые влияет эта коррозия, включают алюминий, цинк и свинец. vii) Эрозионная коррозия Возникает при относительном движении между металлической поверхностью и агрессивными жидкостями. При этой коррозии поверхность металла постепенно изнашивается из-за истирания быстро движущейся жидкости. viii) Фреттинг-коррозия: Возникает в области контакта двух металлов, соединенных вместе. Проскальзывания и различия между контактными площадками вызывают это. Это обычно происходит в болтовых и заклепочных соединениях, зажимных поверхностях и т. д. Как предотвратить коррозиюСуществует множество методов предотвращения коррозии, некоторые из них описаны ниже; i) Гальваника В этом методе электрический ток используется для создания тонкого слоя металла поверх другого металла. Это делается для того, чтобы сделать более дешевые металлы более привлекательными, а также защитить их от коррозии. Для этого метода требуются два разных металла, раствор электролита и два электрода в резервуаре, а также батарея или источник тока, который пропускает необходимый ток в раствор для проведения электролиза. При пропускании тока один электрод получает положительный заряд, а другой — отрицательный. ii) Гальванизация В этом методе железо покрывается слоем цинка. Железо погружают в расплавленный цинк. Слой цинка защищает железо от коррозии. Этот метод используется уже более 200 лет. iii) Окраска и смазка В этом методе на металлическую поверхность наносится слой краски или смазки. Этот слой краски или смазки защищает металл от коррозии. Для этой цели можно использовать покрытие из углеродного волокна. iv) Выбор материала Выберите материалы, не подверженные коррозии. Например, нержавеющая сталь и алюминий устойчивы к коррозии. v) Использование ингибиторов коррозии Как следует из названия, эти ингибиторы при добавлении к корродированному металлу могут предотвратить дальнейшую коррозию. vi) Сухая и чистая: Металлическая поверхность должна быть сухой и чистой. Следующая темаУглеродные соединения ← предыдущая следующий → |
Подход клеточных автоматов к явлениям коррозии и пассивации
Представлен обзор нашего исследования по применению методологии клеточных автоматов к явлениям коррозии и пассивации. Найдены и представлены примеры своеобразного карьерного развития. Утверждается и показано в результатах моделирования, что скорость диффузии в корродирующей среде в основном влияет на характерный масштаб длины процесса коррозии. Представлены и обсуждены новые данные о развитии питтинговой коррозии на плоской поверхности раздела.
Ключевые слова: компьютерное моделирование; компьютерное моделирование; коррозия; интерфейсы; наноматериалы; пассивация; химия поверхности
Ссылки
1 H. H. Uhlig. Коррос. науч. 19 , 777 (1979).10.1016/S0010-938X(79)80104-3Поиск в Google Scholar
H. Uhlig. Коррос. науч. 19 , 777 (1979).10.1016/S0010-938X(79)80104-3Поиск в Google Scholar
2 D. Landoldt. Corrosion et Chimie de Surfaces des Metaux , Presses Polytechniques et Universitaires Romandes, Лозанна (1993). Поиск в Google Scholar Коррос. науч. 44 , 1143 (2002). Поиск в Google Scholar
4 З. Шклярска-Смяловска. Точечная и щелевая коррозия , NACE International, Houston (2005). Поиск в Google Scholar
5 10.1038/337147a0, R.C. Furneaux, WR Rigby, AP Davidson. Nature 337 , 147 (1989). Поиск в Google Scholar
6 10.1016/j.cis.2007.07.003, G. Cao, D. Liu. Доп. Коллоидный интерфейс Sci. 136 , 45 (2008). Поиск в Google Scholar
7 10.1016/S0960-0779(02)00394-6, Д. Сазу, М. Пагицас. Chaos, Solitons Fractals 17 , 505 (2003). Search in Google Scholar
8 10.1016/S1388-2481(01)00150-3, M. Pagitsas, A. Diamantopoulou, D. Sazou. Электрохим. коммун. 3 , 330 (2001). Поиск в Google Scholar
Pagitsas, A. Diamantopoulou, D. Sazou. Электрохим. коммун. 3 , 330 (2001). Поиск в Google Scholar
9 10.1021/j100064a020, К. Линденберг, П. Аргиракис, Р. Копельман. J. Phys. хим. 98 , 3389 (1997). Поиск в Google Scholar
10 10.1103/PhysRevE.47.3757, П. Аргиракис, Р. Копельман. Физ. Rev. E 47 , 3757 (1993). Поиск в Google Scholar
11 RH Landau, MJ Paez, CC Bordeianu. Вычислительная физика. Решение проблем с помощью компьютеров , стр. 145–147, Wiley-VCH (2007).10.1002/9783527618835 Поиск в Google Scholar
12 Дж. фон Нейман. Теория самовоспроизводящихся автоматов , отредактировано и дополнено А. В. Берксом, University of Illinois Press, Urbana (1966).Поиск в Google Scholar
13 W. Aspray. John Von Neumann and the Origins of Modern Computing , The MIT Press, Cambridge, MA (1990). Поиск в Google Scholar Л. Макинтайр, К. Зигуракис. Биофиз. J. 69 , 1284 (1995). Поиск в Google Scholar
J. 69 , 1284 (1995). Поиск в Google Scholar
15 J. W. T. Wimpenny, R. Colasanti. FEMS микроб. Экол. 22 , 1 (2006). Поиск в Google Scholar
16 10.1134/S19954230043, Лазарева Г.Г., Миронова В.В., Омельянчук Н.А., Шваб И.В., Вшивков В.А., Горпинченко Д.Н., Николаев С.В., Колчанов Н.А. Номер. Анальный. заявл. 1 , 123 (2008). Поиск в Google Scholar
17 10.1016/S0370-1573(99)00117-9, Д. Чоудхури, Л. Сантен, А. Шадшнайдер. Физ. Rep. 329 , 199 (2000). Поиск в Google Scholar
18 10.1103/PhysRevE.74.061115, M. J. Kearney. Физ. Ред. Д 74 , 061115 (2006). Поиск в Google Scholar
19 10.1016/j.advengsoft.2006.09.002, А. Эрнандес Энсинас, Л. Эрнандес Энсинас, С. Хойя Уайт, А. Мартин дель Рей, Г. Родригес Санчес. Доп. англ. Программное обеспечение 38 , 372 (2007). Поиск в Google Scholar
20 10. 1029/2009JB006431, Г. М. Крисчи, М. В. Аволио, Б. Бенке, Д. Д’Амброзио, С. Ди Грегорио, В. Лупиано, М. Нери , Р. Ронго, В. Спатаро. Ж. Геофиз. Рез. 115 , 1 (2010). Поиск в Google Scholar
1029/2009JB006431, Г. М. Крисчи, М. В. Аволио, Б. Бенке, Д. Д’Амброзио, С. Ди Грегорио, В. Лупиано, М. Нери , Р. Ронго, В. Спатаро. Ж. Геофиз. Рез. 115 , 1 (2010). Поиск в Google Scholar
21 10.1016/S0198-9715(00)00008-9, Д. П. Уорд, А. Т. Мюррей, С. Р. Финн. Вычисл. Окружающая среда. Городская система 24 , 539 (2000). Поиск в Google Scholar
22 А.-Л. Барабаси, Его Превосходительство Стэнли. Fractal Concepts in Surface Growth , Cambridge University Press, Cambridge, MA (1995). 10.1017/CBO9780511599798Search in Google Scholar Физ. Rev. A 45 , 2480 (1992). Поиск в Google Scholar пабмед
24 10.1103/PhysRevE.48.2906, P. Meakin, T. Jossang, J. Feder. Физ. E 48 , 2906 (1993). Поиск в Google Scholar пабмед
25 К. Вотрен-Ул, А. Шос, Дж. Стафей, Дж. П. Бадиали. поль. Дж. Хим. 78 , 1795 (2004). Поиск в Google Scholar
Поиск в Google Scholar
26 10.1021/jp063021+, FDAA Reis, J. Stafiej, JP Badiali. J. Phys. хим. B 110 , 17554 (2006 г.). Поиск в Google Scholar пабмед
27 10.1016/j.corsci.2008.03.012, C. Vautrin-Ul, H. Mendy, A. Taleb, A. Chaussé, J. Stafiej, J. P. Badiali. Коррос. науч. 50 , 2149 (2008). Поиск в Google Scholar
28 10.1016/j.electacta.2010.01.106, D. di Caprio, J. Stafiej. Электрохим. Acta 55 , 3884 (2010). Поиск в Google Scholar
29 10.1016/j.electacta.2011.02.018, D. di Caprio, J. Stafiej. Электрохим. Acta 56 , 3963 (2011). Поиск в Google Scholar
30 10.1103/PhysRevB.79.035414, Л. Стэнтон, А. Головин. Физ. Rev. B 79 , 035414 (2009). Поиск в Google Scholar
31 10.1515/CORRREV.2011.028, G. Contreras, S. Goidanich, S. Maggi, C. Piccardi, M.V. Diamanti, M.P. Pedeferri, L. Лаззари.







 «Опасные» и «безопасные покрытия
«Опасные» и «безопасные покрытия В Тихом океане на судно налетел тайфун и трюмы заполнились соленой водой, в результате чего возникла большая гальваническая пара: медный концентрат + стальной корпус судна. Через некоторое время стальной корпус судна начал размягчаться и оно вскоре подало сигнал бедствия. К счастью, экипаж был спасен подоспевшим немецким судном, а сама «Анатина» кое-как добралась до порта.
В Тихом океане на судно налетел тайфун и трюмы заполнились соленой водой, в результате чего возникла большая гальваническая пара: медный концентрат + стальной корпус судна. Через некоторое время стальной корпус судна начал размягчаться и оно вскоре подало сигнал бедствия. К счастью, экипаж был спасен подоспевшим немецким судном, а сама «Анатина» кое-как добралась до порта.