Получение ацетилена: Ацетилен, структурная формула, химические свойства
alexxlab | 14.07.1993 | 0 | Разное
Ацетилен, структурная формула, химические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Ацетилен: свойства, как получают, где применяют
Автор статьи Лебедев Юрий Агафонович
Дата публикации:
14.03.2022
Дата обновления:
15.09.2022
Заместитель директора
Работает в отрасли c 1999 г.
Ацетилен (этин) — это вещество, относящееся к классу алкинов, непредельный углеводород. Записывается с использованием химической формулы C2H2. Представляет собой газ без цвета. Создает повышенную огнеопасность.
В этом материале мы рассмотрим получение ацетилена, особенности его использования и виды, в которых может встречаться такое вещество.
Содержание статьи
- Особенности получения ацетилена
- Преимущества ацетилена
- Виды производимого ацетилена
- Особенности и свойства
- Физические свойства
- Область использования
- Особенности хранения
Особенности получения ацетилена
В зависимости от конкретных условий, доступно получение промышленно или лабораторно. При выработке в лаборатории применяется химическая реакция от соединения воды и карбида кальция. Это позволяет получить небольшое количество вещества, которого оказывается вполне достаточно для применения в этой области. Реакция становится более управляемой, когда в нее вводится поваренная соль — это помогает значительно уменьшить скорость протекания.
При выработке в лаборатории применяется химическая реакция от соединения воды и карбида кальция. Это позволяет получить небольшое количество вещества, которого оказывается вполне достаточно для применения в этой области. Реакция становится более управляемой, когда в нее вводится поваренная соль — это помогает значительно уменьшить скорость протекания.
Промышленное производство предполагает выработку большого количества вещества. Основной метод в таком случае — пиролиз. Он применяется к метану, бутану и пропану.
Использование карбидного метода направлено на то, чтобы получить чистый газ. Он проигрывает пиролизу, потому что связан с применением большого количества электроэнергии.
Использование пиролиза позволяет уменьшить затраты энергии, повысить КПД применяемого оборудования.
В промышленности также распространен электрический крекинг. В таком случае удается получить ацетилен из метана. Вещество помещается в электродуговую печь. Температура прогрева при этом составляет от 2000 до 3000 °С. Важным требованием становится формирование напряжения 1 кВ.
Важным требованием становится формирование напряжения 1 кВ.
Чтобы выработать большое количество готового продукта, можно применять окислительный пиролиз. Средство связано с нагнетанием температуры 16000 °С.
Преимущества ацетилена
Такое вещество как ацетилен применяется в сварке. При использовании с кислородом таким образом удается значительно увеличивать температуру прогрева дуги.
Несмотря на уменьшение применения такого средства в сварке в последнее время, его по-прежнему выбирают по причине наличия нескольких важных преимуществ. К ним относятся такие, как:
- Значительное повышение температуры пламени.
- Доступность формирования ацетилена в месте его использования.
- Стоимость применения подобного вещества во время работы.
Недостаток — ограниченное использование и повышенная опасность появления взрыва при высоких концентрациях. Строгое соблюдение прописанных мер безопасности — это важное требование для нормальной работы с ацетиленом.
Нужно хранить и использовать такое средство исключительно в том случае, если пространство хорошо проветривается. Также требуется регулярно проверять тару, внутри которой содержится газ.
Не допускается использование баллонов с большими вмятинами, коррозией. Регулярно проводится освидетельствование и ремонт, может потребоваться дополнительное окрашивание, замена запорной арматуры и других элементов конструкции.
Хотите получить консультацию?
Позвоните нам по телефону!+7 (495) 532 17 17 Пн.-Пт. с 9:00 до 18:00, обед с 13:00 до 14.00, Сб. с 9.00 до 15:00
Виды производимого ацетилена
В промышленности такое вещество может использоваться в разных состояниях. Выпускается два варианта продукта:
- Газообразный. Вещество имеет резкий запах. Это становится преимуществом — в отличие от азота или кислорода, можно быстро определить наличие утечки и принять нужные меры.
- Жидкий. Бесцветное вещество, способное преломлять цвет. Также нельзя допускать утечки — сохраняется высокий уровень взрывоопасности и пожароопасности.

Особенности и свойства
Химические свойства такого вещества связаны с особенностями его химической формулы. В частности, на параметры влияет наличие в нем атомов водорода и углерода.
Вот несколько наиболее важных химических свойств:
- Возможность превращения в бензол. Это происходит при сильном прогревании до 4000 °С и смешивании с графитом.
- Доступность получения уксусного альдегида. Создается при смешивании с водой и при параллельном введении ряда катализаторов.
- Заметные кислотные свойства. Меняются в зависимости от уровня содержания водорода.
Физические свойства
Важны физические свойства продукта:
- Основное состояние — бесцветный газ.
- Плохо растворяется в воде.
- Температура кипения −830 °С.
- При сжимании запускается реакция разложения со стремительным выделением энергии.
Область использования
Вещество применяется не только при выполнении сварки. Среди других решаемых задач:
- Производство карбидных ламп.

- Изготовление взрывчатки.
- Получение множества химических веществ — от полимеров до уксуса.
- Создание ракетного топлива.
Требования к такому веществу указываются в стандарте ГОСТ 5457-75.
Особенности хранения
Так как газ представляет повышенную угрозу возгорания и взрыва, нужно правильно хранить его. Среди основных требований:
- Использование баллонов в хорошем состоянии. Они должны проходить регулярное освидетельствование. Проверяется текущее состояние емкости, анализируется, нет ли на ней повреждений. Не допускается применение тары со следами коррозии, большими вмятинами и другими механическими повреждениями на поверхности.
- Правильное складирование. Баллоны должны находиться в фиксированном положении без сильного давления и риска механических ударов.
- Исключение контакта с катализаторами горения. Не допускается размещения рядом с источниками высоких температур или под прямыми солнечными лучами.
Также нужно соблюдать осторожность во время перевозки, следить за тем, чтобы емкости не падали и не получали механические повреждения. Рекомендуем обратить особое внимание на оборудование места для хранения. Это должен быть удобный склад с хорошей системой вентиляции.
Рекомендуем обратить особое внимание на оборудование места для хранения. Это должен быть удобный склад с хорошей системой вентиляции.
Источники:
- https://ru.wikipedia.org/wiki/Ацетилен
- Ацетилен, его свойства, получение и применение. С. А. Миллер
ЧАСТО ЗАДАВАЕМЫЕ ВОПРОСЫ
Как получают ацетилен?
Возможно промышленное и лабораторное производство. Для получения большого количества вещества используют метод пиролиза или электрического крекинга. Для получения небольшого количества в лабораторных условиях соединяют воду и карбид кальция.
Что такое электрический крекинг?
Метод получения ацетилена из метана.
Где используют ацетилен?
При сварке, на производстве карбидных ламп, при изготовлении взрывчатки, для создания ракетного топлива и др.
В каком состоянии может находиться ацетилен?
Жидком и газообразном.
Если вам понравилась статья, поделитесь ей в социальных сетях
Технология производства ацетилена.
 Детали процесса производства ацетилена
Детали процесса производства ацетиленаАцетилен — легковоспламеняющийся газ, бесцветный, легче воздуха, с чесночным запахом. Будучи бесцветным и легковоспламеняющимся газом, он используется в качестве топлива и химического строительного блока. Он остается нестабильным в чистом виде, поэтому с ним обычно обращаются в виде раствора. Химическое соединение с формулой C2h3 представляет собой соединение углерода и водорода. Это не только углеводород, но и простейший алкин.
Как получить ацетилен?
В промышленных масштабах ацетилен получают в результате химической реакции между карбидом кальция и водой. В результате реакции выделяется значительное количество тепла, которое необходимо уменьшить, чтобы предотвратить взрыв газообразного ацетилена, как на ацетиленовых газовых установках БДМ.
| Химическая реакция между карбидом кальция и водой с образованием ацетилена |
Открытие ацетиленового газа
Эдмунд Дэви, профессор химии и ученый с мировым именем, еще в 1836 году открыл ацетилен как «новый карбюратор водорода». А в 1860 году он был повторно открыт французским химиком Марселлином Бертло, который изобрел название «ацетилен». сбор стоков. Кроме того, ему также удалось создать его, вызывая электричество через смесь цианогена и водородных газов. Чистый газ не имеет запаха, в то время как товарный газ имеет чесночный запах из-за присутствия примесей, таких как сероводород и фосфин.
А в 1860 году он был повторно открыт французским химиком Марселлином Бертло, который изобрел название «ацетилен». сбор стоков. Кроме того, ему также удалось создать его, вызывая электричество через смесь цианогена и водородных газов. Чистый газ не имеет запаха, в то время как товарный газ имеет чесночный запах из-за присутствия примесей, таких как сероводород и фосфин.
| Получение ацетилена в процессе термического крекинга |
Химические свойства газообразного ацетилена
- Молекулярный вес: 26,038
- Удельный объем: 14,7 кубических футов на фунт
- Пределы воспламеняемости: 2,5-100% в воздухе
- Клапан CGA: 510
- Название DOT: Ацетилен, растворенный
- № ООН: UN1001
- Класс DOT: 2.1
- Этикетка DOT: Горючий газ
- Регистратура CAS: 74-86-2
Применение ацетилена
Существует несколько вариантов использования газа. Фактически, 80% ацетилена, производимого ежегодно, используется для химического синтеза. Остальные 20% ацетилена используются для ряда функций, таких как кислородно-ацетиленовая газовая сварка и резка из-за высокой температуры пламени.
Фактически, 80% ацетилена, производимого ежегодно, используется для химического синтеза. Остальные 20% ацетилена используются для ряда функций, таких как кислородно-ацетиленовая газовая сварка и резка из-за высокой температуры пламени.
Хранение и обращение
Поскольку он является взрывоопасным газом, его необходимо хранить и обращаться с ним с осторожностью. Чтобы обеспечить его безопасность, давление поддерживается на низком уровне, а длина трубопровода остается очень короткой, пока он транспортируется по трубопроводам. Для хранения и транспортировки газа используются специальные баллоны для хранения. В специальные цилиндры вводят абсорбирующий материал, в том числе диатомовую землю и небольшое количество ацетона. После растворения он теряет свою взрывоопасность и, таким образом, становится безопасным для транспортировки.
- Дом
© acetylenegasplant.com Все права защищены.
Home
О примерно
аксессуарах
Отправить запрос
о ацетилене
Описание процесса
Оксицетилен Сварка
Chemicals
. Приложения
Приложения
.
Селективное электрокаталитическое полугидрирование примесей ацетилена для производства полимерного этилена
Chai, Y. et al. Контроль внутренней части пор цеолита для хемоселективного разделения алкинов/олефинов. Наука 368 , 1002–1006 (2020).
Артикул КАС пабмед Google ученый
Чжан, Л., Чжоу, М., Ван, А. и Чжан, Т. Селективное гидрирование на металлических катализаторах на носителе: от наночастиц до отдельных атомов. Хим. Ред. 120 , 683–733 (2020).
Артикул КАС пабмед Google ученый
Bridier, B. & Pérez-Ramirez, J. Совместные эффекты в тройных катализаторах Cu-Ni-Fe приводят к повышенной селективности по алкену при гидрировании алкина. Дж. Ам. хим. соц. 132 , 4321–4327 (2010).
Дж. Ам. хим. соц. 132 , 4321–4327 (2010).
Артикул КАС пабмед Google ученый
Бос, А. Н. Р. и Вестертерп, К. Р. Механизм и кинетика селективного гидрирования этина и этена. Хим. англ. Процесс. 32 , 1–7 (1993).
Артикул КАС Google ученый
Шбиб, Н.С., Гарсия, М.А., Гигола, К.Е. и Эрразу, А.Ф. Кинетика гидрирования ацетилена на начальном этапе производства этилена. Индивидуальный инж. хим. Рез. 35 , 1496–1505 (1996).
Артикул КАС Google ученый
Ниу, Ю. и др. Манипулирование межузельными атомами углерода в октаэдрической позиции никеля для высокоэффективного гидрирования алкина. Нац. коммун. 11 , 3324 (2020).
Артикул КАС пабмед ПабМед Центральный Google ученый
Примо, А., Неату, Ф., Флореа, М., Парвулеску, В. и Гарсия, Х. Графены в отсутствие металлов в качестве карбокатализаторов для селективного гидрирования ацетилена и алкена. Нац. коммун. 5 , 5291 (2014).
Артикул КАС пабмед Google ученый
Хуанг, Ф. и др. Закрепление частиц Cu 1 на наноалмаз-графене для полугидрирования ацетилена. Нац. коммун. 10 , 4413 (2019).
Артикул КАС Google ученый
Кодзима Т., Камеока С., Фуджи С., Уэда С. и Цай А.-П. Перестраиваемые катализом сплавы Гейслера в селективном гидрировании алкинов: новый потенциал для старых материалов. Науч. Доп. 4 , eaat6063 (2018).
Артикул КАС пабмед ПабМед Центральный Google ученый
Чжао, X.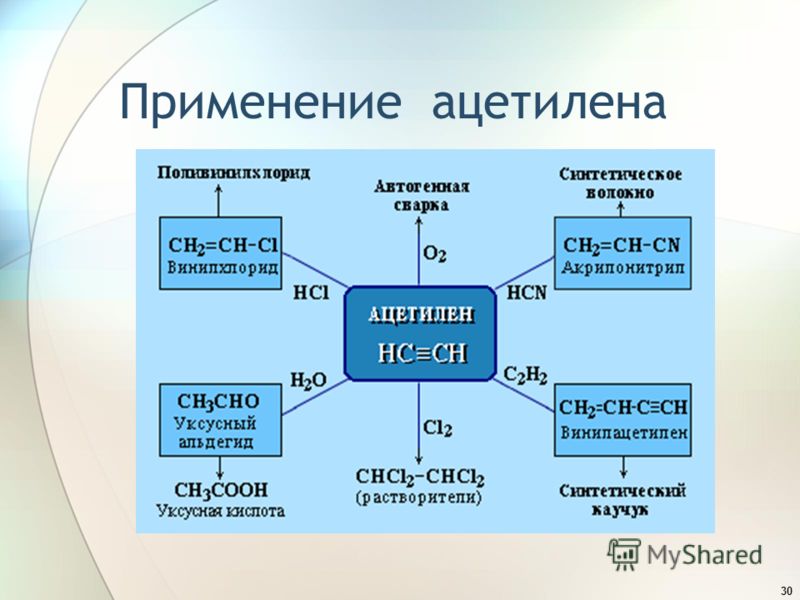 и др. Обработка тиолом создает селективные палладиевые катализаторы для полугидрирования внутренних алкинов. Chem 4 , 1080–1091 (2018).
и др. Обработка тиолом создает селективные палладиевые катализаторы для полугидрирования внутренних алкинов. Chem 4 , 1080–1091 (2018).
Артикул КАС Google ученый
Ван, С. и др. Активация и распространение водорода на нанокластеры палладия размером менее 1 нм, заключенные в содалитовый цеолит, для полугидрирования алкинов. Анж. хим. Междунар. Эд. 58 , 7668–7672 (2019).
Артикул КАС Google ученый
Ху, М. и др. Интерметаллические наночастицы PdZn размером менее 2 нм, ограниченные MOF, в качестве высокоэффективных катализаторов для селективного гидрирования ацетилена. Доп. Матер. 30 , 1801878 (2018).
Артикул КАС Google ученый
Armbrüster, M. et al. Al 13 Fe 4 в качестве недорогой альтернативы палладию в гетерогенном гидрировании. Нац. Матер. 11 , 690–693 (2012).
Нац. Матер. 11 , 690–693 (2012).
Артикул пабмед КАС Google ученый
Хуанг, Ф. и др. Атомно-дисперсный Pd на гибриде наноалмаз/графен для селективного гидрирования ацетилена. Дж. Ам. хим. соц. 140 , 13142–13146 (2018).
Артикул КАС пабмед Google ученый
Wei, S. et al. Прямое наблюдение превращения наночастиц благородных металлов в термически стабильные отдельные атомы. Нац. нанотехнологии. 13 , 856–861 (2018).
Артикул КАС пабмед Google ученый
Райли, К. и др. Разработка эффективных катализаторов селективного гидрирования алкинов допированием церия одноатомным промотором. Дж. Ам. хим. соц. 140 , 12964–12973 (2018).
Артикул КАС пабмед Google ученый
Дин, К. и др. Общий подход к синтезу биметаллических наночастиц на носителе с помощью поверхностной неорганической химии. Наука 362 , 560–564 (2018).
Артикул КАС пабмед Google ученый
Кириаку, Г. и др. Геометрия изолированных атомов металлов как стратегия селективного гетерогенного гидрирования. Наука 335 , 1209–1212 (2012).
Артикул КАС пабмед Google ученый
Тешнер, Д. и др. Роль подповерхностного углерода и водорода в катализируемом палладием гидрировании алкинов. Наука 320 , 86–89 (2008).
Артикул КАС пабмед Google ученый
Davitt, HJ & Albright, L.F. Электрохимическое гидрирование этилена, ацетилена и смесей этилен-ацетилен. Дж. Электрохим. соц. 118 , 236 (1971).
соц. 118 , 236 (1971).
Артикул КАС Google ученый
Берк, Л. Д., Льюис, Ф. А. и Кембалл, К. Гидрирование ацетилена на палладиевых палладиевых и платинированных платиновых электродах. Пер. Фарадей Сок. 60 , 919–929 (1964).
Артикул КАС Google ученый
Оцука К. и Яги Т. Электрохимический мембранный реактор для селективного гидрирования ацетилена в изобилии этилена. J. Катал. 145 , 289–294 (1994).
Артикул КАС Google ученый
Хуанг Б., Дуранте К., Иссе А. А. и Дженнаро А. Высокоселективное электрохимическое гидрирование ацетилена в этилен на катодах из серебра и меди. Электрохим. коммун. 34 , 90–93 (2013).
Артикул КАС Google ученый
Белтовска-Бжезинска М., Лучак Т., Мончка М., Балтрушат Х. и Мюллер У. Окисление и гидрирование этина на пористом платиновом электроде в кислом растворе. Дж. Электроанал. хим. 519 , 101–110 (2002).
Артикул Google ученый
Pei, G. X. et al. Характеристики одноатомного катализатора Pd, легированного медью, для полугидрирования ацетилена в моделируемых начальных условиях. ACS Катал. 7 , 1491–1500 (2017).
Артикул КАС Google ученый
Jiang, L. et al. Фасетная инженерия ускоряет побочное гидрирование сильно разбавленных металлических нанокатализаторов. Нац. нанотехнологии. 15 , 848–853 (2020).
Артикул КАС пабмед Google ученый
Zhou, H. et al. Интерметаллическая наноструктура PdZn с ансамблями Pd–Zn–Pd для высокоактивного и хемоселективного полугидрирования ацетилена. ACS Катал. 6 , 1054–1061 (2016).
ACS Катал. 6 , 1054–1061 (2016).
Артикул КАС Google ученый
Studt, F. et al. Идентификация катализаторов на основе сплавов неблагородных металлов для селективного гидрирования ацетилена. Наука 320 , 1320–1322 (2008).
Артикул КАС пабмед Google ученый
Чжао, З. Дж. и др. Конкуренция образования связи C – C и образования связи C – H при гидрировании ацетилена на переходных металлах: исследование теории функционала плотности. AlChE J. 65 , 1059–1066 (2019).
Артикул КАС Google ученый
Seh, Z.W. et al. Сочетание теории и эксперимента в электрокатализе: понимание дизайна материалов. Наука 355 , eaad4998 (2017).
Артикул пабмед Google ученый
Динь, К.-Т. и другие. CO 2 электровосстановление до этилена с помощью катализа меди с помощью гидроксида на резкой границе раздела. Наука 360 , 783–787 (2018).
Артикул КАС пабмед Google ученый
Ким Ю.-Г. и другие. Реконструкция поверхности монокристаллических электродов из чистой меди при потенциалах восстановления CO в щелочных растворах: исследование, проведенное сериатимом ECSTM-DEMS. Дж. Электроанал. хим. 780 , 290–295 (2016).
Артикул КАС Google ученый
Бодаппа, Н. и др. Ранние стадии электрохимического окисления поверхности Cu(111) и поликристаллической меди, выявленные с помощью рамановской спектроскопии in situ. Дж. Ам. хим. соц. 141 , 12192–12196 (2019).
Артикул КАС пабмед Google ученый
Wang, Y. et al. Синтез катализатора при электровосстановлении CO 2 способствует огранке и способствует электросинтезу возобновляемых топлив. Нац. Катал. 3 , 98–106 (2019).
Артикул КАС Google ученый
Люк, В. и др. Двумерные медные нанолисты для электрохимического восстановления монооксида углерода до ацетата. Нац. Катал. 2 , 423–430 (2019).
Артикул КАС Google ученый
Qu, Y. et al. Прямое превращение объемной меди в одиночные центры меди путем испускания и захвата атомов. Нац. Катал. 1 , 781–786 (2018).
Артикул КАС Google ученый
Лю, Г.-к и др. Электрохимическая полимеризация ацетилена на Rh-электродах, исследованная с помощью спектроскопии комбинационного рассеяния с усилением поверхности. Дж. Электроанал. хим. 594 , 73–79 (2006).
Дж. Электроанал. хим. 594 , 73–79 (2006).
Артикул КАС Google ученый
Мацуда, Р. и др. Высоко контролируемое размещение ацетилена в металлоорганическом микропористом материале. Природа 436 , 238–241 (2005).
Артикул КАС пабмед Google ученый
Паттерсон, М. Л. и Уивер, М. Дж. Спектроскопия комбинационного рассеяния с усилением поверхности как исследование связи адсорбат-поверхность: простые алкены и алкины, адсорбированные на золотых электродах. J. Phys. хим. 89 , 5046–5051 (1985).
Артикул КАС Google ученый
Wang, X. et al. Эффективный электросинтез метана достигается за счет локальной настройки CO 2 наличие. Дж. Ам. хим. соц. 142 , 3525–3531 (2020).
Артикул КАС пабмед Google ученый
Wu, Y., Liu, C., Wang, C., Lu, S. & Zhang, B. Полугидрирование с селективным переносом алкинов с H 2 O (D 2 O) в виде H ( D) источник над катодом Pd-P. Анжю. хим. Междунар. Эд. 132 , 21356–21361 (2020).
Артикул Google ученый
Крессе, Г. и Фуртмюллер, Дж. Эффективность расчетов полной энергии ab-initio для металлов и полупроводников с использованием базисного набора плоских волн. Вычисл. Матер. науч. 6 , 15–50 (1996).
Артикул КАС Google ученый
Крессе, Г. и Фуртмюллер, Дж. Эффективные итерационные схемы для неэмпирических расчетов полной энергии с использованием базисного набора плоских волн. Физ. Версия Б 54 , 11169 (1996).
Артикул КАС Google ученый
Blöchl, PE Метод дополненной волны проектора. Физ. Ред. B 50 , 17953 (1994).
Артикул Google ученый
Хаммер, Б., Хансен, Л. Б. и Норсков, Дж. К. Улучшенная энергетика адсорбции в рамках теории функционала плотности с использованием пересмотренных функционалов Пердью-Берка-Эрнзергофа. Физ. Ред. B 59 , 7413 (1999).
Артикул Google ученый
Nørskov, J.K. et al. Происхождение перенапряжения восстановления кислорода на катоде топливного элемента. J. Phys. хим. B 108 , 17886–17892 (2004 г.).
Артикул КАС Google ученый
Петерсон А. А., Абильд-Педерсен Ф., Штудт Ф.



