Получить карбид кальция из оксида кальция: CaO -> CaC2 уравнение реакции
alexxlab | 25.10.1989 | 0 | Разное
Оксид кальция, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Оксид кальция – формула, реакции получения, тип химической связи
4.7
Средняя оценка: 4.7
Всего получено оценок: 140.
4.7
Средняя оценка: 4.7
Всего получено оценок: 140.
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.
Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
Рис. 1. Кубические гранецентрированные кристаллические решётки.Общее описание вещества представлено в таблице.
Признак | Значение |
Формула соединения оксид кальция | CaO |
Температура плавления | 2627°C |
Температура кипения | 2850°C |
Растворимость | В глицерине. |
Молярная масса | 56,077 г/моль |
Плотность | 3,37 г/см3 |
Химическая связь в кристалле | Ионная |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
Рис. 2. Порошок оксида кальция.Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Это природное вещество, встречающееся в форме минералов – арагонита, ватерита, кальцита. Входит в состав мрамора, мела, известняка.Реакция получения оксида кальция из известняка выглядит следующим образом:
CaCO3 → CaO + CO2.
Кроме того, негашёную известь можно получить двумя способами:
Реакции протекают при высоких температурах.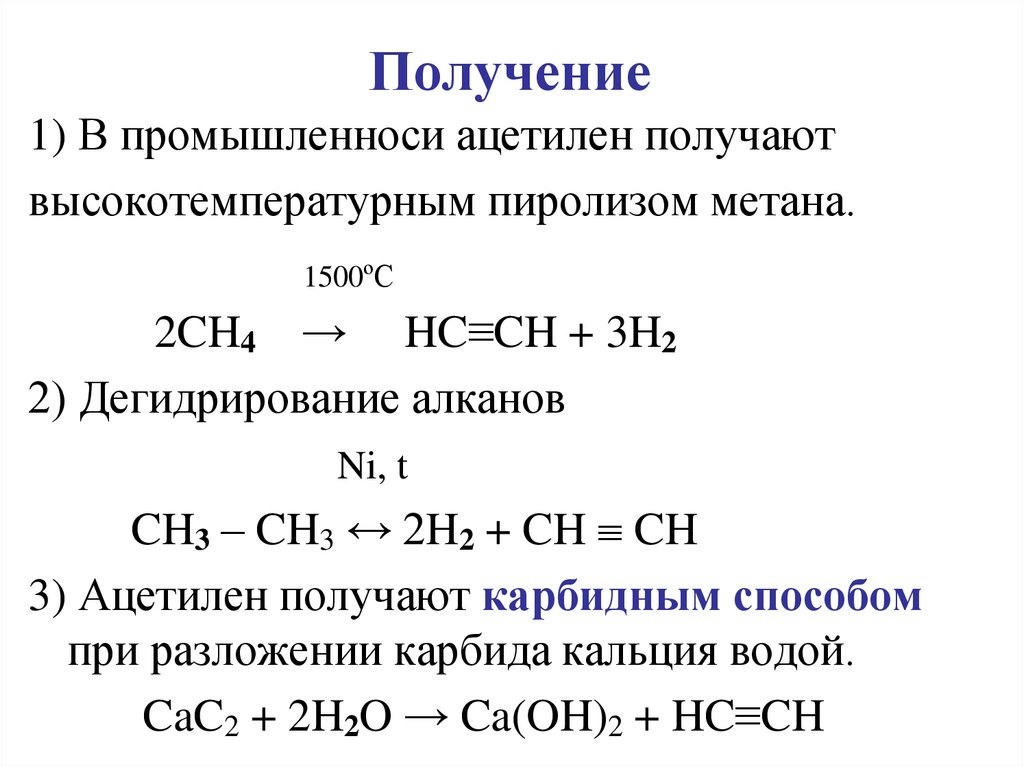 Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции | Что образуется | Молекулярное уравнение |
С водой | Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла | CaO + H2O → Ca(OH)2 |
С кислотами | Растворяется, образуя соли | CaO + 2HCl → CaCl2 +H2O |
С оксидами неметаллов (кислотными остатками) | Образуются соли | CaO + SO2 → CaSO3 |
С углеродом при нагревании | Образуется карбид кальция | CaO + 3С → СаС2 + CO |
С алюминием | Восстанавливает кальций. | 3CaO + 2Al → Са + Al2O3 |
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупорных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.
Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Тест по теме
Доска почёта
Чтобы попасть сюда – пройдите тест.
Владимир Комаров
10/10
Сергей Ефремов
4/10
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 140.
А какая ваша оценка?
Оксид кальция – формула, реакции получения, тип химической связи » Kupuk.net
Главная » Уроки » Химия
Автор Беликова Ирина На чтение 3 мин Просмотров 44
Негашёная известь – это оксид кальция. Его получают в лабораториях и промышленным путём из природных материалов. Вещество активно используется в строительстве и промышленности.
Физические свойства
Оксид кальция – неорганическое кристаллическое вещество в виде белого или серо-белого порошка без запаха и вкуса. Твёрдое вещество кристаллизуется в кубические гранецентрированные кристаллические решётки по типу хлорида натрия (NaCl).
Рис. 1. Кубические гранецентрированные кристаллические решётки.
Общее описание вещества представлено в таблице.
Признак | Значение |
Формула соединения оксид кальция | CaO |
Температура плавления | 2627°C |
Температура кипения | 2850°C |
Растворимость | В глицерине. В этаноле не растворяется, с водой образует гидроксид |
Молярная масса | 56,077 г/моль |
Плотность | 3,37 г/см3 |
Химическая связь в кристалле | Ионная |
Оксид кальция – едкое вещество, относящееся ко второму классу опасности. Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
Агрессивные свойства проявляет при взаимодействии с водой, образуя гашёную известь.
Рис. 2. Порошок оксида кальция.
Получение
Оксид кальция также называют жжёной известью из-за способа получения. Получают негашёную известь путём нагревания и разложения известняка – карбоната кальция (CaCO3).
Это природное вещество, встречающееся в форме минералов – арагонита, ватерита, кальцита. Входит в состав мрамора, мела, известняка.
Реакция получения оксида кальция из известняка выглядит следующим образом:
CaCO3 → CaO + CO2.
Кроме того, негашёную известь можно получить двумя способами:
- из простых веществ, наращивая оксидный слой на металле –
2Ca + O2 → 2CaO; - при термической обработке гидроксида или солей кальция –
Ca(OH)2 → CaO + h3O; 2Ca(NO3)2 → 2CaO + 4NO2 + O2.
Реакции протекают при высоких температурах. Температура сожжения известняка – 900-1200°C. При 200-300°C на поверхности металла начинает образовываться оксид. Для разложения солей и гидроксида необходима температура в 500-600°C.
Для разложения солей и гидроксида необходима температура в 500-600°C.
Химические свойства
Оксид кальция является высшим оксидом и максимально проявляет окислительные свойства. Соединения взаимодействует с неорганическими веществами и свободными галогенами. Основные химические свойства оксида приведены в таблице.
Реакции | Что образуется | Молекулярное уравнение |
С водой | Образуется гидроксид (гашёная известь). Реакция протекает бурно с выделением тепла | CaO + h3O → Ca(OH)2 |
С кислотами | Растворяется, образуя соли | CaO + 2HCl → CaCl2 +h3O |
С оксидами неметаллов (кислотными остатками) | Образуются соли | CaO + SO2 → CaSO3 |
С углеродом при нагревании | Образуется карбид кальция | CaO + 3С → СаС2 + CO |
С алюминием | Восстанавливает кальций. | 3CaO + 2Al → Са + Al2O3 |
Применение
Оксид используется в пищевой промышленности в качестве:
- улучшителя муки и хлеба;
- пищевой добавки Е529;
- регулятора кислотности;
- питательной среды для дрожжей;
- катализатора гидрогенизации (присоединения водорода) жиров.
Кроме того, негашёная известь применяется в химической и строительной промышленности для производства различных веществ:
- масел;
- стеарата кальция;
- солидола;
- огнеупорных материалов;
- гипса;
- высокоглиноземистого цемента;
- силикатного кирпича.
Рис. 3. Цемент, кирпич, гипс получают из оксида кальция.
Что мы узнали?
Оксид кальция или негашёная известь – кристаллическое вещество, бурно реагирующее с водой и образующее гашёную известь. Широко используется в промышленности, в частности пищевой и строительной. Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Зарегистрирован как пищевая добавка Е529. Имеет высокие температуры плавления и кипения, растворяется только в глицерине. Образуется при сжигании карбоната кальция. Проявляет окислительные свойства, образует соли с оксидами и кислотами, взаимодействует с углеродом и алюминием.
Оцените автора
КАЛЬЦИЯ ЦИАНАМИД С БОЛЕЕ 0,1 % КАРБИДА КАЛЬЦИЯ | CAMEO Chemicals
Добавить в MyChemicals Страница для печати
Химический паспорт
Химические идентификаторы | Опасности | Рекомендации по ответу | Физические свойства | Нормативная информация | Альтернативные химические названия
Химические идентификаторы
Что это за информация?
Поля химического идентификатора
включают общие идентификационные номера,
алмаз NFPA
Знаки опасности Министерства транспорта США и общий
описание хим. Информация в CAMEO Chemicals поступает
из множества
источники данных.
| Номер CAS | Номер ООН/НА | Знак опасности DOT | Береговая охрана США КРИС Код |
|---|---|---|---|
|
|
| никто |
| Карманный справочник NIOSH | Международная карта химической безопасности | ||
| Цианамид кальция |
| ||
NFPA 704
| Алмаз | Опасность | Значение | Описание |
|---|---|---|---|
| Здоровье | |||
| Воспламеняемость | 3 | Может воспламеняться практически при любых температурах окружающей среды. | |
| нестабильность | 1 | Обычно стабилен, но может стать нестабильным при повышенных температурах и давлениях. | |
| Специальный | Вт | Реагирует бурно или взрывоопасно с водой. |
(NFPA, 2010)
Общее описание
Твердое вещество без запаха от бесцветного до серого. Может вызвать заболевание при приеме внутрь. Может раздражать кожу. При воздействии воды или высоких температур цианамид кальция может выделять токсичные и легковоспламеняющиеся пары. Используется для производства пестицидов и удобрений.
Опасности
Что это за информация?
Опасные поля
включают
специальные предупреждения об опасности
воздух и вода
реакции, пожароопасность, опасность для здоровья, профиль реактивности и
подробности о
задания реактивных групп
а также
потенциально несовместимые абсорбенты. Информация в CAMEO Chemicals поступает из различных источников.
источники данных.
Информация в CAMEO Chemicals поступает из различных источников.
источники данных.
Предупреждения о реактивности
- Сильный восстановитель
- Реагирует с водой
Реакции с воздухом и водой
В зависимости от содержания карбида кальция цианамид реагирует с водой (влагой воздуха или почвы) с образованием ацетилена и гидратированного оксида кальция или гидроксида кальция. Поглощение воды при обращении или хранении технического цианамида кальция может привести к взрыву [Pieri, M. Chem. Абс. 46, 8335 1952].
Пожароопасность
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие горючие газы)]:
Выделяют легковоспламеняющиеся газы при контакте с водой. Может воспламениться при контакте с водой или влажным воздухом. Некоторые из них бурно или взрывоопасно реагируют на контакт с водой. Может воспламениться от тепла, искр или пламени. Может воспламениться после тушения пожара. Некоторые транспортируются в легковоспламеняющихся жидкостях. Слив может создать опасность пожара или взрыва. (ЭРГ, 2020)
Некоторые транспортируются в легковоспламеняющихся жидкостях. Слив может создать опасность пожара или взрыва. (ЭРГ, 2020)
Опасность для здоровья
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие легковоспламеняющиеся газы)]:
Вдыхание или контакт с парами, веществами или продуктами разложения может привести к серьезным травмам или смерти. Может образовывать коррозионные растворы при контакте с водой. При пожаре выделяются раздражающие, коррозионные и/или токсичные газы. Сток от противопожарной или разбавляющей воды может привести к загрязнению окружающей среды. (ЭРГ, 2020)
Профиль реакционной способности
При гидратации КАРБИД КАЛЬЦИЯ образует соли кальция, которые являются основными и обычно растворимы в воде. Полученные растворы содержат умеренные концентрации гидроксид-ионов и имеют рН более 7,0. Они реагируют как основания, чтобы нейтрализовать кислоты. Эти нейтрализации выделяют тепло, но меньше или намного меньше, чем выделяется при нейтрализации оснований в группе реакционной способности 10 (Основания) и при нейтрализации аминов. Обычно они не реагируют ни как окислители, ни как восстановители, но такое поведение не невозможно.
Обычно они не реагируют ни как окислители, ни как восстановители, но такое поведение не невозможно.
Принадлежит к следующей реакционной группе(ам)
- Цианиды неорганические
- Соли, основные
Потенциально несовместимые абсорбенты
Информация отсутствует.
Рекомендации по реагированию
Что это за информация?
Поля рекомендации ответа включают в себя расстояния изоляции и эвакуации, а также рекомендации по пожаротушение, пожарное реагирование, защитная одежда и первая помощь. информация в CAMEO Chemicals поступает из различных источники данных.
Изоляция и эвакуация
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие легковоспламеняющиеся газы)]:
НЕМЕДЛЕННЫЕ МЕРЫ ПРЕДОСТОРОЖНОСТИ: Изолируйте зону разлива или утечки во всех направлениях на расстоянии не менее 50 метров (150 футов) для жидкостей и не менее 25 метров (75 футов) для твердых тел.
РАЗЛИВ: При необходимости увеличьте расстояние для немедленных мер предосторожности в подветренном направлении.
ПОЖАР: Если цистерна, железнодорожная цистерна или автоцистерна вовлечены в пожар, ИЗОЛИРОВАТЬ на расстоянии 800 метров (1/2 мили) во всех направлениях; также рассмотрите первоначальную эвакуацию на 800 метров (1/2 мили) во всех направлениях. (ЭРГ, 2020)
Пожаротушение
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие горючие газы)]:
НЕ ИСПОЛЬЗУЙТЕ ВОДУ ИЛИ ПЕНУ.
НЕБОЛЬШОЙ ПОЖАР: Сухой химикат, кальцинированная сода, известь или песок.
БОЛЬШОЙ ПОЖАР: СУХОЙ песок, сухие химикаты, кальцинированная сода или известь или убрать из зоны и дать огню гореть. Если это можно сделать безопасно, уберите неповрежденные контейнеры из зоны вокруг огня.
ПОЖАР, СВЯЗАННЫЙ С МЕТАЛЛАМИ ИЛИ ПОРОШКАМИ (АЛЮМИНИЙ, ЛИТИЙ, МАГНИЙ И Т.Д.): Используйте сухие химические вещества, СУХОЙ песок, порошок хлорида натрия, графитовый порошок или огнетушители класса D; кроме того, для лития вы можете использовать порошок Lith-X® или медный порошок. Также см. Руководство ERG 170.
Также см. Руководство ERG 170.
ПОЖАР, ВКЛЮЧАЮЩИЙ РЕЗЕРВУАРЫ ИЛИ АВТОМОБИЛЬНЫЕ/ТРЕЙЛЕРНЫЕ НАГРУЗКИ: Тушить огонь с максимального расстояния или использовать беспилотные устройства основного потока или контрольные насадки. Не допускайте попадания воды внутрь контейнеров. Охладите контейнеры заливающим количеством воды до тех пор, пока огонь не погаснет. Немедленно отозвать в случае усиления звука от вентиляционных предохранительных устройств или обесцвечивания бака. ВСЕГДА держитесь подальше от танков, охваченных огнем. (ЭРГ, 2020)
Непожарное реагирование
Выдержка из Руководства ERG 138 [Вещества, реагирующие с водой (выделяющие легковоспламеняющиеся газы)]:
УСТРАНИТЕ все источники воспламенения (не курить, факелы, искры или пламя) в непосредственной близости. Не прикасайтесь к рассыпанному материалу и не ходите по нему. Остановите утечку, если вы можете сделать это без риска. Используйте распыление воды, чтобы уменьшить количество паров или отклонить дрейф облаков паров. Избегайте попадания стекающей воды на разлитый материал. НЕ ПОПАДАЙТЕ ВОДУ на пролитое вещество или внутрь контейнеров.
Избегайте попадания стекающей воды на разлитый материал. НЕ ПОПАДАЙТЕ ВОДУ на пролитое вещество или внутрь контейнеров.
НЕБОЛЬШОЙ РАЗЛИВ: Накрыть СУХОЙ землей, СУХИМ песком или другим негорючим материалом, а затем накрыть полиэтиленовой пленкой, чтобы свести к минимуму распространение или контакт с дождем. Дайка для последующей утилизации; не применяйте воду, если это не предписано.
РАЗЛИВ ПОРОХА: Накройте разлив порошка пластиковой пленкой или брезентом, чтобы свести к минимуму распространение и сохранить порошок сухим. ЗАПРЕЩАЕТСЯ ЧИСТИТЬ ИЛИ УТИЛИЗИРОВАТЬ, КРОМЕ ПОД НАБЛЮДЕНИЕМ СПЕЦИАЛИСТА. (ЭРГ, 2020)
Защитная одежда
Выдержка из Карманного справочника NIOSH по цианамиду кальция:
Кожа: ПРЕДОТВРАТИТЬ КОНТАКТ С КОЖЕЙ – Носите соответствующую защитную одежду для предотвращения контакта с кожей.
Глаза: ПРЕДОТВРАЩАЙТЕ ПОПАДАНИЕ В ГЛАЗА – Носите соответствующую защиту для глаз, чтобы предотвратить попадание в глаза.
Мытье кожи: ПРИ ЗАГРЯЗНЕНИИ – Рабочий должен немедленно вымыть кожу, когда она становится загрязненной.
Снять: ПРИ ВЛАЖНОСТИ ИЛИ ЗАГРЯЗНЕНИИ – Рабочую одежду, которая намокла или сильно загрязнилась, следует снять и заменить.
Смена: ЕЖЕДНЕВНО – Рабочие, чья одежда могла быть заражена, должны переодеться в чистую одежду перед тем, как покинуть рабочее место.
Предоставьте:
• СРЕДСТВА ДЛЯ ПРОМЫВКИ ДЛЯ ГЛАЗ – Фонтанчики для промывки глаз должны быть установлены в зонах, где существует вероятность того, что рабочие могут подвергнуться воздействию этих веществ; это не зависит от рекомендации по ношению защиты глаз.
• БЫСТРОЕ ОБМАЧИВАНИЕ. В непосредственной близости от рабочей зоны должны быть предусмотрены средства для быстрого обливания тела в экстренных случаях, когда существует вероятность воздействия. [Примечание: предполагается, что эти сооружения обеспечивают достаточное количество или поток воды для быстрого удаления вещества с любых участков тела, которые могут подвергаться воздействию. Фактическое определение того, что представляет собой адекватное оборудование для быстрого смачивания, зависит от конкретных обстоятельств. В некоторых случаях должен быть легко доступен проточный душ, тогда как в других случаях адекватным может считаться наличие воды из раковины или шланга.] (NIOSH, 2022)
Фактическое определение того, что представляет собой адекватное оборудование для быстрого смачивания, зависит от конкретных обстоятельств. В некоторых случаях должен быть легко доступен проточный душ, тогда как в других случаях адекватным может считаться наличие воды из раковины или шланга.] (NIOSH, 2022)
Ткани для костюмов DuPont Tychem®
Информация отсутствует.
Первая помощь
ГЛАЗА: Сначала проверьте наличие у пострадавшего контактных линз и снимите их, если они есть. Промывать глаза пострадавшего водой или физиологическим раствором в течение 20–30 минут, одновременно звоня в больницу или токсикологический центр. Не закапывайте в глаза пострадавшему какие-либо мази, масла или лекарства без специальных указаний врача. НЕМЕДЛЕННО доставьте пострадавшего после промывания глаз в больницу, даже если симптомы (например, покраснение или раздражение) не развиваются.
КОЖА: НЕМЕДЛЕННО промойте пораженные участки кожи водой, сняв и изолировав всю загрязненную одежду. Тщательно промойте все пораженные участки кожи водой с мылом. При появлении таких симптомов, как покраснение или раздражение, НЕМЕДЛЕННО вызовите врача и будьте готовы доставить пострадавшего в больницу для лечения.
Тщательно промойте все пораженные участки кожи водой с мылом. При появлении таких симптомов, как покраснение или раздражение, НЕМЕДЛЕННО вызовите врача и будьте готовы доставить пострадавшего в больницу для лечения.
ПРИ ВДЫХАНИИ: НЕМЕДЛЕННО покинуть зараженную зону; сделать глубокий вдох свежего воздуха. При появлении симптомов (таких как свистящее дыхание, кашель, одышка или жжение во рту, горле или груди) вызовите врача и будьте готовы доставить пострадавшего в больницу. Обеспечьте надлежащую защиту органов дыхания спасателям, входящим в неизвестную атмосферу. По возможности следует использовать автономный дыхательный аппарат (SCBA); если это невозможно, используйте уровень защиты выше или равный рекомендованному в разделе «Защитная одежда».
ПРОГЛАТЫВАНИЕ: НЕ ВЫЗЫВАТЬ РВОТУ. Если пострадавший в сознании и у него нет конвульсий, дайте 1-2 стакана воды для разбавления химиката и НЕМЕДЛЕННО позвоните в больницу или токсикологический центр. Будьте готовы доставить пострадавшего в больницу, если это будет рекомендовано врачом. Если пострадавший находится в судорогах или без сознания, ничего не давать ртом, убедиться, что дыхательные пути пострадавшего открыты, и уложить пострадавшего на бок так, чтобы голова была ниже туловища. НЕ ВЫЗЫВАЕТ РВОТУ. НЕМЕДЛЕННО доставьте пострадавшего в больницу. (НТП, 1992)
Если пострадавший находится в судорогах или без сознания, ничего не давать ртом, убедиться, что дыхательные пути пострадавшего открыты, и уложить пострадавшего на бок так, чтобы голова была ниже туловища. НЕ ВЫЗЫВАЕТ РВОТУ. НЕМЕДЛЕННО доставьте пострадавшего в больницу. (НТП, 1992)
Физические свойства
Что это за информация?
Поля физических свойств включают в себя такие свойства, как давление пара и температура кипения, а также пределы взрываемости и пороги токсического воздействия Информация в CAMEO Chemicals поступает из различных источников. источники данных.
| Химическая формула: |
|
Температура вспышки: данные отсутствуют
Нижний предел взрываемости (НПВ): данные отсутствуют
Верхний предел взрываемости (ВПВ): данные отсутствуют
Температура самовоспламенения: данные отсутствуют
Температура плавления: 2372°F (НТП, 1992)
Давление паров:
0 мм рт. ст.
(приблизительно)
(NIOSH, 2022)
ст.
(приблизительно)
(NIOSH, 2022)
Плотность паров (относительно воздуха): данные недоступны
Удельный вес: 2,29 при 68°F (НТП, 1992)
Точка кипения: Сублимы> 2102 ° F (NTP, 1992)
Молекулярный вес: 80,1 (НТП, 1992)
Растворимость в воде: Разлагается (НТП, 1992)
Энергия/потенциал ионизации: данные отсутствуют
IDLH: данные отсутствуют
AEGL (рекомендательные уровни острого воздействия)
Информация об AEGL отсутствует.ERPG (Руководство по планированию реагирования на чрезвычайные ситуации)
Информация о ERPG отсутствует.PAC (критерии защитного действия)
| Химические вещества | ПАК-1 | ПАК-2 | ПАК-3 |
|---|---|---|---|
| Цианамид кальция (156-62-7) | 1,5 мг/м3 | 5,6 мг/м3 | 50 мг/м3 |
(DOE, 2018)
Нормативная информация
Что это за информация?
Поля нормативной информации
включить информацию из
Сводный список III Агентства по охране окружающей среды США
списки,
Химический завод Агентства кибербезопасности и безопасности инфраструктуры США
антитеррористические стандарты,
и Управление по охране труда и здоровья США
Перечень стандартов по управлению безопасностью технологического процесса при работе с особо опасными химическими веществами
(подробнее об этих
источники данных).
Сводный перечень списков EPA
| Нормативное наименование | Номер CAS/ 313 Код категории | EPCRA 302 EHS TPQ | EPCRA 304 EHS RQ | CERCLA RQ | ЭПКРА 313 ТРИ | RCRA Код | CAA 112(r) RMP TQ |
|---|---|---|---|---|---|---|---|
| Цианамид кальция | 156-62-7 | 1000 фунтов | 313 |
(Список списков Агентства по охране окружающей среды, 2022 г. )
)
Антитеррористические стандарты химических предприятий CISA (CFATS)
Отсутствует нормативная информация.
Список стандартов OSHA по управлению безопасностью процессов (PSM)
Отсутствует нормативная информация.
Альтернативные химические названия
Что это за информация?
В этом разделе приводится список альтернативных названий этого химического вещества, включая торговые названия и синонимы.
- АЭРОЦИАНАМИД ГРАНУЛЯРНЫЙ
- AERO ЦИАНАМИД СПЕЦИАЛЬНЫЙ МАТЕРИАЛ
- АЭРО-ЦИАНАМИД
- АЛЗОДЕФ
- КАРБИМИД КАЛЬЦИЯ
- КАЛЬЦИЯ ЦИАНАМИД
- КАЛЬЦИЯ ЦИАНАМИД
- КАЛЬЦИЯ ЦИАНАМИД (CACN2)
- КАЛЬЦИЯ ЦИАНАМИД С БОЛЕЕ 0,1 % КАРБИДА КАЛЬЦИЯ
- КАЛЬЦИЯ ЦИАНАМИД [НЕ ГИДРАТИРОВАННЫЙ, С КАРБИДОМ КАЛЬЦИЯ > 0,1%]
- ССС
- CY-L 500
- ЦИАНАМИД
- ЦИАНАМИД
- ЦИАНАМИД ГРАНУЛИРОВАННЫЙ
- ЦИАНАМИД СПЕЦИАЛЬНЫЙ
- ЦИАНАМИД, СОЛЬ КАЛЬЦИЯ (1:1)
- ДОРМЕКС
- ИЗВЕСТЕВОЙ АЗОТ
- ИЗВЕСТЬ-АЗОТ
- ЛИМЕНИТРОГЕН
- НКИ-C02937
- АЗОТНАЯ ИЗВЕСТЬ
- НИТРОЛИМ
- НИТРОИЗВЬ
- ПЕРЛКА
- ВВС США CY-2
Известь — химическое вещество, проверенное временем — Science Learning Hub
Добавить в коллекцию
Чистая или негашеная известь — это оксид кальция. Простота производства и химические свойства делают его важным промышленным химикатом.
Простота производства и химические свойства делают его важным промышленным химикатом.
Лайм имеет долгую историю, восходящую к древнейшим временам. В основном его использовали в качестве ингредиента в растворе и в качестве удобрения для почвы.
Производство извести
С давних времен известь изготавливали путем нагревания известняка до высоких температур. Методы производства эволюционировали от нагревания известняка на открытом огне до использования печей для обжига кирпичной извести в начале 17 века и современных горизонтальных вращающихся печей диаметром несколько метров и длиной до 100 метров. Эти современные печи работают при температуре около 1100-1200°C, что позволяет быстро превращать известняк в известь.
CaCO 3 ( s ) известняк → CaO( s ) известь + CO 2 ( г ) двуокись углерода
Химические свойства извести
Известь (оксид кальция) представляет собой белое твердое вещество с сильными основными свойствами.
Известь легко вступает в реакцию с водой с образованием гашеной извести, которая представляет собой гидроксид кальция. В ходе этой реакции выделяется значительное количество тепловой энергии.
Гидроксид кальция умеренно растворим в воде с образованием щелочного раствора, известного как известковая вода. Когда газообразный диоксид углерода пропускают через известковую воду или над ней, она становится молочной из-за образования карбоната кальция.
CaO( s ) | + | H 2 O( l ) | → | Ca(OH) 2 ( s ) | ||
Ca(OH) 2 ( s ) | + | H 2 O( l ) | → | Ca(OH) 2 ( aq ) | ||
Ca(OH) 2( aq ) | + | CO 2 ( g ) | → | CaCO 3 ( s ) | + | H 2 O( л ) |
Известь реагирует с кислыми газами, как диоксид серы. | ||||||
CaO( s ) | + | SO 2 ( g ) | → | CaSO 3 ( s ) | ||
Электростанции, работающие на угле и газе, производят большие объемы газообразных продуктов, некоторые из которых представляют собой диоксид серы. Известь и гашеная известь используются для сокращения этих выбросов серы.
Гашеная известь вступает в реакцию с газообразным хлором с образованием отбеливающего агента гипохлорита кальция – распространенной формы хлора «для плавательных бассейнов».
2Ca(OH) 2 ( s ) | + | 2Cl 2 ( g ) | → | Ca(ClO) 2 ( с ) | + | CaCl 2 ( s ) | + | 2H 2 O( l ) |
When heated with кокс, форма углерода, оксид кальция объединяется с образованием карбида кальция. При смешивании карбида кальция с водой образуется газ ацетилен. Это топливо кислородно-ацетиленовой газовой горелки, используемой в металлургической промышленности для резки и сварки.
При смешивании карбида кальция с водой образуется газ ацетилен. Это топливо кислородно-ацетиленовой газовой горелки, используемой в металлургической промышленности для резки и сварки.
2CaO( s ) | + | 5C( s ) | → | 2CaC 2 ( s ) | + | CO 2 ( G ) | ||
CAC 2 ( S. | CAC 2 77 ( S | 8 .0003 | + | 2H 2 O( l ) | → | Ca(OH) 2 ( s) | + | C 2 H 2 ( G ) |
LIME MITTAR
MITTA Известковый раствор получают путем смешивания извести, песка и воды. Это один из старейших видов строительного раствора, восходящий к античным временам. В настоящее время раствор производится путем смешивания цементного порошка, песка и воды.
Это один из старейших видов строительного раствора, восходящий к античным временам. В настоящее время раствор производится путем смешивания цементного порошка, песка и воды.
Затвердевание известкового раствора в твердый вяжущий материал включает реакцию с атмосферным углекислым газом с образованием кристаллов карбоната кальция, которые плотно соединяют песчинки.
Ca(OH) 2 ( s ) | + | CO 2 ( g ) | → | CaCO 3 ( s ) |
Фреска – это техника живописи, при которой пигмент наносится на свежую поверхность известкового раствора.
Эта техника широко использовалась художниками эпохи Возрождения в 15-м и 16-м веках – некоторые из созданных работ, такие как роспись потолка Сикстинской капеллы Микеланджело, ежегодно восхищают непрерывный поток посетителей Ватикана.
Известь – интересное физическое свойство
Если кусок извести размером с мрамор нагреть до высокой температуры, он излучает очень яркий белый свет. В 1820-х годах офицер британской армии Томас Драммонд использовал это свойство извести для разработки фонарей, которые можно было использовать на маяках и на поле боя. Названные фонарями Драммонда, они в конечном итоге заменили газовые фонари, используемые в мюзик-холлах и театрах. Исполнители и актеры теперь были «в центре внимания» на сцене.
Оксиды редкоземельных металлов (оксиды церия и тория) также проявляют это свойство.
Опубликовано 9 октября 2012 г. Ссылка на концентраторы
Перейти к полному глоссарию
Добавить 0 предметов в коллекцию
Загрузка 0.
999003
Загрузка 00003
999003
. OEC – Обсерватория экономической сложности
О
#постоянная ссылка на раздел Обзор На этой странице содержатся последние данные о торговле карбидом кальция. В 2020 году Карбид кальция был 3531-м наиболее продаваемым продуктом в мире с общим объемом продаж 208 миллионов долларов. В период с 2019 по 2020 год экспорт карбида кальция сократился на -17,7%, с 253 млн долларов до 208 млн долларов. Торговля Карбидом кальция составляет 0,0012% от общего объема мировой торговли.
В 2020 году Карбид кальция был 3531-м наиболее продаваемым продуктом в мире с общим объемом продаж 208 миллионов долларов. В период с 2019 по 2020 год экспорт карбида кальция сократился на -17,7%, с 253 млн долларов до 208 млн долларов. Торговля Карбидом кальция составляет 0,0012% от общего объема мировой торговли.
Карбид кальция входят в состав Карбидов.
Экспорт В 2020 году крупнейшими экспортерами карбида кальция были Китай (68,8 млн долларов США), Словакия (40,6 млн долларов США), Австрия (18 млн долларов США), Казахстан (16,5 млн долларов США) и Германия (11,4 млн долларов США).
Импорт В 2020 году крупнейшими импортерами карбида кальция были Индия (23,1 млн долларов), Франция (16 млн долларов), Россия (15,7 млн долларов), Германия (10,9 млн долларов) и Канада (9,52 млн долларов). .
.
Рейтинг Карбид кальция занимает 2686-е место в индексе сложности продукта (PCI).
Описание Карбид кальция используется в производстве ацетилена. При взаимодействии ацетилена с водой образуется газообразный водород и гидроксид кальция. Газообразный водород используется в производстве аммиака и метанола.
Последние тенденции
#permalink в разделПоследние данные
#permalink к разделуПросмотр
Поток
Scale
показывает последние тенденции в области карбида кальция. Страны показаны на основе наличия данных.
Для получения полной информации о структуре торговли посетите обозреватель тенденций или продукт в профиле страны.
* С использованием обменных курсов на январь 2020 г., если торговые данные представлены в местной валюте.
Explore Latest Trends
Historical Data
#permalink to sectionExporters and Importers
#permalink to sectionTrade By Country
Yearcaret-down2020201920182017201620152014201320122011201020092008200720062005200420032002200120001999199819971996
Calcium carbide are the world’s 3531st most торгуемый продукт.
В 2020 году крупнейшими экспортерами карбида кальция были Китай (68,8 млн долларов), Словакия (40,6 млн долларов), Австрия (18 млн долларов), Казахстан (16,5 млн долларов) и Германия (11,4 млн долларов).
В 2020 году крупнейшими импортерами карбида кальция были Индия (23,1 млн долларов), Франция (16 млн долларов), Россия (15,7 млн долларов), Германия (10,9 млн долларов) и Канада (9,52 млн долларов).
Исследование визуализаций
Динамика рынка
#постоянная ссылка на разделТорговля по странам
Startingcaret-down20192018201720162015201420132012201120102009200820072006200520042003200220012000199919981997Endingcaret-down202020192018201720162015201420132012201120102009200820072006200520042003200220012000199919981997
Value
Between 2019 and 2020, the exports of Calcium carbide grew the fastest in Kazakhstan ($1.73M), India ($463k), Russia ($164k), Turkey ($88.2 тыс.) и Франции (57 тыс. долларов).
В период с 2019 по 2020 год самые быстрорастущие импортеры Карбид кальция были Малайзией (1,47 миллиона долларов), Россией (1,35 миллиона долларов), США (846 тысяч долларов), Эфиопией (787 тысяч долларов) и Пакистаном (733 тысячи долларов).
Исследовать визуализации
Концентрация рынка
#permalink to sectionСовокупная доля рынка
Стоимость
На этой диаграмме показано изменение концентрации рынка экспорта Карбид кальция.
В 2020 году концентрация рынка, измеренная с помощью энтропии Шеннона, составила 3,18. Это означает, что большая часть экспорта Карбид кальция объясняются 9 странами.
Explore Visualizations
Net Trade
#permalink to sectionYearcaret-down202020192018201720162015201420132012201120102009200820072006200520042003200220012000199919981997
This map shows which countries export or import more of Calcium carbide . Каждая страна окрашена в зависимости от разницы в экспорте и импорте Карбид кальция в течение 2020 года.
В 2020 году странами, у которых была самая большая торговая стоимость в экспорте, чем в импорте Карбид кальция , были Китай (68,7 млн долларов США), Словакия (40,6 млн долларов США), Казахстан (16,5 млн долларов США), Австрия (16,5 млн долларов) и Испании (10,9 млн долларов).
В 2020 году странами с наибольшей стоимостью импорта по сравнению с экспортом Карбид кальция были Индия (22,2 млн долларов), Франция (16 млн долларов), Россия (15,4 млн долларов), Канада (9,25 млн долларов), и Пакистан (8,22 млн долларов).
Сравнение страны
#permalink в разделКонтинентальный Карет-Даунгальтарценарктаааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааааатели Можно выбрать основные страны, которые экспортируют или импортируют Карбид кальция в мире или по континентам, а также выбрать интересующую меру.
Сложность продукта
#постоянная ссылка на разделГраница диверсификации
#постоянная ссылка на разделСпециализация
На диаграмме сложность-связь сравниваются риск и стратегическая ценность потенциальных экспортных возможностей продукта.


 В этаноле не растворяется, с водой образует гидроксид
В этаноле не растворяется, с водой образует гидроксид Образуется оксид алюминия
Образуется оксид алюминия Образуется оксид алюминия
Образуется оксид алюминия