Презентация неорганические полимеры: Презентация по химии на тему: Неорганические полимеры
alexxlab | 07.03.2023 | 0 | Разное
Неорганические и элементоорганические полимеры – презентация, доклад, проект
Вы можете изучить и скачать доклад-презентацию на тему Неорганические и элементоорганические полимеры. Презентация на заданную тему содержит 13 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас – поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!
Презентации» Химия» Неорганические и элементоорганические полимеры
Слайды и текст этой презентации
Слайд 1
Описание слайда:
Неорганические и элементоорганические полимеры
Слайд 2
Описание слайда:
Неорганические полимеры
Слайд 3
Красный фосфор
Слайд 4
Описание слайда:
Производство спичек
Слайд 5
Описание слайда:
Черный фосфор
Слайд 6
Описание слайда:
Карбин
Слайд 7
Описание слайда:
Слайд 8
Описание слайда:
Элементоорганические полимеры
Слайд 9
Описание слайда:
Силиконы
Слайд 10
Описание слайда:
Слайд 11
Описание слайда:
Полифосфазены
Слайд 12
Описание слайда:
Полигерманы и полистаннаны
Слайд 13
Описание слайда:
Спасибо за внимание
Tags Неорганические и элементоорганические полимеры
Похожие презентации
Презентация успешно отправлена!
Ошибка! Введите корректный Email!
Презентация “Полимеры”
Полимеры
Презентация по химии
Студента 1 курса группы МТ-11 РКСИ
Погорелова Сергея,
Преподаватель Троилина В. С.
С.
Июнь 2020
Полимеры – это
высокомолекулярные вещества, молекулы которых состоят из повторяющихся структурных звеньев, связанных с друг другом химической связью.
Слово образовано от греч. πολύ «много» + μέρος «часть»
В полимерах всегда находится большое количество мономерных звеньев, если это количество слишком мало, то это уже не полимер, а олигомер. Количество звеньев считается достаточным, если при добавлении нового мономерного звена свойства не изменяются.
Полипропилен
Характеристика
Во многом обусловлены не только молекулярной массой, но и химическим составом звеньев, пространственной конфигурацией молекул, степенью разветвленности молекул, типом связей между молекулами, способом производства полимера. В зависимости от всех этих параметров свойства полимеров могут различаться очень сильно.
Химический состав
Полимеры в качестве химических веществ могут: — образовывать новые химические связи между молекулами; — образовывать новые связи между отдельными звеньями молекулы; — присоединять боковые звенья к основной цепочке молекул; — распадаться на отдельные мономеры.
Органические
(полиэтилен)
Большая часть всех известных полимеров являются органическими. К ним относятся все синтетические полимеры.
Полиэтилен в гранулах
Химический состав
Основу веществ неорганической природы составляют такие элементы, как S, O, P, H и другие. Такие полимеры не бывают эластичными и не образуют макроцепей. К ним относятся полисиланы, поликремниевые кислоты, полигерманы.
Неорганические
(силикаты)
Химический состав
К полимерам с элемнтоорганической природой относится смесь как органических, так и неорганических полимеров. Главная цепь – всегда неорганическая, боковые – органические. Примерами полимеров могут служить полисилоксаны, поликарбоксилаты, полиорганоциклофосфазены.
Элементоорганические
(фторопласт-4)
Фторопласт листовой
Структура
Молекулярный вес обычных полимеров колеблется от 10000 до 1000000.
ЛИНЕЙНАЯ
(целлюлоза)
Структурные звенья соединены
в длинные цепи, одно за другим
РАЗВЕТВЛЕННАЯ
(амилопектин)
Структурные звенья соединены
беспорядочно
СЕТЧАТАЯ
Линейные молекулы соединены
между собой химическими связями
По происхождению
ПРИРОДНЫЕ
Природные или натуральные полимеры можно встретить в природе в естественных условиях. К этой группе относятся, например, янтарь, шелк, каучук, крахмал.
Янтарь
Каучук
Крахмал
По происхождению
ИСКУССТВЕННЫЕ (МОДИФИЦИРОВАННЫЕ)
Искусственные полимеры отличаются от синтетических тем, что они синтезированы хоть и в лабораторных условиях, но на основе природных полимеров. К искусственным полимерам относится целлулоид, ацетатцеллюлоза, нитроцеллюлоза.
Целлулоид
Нитроцеллюлоза
Ацетатцеллюлоза
По происхождению
СИНТЕТИЧЕСКИЕ
Синтетические полимеры получают в лабораторных условиях, синтезирует их человек.
Полиэтилен
Полипропилен
Полиуретан
ПВХ
По реакции
В зависимости от реакции получения полимеры подразделяются
Реакция полимеризации характерна для многих органических веществ, в которых имеются двойные или тройные связи.
Например: реакция образования полиэтилена:
nCH 2 =CH 2 — [-CH 2 -CH 2 -]n
где n – число молекул мономера, взаимно соединенных в процессе полимеризации, или степень полимеризации.
ПОЛИМЕРИЗАЦИОННЫЕ
По реакции
В зависимости от реакции получения полимеры подразделяются
Поликонденсация—процесс образования высокомолекулярных веществ, при котором соединение молекул исходных мономеров сопровождается выделением других продуктов, например, воды, спирта, соляной кислоты, аммиака и др. , в результате чего молекулярная масса полимера не равна сумме молекулярных масс исходных мономеров.
, в результате чего молекулярная масса полимера не равна сумме молекулярных масс исходных мономеров.
ПОЛИКОНДЕНСАЦИОННЫЕ
По температуре
Важное практическое значение имеет классификация полимеров по отношению к температурному воздействию
ТЕРМОПЛАСТИЧНЫЕ
ТЕРМОРЕАКТИВНЫЕ
Полиэтилен,
поливинилхлорид,
полистирол
Эпоксидные смолы
Температура размягчения полимеров (softering point, Erweichungspunkt, temperature de ramollissement) – это температура, при которой в процессе нагревания резко возрастает деформируемость образца.
Получение
Искусственные полимеры получают в результате трех типов реакций: полимеризации, поликонденсации, химических реакций. Полимеризацией называется процесс присоединения повторяющихся цепочек молекул (звеньев) к активному центру роста макромолекулы. Механизм полимеризации состоит из таких этапов, как: — образование центров полимеризации; — рост молекул путем последовательного присоединения новых звеньев; — перенос центров полимеризации на другие молекулы, которые начинают активно расти; — разветвление молекул; — прекращение процесса роста молекул.
Состояния
Полимеры существуют в различных агрегатных состояниях: в виде тягучей жидкости (смазки, клеи, лаки и краски, герметики), в виде эластичных материалов (резины, силикон, эластомеры, поролон) и в виде твердых пластмасс (полиэтилен, полипропилен, поликарбонат и т.д.).
Практически все полимеры являются хорошими диэлектриками, обладают низкой теплопроводностью, высокой механической прочностью.
Термопласта
Сокращенные обозначения
- ПАС – полиалкилсульфон.
- ПБТ – полибутилентерефталат.
- ПВА – поливинилацетат
- ПВС – поливиниловый спирт.
- ПВФ, фторопласт-1 – поливинилфторид
- ПВХ – поливинилхлорид
- ПВДФ, фторопласт-2 – поливинилиденфторид
- ПВДХ – поливинилиденхлорид
- ПИ – полиимиды.
- ПК – поликарбонаты.
- ПММА – полиметилметакрилат
- ПО – полиолефины.
- ПП – полипропилен.
- ПС – полистирол
- ППС – пенополистирол
- СКС-30, СКМС-30 – бутадиен-стирольный, бутадиен-метилстирольный с 30% стирола в молекуле.

- СКС-30А – бутадиен-стирольный низкотемпературной полимеризации
- СКТВ – метилвинилсилоксановый [до 1% (мол.) винилового мономера]
- СКЭП – сополимер этилена (40-70%) и пропилена.
- СКЭПТ – сополимер этилена, пропилена и 1-2% несопряженного диена.
- СКУ – полиуретановый.
ТЕРМОПЛАСТЫ
- АБС – привитой сополимер акрилонитрила, стирола с бутадиеновым или бутадиен-стирольным каучуком.
- АЦ – ацетат целлюлозы.
- ЛПЭНП – линейный полиэтилен низкой плотности.
- МС – сополимер стирола с метилметакрилатом.
- МСН – сополимер стирола с метилметакрилатом и акрилонитрилом.
- ПАН – полиакрилонитрил.
- ПА – полиамиды.
- ПАК – полиамидокислота.
- ПАР – полиарилаты.
- ПСФ – полисульфон.
- ПТП – пентапласт .
- ПТФЭ, фторопласт-4, фторлон-4, тефлон – политетрафторэтилен
- ПТФХЭ, фторопласт-3. фторлон-3– политрифторхлорэтилен.
- ПУ – полиуретаны.
- ПФ – полиформальдегид.

- ПФО – полифениленоксид.
- ФФС – фенолформальдегидные смолы.
- ЭС – эпоксидные смол ы
- Эластомеры и их сокращенные обозначения
- БК – статический сополимер изобутилена и 0,6 -3,0 % изопрена.
Автомобилестроение
Надежность работы современного автомобиля, долговечность и комфорт его эксплуатации, а также (что важно) безопасность передвижения могут быть обеспечены только при условии применения полимерных материалов — пластмасс, резин, лаков и красок и прочее.
Из пластмасс изготовляют кузова и кабины автомобилей и их отдельные крупногабаритные детали, разнообразные малогабаритные детали конструкционного и декоративного назначения, теплоизоляционные и звукоизоляционные детали
К важнейшим и наиболее материалоемким резиновым изделиям для автомобилестроения относятся шины.
Лакокрасочные материалы применяемые для грунтования и окончательной отделки металлических поверхностей,.
Авиастроение
Целесообразность применения полимеров в летательных аппаратах обусловлена их легкостью, вариабельностью состава и строения и следовательно, широким диапазоном технических свойств.
Основные полимеры и сегменты использования:
Реактопласты;
Термопласты;
Пенопласты и сотопласты;
Резина;
Герметики и клеи;
Лакокрасочные материалы.
Машиностроение
Целесообразность применения полимеров в машиностроении определяется, прежде всего, возможностью удешевления продукции. При этом улучшаются также важнейшие технико-экономические параметры машин: уменьшается масса, повышаются долговечность, надежность и прочие существенные свойства.
: Так например потребление пластических масс в этой отрасли уже становится соизмеримым (в единицах объема) с потреблением стали. Непрерывно, отмечают аналитики, возрастает также применение лакокрасочных материалов, синтетических волокон, клеев, резины и прочих веществ и материалов на полимерной основе.
Медицина
Применение полимерных материалов с целью изготовления изделий и техники медицинского назначения позволяет осуществлять серийный выпуск инструментов, предметов ухода за больными, специальной посуды и различных видов упаковок для лекарств,.
Также отдельно следует остановиться и на вопросе практического использования полимерных материалов в таком медицинском сегменте, как – хирургия. Учитывая свойства получаемых изделий полимерные материалы получили активное применение сразу в нескольких сегментах современной хирургии:
Восстановительная хирургия; сердечно-сосудистая хирургия; хирургия внутренних органов и тканей; травматология и ортопедия; применение полимеров в функциональных узлах хирургических аппаратов.
Пищевая промышленность
К числу наиболее крупных потребителей полимерных материалов в пищевой промышленности выступают “пищевое машиностроение” и производство тары и упаковки для хранения и транспортировки продуктов питания.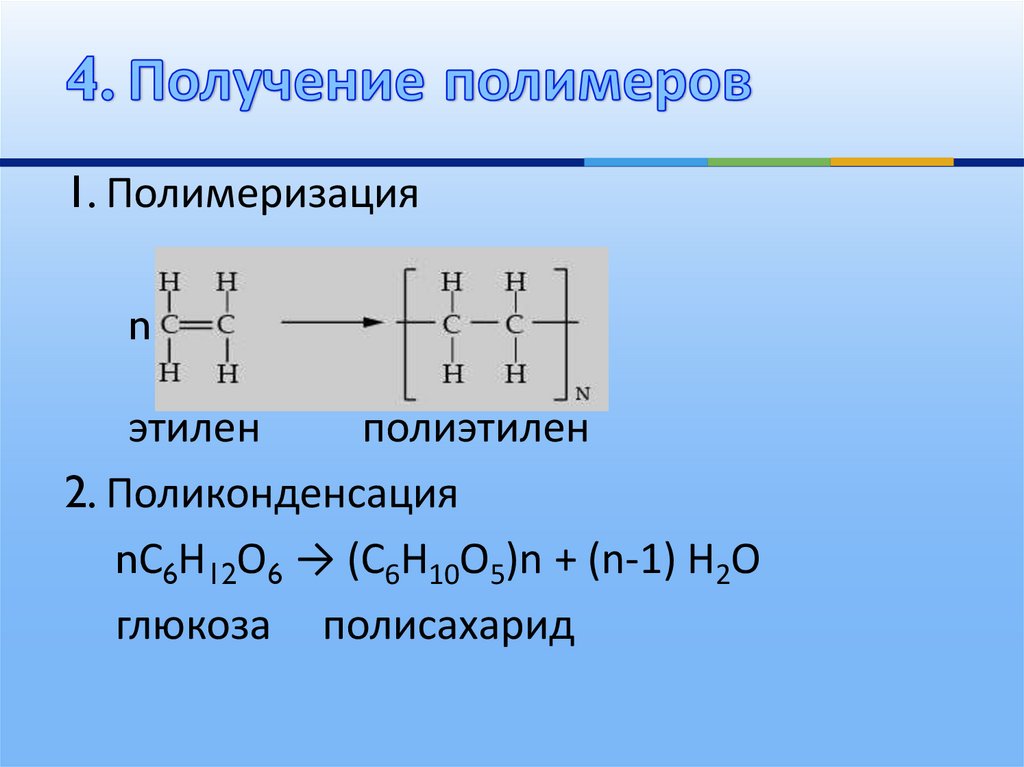 При этом, в последнем случае, полимеры могут выступать и как основной материал (например, пластиковые бутылки), так и в качестве вспомогательных элементов и добавок, призванных (например) уберечь металлический контейнер от коррозии.
При этом, в последнем случае, полимеры могут выступать и как основной материал (например, пластиковые бутылки), так и в качестве вспомогательных элементов и добавок, призванных (например) уберечь металлический контейнер от коррозии.
Источники
https://obrazovaka.ru/himiya/polimer-primery.html
https://ru.wikipedia.org/wiki/Полимеры
Спасибо
за внимание!
PPT – лекция 01: Введение в неорганические полимеры, доктор Сальма Амир Презентация PowerPoint
PPT – лекция 01: Введение в неорганические полимеры, доктор Сальма Амир Презентация PowerPoint – ID: 10514938Создание онлайн-презентаций | Создать опрос | Создать викторину | Создать лид-форму Получите доступ к более чем 1 00 000 шаблонов PowerPoint (для пользователей SlideServe) — Browse Now
Пропустить это видео
Загрузка слайд-шоу за 5 секунд. .
.
лекция 01: Введение в неорганические полимеры доктора Сальмы Амир Презентация PowerPoint
лекция 01: Введение в неорганические полимеры доктора Сальмы Амир
359 просмотров
органические и неорганические полимеры, преимущества неорганических полимеров
Загружено на
- Сальма Амир
– – – – – – – – – – – – – – – – – – – – – – – – – Р Н Д – – – – – – – – – – – – – – – – – – – – – – – – – – –
Стенограмма презентации
Лекция № 01 Название курса: Неорганические полимеры Тема: Введение в неорганические полимеры Преподаватель курса: д-р Салма Амир GFCW Пешавар
Введение • Химия полимеров затрагивает почти все аспекты современной жизни, от электронных технологий до медицины, широкого спектра волокон, пленок, эластомеров и конструкционных материалов, от которых все зависят.
 • Большинство этих полимеров являются органическими материалами. Под этим мы подразумеваем, что их длинные полимерные цепи состоят в основном из атомов углерода, связанных между собой ковалентными связями. • Органические полимеры получают либо из нефти, либо из растений, животных или микроорганизмов. Следовательно, они, как правило, доступны в больших количествах и по номинальной стоимости. Трудно представить жизнь без них. • После стольких дискуссий у всех возникает вопрос: почему при наличии уже сотен органических полимеров ученые должны быть заинтересованы в синтезе еще большего количества макромолекул?
• Большинство этих полимеров являются органическими материалами. Под этим мы подразумеваем, что их длинные полимерные цепи состоят в основном из атомов углерода, связанных между собой ковалентными связями. • Органические полимеры получают либо из нефти, либо из растений, животных или микроорганизмов. Следовательно, они, как правило, доступны в больших количествах и по номинальной стоимости. Трудно представить жизнь без них. • После стольких дискуссий у всех возникает вопрос: почему при наличии уже сотен органических полимеров ученые должны быть заинтересованы в синтезе еще большего количества макромолекул?Введение неорганических полимеров • Неорганические полимеры, глядя на их название, можно сказать, что они являются неорганическими или не содержащими углерода полимерами. Наиболее очевидным определением неорганического полимера является полностью ковалентно связанная макромолекула со скелетной структурой, которая не включает атомы углерода в основной цепи.
 • Полимеры, содержащие неорганические повторяющиеся звенья в основной полимерной цепи, известны как неорганические полимеры. • Это гигантская трехмерная или двумерная сетчатая структура, состоящая из множества ковалентных связей, но с отсутствием или почти полным отсутствием углеводородных звеньев в основной молекулярной цепи. • Ковалентно связанные кристаллы (например, оксиды и галогениды), конденсированные фосфаты и т. д. являются примерами неорганических полимеров. Эти полимеры обладают отличительными физико-химическими характеристиками и уникальными физическими, механическими и электрическими свойствами. Эти полимеры находят широкое применение в быту, особенно в области техники и технологий.
• Полимеры, содержащие неорганические повторяющиеся звенья в основной полимерной цепи, известны как неорганические полимеры. • Это гигантская трехмерная или двумерная сетчатая структура, состоящая из множества ковалентных связей, но с отсутствием или почти полным отсутствием углеводородных звеньев в основной молекулярной цепи. • Ковалентно связанные кристаллы (например, оксиды и галогениды), конденсированные фосфаты и т. д. являются примерами неорганических полимеров. Эти полимеры обладают отличительными физико-химическими характеристиками и уникальными физическими, механическими и электрическими свойствами. Эти полимеры находят широкое применение в быту, особенно в области техники и технологий.Причины интереса к неорганическим полимерам Недостатки, связанные с органическими полимерами • Многие полимеры с органической цепью реагируют с кислородом или озоном в течение длительного периода времени и теряют свои полезные свойства. • Большинство органических полимеров горят, часто с выделением ядовитого дыма.
 • Многие органические полимеры разлагаются под воздействием ультрафиолетового или гамма-излучения. • Органические полимеры иногда размягчаются при недопустимо низких температурах, набухают или растворяются в органических растворителях, маслах или гидравлических жидкостях.
• Многие органические полимеры разлагаются под воздействием ультрафиолетового или гамма-излучения. • Органические полимеры иногда размягчаются при недопустимо низких температурах, набухают или растворяются в органических растворителях, маслах или гидравлических жидкостях.Преимущества неорганических полимеров • Неорганические элементы могут иметь другую валентность, чем углерод, и это означает, что количество боковых групп, присоединенных к основной цепи, может отличаться от ситуации в органическом полимере. Это повлияет на гибкость макромолекулы, ее способность реагировать с химическими реагентами, ее стабильность при высоких температурах и ее взаимодействие с растворителями и другими полимерными молекулами. • Связи, образованные между неорганическими элементами, часто длиннее, прочнее и более устойчивы к реакциям свободнорадикального расщепления, чем связи, образованные углеродом. • Более того, использование неуглеродных элементов в основной цепи дает возможность адаптировать химический состав таким образом, который невозможен для полностью органических макромолекул.

неорганический полимер | Britannica
неорганический полимер , любой из класса больших молекул, не содержащих углерода и являющихся полимерами, т. е. состоящих из множества мелких повторяющихся звеньев, называемых мономерами. Слово полимер происходит от греческого термина поли, означает много, и мерос, что означает часть. Природа изобилует полимерами на основе углерода (то есть органическими), такими как шерсть, шелк, белки, крахмал и целлюлоза. Кроме того, резина и пластик изготавливаются из самых разнообразных искусственных органических полимеров (9).0069 см. эластомер; промышленные полимеры, химия; пластик). Но многие неорганические соединения, такие как оксикислоты и оксианионы, также образуют полимеры. Особенно это касается слабых кислот, таких как борная кислота H 3 BO 3 и кремниевая кислота H 4 SiO 4 . В анионах слабых кислот высокая плотность отрицательного заряда приходится на атомы кислорода.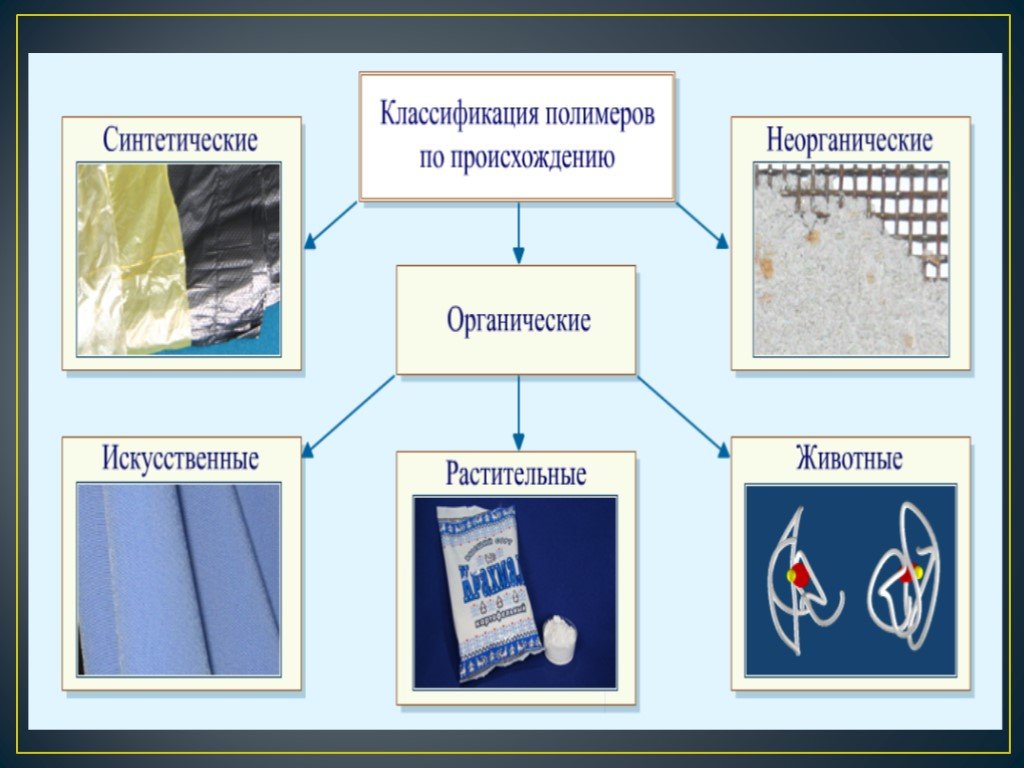 Эта плотность заряда может быть уменьшена в процессе полимеризации.
Эта плотность заряда может быть уменьшена в процессе полимеризации.
В этой статье обсуждаются основные классы неорганических полимеров, включая бораты и три класса силиконовых полимеров — силикаты, силиконы и силаны. Для более подробного обсуждения боратов и силикатов см. см. минерал.
Эти соединения представляют собой соли оксикислот бора (В), такие как борная кислота, H 3 BO 3 , метаборная кислота, HBO 2 , и тетраборная кислота, H 2 B
7 4 O
7 4 7 . Бораты образуются либо в результате реакции основания с оксикислотой бора, либо в результате плавления борной кислоты или оксида бора, B 2 O 3 , с расплавленным оксидом или гидроксидом металла. Структуры боратных анионов варьируются от простых тригональных плоских BO 3 3− до достаточно сложных структур, содержащих цепочки и кольца трех- и четырехкоординированных атомов бора. ( См. химическую связь для описания молекулярных форм. ) Например, метаборат кальция, CaB 2 O 4 , состоит из бесконечных цепей B 2 O 4 2− единиц, тогда как калий борат, K[B 5 O 6 (OH) 4 ] · 2H 2 O (обычно пишется как KB 5 O 8 · 4H 2 O), состоит из двух колец B 3 O 3 , связанных через общий четырехкоординированный атом бора. Тетрабораты B 4 O 5 (OH) 4 2− содержат как трех-, так и четырехкоординированный бор, окруженный соответственно тригонально и тетраэдрически атомами кислорода (O). С коммерческой точки зрения наиболее важным боратом является бура или декагидрат тетрабората натрия, Na 2 B 4 O 7 · 10H 2 O. Бура естественным образом встречается в высохших руслах озер, таких как озеро Сирлс в Калифорнии. Его можно использовать для смягчения воды и приготовления моющих средств.
) Например, метаборат кальция, CaB 2 O 4 , состоит из бесконечных цепей B 2 O 4 2− единиц, тогда как калий борат, K[B 5 O 6 (OH) 4 ] · 2H 2 O (обычно пишется как KB 5 O 8 · 4H 2 O), состоит из двух колец B 3 O 3 , связанных через общий четырехкоординированный атом бора. Тетрабораты B 4 O 5 (OH) 4 2− содержат как трех-, так и четырехкоординированный бор, окруженный соответственно тригонально и тетраэдрически атомами кислорода (O). С коммерческой точки зрения наиболее важным боратом является бура или декагидрат тетрабората натрия, Na 2 B 4 O 7 · 10H 2 O. Бура естественным образом встречается в высохших руслах озер, таких как озеро Сирлс в Калифорнии. Его можно использовать для смягчения воды и приготовления моющих средств. Его полезность возникает из-за нерастворимости боратов кальция и магния и щелочной или щелочной природы водных растворов буры. Бура также используется в производстве боросиликатного стекла и эмалей, а также в качестве антипирена.
Его полезность возникает из-за нерастворимости боратов кальция и магния и щелочной или щелочной природы водных растворов буры. Бура также используется в производстве боросиликатного стекла и эмалей, а также в качестве антипирена.
Силикаты представляют собой соли, содержащие анионы кремния (Si) и кислорода. Существует много типов силикатов, поскольку соотношение кремния и кислорода может сильно различаться. Однако во всех силикатах атомы кремния находятся в центрах тетраэдров с атомами кислорода в углах. Кремний всегда четырехвалентен (т. е. имеет степень окисления +4). Изменение отношения кремния к кислороду происходит из-за того, что кремний-кислородные тетраэдры могут существовать как дискретные, независимые единицы или могут иметь общие атомы кислорода на углах, краях или, в более редких случаях, на гранях несколькими способами. Таким образом, отношение кремния к кислороду варьируется в зависимости от степени, в которой атомы кислорода являются общими для атомов кремния, поскольку тетраэдры связаны друг с другом.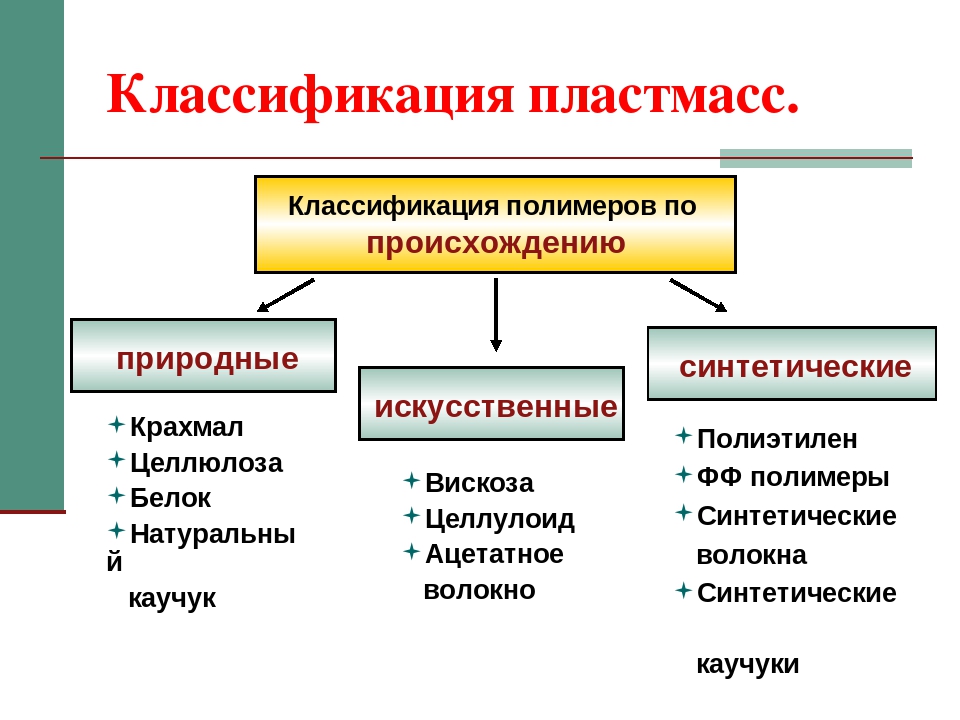 Связь этих тетраэдров обеспечивает довольно удобный способ классификации силикатов. Обычно признаются семь различных классификаций.
Связь этих тетраэдров обеспечивает довольно удобный способ классификации силикатов. Обычно признаются семь различных классификаций.
В некоторых силикатах отдельные тетраэдры SiO 4 4− существуют как самостоятельные единицы. Силикаты магния (Mg 2 SiO 4 ) и циркония (ZrSiO 4 ) являются примерами.
Два тетраэдра SiO 4 имеют общий угловой атом кислорода с образованием дискретных ионов Si 2 O 7 6− . Два соединения с таким типом связи: Ca 2 ZnSi 2 O 7 и Zn 4 (OH) 2 Si 2 O 7 · H 2 O.
SiO 4 9007 могут образовывать замкнутые углы и тетраэдры. В BaTiSi 3 O 9 три тетраэдра SiO 4 имеют общие углы, тогда как в Be 3 Al 2 Si 6 O 18 , который известен как темно-зеленый изумруд, ), шесть тетраэдров имеют общие углы, образуя замкнутое кольцо.

SiO 4 тетраэдры, в которых каждый тетраэдр имеет два общих атома кислорода от двух других тетраэдров, существуют в виде цепочек в некоторых силикатах. Примером этого типа силиката является CaMg(SiO 3 ) 2 . Из формулы видно, что ионы SiO 3 2− существуют, но эти ионы не встречаются как самостоятельные образования. Параллельные цепочки проходят по всей длине кристалла и скрепляются положительно заряженными ионами металлов, лежащими между ними.
Когда тетраэдры SiO 4 в одиночных цепочках имеют общие атомы кислорода, образуются двойные цепи кремний-кислород. Катионы металлов связывают параллельные цепи вместе. Многие из этих силикатов имеют волокнистую природу, потому что ионные связи между катионами металлов и силикатными анионами не так прочны, как кремний-кислородные связи внутри цепей. Класс волокнистых силикатных минералов, принадлежащих к этой группе, в совокупности называется асбестом.
 Наиболее известным и наиболее распространенным видом асбеста является хризотил, имеющий формулу Mg 9.0077 3 (Si 2 O 5 )(OH) 4 . Это соединение существует в виде волокон длиной более 20 мм (0,8 дюйма). В прошлом он использовался во многих огнезащитных и изоляционных целях, но его использование для этих целей было прекращено, поскольку длительное воздействие асбестовых волокон в воздухе может вызвать рак легких.
Наиболее известным и наиболее распространенным видом асбеста является хризотил, имеющий формулу Mg 9.0077 3 (Si 2 O 5 )(OH) 4 . Это соединение существует в виде волокон длиной более 20 мм (0,8 дюйма). В прошлом он использовался во многих огнезащитных и изоляционных целях, но его использование для этих целей было прекращено, поскольку длительное воздействие асбестовых волокон в воздухе может вызвать рак легких.Когда атомы кислорода распределяются между двойными цепочками, образуются слои кремний-кислород. Ионы металлов образуют ионные связи между листами. Эти ионные связи слабее, чем кремний-кислородные связи внутри листов, поэтому силикаты с такой структурой расщепляются на тонкие слои. Пример этого класса силикатов включает тальк, Mg 3 Si 4 O 10 (OH) 2 .
Самый интересный класс силикатов состоит из цеолитов. Эти соединения представляют собой трехмерные кремний-кислородные сети, в которых часть ионов четырехвалентного кремния заменена ионами трехвалентного алюминия (Al 3+ ).
 Возникающий в результате отрицательный заряд, поскольку каждый ион Al 3+ имеет на один положительный заряд меньше, чем заменяемый им ион Si 4+ , нейтрализуется распределением положительных ионов по всей сети. Примером цеолита является Na 9.0077 2 (Al 2 Si 3 O 10 ) · 2H 2 O. Для цеолитов характерно наличие в их структуре тоннелей и систем сообщающихся между собой полостей. Цеолиты используются в качестве молекулярных сит для удаления воды и других малых молекул из смесей, а также их можно использовать для разделения молекул, у которых молекулярные массы одинаковы или близки, но молекулярная структура различна. Кроме того, они используются в качестве твердых носителей для высокодисперсных катализаторов и для ускорения конкретных химических реакций, зависящих от размера.
Возникающий в результате отрицательный заряд, поскольку каждый ион Al 3+ имеет на один положительный заряд меньше, чем заменяемый им ион Si 4+ , нейтрализуется распределением положительных ионов по всей сети. Примером цеолита является Na 9.0077 2 (Al 2 Si 3 O 10 ) · 2H 2 O. Для цеолитов характерно наличие в их структуре тоннелей и систем сообщающихся между собой полостей. Цеолиты используются в качестве молекулярных сит для удаления воды и других малых молекул из смесей, а также их можно использовать для разделения молекул, у которых молекулярные массы одинаковы или близки, но молекулярная структура различна. Кроме того, они используются в качестве твердых носителей для высокодисперсных катализаторов и для ускорения конкретных химических реакций, зависящих от размера.
Силиконы представляют собой полимерные кремнийорганические соединения, содержащие связи Si–O–Si и связи Si–C. Как правило, они очень стабильны из-за наличия прочных связей кремний-кислород и кремний-углерод. Общая формула для силиконов: (R 2 SiO) x , где R может быть любой из множества органических групп. Силиконы могут быть линейными, циклическими или сшитыми полимерами, как показано здесь.
Общая формула для силиконов: (R 2 SiO) x , где R может быть любой из множества органических групп. Силиконы могут быть линейными, циклическими или сшитыми полимерами, как показано здесь.
Линейные и циклические силиконы получают реакцией воды с органохлорсиланами общей формулы R 2 SiCl 2 с последующей реакцией полимеризации, которая происходит путем отщепления молекулы воды от двух гидроксильных групп соседних молекул R 2 Si(OH) 2 .
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчас
Силиконовые полимеры обладают некоторыми свойствами соединений углерод-водород и соединений кремний-кислород. Они устойчивы ко многим химическим реагентам и к нагреванию. В зависимости от степени полимеризации и сложности присоединенных органических групп силиконы могут встречаться в виде масел, смазок, резиноподобных веществ или смол. Они используются в качестве смазочных материалов, гидравлических жидкостей и электрических изоляторов. Они особенно полезны в качестве смазочных материалов в условиях резких перепадов температуры, поскольку их вязкость очень мало меняется при изменении температуры. Силиконы также обладают водоотталкивающими свойствами. Бумагу, шерсть, шелк и другие ткани можно покрыть водоотталкивающей пленкой, подвергнув их кратковременному (одну-две секунды) воздействию паров триметилхлорсилана (СН 3 ) 3 SiCl. Группы ОН на поверхности материалов вступают в реакцию с силаном, и поверхность покрывается тонкой водоотталкивающей пленкой групп (СН 3 )Si―O―. поверхность―OH + Cl―Si(CH 3 ) 3 → (поверхность―O―Si(CH 3 ) 3 + HCl
Они особенно полезны в качестве смазочных материалов в условиях резких перепадов температуры, поскольку их вязкость очень мало меняется при изменении температуры. Силиконы также обладают водоотталкивающими свойствами. Бумагу, шерсть, шелк и другие ткани можно покрыть водоотталкивающей пленкой, подвергнув их кратковременному (одну-две секунды) воздействию паров триметилхлорсилана (СН 3 ) 3 SiCl. Группы ОН на поверхности материалов вступают в реакцию с силаном, и поверхность покрывается тонкой водоотталкивающей пленкой групп (СН 3 )Si―O―. поверхность―OH + Cl―Si(CH 3 ) 3 → (поверхность―O―Si(CH 3 ) 3 + HCl
Силаны представляют собой соединения кремния и водорода. Кремний образует ряд гидридов которые имеют общую формулу Si n H 2 n + 2 , включая SiH 4 , Si 2 H 6 , Si 3 H 8 и Si 4 H 10 . Эти соединения содержат одинарные связи Si—H и Si—Si. Кремний имеет пустую валентную оболочку d орбиталей ( см. химическая связь), из-за чего химия силанов сильно отличается от химии соответствующих углерод-водородных соединений (углеводородов). Например, силаны самопроизвольно воспламеняются на воздухе, тогда как соответствующие углеводороды этого не делают.
Эти соединения содержат одинарные связи Si—H и Si—Si. Кремний имеет пустую валентную оболочку d орбиталей ( см. химическая связь), из-за чего химия силанов сильно отличается от химии соответствующих углерод-водородных соединений (углеводородов). Например, силаны самопроизвольно воспламеняются на воздухе, тогда как соответствующие углеводороды этого не делают.
Самый простой силан, SiH 4 , называется силаном. Он имеет формулу и тетраэдрическую структуру, аналогичную углеводородному метану CH 4 . Его можно приготовить в лаборатории добавлением водной кислоты к ионному силициду, такому как силицид магния, Mg 2 Si. Mg 2 Si + 4H 3 O + (водный) → 2Mg 2+ + SiH 4 + 4H 2 O Силан представляет собой бесцветный газ, бурно реагирующий при нормальной температуре, но бурно реагирующий с температурой. воздуха для получения диоксида кремния и воды. SiH 4 + 2O 2 → SiO 2 + 2H 2 O
Силаны легко реагируют с галогеноводородами с образованием галогенированных силанов.

