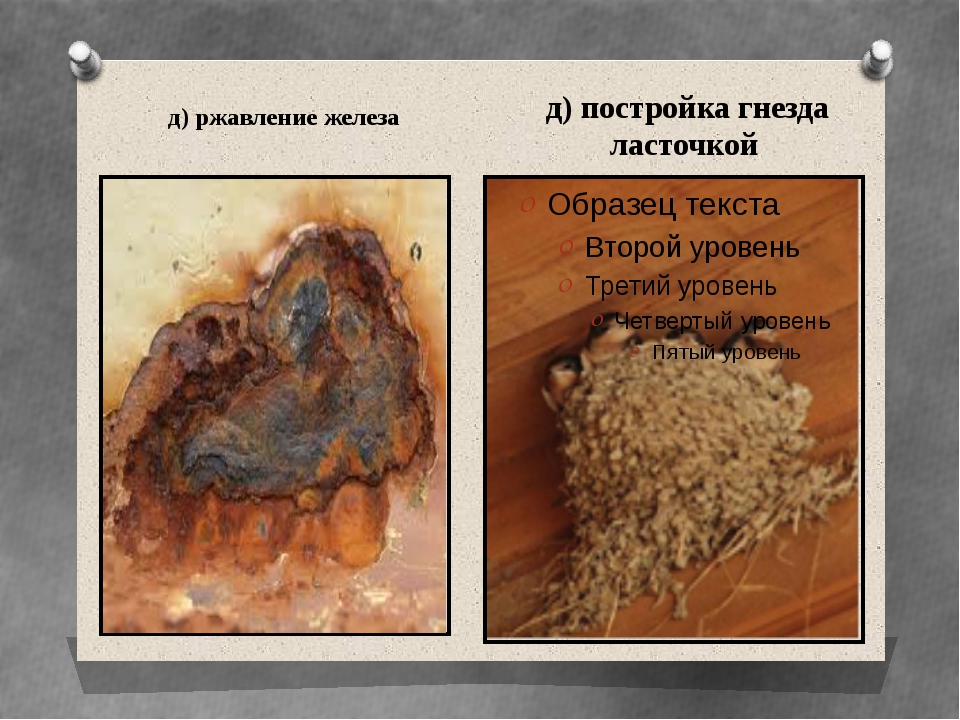
Признаки ржавления железа: Процесс коррозии железа. Химическая коррозия, электрохимическая коррозия, элетрокоррозия
alexxlab | 27.05.2018 | 0 | Разное
Процесс коррозии железа чаще всего сводится к его окислению кислородом воздуха или кислотами, содержащимися в растворах, и превращению его в оксиды. Коррозия металлов (ржавление) вызывается окислительно-восстановительными реакциями, протекающими на границе металла и окружающей среды. В зависимости от механизма возникновения, различают такие виды коррозии железа, как: химическая, электрохимическая и электрическая.
Процесс химической коррозии железа
Окислительно-восстановительные реакции в данном случае проходят через переход электронов на окислитель. В процессе коррозии такого типа кислород воздуха взаимодействует с поверхностью железа. При этом образуется оксидная пленка, которая называется ржавчиной:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
В отличие от плотно прилегающих оксидных пленок, которые образуются в процессе коррозии на щелочных металлах, алюминии, цинке, рыхлая оксидная пленка на железе свободно пропускает к поверхности металла кислород воздуха, а также другие газы и пары воды. Это способствует дальнейшей коррозии железа.
Процесс электрохимической коррозии
Этот вид коррозии проходит в среде, которая проводит электрический ток. Металл в грунте подвергается, преимущественно, электрохимической коррозии. Процесс коррозии такого типа – это результат химических реакций с участием компонентов окружающей среды. Также электрохимическая коррозия возникает в случае контакта металлов, находящихся в ряду напряжений на некотором расстоянии друг от друга, в результате чего возникает гальваническая пара катод-анод.
Атмосферный и грунтовый процесс коррозии выражается схемой:
Fe + O2 + H2O → Fe2O3 · xH2O
В результате образуется ржавчина различной расцветки, что обусловлено тем, что образуются различные окислы железа. Какое именно вещество образуется в процессе коррозии железа, зависит от давления кислорода, влажности воздуха, температуры, длительности процесса, состава железного сплава, состояния поверхности изделия и т. д. Скорость разрушения разных металлов различна.
Процесс коррозии металла в растворах электролитов – это результат работы большого количества микроскопических гальванических элементов, у которых в качестве катода выступают примеси в металле, а в качестве анода – сам металл. В результате чего возникают микроскопические гальванические элементы.
Также атомы железа на разных участках имеют различную способность отдавать электроны (окисляться). Участки металла, на котором протекает этот процесс, выступают в роли анода. Остальные участки – катодные, на которых происходят процессы восстановления воды и кислорода:
H2O + 2e– = 2OH– + H2↑
O2 + 2H2O + 4e– = 4OH–
Результат – из ионов железа (II) и гидроксид-ионов образуется гидроксид железа (II). Далее идет его окисление до гидроксида железа (III) – основного компонента ржавчины:
Fe2+ + 2OH– = Fe(OH)2
Fe(OH)2 + O2 + H2O → Fe2O3 · xH2O
Для того чтобы гальванический элемент работал, необходимо наличие двух металлов различной химической активности и среды, которая проводит электрический ток, – электролита. При контакте железа и другого металла (например, цинка) коррозия железа замедляется, а более активного металла (цинка) – ускоряется. Это обусловлено тем, что поток электронов идет от более активного металла (анода) к менее активному металлу (катоду). Так, при контакте железа с менее активным металлом, коррозия железа ускоряется.
Процесс электрической коррозии
Такой вид разрушения металлических подземных конструкций, кабелей и сооружений могут вызывать блуждающие токи, исходящие от трамваев, метро, электрических железных дорог и различных электроустановок с постоянным током.
Ток с металлических конструкций выходит в грунт в виде положительных ионов металла – происходит электролиз металла. Участок выхода токов – это анодные зоны. Именно в них и протекают активные процессы электрической коррозии железа. Блуждающие токи могут достигать 300 А и действовать в радиусе нескольких десятков километров.
Блуждающими токами, исходящими от источников переменного тока, вызывается слабая коррозия подземных стальных конструкций, и сильная – конструкций из цветных металлов. Защита металлических конструкций от коррозии является очень важной задачей, так как она причиняет огромные убытки.
Ржавчина — Википедия
 Цвета ржавчины
Цвета ржавчиныРжа́вчина является общим термином для определения окислов железа. В разговорной речи это слово применяется к красным окислам, образующимся в ходе реакции железа с кислородом в присутствии воды или влажного воздуха. Есть и другие формы ржавчины, например, продукт, образующийся в ходе реакции железа с хлором при отсутствии кислорода. Такое вещество образуется, в частности, в арматуре, используемой в подводных бетонных столбах, и называют его
Ржавчиной, как правило, называют продукт коррозии только железа и его сплавов, таких как сталь. Многие другие металлы тоже подвергаются коррозии, но именно окислы железа обычно называют ржавчиной.
Химические реакции
 Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.
Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.Причины ржавления
Если железо, содержащее какие-либо добавки и примеси (например, углерод), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций. Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе (слой пассивации) защищает основную массу железа от дальнейшего окисления. Превращение же пассивирующего слоя оксида железа в ржавчину является результатом комбинированного действия двух реагентов, как правило, кислорода и воды. Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы.
Происходящие реакции
 Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформация поверхности, вызванная сильным окислением.
Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформация поверхности, вызванная сильным окислением.Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду.[3] Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановление кислорода:
- O2 + 4 e− + 2 H2O → 4 OH−
Поскольку при этом образуются гидроксид-анионы, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
- Fe → Fe2+ + 2 e−
Следующая окислительно-восстановительная реакция происходит в присутствии воды и имеет решающее значение для формирования ржавчины:
- 4 Fe2+ + O2 → 4 Fe3+ + 2 O2−
Кроме того, следующие многоступенчатые кислотно-щелочные реакции влияют на ход формирования ржавчины:
- Fe2+ + 2 H2O ⇌ Fe(OH)
- Fe3+ + 3 H2O ⇌ Fe(OH)3 + 3 H+
что приводит к следующим реакциям поддержания баланса дегидратации:
- Fe(OH)2 ⇌ FeO + H2O
- Fe(OH)3 ⇌ FeO(OH) + H2O
- 2 FeO(OH) ⇌ Fe2O3 + H2O
Из приведённых выше уравнений видно, что формирование продуктов коррозии обусловлено наличием воды и кислорода. С ограничением растворённого кислорода на передний план выдвигаются железо(II)-содержащие материалы, в том числе FeO и чёрный магнит (Fe3O4). Высокая концентрация кислорода благоприятна для материалов с трёхвалентным железом, с номинальной формулой Fe(OH)3-xOx/2. Характер коррозии меняется со временем, отражая медленные скорости реакций твёрдых тел.
Кроме того, эти сложные процессы зависят от присутствия других ионов, таких как Ca2+, которые служат в качестве электролита, и таким образом, ускоряют образование ржавчины, или в сочетании с гидроксидами и оксидами железа образуют различные осадки вида Ca-Fe-O-OH.
Более того, цвет ржавчины можно использовать для проверки наличия ионов Fe2+, которые меняют цвет ржавчины с жёлтого на синий.
Предотвращение ржавления
 Отслаивающаяся краска обнажает участки ржавой поверхности листового металла.
Отслаивающаяся краска обнажает участки ржавой поверхности листового металла.Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали образуется пассивирующий слой оксида хрома(III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Гальванизация
Катодная защита
Катодная защита является методом, используемым для предотвращения коррозии в скрытых под землёй или под водой структурах путём подачи электрического заряда, который подавляет электрохимические реакции. Если её правильно применять, коррозия может быть остановлена полностью. В своей простейшей форме это достигается путём соединения защищаемого объекта с протекторным анодом, в результате чего на поверхности железа или стали происходит только катодный процесс. Протекторный анод должен быть сделан из металла с более отрицательным электродным потенциалом, чем железо или сталь, обычно это цинк, алюминий или магний.
Лакокрасочные и другие защитные покрытия
От ржавчины можно предохранять с помощью лакокрасочных и других защитных покрытий, которые изолируют железо из окружающей среды. Большие поверхности, поделённые на секции, как например, корпуса судов и современных автомобилей, часто покрывают продуктами на основе воска. Такие средства обработки содержат также ингибиторы от коррозии. Покрытие стальной арматуры бетоном (железобетон) обеспечивает некоторую защиту стали в среде с высоким рН. Однако коррозия стали в бетоне всё ещё является проблемой.
Покрытие слоем металла
Ржавчина может полностью разрушить железо. Обратите внимание на гальванизацию незаржавевших участков.- Оцинковка (оцинкованное железо/сталь): железо или сталь покрываются слоем цинка. Может использоваться метод горячего цинкования или метод цинкового дутья.
- Лужение: мягкая листовая сталь покрывается слоем олова. В настоящее время практически не используется из-за высокой стоимости олова.
- Хромирование: тонкий слой хрома наносится электролитическим способом на сталь, обеспечивая как защиту от коррозии, так и яркий, полированный внешний вид. Часто используется в блестящих компонентах велосипедов, мотоциклов и автомобилей.
Воронение
Воронение — это способ, который может обеспечить ограниченную устойчивость к коррозии для мелких предметов из стали, таких как огнестрельное оружие и др. Способ состоит в получении на поверхности углеродистой или низколегированной стали или чугуна слоя окислов железа толщиной 1-10 мкм. Для придания блеска, а также для улучшения защитных свойств окисной плёнки, её пропитывают минеральным или растительным маслом.
Снижение влажности
Ржавчины можно избежать, снижая влажность окружающего железо воздуха. Этого можно добиться, например, с помощью силикагеля.
Ингибиторы
Ингибиторы коррозии, как, например, газообразные или летучие ингибиторы, можно использовать для предотвращения коррозии в закрытых системах. Некоторые ингибиторы коррозии чрезвычайно ядовиты. Одним из лучших ингибиторов выступают соли технециевой кислоты.
Экономический эффект
Ржавчина вызывает деградацию изделий и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстрому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое поеданием ржавчиной. Это явление стало причиной разрушения моста через реку Мианус (штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главной причиной разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту. Погибли 46 водителей и пассажиров, находившихся в то время на мосту.
 Мост Кинзу после разрушения.
Мост Кинзу после разрушения.Мост Кинзу в штате Пенсильвания был снесён смерчем в 2003 году в значительной степени потому, что центральные опорные болты, соединяющие сооружение с землёй, проржавели, из-за чего мост держался лишь под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские трудности. Это один из наиболее распространённых отказов железобетонных мостов.
См. также
Примечания
Ссылки
Ржавчина на металле: вред, виды коррозии
Мы – продавцы металлопроката – как никто сталкивается с этим наваждением – ржавиной. И мы точно знаем вред от коррозии. В этой статье мы скажем несколько слов об этой проблеме, ее проявлениях, ее масштабах.

Ущерб, ущерб…
Все видели эти оранжево-бурые или желтоватые пятна ржавчины на металлических деталях. Экономический ущерб от коррозии металлов огромен. В США и Германии подсчитанный ущерб от коррозии и затраты на борьбу с ней составляют примерно 3 % ВВП. При этом потери металла, в том числе из-за выхода из строя конструкций, изделий, оборудования, составляют до 20 % от общего объема производства стали в год. По России точные данные о потерях от коррозии не подсчитаны.
Доподлинно известно, что именно проржавевшие металлоконструкции стали причиной обрушения нескольких мостов в Соединенных Штатах, в том числе с многочисленными человеческими жертвами. Крайне неприятен и экологический вред: утечка газа, нефти при разрушении трубопроводов приводит к загрязнению окружающей среды.
Виды коррозии и ее причины
Перед тем как говорить о ржавчине на железе, кратко рассмотрим другие ее типы.
Коррозии подвержены не только металлы, но и неметаллические изделия. В этом случае коррозию еще называют «старением». Старению подвержены пластмассы, резины и другие вещества. Для бетона и железобетона существует термин “усталость”. Происходит их разрушение или ухудшение эксплуатационных характеристик из-за химического и физического воздействия окружающей среды. Корродируют и металлические сплавы – медь, алюминий, цинк: в процессе их коррозии на поверхности изделий образуется оксидная пленка, плотно прилегающая к поверхности, что значительно замедляет дальнейшее разрушение металла (а патина на меди еще и придает ей особый шарм). Драгоценные металлы являются таковыми не только из-за своей красоты, ценимой ювелирами, но и за счет стойкости к коррозии. Золото и серебро до сих пор используется для покрытия особо чувствительных электронных контактов а платина применяется в космической отрасли.
Корродировать металл может в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия). Коррозия заметно ускоряется с повышением температуры.

Типы ржавчины
В большей степени коррозии подвержено железо. С точки зрения химии ржавчина – это окислительный процесс (как и горение). Элементы возникающие при окислении в кислородной среде называются Оксиды. Можно выделить 4 основных типа.
1. Желтая ржавчина – химическая формула FeO(OH)h3O (оксид железа двухвалетный). Возникает во влажной, недонасыщенной кислородом среде. Часто встречается под водой. В природе существует в виде минерала вюстита, при этом являясь монооксидом (те содержит 1 атом кислорода).
2. Коричневая ржавчина – Fe2O3 (двойной оксид железа): растет без воды и встречается редко.
3. Черная ржавчина – Fe3O4 (оксид железа четырех валентый). Образуется при малом содержании кислорода и без воды поэтому стабильна и распространяется очень медленно. Этот оксид является ферромагнетиком (при определенных условиях обладает намагниченностью в отсутствие внешнего магнитного поля), поэтому потенциально применим для создания сверх-проводников.
4. Красная ржавчина – химическая формула Fe2O3•h3O (оксид железа трехвалентный). Возникает под воздействием кислорода и воды, самый частый тип, процесс протекает равномерно и затрагивает всю поверхность. В отличии от всех вышеперечисленных не столь опасных для железа видов окисления этот в своей толще образует гидроксид железа, который, начиная отслаиваться, открывает для разрушения все новые слои металла. Реакция может продолжатся до полного разрушения конструкции. Применяется при выплавке чугуна и как краситель в пищевой промышленности. Встречается в природе в естественном виде под названием гематид.
Несколько видов ржавления могут протекать одновременно, не особо мешая друг другу.
Химическая и электрохимическая коррозия
Железо ржавеет, если в нем есть добавки и примеси (например, углерод) и при этом контактирует с водой и кислородом. Если же в воде растворена соль (хлорида натрия и калия), реакция становится электрохимической и процесс ржавления ускоряется. Массовое применение этих солей как в бытовой химии так и для борьбы с льдом и снегом делают электрохимическую коррозию очень распространенным и опасным явлением: потери в США от использования солей в зимний период составляют 2,5 млрд. долларов. При одновременном воздействии воды и кислорода образуется гидроксид железа, который, в отличие от оксида, отслаивается от металла и никак его не защищает. Реакция продолжается либо до полного разрушения железа, либо пока в системе не закончится вода или кислород.

Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла. В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге). Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Во второй части статьи мы расскажем, как вы можете защитить свои металлоконструкции от этой напасти или победить ее, если она уже атакует.
Ржавчина
Ржавчина – продукт взаимодействия внешней окислительной атмосферы с железом. Процесс ее образования называется ржавлением ( коррозия ). Термин «ржавчина» присущ только продуктам коррозии железа и его сплавов. Любые другие металлы могут корродировать, но не ржаветь!
Ржавчина – это гидратированная окись железа (гидроксид железа). Химическая формула ржавчины – Fe2O3•H2О (иногда пишут просто Fe2O3). На поверхности образуется в виде шероховатого налета, который имеет рыхлую структуру. Цвет ржавчины – от оранжевого до красно-коричневого.

Железо при рН среды > 5,5 образует труднорастворимый гидрат закиси железа, имеющий белый цвет:
Fe2+mH2O + 2OH– = mH2O + Fe(OH)2↓
При взаимодействии гидрата закиси железа с растворенным кислородом в воде, образуются еще более труднорастворимое соединение – гидрат окиси железа (бурый цвет):
2Fe(OH)2 + 1/2 O2 + H2О = 2Fe(OH)3↓
Вторичные продукты коррозии (Fe(OH)2 и Fe(OH)3) могут и дальше превращаться, с образованием гидратированных окислов FeO•Fe2O3•nH2О – ржавчины. FeO – нестабильное соединение, поэтому в формуле ржавчины его часто просто не записывают.
Реакции образования ржавчины:
2e + 2H+ – H2;
4e +O2 + 4H+ – 2H2O;
2e + Fe(OH)2 + 2H+ – Fe + 2H2O;
2e + Fe2+ – Fe;
2e + Fe(OH)3– + 3H+ – Fe + 3H2O;
e + Fe(OH)3 + H+ – Fe(OH)2 + h3O;
e + Fe(OH)3 + 3H+ – Fe2+ + 3H2O;
Fe(OH)3- + H+ – Fe(OH)2 + H2O;
e + Fe(OH)3 – Fe(OH)3-;
Fe3+ + 3H2O – Fe(OH)3 + 3H+;
Fe2+ + 2H2O – Fe(OH)2 + 2H+;
e + Fe3+ – Fe2+;
Fe2+ + H2O – FeOH + H+;
FeOH+ + H2O > Fe(OH)2 + H+;
Fe(OH)2 + H2O – Fe(OH)3- + H+;
Fe3+ + H2O – FeOH2+ + H+;
FeOH2+ + H2O – Fe(OH)3 + H+;
FeOH2+ + H+ – Fe2+ + H2O;
e + FeOH2+ + 2H+ – Fe2+ +2H2O;
e + Fe(OH)3 + H+ – Fe(OH)2 + H2O;
e + Fe(OH)3 + 2H+ – FeOH+ + 2H2O;
e + Fe(OH)3 + 3H+ – Fe2+ + 3H2O.
Ржавчина может существовать в двух формах: магнитной (γ- Fe2O3) и немагнитной (α-Fe2O3). Гидратированная окись железа в α форме (гематит) -более стабильное соединение. Раствор, насыщенный ржавчиной, почти нейтральный. γ- Fe2O3 обычно между гидратированными оксидами Fe2O3 и FeO образует черный промежуточный слой. Поэтому можно сказать, что ржавчина состоит из трех слоев оксидов железа разной степени окисления.
Процесс ржавления металла начинается только при наличии в воздухе влаги. При попадании на поверхность изделия из железа капли воды, спустя некоторое время, можно заметить изменение ее цвета. Капля становится мутной и постепенно окрашивается в бурый цвет. Это свидетельствует о появлении, в месте контакта воды с поверхностью, продуктов коррозии железа.
Если ржавчина уже образовалась – остановить процесс коррозии крайне трудно и не всегда удается. Лучше его предупреждать и заранее защищать металл!
Именно по этой причине следует знать о том, как убрать ржавчину, и как противостоять ее появлению.
Сформировать представления о коррозии с точки зрения окислительно-восстановительных процессов; показать значение коррозии для народного хозяйства; продолжить формирование у учащихся умений устанавливать причинно-следственные связи между строением и свойствами металлов. Эксперимент мог быть домашним заданием. Коррозия вызывается окислительно-восстановительными реакциями, в которых металл в результате взаимодействия с каким-либо веществом из своего окружения превращается в нежелательное соединение. Одним из наиболее известных коррозионных процессов является ржавление железа.
Для того чтобы ржавчина не нанесла вред изделиям необходимо использовать специальные средства для того, чтобы на поверхности объектов из железа образовалась пленка, защищающая от проникновения в структуру металла воздуха и воды. Важно: Для того чтобы на окрашенном изделии не образовалось ржавчины необходимо следить, чтобы краска лежала ровным слоем и не имела никаких сколов. Иначе на поверхность металла будет влиять влажность и воздух.
В настоящее время имеются средства для удаления ржавчины. Их можно использовать, когда налет уже образовался. Они направлены на то, чтобы сделать структуру налета более хрупкой для получения возможности снятия его с поверхности металла.
Самым популярным средством устранения ржавого налета является преобразователь ржавчины. Он представляет собой раствор, который превращает налет в вещество, которое легко поддается устранению. Многие такие средства делают структуру ржавчины более однородной, что позволяет оставлять ее на поверхности металла для проведения лакокрасочных работ, если она не нарушает ее ровность.

Сегодня не редко встречается специальная краска по ржавчине. Она представлена на отечественном рынке большим количеством марок. Ее достоинством является то, что, она дает достаточно плотное покрытие.
В связи с тем, что окружающая среда становится все более агрессивной, в том числе из-за ее загрязнения, металлы эксплуатируются все в более сложных условиях. Оксиды серы или азота, выделяемые из атмосферы, образуют микрокапли азотной или серной кислоты, что приводит к существенному возрастанию скорости появления ржавчины. Железо является химически активным металлом.
Она обладает тройным действием. Она не только устраняет следы ржавчины, но и делает покрытие более ровным и привлекательным.
Содержание
Краски для работы с ржавыми предметами обладают высоким уровнем насыщенности цвета, чтобы даже в один слой скрывались все следы наличия ржавого налета. При этом на металле образуется небольшой слой пленки, который не дает ржавчине и дальне распространяться и развиваться новой. Чистый вкус здоровья.
Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций.
Абсолютная защита от любых вредных примесей.
Способы удаления ржавчины
Аналог бутилированной воды. Безопасная вода для беременных, аллергиков и маленьких детей. Выход очевиден: механически избавляться от выпадающего в осадок окисленного железа.
До недавнего времени этим способом пользовались не только в домашних условиях, но и в промышленных масштабах — воду просто отстаивали что,
Ржавчина – это… Что такое Ржавчина?
 Цвета ржавчины
Цвета ржавчиныРжа́вчина является общим термином для определения оксидов железа. В разговорной речи этот термин применяется к красным окислам, образующимся в результате реакции железа с кислородом в присутствии воды или влажного воздуха. Есть и другие формы ржавчины, например, продукт, образующийся в результате реакции железа с хлором при отсутствии кислорода. Такое вещество образуется, в частности, в арматуре, используемой в подводных бетонных столбах, и называют его зелёной ржавчиной. Несколько видов коррозии различимы визуально или с помощью спектроскопии, они формируются при разных внешних условиях.[1] Ржавчина состоит из гидратированного оксида железа(III) Fe2O3·nH2O и метагидроксида железа (FeO(OH), Fe(OH)3). При наличии кислорода и воды и достаточном времени любая масса железа в конечном итоге преобразуется полностью в ржавчину и разрушается. Поверхность ржавчины не создаёт защиту для нижележащего железа, в отличие от образования патины на медной поверхности.
Ржавчиной как правило называют продукт коррозии только железа и его сплавов, таких как сталь. Многие другие металлы тоже подвергаются коррозии, но именно оксиды обычно не называют ржавчиной.
Химические реакции
 Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.
Толстый слой ржавчины на звеньях цепи возле моста Золотые Ворота в Сан-Франциско. Цепь постоянно подвергается воздействию сырости и солёных брызг, вызывающих разрушение поверхности, растрескивание и шелушение металла.Причины ржавления
Если железо, содержащее какие-либо добавки и примеси (например, чугун), находится в контакте с водой, кислородом или другим сильным окислителем и/или кислотой, то оно начинает ржаветь. Если при этом присутствует соль, например, имеется контакт с солёной водой, коррозия происходит быстрее в результате электрохимических реакций. Чистое железо относительно устойчиво к воздействию чистой воды и сухого кислорода. Как и у других металлов, например, у алюминия, плотно приставшее оксидное покрытие на железе (слой пассивации) защищает основную массу железа от дальнейшего окисления. Превращение же пассивирующего слоя оксида железа в ржавчину является результатом комбинированного действия двух агентов, как правило, кислорода и воды. Другими разрушающими факторами являются диоксид серы и углекислый газ в воде. В этих агрессивных условиях образуются различные виды гидроксида железа. В отличие от оксидов железа, гидроксиды не защищают основную массу металла. Поскольку гидроксид формируется и отслаивается от поверхности, воздействию подвергается следующий слой железа, и процесс коррозии продолжается до тех пор, пока всё железо не будет уничтожено, или в системе закончится весь кислород, вода, диоксид углерода или диоксид серы.[2]
Происходящие реакции
 Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформации поверхности, вызванная сильным окислением.
Покрытый ржавчиной и грязью болт. Заметна точечная коррозия и постепенная деформации поверхности, вызванная сильным окислением.Ржавление железа — это электрохимический процесс, который начинается с переноса электронов от железа к кислороду.[3] Скорость коррозии зависит от количества имеющейся воды, и ускоряется электролитами, о чём свидетельствуют последствия применения дорожной соли на коррозию автомобилей. Ключевой реакцией является восстановления кислорода:
- O2 + 4 e– + 2 H2O → 4 OH–
Поскольку при этом образуются ионы гидроксидов, этот процесс сильно зависит от присутствия кислоты. Действительно, коррозия большинства металлов кислородом ускоряется при понижении pH. Обеспечение электронов для вышеприведённой реакции происходит при окисления железа, которое может быть описано следующим образом:
- Fe → Fe2+ + 2 e−
Следующая окислительно-восстановительная реакция происходит в присутствии воды и имеет решающее значение для формирования ржавчины:
- 4 Fe2+ + O2 → 4 Fe3+ + 2 O2−
Кроме того, следующие многоступенчатые кислотно-щелочные реакции влияют на ход формирования ржавчины:
- Fe2+ + 2 H2O ⇌ Fe(OH)2 + 2 H+
- Fe3+ + 3 H2O ⇌ Fe(OH)3 + 3 H+
что приводит к следующим реакциям поддержания баланса дегидратации:
- Fe(OH)2 ⇌ FeO + H2O
- Fe(OH)3 ⇌ FeO(OH) + H2O
- 2 FeO(OH) ⇌ Fe2O3 + H2O
Из приведённых выше уравнений видно, что формирование продуктов коррозии обусловлено наличием воды и кислорода. С ограничением растворённого кислорода на передний план выдвигаются железо(II)-содержащие материалы, в том числе FeO и чёрный магнит (Fe3O4). Высокая концентрация кислорода благоприятна для материалов с трёхвалентным железом, с номинальной формулой Fe(OH)3-xOx/2. Характер коррозии меняется со временем, отражая медленные скорости реакций твёрдых тел.
Кроме того, эти сложные процессы зависят от присутствия других ионов, таких как Ca2+, которые служат в качестве электролита, и таким образом, ускоряют образование ржавчины, или в сочетании с гидроксидами и оксидами железа образуют различные осадки вида Ca-Fe-O-OH.
Более того, цвет ржавчины можно использовать для проверки наличия ионов Fe2+, которые меняет цвет ржавчины с жёлтого на синий.
Предотвращение ржавления
 Отслаивающаяся краска обнажает участки ржавой поверхности листового металла.
Отслаивающаяся краска обнажает участки ржавой поверхности листового металла.Ржавчина является проницаемой для воздуха и воды, поэтому внутрилежащее железо продолжает разъедаться. Предотвращение ржавчины, следовательно, требует покрытия, которое исключает образование ржавчины. На поверхности нержавеющей стали формируется пассивирующий слой оксида хрома(III). Подобное проявление пассивации происходит с магнием, титаном, цинком, оксидом цинка, алюминием, полианилином и другими электропроводящими полимерами.
Гальванизация
Хорошим подходом к предотвращению ржавчины является метод гальванизации, который обычно заключается в нанесении на защищаемый объект слоя цинка либо методом горячего цинкования, либо методом гальванотехники. Цинк традиционно используется, потому что он достаточно дёшев, обладает хорошей адгезией к стали и обеспечивает катодную защиту на стальную поверхность в случае повреждения цинкового слоя. В более агрессивных средах (таких, как солёная вода), предпочтительнее является кадмий. Гальванизация часто не попадает на швы, отверстия и стыки, через которые наносилось покрытие. В этих случаях покрытие обеспечивает катодную защиту металла, где оно выступает в роли гальванического анода, на который прежде всего и воздействует коррозия. В более современные покрытия добавляют алюминий, новый материал называется цинк-алюм. Алюминий в покрытии мигрирует, покрывая царапины и, таким образом, обеспечивая более длительную защиту. Этот метод основан на применении оксидов алюминия и цинка, защищающих царапины на поверхности, в отличие от процесса оксидизации, как в случае применения гальванического анода. В некоторых случаях при очень агрессивных средах или длительных сроках эксплуатации применяются одновременно и гальванизация цинком, и другие защитные покрытия, чтобы обеспечить надёжную защиту от коррозии.
Катодная защита
Катодная защита является методом, используемым для предотвращения коррозии в скрытых под землёй или под водой структурах путём подачи электрического заряда, который подавляет электрохимические реакции. Если её правильно применять, коррозия может быть остановлена полностью. В своей простейшей форме это достигается путём соединения защищаемого объекта с протекторным анодом, в результате чего на поверхности железа или стали происходит только катодный процесс. Протекторный анод должен быть сделан из металла с более отрицательным электродным потенциалом, чем железо или сталь, обычно это цинк, алюминий или магний.
Лакокрасочные и другие защитные покрытия
От ржавчины можно предохранять с помощью лакокрасочных и других защитных покрытий, которые изолируют железо из окружающей среды. История красок для нанесения на ржавчину насчитывает 50 лет, когда в Англии была изобретена краска Hammerite. Большие поверхности, поделённые на секции, как например, корпуса судов и современных автомобилей, часто покрывают продуктами на основе воска. Такие средства обработки содержат также ингибиторы от коррозии. Покрытие стальной арматуры бетоном (железобетон) обеспечивает некоторую защиту стали в среде с высоким рН. Однако коррозия стали в бетоне всё ещё является проблемой.
Покрытие слоем металла
Ржавчина может полностью разрушить железо. Обратите внимание на гальванизацию незаржавевших участков.- Оцинковка (оцинкованное железо/сталь): железо или сталь покрываются слоем цинка. Может использоваться метод горячего цинкования или метод цинкового дутья.
- Лужение: мягкая листовая сталь покрывается слоем олова.
- Хромирование: тонкий слой хрома наносится электролитическим способом на сталь, обеспечивая как защиту от коррозии, так и яркий, полированный внешний вид. Часто используется в блестящих компонентах велосипедов, мотоциклов и автомобилей.
Воронение
Воронение — это метод, который может обеспечить ограниченную устойчивость к коррозии для мелких предметов из стали, таких как огнестрельное оружие и др. Метод состоит в получении на поверхности углеродистой или низколегированной стали или чугуна слоя окислов железа толщиной 1-10 мкм. Для придания блеска, а также для улучшения защитных свойств окисной плёнки, её пропитывают минеральным или растительным маслом.
Снижение влажности
Ржавчины можно избежать, снижая влажность окружающей железо атмосферы. Этого можно добиться, например, с помощью силикагеля.
Ингибиторы
Ингибиторы коррозии, как, например, газообразные или летучие ингибиторы, можно использовать для предотвращения коррозии в закрытых системах.
Экономический эффект
Ржавчина вызывает деградацию инструментов и конструкций, изготовленных из материалов на основе железа. Поскольку ржавчина имеет гораздо больший объём, чем исходное железо, её нарост ведёт к быстому разрушению конструкции, усиливая коррозию на прилегающих к нему участках — явление, называемое «поеданием ржавчиной». Это явление стало причиной разрушения моста через реку Мианус (штат Коннектикут, США) в 1983 году, когда подшипники подъёмного механизма полностью проржавели изнутри. В результате этот механизм зацепил за угол одной из дорожных плит и сдвинул её с опор. Ржавчина была также главным фактором разрушения Серебряного моста в Западной Вирджинии в 1967 году, когда стальной висячий мост рухнул меньше, чем за минуту. Погибли 46 водителей и пассажиров, находившихся в то время на мосту.
 Мост Кинзу после разрушения.
Мост Кинзу после разрушения.Мост Кинзу в штате Пенсильвания была снесён торнадо в 2003 году в значительной степени потому, что центральные базовые болты, соединяющие конструкцию с землёй, проржавели, предоставив мосту возможность держаться просто под действием силы тяжести.
Кроме того, коррозия покрытых бетоном стали и железа может вызвать раскалывание бетона, что создает серьёзные конструкторские проблемы. Это один из наиболее распространённых отказов железобетонных мостов.
См. также
Примечания
- ↑ Interview, David Des Marais.(недоступная ссылка — история)
- ↑ Holleman, A. F.; Wiberg, E. “Inorganic Chemistry” Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Hubert Gräfen, Elmar-Manfred Horn, Hartmut Schlecker, Helmut Schindler “Corrosion” Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim, 2002. DOI: 10.1002/14356007.b01_08
Ссылки
Коррозия металлов. Все виды особенности и факты
Коррозия — разрушительный процесс, который пагубно влияет на металлические конструкции. Процесс может иметь как химические, так и химико-физические причины. Чаще всего причиной возникновения таких проблем является неустойчивость материала к воздействию внешних факторов, чаще всего термодинамического характера.
Чаще всего ржавчина прогрессирует исключительно в верхних слоях материала, но иногда проникает и вглубь.
Виды коррозийных процессов
Коррозия металлов имеет большое количество разновидностей. Но в основном все виды подразделяются на два основных типа:
- Коррозия общего характера. Она называется равномерной, а встречается чаще всего. Причиной возникновения такой коррозии считаются химические и электрохимические реакции. Такая разновидность коррозии приводит к отрицательному воздействию на всю поверхность материала и металлической конструкции. При этом процесс может быть равномерным или неравномерным. При неравномерном распределении ржавчины, она на одном участке разъедает материала быстрее и сильнее, чем на соседнем.
- Местный вид коррозии. Возникает на одном участке, где и развивается.
- Местная пятнами. Возникает на отдельных участках материала.
- Язвенная, ее еще называют питтинг.
- Межкристаллитная — такая коррозия возникает на пограничных областях металлического кристалла. Чаще вспыхивает в тех материалах, которые содержат в составе никель и алюминий. Металл в кратчайшие сроки остается без первоначальных показателей прочности и эластичности.
- Растрескивающая.
- Подповерхностная.
- Коррозия под током — возникает под воздействием блуждающего или постоянного тока.
- Коррозийная кавитация — вариант разрушений, когда помимо ржавчины на металл воздействует и ударная сила.
- Фреттинг-коррозия — одновременное воздействие ржавчины и вибрации, которые совместно приводят к разрушению металлических конструкций. варианты.


Есть еще различия и по механизму воздействия.
См.также: Самые дорогие металлы в мире
Химический вариант разрушения
Это разновидность процесса, при котором рушатся связи металлические, а между атомами веществ материала и окислителей возникает химическая взаимодействие. В такой ситуации не образуется электрический ток между различными областями материала. В свою очередь такой вид разрушения подразделяется еще на два типа:
- Газовый вариант. Получается при воздействии агрессивных азов, а также паров в сочетании с высокими показателями температуры. Если материал относится к активным, то воздействие таких сред может привести к окончательному разрушению материала по всей поверхности. К таким средам относятся: сероводород, диоксид серы, пары воды, кислород. Такой вид разрушительного процесса чаще всего заметен в промышленности и на химическом производстве.
- Жидкостный вариант ржавчины. Случается в неэлектролитических веществах. Если имеется даже небольшое содержание жидкости, то процесс становится электрохимическим.
Важно, что при химической разновидности коррозии металл разрушается со скоростью протекания химической реакции.
См.также: Обработка металла давлением
Электрохимическая ржавчина
Этот вариант разрушительных процессов возникает в среде электролитов. Процесс сочетается с возникновением тока. В итоге из решетки вещества убирается атом и одновременно протекают два процесса:
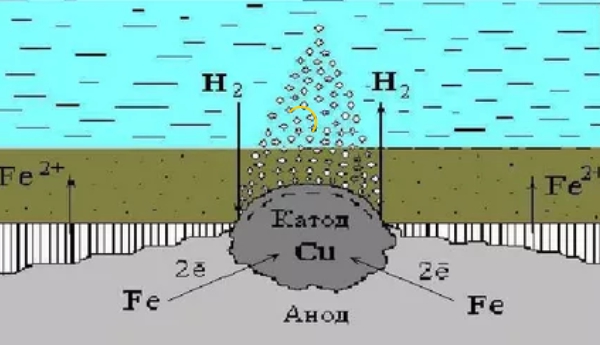

- Анодный — вещество материала в качестве ионов входит в раствор.
- Катодный — те вещества, которые получаются в предыдущем процессе, связываются при помощи деполяризатора.
Собственно отвод электродов так и называется — деполяризация, а непосредственно вещества, которые способствуют данному процессу именуются деполяризаторами.
Наиболее часто возможно встретить вариант разрушения с водородной и кислородной деполяризацией.
Разновидность металлов по отношению к коррозии электрохимического вида
Все металлы по отношению к такому виду ржавчины делятся на 4 подтипа:
- Активные вещества или материалы с высокими параметрами термодинамической нестабильности. Это все щелочные виды металлов. Они подвержены влиянию коррозии даже в абсолютно нейтральных средах, где нет кислорода и других окислительных веществ.
- Средние материалы по уровню активности — в таблице Менделеева расположены между кадмием и водородом. Это материалы отличающиеся термодинамической нестабильностью в агрессивных кислых средах.
- Материалы с низкими параметрами активности или вещества с промежуточными параметрами стабильности по термодинамике. Противостоят коррозии в кислых и нейтральных атмосферах, при отсутствии кислорода.
- Благородные разновидности веществ. Это материалы с высокой стабильностью. Они поддаются коррозии только в кислых средах и в присутствии сильнейших окислителей.
Такие типы ржавчины могут разделяться по видам агрессивных сред, в которой она протекает:
- Процесс в электролитных веществах — процесс протекает в жидких кислых, щелочных средах, а также в простой воде.
- Атмосферный вид — любой газовый вариант с наличием влажности. Это очень распространенный вариант электрохимического разрушения металла. Главное, чтобы в данной среде была влажность. Только при таких условиях есть возможность протекания необходимых реакций.
При электрохимической вариации процесса одна часть металла служит анодом, а другая — катодом. Последним становятся те участки металла, куда больше поступает кислорода.
В зависимости от воздействующих сред есть и другие разновидности коррозий:
- Почвенная — протекает с разной степенью интенсивности. Все зависит от агрессивности почвы. В таких условиях происходит подземные разрушительные процессы на трубах и прочих подземных конструкциях.
- Аэрационная — причиной служит неравномерный приток воздуха к разным участкам материала.
- Морская — процесс проходит строго в соленой воде.
- Биокоррозия — результат жизнедеятельности бактерий и микроорганизмов. Они выделяют газы, которые и приводят к возникновению разрушительных процессов.
- Электрокоррозия — является результатом воздействия блуждающего тока.
Кроме того основные виды коррозии могут различаться в зависимости от типа металла, на которых они возникают.
Разрушительные процессы на меди
Медь считается достаточно стабильным металлом. Ее стабильность замечена в следующих средах:
- Атмосфера.
- Морская и пресная вода.
- Галогеновые среды со специальными условиями.
- В кислотах-неокислителях.
При этом медные конструкции отличаются нестабильностью в следующих условиях:
- При контакте с соединениями серы, а также с самой серой в чистом виде.
- При погружении в растворы солей-окислителей.
- В агрессивной воде.
Также часто встречается и атмосферная коррозия меди.
Ржавление железа
Еще один популярный элемент, который часто подвергается действию ржавчины — железо. Чаще всего железо подвергается разрушительным процессам в результате контакта с воздухом или кислотным раствором.
Способы защиты от коррозии металлов
Используется несколько основных методов по защите металлических конструкций от разрушительного воздействия коррозии. При использовании защиты в основном делается упор на то, что ржавчина без внешних повреждений не может проникнуть к металлу.
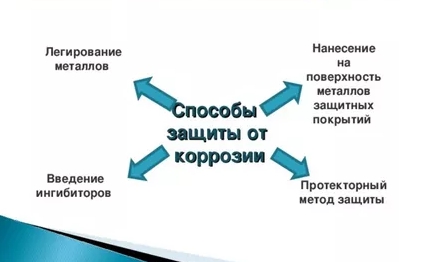

При этом важно, что защитные покрытия выполняют не только предохраняющую функцию, но и придают металлическим конструкциям симпатичный внешний вид.
Прежде всего, это покрытия, которые разделяются на три типа, по материалам нанесения:
- Металлические.
- Неметаллические.
- Химические.
Каждый из них имеет свои особенности и преимущества.
Металлические покрытия. Это способ, при котором на металлическую конструкцию наносят тонким слоем другой вид металла, который более стабилен к разрушительному действию коррозии при аналогичных условиях.
Покрытие может называться анодным или катодным в зависимости от того более активный или менее активный металл сверху.
Неметаллические покрытия. Они подразделяются на органические и неорганические. Чаще всего используется высокополимерный пластик, стекло и керамика. Из органических известны и популярны лаки, битум, краски, а также резина.
Химические покрытия. Это вариант, при котором на поверхности металлической конструкции при помощи химической обработки, наносится пленка, устойчивая к воздействию коррозии. Таких пленок может быть несколько разновидностей:
- Оксидирование — нанесение оксидных пленок.
- Фосфатирование — получение пленки фосфатов.
- Азотирование — пленка из активного азота.
- Воронение стали.
- Цементация — соединение с углеродом.
Также в качестве защиты используется изменение состава коррозийной среды. Еще один вариант защиты — ввести в металл технические соединения, которые повышают стойкость материала к разрушительным действиям коррозии.
Протекторный вид — вариант электрохимической защиты, при которой к конструкции присоединяются пластины с более активным металлом. При этом протектор — материал с отрицательными параметрами потенциала, а защищаемый материал — катод.
Заключение
Процесс коррозийной порчи материала разнообразный и многосторонний. Нюансы зависят от среды, от вида и активности металла, а также от дополнительных факторов влияния. Поэтому существует много способов защиты металлических конструкций от разрушительного влияния ржавчины и агрессивных сред.
Чаще всего применяются защитные пленки, как металлические, так и неметаллические. В отдельных случаях металл специально подвергают химической обработке. Наиболее стабильны по отношению к коррозии считаются благородные металлы, в том числе золото и платина.
ржавления железа и как его предотвратить?
Что такое ржавчина железа?
Когда железный предмет остается на длительное время во влажном воздухе (или воде), он покрывается красно-коричневым слоистым веществом, называемым ржавчиной. Это называется ржавлением железа.
Во время ржавления железа железный металл соединяется с кислородом воздуха в присутствии воды с образованием гидратированного оксида железа (III), Fe 2 O 3 .xH 2 О. (количество молекул вода х меняется, она не фиксируется).Ржавчина красно-коричневого цвета. Мы все видели железные гвозди, шурупы, трубы и перила, покрытые красно-коричневой ржавчиной. Это не только железо, которое ржавеет, даже сталь ржавеет от воздействия влажного воздуха или воды. Но сталь ржавеет не так легко, как железо.
Условия, необходимые для ржавления железа
Для ржавления железа нужны воздух и вода. Таким образом, для ржавления железа необходимы два условия:
Наличие воздуха (или кислорода)
Наличие воды (или влаги)
Мы знаем, что железо ржавеет при помещении во влажный воздух или в воду.Теперь влажный воздух также содержит водяной пар. Таким образом, только влажный воздух снабжает как вещи, так и воздух и воду, необходимые для ржавления железа. Опять же, обычная вода всегда растворяется в воздухе. Таким образом, обычная вода также снабжает обе вещи, необходимые для ржавчины.
Предотвращение ржавчины
Потеря железных предметов из-за ржавчины наносит большой ущерб экономике страны, поэтому ее следует предотвращать. Несколько методов используются для защиты железных объектов от ржавчины. Большинство методов включают в себя покрытие железных предметов чем-то, чтобы не допустить попадания воздуха и воды (которые вызывают ржавчину).Различные распространенные методы предотвращения ржавления железа приведены ниже:
- Покраска: Наиболее распространенный метод предотвращения ржавления железа заключается в покрытии его поверхности краской. Когда слой краски наносится на поверхность железного предмета, воздух и влага не могут вступать в контакт с железным предметом, и, следовательно, ржавчина не происходит. Железные изделия, такие как оконные решетки, перила, стальная мебель, железные мосты, железнодорожные вагоны, корабли и кузова легковых автомобилей, автобусов и грузовых автомобилей и т. Д.все окрашены, чтобы защитить их от ржавчины.
- Нанесение смазки или масла: При нанесении некоторого количества смазки или масла на поверхность железного предмета воздух и влага не могут соприкасаться с ним и, следовательно, предотвращается коррозия. Например, инструменты и детали машины, изготовленные из железа и стали, смазываются смазкой или маслом для предотвращения их коррозии.
- Оцинковка: Процесс нанесения тонкого слоя металлического цинка на железные предметы называется гальванизацией.Это делается путем погружения железного предмета в расплавленный металлический цинк. Тонкий слой металлического цинка затем образуется по всему железному объекту. Этот тонкий слой металлического цинка на поверхности железных предметов защищает их от ржавления, поскольку металлический цинк не подвержен коррозии под воздействием влажного воздуха. Железные листы, используемые для изготовления ведер, бочек, мусорных баков и навесов, оцинкованы, чтобы предотвратить их ржавление. Железные трубы, используемые для водоснабжения, также оцинкованы, чтобы предотвратить ржавление.
Как цинк может предотвратить ржавление? Цинк – довольно реактивный металл.Воздействие воздуха на металлический цинк образует очень тонкое покрытие из оксида цинка по всему телу. Это покрытие из оксида цинка является твердым и непроницаемым для воздуха и, следовательно, предотвращает дальнейшую коррозию металлического цинка. Объект из оцинкованного железа остается защищенным от ржавчины, даже если в слое цинка произошел разрыв. Это потому, что цинк легче окисляется, чем железо. Таким образом, когда слой цинка на поверхности оцинкованного железного предмета разрушается, цинк продолжает разъедать, а железный предмет не подвержен коррозии и ржавчине.
- Хромирование и лужение: Олово и хромовые металлы устойчивы к коррозии.Таким образом, когда гальваническим способом на железные и стальные объекты наносится тонкий слой металлического олова (или хрома), они защищаются от ржавления. Олово используется для покрытия ящиков, потому что оно не ядовито и, следовательно, не загрязняет пищу, содержащуюся в них. Хромирование выполняется на стержнях велосипедных ручек и автомобильных бамперах из железа и стали, чтобы защитить их от ржавчины и придать им блестящий вид.
- Коррозия железа может быть предотвращена путем его легирования для производства нержавеющей стали: Когда железо легируют хромом и никелем, получается нержавеющая сталь.Нержавеющая сталь вообще не ржавеет. Кухонная утварь, ножи, ножницы, хирургические инструменты и т. Д. Изготовлены из нержавеющей стали и совсем не ржавеют.
Введение
Со временем у некоторых металлических материалов возникают химические изменения на их поверхности, если они не используются или остаются в неподвижном состоянии. Эти изменения известны как коррозия. Коррозия – это процесс, который приводит к постепенному разложению металлов. Это произойдет с железом и его сплавами, такими как сталь. Ржавчина железа является одним из них. Железные предметы реагируют с кислородом, присутствующим в воздухе, и образуют ржавчину во влажной среде.Другими примерами коррозии являются потускнение на щепке и сине-зеленая патина на меди. Ржавчина – это в основном оксид железа. В основном, красный оксид образуется в результате окислительно-восстановительной реакции между кислородом и железом в присутствии влаги воздуха и воды. Было исследовано, что поверхностная ржавчина рыхлая и шелушащаяся и не обеспечивает никакой защиты железу. «Зеленая ржавчина» возникает, когда железо реагирует с хлоридом в присутствии воды и кислорода, которые в основном обнаруживаются в подводных железных столбах.
Какая химия стоит за ржавчиной железа?
Образование ржавчины происходит в присутствии воды и кислорода на железе или некоторых его сплавах.Реакция требует значительного времени для развития. Образование связей между атомами железа и атомами кислорода приводит к образованию оксидов железа. Ржавчина железа включает в себя повышение степени окисления железа с потерей электронов. Химическая формула ржавчины может быть записана как Fe2O3.3h3O (гидратированный оксид железа (III)).
Реакция ржавления железа: 4Fe + 3O2 → 2Fe2O3
Fe2O3 реагирует с водой и образует Fe2O3.3h3O.
Ржавчина образуется из двух разных оксидов железа, которые отличаются из-за степени окисления в атоме железа.Эти оксиды представляют собой
Оксид железа (II) или оксид железа. Степень окисления железа в этом соединении составляет +2, а его химическая формула – FeO.
Оксид железа (III) или оксид железа (III), в котором атом железа имеет степень окисления +3. Химическая формула этого соединения – Fe2O3.
Все мы знаем, что кислород является отличным окислителем, а железо – восстановителем. Таким образом, атомы железа охотно обеспечивают свои электроны кислородом при воздействии на него.Ржавчина железа включает процесс:
Fe → Fe2 + + 2e-
Степень окисления железа изменяется из-за атома кислорода в присутствии воды.
Ионы двухвалентного железа окисляются до ионов трехвалентного железа в присутствии влаги и воздуха, а также образуются гидроксильные ионы и образуется гидроксид трехвалентного железа.
4Fe2 + + O2 + 2h3O → 4Fe3 + + 4OH-
Fe3 + + 3OH- → Fe (OH) 3
Fe (OH) 3 превращается в Fe2O3.3h3O.
Факторы, влияющие на ржавление железа
Все химические реакции ржавления зависят от наличия воды и кислорода.Коррозия железа может контролироваться путем ограничения количества кислорода и воды, окружающих металл.
Почему ржавчина является нежелательным явлением?
Ржавчина известна как великий разрушитель вещей. Он может уничтожать автомобили и другие транспортные средства, тонуть корабли, срывать мосты, разжигать огонь и уничтожать все, что состоит из железа или его сплавов.
Весь кусок металла может распасться и превратиться в ржавчину, если его оставить без присмотра на продолжительное время. Это может вызвать много проблем, поскольку железо используется для строительства зданий, мостов, автомобилей и т. Д.Ржавчина делает металл слабее, так как окисленный металл слабее самого исходного металла. Это также делает металл ломким и подвергает его риску разрушения. Железо также используется для изготовления водопроводных труб и резервуаров. Если это железо ржавеет, трубы могут быть повреждены. Они также могут увеличить количество оксида железа в транспортируемой воде. Ржавчина также является питательной средой для бактерий. Если человек получил травму из-за ржавого железа, он может подвергнуться риску столбняка.
Как можно предотвратить ржавление?
Лакокрасочное покрытие
Ржавчина может быть предотвращена многими способами.Один из способов – сохранить железо от коррозии, покрасив его. Слои краски сопротивляются кислороду и воде, образуя ржавчину на поверхности железа, поскольку краска препятствует прямому контакту железа с ними. Железо защищено от коррозии, пока краска там. Масляные краски без проблем и наиболее рекомендуются. В качестве альтернативы, любая органическая краска толщиной 15-25 мкм может быть использована для предотвращения ржавчины.
В качестве альтернативы, ржавчину можно предотвратить с помощью термопластичного или термореактивного полимерного порошкового покрытия на поверхности железа.Порошковое покрытие считается лучше краски, так как дает более толстый защитный слой. Распыление сухого органического порошка на поверхность железа и нагревание железа до температуры плавления порошка. После расплавления порошок создает ровный слой на поверхности железа. Обычные материалы, используемые для порошкового покрытия, включают органические материалы на основе винила, полиэстера, нейлона, акрила, уретана и эпоксидной смолы.
Железные сплавы
Другие стратегии включают легирование железа другими металлами. Например, нержавеющая сталь в основном состоит из железа с небольшим количеством хрома.
Оцинковка
В другой стратегии железо оцинковано или оцинковано. Цинк имеет более низкий восстановительный потенциал, что позволяет ему легче окисляться, чем железо. Цинк – более активный металл. Этот процесс известен как гальванизация. Металл (железо) покрыт другим металлом, таким как цинк, чтобы сформировать защитный слой. Гальванизацию можно выполнить двумя способами:
Горячее цинкование: включает погружение железа в очень горячую ванну расплавленного цинка.
Электрогальванизация: использование металлического цинка в качестве анода, железо в качестве катода и пропускание электричества. через раствор цинка нанести ровное покрытие цинком на поверхность железа.
Электрогальванизация является предпочтительным методом гальванизации сегодня, поскольку он производит равномерное покрытие, в отличие от метода горячего погружения.
Катодная защита
Важным методом защиты железа от ржавления является превращение его в катод с гальваническим элементом. Этот процесс известен как катодная защита. Может использоваться для металлов, а не только для железа. В этом процессе железо связано с более активным металлом, таким как магний или цинк. Более активные металлы имеют более низкий восстановительный потенциал.Затем другой металл (железо) ведет себя как катод и не окисляется. Этот процесс очень полезен для хранения железных резервуаров под водой, когда аноды контролируются должным образом и своевременно заменяются. Этот процесс также используется для защиты металлических частей водонагревателей.
.
10 Признаки и симптомы дефицита железа
Дефицит железа возникает, когда организму не хватает минерального железа. Это приводит к аномально низкому уровню эритроцитов.
Это потому, что железо необходимо для производства гемоглобина, белка в эритроцитах, который позволяет им переносить кислород по всему организму.
Если вашему организму не хватает гемоглобина, ваши ткани и мышцы не будут получать достаточного количества кислорода и смогут эффективно работать. Это приводит к состоянию, которое называется анемия.
Хотя существуют различные виды анемии, железодефицитная анемия является наиболее распространенной во всем мире (1).
Распространенные причины дефицита железа включают неадекватное потребление железа из-за неправильного питания или ограничительного питания, воспалительных заболеваний кишечника, повышенных потребностей во время беременности и потери крови из-за обильных менструаций или внутреннего кровотечения.
Какая бы ни была причина, дефицит железа может привести к неприятным симптомам, которые могут повлиять на качество вашей жизни. К ним относятся плохое здоровье, концентрация внимания и производительность труда (2).
Признаки и симптомы дефицита железа различаются в зависимости от тяжести анемии, скорости ее развития, возраста и состояния здоровья.
В некоторых случаях люди не испытывают никаких симптомов.
Вот 10 признаков и симптомов дефицита железа, начиная с самых распространенных.
Чувство сильной усталости – один из наиболее распространенных симптомов дефицита железа, затрагивающий более половины дефицитных (3, 4).
Это происходит потому, что вашему организму необходимо железо для выработки белка, называемого гемоглобином, который содержится в эритроцитах.Гемоглобин помогает переносить кислород по всему организму.
Когда вашему организму не хватает гемоглобина, меньше кислорода попадает в ваши ткани и мышцы, лишая их энергии. Кроме того, ваше сердце должно работать усерднее, чтобы перемещать больше крови, богатой кислородом, по всему телу, что может утомлять вас (1).
Поскольку усталость часто считается нормальной частью занятой современной жизни, трудно диагностировать дефицит железа только с помощью одного этого симптома.
Однако многие люди с дефицитом железа испытывают низкое энергопотребление наряду со слабостью, ощущением расшатанности, трудности с концентрацией внимания или низкой производительностью на работе.
Резюме: Усталость является одним из наиболее распространенных признаков дефицита железа. Это связано с тем, что меньше кислорода поступает в ткани организма, лишает их энергии.
Бледная кожа и бледная окраска внутренних органов нижних век – другие распространенные признаки дефицита железа (5, 6, 7).
Гемоглобин в эритроцитах придает крови красный цвет, поэтому низкие уровни при дефиците железа делают кровь менее красной. Вот почему кожа может потерять свой здоровый, розовый цвет у людей с дефицитом железа.
Эта бледность у людей с дефицитом железа может появляться по всему телу или ограничиваться одной областью, например, лицом, деснами, внутренней частью губ или нижними веками и даже ногтями (8).
Это часто одна из первых вещей, которые врачи будут искать в качестве признака дефицита железа. Тем не менее, это должно быть подтверждено анализом крови (6).
Бледность чаще наблюдается в умеренных или тяжелых случаях анемии (9).
Если вы опустите нижнее веко, внутренний слой должен быть ярко-красного цвета.Если это очень бледно-розовый или желтый цвет, это может указывать на то, что у вас дефицит железа.Резюме: Бледность в целом или в определенных областях, таких как лицо, нижнее внутреннее веко или ногти, может быть признаком умеренного или тяжелого дефицита железа. Это вызвано снижением уровня гемоглобина, который придает крови красный цвет.
Гемоглобин позволяет вашим эритроцитам переносить кислород по всему организму.
Когда уровень гемоглобина в вашем организме низок во время дефицита железа, уровень кислорода также будет низким.Это означает, что ваши мышцы не будут получать достаточное количество кислорода для нормальной деятельности, такой как ходьба (10).
В результате ваша частота дыхания будет увеличиваться, когда ваше тело будет пытаться получить больше кислорода.
Вот почему одышка является распространенным симптомом (4).
Если вы чувствуете, что задыхаетесь, выполняя обычные ежедневные задачи, которые вам раньше было легко, такие как ходьба, подъем по лестнице или тренировка, возможно, виноват дефицит железа.
Резюме: Одышка является признаком дефицита железа, поскольку низкий уровень гемоглобина означает, что организм не может эффективно доставлять кислород к мышцам и тканям.
Дефицит железа может вызвать головную боль (11).
Этот симптом, по-видимому, встречается реже, чем другие, и часто сопровождается легкомысленностью или головокружением (4).
При дефиците железа низкий уровень гемоглобина в эритроцитах означает, что недостаточно кислорода может достичь мозга. В результате кровеносные сосуды головного мозга могут опухать, вызывая давление и головные боли (12).
Хотя есть много причин головных болей, частые, периодические головные боли и головокружение могут быть признаком дефицита железа.
Резюме: Головные боли и головокружение могут быть признаком дефицита железа. Нехватка гемоглобина означает, что недостаточно кислорода достигает мозга, заставляя его кровеносные сосуды набухать и создавать давление.
Заметное сердцебиение, также известное как учащенное сердцебиение, может быть еще одним симптомом железодефицитной анемии.
Гемоглобин – это белок эритроцитов, который помогает транспортировать кислород по всему организму.
При дефиците железа низкий уровень гемоглобина означает, что сердце должно работать очень усердно, чтобы переносить кислород.
Это может привести к нерегулярному сердцебиению или ощущению того, что ваше сердце бьется слишком быстро (4, 13).
В крайних случаях это может привести к увеличению сердца, сердцебиению или сердечной недостаточности (4).
Однако эти симптомы, как правило, встречаются реже. Вам придется долго страдать от дефицита железа, чтобы испытать их.
Резюме: В случаях дефицита железа сердце должно работать очень усердно, чтобы транспортировать кислород по всему организму.Это может привести к нерегулярному или быстрому сердцебиению и даже сердцебиению, расширению сердца или сердечной недостаточности.
Сухая и поврежденная кожа и волосы могут быть признаками дефицита железа (4).
Это потому, что когда ваше тело испытывает дефицит железа, оно направляет свой ограниченный кислород на более важные функции, такие как органы и другие ткани организма.
Когда кожа и волосы лишены кислорода, они могут стать сухими и слабыми.
Более тяжелые случаи дефицита железа были связаны с выпадением волос (14, 15).
Совершенно нормально, что некоторые волосы выпадают во время ежедневного мытья и расчесывания, но если вы теряете комки или намного больше, чем обычно, это может быть связано с дефицитом железа.
Резюме: Поскольку кожа и волосы получают меньше кислорода из крови при дефиците железа, они могут стать сухими и поврежденными. В более тяжелых случаях это может привести к выпадению волос.
Иногда просто заглянув внутрь или вокруг рта, можно определить, страдаете ли вы железодефицитной анемией.
Признаки включают, когда ваш язык становится опухшим, воспаленным, бледным или странно гладким (16).
Низкий гемоглобин при дефиците железа может привести к тому, что язык станет бледным, в то время как более низкий уровень миоглобина может вызвать его воспаление, гладкость и опухание.
Миоглобин – это белок в эритроцитах, который поддерживает ваши мышцы, такие как мышцы, составляющие язык (16).
Дефицит железа также может вызвать сухость во рту, воспаленные красные трещины в углах рта или язвы во рту (17).
Резюме: Болезненный, опухший или странно гладкий язык может быть признаком железодефицитной анемии. Трещины по углам рта также могут быть признаком.
Дефицит железа был связан с синдромом беспокойных ног (18).
Синдром беспокойных ног – сильное желание двигать ногами в покое. Это может также вызвать неприятные и странные ощущения ползания или зуда в ногах и ступнях.
Ночью обычно хуже, а это значит, что больные могут изо всех сил пытаться выспаться.
Причины синдрома беспокойных ног до конца не изучены.
Однако считается, что до 25% людей с синдромом беспокойных ног имеют железодефицитную анемию, и чем ниже уровень железа, тем хуже симптомы (19).
Резюме: Люди с железодефицитной анемией имеют больше шансов испытать синдром беспокойных ног. Это сильное желание двигать ногами в состоянии покоя.
Гораздо менее распространенным симптомом дефицита железа являются ломкие или ложкообразные ногти, состояние, которое называется койлонихия (8, 20).
Это часто начинается с ломких гвоздей, которые легко ломаются и трескаются.
На более поздних стадиях дефицита железа могут возникнуть гвозди в форме ложки, где середина гвоздя опускается, а края поднимаются, чтобы придать округлую форму, как ложка.
Однако, это редкий побочный эффект, который обычно наблюдается только в тяжелых случаях железодефицитной анемии.
Резюме: Хрупкие или ложкообразные ногти могут быть признаком более тяжелой железодефицитной анемии.
Есть несколько других признаков того, что ваше железо может быть низким.Они, как правило, встречаются реже и могут быть связаны со многими состояниями, кроме дефицита железа.
Другие признаки железодефицитной анемии:
- Странная тяга: Тяга к странным продуктам питания или непродовольственным товарам называется «пика». Это обычно включает в себя тягу к еде льда, глины, грязи, мела или бумаги и может быть признаком дефицита железа. Это также может произойти во время беременности (21).
- Чувство тревоги: Недостаток кислорода в тканях организма при дефиците железа может вызвать чувство тревоги.Тем не менее, это имеет тенденцию улучшаться или разрешаться по мере исправления уровня железа (22).
- Холодные руки и ноги: Дефицит железа означает, что меньше кислорода поступает в руки и ноги. Некоторые люди могут вообще легче чувствовать холод или иметь холодные руки и ноги.
- Более частые инфекции: Поскольку железо необходимо для здоровой иммунной системы, его недостаток может привести к тому, что вы заболеете больше болезней, чем обычно (23).
Резюме: Другие более общие признаки дефицита железа могут включать в себя странную тягу к еде, чувство беспокойства, холодные руки и ноги и повышенный риск инфекций.
Если вы считаете, что у вас железодефицитная анемия, примите во внимание следующий совет.
Поговорите со своим врачом
Если вы считаете, что у вас наблюдаются признаки или симптомы дефицита железа, вам следует записаться на прием к врачу. Если у вас еще нет врача, вы можете использовать инструмент Healthline FindCare, чтобы найти ближайшего к вам поставщика. Простой анализ крови подтвердит наличие у вас железодефицитной анемии (3).
Если ваш врач подтвердит, что у вас дефицит железа, вы, скорее всего, сможете довольно легко справиться с ним, увеличив потребление железа из своего рациона или с добавками железа (4).
Основной целью лечения является восстановление нормального уровня гемоглобина и пополнение запасов железа.
Постарайтесь убедиться, что вы получаете достаточное количество железа из реальной пищи в своем рационе. Принимайте добавки, только если ваш врач рекомендует их.
Ешьте продукты, богатые железом
Если ваш врач считает, что ваш дефицит железа может быть вызван недостатком железа в вашей диете, подумайте о том, чтобы потреблять больше продуктов, богатых железом, таких как:
- Красное мясо, свинина и домашняя птица
- Темно-зеленые листовые овощи, такие как шпинат и капуста
- Сухофрукты, такие как изюм и абрикосы
- Горох, бобы и другие бобовые
- Морепродукты
- Обогащенные железом продукты
- Семена и орехи
Помогите улучшить усвоение железа
Важно, что употребление витамина С поможет организму лучше усваивать железо.Убедитесь, что вы едите достаточно продуктов, богатых витамином С, таких как фрукты и овощи (24).
Также может быть полезно избегать определенных продуктов, которые могут ингибировать усвоение железа при употреблении в больших количествах. К ним относятся чай и кофе, а также продукты с высоким содержанием кальция, такие как молочные продукты и цельнозерновые крупы.
Принимайте железосодержащие добавки, если ваш врач рекомендует их
Как правило, вы должны принимать железосодержащие добавки только в качестве крайней меры, и если ваш врач рекомендует их.Это, вероятно, будет иметь место, если вы не сможете восстановить уровень железа с помощью одной диеты.
Если вы принимаете железосодержащие добавки, попробуйте пить апельсиновый сок, чтобы усилить усвоение железа.
Имейте в виду, что есть некоторые неприятные побочные эффекты от приема железосодержащих добавок. К ним относятся боли в животе, запоры или диарея, изжога, тошнота и черный стул.
Однако эти побочные эффекты обычно уменьшаются со временем и зависят от дозы железа, которое вы принимаете.
Резюме: Если вы считаете, что у вас железодефицитная анемия, поговорите со своим врачом, который, вероятно, порекомендует вам больше продуктов, богатых железом (плюс витамин С, чтобы увеличить усвоение железа) или, возможно, добавки с железом.
Железодефицитная анемия является наиболее распространенным видом анемии во всем мире.
У некоторых людей есть очевидные симптомы, в то время как у других их вообще нет. Это часто зависит от тяжести анемии.
К общим признакам и симптомам относятся усталость, бледность кожи, заметное сердцебиение, головные боли и головокружение, чувство одышки, сухость и повреждение волос и кожи, воспаленный или опухший язык и рот, беспокойные ноги и ломкие или ложкообразные ногти.
Если вы считаете, что у вас есть симптомы дефицита железа, обязательно посетите вашего врача.Самодиагностика не рекомендуется.
К счастью, большинство форм дефицита железа можно довольно легко лечить, обычно с помощью богатой железом диеты или добавок железа, если ваш врач рекомендует их.
Наблюдение за превращением ржавчины в железо.
 а) Цветные СЭМ-изображения нанолезвий оксида железа, использованных в эксперименте. б) Раскрашенное поперечное сечение СЭМ-изображения нанолезвий. в) Цветное СЭМ-изображение нанопластин после 1 часа реакции восстановления при 500 ° С в молекулярном водороде, показывающее пилообразную форму по краям (квадрат). г) Цветное СЭМ-изображение, показывающее образование отверстий после 2 часов восстановления. Масштабная линейка составляет 1 микрометр.Предоставлено: W. Zhu et al. / ACS Nano и K. Irvine / NIST.
а) Цветные СЭМ-изображения нанолезвий оксида железа, использованных в эксперименте. б) Раскрашенное поперечное сечение СЭМ-изображения нанолезвий. в) Цветное СЭМ-изображение нанопластин после 1 часа реакции восстановления при 500 ° С в молекулярном водороде, показывающее пилообразную форму по краям (квадрат). г) Цветное СЭМ-изображение, показывающее образование отверстий после 2 часов восстановления. Масштабная линейка составляет 1 микрометр.Предоставлено: W. Zhu et al. / ACS Nano и K. Irvine / NIST.Используя современную технику микроскопии, экспериментаторы из Национального института стандартов и технологий (NIST) и их коллеги стали свидетелями медленного, атомного преобразования ржавчины – оксида железа – обратно в чистый железный металл на всех своих химических этапах.
Среди самых распространенных минералов на Земле, оксиды железа играют ведущую роль в хранении магнитных данных, косметике, пигментации красок и доставке лекарств.Эти материалы также служат катализаторами для нескольких типов химических реакций, включая производство аммиака для удобрения.
Чтобы отрегулировать свойства этих минералов для каждого применения, ученые работают с наночастицами частиц оксидов. Но для этого исследователям необходимо детальное понимание восстановления на атомном уровне, ключевой химической реакции, которую испытывают оксиды железа. Однако этого знания часто не хватает, потому что сокращение – процесс, который фактически противоположен коррозии – идет слишком быстро, чтобы многие типы зондов могли его исследовать на таком прекрасном уровне.
В новых попытках изучить микроскопические детали восстановления оксидов металлов, исследователи использовали специально адаптированный просвечивающий электронный микроскоп (TEM) на установке NanoLab NIST для документирования пошагового превращения нанокристаллов гематита из оксида железа (Fe 2). O 3 ) до железоокисного магнетита (Fe 3 O 4 ) и, наконец, до металлического железа.
«Несмотря на то, что люди изучали оксид железа в течение многих лет, динамических исследований в атомном масштабе не проводилось», – говорит Вэньхуэй Чжу из Государственного университета Нью-Йорка в Бингемтоне, которая работала над докторской диссертацией в NanoLab в 2015 и 2016 годах. ,«Мы видим, что на самом деле происходит в течение всего процесса сокращения, а не только на начальных этапах».
Это очень важно, добавил Рину Шарма из NIST, «если вы хотите контролировать состав или свойства оксидов железа и понимать взаимосвязь между ними».
Понижая температуру реакции и уменьшая давление газообразного водорода, который действовал в качестве восстановителя, ученые замедлили процесс восстановления, чтобы его можно было захватить с помощью ТЭМ окружающей среды – специально настроенной ТЭМ, которая может изучать оба твердых вещества. и газ.Прибор позволяет исследователям выполнять визуализацию образца с атомным разрешением в реальных условиях – в этом случае в газовой среде, необходимой для восстановления оксидов железа, – а не в вакууме, необходимом в обычных ПЭМ.
«Это самый мощный инструмент, который я использовал в своих исследованиях, и один из немногих в Соединенных Штатах», – сказал Чжу. Она, Шарма и их коллеги описывают свои выводы в недавнем выпуске ACS Nano .
Команда исследовала процесс восстановления в бикристалле оксида железа, состоящем из двух идентичных кристаллов оксида железа, повернутых на 21.8 градусов по отношению друг к другу. Бикристаллическая структура также служила для замедления процесса восстановления, что облегчало отслеживание с помощью ТЕА в окружающей среде.
При изучении реакции восстановления исследователи выявили ранее неизвестное промежуточное состояние при превращении из магнетита в гематит. На средней стадии оксид железа сохранил свою первоначальную химическую структуру, Fe 2 O 3 , но изменил кристаллографическое расположение его атомов с ромбоэдрического (вытянутый по диагонали куб) на кубический.
В этом промежуточном состоянии обнаружен дефект, при котором атомы кислорода не могут заселить некоторые участки в кристалле, как это обычно бывает. Этот так называемый кислородный вакансионный дефект не является редкостью и, как известно, сильно влияет на электрические и каталитические свойства оксидов. Но исследователи были удивлены, обнаружив, что дефекты возникли в упорядоченном порядке, который никогда не был обнаружен при восстановлении Fe 2 O 3 до Fe 3 O 4 , сказал Шарма.
Значение промежуточного состояния остается в стадии изучения, но оно может быть важно для контроля скорости восстановления и других свойств процесса восстановления, добавляет она. «Чем больше мы понимаем, тем лучше мы можем манипулировать микроструктурой этих оксидов», – сказал Чжу. Управляя микроструктурой, исследователи могут повысить каталитическую активность оксидов железа.
Совместная работа платины и оксида железа делает работу
Дополнительная информация: Вэньхуэй Чжу и соавт.Атомно-масштабное исследование динамики восстановления двумерных Fe-ананоструктур, ACS Nano (2017). DOI: 10.1021 / acsnano.6b06950 Предоставлено Национальный институт стандартов и технологий
Цитирование : Наблюдение за превращением ржавчины в железо (2017, 5 апреля) восстановлено 16 июля 2020 г. с https: // физ.орг / Новости / 2017-04-ржаво-iron.html
Этот документ защищен авторским правом. Кроме честных сделок с целью частного изучения или исследования, нет Часть может быть воспроизведена без письменного разрешения. Содержание предоставлено исключительно в информационных целях.
,
