Производство кислоты ортофосфорной: Производство ортофосфорной кислоты
alexxlab | 26.10.1986 | 0 | Разное
Мировой рынок ортофосфорной кислоты
Мировой рынок ортофосфорной кислоты
29 мая
Сферы применения.
Основной сферой применения фосфорной кислоты остается производство фосфатных и сложных удобрений, более 90 % фосфорсодержащей руды используется именно для этих целей. Среди иных сфер можно отметить звероводство, пищевую, деревообрабатывающую и фармацевтическую промышленность, производство бытовой химии, стройматериалов и др.
Рис.1 Основные сферы применения фосфорной кислоты.
Крупнейшие производители
На долю десяти крупнейших производителей фосфорной кислоты приходится около 45 % суммарных мировых мощностей. В основном это интегрированные компании, расположенные вблизи источников сырья (залежей фосфорсодержащих руд).
Возглавляет мировой рейтинг марокканская компания OCP, что вполне закономерно, так как Марокко располагает крупнейшими в мире залежами фосфорсодержащих руд, на втором месте – североамериканская Mosaic, на третьем – канадская PotashCorp, хотя следует отметить, что китайская Yunnan Yuntianhua International Chemical Co.
Рис2. Мировое производство фосфорсодержащих руд.
Производственные мощности
В то время, как открываются новые производства, некоторые производители в Испании, Бельгии, Японии и США объявили о закрытии устаревших и нерентабельных заводов. Большинство новых производств по выпуску фосфорной кислоты интегрированы в промышленные комплексы по выпуску фосфатных удобрений, но в таких странах как Иордания и Тунис конечным (товарным) продуктом будет сама фосфорная кислота, а не удобрения.
Таблица 1. Мощности по производству фосфорной кислоты в некоторых странах.
Кризис истощения почвы
НЕТ ФОСФОРА, НЕТ ЕДЫ! С таким заявлением выступила группа исследователей из Австралии и Швеции. По их расчетам существует опасение, что в связи с ростом населения в мире, производство удобрений может достигнуть пика к 2033 году, а затем начнется спад производства из-за сокращения природных резервов фосфора и, соответственно, стремительный рост цен на фосфатные удобрения.
Генетически модифицированные организмы.
Во многих случаях использование трансгенных растений сильно повышает урожайность. Есть мнение, что при нынешнем размере населения планеты только ГМО могут избавить мир от угрозы голода. Противники этого мнения считают, что при современном уровне агротехники и механизации сельскохозяйственного производства уже существующие сейчас, полученные классическим путем, сорта растений и породы животных способны сполна обеспечить население планеты высококачественным продовольствием.
Мировой баланс спроса и предложения.
По-прежнему основной движущей силой в структуре спроса на фосфорную кислоту будут оставаться фосфатные и сложные удобрения.
Таким образом, если в 2010 году на производство фосфатных удобрений было использовано 32,8 млн т фосфорной кислоты, в 2011 году – 34,3 млн т, то в 2015 году этот показатель достиг практически 38 млн т (P2 O5 ). Остальные объемы – около 7 млн т – использованы в иных целях: в составе кормов для животных, пищевой, фармацевтической промышленности и т. п.
п.
Рис. 4 Мировой баланс спроса и предложения фосфорной кислоты
Россия остается одним из крупнейших мировых производителей фосфатных удобрений.
Компания Альбион предлагает поставки качественной ортофосфорной кислоты для нужд Вашего производства!
Теги: агрохимия,корма,удобрения
Актуальные новости:
11 сентября
Триацетин – добавка E1518 – свежее поступление на склад в Москве по выгодной цене!
27 августа
Что тверже: Эпоксидная смола или Полиэфирная?
21 августа
SALE! Сульфид натрия из Ирана – по цене 48 руб с НДС со склада в Москве!
12 августа
Расширяем ассортимент: Сульфат бария для ЛКМ – уже в продаже!
6 августа
Чем отличается дихлоризоцианурат натрия от дихлоризоцианурата натрия дигидрата?
Сообщение отправлено!
Спасибо за Ваш интерес к нашей продукции.
Что-то пошло не так 🙁
Спасибо за Ваш интерес к нашей продукции. К сожалению по техническим причинам Ваша заявка не отправлена. Попробуйте чуть позже, либо свяжитесь с нами по контактным телефонам!
Ортофосфорная кислота от ООО ХИМАЛЬЯНС
Главная / Кислоты / Ортофосфорная кислота – h4PO4
%D
%d.%M.%y
%h~:~%m
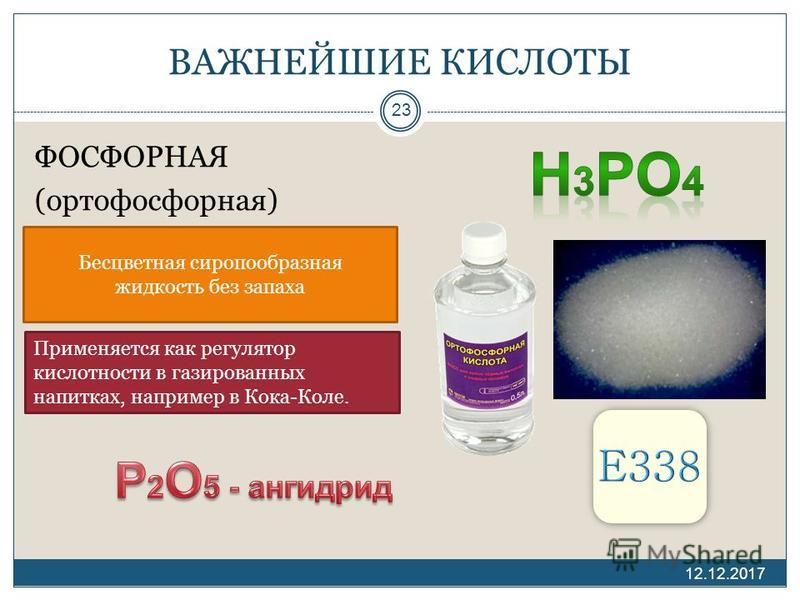
Ортофо́сфорная кислота́ (фо́сфорная кислота́) — неорганическая кислота средней силы, с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2
O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.Получение
Фосфорную кислоту получают из фосфата:
Можно получить гидролизом пентахлорида фосфора:
Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:
С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и её концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]ClO4.
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:
Качественной реакцией на ион РО43− является образование ярко-жёлтого осадка молибденофосфата аммония:
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
- (дигидрофосфат натрия)
- (гидрофосфат натрия)
- (фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Авиационная промышленность
В составе гидрожидкостей НГЖ-5У и ее иностранных аналогов.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Стоматология
Ортофосфорная кислота применяется для протравливаня (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется протравливание эмали зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4 и 5 поколения стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6 и 7 поколения отдельный этап протравливания кислотой отсутвует. Так адгезивы являются самопротравливающимися. Хотя некоторые производители все же рекомендуют для усиления адгезии кратковременно протравливать эмаль и при использовании самопротравливащих адгезивов.
Ортофосфорная кислота
Оптовые поставки по России и странам СНГ
Узнать стоимость
Синонимы: Фосфорная кислота, Phosphoric acid
Формула: h4PO4
CAS: 7664-38-2
Код ТН ВЭД: 2809200000
Стандарт:
ТУ 2121-342-00209438-04 – ортофосфорная кислота техническая
ТУ 2142-002-00209450-96 – ортофосфорная кислота улучшенная
ГОСТ 10678-76 – ортофосфорная кислота термическая
GB 3149-2004 – ортофосфорная кислота пищевая 75% и 85%
Описание:
Ортофосфорная кислота трехосновная, средней силы. Образует три ряда солей – фосфатов. При нагревании растворов кислоты происходит её дегидратация с образованием конденсированных фосфорных кислот. В промышленности ортофосфорную кислоту получают экстракционным (сернокислотным) или термическим способами.
Образует три ряда солей – фосфатов. При нагревании растворов кислоты происходит её дегидратация с образованием конденсированных фосфорных кислот. В промышленности ортофосфорную кислоту получают экстракционным (сернокислотным) или термическим способами.
Применение:
- для производства удобрений (как и хлористый кальций), синтетических моющих средств (CMC),
- в металлообрабатывающей промышленности для очистки и полировки металлов,
- в производстве активированного угля и киноплёнки,
- фосфорных солей аммония, натрия, кальция, марганца и алюминия,
- для производства огнеупоров, огнеупорных связующих, керамики, стекла,
- в медицине,
- в текстильной промышленности для выработки тканей с огнезащитной пропиткой,
- в нефтяной, спичечной промышленности,
- для органического синтеза.
Промышленная ортофосфорная кислота – важнейший полупродукт для производства фосфорных и комплексных удобрений и технических фосфатов, широко используется также для фосфатирования металлов, в качестве катализатора в органическом синтезе. Пищевая фосфорная кислота применяется для приготовления безалкогольных напитков, лекарств, зубных цементов и т.д.
Пищевая фосфорная кислота применяется для приготовления безалкогольных напитков, лекарств, зубных цементов и т.д.
- ОФК Китай
- ОФК техническая
- ОФК термическая
- ОФК улучшенная
Кислота ортофосфорная пищевая
75%, 85%
Оставить заявку
| Технические характеристики | Норма | |
|---|---|---|
| Содержание основного вещества (h4PO4), %, не менее | 75,0 | 85,0 |
| Массовая доля (h4PO3), %, не более | 0,012 | 0,012 |
| Массовая доля тяжелых металлов (Pb),%,не более | 0,0005 | 0,0005 |
| Массовая доля мышьяка (As), %, не более | 0,0005 | 0,0005 |
| Массовая доля фтора (F) , %, не более | 0,001 | 0,001 |
Упаковка:
Ортофосфорная кислота упаковывается в стальные гуммированные цистерны, стеклянные, полиэтиленовые бутыли, канистры, бочки, IBC контейнеры по 1000л.
Хранение:
Гарантийный срок хранения – 3 года.
Кислота ортофосфорная техническая
ТУ 2121-342-00209438-04
Оставить заявку
| Технические характеристики | Норма | |
|---|---|---|
| Внешний вид | не нормируется | |
| Массовая доля ОФК (H3PO4), %, не менее | 73,0 | |
| Массовая доля сульфатов (SO4),%,не более | 3,5 | |
| Массовая доля фтористых соединений (F), %, не более | 0,5 | |
| Массовая доля взвешенных частиц, %, не более | 0,6 | |
Упаковка:
Ортофосфорная кислота упаковывается в канистры по 35 кг и в кубовые емкости.
Хранение:
Гарантийный срок хранения – 1 года.
Ортофосфорная кислота термическая
ГОСТ 10678-76
Оставить заявку
| Технические характеристики | Норма | |
|---|---|---|
| Техническая | Пищевая | |
| Внешний вид | бесцветная или со слабым желтым оттенком жидкость в слое 15-20 мм при рассматривании на белом фоне | |
| Ортофосфорной кислоты (Н3РО4), %, не менее | 73,0 | 73,0 |
| Хлоридов, %, не более | 0,01 | 0,005 |
| Сульфатов, %, не более | 0,015 | 0,01 |
| Нитратов, %, не более | 0,0005 | 0,0003 |
| Железа (Fe), %, не более | 0,01 | 0,005 |
| Тяжелых металлов сероводородной группы (Pb), %, не более | 0,002 | 0,0005 |
| Мышьяка (As), %, не более | 0,006 | 0,0001 |
| Восстанавливающих веществ в пересчете на (Н3РО3), %, не более | 0,2 | 0,1 |
| Наличие метафосфорной кислоты (НРО3) | отсутствие | отсутствие |
| Взвешенных частиц, %, не более | отсутствие | отсутствие |
| Наличие желтого фосфора (Р4) | не нормируется | отсутствие |
Упаковка:
Ортофосфорная кислота упаковывается в стальные гуммированные цистерны, стеклянные, полиэтиленовые бутыли, канистры, бочки, IBC контейнеры по 1000л.
Хранение:
Гарантийный срок хранения – 12 месяцев.
Кислота ортофосфорная улучшенная
ТУ 2142-002-00209450-96
Оставить заявку
| Технические характеристики | Норма |
|---|---|
| Внешний вид | слабо-желтая или желтая жидкость |
| Ортофосфорной кислоты, %, не менее | 73,0 |
| Сульфатов, %, не более | 0,35 |
| Железа (Fe), %, не более | 0,04 |
| Тяжелых металлов сероводородной группы (РЬ), %, не более | 0,001 |
| Мышьяка, % , не более | 0,0005 |
| Фтористых соединений (F), %, не более | 0,005 |
| Трибутилфосфата, %, не более | 0,0005 |
| Взвешенных частиц, %, не более | 0,05 |
Упаковка:
Ортофосфорная кислота упаковывается в стальные гуммированные цистерны, стеклянные, полиэтиленовые бутыли, канистры, бочки, IBC контейнеры по 1000л.
Хранение:
Гарантийный срок хранения – 12 месяцев.
Транспортировка:
Кислота ортофосфорная может транспортироваться в стальных (из легированных сталей марки ЭИ-448 или аналогичных) или гуммированных железнодорожных цистернах по ГОСТ 10674 или по ГОСТ Р 51659, в специализированных автоцистернах в соответствии с правилами перевозки опасных грузов, действующими на данном виде транспорта, или транспортом любого вида в транспортной упаковке (таре) организации-потребителя в соответствии с ГОСТ 26319.
Выгодно
Низкие цены за счёт прямых контрактов с производителями
Надёжно
Работаем более 20 лет (с 1997 года) под одним ИНН.
Товар на складе
Более 3 000 тонн продукции в наличии на наших складах
Качество гарантируем
Работаем только с проверенными поставщиками.
Доставим как надо
Контролируем товар на всем пути
Введите ваше имя
Введите ваш телефон
Нажимая кнопку «Получить бесплатную консультацию», Вы соглашаетесь с условиями Политики конфиденциальности.
Наш специалист свяжется с Вами в ближайшее время.
Заявка направленная после 17:00 (+7 GMT),
обрабатывается на следующий день в рабочее время.
Введите ваше имя
Введите ваш телефон
Укажите ваш регион (город)
Нажимая кнопку «Узнать стоимость», Вы соглашаетесь с условиями Политики конфиденциальности.
Наш специалист свяжется с Вами в ближайшее время.
Заявка направленная после 17:00 (+7 GMT),
обрабатывается на следующий день в рабочее время.
Введите ваше имя
Введите ваш телефон
Укажите ваш регион (город)
Нажимая кнопку «Оставить заявку», Вы соглашаетесь с условиями Политики конфиденциальности.
В ТПУ наладили производство ортофосфорной кислоты на основе изотопа фосфор-32
2820
Добавить в закладки
Томский политехнический университет начал коммерческие поставки ортофосфорной кислоты на основе изотопа фосфор-32, используемого для биохимических исследований, диагностики и терапии онкологических заболеваний, сообщает пресс-служба ТПУ. Производственная линия запущена на площадке исследовательского ядерного реактора ТПУ. На сегодняшний день это единственное производство в России. До запуска производства в Томске российские потребители, а это научно-исследовательские и медицинские центры, были вынуждены заказывать материалы с фосфором-32 за рубежом.
Радиоактивный изотоп фосфор-32 активно применяется для проведения
биохимических исследований. Он встраивается в нуклеиновые
кислоты, которые в живых организмах участвуют во всех обменных
процессах, и замещает стабильный фосфор-31. Так как фосфор-32
является бета-излучателем, его передвижение по организму можно
отследить с помощью современной радиометрической аппаратуры. Если
он чрезмерно накапливается в каком-то органе, то это может
говорить о нарушении обменных процессов.
Если
он чрезмерно накапливается в каком-то органе, то это может
говорить о нарушении обменных процессов.
Также фосфор-32 используется непосредственно для лучевой терапии. Радиофармпрепарат на его основе вводится в организм пациента в виде раствора, суспензии, или гранул, которые усваиваются организмом, а изотоп, накапливаясь в определенных органах, облучает пораженные клетки, минимально воздействуя на здоровые ткани. Единственное в России производство этого изотопа ранее было остановлено в 2012 году. При этом спрос на фосфор-32 со стороны биологов и медиков постоянно растет.
«Мы производим ортофосфорную кислоту на основе фосфор-32
(H3P32O4). Ее применяют для
синтеза нуклеотидов, которые используют в биохимических
исследованиях и синтезе лекарственных препаратов. Первые партии
уже ушли заказчикам — это Институт химической биологии и
фундаментальной медицины СО РАН в Новосибирске и Институт
биоорганической химии им. академиков М.М. Шемякина и Ю.А.
Овчинникова в Москве.
академиков М.М. Шемякина и Ю.А.
Овчинникова в Москве.
«По оценке заказчиков, качество наших препаратов превосходит по всем параметрам — радиохимической и радионуклидной чистоте, мольной активности — зарубежные аналоги», — говорит заведующий кафедрой технической физики ТПУ Игорь Шаманин.
Поставки пока осуществляются небольшими партиями по 4-5 гигабеккереля в месяц, вся производственная линия рассчитана на поставки до 100 гигабеккереля в месяц.
По словам ученых, интерес к томской ортофосфорной кислоте уже проявили заказчики и из других стран.
ортофосфорная кислота фосфор-32
Источник: news.tpu.ru
Информация предоставлена Информационным агентством “Научная Россия”. Свидетельство о регистрации СМИ: ИА № ФС77-62580, выдано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций 31 июля 2015 года.
НАУКА ДЕТЯМ
Астрономы обнаружили уникальные неустойчивые галактики с рассогласованными дисками
18:30 / Астрономия
Международная конференция «Симуляционное обучение в медицине: опыт, развитие, инновации. РОСОМЕД — 2022» открылась в МГУ
РОСОМЕД — 2022» открылась в МГУ
18:30 / Здравоохранение, Медицина, Наука и общество
Исследование: первые челюстные позвоночные появились 439 миллионов лет
18:00 / Палеонтология
Запатентован новый способ диагностики меланомы
17:30 / Медицина
В предгорьях Северного Тянь-Шаня найдены стоянки эпохи верхнего палеолита
16:30 / Археология
Директор Института астрономии РАН Михаил Сачков: астроном — это романтик, который много знает
16:00 / Астрономия
Изобретение ученого Пермского Политеха повысит эффективность обработки титана и полимерных композитов
15:30 / Инженерия
Новосибирские студенты разработали диалоговую систему для видеоигр
14:37 / Новые технологии, Филология, Экономика
Восьмая Всероссийская премия «За верность науке»
14:30 / Наука и общество
«Нам надо работать вместе на общий результат». В МГУ имени М.В. Ломоносова обсудили сотрудничество между учеными в рамках Международной ассоциации академии наук
В МГУ имени М.В. Ломоносова обсудили сотрудничество между учеными в рамках Международной ассоциации академии наук
14:23 / Наука и общество, Экспертный разговор
Памяти великого ученого. Наука в глобальном мире. “Очевиднное – невероятное” эфир 10.05.2008
04.03.2019
Памяти великого ученого. Нанотехнологии. “Очевидное – невероятное” эфир 3.08.2002
04.03.2019
Вспоминая Сергея Петровича Капицу
14.02.2017
Смотреть все
Загальна хімічна технологіяТема 12 Производство фосфорных удобрений Производство фосфорных удобрений
- 12.1. Общая характеристика фосфорных удобрений
- 12.2. Производство фосфорной кислоты экстракционным методом
- 12.3. Производство двойного суперфосфата
Ключові терміни:
апатиты, барабанная гранулятор-сушилка, двойной суперфосфат, камерно-поточный, камерно-поточный метод, камерный метод, ортофосфорная кислота, поточный (бескамерный) метод, простые фосфорные удобрения, фосфориты, экстрактор12.
 1. Общая характеристика фосфорных удобрений
1. Общая характеристика фосфорных удобренийПростые фосфорные удобрения – это кальциевые соли фосфорной (ортофосфорной) кислоты различного состава. В отличии от калийных и азотных удобрений фосфорные удобрения обладают различной растворимостью, которая зависит от природы соли. По растворимости фосфорные удобрения подразделяются на: водорастворимые (группа I), растворимые в органических кислотах или усвояемые (группа II), нерастворимые или растворимые только в сильных минеральных кислотах (группа III).
По содержанию питательного элемента фосфорные удобрения делятся на концентрированные (более 30% P2O5) и неконцентрированные (менее 30% P2O5). В таблице 12.1 приведены характеристики и удельный вес в общем балансе производства основных фосфорных удобрений.
Таблица 12.1 – Ассортимент и характеристики фосфорных удобрений
Удоборение | Формула действующего вещества | Содер-жание усвоя-емого P2O5, % | Группа | Удельный вес по годам, % | |
1970 | 1985 | ||||
Фосфоритная мука | 3Ca(PO4)2·CaF2 | 19 – 30 | III | 30,8 | 8,2 |
Суперфосфат: | Ca(H2PO4)2·H2O | ||||
простой | 19 – 21 | I | 45,1 | 6,6 | |
двойной | 42 – 50 | I | 15,0 | 11,5 | |
Металлург. | 4CaO·P2O5·SiO5 | 8 – 16 | III | 1,1 | 0,3 |
Преципитат | CaHPO4·2H2O | 46 – 48 | II | – | – |
Изданных табл. 12.1 следует, что ассортимент фосфорных удобрений существенно меняется. Резко снижается производство низкоконцентрированных удобрений (фосфоритная мука, шлаки, простой суперфосфат), после некоторого роста наметилась тенденция снижения производства двойного суперфосфата. Это можно объяснить существенным увеличением объема производства комплексных (многосторонних) удобрений, содержащих фосфор.
Сырьем для производства фосфорных удобрений, фосфорной кислоты и элементарного фосфора служат природные фосфатные руды: апатиты и фосфориты. Основным фосфорсодержащим компонентом в них являются двойные соли трикальцийфосфата состава 3Ca3(PO4)2 · CaX2, где Х = F, OH, Cl. В соответствии с этим различают фторапатиты (Х = F) и гидроксилапатиты (Х = OH).
Основным фосфорсодержащим компонентом в них являются двойные соли трикальцийфосфата состава 3Ca3(PO4)2 · CaX2, где Х = F, OH, Cl. В соответствии с этим различают фторапатиты (Х = F) и гидроксилапатиты (Х = OH).
Апатиты представляют собой породы вулканического происхождения, имеют крупнозернистую структуру и, помимо фтор(гидроксил)апатита, содержат нефосфатные минералы, основным из которых является нефелин состава Na2O(K2O) · Al2O3 · 2SiO2. Поэтому для производства фосфорных удобрений используется продукт предварительного обогащения апатитовых руд – апатитовый концентрат, содержащий до 40% P2O5, выход которого составляет около 20% от массы апатитово-нефелиновой руды.
Фосфориты – руды осадочного происхождения, высокодисперсны и содержат фосфор в виде фторапатита и апатитоподобных минералов переменного состава. Содержание фосфора в фосфоритах колеблется от 16 до 30% P2O5.
Методы переработки фосфатного сырья существенно зависят от состава руды и могут быть механическими и химическими. Механической обработкой (измельчением) получают простейшие фосфорные удобрения – фосфоритную муку и металлургические шлаки. Задачей химической переработки природных фосфатов в фосфорные удобрения является превращение нерастворимого трикальцийфосфата (ТКФ) в такие соединения фосфора, которые легко усваиваются растениями и являются высококонцентрированными, то есть содержат возможно больше P2O5 в усвояемой форме при минимальном количестве балласта и вредных примесей.
Химическая переработка природных фосфатов может быть осуществлена тремя методами: химическим разложением, восстановлением углеродом и термической обработкой. Наиболее распространенный метод переработки фосфатного сырья – его разложение серной, фосфорной или азотной кислотами, используемое в промышленных масштабах для производства фосфорных удобрений, фосфорной кислоты, фосфора и комплексных удобрений на основе соединений фосфора (рис. 12.1).
12.1).
Рисунок 12.1 – Схема кислотной переработки фосфатного сырья
В результате кислотной обработки нейтральный ТКФ последовательно превращается в гидрофосфат и дигидрофосфат кальция, что сопровождается переходом соли из III группы растворимости во II и в I и повышением содержания в ней P2O5 (табл. 12.2)
Таблица 12.2 – Свойства фосфатов кальция
Свойства | Дигидро-фосфат кальция Ca(H2PO4)2 | Гидро-фосфат кальция CaHPO4 | Трикальций- фосфат Ca3(PO4)2 |
Группа растворимости | I | II | III |
pH растворителя | pH≥7 | pH<7 | pH<<7 |
Содержание P2O5, % | 60,7 | 52,2 | 45,8 |
Ниже из простых фосфорных удобрений рассматривается производство двойного суперфосфата, который сохранил свое значение, несмотря на интенсивное внедрение в сельское хозяйство комплексных минеральных удобрений.
Двойной суперфосфат получают фосфорнокислотным разложением природных фосфатов. Так как для производства фосфорной кислоты используется то же фосфорное сырье, то производство двойного суперфосфата складывается из двух последовательных стадий:
- производства фосфорной кислоты (стадия I), используемой как реагент во II стадии;
- фосфорнокислотного разложения фосфатов с получением двойного суперфосфата (стадия II), что представлено на рис. 12.2.
Фосфорную кислоту производили ранее исключительно кислотным разложением фосфатов, поэтому производство двойного суперфосфата можно рассматривать как процесс двойного воздействия кислот на фосфат, откуда и получил свое название «двойной».
Рисунок 12.2 – Общая схема получения двойного суперфосфата
12.2. Производство фосфорной кислоты экстракционным методом
В технологии под фосфорной кислотой подразумевают ортофосфорную кислоту H3PO4 (P2O5·3H2O) с содержанием в ней 72,4% P2O5. Ортофосфорная кислота представляет собой бесцветные кристаллы с температурой плавления 42,4ºС, гигроскопичные и расплывающиеся на воздухе. В переохлажденном состоянии – это густая маслянистая жидкость плотностью 1,88 т/м3. Смешивается с водой во всех отношениях. При нагревании подвергается дегидратации с образованием полифосфорных кислот различного состава (P2O5 · nH2O), где n< 3; пирофосфорной H4P2O7(P2O5·2H2O), триполифосфорной H5P3O10(3P2O5·5H2O) и т.д. Техническая полифосфорная кислота, содержащая 70 – 80% P2O5 и известная под названием суперфосфатной кислоты, имеет плотность 1,8 – 2,0 т/м3 и температуру затвердевания 3 – 8ºС. Высокое содержание P2O5 и способность образовывать растворимые комплексные соединения позволяет использовать суперфосфорную кислоту для получения высококонцентрированных жидких и твердых фосфорных удобрений.
Ортофосфорная кислота представляет собой бесцветные кристаллы с температурой плавления 42,4ºС, гигроскопичные и расплывающиеся на воздухе. В переохлажденном состоянии – это густая маслянистая жидкость плотностью 1,88 т/м3. Смешивается с водой во всех отношениях. При нагревании подвергается дегидратации с образованием полифосфорных кислот различного состава (P2O5 · nH2O), где n< 3; пирофосфорной H4P2O7(P2O5·2H2O), триполифосфорной H5P3O10(3P2O5·5H2O) и т.д. Техническая полифосфорная кислота, содержащая 70 – 80% P2O5 и известная под названием суперфосфатной кислоты, имеет плотность 1,8 – 2,0 т/м3 и температуру затвердевания 3 – 8ºС. Высокое содержание P2O5 и способность образовывать растворимые комплексные соединения позволяет использовать суперфосфорную кислоту для получения высококонцентрированных жидких и твердых фосфорных удобрений.
Физико-химические основы процесса. Экстракционный метод производства фосфорной кислоты основан на реакции разложения природных фосфатов серной кислотой. Процесс состоит из двух стадий: разложения фосфатов и фильтрования образовавшейся фосфорной кислоты и промывки сульфата кальция водой.
Сернокислотное разложение фосфата кальция представляет гетерогенный необратимый процесс, протекающий в системе «твердое тело – жидкость» и описываемый уравнением
Ca5(PO4)3F + 5H2SO4 + nH3PO4 + 5mH2O =
= (n + 3)H3PO4 + 5CaSO4 · mH2O + HF.
Для удобства записи и упрощения расчетов формула двойной соли фторапатита 3Ca3(PO4)2 · CaF2 записывается в виде Ca5(PO4)3F.
Часть образовавшейся фосфорной кислоты возвращается в процесс. Фактически фосфат разлагается смесью серной и фосфорной кислот. В зависимости от концентрации фосфорной кислоты в системе и температуры образующийся сульфат кальция может осаждаться в виде ангидрита (m = 0), полугидрата (m = 0,5) и дигидрата (m = 2). В соответствии с этим различают три варианта экстракционного метода производства фосфорной кислоты: ангидритный, полугидратный и дигидратный.
Фактически фосфат разлагается смесью серной и фосфорной кислот. В зависимости от концентрации фосфорной кислоты в системе и температуры образующийся сульфат кальция может осаждаться в виде ангидрита (m = 0), полугидрата (m = 0,5) и дигидрата (m = 2). В соответствии с этим различают три варианта экстракционного метода производства фосфорной кислоты: ангидритный, полугидратный и дигидратный.
В табл. 12.3 приведены условия разложения фторапатита для каждого из вариантов этого процесса.
Температурный режим зависит от варианта экстракционного процесса. В дигидратном методе гидратированный сульфат кальция осаждается в форме дигидрата при 70 – 80ºС и концентрации кислоты в реакционной смеси 20 – 32% P2O5, в полугидратном методе – в форме полугидрата при 90 -100ºС и концентрации кислоты 35 – 42%. На рисунке 12.3 показана зависимость формы кристаллизации сульфата кальция от температуры и
Рисунок 12.3 – Влияние температуры и концентрации кислоты на форму кристаллизации сульфата кальция
концентрации фосфорной кислоты (P2O5). В области ниже кривой 2 сульфат кальция кристаллизируется в виде дигидрата, выше кривой 1 – в виде ангидрита, в области между кривыми 1 и 2 – в виде полугидрата.
В области ниже кривой 2 сульфат кальция кристаллизируется в виде дигидрата, выше кривой 1 – в виде ангидрита, в области между кривыми 1 и 2 – в виде полугидрата.
Таблица 12.3 – Условия разложения фторапатита
Тип процесса | Температура ºС | Концентрация P2O5 в жидкой фазе, % | Теплота реакции, кДж/моль |
Дигидратный | 70 – 80 | 25 – 32 | 384,4 |
Полугидратный | 95 – 100 | 38 – 48 | 371,0 |
Выделяющийся при кислотном разложении фторапатита фтористый водород частично поступает в атмосферу, а частично вступает в реакцию с кремниевой кислотой, образующейся при разложении примесей, содержащихся в фосфатном сырье:
H2SiO3 + 6HF = H2SiF6 +3H2O.
Образовавшаяся кремнефтористоводородная кислота частично разлагается, и в газовую фазу выделяется тетрафторсилан
2H2SiF6 + H2SiO3 = 3SiF4 + 3H2O.
Одновременно протекает реакция взаимодействия тетрафторсилана с фтористым водородом с образованием кремнефтористоводородной кислоты
SiF4+ 6HF = H2SiF6.
Выделение фтористых соединений в газовую фазу возрастает с повышением температуры.
Скорость кислотного разложения фторапатита возрастает с повышением температуры, степени измельчения сырья и интенсивности перемешивания реагентов.
Рисунок 12.4 – Зависимость степени разложения фосфата от концентрации кислоты
Существенное влияние на скорость процесса кислотного разложения фосфатов оказывает концентрация серной кислоты. От нее зависит не только скорость химической реакции, но и структура кристалличес-кого сульфата кальция, осаждающегося на повер- хности частиц фосфата и скорость диффузии кислоты к твердой фазе.
При низкой концентрации кислоты образуются крупные кристаллы, не препятствующие диффузии. При высокой концентрации кислоты в результате пресыщения жидкой фазы сульфатом кальция выпадают мелкие кристаллы, препятствующие диффузии кислоты и замедляющие скорость процесса. Поэтому зависимость скорости и степени разложения от начальной концентрации серной кислоты имеет сложный характер (рис.12.4).
Скорость и степень разложения фосфата кислотной низкой концентрации (максимум 1) достаточно высоки. Однако большое количество воды, вводимой с кислотой, затрудняет кристаллизацию продукта. Максимум 2, также отвечающий высокой скорости разложения, достигается при концентрации кислоты в реакционной системе 5 – 10%, что соответствует концентрации исходной кислоты около 60% при соотношении жидкой и твердой фаз 3:1, которое обеспечивает необходимую подвижность пульпы.
Высокая степень разложения фосфатов, равная 0,99 дол.ед., достигается всего за 1 – 1,5 часа. Практически процесс экстракции продолжается 4 – 8 часов. Это необходимо для образования крупных кристаллов сульфата кальция, которые легко фильтруются и промываются для извлечения фосфорной кислоты небольшим количеством воды. Образованию крупных кристаллов способствует также перемешивание системы, незначительный избыток серной кислоты, снижающий степень пресыщения раствора и постоянство температуры процесса.
Это необходимо для образования крупных кристаллов сульфата кальция, которые легко фильтруются и промываются для извлечения фосфорной кислоты небольшим количеством воды. Образованию крупных кристаллов способствует также перемешивание системы, незначительный избыток серной кислоты, снижающий степень пресыщения раствора и постоянство температуры процесса.
Принципиальная и технологическая схемы производства. Принципиальные схемы производства экстракционной фосфорной кислоты дигидратным и полугидратным методами идентичны. Однако полугидратный метод позволяет получать более концентрированную кислоту (см. табл.12.3), снизить потери сырья и обеспечить более высокие интенсивность и производительность аппаратуры. Принципиальная схема производства экстракционной фосфорной кислоты одностадийным полугидратным методом приведена на рис. 12.5. На рис..12.6 представлена технологическая схема того же процесса.
Рисунок 12.5 – Принципиальная схема производства экстракционной фосфорной кислоты
Смесь серной кислоты и оборотного раствора фосфорной кислоты из сборника 2 и фосфат из бункера 1 подают в многосекционный экстрактор 3.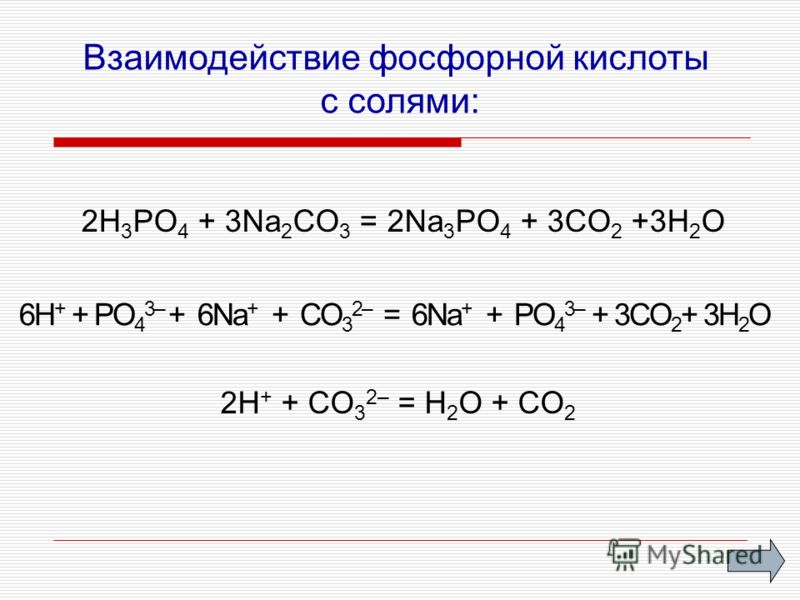 По мере движения пульпы в экстракторе образуется фосфорная кислота и завершается процесс кристаллизации сульфата кальция. Из последней секции экстрактора пульпа поступает на трехсекционный вакуум-фильтр 4. Основной фильтрат Ф-1 из первой секции фильтра отводится как продукционная фосфорная кислота, причем часть ее добавляется к оборотному раствору, направляемому в сборник кислоты 2. Осадок сульфита кальция на фильтре промывается противотоком горячей водой, при этом промывной раствор Ф-3 используется для первой промывки во второй секции фильтра. Фильтрат первой промывки Ф-2 направляется в виде оборотного раствора в сборник 2. Образовавшаяся фосфорная кислота (Ф-1) подогревается в подогревателе 5 паром и поступает в концентратор 6, где упаривается до заданной концентрации за счет прямого контакта с топочными газами и направляется на склад. Выделяющиеся из концентратора газы проходят промывной скруббер 7, в котором улавливаются соединения фтора и выбрасываются в атмосферу. Газы, выделяющиеся из экстрактора и содержащие фтористый водород и тетрафторсилан, поступают на абсорбцию в абсорбер, орошаемый водой или разбавленной кремнефтористоводородной кислотой.
По мере движения пульпы в экстракторе образуется фосфорная кислота и завершается процесс кристаллизации сульфата кальция. Из последней секции экстрактора пульпа поступает на трехсекционный вакуум-фильтр 4. Основной фильтрат Ф-1 из первой секции фильтра отводится как продукционная фосфорная кислота, причем часть ее добавляется к оборотному раствору, направляемому в сборник кислоты 2. Осадок сульфита кальция на фильтре промывается противотоком горячей водой, при этом промывной раствор Ф-3 используется для первой промывки во второй секции фильтра. Фильтрат первой промывки Ф-2 направляется в виде оборотного раствора в сборник 2. Образовавшаяся фосфорная кислота (Ф-1) подогревается в подогревателе 5 паром и поступает в концентратор 6, где упаривается до заданной концентрации за счет прямого контакта с топочными газами и направляется на склад. Выделяющиеся из концентратора газы проходят промывной скруббер 7, в котором улавливаются соединения фтора и выбрасываются в атмосферу. Газы, выделяющиеся из экстрактора и содержащие фтористый водород и тетрафторсилан, поступают на абсорбцию в абсорбер, орошаемый водой или разбавленной кремнефтористоводородной кислотой.
Рисунок 12.6 – Технологическая схема производства экстракционной фосфорной кислоты полугидратным методом: 1 – бункер фосфата; 2 – сборник серной кислоты; 3 – экстрактор; 4- вакуум-фильтр; 5 – подогреватель фосфорной кислоты; 6 – концентратор; 7 – промывной скруббер; 8 – сборник промывной жидкости
Основные аппараты в производстве экстракционной кислоты – экстрактор и вакуум-фильтр. Экстрактор – это железобетонный аппарат прямоугольного сечения, разделенный на 10 секций с мешалками, в котором пульпа последовательно перетекает из одной секции в другую. В другом варианте экстрактор составляет два сблокированных стальных экстрактора 730 м3, производительность его равна 340 т/сутки P2O5 при интенсивности около 25 кг/м3·ч.
12.3. Производство двойного суперфосфата
Двойной суперфосфат – концентрированное безбалластное простое фосфорное удобрение, получаемое разложением природных фосфатов фосфорной кислотой. Он представляет твердый гигроскопичный продукт серого цвета и выпускается в гранулированном виде. В отличие от простого суперфосфата не содержит балласта – сульфата кальция (СаSO4) и поэтому, обладая той же агрохимической активностью, имеет большую концентрацию фосфорсодержащего компонента. Двойной суперфосфат содержит 45 – 51% общего P2O5, в том числе 42 – 49% в усвояемой форме в виде водорастворимых соединений (H3PO4)2; Ca(H2PO4)2; Mg(H2PO4)2; и цитратно-растворимых соединений (CaHPO4;Mg HPO4; фосфаты железа).
В отличие от простого суперфосфата не содержит балласта – сульфата кальция (СаSO4) и поэтому, обладая той же агрохимической активностью, имеет большую концентрацию фосфорсодержащего компонента. Двойной суперфосфат содержит 45 – 51% общего P2O5, в том числе 42 – 49% в усвояемой форме в виде водорастворимых соединений (H3PO4)2; Ca(H2PO4)2; Mg(H2PO4)2; и цитратно-растворимых соединений (CaHPO4;Mg HPO4; фосфаты железа).
Физико-химические основы процесса. Разложение природных фосфатов фосфорной кислотой представляет гетерогенный необратимый процесс, протекающий по уравнению
Ca5(PO4)3F+7H3PO4+ 5H2O = 5Ca(H2PO4) · H2O + HF–132 кДж.
В этом процессе фосфорная кислота является не только реагентом кислотного разложения, но и носителем фосфора, что обеспечивает получение продукта с высоким содержанием усвояемого Р2О5.
Процесс взаимодействия фосфорной кислоты с трикальцийфосфатом протекает в две стадии. На первой стадии компоненты реагируют в подвижной суспензии, жидкая фаза которой содержит фосфорную кислоту, монокальцийфосфат и другие растворимые продукты реакции. Эта стадия, идущая сначала с высокой скоростью, замедляется по мере нейтрализации кислоты и заканчивается при насыщении жидкой фазы фосфатами кальция. Продолжительность этой стадии зависит от организации технологического процесса и типа аппаратуры и колеблется от секунд до нескольких часов.
На второй стадии происходит кристаллизация монокальцийфосфата (дигидрофосфата кальция), приводящая к изменению состава жидкой и твердой фаз реакционной смеси. Выделение кристаллов, отлагающихся на частицах фосфата, затрудняет доступ к ним ионов H+, процесс разложения фосфата резко замедляется и, когда жидкая фаза насыщается дигидрофосфатом и моногидрофосфатом кальция, процесс прекращается.
Скорость растворения фосфатов в растворах фосфорной кислоты, не насыщенных продуктами реакции, лимитируется скоростью диффузии ионов кальция Ca2+ от частиц фосфата в жидкую фазу. Поэтому высокая степень разложения фосфата на первой стадии может быть достигнута лишь при определенной концентрации фосфорной кислоты, равной 30 -40% Р2О5. На второй стадии, которая является определяющей для процесса разложения фосфата в целом, наибольшая скорость разложения достигается в растворах, содержащих около 45% Р2О5. С учетом этих требований выбирается технологический режим производства суперфосфата.
Поэтому высокая степень разложения фосфата на первой стадии может быть достигнута лишь при определенной концентрации фосфорной кислоты, равной 30 -40% Р2О5. На второй стадии, которая является определяющей для процесса разложения фосфата в целом, наибольшая скорость разложения достигается в растворах, содержащих около 45% Р2О5. С учетом этих требований выбирается технологический режим производства суперфосфата.
Так, например, в бескамерном методе сырье обрабатывается при 50 – 100ºС фосфорной кислотой концентрацией 28 – 40% Р2О5, что отвечает оптимальным условиям первой стадии. Так как при этой концентрации кислоты вторая стадия процесса практически не идет, то процесс завершают при сушке реакционной массы, когда вследствие испарения воды повышается ее активность.
Технологическая схема производства. В производстве двойного суперфосфата используются три метода, различающиеся аппаратурным оформлением, концентрацией использованной фосфорной кислоты и температурным режимом процесса.
- Камерный метод с использованием суперфосфатных камер непрерывного действия и выдерживанием продукта для созревания на складе. Для разложения фосфатов используют термическую или экстракционную кислоту концентрацией 50 – 58% P2O5 при избытке 110% от стехиометрического количества. Степень разложения фосфата 0,75 – 0,80 д.ед.
- Камерно-поточный метод с использованием аналогичных камер, но без операции складского созревания. Для разложения фосфатов используется экстракционная кислота концентрацией 47 – 49%, взятая в стехиометрическом отношении. Степень разложения не выше 0,7 дол.ед.
- Поточный (бескамерный) метод с использованием неупаренной кислоты концентрацией 30% P2O5 при степени разложения фосфата до 0,55 дол.ед. В отличие от предыдущих методов здесь разложение сырья осуществляют в две ступени. Первую стадию процесса проводят в реакторах до степени разложения 0,5 дол. ед. Дальнейшее разложение протекает при высокой температуре в сушилках различного типа: распылительных (РС), барабанных грануляторах-сушилках (БГС), распылительных сушилках-грануляторах кипящего слоя (РКСГ).
 Наиболее распространены схемы с использованием аппаратов БГС, конструкция которых непрерывно совершенствуется. На рисунке 12.7 представлена технологическая схема производства двойного суперфосфата поточным методом с аппаратом БГС производительностью 180 тыс. тонн в год.
Наиболее распространены схемы с использованием аппаратов БГС, конструкция которых непрерывно совершенствуется. На рисунке 12.7 представлена технологическая схема производства двойного суперфосфата поточным методом с аппаратом БГС производительностью 180 тыс. тонн в год.
Рисунок 12.7 – Технологическая схема производства двойного суперфосфата поточным методом: 1 – бункер фосфата; 2 – сборник фосфорной кислоты; 3 – реактор I ступени; 4 – реактор II ступени; 5 – аппарат БГС; 6 – топка; 7,8 – грохоты; 9 – дробилка; 10 – барабан-аммонизатор; 11 – холодильник «КС»; 12, 13 – циклон
Измельченный фосфат из бункера 1 и фосфорная кислота из сборника 2 подают в реактор I ступени 3. Из него реакционная пульпа перетекает в реактор II ступени 4. В оба реактора подают острый пар, обеспечивающий температуру реакционной массы 90 – 100ºС. Из реактора II ступени пульпа поступает в аппарат БГС 5, где происходят завершающая стадия разложения фосфорита, сушка и грануляция пульпы. В аппарат БГС подается также ретур – тонко измельченный двойной суперфосфат после отделения товарного продукта. Отношение масс ретура и готового суперфосфата равно 3:1. Пульпа, поступающая в аппарат БГС, разбрызгивается форсунками и наслаивается на частицы ретура, образуя гранулы, которые высушиваются при 700ºС топочными газами, поступающими в аппарат из топки 6. Сухой продукт направляется на грохоты 7 и 8, где его разделяют на три фракции. Крупную фракцию после измельчения в дробилке 9 смешивают с мелкой фракцией, прошедшей через грохот 8, и пылью из циклонов 12 и 13 и в виде ретура возвращают в аппарат БГС. Товарную фракцию суперфосфата, прошедшую через грохот 7, с размерами гранул 1 – 4 мм направляют в барабан-аммонизатор 10, где остаточная фосфорная кислота нейтрализуется аммиаком. Из аммонизатора она попадает в холодильник кипящего слоя 11 и затем на склад. Выделяющиеся из аппарата БГС фторсодержащие газы очищаются от пыли в циклоне 12 и направляются на абсорбцию водой, после чего выбрасываются в атмосферу.
Отношение масс ретура и готового суперфосфата равно 3:1. Пульпа, поступающая в аппарат БГС, разбрызгивается форсунками и наслаивается на частицы ретура, образуя гранулы, которые высушиваются при 700ºС топочными газами, поступающими в аппарат из топки 6. Сухой продукт направляется на грохоты 7 и 8, где его разделяют на три фракции. Крупную фракцию после измельчения в дробилке 9 смешивают с мелкой фракцией, прошедшей через грохот 8, и пылью из циклонов 12 и 13 и в виде ретура возвращают в аппарат БГС. Товарную фракцию суперфосфата, прошедшую через грохот 7, с размерами гранул 1 – 4 мм направляют в барабан-аммонизатор 10, где остаточная фосфорная кислота нейтрализуется аммиаком. Из аммонизатора она попадает в холодильник кипящего слоя 11 и затем на склад. Выделяющиеся из аппарата БГС фторсодержащие газы очищаются от пыли в циклоне 12 и направляются на абсорбцию водой, после чего выбрасываются в атмосферу.
Основным аппаратом в поточной схеме является барабанная гранулятор-сушилка, представляющая барабан диаметром 4,5 м и длинной до 35 м, установленный под углом 3º и вращающийся с частотой 4 об/м. Барабан содержит внутри лопастную насадку переменной конфигурации, с помощью которой при вращении барабана создается завеса частиц суперфосфата, ссыпающегося с полок. Теплоноситель (топочные газы) и поток суспензии суперфосфата подаются по оси аппарата, что уменьшает нагрев его стенок и позволяет применять топочные газы, нагретые до 950ºС. Производительность аппарата БГС составляет 40 т/час.
Барабан содержит внутри лопастную насадку переменной конфигурации, с помощью которой при вращении барабана создается завеса частиц суперфосфата, ссыпающегося с полок. Теплоноситель (топочные газы) и поток суспензии суперфосфата подаются по оси аппарата, что уменьшает нагрев его стенок и позволяет применять топочные газы, нагретые до 950ºС. Производительность аппарата БГС составляет 40 т/час.
Расходные коэффициенты на 1 т усвояемого Р2O5 составляют:
- фосфорит 0,28 – 0,29 т;
- экстракционная фосфорная кислота 0,80 – 0,83 т.
Себестоимость продукта в поточном и камерном методах практически одинакова. При этом себестоимость Р2O5 в них на 20% выше, чем в производстве простого суперфосфата. Однако, это компенсируется экономией при транспортировке, хранении и внесении в почву более концентрированного удобрения, каким является двойной суперфосфат.
Пример решения задачи
Составить материальный баланс фильтрации экстракционной пульпы, полученной из серной кислоты с массовой долей ω% и апатитового концентрата, содержащего g % P2O5, e % CaO, f % фтора.
Концентрация продукционной фосфорной кислоты а % P2O5, коэффициент разложения апатита b % содержания жидкой фазы в отбросном промытом фосфогипсе с %, отношение ж/т в пульпе 3:1.
Степень выделения фтора в газовую фазу d % от содержания его в сырье. В процессе экстракции испаряется 262 кг H2O на 1 т апатита. Фильтрация осуществляется на карусельном вакуум фильтре с 4–мя зонами фильтрации (одна основная и три промывные). Влажность отмытого гипса по зонам:
- после первой а1 = 52%
- после второй а2 = 50%
- после третьей а3 = 45%
Расчет составляем на 1000 кг апатитового концентрата по основным стадиям процесса.
Исходные данные
а = 32% b = 98% c = 40% d = 20% ω = 93 % g = 39,4% e = 52% f = 3 %
Решение
1) Основная фильтрация
Приход
Масса поступающей на фильтрацию пульпы
Gп = 100 • Gч (Ж+Т) = 1,6 • 100(3+1) = 6400 кг
где Gч – гипсовое число; Gч = 1,6
Расход
Выход продукционной фосфорной кислоты
[TEX]Gпрод=\frac{1000\cdot g\cdot b\cdot Mh4PO4}{a\cdot 100} = \frac{1000\cdot 0. 394\cdot 98\cdot 98}{32\cdot 100} [/TEX]= 1182.5 кг
394\cdot 98\cdot 98}{32\cdot 100} [/TEX]= 1182.5 кг
где Мh4PO4 – молярная масса фосфорной кислоты, 98 кг/кмоль.
Масса фосфогипса после первой фильтрации:
[TEX]Gфг1=\frac{1600\cdot 100}{100-а1} =\frac{1600\cdot 100}{100-52}=3333,3 кг [/TEX]
В том числе, кг:
Гипс Gч • 1000 = 1,6 • 1000 = 1600
Жидкая фаза 3333,3 – 1600 = 1733,3
Масса оборотной кислоты
Gоб.к. = Gч • 1000 • Ж – (Gпрод + 1733,3) = 1600 • 3 – (1182,5 + 1733,3) = 1884,2 кг
Материальный баланс основной фильтрации
| Приход | кг | Расход | кг |
| Пульпа | 6400 | Продукционная фосфорная кислота | 1182,5 |
| Оборотная фосфорная кислота | 1884,2 | ||
| Фосфогипс | 3333,3 | ||
| Всего | 6400 | 6400 |
2) Первая промывка
Приход
Масса фосфогипса, поступающая с основной фильтрации – 3333,3 кг
Масса первого фильтрата
Gф1 = Gпрод + Gоб. к = 1182,5 + 1884,2 = 3066,7 кг
к = 1182,5 + 1884,2 = 3066,7 кг
Масса раствора разбавления
[TEX]Gpp=6400-(1000+\frac{1,75\cdot e\cdot 100}{\omega } -\frac{1000\cdot f\cdot d\cdot MSiF4}{n\cdot AF}) =4691.7 кг[/TEX]
где МSiF4 – молярная масса SiF4, кг/моль
n – число атомов фтора в молекуле SiF4
АfF– атомная маса фтора, кг/моль.
Масса второго фильтрата, направляемого в экстрактор
Gф2 = Gр.р. – Gоб.к = 4691,7 – 1884,2 = 2807,5 кг
Масса третьего фильтрата, используемого для первой промывки фосфогипса
[TEX]Gф3=Gф2+\frac{Gч\cdot 1000\cdot 100}{100-а} -(Gп-Gф1)=2807,5+\frac{1,6\cdot 1000\cdot 100}{100-50}-(6400-3066,7)=2674,2 кг [/TEX]
Расход
Масса второго фильтрата Gф2 составляет 2807,5 кг
Фосфогипса после первой промывки при влажности а2 = 50% получается
[TEX]Gфг2=\frac{1600\cdot 100}{100-а2} =3200 кг[/TEX]
Материальный баланс первой промывки
| Приход | кг | Расход | кг |
| Фосфогипс | 3333,3 | Второй фильтрат | 2807,5 |
| Третий фильтрат | 2674,2 | Фосфогипс | 3200 |
| Всего | 6007,5 | 6007,5 |
3) Вторая промывка
Приход
Масса поступающего на промывку фосфогипса с влажностью а2 = 50%, составляет 3200 кг
Масса четвертого фильтрата, используемого для второй промывки фосфогипса
[TEX]Gф4=\frac{1600\cdot 100}{100-а3} +Gф3-\frac{1600\cdot 100}{100-а2} =\frac{1600\cdot 100}{100-45} +2674,2-\frac{1600\cdot 100}{100-50} 2383,3кг[/TEX]
Расход
Масса третьего фильтрата, полученного после второй промывки фосфогипса, составляет 2674,2 кг.
Масса фосфогипса после второй промывки:
[TEX]\frac{1600\cdot 100}{100-а3} =\frac{1600\cdot 100}{100-45} =2909,1кг[/TEX]
Материальный баланс второй промывки
| Приход | кг | Расход | кг |
| Фосфогипс | 3200 | Третий фильтрат | 2674,2 |
| Четвертый фильтрат | 2383,3 | Фосфогипс | 2909,1 |
| Всего | 5583,3 | 5583,3 |
4) Третья промывка
Приход
Масса фосфогипса, поступающего на третью промывку, составляет 2909,1 кг.
Масса воды на 1000 кг апатита, направляемой на промывку фосфогипса
[TEX]Gh3O=Gпрод+\frac{1600\cdot 100}{100-с} +1600+Gгаз-100-Gкисл=1182,5+\frac{1600\cdot 100}{100-40} +1600+270,2-1000-978,5=2140,9 кг[/TEX]
где [TEX]Gгаз=\frac{1000\cdot f\cdot d\cdot MSiF4}{nA(F)} =270. 2 кг[/TEX] – количество выделившихся в газовую фазу фтористых соединений в расчете на SiF4 (см. первую промывку),
2 кг[/TEX] – количество выделившихся в газовую фазу фтористых соединений в расчете на SiF4 (см. первую промывку),
[TEX]Gкисл=\frac{1,75\cdot е\cdot 1000}{0,93} = \frac{1,75\cdot 0,52\cdot 1000}{0,93}=978,5 кг [/TEX]– расход 93% серной кислоты на 1000 кг апатитового концентрата
Расход
Масса отбросного фосфогипса
[TEX]\frac{1600\cdot 100}{100-с} =\frac{1600\cdot 100}{100-40} =2666,7 кг[/TEX]
Масса четвертого фильтрата составляет 2383,3 кг
Материальный баланс третьей промывки
| Приход | кг | Расход | кг |
| Фосфогипс | 2909,1 | Четвертый фильтрат | 2383,3 |
| Вода на промывку фосфогипса | 2140,9 | Отбросный фосфогипс | 2666,7 |
| Всего | 5050,0 | 5050,0 |
Ортофосфорная кислота, химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Фосфорная кислота
Фосфор является важным питательным веществом для растений и поглощается корнями растений, обычно в виде иона дигидрофосфата, H 2 PO 4 – , полученный из фосфорной кислоты, H 3 PO 4 . Производство удобрений, используемых для восполнения дефицита фосфора в почвах, зависит от наличия запасов фосфорной кислоты.
Использование фосфорной кислоты
Около 90% производимой фосфорной кислоты используется для производства удобрений. Он в основном превращается в три фосфатные соли, которые используются в качестве удобрений. Это тройной суперфосфат (TSP), гидрофосфат диамония (DAP) и дигидрофосфат моноаммония (MAP).
Рисунок 1 Использование фосфорной кислоты.
Данные Potash Corporation, 2014
Фосфаты также используются в различных других целях, в том числе в безалкогольных напитках и в качестве добавок к кормам для крупного рогатого скота, свиней и птицы.
Несмотря на то, что их использование в качестве добавок в моющих средствах было прекращено во многих странах, в некоторых странах по-прежнему используется кислота.
Годовое производство фосфорной кислоты
| Мир | 43 млн тонн 1,2,3 |
| Китай | 17 миллионов тонн 4 |
| Юго-Восточная и Северо-Восточная Азия (включая Индонезию и Японию) | 10 миллионов тонн 4 |
| США | 8,4 млн тонн 5 |
1 Калийная корпорация, 2014 г.
2 JDCPhosphate, 2014 г.
3 Оценка на 2016 г. 9
Производство фосфорной кислоты
Фосфорная кислота производится двумя способами:
б) термический процесс
Термический метод обычно дает более концентрированный и чистый продукт, но является энергоемким (из-за производства самого фосфора. Кислота, полученная «мокрым» способом, менее чистая, но используется в производстве удобрений
Кислота, полученная «мокрым» способом, менее чистая, но используется в производстве удобрений
(a) Мокрый процесс
Фосфорную кислоту получают из фторапатита, известного как фосфатная порода, 3Ca 3 (PO 4 ) 2 .CaF 2 , путем добавления концентрированной (93%) серной кислоты. кислоту в ряде реакторов с хорошим перемешиванием. Это приводит к образованию фосфорной кислоты и сульфата кальция (гипса), а также других нерастворимых примесей. Добавляют воду и удаляют гипс фильтрованием вместе с другими нерастворимыми материалами (например, кремнеземом). Фтор, как H 2 SiF 6 удаляют на следующей стадии выпариванием.
Хотя реакция протекает поэтапно с участием дигидрофосфата кальция, общую реакцию можно представить в виде:
Однако возможны побочные реакции; например, с фторидом кальция и карбонатом кальция, присутствующими в породе:
Фторокремниевая кислота является важным побочным продуктом этого процесса и производства фтористого водорода. Его можно нейтрализовать гидроксидом натрия с образованием гексафторсиликата натрия. Кислота также используется для получения фторида алюминия, который, в свою очередь, используется в производстве алюминия.
Его можно нейтрализовать гидроксидом натрия с образованием гексафторсиликата натрия. Кислота также используется для получения фторида алюминия, который, в свою очередь, используется в производстве алюминия.
Кристаллическая структура образовавшегося сульфата кальция зависит от условий реакции. При 340-350 К основным продуктом является дигидрат CaSO 4 .2H 2 O. При 360-380 К образуется полугидрат CaSO 4 . 1 / 2 H 2 O.
Сульфат кальция отфильтровывают и затем кислоту концентрируют до приблизительно 56% P 2 O 5 с использованием вакуумной перегонки.
Кислота, полученная в результате «мокрого процесса», является нечистой, но может использоваться без дополнительной очистки для производства удобрений (см. ниже). В качестве альтернативы его можно выпарить до ca 70% P 2 O 5 , раствор суперфосфорной кислоты, который используется непосредственно в качестве жидкого удобрения.
Для получения промышленных фосфатов кислоту очищают путем экстракции растворителем с использованием, например, метилизобутилкетона (МИБК), в котором кислота слабо растворима, и концентрируют до 60% P 2 O 5 . Эту кислоту можно дополнительно очистить с помощью растворителей для извлечения из нее тяжелых металлов и дефторировать (путем выпаривания) с получением продукта пищевого качества.
(b) Термический процесс
Сырьем для этого процесса являются фосфор и воздух:
Первоначально фосфор впрыскивается в печь и сжигается на воздухе при температуре около 1800-3000 К.
В большинстве процессов используется невысушенный воздуха, и многие из них включают добавление пара в фосфорную горелку для создания и поддержания пленки конденсированных полифосфорных кислот, которая защищает башню горелки из нержавеющей стали (с внешним водяным охлаждением). Продукты из горелочной башни поступают непосредственно в гидратационную башню, где газообразный оксид фосфора поглощается рециркулируемой фосфорной кислотой:
В качестве альтернативы фосфор можно сжигать в осушенном воздухе. Пятиокись фосфора конденсируют в виде белого порошка и отдельно гидратируют до фосфорной кислоты.
Пятиокись фосфора конденсируют в виде белого порошка и отдельно гидратируют до фосфорной кислоты.
Этот метод позволяет восстанавливать и повторно использовать тепло.
Сжигание и прямая гидратация, как описано ранее, создают высококоррозионные условия. Оборудование изготовлено из нержавеющей стали или облицовано углеродистым кирпичом. Чтобы уменьшить коррозию, стены башни горелки и гидратора охлаждаются, но продукты реактора выходят при температуре, слишком низкой для полезной рекуперации тепла.
Кислота продукта имеет концентрацию ca 85%.
Тетрафосфорная кислота, одна из семейства полифосфорных кислот, которые могут быть получены селективно, производится либо путем выпаривания воды при высоких температурах в угольном сосуде, либо путем добавления твердого пятиокиси фосфора в почти кипящую фосфорную кислоту. Первый метод обычно дает более чистый продукт из-за высокого содержания мышьяка в пятиокиси фосфора.
Фосфаты
Соли фосфорной кислоты, фосфаты, представляют собой соединения, широко используемые в сельском хозяйстве, промышленности и в быту.
(a) Фосфаты аммония
Дигидрофосфат моноаммония и гидрофосфат диаммония широко используются в качестве удобрений и производятся путем смешивания в правильных пропорциях фосфорной кислоты с безводным аммиаком во вращающемся барабане.
Выбор используемого фосфата аммония зависит от соотношения азота и фосфора, необходимого для урожая.
(b) Фосфаты кальция
Фосфаты кальция широко используются в качестве удобрений. Дигидрофосфат кальция, Ca(H 2 PO 4 ) 2 , получают реакцией фосфоритов с серной кислотой:
Он известен как суперфосфат . Содержит ca 20% P 2 O 5 .
Если фосфатную породу обработать фосфорной кислотой, а не серной кислотой, будет получена более концентрированная форма дигидрофосфата кальция с более высоким общим уровнем P 2 O 5 (50%):
Это известно как тройной суперфосфат . Более высокий уровень фосфатов достигается за счет того, что продукт больше не разбавляется сульфатом кальция.
(c) Фосфаты натрия
Фосфаты натрия получают реакцией фосфорной кислоты и концентрированного раствора гидроксида натрия в соответствующих (стехиометрических) пропорциях. Продукт кристаллизуется.
- Дигидрофосфат мононатрия (MSP, NaH 2 PO 4 ) используется в составах для очистки металлов и подготовки поверхности, в качестве источника фосфата в фармацевтическом производстве и в качестве агента, регулирующего рН, в зубных пастах, в стекловидной эмали. покрытие ( санитарно-технические изделия ) и в производстве крахмалофосфатов. Одно из самых больших применений – обработка питьевой воды. Либо фосфорную кислоту, либо MSP можно использовать для получения тонкого нерастворимого покрытия из фосфата свинца на свинцовых трубах, чтобы предотвратить растворение свинца кислотами в воде.
- Гидрофосфат динатрия (Na 2 HPO 4 ) используется в качестве мягчителя в плавленых сырах, в эмалях и керамических глазурях, при дублении кожи, в производстве красителей и в качестве ингибитора коррозии при очистке воды.

- Тринатрийфосфат (Na 3 PO 4 ) используется в чистящих средствах для тяжелых условий эксплуатации, например, при обезжиривании стали. Это щелочь и секвестрант для ионов кальция, удерживающий их в растворе и предотвращающий образование накипи.
- Пирофосфат динатрия (Na 2 H 2 P 2 O 7 ) используется в качестве разрыхлителя в хлебе / пирожных (помогает высвобождению углекислого газа из пищевой соды), в качестве оксида железа подавитель (эффект потемнения или подрумянивания) при изготовлении различных пищевых продуктов и в качестве диспергатора в буровых растворах нефтяных скважин.
Дата последнего изменения: 5 января 2017 г.
Производство фосфорной кислоты – промышленные отходы
Последнее обновление пн, 05 сентября 2022 г. | Промышленные отходы
Использование электропечного процесса (рис. 11) и подкисление фосфатсодержащих пород производится в промышленных масштабах для производства фосфорной кислоты. В первом методе элементарный фосфор сначала получают из фосфатной руды, кокса и кремнезема в электрической печи, а затем фосфор сжигают на воздухе с образованием P2O5, который охлаждают и реагируют с водой с образованием ортофосфорной кислоты (раздел 9)..2.2). Чрезвычайно высокие нагрузки кислотного тумана на заводе по производству кислоты являются обычным явлением, и обычно используется пять типов туманоулавливающего оборудования: насадочные колонны, электрофильтры, скрубберы Вентури, волокнистые туманоуловители и контакторы с проволочной сеткой [21]. Выбор одного из этих управляющих устройств зависит от требуемой эффективности удаления загрязняющих веществ, требуемых материалов конструкции, потери давления, допускаемой через устройство, а также капитальных и эксплуатационных затрат на установку (с очень высокой эффективностью удаления, являющейся основным фактором). Скруббер Вентури широко используется для сбора тумана и особенно применим к кислоте 9.
11) и подкисление фосфатсодержащих пород производится в промышленных масштабах для производства фосфорной кислоты. В первом методе элементарный фосфор сначала получают из фосфатной руды, кокса и кремнезема в электрической печи, а затем фосфор сжигают на воздухе с образованием P2O5, который охлаждают и реагируют с водой с образованием ортофосфорной кислоты (раздел 9)..2.2). Чрезвычайно высокие нагрузки кислотного тумана на заводе по производству кислоты являются обычным явлением, и обычно используется пять типов туманоулавливающего оборудования: насадочные колонны, электрофильтры, скрубберы Вентури, волокнистые туманоуловители и контакторы с проволочной сеткой [21]. Выбор одного из этих управляющих устройств зависит от требуемой эффективности удаления загрязняющих веществ, требуемых материалов конструкции, потери давления, допускаемой через устройство, а также капитальных и эксплуатационных затрат на установку (с очень высокой эффективностью удаления, являющейся основным фактором). Скруббер Вентури широко используется для сбора тумана и особенно применим к кислоте 9. 0013
0013
- Рис. 11 Блок-схема электропечного процесса производства фосфора (из ссылки 15).
установки для сжигания шлама. Обожженный шлам представляет собой эмульсию фосфора, воды и твердых веществ, выносимую в газовом потоке из фосфорной электропечи в виде пыли или летучих материалов. Содержание примесей варьируется от 15 до 20%, а скруббер Вентури может эффективно улавливать кислотный туман и мелкую пыль, выбрасываемые в выхлопе гидратора.
Фосфорная кислота, полученная мокрым способом, производится путем взаимодействия измельченной обогащенной фосфатной руды с серной кислотой с образованием сульфата кальция (гипса) и разбавленной фосфорной кислоты (см. Раздел 9)..2.4). Нерастворимый сульфат кальция и другие твердые вещества удаляют фильтрованием, а слабую (32%) фосфорную затем концентрируют в испарителях до кислоты, содержащей около 55% P2O5. Выбросы тумана и газа из гипсового фильтра, концентратора фосфорной кислоты и отходящих газов подкисления контролируются скрубберами или другим оборудованием. При подготовке фосфатной руды в результате операций сушки и измельчения образуется пыль, и это обычно контролируется комбинацией сухих циклонов и мокрых скрубберов [21]. Материал, собранный циклонами, перерабатывается, а скрубберная вода сбрасывается в отстойники фосфогипса. Чаще всего используются простые градирни и мокрые циклонные скрубберы, но на некоторых заводах за сухим циклоном следует электрофильтр.
При подготовке фосфатной руды в результате операций сушки и измельчения образуется пыль, и это обычно контролируется комбинацией сухих циклонов и мокрых скрубберов [21]. Материал, собранный циклонами, перерабатывается, а скрубберная вода сбрасывается в отстойники фосфогипса. Чаще всего используются простые градирни и мокрые циклонные скрубберы, но на некоторых заводах за сухим циклоном следует электрофильтр.
9.6 КОНКРЕТНЫЕ ИССЛЕДОВАНИЯ ОБОРУДОВАНИЯ ДЛЯ ОБРАБОТКИ
Предприятия по производству фосфатов и фосфорных удобрений расположены во многих районах США (в основном во Флориде и Калифорнии) и в других странах, таких как Алжир, Иордания и Марокко, как упоминалось ранее. Сточные воды производственных и очистных сооружений и поверхностный сток в большинстве этих мест накапливаются, очищаются и перерабатываются, а избыточные сбросы сбрасываются в природные водные системы. На тех объектах, где сточные воды от производственных и очистных работ и дренажа сбрасываются в муниципальные системы водоснабжения и очищаются вместе с бытовыми, коммерческими, институциональными и другими промышленными сточными водами, требуется определенная степень предварительной очистки в соответствии с федеральными нормами или местными постановлениями, такими как представленные в разделе 9. 4. Например, согласно USEPA [6], операции установки предварительной обработки, необходимые для производства фосфорных удобрений, включают отделение твердых частиц и нейтрализацию, и это может быть достигнуто либо суспендированным биологическим процессом, биологическим процессом с фиксированной пленкой, либо независимым физико-химическим процессом. система.
4. Например, согласно USEPA [6], операции установки предварительной обработки, необходимые для производства фосфорных удобрений, включают отделение твердых частиц и нейтрализацию, и это может быть достигнуто либо суспендированным биологическим процессом, биологическим процессом с фиксированной пленкой, либо независимым физико-химическим процессом. система.
9.6.1 Добыча фосфатов из гальки
В одном из более ранних отчетов о добыче и производстве фосфатов во Флориде и ее усилиях по борьбе с загрязнением воды Уэйкфилд [31] дал следующее обобщенное описание. Из-за огромных объемов воды, используемой для промывки, гидравлической сортировки, флотации и обогащения фосфатных руд (т. труднодоступны, а избыток сточных вод представляет собой серьезную проблему удаления, рекуперация и повторное использование воды всегда имели большое значение. Отходы добычи и переработки состоят из большого количества нефосфатных песков и глин вместе с неизвлеченными фосфатными материалами размером менее 300 меш, и они закачиваются в огромные лагуны. Легко осевшие пески заполняют ближний конец, оставляя остальную часть постепенно заполняться «шламами» (полуколлоидной водной взвесью), а тонкий слой практически чистой воды на поверхности лагуны стекает по водосбросам и возвращается в шайбы. для повторного использования.
Легко осевшие пески заполняют ближний конец, оставляя остальную часть постепенно заполняться «шламами» (полуколлоидной водной взвесью), а тонкий слой практически чистой воды на поверхности лагуны стекает по водосбросам и возвращается в шайбы. для повторного использования.
Вышеупомянутое идеальное управление сточными водами, однако, невозможно во время дождливой погоды (дожди 3 дюйма в день или 7,6 см в день часты в тропическом климате Флориды), потому что в лагуны попадает больше воды, чем может быть использовано шайбы, а избыточный объем должен быть сброшен в близлежащие поверхностные воды. В частности, в небольших ручьях это приводит к сильному замутнению воды из-за того, что более крупный из медленно уплотняющихся шламов в большинстве случаев находится у поверхности лагун. Кроме того, в больших земляных плотинах, образующих отстойные лагуны, нет основных стен (из соображений стоимости); скорее, обычно полагаются на слизи, чтобы запечатать их внутреннюю поверхность и предотвратить чрезмерное просачивание. Таким образом, вся операция включает в себя тонкий баланс поступления шлама и сброса водослива для достижения цели максимального повторного использования воды с минимальной опасностью прорыва плотины и минимальным сбросом мути в ручей. Такие плотины очень часто выходили из строя, и эффект загрязнения от объема, например, пруда площадью 100 акров (0,4 км2) с глубиной 25–30 футов (7,6–90,1 м) затвердевшего ила, сбрасываемого в поток со средним расходом, возможно, 300 кубических футов в секунду (8,5 м3/с), было разрушительным.
Таким образом, вся операция включает в себя тонкий баланс поступления шлама и сброса водослива для достижения цели максимального повторного использования воды с минимальной опасностью прорыва плотины и минимальным сбросом мути в ручей. Такие плотины очень часто выходили из строя, и эффект загрязнения от объема, например, пруда площадью 100 акров (0,4 км2) с глубиной 25–30 футов (7,6–90,1 м) затвердевшего ила, сбрасываемого в поток со средним расходом, возможно, 300 кубических футов в секунду (8,5 м3/с), было разрушительным.
Существуют, однако, и другие гораздо более частые ситуации, когда сточные воды с более высокой или низкой мутностью сбрасываются в ручьи для защиты плотин или в качестве избыточного стока во время сильных дождей. Эти сбросы объемов мутных сточных вод могут быть связаны с недостаточным проектированием отстойников или с тем, что шламы сточных вод имеют более полностью коллоидную природу и не слишком хорошо осветляются. Обычно они продолжаются в течение продолжительных периодов и вызывают заметное помутнение ручья, хотя и не приближаются к тем, которые возникают после разрушения плотины отстойника. Когда ручьи содержат значительную мутность из-за стоков фосфатного производства, местные рыбаки-спортсмены утверждают, что это портит рыбную ловлю (но в основном они просто предпочитают ловить рыбу в чистых водах), в то время как руководители отрасли продемонстрировали, что рыба не страдает от зарыбления выработанных ям и отстойников. с басом и другими видами. Наконец, положительный эффект от сброса умеренного уровня мутности, отмеченный на водоочистной станции, расположенной ниже по течению, заключается в снижении затрат на химические реагенты, несомненно, из-за большей мутности сырой воды, которая способствует коагуляции цвета и других примесей.
Когда ручьи содержат значительную мутность из-за стоков фосфатного производства, местные рыбаки-спортсмены утверждают, что это портит рыбную ловлю (но в основном они просто предпочитают ловить рыбу в чистых водах), в то время как руководители отрасли продемонстрировали, что рыба не страдает от зарыбления выработанных ям и отстойников. с басом и другими видами. Наконец, положительный эффект от сброса умеренного уровня мутности, отмеченный на водоочистной станции, расположенной ниже по течению, заключается в снижении затрат на химические реагенты, несомненно, из-за большей мутности сырой воды, которая способствует коагуляции цвета и других примесей.
Продолжить чтение здесь: Утилизация отходов фосфатной промышленности
Была ли эта статья полезной?
Desmet Ballestra – Заводы по производству фосфорной кислоты
Торговая марка фосфорной кислоты
Desmet Ballestra является постоянным лицензиатом Prayon Technology с 2009 года. Предлагаемые процессы основаны на двухводном (DH) и полугидратном (HH) гипсе. формирование и различные комбинации двух процессов, которые должны быть выбраны в соответствии с несколькими факторами, такими как качество породы, требуемая концентрация кислоты, доступность воды, расход пара.
Предлагаемые процессы основаны на двухводном (DH) и полугидратном (HH) гипсе. формирование и различные комбинации двух процессов, которые должны быть выбраны в соответствии с несколькими факторами, такими как качество породы, требуемая концентрация кислоты, доступность воды, расход пара.
Характеристики предлагаемых растворов
Все доступные процессы позволяют производить 52-54% фосфорной кислоты после этапа концентрирования. Фосфорная кислота в основном используется в качестве сырьевого компонента на заводах по производству удобрений.
Эффективность установки
Высокая эффективность преобразования фосфатов и контроля над фосфатами, обеспечиваемая внедрением наилучшей доступной технологии в сочетании с проектированием процессов Prayon, сводящим к минимуму риск засорения установки и увеличивающим эксплуатационную готовность установки .
Заводские выбросы
Контроль загрязнения воздуха с помощью специального скруббера для соответствия уровню выбросов предприятия, требуемому самыми строгими законами и стандартами.
Хорошо зарекомендовавшее себя ноу-хау в выборе наиболее подходящих конструкционных материалов для обеспечения кислотостойкости.
Побочные продукты
Конфигурация установки позволяет извлекать плавиковую кислоту (FSA) в качестве побочного продукта с концентрацией до 18%. FSA можно продавать как таковой на рынке или далее превращать в ценную AHF (безводную фтористоводородную кислоту) или AlF 9.0003 3 (для такой технологии DBI сотрудничает с Buss ChemTech) или нейтрализуется для утилизации.
Индивидуальная конфигурация
Установки Desmet Ballestra для производства фосфорной кислоты легко настраиваются для переработки нескольких типов фосфатных пород и максимального повышения эффективности установки.
Технология производства фосфорной кислоты
Desmet Ballestra предлагает установки, основанные на следующих технологических процессах Prayon Technology:
- DH: дигидрат (простая кристаллизация)
- HH: полугидрат (простая кристаллизация)
- CPP: Central Prayon Process (двойная кристаллизация DH-HH)
- HDH: от полугидрата до дигидрата (двойная кристаллизация HH-DH)
- DA-HF: воздействие дигидратов, фильтрация полугидратов (двойная кристаллизация DH-HH)
При выборе наиболее подходящего процесса будет учитываться несколько факторов, таких как качество породы, требуемые характеристики и экономичность (капитальные затраты, потребление сырья, потребление водяного пара). Каждый проект завода зависит от потребностей Заказчика.
Каждый проект завода зависит от потребностей Заказчика.
В приведенной ниже таблице сравниваются различные процессы производства фосфорной кислоты (в столбцах указаны относительные величины):
Эти процессы широко применялись во многих проектах по производству фосфорной кислоты по всему миру и стали ведущими процессами на рынке благодаря своей универсальности и специфике. Преимущества:
- Хорошо зарекомендовавший себя процесс
- Способность эффективно конвертировать различные типы фосфоритов (осадочных и магматических)
- Более низкие затраты на техническое обслуживание и более высокие эксплуатационные факторы
- Одноступенчатая/двухступенчатая фильтрация
- Простота эксплуатации/отключения, гибкость и простота транспортировки гипса
- Требуются строительные материалы более низких сортов
- Более легкий контроль водного баланса
Растворы для двойной кристаллизации, в частности DA-HF, могут быть использованы для модернизации существующих установок, например. для устранения узких мест технологических установок ЦО, увеличения производственных мощностей при ограниченных инвестиционных затратах.
для устранения узких мест технологических установок ЦО, увеличения производственных мощностей при ограниченных инвестиционных затратах.
Каждый маршрут технологического процесса включает в себя самые современные технологические решения Prayon и собственные компоненты Profile (часть Prayon Group), такие как:
- Многокамерная конструкция реактора, позволяющая гибко и легко контролировать сульфат в секции атаки, снижая P 2 O 5 потери сульфата кальция.
- Сульфатный градиент пульпы в резервуаре для обработки или в резервуаре для конверсии, который минимизирует нерастворимые потери и/или регулирует тип кристаллов гипса.
- Уровень градиента сульфата от одной зоны к другой можно регулировать в зависимости от параметров процесса и происхождения фосфатной породы.
- Низкоуровневое мгновенное охлаждение (LLFC), которое более точно контролируется, чем воздушное охлаждение, особенно когда скорость охлаждения должна превышать номинальную мощность.

- Запатентованные мешалки Prayon, обладающие высокой эффективностью и низким энергопотреблением, что является критическим параметром для экономической устойчивости производства фосфорной кислоты.
- Фильтр с опрокидывающимся лотком Prayon, включающий в себя новейшие разработки (ячейки быстрого слива, центральный клапан, конструкция инвертирующей дорожки), который признан лучшим доступным фильтром в производстве фосфорной кислоты, обладающим высочайшей эффективностью промывки. Горизонтальные ленточные фильтры также могут использоваться для фильтрации.
Фосфорная кислота технического сорта (очищенная фосфорная кислота)
Компания Desmet Ballestra включает очистку фосфорной кислоты в свой портфель химических технологий с 2015 года, когда она получила крупный проект по производству фосфорной кислоты, включая очистку фосфорной кислоты товарного сорта.
Процесс очистки фосфорной кислоты является результатом нескольких последовательных стадий удаления с рециркуляцией для достижения целевого качества (основные удаляемые примеси включают мышьяк, гипс, тяжелые металлы, фтор, хлор) и степени извлечения.
Эффективное разделение жидкой и твердой фаз имеет решающее значение для производства фосфорной кислоты
Ответственное производство удобрений для увеличения сельскохозяйственного производства и урожайности дает преимущества во всем мире для увеличения производства продуктов питания.
Удобрение представляет собой природный или искусственный материал, который содержит не менее 5 процентов одного из трех основных питательных веществ – азота (N), фосфора (P) или калия (K). N, P и K в различных химических формах являются ключевыми питательными микроэлементами почти для всех живых организмов, особенно для улучшения сельскохозяйственных культур.
Неорганические удобрения и органические удобрения являются двумя наиболее важными источниками питательных веществ для растений. Минеральные удобрения обеспечивают выдающийся баланс питательных веществ, необходимый после использования навоза и растительных остатков, и в большинстве частей мира баланс, обеспечиваемый минеральными удобрениями, является существенным.
В то время как азот является крупнейшей отраслью удобрений, фосфор – второй по величине, а калий – наименьший. Свидетельством его размера является то, что основное природное месторождение фосфора содержит более 270 миллионов тонн добытого апатита (фосфата кальция с другими элементами). Фосфор добывают из природных месторождений полезных ископаемых, которые когда-то были отложениями на дне древних морей.
Каменный фосфат является сырьем, используемым для производства большинства коммерческих фосфатных удобрений. Фосфатную муку когда-то вносили непосредственно в кислые почвы. Однако из-за низкой доступности фосфора, высоких транспортных расходов и низкой реакции сельскохозяйственных культур в настоящее время в сельском хозяйстве используется очень мало каменного фосфата.
Переработка фосфатной породы заключается в отделении фосфата от смеси песка, глины и фосфата, которая составляет матричный слой. Содержание фосфатов улучшается за счет обогащения. Обогащенные породы можно использовать в качестве источника фосфора, но большая их часть идет на заводы по производству фосфорной кислоты. Фосфорная кислота используется как сырье для производства смешанных удобрений. Кислота также может быть дополнительно очищена и использована для пищевых подкислителей. Упрощенная технологическая схема фосфата показана ниже.
Фосфорная кислота используется как сырье для производства смешанных удобрений. Кислота также может быть дополнительно очищена и использована для пищевых подкислителей. Упрощенная технологическая схема фосфата показана ниже.
Выбор оборудования для надежного производства фосфорной кислоты
При производстве фосфорной кислоты отделение ценной жидкости от твердых отходов является важным процессом. Попытки оптимизировать эффективность и эксплуатационные расходы в этой части процесса значительно повышают ценность кислоты в конце.
Сгущение, осветление и фильтрация являются неотъемлемой частью производства фосфорной кислоты. Выбор оборудования и его размеры зависят от технологических целей заказчика, состава исходной пульпы (например, гранулометрический состав, плотность пульпы и т. д.) и общей стоимости владения в течение жизненного цикла оборудования.
Сгущение
В производстве фосфорной кислоты загустители используются для концентрирования пульпы фосфатной породы перед ее реакцией с кислотой. Благодаря характеру и свойствам минералогических характеристик фосфаты можно загущать до консистенции пасты, что снижает содержание воды и экономит затраты на кислоту.
Благодаря характеру и свойствам минералогических характеристик фосфаты можно загущать до консистенции пасты, что снижает содержание воды и экономит затраты на кислоту.
Достижение более плотного нижнего продукта снижает потери воды, обеспечивает более ценную жидкость из верхней части сгустителя и уменьшает количество необходимой серной кислоты.
Компания WesTech работала с заводами по производству фосфорной кислоты в поисках высокоэффективных загустителей и обнаружила, что как пастообразные загустители HiDensity™, так и Deep Bed™ успешно создают твердые частицы нижнего продукта с более высокой плотностью для снижения потерь воды или использования воды для обработки фосфатов.
В Марокко для обезвоживания фосфоритной руды была внедрена система пасты и сгущенных хвостов WesTech. При транспортировке породы по трубопроводу для пульпы был успешно использован пастообразный загуститель WesTech Deep Bed для получения более плотного, но при этом поддающегося перекачиванию нижнего продукта. Уменьшение содержания воды обеспечило значительную экономию затрат на серную кислоту при производстве фосфорной кислоты и уменьшило количество воды, направляемой в хвостохранилища, на целых 50 процентов.
Уменьшение содержания воды обеспечило значительную экономию затрат на серную кислоту при производстве фосфорной кислоты и уменьшило количество воды, направляемой в хвостохранилища, на целых 50 процентов.
Осветление
Осветлители удаляют мелкий гипс из продукта фосфорной кислоты, чтобы обеспечить чистую жидкость для последующих стадий производства. Основная цель осветлителя — равномерно распределить корм в резервуаре, чтобы разделение жидкой и твердой фаз происходило по всему резервуару.
Существует несколько важных факторов, определяющих правильность осветления на заводах по производству фосфорной кислоты:
- Идеальная скорость осаждения твердых частиц помогает определить оптимальную производительность кислоты. Может потребоваться добавление флокулянта, чтобы сократить время, необходимое для удаления примесей фосфорной кислоты.
- Характеристики навозной жижи и предпочтения растений определяют конструкцию отстойника: от баков с резиновой футеровкой и устойчивых к истиранию угольных кирпичей до экзотических компаундов из нержавеющей стали.

- Более эффективное осветление быстрее удаляет примеси, что приводит к более высокому качеству фосфорной кислоты и лучшему последующему удобрению.
Как для сгустителей, так и для осветлителей правильно спроектированный обечайочный колодец может рассеивать энергию и равномерно распределять поступающее сырье.
Крайне важно, чтобы и загустители, и осветлители были эффективными и экономичными. Инновационные приборы WesTech EvenFlo® Feedwell и MudMax™ помогают загустителям и осветлителям работать с максимальной эффективностью. Запатентованный питательный колодец EvenFlo обеспечивает большой поток в бак осветлителя или сгустителя в широком диапазоне скоростей потока, контролируя скорость воды, поступающей в питательный колодец, и обеспечивая равномерный поток и однородность. MudMax — это решение для надежного измерения уровня слоя, помогающее сгустителю или осветлителю обеспечивать стабильные характеристики нижнего продукта.
Узнайте, как EvenFlo может повысить производительность вашего сгустителя или осветлителя
Фильтрация
С фильтрацией на заводах по производству фосфорной кислоты наблюдается тенденция к тому, чтобы все больше и больше ленточных фильтров брали на себя большую долю функций фильтрации. Ленточные фильтры отделяют твердые частицы от жидкости, в основном используются при обезвоживании шламов в химической промышленности, горнодобывающей промышленности и при очистке воды.
Ленточные фильтры отделяют твердые частицы от жидкости, в основном используются при обезвоживании шламов в химической промышленности, горнодобывающей промышленности и при очистке воды.
По сравнению с фильтром с опрокидывающимся поддоном или настольным фильтром горизонтальные ленточные фильтры обеспечивают наивысшую эффективность фильтрации при минимальных первоначальных затратах. Они являются частью предпочтительных систем фильтрации в производстве фосфорной кислоты, поскольку они учитывают уникальные условия, существующие на заводах, а именно:
- Высокотемпературный (до 105°C для фильтрации HH)
- Высокая кислотность (40 процентов P 2 O5 )
- Среда с высоким содержанием солеотложений (в зависимости от содержания карбонатов в породах)
- Высокая гидравлическая мощность (до 3 м 3 /hm 2 фильтрующая поверхность – средняя)
- Высокая эффективность стирки
- Требуется высокий уровень обслуживания
- Максимизировать P 2 Извлечение O5
Надежная конструкция горизонтальных ленточных фильтров WesTech обеспечивает эксплуатационную гибкость, большую пропускную способность и возможность работы с агрессивными шламами, такими как фосфорная кислота. Они также лучше всего подходят для большой площади фильтрации и эффективной промывки, необходимой при производстве фосфорной кислоты.
Они также лучше всего подходят для большой площади фильтрации и эффективной промывки, необходимой при производстве фосфорной кислоты.
Снижение затрат на утилизацию сточных вод, содержащих фосфорную кислоту
Сточные воды, извлекаемые из гипсовой кладки, содержат опасные для окружающей среды загрязнители, включая остаточную фосфорную кислоту, плавиковую кислоту, кремнефтористоводородную кислоту и тяжелые металлы. Двухступенчатая система нейтрализации WesTech удаляет эти загрязняющие вещества, получая пригодную для использования заводскую воду, включая сточные воды с небольшими твердыми частицами, что обеспечивает гораздо более простую и дешевую утилизацию.
См. нашу схему двухэтапного удаления фосфатов (PDF)
Очистка любых сточных вод, которые могут включать меры по закрытию гипсовых штабелей, должна включать удаление фторидов и нейтрализацию кислоты перед сбросом. Процесс высокоплотного шлама (HDS) — это проверенная технология, разработанная для нейтрализации кислых отходов и осаждения металлов из промышленных стоков.
Процесс высокоплотного шлама (HDS) — это проверенная технология, разработанная для нейтрализации кислых отходов и осаждения металлов из промышленных стоков.
WesTech имеет опыт применения систем обработки известью с использованием процесса HDS для удаления металлов как из дренажных вод кислых пород, так и из других промышленных кислых сточных вод. Используя как лабораторные испытания, так и опыт полномасштабной установки, инженеры WesTech успешно нацелились на плавиковую кислоту, применив тот же процесс HDS к очистке сточных вод гипсовой кладки (9).0138 World Fertilizer Magazine, март 2019 г. (PDF) ). Нейтрализация кремнефтористоводородной кислоты является важной частью достижения максимальной скорости реакции, минимальной концентрации загрязняющих веществ в сточных водах и максимального использования извести в процессе производства фосфорной кислоты.
Нейтрализация плавиковой кислоты Упрощенная технологическая картаВыберите поставщика, знающего отрасль
Фосфат является ключевым питательным веществом для выращивания здоровых культур. Чтобы наилучшим образом использовать это питательное вещество, необходимо преобразовать его в фосфорную кислоту для производства удобрений, чтобы эффективно кормить растущее население мира. Однако производство фосфорной кислоты сопряжено с рядом уникальных проблем, в том числе с обращением с сильно едкой кислотой. Требуется особая осторожность на этапах сгущения, осветления и фильтрации процесса.
Чтобы наилучшим образом использовать это питательное вещество, необходимо преобразовать его в фосфорную кислоту для производства удобрений, чтобы эффективно кормить растущее население мира. Однако производство фосфорной кислоты сопряжено с рядом уникальных проблем, в том числе с обращением с сильно едкой кислотой. Требуется особая осторожность на этапах сгущения, осветления и фильтрации процесса.
Для решения сложных задач производства фосфорной кислоты, таких как создание высококачественного недорогого продукта с наименьшим количеством примесей, надежное оборудование для разделения жидкой и твердой фаз WesTech обеспечивает минимальные эксплуатационные расходы и расходы на техническое обслуживание. Более плотный нижний поток сгустителя, равномерное распределение в осветлителе и большая площадь фильтрации ленточного фильтра являются ключевыми факторами при выборе технологического оборудования на заводе по производству фосфорной кислоты.
Анализ затрат на производство фосфорной кислоты 2022
- Дом
- Все продукты
- Фосфорная кислота
Отчеты о затратах на производство фосфорной кислоты
Химические вещества
Фосфорная кислота, более известная как ортофосфорная кислота или фосфорная (V) кислота, является слабой кислотой. Обычно встречается в виде бесцветного сиропа с концентрацией 85% в воде. Фосфорная кислота обычно встречается в химических лабораториях в виде 85% водного раствора. Хоть фосфорная кислота и не соответствует строгому определению сильной кислоты, все же 85% раствор может раздражать кожу и повреждать глаза.
Обычно встречается в виде бесцветного сиропа с концентрацией 85% в воде. Фосфорная кислота обычно встречается в химических лабораториях в виде 85% водного раствора. Хоть фосфорная кислота и не соответствует строгому определению сильной кислоты, все же 85% раствор может раздражать кожу и повреждать глаза.
Фосфорная кислота в основном используется в качестве удобрений, потребляя около 90% продукции. Пищевая фосфорная кислота используется для подкисления пищевых продуктов, а также напитков, например, в различных колах и джемах, она используется для придания острого или кислого вкуса. Безалкогольные напитки, состоящие из фосфорной кислоты, иногда называют фосфатными газированными напитками или фосфатами. Некоторые из других применений фосфорной кислоты включают ее использование в антикоррозийной обработке, в качестве регулятора pH в средствах по уходу за кожей и других косметических продуктах, в топливных элементах с фосфорной кислотой и в обработке сложных полупроводников.
Procurement Resource предоставляет подробный анализ затрат на производство фосфорной кислоты . Отчет включает в себя производственный процесс с подробным описанием процессов и потоков материалов, капитальных вложений, эксплуатационных расходов, а также финансовых расходов и амортизационных отчислений. Исследование основано на последних ценах и других доступных экономических данных. Мы также предлагаем дополнительный анализ отчета с подробной разбивкой всех компонентов затрат (Детали капитальных вложений, Детали производственных затрат, Экономика для другого местоположения завода, Динамическая модель затрат).
Отчет включает в себя производственный процесс с подробным описанием процессов и потоков материалов, капитальных вложений, эксплуатационных расходов, а также финансовых расходов и амортизационных отчислений. Исследование основано на последних ценах и других доступных экономических данных. Мы также предлагаем дополнительный анализ отчета с подробной разбивкой всех компонентов затрат (Детали капитальных вложений, Детали производственных затрат, Экономика для другого местоположения завода, Динамическая модель затрат).
Производство фосфорной кислоты по процессу полугидрата
Фосфорная кислота производится с помощью этого процесса, который включает измельчение, реакцию, фильтрацию и концентрацию с помощью процесса полугидрата.
Детали: Завод в Германии 2 кв. 2022 г. От 149$9,00 долларов США
Производство фосфорной кислоты из процесса дигидрата
Фосфорная кислота производится с помощью этого процесса, который включает измельчение, реакцию, фильтрацию и концентрацию.
Детали: Завод в Германии 2 кв. 2022 г. От 149$9,00 долларов США
Аналогичные отчеты
Производство 1,2-дихлорэтана из этилена и соляной кислоты
Отчет посвящен анализу затрат на производство ЭДХ путем взаимодействия этилена и соляной кислоты с использованием метода оксихлорирования.
Детали: Завод в Германии 2 кв. 2022 г. От 149$9,00 долларов США
Производство 1,2-дихлорэтана из этилена и хлора-LTC
В данном отчете представлена структура себестоимости производства ЭДХ хлорированием этена при низких температурах.
Детали: Завод в Германии 2 кв. 2022 г. От 149$9,00 долларов США
Производство 1,2-дихлорэтана из этилена и хлора-HTC
В отчете представлен анализ затрат на производство ЭДХ из этилена и хлора.
Детали: Завод в Германии 2 кв. 2022 г. От 149$9,00 долларов США
Производство полиэтилентерефталата (ПЭТ) из терефталевой кислоты
В этом отчете представлена структура затрат на производство ПЭТ путем этерификации этиленгликоля и терефталевой кислоты.
Детали: Завод в Германии 2 кв. 2022 г. От 149$9,00 долларов США
Производство полиэтилентерефталата (ПЭТ) из DMT
Отчет содержит анализ затрат на производство ПЭТ с использованием процесса ДМТ.
Детали: Завод в Германии 2 кв. 2022 г. От 149$9,00 долларов США
Используйте наши отчеты как
ТЭО
Технико-экономические оценки
Инвестиционный анализ
Многорегиональный анализ затрат
Лидеры доверяют
Наши ценные идеи помогли компаниям в различных секторах по всему миру, позволив нам завоевать доверие крупных ТНК.
Данфосс
Джонсон и Джонсон
Юнилевер
Диверси
Герметичный воздух
Эколаб
HP
Джинан Инвестмент
Нестле
Патент СШАна способ производства фосфорной кислоты путем кристаллизации полугидрата фосфорной кислоты Патент (патент № 6,814,949 от 9 ноября 2004 г.
 )
)Изобретение относится к способу одновременного получения пищевой и кормовой фосфорной кислоты путем кристаллизации полугидрата фосфорной кислоты h4PO4×0,5h3O из предварительно очищенной исходной кислоты.
Фосфорная кислота может быть получена мокрым способом, когда минеральная кислота, обычно серная кислота, реагирует с концентратом фосфата кальция, в результате чего образуется разбавленная фосфорная кислота, содержащая приблизительно 30% P2O5, и образуется осадок сульфата кальция. После фильтрации кислота содержит анионные примеси многих видов, такие как сульфатные и фторсодержащие соединения, а также катионные примеси, из которых наиболее значительными являются железо, алюминий, магний и кальций, а также органические примеси. Количество и тип примесей зависят прежде всего от сырого фосфата, используемого в качестве сырья.
В типичном мокром процессе серная кислота вступает в реакцию с концентратом фосфата кальция. При отделении образовавшегося гипса фильтрованием получают кислоту, содержащую примерно 30% Р2О5, которую дополнительно концентрируют до концентрации примерно 50-55% Р2О5. Большая часть примесей фосфатного концентрата остается в фосфорной кислоте, и поэтому эта кислота обычно используется только в качестве сырья для удобрений.
Большая часть примесей фосфатного концентрата остается в фосфорной кислоте, и поэтому эта кислота обычно используется только в качестве сырья для удобрений.
Для очистки влажной фосфорной кислоты было разработано множество способов очистки, чтобы снизить концентрацию примесей до таких уровней, чтобы кислоту можно было использовать даже для целей, отличных от приготовления удобрений. Известные процессы очистки включают экстракцию растворителем, осаждение с помощью растворителя, непрямую очистку и методы ионного обмена.
Преобладающий метод получения чистой фосфорной кислоты пищевого или промышленного качества заключается в отделении примесей от кислоты мокрого способа путем экстракции органическим растворителем (Дэвистер, А., Мартин, Г., Из влажной неочищенной фосфорной кислоты). кислоты в продукты высокой чистоты, Proc. Fertilizer Soc., (1981), № 201).
Фосфорную кислоту также получают в термической печи, в которой элементарный фосфор получают из сырого фосфата и углерода, а элементарный фосфор сжигают до пятиокиси фосфора и гидролизуют до чистой фосфорной кислоты. Этот процесс является дорогостоящим и энергоемким.
Этот процесс является дорогостоящим и энергоемким.
Известны также способы очистки фосфорной кислоты путем кристаллизации. Во многих из этих способов сначала получают промежуточное соединение, такое как фосфат мочевины (DE-A-25 11 345) или фосфат анилина (WO 97/00714), который в дальнейшей реакции образует фосфорную кислоту и рециклируемый реагент или побочный продукт. Эти способы лучше подходят для получения фосфатных солей, т.е. фосфорнокислого аммония, чем для получения фосфорной кислоты.
Для улучшения этих процессов были разработаны процессы, в которых сама фосфорная кислота кристаллизуется либо в виде полугидрата, h4PO4×0,5h3O, (EP-B1 0 209920) или в безводной форме h4PO4 (GP-A 2 078 694). В этих процессах результат очистки был не очень хорошим, или требовалась очень сильная кислота (68% P2O5). В российском патенте (RU-C1-2059570) описан способ кристаллизации, при котором достаточно чистая пищевая фосфорная кислота получается только за четыре кристаллизации. Также известны процессы (заявка JP 3-237008 и заявка JP 3-193614), в которых кислоту для электроники получают путем кристаллизации фосфорной кислоты из фосфорной кислоты пищевого качества.
Кормовую фосфорную кислоту обычно получают из кислоты мокрого способа путем осаждения с помощью различных процессов осаждения ионов, вредных с точки зрения целевого использования, и путем отделения осадков от кислоты. При необходимости кислоту концентрируют до нужной концентрации.
В процессах экстракции или кристаллизации требуется предварительная обработка для удаления твердых частиц и ионов, плохо удаляемых в процессе. Часто возникает проблема отдельной стадии процесса и побочного потока, содержащего примеси, для которого необходимо найти какую-то целенаправленную утилизацию.
Из литературы известен ряд процессов, посредством которых отдельные ионы (например, As, SO4) осаждаются из фосфорной кислоты.
Существует множество способов удаления магния из фосфорной кислоты (патент FI 95905, патент США № 3642439, патент США № 4299804, патент США № 4243643 и патент США № 3819810). Методы требуют отдельных процессов и обычно производят побочный продукт. Также было предложено удалять магний из концентрата, например, путем предварительного выщелачивания (Chemical Engineering, 19 сентября). 92, с. 23). В этом случае также требуется отдельный многоэтапный процесс. Однако, согласно Беккеру (Pierre Becker, Phosphates and Phosphoric acid, Raw Materials, Technology and Economics of the Wet Process, 1983, p. 432), не существует простого и экономичного метода удаления магния из фосфорной кислоты.
92, с. 23). В этом случае также требуется отдельный многоэтапный процесс. Однако, согласно Беккеру (Pierre Becker, Phosphates and Phosphoric acid, Raw Materials, Technology and Economics of the Wet Process, 1983, p. 432), не существует простого и экономичного метода удаления магния из фосфорной кислоты.
При получении очищенных фосфорных кислот возникает ряд проблем. Термический процесс имеет недостатки, связанные с высоким потреблением энергии и дополнительным оборудованием для предотвращения вредных выбросов в окружающую среду. Для извлечения требуется большая установка, чтобы сложный процесс был прибыльным. Многие новые процессы имели проблемы с достижением достаточно высокого качества.
В процессах очистки обычно образуются проблемные побочные потоки, содержащие большое количество примесей, и эти потоки необходимо обрабатывать отдельно для получения побочных продуктов или вывозить на свалку.
В процессах, использующих рециклируемые реагенты для экстракции или осаждения, отработанный реагент необходимо регулярно заменять свежим реагентом. Кроме того, всегда существует вероятность того, что в продукте останутся токсичные или другие вредные остатки химического вещества.
Кроме того, всегда существует вероятность того, что в продукте останутся токсичные или другие вредные остатки химического вещества.
В процессах кристаллизации фосфорной кислоты очистка требует нескольких стадий (4-5) для достижения пищевого качества. Кристаллизация безводной фосфорной кислоты, h4PO4, дополнительно имеет тот недостаток, что требуется высокая концентрация (>68% P2O5) в исходном материале, что сильно увеличивает вязкость содержащей примеси кислоты.
Целью настоящего изобретения является создание нового способа, в котором посредством развития мокрого способа производится достаточно чистая крепкая фосфорная кислота, из которой получают как фосфорную кислоту пищевого качества, так и фосфорную кислоту. подходит для производства кормов для животных.
Вышеупомянутые цели изобретения в настоящее время достигаются с помощью процесса нового типа, который включает стадию предварительной обработки, на которой содержание магния, мышьяка и сульфата регулируется до уровней, подходящих для конечных продуктов. Если уровни примесей, например, уровни ионов Mg и As, уже достаточно низки, предварительную обработку в отношении них можно не проводить. Уровень магния предпочтительно регулируют в связи с концентрированием. Уровни мышьяка и сульфата регулируются в связи с мокрым процессом. При концентрировании фтор испаряется до необходимого уровня, когда кислота является достаточно чистой и молярное соотношение F/Si<6. Перед подачей кислоты на кристаллизацию фосфорной кислоты удаляют выпавший из нее при обработке гипс; это улучшает как работу кристаллизации, так и качество кормовой кислоты.
Если уровни примесей, например, уровни ионов Mg и As, уже достаточно низки, предварительную обработку в отношении них можно не проводить. Уровень магния предпочтительно регулируют в связи с концентрированием. Уровни мышьяка и сульфата регулируются в связи с мокрым процессом. При концентрировании фтор испаряется до необходимого уровня, когда кислота является достаточно чистой и молярное соотношение F/Si<6. Перед подачей кислоты на кристаллизацию фосфорной кислоты удаляют выпавший из нее при обработке гипс; это улучшает как работу кристаллизации, так и качество кормовой кислоты.
Кислоты конечного продукта получают путем кристаллизации в процессе полугидрата фосфорной кислоты, и продукт, перекристаллизованный таким образом, пригоден для использования в пищевых продуктах, а маточный раствор процесса пригоден для использования в кормах для животных.
Основные характеристики способа согласно изобретению приведены в прилагаемых пунктах 1-10 формулы изобретения.
Таким образом, в соответствии с изобретением предложен способ получения пищевой фосфорной кислоты путем кристаллизации полугидрата фосфорной кислоты, h4PO4×0,5h3O, из предварительно очищенной исходной кислоты, при этом исходная кислота, используемая для кристаллизации, очищается. с помощью следующих шагов,
с помощью следующих шагов,
а) после стадии пенной флотации фосфатного концентрата концентрат направляют на стадию сильномагнитной сепарации с целью снижения концентрации ионов Mg,
б) фосфатный концентрат выщелачивают в смеси серной кислоты и фосфорной кислоты по мокрому способу, удаляют осажденные ионы SO4 и As и добавляют источник кремния, чтобы довести молярное соотношение F/Si до <6,
c) фосфорную кислоту концентрируют, твердые вещества осадок удаляют, а ионы F испаряют,
d) исходная кислота, полученная на этапе c, с концентрацией P2O5 >58%, концентрацией твердых веществ <0,05%, концентрацией ионов Mg <1,5%, концентрацией ионов SO4 <1%, концентрацией ионов As <8 частей на миллион и концентрации ионов F <0,2%, кристаллизуется при устойчивой скорости роста кристаллов <10 мкм/мин, что соответствует <25 мас.% кристаллов/час, когда затравочные кристаллы добавляются в количестве не более 2% в виде 40%-ной суспензии кристаллов, имеющей концентрацию ионов Fe <500 частей на миллион и размер затравочных кристаллов <200 мкм, при этом разница температур при первой кристаллизации составляет <17°С, и кристаллы промывают недонасыщенным маточным раствором. щелок последующей стадии перекристаллизации,
щелок последующей стадии перекристаллизации,
e) фосфорную кислоту, кристаллизованную на стадии d, расплавляют, разбавляют до концентрации P2O5 <63%, добавляют затравочные кристаллы и проводят кристаллизацию, как на стадии d, при разнице температур <8°C, и кристаллы промывают недонасыщенным раствором фосфорной кислоты, и
f) необязательно фосфорную кислоту, кристаллизованную на этапе e, расплавляют, разбавляют до концентрации P2O5 <63%, добавляют затравочные кристаллы и проводят кристаллизацию как и на стадии d, при разнице температур <6°C, и кристаллы промывают недонасыщенным промывочным раствором, приготовленным из кристаллов продукта.
В фосфатной цепи, которая начинается на руднике и заканчивается фосфорнокислотными продуктами, вносятся такие изменения, что вместо фосфорной кислоты на удобрение получаются два потока, причем более чистый из них подходит для пищевых продуктов. фосфорной кислоты (Official Journal of the European Communities, No. L339/59-60, (20 Dec. 1996) E338 Phosphoric Acid) и полученной в качестве маточного раствора, отвечающей требованиям, предъявляемым к кормовым фосфатам для животных (Chemical Economics Handbook, SRI Международный, 19 ноября97; Корма для животных, фосфатные добавки). Кислоты, конечно, также могут быть использованы для получения других продуктов, например моющие фосфаты. Процесс кристаллизации не производит отходов; весь подаваемый материал может быть преобразован в продукцию с более высокой добавленной стоимостью.
1996) E338 Phosphoric Acid) и полученной в качестве маточного раствора, отвечающей требованиям, предъявляемым к кормовым фосфатам для животных (Chemical Economics Handbook, SRI Международный, 19 ноября97; Корма для животных, фосфатные добавки). Кислоты, конечно, также могут быть использованы для получения других продуктов, например моющие фосфаты. Процесс кристаллизации не производит отходов; весь подаваемый материал может быть преобразован в продукцию с более высокой добавленной стоимостью.
В производственной цепочке согласно изобретению предпочтительно удалять магний, чтобы облегчить концентрирование фосфорной кислоты и удаление фтора, а также для предотвращения осаждения фосфата магния (патент FI 95905) при кристаллизации фосфорной кислоты.
Хотя можно использовать концентраты, содержащие даже более 2% MgO, технически и экономически выгодно, если концентрат содержит <1,2% MgO. Вместо того, чтобы удалять магний из фосфорной кислоты в отдельном процессе, концентрация фосфата была сделана более эффективной, так что полученное качество было достаточно высоким для дальнейшего процесса. Для процессов пенной флотации характерно, что выход фосфора в большей степени теряется на завершающей стадии очистки.
Для процессов пенной флотации характерно, что выход фосфора в большей степени теряется на завершающей стадии очистки.
Таким образом, было установлено, что добавление сильномагнитного сепаратора в конце цикла пенной флотации обеспечивает высокое качество концентрата и высокий выход. Концентрацию фосфата пенной флотацией можно оставить в диапазоне, при котором выход все еще остается хорошим, а требуемая чистота достигается магнитной сепарацией. Эффективность разделения обычно оптимизируется за счет силы магнитного поля, скорости потока и адаптации проницаемости матрицы к той, которая подходит для распределения частиц по размерам в исходном материале. Потери фосфора можно свести к минимуму за счет соответствующей корректировки промывок.
В соответствии с изобретением при магнитном разделении используется плотность магнитного потока не менее 1 Тесла, предпочтительно 1-3 Тесла.
К другим преимуществам магнитной сепарации относятся простота процесса, небольшие инвестиции и низкие эксплуатационные расходы. При магнитной сепарации не образуется трудноутилизируемый поток отходов, а отделенные минералы находятся в своей первоначальной форме и, таким образом, пригодны для объединения с концентратом песка, выходящим из процесса пенной флотации. Другие примеси (например, Fe, Al) также удаляются при очистке в дополнение к магнию. Обычно концентрат после обработки содержит примерно 37% P2O5 и <0,8% MgO.
При магнитной сепарации не образуется трудноутилизируемый поток отходов, а отделенные минералы находятся в своей первоначальной форме и, таким образом, пригодны для объединения с концентратом песка, выходящим из процесса пенной флотации. Другие примеси (например, Fe, Al) также удаляются при очистке в дополнение к магнию. Обычно концентрат после обработки содержит примерно 37% P2O5 и <0,8% MgO.
При получении фосфорной кислоты апатитовый концентрат выщелачивают по мокрому способу в смеси серной и фосфорной кислот и отделяют образовавшийся гипс. Образовавшаяся кислота имеет концентрацию примерно 28% P2O5. Более чистый концентрат на этой стадии дает более чистую кислоту, которую легче фильтровать.
Затем фосфорную кислоту концентрируют. Кальций (например, в виде апатита) добавляют к кислоте, содержащей приблизительно 40% P2O5, причем кальций осаждает сульфат до гипса. Сульфат удаляют для того, чтобы кислоту было легче концентрировать и чтобы в кормовой кислоте не оставалось сульфата как наполнителя. Утилизация отделившегося гипса не представляет проблемы, так как при мокром способе гипс образуется даже иначе. Сульфид, например, в виде сульфида натрия, дозируется в соответствии с необходимостью доведения уровня мышьяка в кислоте до желаемого уровня. Также другие тяжелые металлы, т.е. медь, может быть осаждена в то же время.
Утилизация отделившегося гипса не представляет проблемы, так как при мокром способе гипс образуется даже иначе. Сульфид, например, в виде сульфида натрия, дозируется в соответствии с необходимостью доведения уровня мышьяка в кислоте до желаемого уровня. Также другие тяжелые металлы, т.е. медь, может быть осаждена в то же время.
Кислоту, полученную на предыдущей стадии, концентрируют, и осадок, содержащий в основном гипс, отделяют от горячей кислоты (60-80°С) центрифугированием и/или фильтрованием. После этой стадии концентрация кислоты составляет приблизительно 58-60% P2O5, содержание твердых веществ <0,05% и содержание фтора <0,18% F.
Полученную кислоту используют в качестве сырья на стадии кристаллизации фосфорной кислоты. Сначала кислоту охлаждают с помощью теплообменника до температуры, подходящей для кристаллизации. Используемой охлаждающей жидкостью может быть вода и/или холодный маточный раствор, выходящий из процесса кристаллизации. Зимой может быть предпочтительнее подогрев маточного раствора для предотвращения переохлаждения, например, при транспортировке
Охлажденную кислоту, насыщенную по полугидрату фосфорной кислоты, h4PO4×0,5h3O, подают в кристаллизатор. Кристаллизацию проводят, добавляя приблизительно 2% затравочных кристаллов и охлаждая с подходящей скоростью до тех пор, пока не образуется достаточное количество кристаллов (30-50%). Полученные кристаллы плавят и перекристаллизовывают по меньшей мере один раз, обычно дважды.
Кристаллизацию проводят, добавляя приблизительно 2% затравочных кристаллов и охлаждая с подходящей скоростью до тех пор, пока не образуется достаточное количество кристаллов (30-50%). Полученные кристаллы плавят и перекристаллизовывают по меньшей мере один раз, обычно дважды.
Чтобы процесс кристаллизации функционировал технически хорошо и чтобы очистка кислоты была достаточной, условия должны находиться в определенных точных пределах. Наиболее важными изобретательскими факторами, связанными со стадией кристаллизации способа по изобретению, являются:
Элементы, изоморфные фосфору (например, As, Cr, V), и ионы, образующие сильные комплексы с фосфорной кислотой (например, Fe), включаются в кристаллы, если только скорость кристаллизации не является достаточно низкой. Требуется достаточное время пребывания (примерно 2 ч), чтобы не превысить критическую скорость роста, которая также поддерживается постоянной при периодической кристаллизации. Когда затравочные кристаллы обычно имеют размер <100 мкм и типичный размер кристаллов кристаллического продукта составляет приблизительно 0,7 мм, средняя скорость роста кристаллов, полученная при времени пребывания в два часа, составляет приблизительно 5 мкм/мин.
Чтобы избежать кристаллизации на стенках, разница температур между суспензией кристаллов и хладагентом на 1-й, 2-й и 3-й стадиях кристаллизации не должна превышать 17°С, 8°С и 6°С. , выгодно, если разность температур в начале кристаллизации меньше, так как площадь поверхности роста еще не достаточна.
Важным моментом на стадиях кристаллизации в способе согласно изобретению является уделение особого внимания промывке. Маточный раствор последующей стадии кристаллизации используют для промывки. Степень насыщения устанавливают несколько недонасыщенной, позволяя насыщенному маточному раствору нагреться примерно до 5°С. На последней стадии используют промывной раствор, который готовят из кристаллов продукта и соответственно доводят до ненасыщенности. Поскольку промывочные кислоты могут быть повторно использованы в процессе в качестве сырья, всегда можно выполнить промывку в достаточном количестве, чтобы как можно лучше удалить загрязненный маточный раствор, присутствующий в кристаллической лепешке. Типичное количество приблизительно в 1,5 раза превышает количество маточного раствора в лепешке, что обычно составляет приблизительно 10-30% веса лепешки. Высокая вязкость (>2000 сП) суспензий кристаллов ухудшает результат промывки, так как кристаллы начинают слипаться друг с другом (агломерировать), в этом случае они заключают внутри себя маточный раствор, который невозможно удалить промывкой.
Типичное количество приблизительно в 1,5 раза превышает количество маточного раствора в лепешке, что обычно составляет приблизительно 10-30% веса лепешки. Высокая вязкость (>2000 сП) суспензий кристаллов ухудшает результат промывки, так как кристаллы начинают слипаться друг с другом (агломерировать), в этом случае они заключают внутри себя маточный раствор, который невозможно удалить промывкой.
Затравочные кристаллы получают из фосфорной кислоты, содержащей более 60% P2O5 и <500 ppm Fe. Более высокое содержание железа, чем это в затравочной кислоте, значительно снижает качество образующихся кристаллов продукта. Полученную суспензию затравочных кристаллов, которая содержит примерно 30-40% кристаллов с размером кристаллов <200 мкм, используют в количестве примерно 3-5% от количества сырья для кристаллизации. Таким образом, настоящие затравочные кристаллы используются в количестве примерно 1-2%. Таким образом, кристаллы продукта или их кусочки не подходят для затравки, так как их поверхность, вероятно, загрязнена. Только на тех стадиях кристаллизации, на которых сырье не менее чисто, чем затравка кристалла (например, 3-я кристаллизация), также может происходить самопроизвольное зародышеобразование.
Только на тех стадиях кристаллизации, на которых сырье не менее чисто, чем затравка кристалла (например, 3-я кристаллизация), также может происходить самопроизвольное зародышеобразование.
Наиболее подходящие условия для стадий кристаллизации способа согласно изобретению собраны в таблице 1.
ТАБЛИЦА 1 Предпочтительные условия кристаллизации 1-й кристалл- 2-й кристалл- 3-й кристалл- лизация лизация лизация Концентрация сырья, P2O5 % 58-61 60-63 60-63 Температура шлама/охлаждающей жидкости <17 <8 <6 разница, °С. Время пребывания, ч 1,5-3 1,5-3 1,5-3 Кристалл процент 25-40 35-50 30-45 Количество посевной жижи, % от корма 3-4 3-4 3-4 Скорость роста кристаллов, мкм/мин 4-8 5-10 5-10
РИС. 1 представлена схема способа согласно изобретению получения пищевой и кормовой фосфорной кислоты.
РИС. 2 представлена справочная схема получения фосфорной кислоты для удобрений.
Способ согласно изобретению получения пищевой и кормовой фосфорной кислоты имеет следующие преимущества по сравнению с другими способами:
В производственной цепочке не образуются трудноудаляемые отходы; концентрат песка, поступающий с магнитной сепарации, и гипс, подлежащий сепарации, могут быть объединены с обычными потоками производственной цепочки.
При кристаллизации все примеси (катионы, анионы, органика, красители) отделяются одновременно, поэтому для выделения определенных ионов не требуется отдельных технологических операций.
Качество пищевой кислоты, полученной с помощью этого процесса, во многих отношениях (в частности, тяжелые металлы и органические вещества) явно выше, чем качество соответствующих кислот на рынке
Инвестиции невелики, поскольку значительная часть оборудования требуется уже существует (например, единицы концентрации). Дополнительное оборудование легко разместить на существующей установке
Производство не требует оборотных дополнительных химикатов, требующих отдельной обработки (например, органических химикатов для выщелачивания или осаждения), эффективность которых со временем снижается и их необходимо заменять.
Энергозатраты в процессе низкие, так как выходящий холодный маточный раствор охлаждает сырье, поступающее на кристаллизацию. Поскольку теплота, выделяющаяся при образовании кристаллов при кристаллизации, равна теплоте, необходимой для их плавления, эти потоки также компенсируют друг друга.
Эксплуатационные затраты процесса низкие, поскольку магнитная сепарация в больших масштабах потребляет почти столько же энергии, сколько и в малых.
В остальной части предварительной обработки используются вещества, естественно относящиеся к процессу (апатит, силикат) или экономичные потоки отходов (сульфид натрия).
При кристаллизации не образуется отходов, требующих отдельной обработки.
Требуется очень небольшое количество обслуживающего персонала, поскольку все частные факторы процесса (магнитная сепарация, кристаллизация, фильтрация, плавление) известны и надежны.
Из-за небольших капиталовложений и низких эксплуатационных расходов получение пищевой кислоты, реализуемое с помощью такого интегрированного процесса, как этот, выгодно в гораздо меньших масштабах, чем, например, при использовании преобладающей технологии экстракции.
Подходит для интегрированного производства, в котором несколько сортов продукта получают только путем регулирования производительности процесса, количества перекристаллизаций или отбора кислоты с разных промежуточных стадий.
Процесс также является процессом концентрирования, при котором возможны все концентрации <66% P2O5.
Благодаря повышенной эффективности очистки выход процесса кристаллизации выше или, соответственно, качество лучше, чем в процессах, ранее описанных в литературе.
Процесс может выполняться как в периодическом режиме, так и в непрерывном режиме.
С точки зрения экономики важно, чтобы потери фосфора были минимальными и происходили на как можно более ранней стадии производственной цепочки. Поэтому предпочтительно удалять примеси уже на этапе концентрирования в виде природных стабильных минералов вместо того, чтобы осаждать примеси в виде соединений, которые, возможно, даже придется вывозить на свалку. В процессе кристаллизации фосфорной кислоты выход продукта составляет 100%, так как оба потока, выходящие из процесса, являются продуктами.
Проценты в настоящем описании и прилагаемой формуле изобретения являются весовыми процентами, если не указано иное.
ПРИМЕР 1
Фосфатный концентрат в виде суспензии с содержанием твердых веществ приблизительно 30% подавали в сильномагнитный сепаратор. Сила магнитного поля составляла 1,7 Тесла. Типы и количества корма и продукта указаны в таблице 2.
ТАБЛИЦА 2 Фосфат Очищенный фосфат сконцентрироваться на из магнитного Уступить в магнитная сепарация разделение товар Масса % 95,0 Р2О5, % 36,1 37,5 98,4 К2О, % 0,14 0,10 66,9 МgО, % 1,26 0,62 46,8 Na2O, % 0,31 0,30 93,2 SiO2, % 1,93 0,90 44.1 Fe2O3, % 0,6 0,3 45,6 Al2O3, % 0,3 0,2 59,2 СаО, % 49,9 51,0 96,9 СО2, % 4.7 4.1 82,6 ПРИМЕР 2
Фосфатный концентрат из другого рудного месторождения, содержащий 37,5% P2O5 и 1,83% MgO, обрабатывали в виде 25%-ного шлама в магнитном поле 2,0 Тл. Выход фосфора составил 95,3 % в очищенном продукте, который содержал 38,4 % P2O5 и 1,0 % MgO. Магнитный побочный продукт содержал 23,7 % P2O5 и 11,7 % MgO.
Выход фосфора составил 95,3 % в очищенном продукте, который содержал 38,4 % P2O5 и 1,0 % MgO. Магнитный побочный продукт содержал 23,7 % P2O5 и 11,7 % MgO.
ПРИМЕР 3
Фосфорную кислоту мокрого способа (27% P2O5) концентрировали до концентрации 40% P2O5. Фосфатный концентрат добавляли в количестве 1% для осаждения сульфата в виде гипса с пребыванием в течение 1 часа при 50°С. Молярное отношение F/Si в фосфорной кислоте доводили до <6 путем добавления растворимого источника кремния. Осажденный гипс фильтровали перед концентрированием до >58% P2O5. Фосфорную кислоту концентрировали и твердые вещества, образующиеся при концентрировании, отделяли. Кислота, приготовленная таким образом, содержала 58,5 % P2O5, 0,15 % F и менее 0,05 % твердых веществ.
ПРИМЕР 4
Фосфорную кислоту, предварительно обработанную по примерам 1 и 3, кристаллизовали в 110-литровом кристаллизаторе непрерывного действия при времени пребывания 1,8 часа и перекристаллизовывали при времени пребывания 1,7 и 2,2 часа. . На каждом этапе использовалось приблизительно 4% суспензии затравочных кристаллов (<20 частей на миллион Fe). Общий выход процесса составил примерно 30%. В таблице 3 приведены анализы образовавшихся промежуточных и конечных продуктов.
. На каждом этапе использовалось приблизительно 4% суспензии затравочных кристаллов (<20 частей на миллион Fe). Общий выход процесса составил примерно 30%. В таблице 3 приведены анализы образовавшихся промежуточных и конечных продуктов.
ТАБЛИЦА 3 Первый
Второй кристалл
кристалл
Третий кристалл
Процесс Кормовая кислота
товар
товар
товар
маточный раствор Р2О5, %
61
64,2
64,7
64,6
58,4 Как, м.д.
0,3
0,1 <0,1
<0,1
0,4 Ф, м.д.
1700
80
10
<10
2000 г. Cl, м.д.
<10
<10
<10
<10
<10 NO3, млн
6
<5
<5
<5
9SO4, м.д.
3000
192
36
30
4200 Al, м.д.
1200
100
11
2
1700 Ca, м.д.
300
27
3
<2
460 Cr, м.д.
3
0,5
<0,3
<0,3
3,7 Cu, м.д.
0,7
<0,4
<0,2
<0,2
1.1 Fe, м.д.
4500
600
70
16,6
5700 мг, м.д.
7000
450
47
8
10300 Мн, м.д.
500
44
4
<2
720 Ni, м. д.
4
0,3 <0,2
<0,2
5.7 Cd, м.д.
0,3
<0,1
<0,1
<0,1
0,5 В, м.д.
10
2,5
0,3
<0,2
13,5 Сухой остаток, %
<0,05 ПРИМЕР 5
д.
4
0,3 <0,2
<0,2
5.7 Cd, м.д.
0,3
<0,1
<0,1
<0,1
0,5 В, м.д.
10
2,5
0,3
<0,2
13,5 Сухой остаток, %
<0,05 ПРИМЕР 5
Фосфорную кислоту, предварительно обработанную в соответствии с примерами 1 и 3, кристаллизовали в 110-литровом кристаллизаторе непрерывного действия с временем пребывания 2,7 часа и дважды перекристаллизовывали с временем пребывания 1,1 и 2,2 часа. Общий выход процесса составил примерно 25%. На каждом этапе использовалось приблизительно 4% суспензии затравочных кристаллов (<20 частей на миллион Fe). Чистую полученную кислоту разбавляли водой до конечной концентрации 55,8% P2O5. В таблице 4 показаны анализы исходной кислоты и конечных продуктов.
ТАБЛИЦА 4 Кормовая кислота
Кислота чистого продукта
Процесс маточного раствора Р2О5, %
58
55,8
55,5 Как, м.д.
0,3 <0,1
<0,2 Ф, м. д.
1500
3
0,21 ТМ, м.д.* <10 Cl, м.д.
8
<10
<10 NO3, млн
<5
<5
13 SO4, м.д.
4200
30
5400 Al, м.д.
1500
5
1800 Ca, м.д.
240
<2
310 Cr, м.д.
3.3
<0,3
3,6 Cu, м.д.
<0,4
<0,2
<0,4 Fe, м.д.
4000
17.1
5000 мг, м.д.
7900
9
9800 Мн, м.д.
570
<2
710 Ni, м.д.
4.3
<0,2
5,8 Zn, г/т 0,93 Pb, м.д. <0,1 Cd, м.д.
0,3
<0,1
0,4 рт.ст., м.д.
<0,01 В, м.д.
11,4
<0,2
14.3 летучие кислоты, 0,024 &mgr;экв/г Сухой остаток, %
<0,05 *сумма тяжелых металлов в соответствии с Кодексом пищевых химикатов (1997, США) ПРИМЕР 6
д.
1500
3
0,21 ТМ, м.д.* <10 Cl, м.д.
8
<10
<10 NO3, млн
<5
<5
13 SO4, м.д.
4200
30
5400 Al, м.д.
1500
5
1800 Ca, м.д.
240
<2
310 Cr, м.д.
3.3
<0,3
3,6 Cu, м.д.
<0,4
<0,2
<0,4 Fe, м.д.
4000
17.1
5000 мг, м.д.
7900
9
9800 Мн, м.д.
570
<2
710 Ni, м.д.
4.3
<0,2
5,8 Zn, г/т 0,93 Pb, м.д. <0,1 Cd, м.д.
0,3
<0,1
0,4 рт.ст., м.д.
<0,01 В, м.д.
11,4
<0,2
14.3 летучие кислоты, 0,024 &mgr;экв/г Сухой остаток, %
<0,05 *сумма тяжелых металлов в соответствии с Кодексом пищевых химикатов (1997, США) ПРИМЕР 6
Фосфорную кислоту кристаллизовали порцией в резервуаре-кристаллизаторе емкостью 0,6 м3 в течение 2 часов. Суспензию затравочных кристаллов использовали в количестве 3% (250 частей на миллион Fe). Разница температур между суспензией кристаллов и охлаждающей жидкостью первоначально составляла 4°С, а в конце 8°С, следуя кривой устойчивого роста кристаллов. Количество кристаллов составляло 41%, а размер кристаллов составлял приблизительно 1 мм.
Количество кристаллов составляло 41%, а размер кристаллов составлял приблизительно 1 мм.
При перекристаллизации время пребывания в первом случае составляло 5 часов, при этом суспензию затравочных кристаллов использовали в количестве 3%, а разницу температур поддерживали постоянной (6°С). Размер кристаллов составлял примерно 1 мм. Во втором случае время пребывания составляло три часа, а температура соответствовала кривой устойчивого роста кристаллов (2…6°С). В обоих случаях количество кристаллов составляло 31%, кристаллы отделяли центрифугой и для промывки кристаллов использовали промывной раствор в количестве 12,5% от количества кристаллов. Общий выход процесса составил приблизительно 35%. В таблице 5 показаны условия периодической кристаллизации.
ТАБЛИЦА 5 Получение пищевой кислоты методом периодической кристаллизации в две стадии 2-й
2-й
2-й
2-й 2-й
2-й
1-й
1-й
кристалл-
кристалл-
кристалл-
кристалл- 1-й
кристалл-
кристалл-
кристалл-
кристалл-
лизация
лизация
лизация
лизация кристалл-
лизация
лизация
лизация
лизация
подача
товар
подача
товар лизация
Случай 1
Случай 2
подача
товар
Случай 1
Случай 1
Случай 2
Случай 2 Резиденция
2
5
3 время, ч Семенная суспензия
3
3
3 Температура
4 . . . 8
6
2 . . . 6 разница Р2О5, % 60,8
65,962,1
65,7
62,2
66,5 Fe, м.д. 4300
230
230
19
150
7 Ф, м.д. 1600
42
36 <10
13
<10 Сухой остаток, %
41
31
31
<0,05 — — Плотность, г/дм3
1750 1721
1710 1678 1692 Вязкость, сП
350
158
145
75 67 84 Температура
7.1 16,6
57 41 24 ПРИМЕР 7
. . 8
6
2 . . . 6 разница Р2О5, % 60,8
65,962,1
65,7
62,2
66,5 Fe, м.д. 4300
230
230
19
150
7 Ф, м.д. 1600
42
36 <10
13
<10 Сухой остаток, %
41
31
31
<0,05 — — Плотность, г/дм3
1750 1721
1710 1678 1692 Вязкость, сП
350
158
145
75 67 84 Температура
7.1 16,6
57 41 24 ПРИМЕР 7
Содержание магния в фосфорной кислоте марокканского происхождения уменьшали путем концентрирования и кристаллизации фосфата магния в соответствии с патентом FI 95905. Очищенную кислоту разбавляли водой до 62,9% P2O5, кристаллизовали один раз путем добавления в количестве 6% – суспензия затравочных кристаллов (<20 ppm Fe), изготовленная из чистой фосфорной кислоты. Во время кристаллизации проводят охлаждение от 23°С до 7°С в течение пяти часов. Разница температур между суспензией кристаллов и хладагентом составляла 7°С. Вязкость суспензии кристаллов составляла 7500 сП, кристаллы отделяли в центрифуге, выход кристаллического продукта составлял 55%.


 шлаки
шлаки Наиболее распространены схемы с использованием аппаратов БГС, конструкция которых непрерывно совершенствуется. На рисунке 12.7 представлена технологическая схема производства двойного суперфосфата поточным методом с аппаратом БГС производительностью 180 тыс. тонн в год.
Наиболее распространены схемы с использованием аппаратов БГС, конструкция которых непрерывно совершенствуется. На рисунке 12.7 представлена технологическая схема производства двойного суперфосфата поточным методом с аппаратом БГС производительностью 180 тыс. тонн в год.
