Протекторная защита металлов от коррозии: Протекторная защита металлов от коррозии
alexxlab | 21.04.2023 | 0 | Разное
24.Коррозия. Протекторная защита металлов от коррозии.
Корро́зия — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде.
По типу агрессивных сред, в которых протекает процесс разрушения, коррозия может быть следующих видов:
1)газовая коррозия;
2)атмосферная коррозия;
3)коррозия в неэлектролитах;
4)коррозия в электролитах;
5)подземная коррозия;
6)биокоррозия;
6)коррозия под воздействием блуждающих токов.
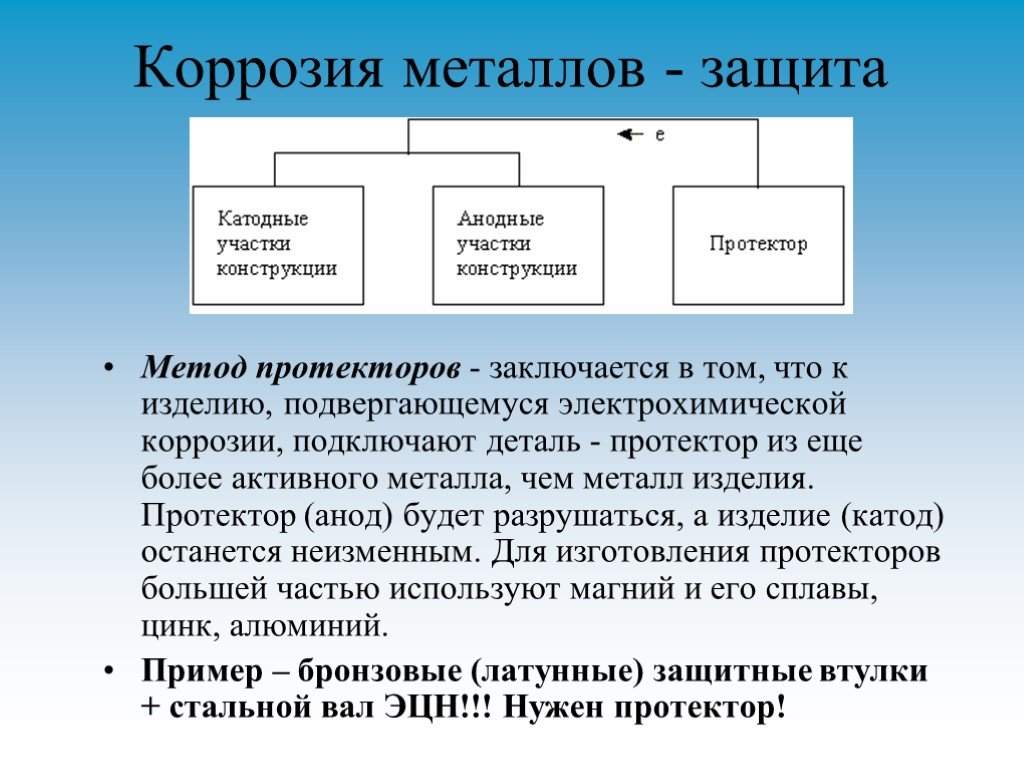
Протекторная
защита металла — способ антикоррозионной защиты,
при котором защищаемой поверхности
необходимо обеспечить контакт с более
активным металлом (ссылка).
Из механизма коррозии металла, следует, что более активный металл начинает испускать электроны и присоединять к образовавшимся ионам гидроксильной группы из раствора электролита, а другой, менее активный, будет принимать электроны, присоединяя их к своим ионам. В результате, более активный металл — анод — будет окисляться, а менее активный металл — катод восстанавливаться. Таким образом, анод будет защищать от коррозии.
Для реализации протекторной защиты необходимо обеспечить соприкосновение самого протектора с чистой поверхностью защищаемого металла См. Рис. 1.
Если
на эту конструкцию будет воздействовать
внешняя среда, то электроны протектора
будут переходить в защищаемый металл
и на катоде начнется выделение водорода.
Ионы протектора, соединяясь с кислородом
(гидроксильными группами OH), вызывают
окислительную реакцию, которая приводит
к появлению гидроокиси того металла,
из которого сделан протектор.
Среди лакокрасочных материалов выделят класс протекторных грунтовок (цинконаполненных или цинкосодержащих). Применение данного вида материалов получило название «холодное цинкование». Механизм их действия мы опишем в следующих постах.
Электрохи́мия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. Прямой перенос заряда с молекулы на молекулу в электрохимии не рассматривается.
Электрод
первого рода представляет
пластинку, изготовленную из простого
вещества (металла или полупроводника)
и погруженную в раствор, содержащий его
ионы.
К электродам первого рода относятся электроды, в уравнение Нернста которых под знаком логарифма входят активности веществ, участвующих в электродной реакции. Потенциал таких электродов меняется с изменением концентрации реагентов.
Защита металлов от коррозии | Задачи 284
Задание 284.
Если пластинку из чистого цинка опустить в разбавленную кислоту, то начавшееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
При опускании пластинки из чистого цинка в раствор разбавленной кислоты, начавшееся выделение водорода вскоре почти прекратится, потому что на пластинке из цинка образуется оксидная плёнка, которая будет препятствовать дальнейшему взаимодействию цинка с разбавленной кислотой.
 Оксидная плёнка образуется при взаимодействии цинка с кислородом, растворённым в воде по схеме:
Оксидная плёнка образуется при взаимодействии цинка с кислородом, растворённым в воде по схеме:Zn + 1/2O2 = ZnO
Если прикоснуться к цинковой пластинке медной палочкой, то возникнет гальваническая пара цинк — медь, в которой цинк будет являться анодом, а медь – катодом. Это происходит, потому что стандартный электродный потенциал цинка (-0,763 В) значительно отрицательнее, чем потенциал меди (+0,34 В).
Анодный процесс: Zn0 – 2 = Zn2+
Катодный процесс в кислой среде: 2Н+ + 2 = H2↑
Образующиеся ионы Zn2+ будут с имеющимися анионами кислоты давать соль, а ионы водорода Н+, деполяризуясь на медной палочке, Zn0 – 2 = Zn2+образуют водород, который в виде пузырьков газа выделяется из раствора. Ионно-молекулярное уравнение реакции будет иметь вид:
Zn + 2H+ = Zn2+ + H2↑
Молекулярная форма уравнения реакции:
Zn + 2HCl = ZnCl2 + H2↑
Задание 285.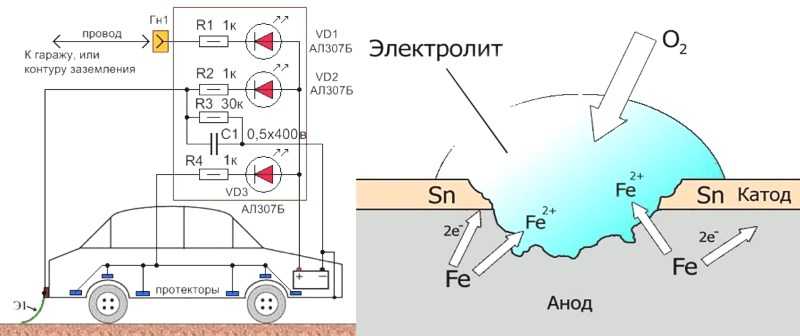
В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
Для предотвращения коррозии стальных конструкций применяется протекторная защита: создаётся электрический контакт защищаемой конструкции с протектором – более активным металлом (обычно Zn, Mg, Al или их сплавы). При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы:
Анодный процесс: Zn0 – 2 = Zn2+
Катодный процесс:
а) в нейтральной или щелочной среде: 1/2O2 + H2O + 2 = 2OH–;
б) в кислой среде: 1/2O2 + 2H+ + 2 = H2O
Таким образом, цинк разрушается, окисляясь до ионов Zn2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Zn(OH)2 или в виде ионов Zn2+ уходит в раствор, если реакция среды кислая. Основной металл остаётся неповреждённым.
Основной металл остаётся неповреждённым.
Задание 286.
Железное изделие покрыли никелем. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
Решение:
Железо имеет более электроотрицательный стандартный электродный потенциал (-0,44 В), чем никель (-0,24 В), поэтому железо является анодом, никель – катодом.
Анодный процесс – окисление металла: Fe0 – 2 = Fe2+
и катодный процесс – восстановление ионов водорода (водородная деполяризация) или молекул кислорода (кислородная деполяризация). Поэтому при коррозии пары Fe — Ni с водородной деполяризацией происходит следующие процессы:
Анодный процесс: Fe0 – 2 = Fe2+
Катодный процесс: в кислой среде: 2Н+ + 2 = Н2
Продуктом коррозии будет газообразный водород соединение железа с кислотным остатком (соль).
При коррозии пары Fe — Ni в атмосферных условиях на катоде происходит кислородная деполяризация, а на аноде – окисление железа:
Анодный процесс: Fe0 – 2 = Fe2+
Катодный процесс:
в нейтральной среде: 1/2O2 + H2O + 2 = 2OH–
Так как ионы Fe2+ с гидроксид-ионами ОН– образуют нерастворимый гидроксид, то продуктом коррозии будет Fe(OH)2. При контакте с кислородом воздуха Fe(OH)2 быстро окисляется до метагидроксида железа FeO(OH), приобретая характерный для него бурый цвет:
4Fe(OH)2 + О2 = 4FeO(OH) + 2Н2О
Так как никель имеет более электроположительный стандартный электродный потенциал, чем железо, то данное покрытие является катодным. При повреждении катодного покрытия (или наличия пор) возникает коррозионный элемент, в котором основной материал в поре служит анодом и растворяется, а материал покрытия – катодом, на котором выделяется водород или поглощается кислород.
Металлы с покрытием: защита от коррозии Защита
Все, что сделано из железа или стали, является главной мишенью для разрушительных сил коррозии. Коррозия возникает из-за химической реакции между влагой, окружающей атмосферой и атомами, из которых состоит металлическое вещество. Коррозия является серьезной проблемой, которая может привести к преждевременному износу мостов, зданий, транспортных средств, техники и всего остального, что построено из металла и других материалов.
Красная и белая ржавчина: в чем разница?
Двумя распространенными типами коррозии, поражающими металлы, являются красная и белая ржавчина. Большинство людей знакомы с первым. Красная ржавчина — это образование оксида железа, этого красновато-коричневого материала, который вы часто видите на кузове старых автомобилей или уличной решетке, который с течением времени подвергался воздействию элементов.
Гальваническое покрытие для предотвращения коррозии
Гальваническое покрытие является одним из самых популярных методов, используемых для борьбы с коррозией. Гальваническое покрытие влечет за собой электроосаждение металла на поверхность стального или железного изделия. Это металлическое покрытие действует как расходуемый барьер, который может замедлить и даже предотвратить образование коррозии на нижележащем материале, который называется подложкой. Хотя цинк часто является предпочтительным металлом для обеспечения защиты от коррозии, сплав цинка и никеля, такой как тот, который предлагает компания Sharretts Plating Company, имеет тенденцию давать лучшие долгосрочные результаты, чем при покрытии только цинком. Фактически, цинк-никель является лучшим выбором для защиты от коррозии в автомобильной промышленности.
Химическое покрытие
Химическое покрытие — это производное гальванопокрытия, не требующее использования электрического тока. Вместо этого осаждение происходит посредством автокаталитической химической реакции. Это обеспечивает более равномерное нанесение покрытия и расширяет возможности управления толщиной покрытия. Химическое никелирование является наиболее распространенным методом нанесения покрытия химическим путем, когда требуется превосходная защита от коррозии.
Ванна для химического никелирования также обычно содержит фосфор. Регулирование количества фосфора повлияет на способность никелевого покрытия предотвращать коррозию в определенных условиях. Например, покрытие с низким содержанием фосфора обеспечит наилучшую защиту от коррозии в щелочной среде, тогда как покрытие с высоким содержанием фосфора лучше подходит для кислой среды.
Измерение уровня защиты от коррозии с помощью соляного тумана
Испытание в солевом тумане считается наиболее надежным методом измерения эффективности антикоррозионного покрытия. Проще говоря, испытание в солевом тумане предполагает постоянное нанесение раствора соленой воды на материал с покрытием, чтобы оценить, сколько времени потребуется для появления ржавчины на поверхности.
Проще говоря, испытание в солевом тумане предполагает постоянное нанесение раствора соленой воды на материал с покрытием, чтобы оценить, сколько времени потребуется для появления ржавчины на поверхности.
Свяжитесь с SPC, чтобы узнать больше о преимуществах использования гальванического и химического покрытия для защиты от коррозии.
Как металлические покрытия защищают металлы от коррозии
На протяжении веков металлы широко использовались в нашей повседневной жизни. От алюминия и меди в электропроводке до золота и серебра в ювелирных изделиях, изделиях из серебра и электронике — металлы использовались для самых разных целей. Одним из наиболее широко используемых металлов сегодня является железо, а точнее, его более популярный сплав в форме стали. Сталь стала одним из самых универсальных продуктов, используемых в бытовой технике, автомобильных панелях, знаках, зданиях и мостах. Однако, как и другие металлы, сталь подвержена коррозии.
Реклама
Понимание процесса коррозии в металлах
Чтобы понять, как металлические покрытия защищают металлы, важно знать, что такое коррозия и чем она вызвана.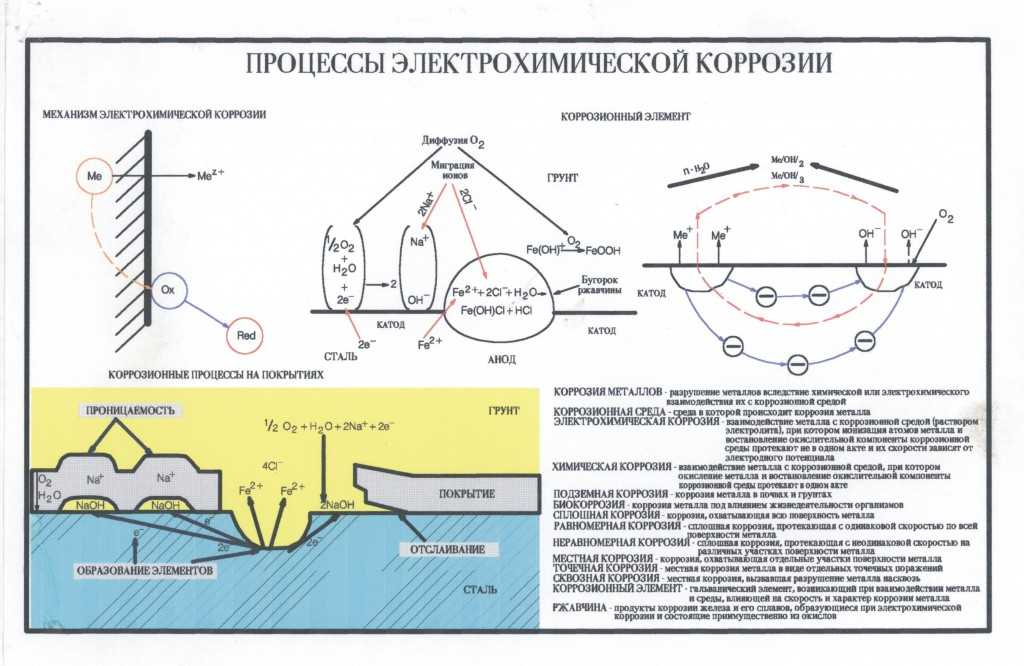 Коррозия представляет собой естественную электрохимическую реакцию, которая переводит очищенный металл в более химически стабильное состояние. Для возникновения коррозии должны присутствовать три компонента:
Коррозия представляет собой естественную электрохимическую реакцию, которая переводит очищенный металл в более химически стабильное состояние. Для возникновения коррозии должны присутствовать три компонента:
- Анод (в данном случае железо, содержащееся в стали)
- Катод (кислород)
- Раствор электролита (например, влага в воздухе)
В процессе коррозии железо в стали подвергается реакции окисления из-за присутствия кислорода с образованием гидратированного оксида железа (III), широко известного как ржавчина. В отличие от легкой коррозии алюминия, которая полезна, поскольку оксид образует защитный слой, предотвращающий дальнейшую коррозию, ржавчина является хрупкой и легко отслаивается, подвергая большую часть металла воздействию атмосферы и приводя к дальнейшей коррозии и деградации. Эта непрерывная коррозия в конечном итоге приводит к потере толщины материала, снижению прочности материала, перфорации и сокращению срока службы.
Реклама
Два распространенных типа металлических покрытий
Металлические покрытия могут наноситься на сталь для создания защитного слоя, что позволяет использовать сталь в различных сложных условиях. Металлические покрытия обеспечивают два основных типа защиты: барьерную защиту и, в отдельных случаях, гальваническую защиту.
Металлические покрытия обеспечивают два основных типа защиты: барьерную защиту и, в отдельных случаях, гальваническую защиту.
Барьерная защита
Когда металлическое покрытие, такое как цинк, наносится на сталь, оно высыхает и затвердевает, образуя непроницаемый барьер, предотвращающий проникновение влаги. Это удаляет один из основных компонентов, необходимых для возникновения коррозии. Без электролита (влага/вода) не может произойти окисление и, следовательно, не может образоваться ржавчина.
Другим важным аспектом барьерной защиты является защита от коррозии. Как упоминалось ранее, некоторые металлы, такие как алюминий, реагируют с кислородом, образуя защитную оксидную пленку на его поверхности. Эта оксидная пленка эластична и прочно прилипает к поверхности алюминия, предотвращая проникновение влаги и дальнейшую коррозию. Это делает алюминий идеальным материалом для листового металла. (Подробнее см. в разделе «Коррозионные свойства алюминия и его сплавов». )
)
Цинк, чаще всего используемый для покрытия конструкционной стали, вступает в реакцию с кислородом и влагой в атмосфере с образованием продуктов коррозии, которые создают защитный слой, защищающий нижележащую сталь. Свежий цинк реагирует с кислородом с образованием оксида цинка и с водой с образованием гидроксида цинка. При взаимодействии гидроксида цинка с углекислым газом в атмосфере образуется карбонат цинка. Эти продукты коррозионной пленки, такие как пленка, образующаяся на алюминии, устойчивы к проникновению воды и плотно прилегают к поверхности стали, так что она не отслаивается так легко, как коррозия, образующаяся на железе.
Реклама
Цинк, однако, является химически активным металлом и со временем будет медленно подвергаться коррозии и эрозии. Скорость деградации цинка по-прежнему в несколько раз ниже, чем у стали, и поэтому значительно продлевает срок службы стали, которую он предназначен защищать.
Гальваническая защита
Второй метод, с помощью которого металлические покрытия защищают сталь, заключается в обеспечении гальванической защиты нижележащей стали, позволяя металлическому покрытию корродировать преимущественно по отношению к стали, действуя таким образом как расходуемое покрытие. Например, если оголенная сталь обнажается из-за обрезанной кромки, царапины или серьезного повреждения покрытия, окружающее покрытие будет подвергаться коррозии первым, поэтому жертвуя собой, прежде чем сталь начнет корродировать.
Например, если оголенная сталь обнажается из-за обрезанной кромки, царапины или серьезного повреждения покрытия, окружающее покрытие будет подвергаться коррозии первым, поэтому жертвуя собой, прежде чем сталь начнет корродировать.
Гальваническая защита (также известная как гальваническая катодная защита) происходит потому, что цинк по своей природе является более электроотрицательным, чем железо/сталь в гальваническом ряду. (Справочную информацию см. в статье «Введение в серию гальванотехники: гальваническая совместимость и коррозия».) Когда наносится цинковое покрытие, оно действует как расходуемый анод, а нижележащая сталь становится катодом; поэтому цинк всегда будет корродировать первым. Эта гальваническая коррозия будет продолжаться до тех пор, пока полностью не израсходуется материал анода (цинковое покрытие).
Гальваническая защита важна, поскольку покрытия, особенно в строительстве, могут быть поцарапаны и повреждены. (Узнайте о преимуществах этого метода защиты в разделе «Гальванизация и его эффективность в предотвращении коррозии». ) Именно по этой причине цинковые металлические покрытия предпочтительнее алюминиевых при защите стальных элементов. В то время как цинк и алюминий близки в гальваническом ряду, защитная оксидная пленка, образованная алюминием, настолько непроницаема, что не разрушается коррозией и, следовательно, не обеспечивает гальванической защиты поврежденной стали. Цинк, с другой стороны, хотя и является эффективным барьером, не обеспечивает такой защиты, как алюминий, поэтому он будет предпочтительнее подвергаться коррозии и защищать поврежденную или открытую сталь.
) Именно по этой причине цинковые металлические покрытия предпочтительнее алюминиевых при защите стальных элементов. В то время как цинк и алюминий близки в гальваническом ряду, защитная оксидная пленка, образованная алюминием, настолько непроницаема, что не разрушается коррозией и, следовательно, не обеспечивает гальванической защиты поврежденной стали. Цинк, с другой стороны, хотя и является эффективным барьером, не обеспечивает такой защиты, как алюминий, поэтому он будет предпочтительнее подвергаться коррозии и защищать поврежденную или открытую сталь.
Заключение
Комбинация барьерной и гальванической защиты, которую обеспечивают металлические покрытия, обеспечивает форму защиты от коррозии, которая не имеет себе равных с точки зрения применения, стоимости и универсальности. Они являются эффективным способом защиты других металлов, таких как сталь (которая технически является металлическим сплавом), от деградации из-за коррозии. Эта защита позволяет использовать уязвимые металлы в ряде требовательных приложений, которые в противном случае считались бы непригодными.

