Пср 15 температура плавления: СИБПРОЕКТ :: OOO «СИБПРОЕКТ-ДрагМет» :: Продукция :: Припой серебряный ПСр 15
alexxlab | 01.08.2023 | 0 | Разное
СИБПРОЕКТ :: OOO «СИБПРОЕКТ-ДрагМет» :: Продукция :: Припой серебряный ПСр 15
Описание: Припой ___ является двухкомпонентным сплавом, состоящим из ___% серебра и ___% меди. Припой ____является эвтектическим сплавом с температурой плавления ___ оС.
Нормативная документация: Припои ПСр 15 производятся в соответствии с ГОСТ 19738-2015, проволока ПСр 15 – ГОСТ 19746-2015, полоса ПСр 15 – ГОСТ 19739-2015.
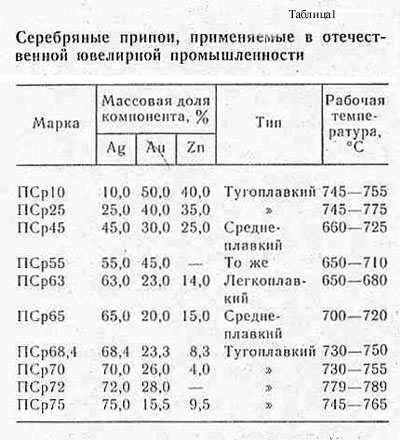
Химический состав серебряных припоев:
Марка припоя | Химический состав, % | |||||||||||||
Ag | Cu | Zn | Sn | Mn | Sb | Cd | Ni | Pb | Примеси не более | |||||
Pb | Fe | Bi | Сумма определяемых примесей | |||||||||||
ПСр 15 | 15,0±0,5 | Остаток | – | – | – | – | 4,8±0,3 | – | – | – | 0,100 | 0,05 | 0,010 | 0,15 |
Размеры припоя:
Марка припоя | Толщина, мм | Ширина, мм | Длина, мм | |||
Min | Max | Min | Max | Min | Max | |
ПСр 15 | 0,1 | 5 | 50 | 200 | 100 | 400 |
Диаметр проволоки:
Марка проволоки | Диаметр, мм | |
Max | ||
ПСр 15 | 0,15 | 6 |
Температура плавления, плотность и удельное электрическое сопротивление:
Марка припоя | Плотность, кг/м3 | Температура плавления, К (°С) | Удельное электрическое сопротивление, 10-3 Ом·м | |
Верхняя критическая точка | Нижняя критическая точка | |||
ПСр 15 | 8500 | 1083 (810) | 913 (640) | 20,7 |
Припой ПСр 15 применяется для лужения и пайки меди, медных и медно-никелевых сплавов, никеля, ковара, нейзильбера, латуней и бронз, пайки и лужения ювелирных изделий. ПСр 15 является самофлюсующимся припоем для пайки меди с бронзой, меди с медью, бронзы с бронзой.
ПСр 15 является самофлюсующимся припоем для пайки меди с бронзой, меди с медью, бронзы с бронзой.
Припой ПСр-15
Припой ПСр 15 относится к классу твердых припоев, состоящих из двухкомпонентного сплава Ag — Cu с минимальным содержанием примесей.
Химический состав и структура
ГОСТ 19738-74 определяет следующий химический состав припоя:
- Серебро — 15+3%.
- Медь — остальное с учетом суммарных примесей 0,15%.
Содержание меди более 80% определяет механические свойства соединяемых пайкой изделий. В структуре припоя преобладает гомогенная медь, между центрами кристаллизации которой располагается раствор серебро — медь. Это связано с тем, что температура фазового перехода жидкое (810 ° С) — твердое (кристаллизация при 640° С) меди на 100° С выше, чем у раствора меди в серебре. Это различие приводит к неравномерности распределения меди по объему отливки (чистая медь + сплав меди и серебра). Кроме этого, в расплаве, за счет наличия примесей, в расплаве присутствует фосфор до 5% и образует кристаллы (Cu-P), которые ухудшают деформируемость сплава в холодном состоянии.
Производство и механические свойства
Особенности фазовых переходов внутри отливки потребовало применения технологий производства, которые выравнивают структуру изделия. В основном — это проволока.
Основные технологии получения проволоки:
- Жидкая экструзия. Технологический процесс предусматривает подачу расплава в фильеру под давлением. Диаметр фильеры 2…5 мм. На выходе изделие охлаждается паром. Калибровка проводится протягиванием через фильеру или вальцовкой на валках с круглым ручьем. Деформация производится ступенчато с обжатием на небольшие величины. После операций по пластической деформации производится «быстрый» отжиг (гомогенизация) при температуре 450…480° С с быстрым охлаждением для предотвращения образования крупных центров кристаллизации.
- Горячее прессование. Заготовку нагревают до температуры 580…600° С производят последовательные операции деформирования на прессах, затем на прокатном стане. При охлаждении проволоки до температуры порядка 400° С проводят быстрое охлаждение.
 Горячее прессование — высокотехнологичный процесс и позволяет получить проволоку с однородной структурой, т.к. на каждом переходе прессования происходит «перемешивание» серебра с медью.
Горячее прессование — высокотехнологичный процесс и позволяет получить проволоку с однородной структурой, т.к. на каждом переходе прессования происходит «перемешивание» серебра с медью.
С развитием технологии порошковой металлургии появились сообщения о производстве порошкового припоя ПСр 15, который более технологичен и экономичен для операций лужения и пайки.
Комплекс механических свойств определяется содержанием меди и структурой проволоки или материала в месте пайки. При пайке (расплавлении припоя) происходят все физические процессы, которые проходят в слитке. Поэтому, после пайки с высокими требованиями к качеству соединения проводят быстрый отжиг.
Сортамент и область применения
Припой ПСр 15 не выпускают в виде полос, т.к. сплав трудно деформируется в холодном состоянии. Основной ассортимент — проволока от 1,5 мм и по заказу.
Твердый припой применяют для любых деталей, в которых содержание меди не менее 60% (латунь, бронза, медно-никелевые сплавы, ковар, нейзильбер).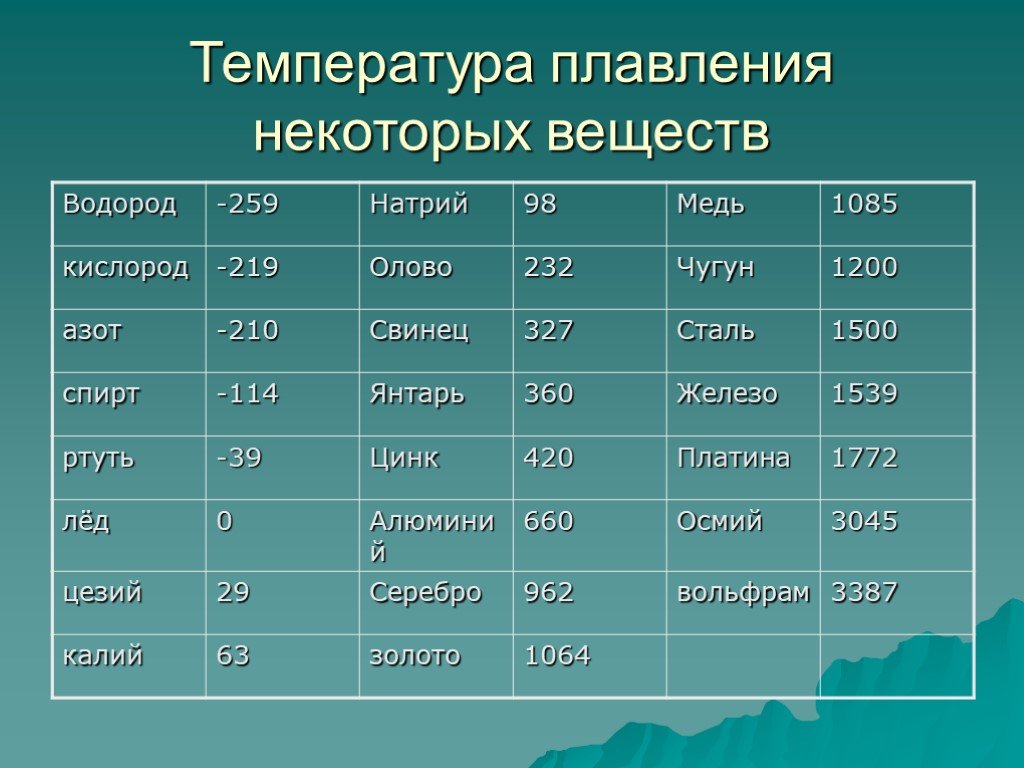 Соединение обладает высокой прочностью на отрыв, но плохо работает при ударных нагрузках или вибрации.
Соединение обладает высокой прочностью на отрыв, но плохо работает при ударных нагрузках или вибрации.
Применяется для пайки и лужения медных трубопроводов высокого давления в системах гидравлики или пневматики, работающих в агрессивных средах. В художественном промысле применяется ограничено — в изделиях с низким содержанием серебра, но требующих обжига (финифть, глазурь и т.п.).
ПСр 15, из широко используемых припоев, имеет низкую цену из-за низкого содержания серебра невысокой пробы и выпускается в больших количествах для примышленного и бытового применения.
Полимеразная спиральная реакция (ПСР): новый метод изотермической амплификации нуклеиновых кислот
- Список журналов
- Научные отчеты
- PMC4518254
В качестве библиотеки NLM предоставляет доступ к научной литературе. Включение в базу данных NLM не означает одобрения или согласия с
содержание NLM или Национальных институтов здравоохранения.
Узнайте больше о нашем отказе от ответственности.
Включение в базу данных NLM не означает одобрения или согласия с
содержание NLM или Национальных институтов здравоохранения.
Узнайте больше о нашем отказе от ответственности.
науч. респ. 2015; 5: 12723.
Опубликовано в сети 29 июля 2015 г. doi: 10.1038/srep12723
, 1, * , 1, * , 1, * , 1 , 1 , 1 и a, 1
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности
Полимеразная спиральная реакция (ПСР) с высокой специфичностью, эффективностью и скоростью в изотермических условиях. Рекомбинантная плазмида bla NDM-1 был импортирован в Escherichia coli BL21 и выбран в качестве микробной мишени. Метод PSR использует ДНК-полимеразу Bst и пару праймеров, предназначенных для последовательности гена bla NDM-1 . Последовательности прямого и обратного праймера Tab обратны друг другу на их 5′-конце (Nr и N), тогда как их последовательности на 3′-конце комплементарны соответствующим последовательностям нуклеиновой кислоты-мишени. Метод ПШР проводили при постоянной температуре 61 °C–65 °C, что приводило к получению сложной спиральной структуры. Анализ PSR непрерывно контролировали с помощью турбидиметра, работающего в режиме реального времени, или визуально определяли с помощью флуоресцентного красителя (SYBR Greenı), и его можно было завершить в течение 1 часа с высоким накоплением 10
Последовательности прямого и обратного праймера Tab обратны друг другу на их 5′-конце (Nr и N), тогда как их последовательности на 3′-конце комплементарны соответствующим последовательностям нуклеиновой кислоты-мишени. Метод ПШР проводили при постоянной температуре 61 °C–65 °C, что приводило к получению сложной спиральной структуры. Анализ PSR непрерывно контролировали с помощью турбидиметра, работающего в режиме реального времени, или визуально определяли с помощью флуоресцентного красителя (SYBR Greenı), и его можно было завершить в течение 1 часа с высоким накоплением 10
Технология амплификации нуклеиновых кислот получила значительное развитие после изобретения полимеразной цепной реакции (ПЦР) 1 .![]()
За последние 20 лет сообщалось о широком спектре методов изотермической амплификации для амплификации ДНК или РНК, включая систему амплификации на основе транскрипции (TAS) 5 , самоподдерживающуюся реакцию репликации последовательности (3SR) 6 , Амплификация на основе последовательности нуклеиновых кислот (NASBA) 7 , Амплификация замещения цепи (SDA) 8 , Репликация по катящемуся кругу (RCR) 9 , Опосредованная петлей изотермическая амплификация (LAMP) 10 , Хеликазозависимая амплификация (HDA) 11 , Изотермическая амплификация с одним праймером (SPIA)  В рамках этих методов TAS, 3SR, NASBA, SDA, HDA и SPIA требуют нескольких ферментов (трех или более) и тщательной оптимизации. Только некоторые из этих методов изотермической амплификации (например, RCR, LAMP и CPA) можно эффективно проводить при постоянной температуре с использованием одного фермента. Однако метод RCR может амплифицировать только кольцевую ДНК, в то время как четыре или более праймеров необходимы для инициации реакции LAMP или CPA.
В рамках этих методов TAS, 3SR, NASBA, SDA, HDA и SPIA требуют нескольких ферментов (трех или более) и тщательной оптимизации. Только некоторые из этих методов изотермической амплификации (например, RCR, LAMP и CPA) можно эффективно проводить при постоянной температуре с использованием одного фермента. Однако метод RCR может амплифицировать только кольцевую ДНК, в то время как четыре или более праймеров необходимы для инициации реакции LAMP или CPA.
В этом исследовании мы описываем новый метод изотермической амплификации нуклеиновых кислот, названный полимеразной спиральной реакцией (ПСР). Для запуска реакции ПСР, как и ПЦР, необходима всего одна пара праймеров и один фермент. Кроме того, поскольку реакция проводится при постоянной температуре, не требуется энергоемкий термоциклер. Более того, положительные результаты можно было определить по визуальному изменению цвета. Метод PSR подходит для тестирования на месте и в месте оказания медицинской помощи.
Основная цель настоящего исследования состояла в том, чтобы продемонстрировать применение метода PSR. Мы выбрали ген bla NDM-1 в качестве модели-мишени. Это ген суперустойчивости к антибиотикам, появившийся в последние годы 14 .
Мы выбрали ген bla NDM-1 в качестве модели-мишени. Это ген суперустойчивости к антибиотикам, появившийся в последние годы 14 .
Характеристика анализа PSR
Как и многие другие методы изотермической амплификации, метод PSR основан на использовании ДНК-полимеразы с активностью замещения цепи. Для инициации реакции необходимы два праймера с обратной последовательностью на 5’-конце.
Как показано на , праймеры для анализа PSR, включая прямой праймер (Ft) и обратный праймер (Bt), были разработаны для нацеливания на ген bla NDM-1 . Заглавные 3′-последовательности прямого праймера (F) и обратного праймера (B) комплементарны последовательности целевого гена bla NDM-1 (положения 32922–32941, 33115–33097, доступ в GenBank: 11027496). Строчная 5’-последовательность прямого праймера (Nr) обратна строчной 5’-последовательности обратного праймера (N). Последовательности Nr и N были извлечены из ботанического гена.
Открыть в отдельном окне
Схематическое представление и примерный дизайн метода PSR.( A ): Схема, показывающая механизм PSR. ( B ): Нуклеотидная последовательность bla NDM-1 (часть) и расположение праймеров и сайтов разрезания ферментами рестрикции подчеркнуты. ( C ): последовательности праймеров Ft и Bt, нацеленные на ген bla NDM-1 .
Механизм метода PSR показан на рис. Когда температура достигает 61–65 °С, двухцепочечная структура матричной ДНК размыкается благодаря присутствию бетаина. На левой диаграмме F-сегмент праймера Ft отжигается с одной одноцепочечной ДНК и удлиняется (от структуры 1 до структуры 2). После плавления структуры 2 В-сегмент праймера Bt гибридизуется с ней (структура 3) и удлиняется (структура 4). Двойные нити структуры 4 плавятся и образуют единую цепь (структура 5). Последовательности Nr и N обратны друг другу, а последовательности Nr и Nrc комплементарны друг другу. Таким образом, последовательности N и Nrc являются обратными и комплементарными друг другу. Структура 5 закручивается в структуру 6. 3′-конец Nrc продолжает расширяться и, наконец, образует спиральную структуру (структура 7). Точно так же механизм удлинения другой одноцепочечной цепи на правой диаграмме такой же, как и на левой диаграмме.
Таким образом, последовательности N и Nrc являются обратными и комплементарными друг другу. Структура 5 закручивается в структуру 6. 3′-конец Nrc продолжает расширяться и, наконец, образует спиральную структуру (структура 7). Точно так же механизм удлинения другой одноцепочечной цепи на правой диаграмме такой же, как и на левой диаграмме.
Геномную ДНК экстрагировали из 6 × 10 6 E. coli pGEX-NDM-BL21 CFU. Для оценки чувствительности анализа PSR использовали серию 10-кратных разведений ДНК с использованием стерилизованной бидистиллированной воды, дающую 6000, 600, 60, 6, 0,6 и 0,06 КОЕ на реакцию. Как показано на рисунке, образцы геномной ДНК, извлеченные из 6000, 600 и 60 КОЕ, были амплифицированы методом PSR в течение 31 минуты, а значение порога пересечения (Ct) для образца 6 КОЕ составило около 39 минут. Матрицы 0,6, 0,06 КОЕ/реакция были отрицательными для амплификации, как и отрицательный контроль (бидистиллированная вода). Следовательно, чувствительность метода ПСР для E. coli pGEX-NDM-BL21, содержащий ген bla NDM-1 , составляет 6 КОЕ на реакцию. Между тем, стандартная кривая, полученная путем построения графика зависимости Ct от концентрации КОЕ (), показывает тонкий коэффициент регрессии (R 2 = 0,9989).
coli pGEX-NDM-BL21, содержащий ген bla NDM-1 , составляет 6 КОЕ на реакцию. Между тем, стандартная кривая, полученная путем построения графика зависимости Ct от концентрации КОЕ (), показывает тонкий коэффициент регрессии (R 2 = 0,9989).
Открыть в отдельном окне
Чувствительность количественного определения последовательно разбавленной ДНК с помощью амплификации PSR. ( A ): График изотермической амплификации представляет продукты амплификации, наблюдаемые с помощью мутномера в режиме реального времени каждые 6 с при различных концентрациях ДНК. Данные представляют собой среднее значение трех повторов для каждого стандартного разведения. Амплификацию проводили при 65 °С в течение 60 мин. ( B ): Стандартная кривая, полученная путем построения графика зависимости порога пересечения (Ct) от концентрации эквивалентов КОЕ. 1, 6000 КОЕ; 2, 600 КОЕ; 3, 60 КОЕ; 4, 6 КОЕ; 5, 0,6 КОЕ; 6, 0,06 КОЕ; 7, отрицательный контроль (бидистиллированная вода).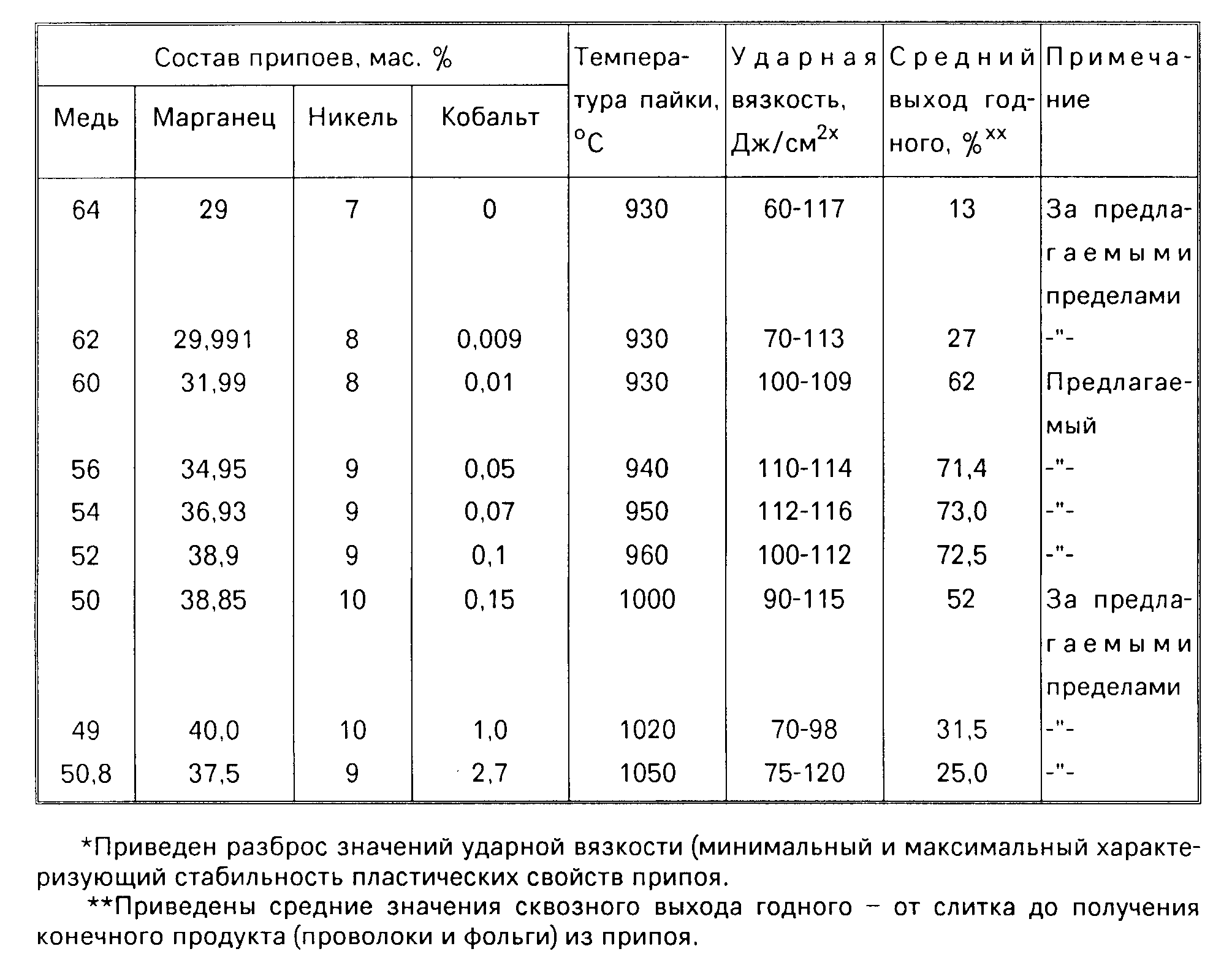
Продукты анализа PSR для теста на чувствительность разделяли электрофорезом в 1% агарозном геле (Armesco) и окрашивали GelRed (Biotium). Изображения были задокументированы с помощью системы визуализации Gel Doc EQ (Bio-Rad). Типичный положительный анализ PSR дает лестницу из нескольких полос на агарозном геле (дорожка 1–4), что позволяет предположить, что ДНК с повторяющимися последовательностями-мишенями была получена из-за разных стадий спиральной амплификации в результате одновременного Bst Удлинение ДНК-полимеразы на 3’-конце и смещение цепи на 5’-конце.
Открыть в отдельном окне
( A ): Результаты гель-электрофореза для продуктов PSR эксперимента по специфичности. ( B ): Визуальные результаты метода PSR в ультрафиолетовом свете. 1-6 – 10-кратные серийные разведения амплифицированного продукта 6000, 600, 60, 6, 0,6, 0,06 КОЕ. 7 – отрицательный контроль (бидистиллированная вода). Дорожка М представляет собой маркер молекулярной массы размером 2000 пар оснований.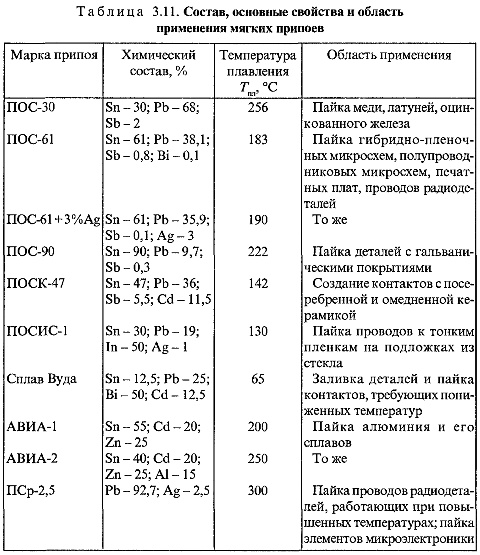
SYBR Greenı может связываться с двухцепочечной ДНК, излучая зеленую флуоресценцию в УФ-свете. Были также проведены эксперименты по определению предела обнаружения bla NDM-1 Анализ PSR при использовании SYBR Greenı для наблюдения за положительными реакциями с использованием визуального изменения цвета вместо обнаружения мутности. Анализ PSR проводили, как описано выше, на водяной бане с постоянной температурой. После прекращения реакции к продуктам PSR добавляли 1 мкл разведенного 1:20 SYBR Greenı (Life Technologies). Изменение цвета можно наблюдать невооруженным глазом при естественном освещении или в УФ-свете с длиной волны 365 нм. Как показано на рисунке, через одну минуту после добавления SYBR Greenı пробирки с 1 по 4 стали зелеными (положительные результаты), а пробирки с 5 по 7 остались светло-оранжевыми (отрицательные результаты), что согласуется с анализом в реальном времени и результатом гель-электрофореза.
Для анализа продукта реакции PSR продукт очищали с помощью набора для очистки ДНК (Tiangen Co. , Китай) и расщепляли Taq I и Hinf I, двумя сайтами разрезания ферментами рестрикции, обнаруженными в исходной последовательности (). Результат показал, что продукт переварился и образовал единый фрагмент (дорожка 1, 3). Кроме того, две полосы на дорожке 2 () вырезали из геля, лигировали в вектор ТА и секвенировали. Полученные последовательности соответствовали предсказанному продукту PSR bla 9.0044 NDM-1 последовательность.
, Китай) и расщепляли Taq I и Hinf I, двумя сайтами разрезания ферментами рестрикции, обнаруженными в исходной последовательности (). Результат показал, что продукт переварился и образовал единый фрагмент (дорожка 1, 3). Кроме того, две полосы на дорожке 2 () вырезали из геля, лигировали в вектор ТА и секвенировали. Полученные последовательности соответствовали предсказанному продукту PSR bla 9.0044 NDM-1 последовательность.
Открыть в отдельном окне
Результаты гель-электрофореза продуктов PSR до и после расщепления рестрикционными ферментами.Lane1, продукт PSR, обработанный Taq I; Дорожка 2 и 4, продукт PSR перед расщеплением; Дорожка 3, продукт PSR, расщепленный с помощью Hinf I. Дорожка M представляет собой маркер молекулярной массы 2000 bp.
Клиническая оценка анализа ПСР
Тест на специфичность и применение в клинической диагностике также являются важными вопросами в любой диагностической лаборатории. Мы оценили специфичность анализа PSR для обнаружения bla гена NDM-1 путем оценки его реактивности с клиническими бактериальными штаммами без bla NDM-1 , выделенными в нашем центре микроорганизмов () 15 . Мы наблюдали, что кривая повышенной мутности появлялась только тогда, когда в качестве матрицы использовались штаммы с bla NDM-1 , в то время как другие штаммы, включая контрольный контроль, были отрицательными для амплификации (). Результаты традиционной ПЦР () и визуального теста () соответствовали анализу в реальном времени, указывая на то, что ПСР специфичен для бла НДМ-1 .
Мы наблюдали, что кривая повышенной мутности появлялась только тогда, когда в качестве матрицы использовались штаммы с bla NDM-1 , в то время как другие штаммы, включая контрольный контроль, были отрицательными для амплификации (). Результаты традиционной ПЦР () и визуального теста () соответствовали анализу в реальном времени, указывая на то, что ПСР специфичен для бла НДМ-1 .
Открыть в отдельном окне
Оценка специфичности анализа ПСР. ( A ): Турбидиметр реального времени записал график амплификации PSR различных клинических штаммов. Амплификацию проводили при 65 °С в течение 60 мин. ( B ): ПЦР обнаружение bla NDM-1 в различных штаммах. Последовательность продукта составляет 813 п.н. ( C ): Визуальные результаты метода PSR в УФ-свете. 1, Escherichia coli pGEX-NDM-BL21; 2, S. maltophilia JKYJ-01; 3, E. faecalis PIJ; 4, A. baumannii H949; 5, A. baumannii B260; 6, P. aeruginosa D104; 7, S. marcescens SY-67; 8, С. Сонней 2531; 9, С. флекснери 4536; 10, S. entericasero тип Paratyphi 86423; 11, энтероинвазивная E. coli 44825; 12, энтеротоксигенные E. coli 44824; 13, V. carchariae 5732; 14, K. pneumoniae 44824; 15, V. parahaemolyticus 5474; 16, отрицательный контроль (дистиллированная вода).
faecalis PIJ; 4, A. baumannii H949; 5, A. baumannii B260; 6, P. aeruginosa D104; 7, S. marcescens SY-67; 8, С. Сонней 2531; 9, С. флекснери 4536; 10, S. entericasero тип Paratyphi 86423; 11, энтероинвазивная E. coli 44825; 12, энтеротоксигенные E. coli 44824; 13, V. carchariae 5732; 14, K. pneumoniae 44824; 15, V. parahaemolyticus 5474; 16, отрицательный контроль (дистиллированная вода).
Таблица 1
Клинические штаммы, использованные для теста специфичности ПСР, нацеленного на bla NDM-1 ген.
| Штаммы | Источник |
|---|---|
S. maltophilia JKYJ-01 90 289 maltophilia JKYJ-01 90 289 | Наш центр микроорганизмов |
| E. faecalis PIJ | Наш центр микроорганизмов |
| A. baumannii H949 | Наш центр микроорганизмов |
| Наш центр микроорганизмов | |
| P. aeruginosa D104 | Наш центр микроорганизмов |
S. marcescens SY-67 marcescens SY-67 | Наш центр микроорганизмов |
| S. sonnei 2531 | Наш центр микроорганизмов |
| S. flexneri 4536 | Наш центр микроорганизмов |
| S Entericaserotype Paratyphi 86423 | Наш центр микроорганизмов |
| энтероинвазивная кишечная палочка 44825 | Наш центр микроорганизмов |
| энтеротоксигенная кишечная палочка 44824 | Наш центр микроорганизмов |
V. carchariae 5732 carchariae 5732 | Наш центр микроорганизмов |
| K. pneumoniae 44824 | Наш центр микроорганизмов |
| Наш центр микроорганизмов |
Открыто в отдельное окно
Метод PSR также применялся для клинического скрининга. Было собрано 78 образцов клинической мокроты для эпиднадзора на основе ПСР за bla NDM-1 от пациентов отделения интенсивной терапии с клиническим подозрением на мультирезистентные инфекции в трех ведущих больницах Пекина. В качестве контроля было собрано 10 образцов мокроты от здоровых людей. Для анализа клинических образцов использовались как ПСР, так и ПЦР.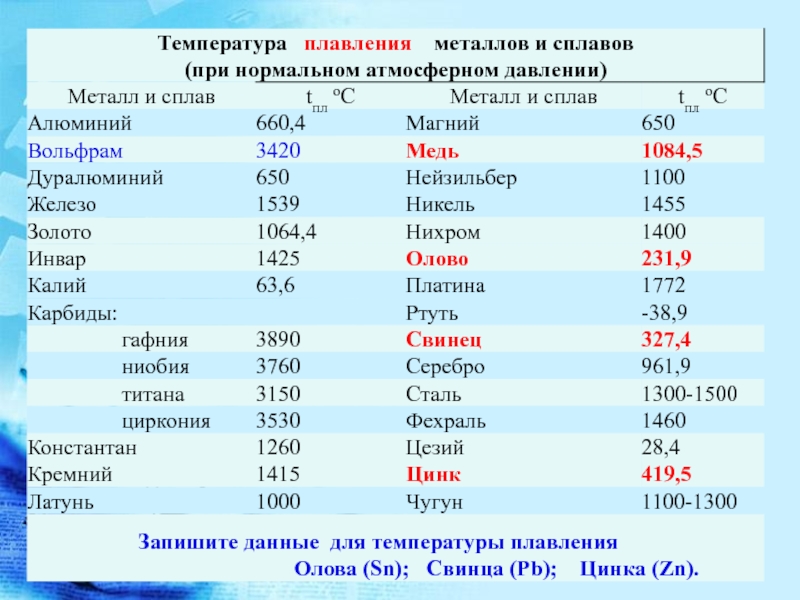 Из 78 клинических образцов PSR выявил 4 положительных образца, что согласуется с анализом PCR. Затем проводили видовую идентификацию с помощью автоматизированной системы (системы Phoenix и BD). Три штамма Acinetobacter baumannii и один штамм 9Штамм 0043 Klebsiella pneumoniae , содержащий штамм bla NDM-1 , был успешно культивирован из этих положительных образцов. Все контрольные образцы от здоровых людей дали отрицательный результат в каждом из анализов. Анализ последовательности гена bla NDM-1 из этих изолятов подтвердил консервативность нуклеотидных последовательностей заявленного гена. Тест на чувствительность к противомикробным препаратам показал, что четыре штамма обладают высокой устойчивостью к карбапенемам, цефалоспоринам и аминогликозидам (данные не представлены).
Из 78 клинических образцов PSR выявил 4 положительных образца, что согласуется с анализом PCR. Затем проводили видовую идентификацию с помощью автоматизированной системы (системы Phoenix и BD). Три штамма Acinetobacter baumannii и один штамм 9Штамм 0043 Klebsiella pneumoniae , содержащий штамм bla NDM-1 , был успешно культивирован из этих положительных образцов. Все контрольные образцы от здоровых людей дали отрицательный результат в каждом из анализов. Анализ последовательности гена bla NDM-1 из этих изолятов подтвердил консервативность нуклеотидных последовательностей заявленного гена. Тест на чувствительность к противомикробным препаратам показал, что четыре штамма обладают высокой устойчивостью к карбапенемам, цефалоспоринам и аминогликозидам (данные не представлены).
Развитие ПЦР, ОТ-ПЦР и других технологий амплификации нуклеиновых кислот значительно способствовало развитию молекулярной биологии. Диагностика на месте также упрощается, поскольку в изотермической реакции амплификации нуклеиновых кислот не требуется точный термоциклер.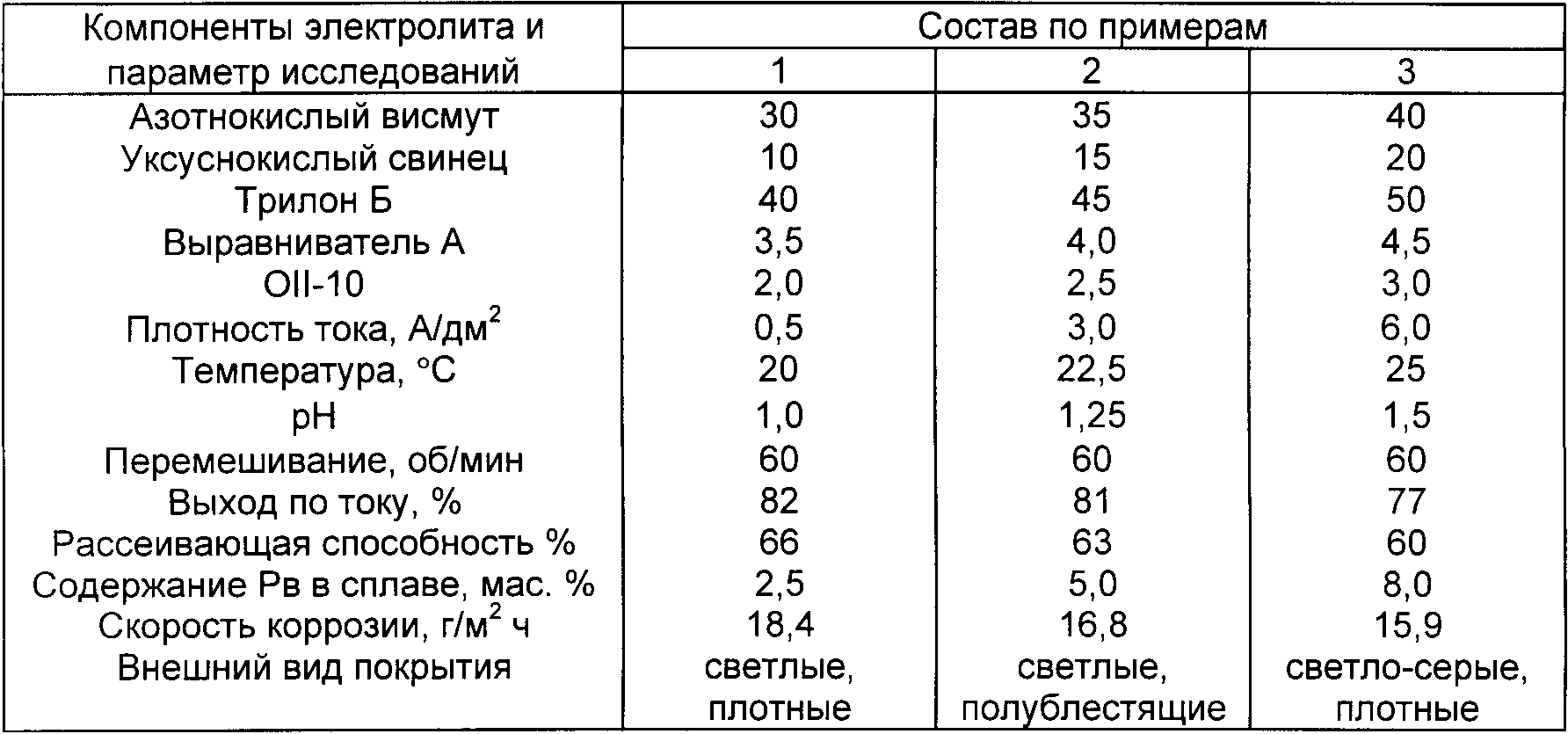
Метод PSR, описанный в этом исследовании, сочетает в себе преимущества ПЦР, в которой требуется только одна пара праймеров, и методы изотермической амплификации, такие как RCR и 3SR. Дизайн праймера для PSR очень прост и удобен. Мы можем использовать программное обеспечение для разработки праймеров для ПЦР (например, Primer 5, DNAMAN) для разработки пары обычных праймеров для ПЦР. Затем все, что нам нужно сделать, это добавить экзогенные последовательности (Nr и N) на 5′-конце праймеров для ПЦР. Значение Tm экзогенных последовательностей устанавливали на 5 °C ниже, чем последовательностей ПЦР, чтобы конъюгация F и B с геном-мишенью происходила раньше, чем образование спиральной структуры. В этом исследовании мы выделили последовательности N и Nr из ботанического гена, чтобы избежать неспецифической реакции микроорганизмов с целевым геном. Более того, современные методы изотермической амплификации требуют начальной инкубации при 95 °C (изотермическая амплификация, опосредованная петлей, амплификация замещения цепи) или включение в реакционную смесь геликазной ДНК (зависимая от хеликазы амплификация) для достижения денатурации двойных цепей Уотсона-Крика. Метод PSR не требует начальной стадии денатурации, реакция продолжается, как только температура достигает 61°C до 65°C.
Метод PSR не требует начальной стадии денатурации, реакция продолжается, как только температура достигает 61°C до 65°C.
Реакционные компоненты PSR включают Tris-HCl, KCl, (NH 4 ) 2 SO 4 , Tween 20, MgSO 4 , dNTP, Bst ДНК-полимераза и бетаин, который представляет собой химическое вещество, дестабилизирующее спираль ДНК. Эти реагенты можно смешивать и хранить при температуре -20 °C перед использованием, как и реагенты PCR MasterMix. Реакцию можно контролировать с помощью мутномера в режиме реального времени или прибора для ОТ-ПЦР с добавлением SYBR Greenı. Между тем, для целей визуального обнаружения с помощью УФ-излучения или даже невооруженным глазом можно напрямую распознать положительный или отрицательный результат.
После введения вариабельных экзогенных последовательностей (Nr и N) мы смогли искусственно установить сайты рестрикции на праймерах Ft и Bt. После завершения реакции PSR и расщепления соответствующими ферментами продукт, расщепленный ферментами, можно в дальнейшем использовать для секвенирования и других экспериментов по молекулярной биологии. Последующие эксперименты продолжаются.
Последующие эксперименты продолжаются.
bla NDM-1 — ген суперустойчивости к антибиотикам, появившийся в последние годы, с общей длиной 813 пар оснований. Klebsiella pneumoniae , Escherichia coli и другие бактерии всегда устойчивы почти ко всем существующим антибиотикам после получения гена bla NDM-1 , поэтому риск внутрибольничной инфекции значительно увеличивается 16 . В этом исследовании PSR также применялся для клинического скрининга. Четыре штамма, содержащие bla NDM-1 с высокой устойчивостью к антибиотикам были окончательно идентифицированы из клинических образцов мокроты, что свидетельствует о клинической значимости этого метода.
Заключительные замечания
Чувствительность обнаружения метода PSR составляет всего 6 клеток на реакцию в течение 45 минут, а положительные результаты можно отличить по простому изменению цвета, что позволяет предположить, что этот метод также может применяться в аналитических приборах на основе биосенсоров. . PSR соответствует руководящим принципам, предложенным Всемирной организацией здравоохранения для разработки диагностических методов, а именно, ASSURED (доступный, чувствительный, специфичный, удобный для пользователя, надежный и быстрый, без оборудования и с доставкой) 17 . Этот метод представляет собой удобную и экономически эффективную альтернативу для клинического скрининга, диагностики на месте и в целях первичного карантина.
. PSR соответствует руководящим принципам, предложенным Всемирной организацией здравоохранения для разработки диагностических методов, а именно, ASSURED (доступный, чувствительный, специфичный, удобный для пользователя, надежный и быстрый, без оборудования и с доставкой) 17 . Этот метод представляет собой удобную и экономически эффективную альтернативу для клинического скрининга, диагностики на месте и в целях первичного карантина.
Олигонуклеотиды и ферменты
Все олигонуклеотиды в этом исследовании были синтезированы компанией Shenzhen BGI Biological Engineering Technology and Services Co. Ltd (Шэньчжэнь, Китай). ДНК-полимераза Bst (большой фрагмент) была приобретена у New England Biolabs (Пекин, Китай).
Методы амплификации PSR
Мишенью матрицы, используемой в этом исследовании, была E. coli pGEX-NDM-BL21, содержащая ген bla NDM-1 , сконструированный нашей лабораторией ранее 18 . Бактериальные штаммы () культивировали в среде LB по стандартным методикам. Затем геномную ДНК экстрагировали с использованием набора Wizard Genomic DNA Purification Kit (Promega Co. USA).
Бактериальные штаммы () культивировали в среде LB по стандартным методикам. Затем геномную ДНК экстрагировали с использованием набора Wizard Genomic DNA Purification Kit (Promega Co. USA).
Реакции ПСР проводили в 25 мкл реакционной смеси, содержащей следующие компоненты: 1,0 мкл Bst Большой фрагмент ДНК-полимеразы (New England Biolabs), 2,5 мкл 10 х реакционного буфера ThermoPol (New England Biolabs, включая 20 мМ Tris-HCl, 10 мМ KCl, 10 мМ (NH 4 ) 2 900 46 СО 4 , 2 мМ MgSO 4 , 0,1% твин 20), 0,8 мМ бетаина (Sigma), 6 мМ MgSO 4 , 1,4 мМ каждого дезоксинуклеозидтрифосфата. Количество праймеров, необходимое для одной реакции, составляло 1,6 мкМ как для Ft, так и для Bt. Наконец, в реакционную пробирку добавляли соответствующее количество матрицы ДНК. Реакция PSR проводилась в течение 60 минут при 65 °C, и сигнал регистрировался каждые 6 секунд с использованием прибора для измерения мутности в реальном времени.
Праймеры ПЦР-анализа для bla NDM-1 были NDM-F (5’-ATGGAATTGCCCAATATTATGCA-3’, восходящий праймер) и NDM-R (5’-TCAGCGCAGCTTGTCGGCCATGC-3’, нижний праймер).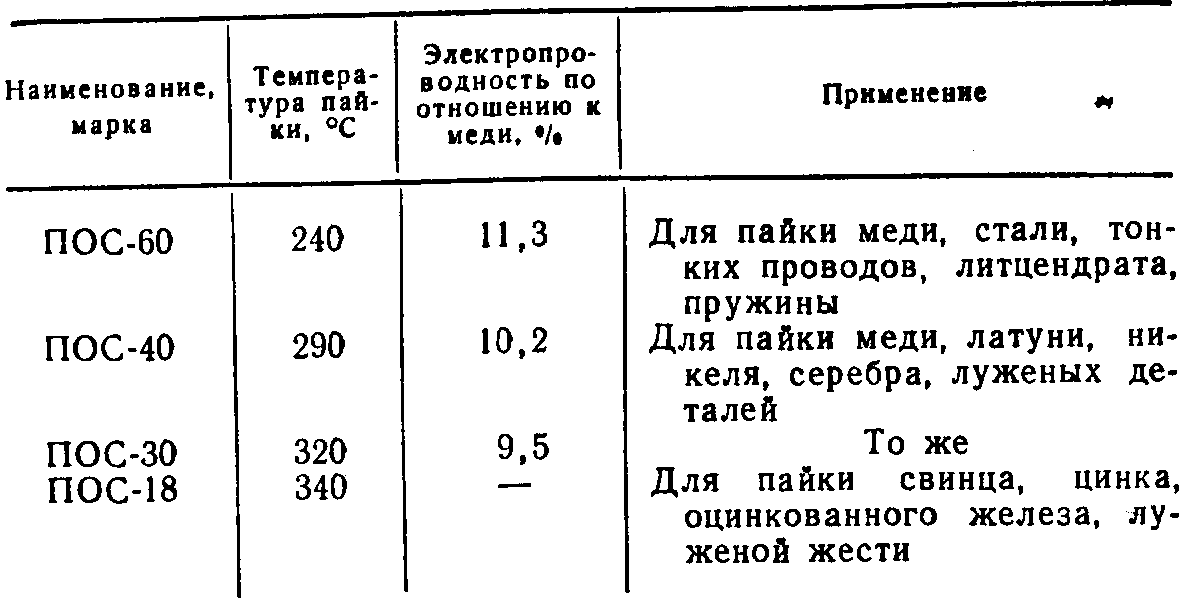 Параметры циклирования ПЦР: начальная активация ПЦР, 95 °C в течение 5 мин; амплификация, 30 циклов при 95°С в течение 30 с, 55°С в течение 30 с и 72°С в течение 30 с; окончательное удлинение, 72 °C в течение 10 мин.
Параметры циклирования ПЦР: начальная активация ПЦР, 95 °C в течение 5 мин; амплификация, 30 циклов при 95°С в течение 30 с, 55°С в течение 30 с и 72°С в течение 30 с; окончательное удлинение, 72 °C в течение 10 мин.
Все описанные здесь эксперименты были повторены для обеспечения воспроизводимости.
Как цитировать эту статью : Лю, В. и др. . Полимеразная спиральная реакция (ПСР): новый метод изотермической амплификации нуклеиновых кислот. Науч. Реп . 5 , 12723; doi: 10.1038/srep12723 (2015).
Эта работа получила поддержку Мегапроектов исследований науки и технологий Китая (грант 2013ZX10004-203) и Национальной программы исследований и разработок в области высоких технологий Китая 863 Program (грант SS2014AA022210).
Вклад авторов W.L., D.D. и З.Ю. провели эксперимент и в равной степени внесли свой вклад в это исследование в качестве первых авторов. Д.З. предоставил бактериальные штаммы.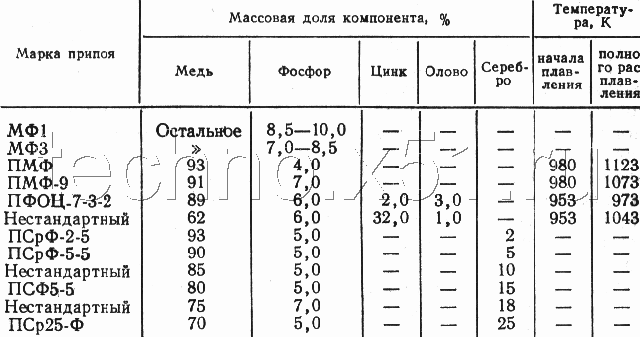 З.К. проектировал эксперименты. Дж.Ю. проанализировал данные. Л. Х. руководил проектом и написал статью.
З.К. проектировал эксперименты. Дж.Ю. проанализировал данные. Л. Х. руководил проектом и написал статью.
- Осте С. Полимеразной цепной реакции. БиоТехники 6, 162–167 (1988). [PubMed] [Google Scholar]
- Хайд С. А., Стивенс Дж., Ливак К. Дж. и Уильямс П. М. Количественная ПЦР в реальном времени. Геном Res 6, 986–994 (1996). [PubMed] [Google Scholar]
- Моррис Т., Робертсон Б. и Галлахер М. Быстрая обратная транскрипция-ПЦР обнаружение РНК вируса гепатита С в сыворотке с использованием флуорогенной системы обнаружения TaqMan. Джей Клин Микробиол 34, 2933–2936 (1996). [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Гупта Р. и другие. Диагностическое значение вложенной полимеразной цепной реакции для чувствительного обнаружения Pneumocystis jirovecii в респираторных клинических образцах. Диагностика Microbiol Infect Dis 64, 381–388 (2009). [PubMed] [Google Scholar]
- Kwoh D. Y.
и другие. Система амплификации на основе транскрипции и обнаружение амплифицированного вируса иммунодефицита человека типа 1 с использованием формата сэндвич-гибридизации на основе шариков.
 Proc Natl Acad Sci USA
86, 1173–1177 (1989). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci USA
86, 1173–1177 (1989). [Бесплатная статья PMC] [PubMed] [Google Scholar] - Fahy E., Kwoh D. Y. и Gingeras T. R. Самоподдерживающаяся репликация последовательности (3SR): изотермическая система амплификации на основе транскрипции, альтернативная ПЦР. Применение методов ПЦР 1, 25–33 (1991). [PubMed] [Google Scholar]
- Compton J. Амплификация на основе последовательности нуклеиновой кислоты. Природа 350, 91–92 (1991). [PubMed] [Google Scholar]
- Уокер Г. Т. и другие. (1992) Амплификация замещения цепи — изотермический метод амплификации ДНК in vitro. Нуклеиновые Кислоты Res 20, 1691–1696.. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Banér J., Nilsson M., Mendel-Hartvig M. & Landegren U. Усиление сигнала щупов висячих замков путем повторения катящегося круга. Нуклеиновые Кислоты Res. 26, 5073–5078 (1998). [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Notomi T.
и другие. Петлевая изотермическая амплификация ДНК.
 Нуклеиновые Кислоты Res
28, Е63 (2000). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Нуклеиновые Кислоты Res
28, Е63 (2000). [Бесплатная статья PMC] [PubMed] [Google Scholar] - Vincent M., Xu Y. & Kong H. Хеликазозависимая изотермическая амплификация ДНК. Представитель EMBO 5, 795–800 (2004). [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kurn N. и другие. Новые изотермические линейные системы амплификации нуклеиновых кислот для приложений с высокой степенью мультиплексирования. Клин Хим 51, 1973–1981 (2005). [PubMed] [Google Scholar]
- Fang R. и другие. Перекрестная амплификация для быстрого обнаружения Mycobacterium tuberculosis в образцах мокроты. Джей Клин Микробиол 47, 845–847 (2009). [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kumarasamy K.K., Toleman M.A. & Walsh T.R. Появление нового механизма устойчивости к антибиотикам в Индии, Пакистане и Великобритании: молекулярное, биологическое и эпидемиологическое исследование. Ланцет Infect Dis 10, 597–602 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Liu W.
 и другие. Чувствительное и быстрое обнаружение гена металло-бета-лактамазы Нью-Дели с помощью петлевой изотермической амплификации. Джей Клин Микробиол
50, 1580–1585 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
и другие. Чувствительное и быстрое обнаружение гена металло-бета-лактамазы Нью-Дели с помощью петлевой изотермической амплификации. Джей Клин Микробиол
50, 1580–1585 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar] - Уолш Т. Р., Уикс Дж., Ливермор Д. М. и Тоулман М. А. Распространение NDM-1 положительных бактерий в окружающей среде Нью-Дели и его последствия для здоровья человека: исследование распространенности в окружающей среде. Ланцет Infect Dis 11, 355–362 (2011). [PubMed] [Академия Google]
- Мэйби Д., Пилинг Р. В., Устиановски А. и Перкинс М. Д. Диагностика для развивающихся стран. Нат Рев Микробиол 2, 231–240 (2004) [PubMed] [Google Scholar]
- Цзоу Д. Ю., Лю В. и Шан В. Клонирование и экспрессия гена bla NDM-1 в Escherichia coli и обнаружение лекарственной устойчивости. Письма в биотехнологии 23, 662-4, 672 (2012). [Google Scholar]
Статьи из Scientific Reports предоставлены здесь с разрешения Издательская группа Nature
цена от поставщика Evek GmbH / Evek
Иностранные бренды.

Серебряные припои, такие как Rothenberger, Rolot S2, имеют сложный многокомпонентный сплав на основе меди. 1,5-2,5% Ag, 5,9-6,5% фосфора, плюс легирующие добавки, такие как кадмий, олово и другие, повышающие качество соединения. Температура плавления: 650-810°С. Подходит для таких материалов, как латунь, медь и бронза. Для латуни и бронзы рекомендуется флюс-паста LP5. Но такие припои не годятся для железоникелевых медно-никелевых сплавов.
Припои PSR
Наиболее продаваемыми марками являются PSR 2, PSR 15, PSR 72, которые наиболее практичны в использовании.
| Сплав | Фе | Аг | Как | Сн | Пб | CD | Сб | Би | Примеси |
|---|---|---|---|---|---|---|---|---|---|
| PSR2 | ≤0,15 | 1,7-2,3 | — | 29-31 | 61-64,65 | 4,5-5,5 | — | ≤0,01 | ≤0,15 |
Припои PSRMC 37,5 и PSR 2,5 менее популярны на рынке.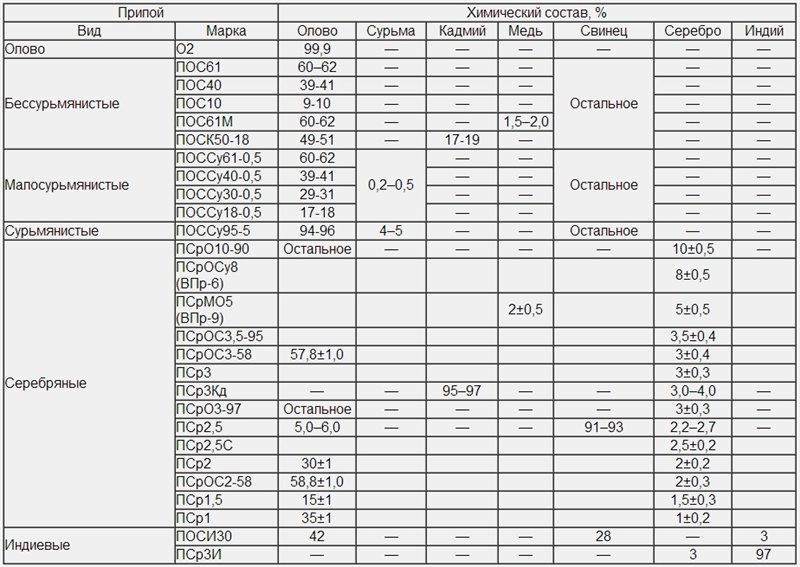 Классификация разделяет припои PSR на мягкие и твердые. К первым относятся те, у которых температура ниже 300 °С. Соответственно, твердый припой плавится при t° более 300 °С… Существуют технические таблицы соответствия номера ПСР припоя и температуры плавления. Например, припой ПСР 72 имеет температуру плавления 780 °С, а припой ПСР 2,5 — 765 °С. PSRMC 37 — это тип серебряного припоя. Имеет температуру плавления около 692°С. Это означает, что его можно классифицировать как твердый припой.
Классификация разделяет припои PSR на мягкие и твердые. К первым относятся те, у которых температура ниже 300 °С. Соответственно, твердый припой плавится при t° более 300 °С… Существуют технические таблицы соответствия номера ПСР припоя и температуры плавления. Например, припой ПСР 72 имеет температуру плавления 780 °С, а припой ПСР 2,5 — 765 °С. PSRMC 37 — это тип серебряного припоя. Имеет температуру плавления около 692°С. Это означает, что его можно классифицировать как твердый припой.
| Сплав | Фе | Аг | Как | Сн | Пб | CD | Сб | Би | Примеси |
|---|---|---|---|---|---|---|---|---|---|
| PSR2.5 | ≤0,15 | 2,2-2,8 | — | 5-6 | 91-92,65 | — | — | ≤0,01 | ≤0,15 |
Преимущества
Выдерживают высокие температуры.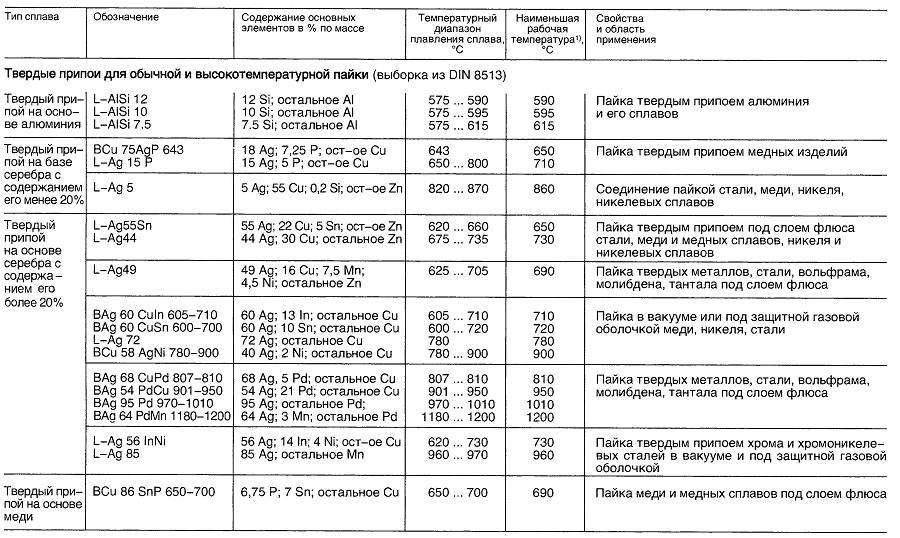 Для соединения меди с медью флюс не требуется. Не вызывает коррозии, экологически безопасен, обладает высокой текучестью, высокими деформационными характеристиками, подходит для паяльных систем, подвергающихся значительным механическим или термическим нагрузкам.
Для соединения меди с медью флюс не требуется. Не вызывает коррозии, экологически безопасен, обладает высокой текучестью, высокими деформационными характеристиками, подходит для паяльных систем, подвергающихся значительным механическим или термическим нагрузкам.
Применение
Идеально подходит для капиллярно-щелевой пайки медных труб в системах холодного и горячего водоснабжения, газоснабжения (жидкий, природный газ), а также для монтажа холодильных установок, систем кондиционирования и нефтепроводов. Эти припои специально разработаны для капиллярно-щелевой пайки медных трубопроводов без использования фитингов.
Припой HTS
Используется при пайке алюминия. Позволяет выполнять работы без использования флюса, что очень удобно, так как алюминий покрыт плотной оксидной пленкой, но только припой hts 2000 способен дать качественный шов. Этот припой очень практичен. Для низкотемпературной сварки изделий из цветных металлов применяют газовую горелку, например кислородно-ацетиленовую, пропановую или МАПП.

