Радиус атома меди: Объяснить, почему радиус атома меди (135 пм) меньше, чем радиус атома калия (236 пм)
alexxlab | 08.01.2023 | 0 | Разное
33. Размеры атомов и ионов. . Общая химия
Рассмотрим зависимость некоторых свойств атомов от строения их электронных оболочек. Остановимся, прежде всего, на закономерностях изменения атомных и ионных радиусов.
Электронные облака не имеют резко очерченных границ. Поэтому понятие о размере атома не является строгим. Но если представить себе атомы в кристаллах простого вещества в виде соприкасающихся друг с другом шаров, то расстояние между центрами соседних шаров (т.е. между ядрами соседних атомов) можно принять равным удвоенному радиусу атома. Так, наименьшее межъядерное расстояние в кристаллах меди равно 0,256 нм; это позволяет считать, что радиус атома меди равен половине этой величины, т.е. 0,128 нм.
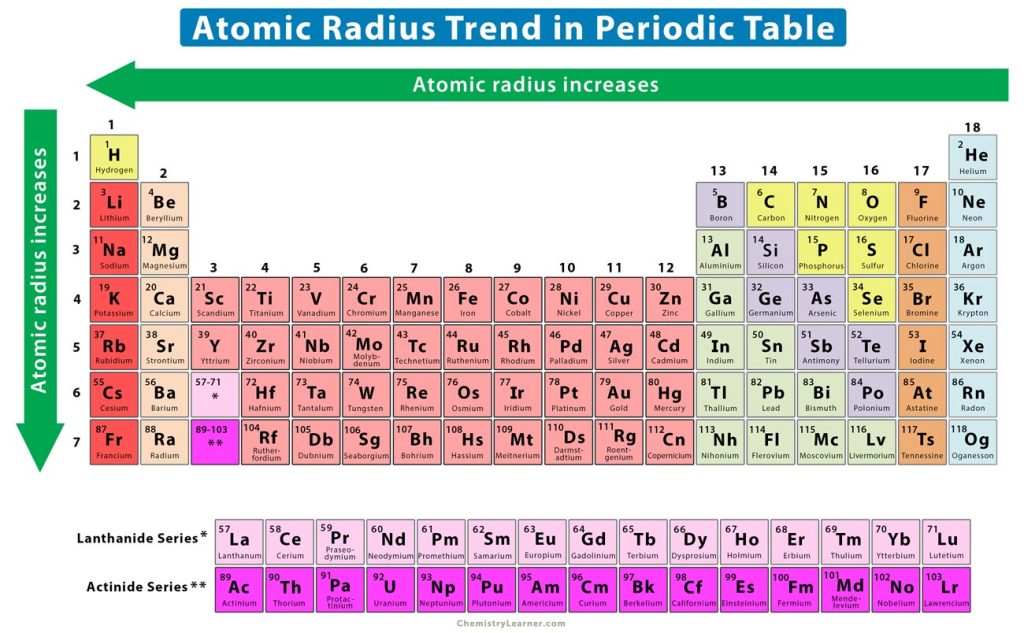
Зависимость атомных радиусов от заряда ядра атома Z имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атома, что особенно четко наблюдается в коротких периодах (радиусы атомов приведены в нм):
Это объясняется увеличивающимся притяжением электронов внешнего слоя к ядру по мере возрастания его заряда.
С началом застройки нового электронного слоя, более удаленного от ядра, т.е. при переходе к следующему периоду, атомные радиусы возрастают (сравните например, радиусы атомов фтора и натрия). В результате в пределах подгруппы с возрастанием заряда ядра размеры атомов увеличиваются. Приведем в качестве примера значения атомных радиусов (в нм) элементов некоторых главных подгрупп:
– 95 –
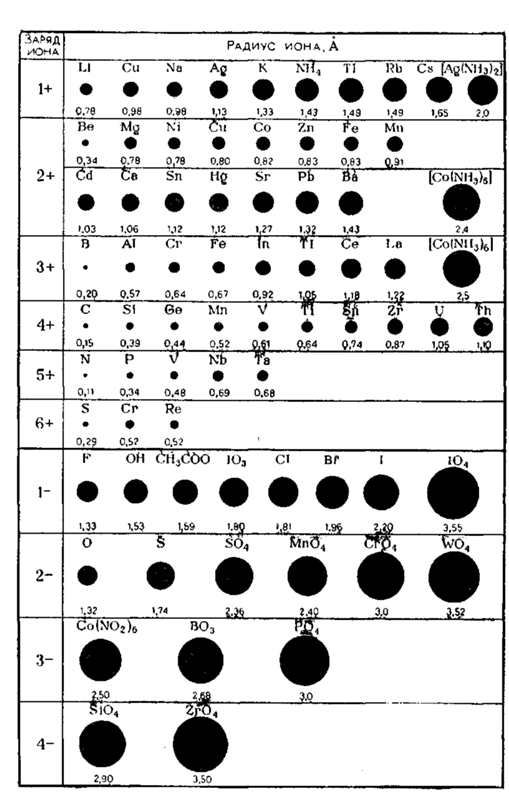
Электроны наружного слоя, наименее прочно связанные с ядром, могут отрываться от атома и присоединяться к другим атомам, входя в состав наружного слоя последних. Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, так как заряд ядра атома превышает сумму зарядов оставшихся электронов. Наоборот, атомы, присоединившие к себе лишние электроны, заряжаются отрицательно. Образующиеся заряженные частицы называются ионами.
Ионы обозначают теми же символами, что и атомы, указывая справа вверху их заряд: например, положительный трехзарядный ион алюминия обозначают Al3+, отрицательный однозарядный ион хлора — Cl–.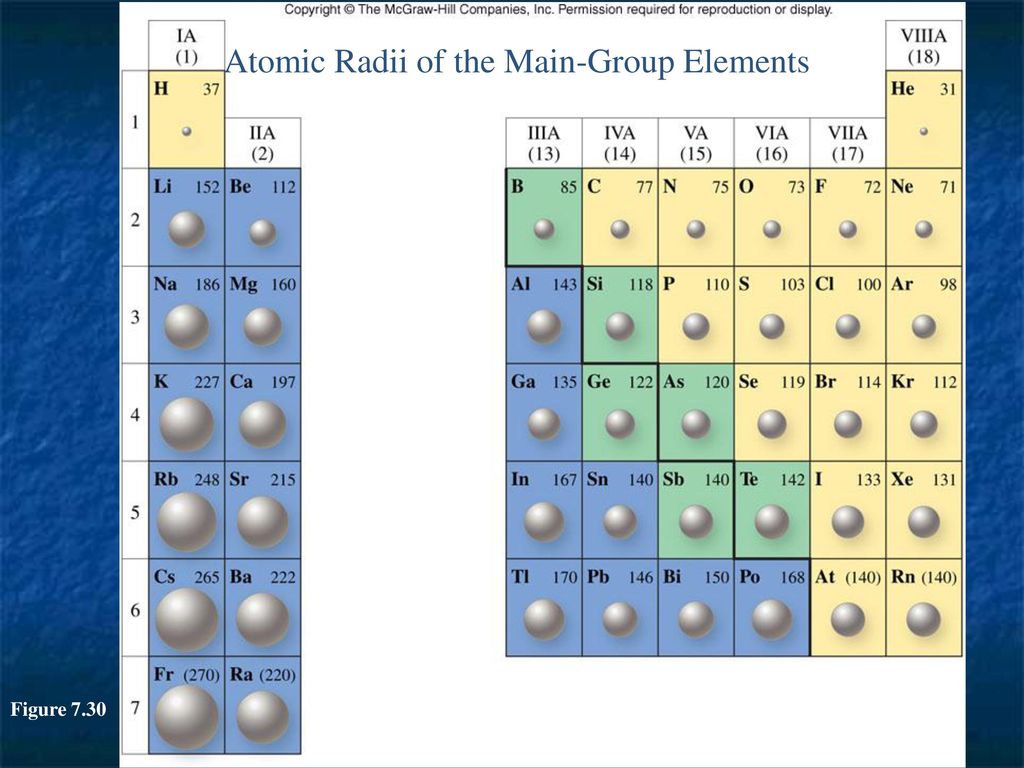
Потеря атомов электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов — к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома. Так, радиус атома калия составляет 0,236 нм, а радиус иона K+ -0,133 нм; радиусы атома хлора и иона Cl– соответственно равны 0,099 и 0,181 нм. При этом радиус иона тем сильней отличается от радиуса атома, чем больше заряд иона. Например, радиусы атома хром и ионов Cr
В пределах одной подгруппы радиусы ионов одинакового заряда возрастают с увеличением заряда ядра. Это иллюстрируется следующими примерами (радиусы ионов даны в нм):
Такая закономерность объясняется увеличением числа электронных слоев и растущим удалением внешних электронов от ядра.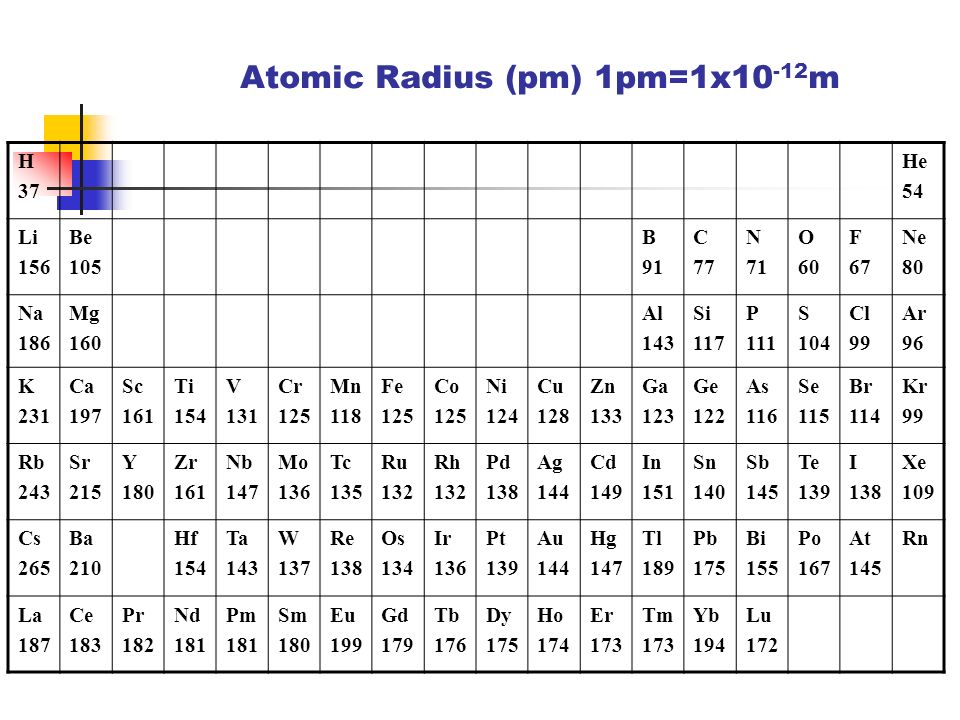
внутриклеточное преобразование сульфата меди в одноатомную медь / Хабр
Планету Земля часто называют колыбелью жизни, и в этом титуле совсем мало преувеличений. Жизнь можно найти и в вечнозеленых тропиках, и в знойных пустынях, и на бескрайних ледяных просторах, и даже в жерлах подводных вулканов. Как сказал Ян Малкольм в фильме «Парк Юрского периода»: «life finds a way». Ученые из Хьюстонского университета провели исследование любопытных бактерий, проживающих в шахтах Бразилии и способных преобразовывать ионы сульфата меди (CuSO4) в одноатомную нуль-валентную медь (Cu0). Чем столь интересен это процесс, и как его можно применить в мире людей? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
Тяжело представить современный мир без меди. Электрические, магнитные, оптические, антимикробные и каталитические свойства позволяют применять медь во множестве отраслей, от солнечных элементов до антимикробных покрытий.
Недавние исследования показали, что многие микроорганизмы, такие как бактерии и грибы, могут продуцировать неорганические наночастицы (НЧ): Ag, Au, Cu, CuO, магнетит и т.д. Особенно любопытны труды, где описан синтез наночастиц меди в диапазоне от 10 до 40 нм внутри- и внеклеточно с использованием бактерий. В данном случае использовались ферменты редуктазы, такие как NADPH (восстановленная форма никотинамидадениндинуклеотидфосфата, C21H29N7O17P3), обладающих окислительно-восстановительным потенциалом для восстановления ионов металлов. Но то, как микроорганизмы естественным образом синтезируют CuO (в размере от 170 до 179 мкм), ранее было неясно.
Почему синтез одноатомной меди столь привлекателен? Дело в том, что отдельные атомы можно использовать и в катализе, и в легировании, и в энергетике.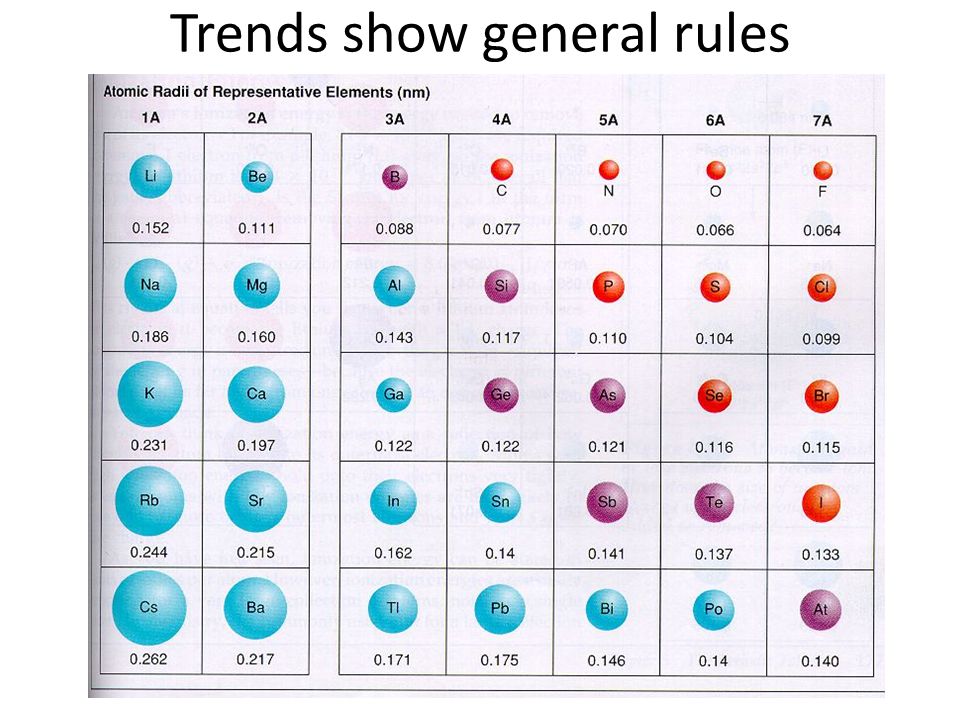
Именно потому ученые решили детально изучить бактерии, которые самостоятельно выполняют одноатомный синтез меди без каких-либо токсичных реагентов.
Результаты исследования
В качестве подопытных были выбраны бактерии, обитающие в рудниках Бразилии (6°27′15.848″ ю.ш. и 50°4′37.507 ″ з.д.).
Изображение №1
Обнаружение изолята из рода Bacillus, способного продуцировать одноатомную медь внутриклеточно, было зарегистрировано с помощью визуального наблюдения изменений цвета среды для роста бактерий с CuSO 4 через 48 часов. Изменение цвета с зеленого (CuSO4 + бактерии) на оранжевый указывает на преобразование CuSO4 в Cu0 (1A). Дополнительным подтверждением наличия Cu0 стали результаты просвечивающей электронной микроскопии (ПЭМ), где показаны бактерии после 48 часов инкубации в сульфате меди (1B). На 1C и 1D показаны снимки бактерии с большим и меньшим увеличением соответственно. Также на 1D отчетливо видны отдельные атомы меди.
Дополнительным подтверждением наличия Cu0 стали результаты просвечивающей электронной микроскопии (ПЭМ), где показаны бактерии после 48 часов инкубации в сульфате меди (1B). На 1C и 1D показаны снимки бактерии с большим и меньшим увеличением соответственно. Также на 1D отчетливо видны отдельные атомы меди.
Для определения габаритов атомов меди было проанализировано около 13000 атомов (1E). Радиус каждого атома находился в пределах от 1.7 до 1.85 Å. На диаграмме размаха (1F) суммированы фактическое распределение населенности и размеры всех измеренных атомов, обнаруженных на ПЭМ снимках. Более 75% атомов меди имели радиус 1.89 ± 0.19 Å. Более крупные размеры ученые рассматривают как перекрытие атомов меди на снимках, когда один атом находится слишком близко к другому.
Данные размеры говорят о том, что обнаруженные атомы это именно нейтральные атомы меди (с нулевой валентностью, Cu0). Радиусы Cu1+, Cu2+ и Cu3+ находятся в диапазоне от 0.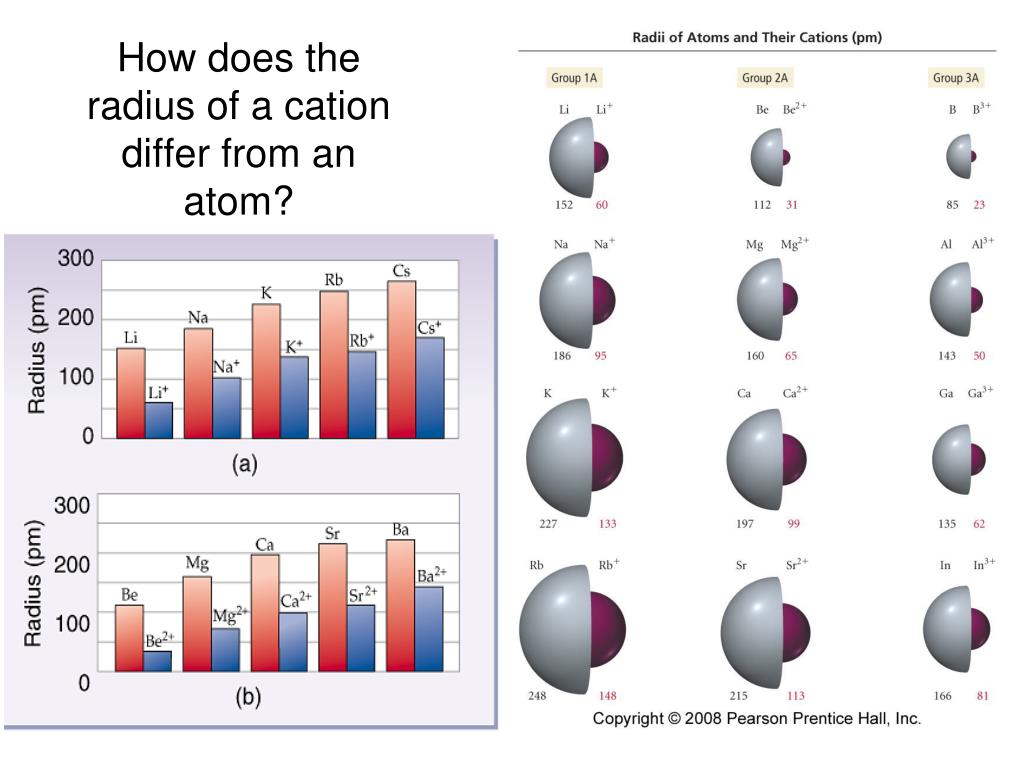 54 до 0.63, т.е. не попадают в диапазон наблюдаемых радиусов. Это дополнительно подтверждает, что присутствующая в образцах медь это именно Cu0.
54 до 0.63, т.е. не попадают в диапазон наблюдаемых радиусов. Это дополнительно подтверждает, что присутствующая в образцах медь это именно Cu0.
Распределение элементов в клетках было определено с помощью энергодисперсионной спектроскопии (EDS от energy dispersive spectroscopy). Молибденовая сетка гарантировала, что все медные сигналы, обнаруженные EDS, принадлежат исключительно бактериям (снимки ниже).
Визуализация в режиме обратного рассеяния показывает четкий контраст между более тяжелыми и более легкими атомами, в данном случае между медью и углеродом, азотом и кислородом.
Следовательно, медь является одним из наиболее распространенных элементов в образце, а Cu0 — самым распространенным типом меди. Это было дополнительно подтверждено анализом результатов рентгеновской фотоэлектронной спектроскопии (3A).
Изображение №3
На графиках 3B и 3C показана спектроскопия характеристических потерь энергии электронами (EELS от electron energy loss spectroscopy) меди.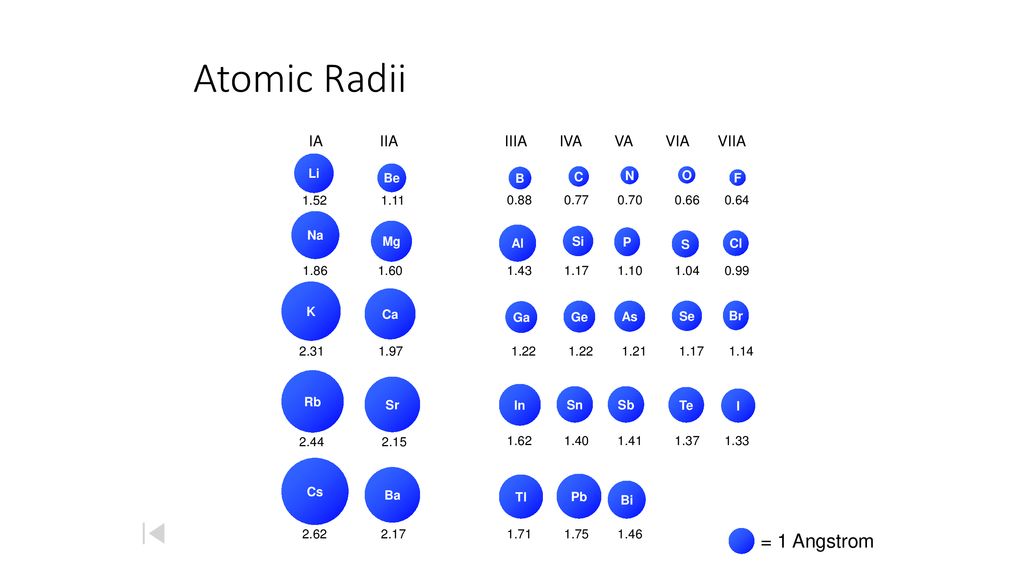 В первом EELS спектре (3B) можно увидеть присутствие углерода, азота и кислорода, которые являются типичными компонентами органического вещества, входящего в состав бактерий. Уровень энергии для каждого из этих элементов составил: 290 эВ — углерод; 400 эВ — азот и 530 эВ — кислород.
В первом EELS спектре (3B) можно увидеть присутствие углерода, азота и кислорода, которые являются типичными компонентами органического вещества, входящего в состав бактерий. Уровень энергии для каждого из этих элементов составил: 290 эВ — углерод; 400 эВ — азот и 530 эВ — кислород.
Медь обычно обнаруживается в диапазоне от 931 до 953 эВ. Но в данном случае обнаружить ее с помощью EELS было невозможно (3C). Ученые объясняют это толщиной одноатомной меди, что является известным ограничением этого метода. Однако с помощью EELS удалось установить, что атомы меди распространены в клетках остаточно равномерно, а вероятность их кластеров крайне мала в отличие от углерода, азота и кислорода.
На графиках 3D–3F показаны результаты рентгеновской фотоэлектронной спектроскопии C 1s, O 1s и Cu 2p на уровне ядра, полученные от меди, синтезированной Bacillus, спустя 48 часов инкубации.
Спектр C 1s (3D) представляет три компонента при 285.8, 287 и 288. 9 эВ, соответствующих связям между белком/пептидами и атомарной медью. Область XPS-спектров O 1s на уровне ядра ( 3E) показывает максимум энергии связи при 532.8 эВ, соответствующий карбоксильным группам, которые принадлежат белкам на поверхности атомарной меди. Cu 2p показывает два пика при 932.3 и при 952.0 эВ, которые соответствуют энергиям связи 2p3/2 и 2p1/2 электронов Cu0 (3F). Эти наблюдения указывают на то, что тип меди, синтезируемой бактериями, это именно одноатомная медь, т.е. Cu0.
9 эВ, соответствующих связям между белком/пептидами и атомарной медью. Область XPS-спектров O 1s на уровне ядра ( 3E) показывает максимум энергии связи при 532.8 эВ, соответствующий карбоксильным группам, которые принадлежат белкам на поверхности атомарной меди. Cu 2p показывает два пика при 932.3 и при 952.0 эВ, которые соответствуют энергиям связи 2p3/2 и 2p1/2 электронов Cu0 (3F). Эти наблюдения указывают на то, что тип меди, синтезируемой бактериями, это именно одноатомная медь, т.е. Cu0.
Полностью удостоверившись в том, что бактерии производят одноатомную медь, ученым осталось понять, как именно это происходит.
Сначала белки бактерий идентифицировали в двух различных условиях роста: культивирование без сульфата меди (контрольная группа) и с сульфатом меди (CuSO4; 100 мг/л). В контрольной группе было зафиксировано экспрессию 652 белков, а в группе с CuSO4 — 458 белка. Из этих 458 белков 313 одинаково экспрессировались в обоих условиях роста, а 145 белков экспрессировались только в присутствии сульфата меди.
Большинство белков (102 белка) участвовали в первичном метаболизме (углерод и энергия). Следовательно, Cu влияет на клетку негативным образом, вызывая выработку большей энергии, дабы пережить это воздействие. Пятнадцать белков участвовали в функциях устойчивости и стресса, а три из них выполняли функции транспорта и поглощения Cu клеткой.
Среди белков, задействованных в транспорте меди, были регулируемый железом транспортер SufB, переносящая медь аденозинтрифосфатаза P-типа (ATPase) и Copz.
Copz — это шаперонный* белок, выполняющий роль внутриклеточной секвестрации (накопления) и транспорта Cu+ из цитоплазмы* в периплазму*.
Шапероны* — белки, выполняющие функцию восстановления правильной нативной третичной или четвертичной структуры белка, а также образование и диссоциация белковых комплексов.
Цитоплазма* — полужидкое содержимое клетки.Периплазма* — обособленный компартмент клеток грамотрицательных бактерий.
Остальные 11 белков, идентифицированные в присутствии сульфата меди, были белками, которые могут участвовать в биосинтезе и стабилизации одноатомной меди. Шесть из них восстанавливают либо сульфат, либо металлы: тиолдисульфид изомераза / тиоредоксин; тиоредоксинредуктаза (TRXR), дикластер 4Fe-4S, ферредоксин 4Fe-4S, дисульфидредуктаза семейства TlpA и сульфатаденилилтрансфераза.
Учитывая функции этих белков, можно предположить, что они восстанавливают сульфат из CuSO4, оставляя свободную токсичную медь (Cu2+) внутри клеток.
Изображение №4
Продукция наночастиц Se с помощью Stenotrophomonas maltophilia показала возможную ассоциацию с алкогольдегидрогеназой. В рамках данного исследования в бактериях Bacillus были идентифицированы два белка-гомолога: NADH (восстановленная форма никотинамидадениндинуклеотида) — зависимая бутанолдегидрогеназа А и NADH-зависимая бутанолдегидрогеназа.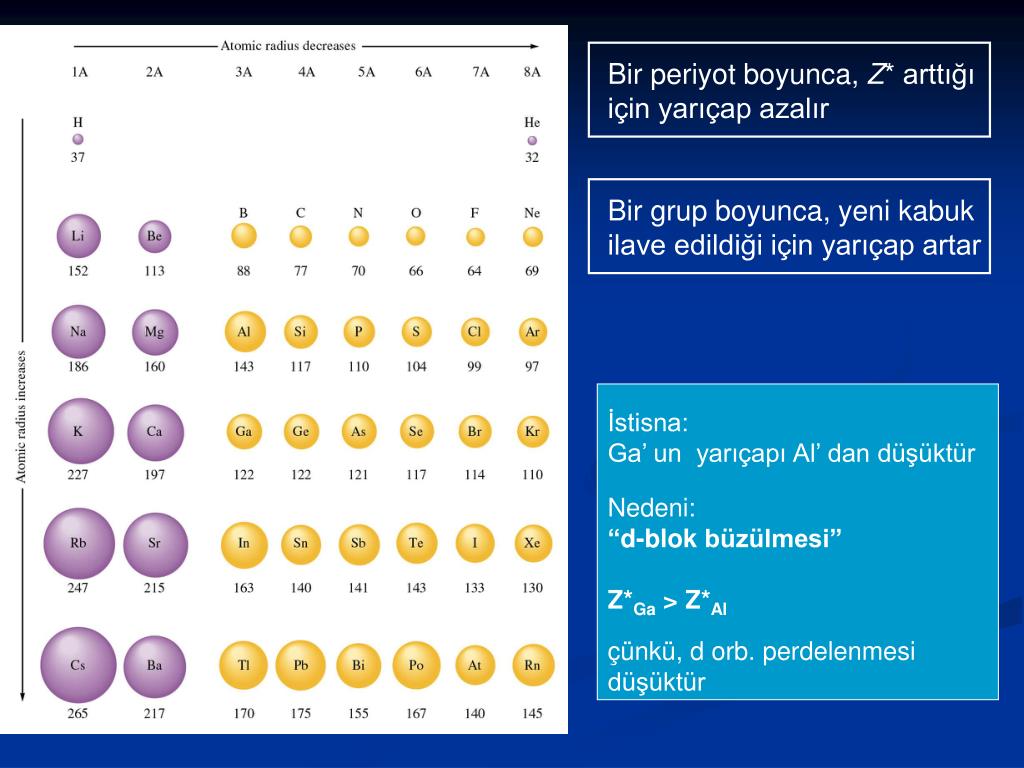
Подобная находка указывает на то, что белки могут участвовать в биогенном синтезе одноатомной меди. Также в бактериях были выявлены белки семейства Ferritin Dps и индуцируемый голоданием ДНК-связывающий белок (Dps от DNA binding protein). Ранее высказывалось мнение, что пути синтеза наночастиц с участием этих белков включают процессы автоокисления, гидроксилирования или восстановления. Но пока это лишь теория.
В данном труде ученые предположили, что в процессе преобразования Cu2+ в Cu0 важную роль играет белок ферритин*.
Ферритин* — сложный белковый комплекс, выполняющий роль основного внутриклеточного хранилища железа.
Вероятно, комбинация этого белка и других белков, экспрессируемых в Bacillus, в среде с добавлением сульфата меди напрямую связано с биосинтезом одноатомной меди (изображение №4).
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.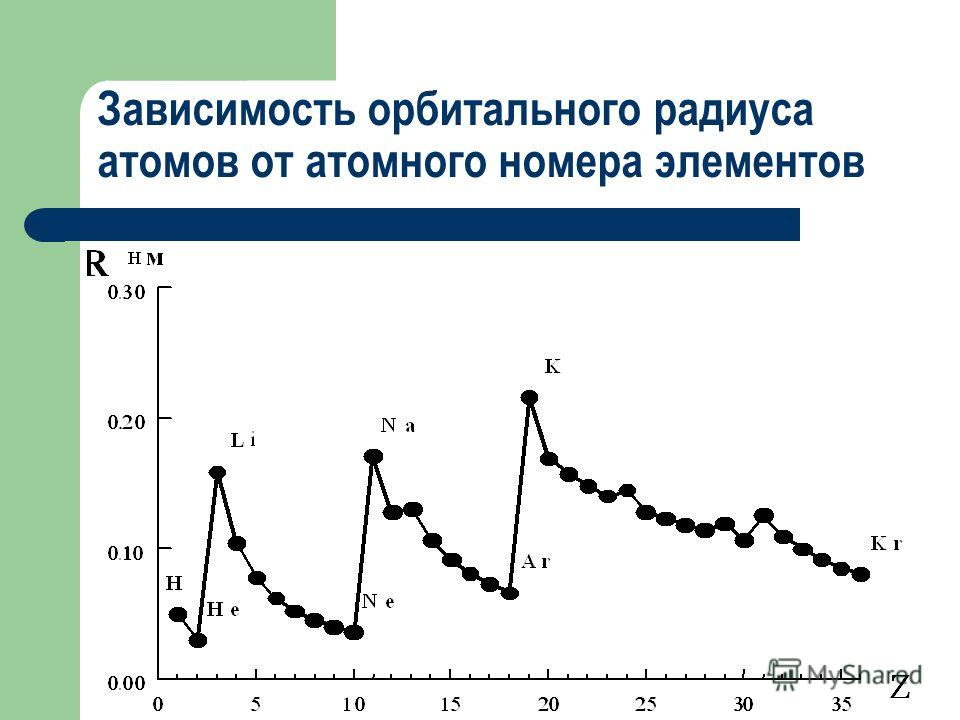
Эпилог
В данном труде ученые исследовали довольно любопытный организм — бактерию Bacillus, способную внутриклеточно синтезировать одноатомную медь (Cu0) из сульфата меди (CuSO4). Данный процесс, являющийся естественным для бактерий, крайне сложно воспроизвести с помощью даже самых современных технологий и методик. Для производства одноатомной меди люди вынуждены применять токсичные реагенты, тогда как бактерии в этом не нуждаются.
По словам авторов труда, их результаты позволяют лучше понять, как столь малые организмы способны регулировать столь сложные химические реакции. Кроме того, это исследование может стать основой для промышленного производства атомарной меди, которое будет лишено прежних недостатков, но обретет новые преимущества, такие как снижение стоимости производства.
Учитывая, что медь используется во многих направлениях (от антибактериального покрытия до электроники), подобного рода открытия действительно несут в себе немалый потенциал.
Важно отметить и то, что изученные бактерии могут быть далеко не единственными микроорганизмами, способными синтезировать одноатомные металлы, которые найдут свое применение в науке, технике и медицине.
Благодарю за внимание, оставайтесь любопытствующими и хорошей всем рабочей недели, ребята. 🙂
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас:Вся правда о VPS (KVM) E5-2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5-2430 2.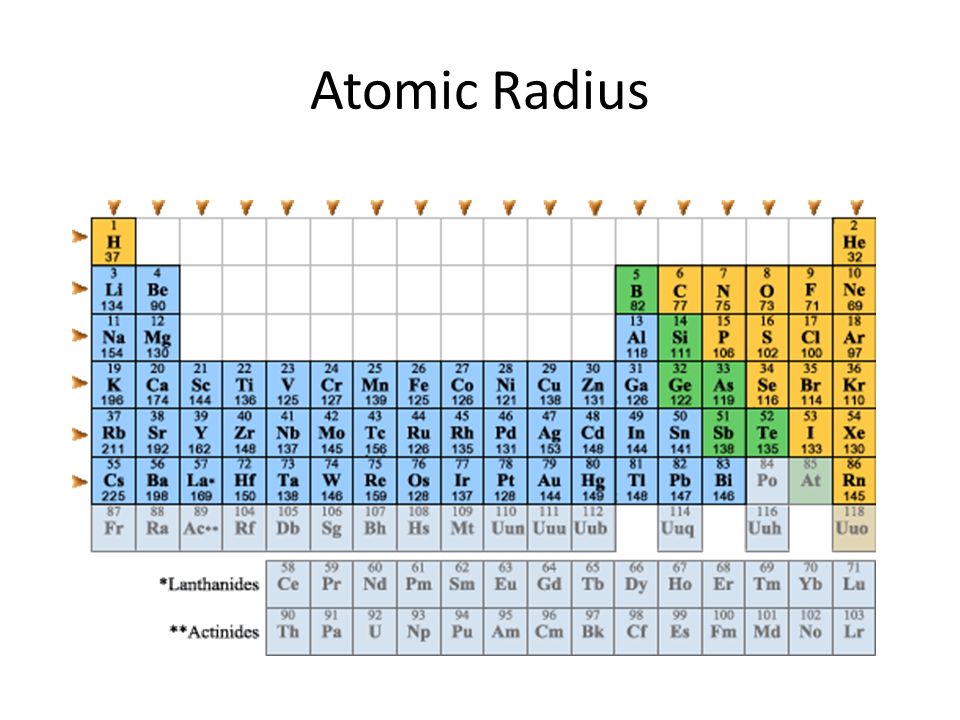 2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5-2650 v4 стоимостью 9000 евро за копейки?
WebElements Periodic Table » Медь » радиусы атомов и ионов
29 Cu
Доступные свойства меди…
Одним из показателей размера является расстояние между элементами внутри элемента. Однако не всегда легко провести разумное сравнение между элементами, так как некоторые связи довольно короткие из-за множественной связи (например, расстояние O=O в O 2 короткое из-за двойной связи, соединяющей два атома). длина связи в CuCu: 255,6 пм.
Существует несколько других способов определения радиуса атомов и ионов. Следуйте соответствующим гиперссылкам для ссылок на литературу и определения каждого типа радиуса. Все значения радиусов даны в пикометрах (пм). Коэффициенты пересчета:
- 1 пм = 1 × 10 ‑12 метр (метр)
- 100 пм = 1 Ангстрем
- 1000 пм = 1 нанометр (нм, нанометр)
Нейтральные радиусы
Размер нейтральных атомов зависит от способа измерения и окружающей среды. Следуйте соответствующим гиперссылкам для определения каждого типа радиуса. Термин «атомный радиус» не особенно полезен, хотя его использование широко распространено. Проблема в его значении, которое явно сильно различается в разных источниках и книгах. Здесь приведены два значения, одно основано на расчетах, а другое на наблюдениях — перейдите по соответствующей ссылке для получения дополнительной информации.
Следуйте соответствующим гиперссылкам для определения каждого типа радиуса. Термин «атомный радиус» не особенно полезен, хотя его использование широко распространено. Проблема в его значении, которое явно сильно различается в разных источниках и книгах. Здесь приведены два значения, одно основано на расчетах, а другое на наблюдениях — перейдите по соответствующей ссылке для получения дополнительной информации.
| Радиусный тип | Значение радиуса / пм | Ссылка периодичности |
|---|---|---|
| Атомный радиус (эмпирический) | 135 | |
| Атомный радиус (расчетный) | 145 | |
| Ковалентный радиус (значения 2008 г.) | 132 | |
| Ковалентный радиус молекулярной одинарной связи | 112 (координационный номер 2) | |
| Ковалентный радиус молекулярной двойной связи | 115 | |
| Ковалентный радиус молекулярной тройной связи | 120 | |
| Ковалентный радиус (эмпирический) | 138 | |
| Радиус Ван-дер-Ваальса | 238 |
 Изображение, показывающее периодичность ковалентного радиуса одинарной связи для химических элементов в виде шариков с кодом размера на сетке периодической таблицы.
Изображение, показывающее периодичность ковалентного радиуса одинарной связи для химических элементов в виде шариков с кодом размера на сетке периодической таблицы.Радиус орбиты валентной оболочки
Ниже приведены расчетные значения радиусов орбит валентных оболочек, R max
| Орбитальный | Радиус [/pm] | Радиус [/AU] | Ссылка периодичности |
|---|---|---|---|
| с орбитальный | 137,4 | 2,59609 | |
| р-орбитальный | – | – | |
| д орбитальный | 32,5 | 0,613359 | |
| ф орбитальный | – | – |

Каталожные номера
Значения R max для валентных орбиталей нейтральных газообразных элементов взяты из ссылки 1.
- Дж. Б. Манн, Расчеты атомной структуры II. Волновые функции Хартри-Фока и значения радиального среднего: от водорода к лоуренцию , LA-3691, Лос-Аламосская научная лаборатория, США, 1968.
Ионные радиусы
В этой таблице приведены некоторые ионные радиусы. В этой таблице геометрия относится к расположению ближайших соседей иона. Размер зависит от геометрии и окружающей среды. Для электронных конфигураций, где это имеет значение, значения, указанные для октаэдрических частиц, являются низкоспиновыми, если не указано, что они высокоспиновые. Условия низкоспиновый и высокоспиновый относятся к электронным конфигурациям определенной геометрии определенных d -блочных ионов металлов. Дополнительная информация доступна в учебниках по неорганической химии, обычно на уровне 1 или на уровне первого курса университета. Для определения ионного радиуса и дополнительной информации перейдите по гипертекстовой ссылке.
Для определения ионного радиуса и дополнительной информации перейдите по гипертекстовой ссылке.
| Ион | Тип координации | Радиус / пм | Ссылка периодичности |
|---|---|---|---|
| Cu(I) | 4-coordinate, tetrahedral | 74 | |
| Cu(II) | 4-coordinate, tetrahedral | 71 | |
| Cu(II) | 4-coordinate, square-planar | 71 | |
| Cu(I) | 6-coordinate, octahedral | 91 | |
| Cu(II) | 6-coordinate, octahedral | 87 | |
| Cu(III) | 6-координатный, октаэдрический | 68 |
Ионные радиусы Полинга
| Ион | Радиус полинга / пм | Ссылка периодичности |
|---|---|---|
| Cu(I) | 96 |
переходных элементов вопрос 1
Этот вопрос является хорошим примером добросовестного студента, пытающегося прочитать в утверждении программы больше, чем есть на самом деле.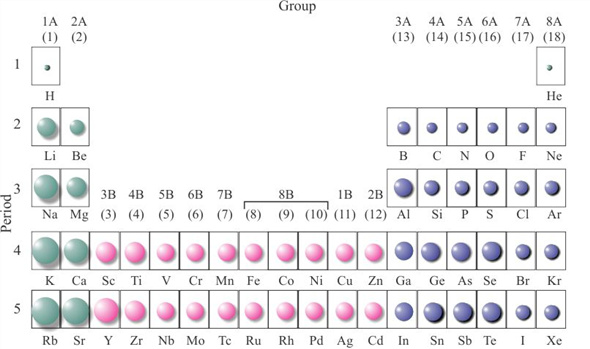 Оно поступило от CIE (Cambridge International). Ученик уровня A, который более тщательно обдумал конкретную тему, чем это было полезно для него!
Оно поступило от CIE (Cambridge International). Ученик уровня A, который более тщательно обдумал конкретную тему, чем это было полезно для него!
Он хотел знать: “Атомный радиус цинка составляет 0,137 нм, а у меди – 0,128 нм (взято из моего текста уровня A). Так почему… энергия ионизации цинка выше?”
Он также спросил: «Подобно атомному радиусу и энергии ионизации, ионный радиус (для какого-то конкретного заряда, скажем, 2+) следует той же схеме, что и атомный радиус?»
Утверждение в части переходных элементов этой программы гласило: «Кандидат должен быть в состоянии: … заявить, что атомные радиусы, ионные радиусы и первая энергия ионизации переходных элементов относительно инвариантны».
Это означает, что атомные и ионные радиусы, а также первая энергия ионизации не сильно меняются в серии переходов. Обратите внимание, что здесь также говорится «указать», а не «объяснить».
Как бы то ни было, этот конкретный студент довольно подробно изучил данные — часто опасная вещь на этом уровне химии! Он пытался связать воедино объяснения трендов атомных радиусов и энергии ионизации по мере прохождения первой серии переходов от скандия к цинку.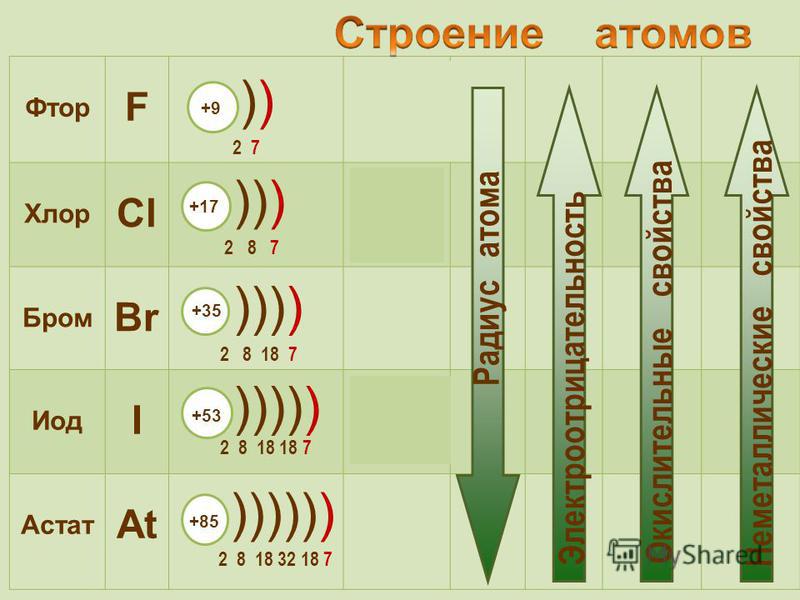
Прежде чем вы продолжите чтение, я избавлю меня от необходимости повторять материал из других мест на сайте, если вы сначала прочитаете фрагменты о переходных металлах на страницах о
энергии ионизации
атомные радиусы
Раздельное рассмотрение двух частей вопроса:
Атомный радиус цинка составляет 0,137 нм, а у меди — 0,128 нм (взято из моего текста уровня A). Так почему . . . Энергия ионизации цинка выше?
Энергия первой ионизации меди +746 кДж моль -1 ; цинк = +906. (Эти значения немного различаются в зависимости от того, какой источник данных вы используете, но только на кДж или два.) Объяснение более высокого значения цинка довольно простое, и вы найдете его на странице энергии ионизации выше.
Высокая энергия ионизации создается факторами, которые вызывают более сильное притяжение внешних электронов к ядру. Вы могли бы подумать, что обычно это приводит к уменьшению атомного радиуса, потому что большее притяжение будет притягивать эти электроны ближе к ядру.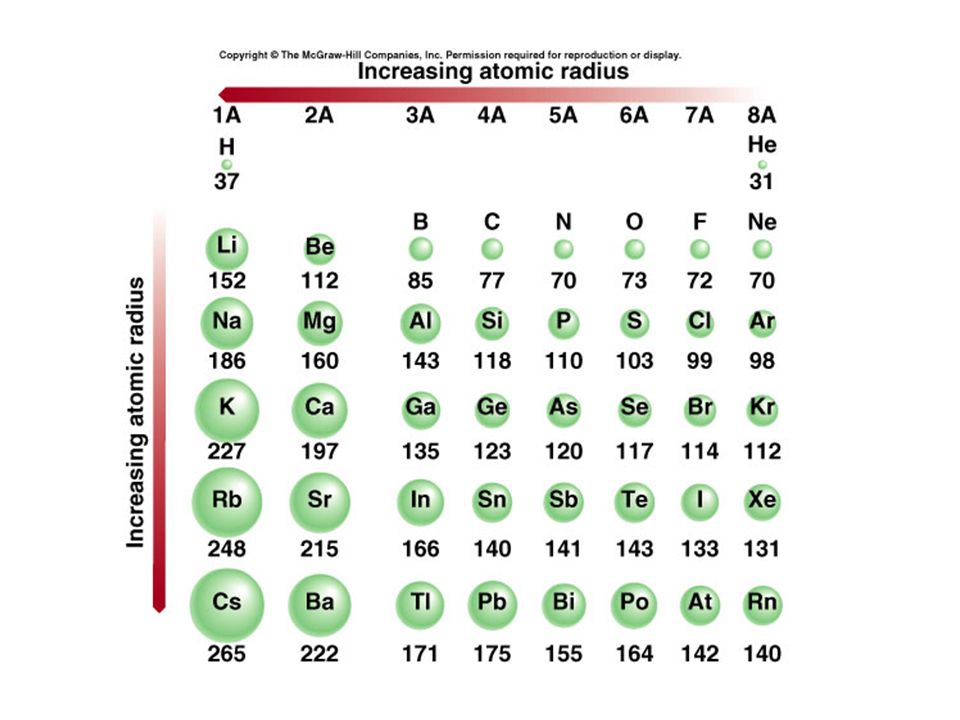 Но вопрос предполагает, что цинк имеет более крупный атом.
Но вопрос предполагает, что цинк имеет более крупный атом.
Какой атом на самом деле больше?
Моей первой мыслью было, что радиусы атомов, данные вопрошающим, были неправильными, потому что тогда проблема исчезла бы. Если вы выполните быстрый поиск в Google, вы найдете много вариаций как для цинка, так и для меди — я быстро нашел значения радиусов в диапазоне от 0,128 до 0,157 нм для меди и от 0,133 до 0,153 нм для цинка. Я понятия не имею, что такое “правильные” значения.
В некоторых списках данных атом меди меньше; в других цинка меньше.
Что, если цинк меньше меди?
Если бы цинк был меньшим атомом, проблема, казалось бы, исчезла – у вас был бы атом с большей энергией ионизации, чем у меди, и атом меньшего размера. Это соответствовало бы обычным объяснениям.
Что, если цинк больше меди?
Если цинка больше, чем меди, то на первый взгляд может показаться, что здесь настоящая трудность.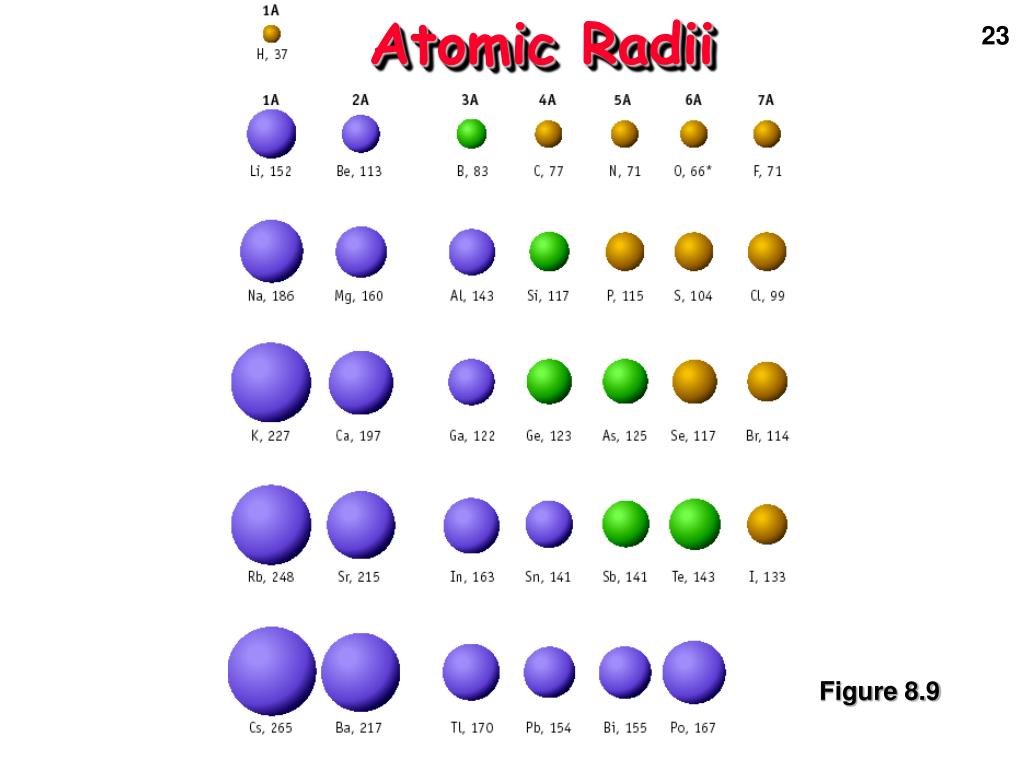 Энергия ионизации цинка больше, чем у меди. Это означает, что внешние электроны удерживаются более прочно. И все же некоторые данные показывают, что атом цинка больше. Это выглядит противоречиво.
Энергия ионизации цинка больше, чем у меди. Это означает, что внешние электроны удерживаются более прочно. И все же некоторые данные показывают, что атом цинка больше. Это выглядит противоречиво.
Возможное решение
Если атомы цинка действительно больше атомов меди, то я думаю, что у меня есть возможный способ обойти эту проблему. Впрочем, это всего лишь предположение, доказательств у меня нет.
Когда вы измеряете или обсуждаете энергию ионизации, вы думаете об удалении электронов из изолированных атомов в газовом состоянии. Однако металлический радиус находится по расстоянию между атомами в металлическом кристалле. Другими словами, атомы не только не изолированы, но и тесно связаны друг с другом.
В случае переходных металлов (за исключением цинка, который вообще не классифицируется как переходный металл) металлическая связь включает по крайней мере некоторые из 3d-орбиталей, а также 4s-поэтому переходные металлы имеют тенденцию имеют более высокие температуры плавления и кипения, чем, скажем, металлы 2-й группы.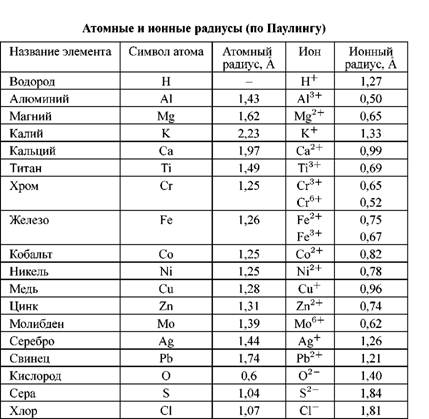
Если часть d-электронов участвует в связывании, то они не могут также участвовать в экранировании внешних (связывающих) электронов от ядра – они являются внешними связывающими электронами. Это означает, что для элементов, которые используют некоторые из своих d-орбиталей для связывания, измеренный атомный радиус будет меньше, чем у несвязанного атома. Было бы больше притяжения от относительно неэкранированного ядра. Если вы пытаетесь сравнить тенденции в атомных радиусах с тенденциями в энергиях ионизации, вы не работаете с одними и теми же основными электронными структурами.
Итак, мне кажется, что пытаться связать тренд энергий ионизации с трендом атомных (металлических) радиусов на самом деле бессмысленно. Это сработало бы только в том случае, если бы у вас были надежные радиусы Ван-дер-Ваальса для атомов металла — другими словами, если бы они не были связаны. (Перейдите по этой ссылке, если вы не знаете, что такое радиус Ван-дер-Ваальса.)
Температуры плавления и кипения цинка для остальной части серии низкие, что отражает тот факт, что в его связывании не участвуют 3d-электроны.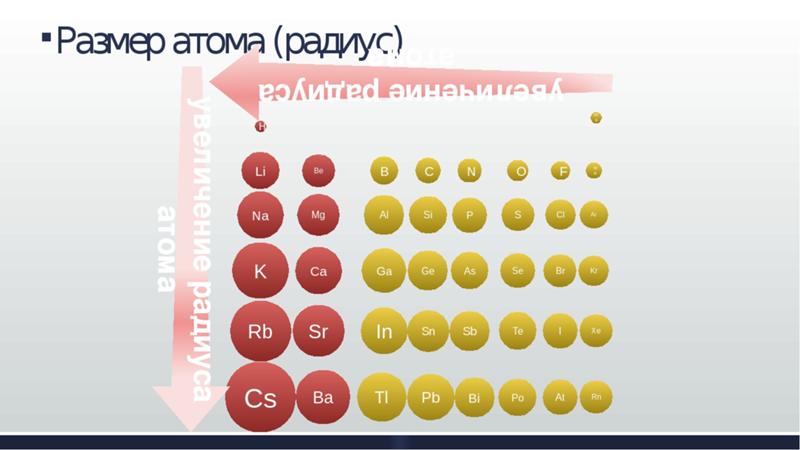 Это означает, что они должны быть полностью доступны для просеивания, даже если цинк связан. В медном корпусе они являются доступными для экранирования в изолированном атоме, но некоторые из них недоступны , когда медь вовлечена в металлическую связь. Результатом этого является притяжение внешних электронов ближе к ядру, когда атом меди связан, например, для уменьшения металлического радиуса.
Это означает, что они должны быть полностью доступны для просеивания, даже если цинк связан. В медном корпусе они являются доступными для экранирования в изолированном атоме, но некоторые из них недоступны , когда медь вовлечена в металлическую связь. Результатом этого является притяжение внешних электронов ближе к ядру, когда атом меди связан, например, для уменьшения металлического радиуса.
Меньшее влияние ядра на связывающие электроны в цинке (из-за наличия всех 10 d-электронов для экранирования в связанном атоме) означает, что связанный атом цинка будет больше, чем связанный атом меди. Другими словами, можно объяснить, что цинк имеет больший металлический радиус, чем медь (если это действительно так!), используя те же общие принципы, которые используются при объяснении энергий ионизации, но вам нужно много копаться. .
Однако я могу ошибаться в этом! Если у вас есть достоверная информация об этом (желательно со ссылкой), не могли бы вы связаться со мной по адресу, указанному на странице об этом сайте.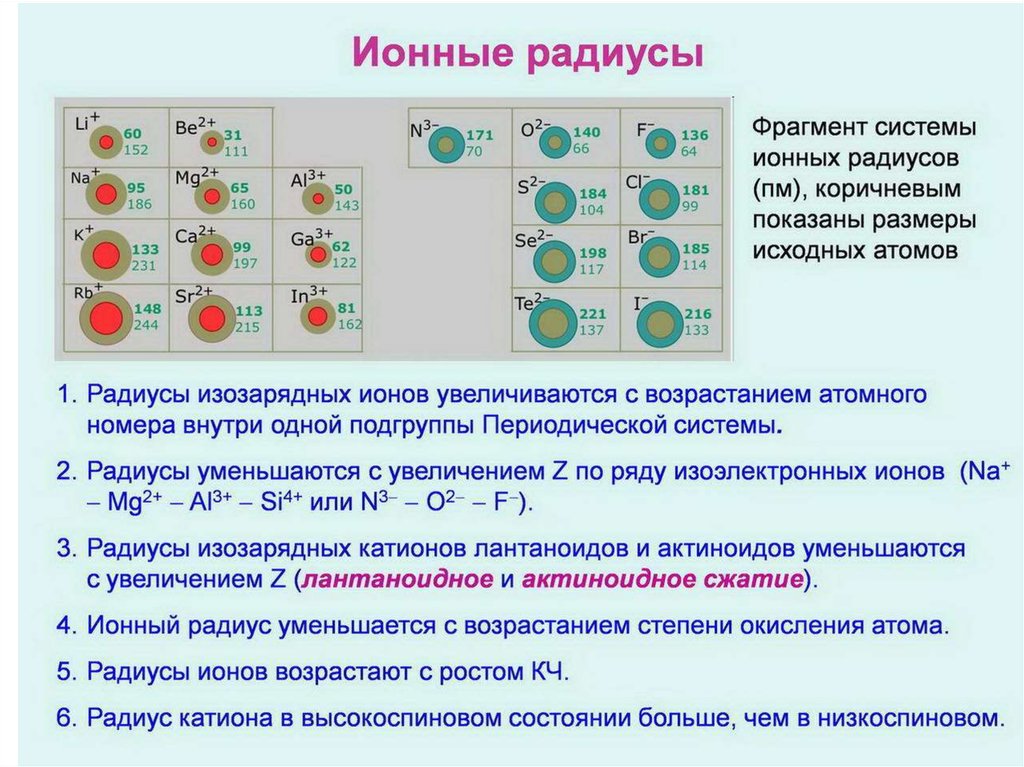
Подобно атомному радиусу и энергии ионизации, ионный радиус (для определенного заряда, скажем, 2+) следует той же схеме, что и атомный радиус?
Вот ионные радиусы для ионов 2+, которые я нашел из двух разных источников. Все значения указаны в нм.
По мере прохождения ряда в ядре каждого из ионов появляется дополнительный протон. Все внешние электроны находятся на орбиталях одного типа, и степень экранирования не меняется — в каждом случае 3d-электроны будут экранироваться 1s-, 2s-, 2p-, 3s- и 3p-электронами.
Чистый эффект этого заключается в том, что притяжение ядра увеличивается по всей серии, и поэтому можно ожидать, что ионный радиус станет меньше. Но это не так — по крайней мере, не на протяжении всей серии.
Так что же происходит? Я подозреваю, что это так же просто, как тот факт, что приведенные значения ионного радиуса не относятся к изолированным ионам. Они будут к чему-то привязаны. Они либо будут окружены непосредственно отрицательными ионами, либо будут ковалентно связаны с лигандами в комплексном ионе.