Расчет массы металла калькулятор: Калькулятор металлов – посчитать точный вес металлопроката
alexxlab | 10.03.2023 | 0 | Разное
App Store: Калькулятор веса металла PRO
Описание
Это приложение создано именно для тебя – истинного профессионала и делового человека! Быстро, легко и удобно рассчитывай вес металла по длине, либо его длину по массе. Нет ничего лишнего – только самые популярные профили и типы металла. Также существует возможность создавать свои материалы. Любой расчет можно сохранить в разделе “Избранное”. Выбери предпочтительные единицы измерения и производи расчеты в любое удобное время и в любом месте!
– самые популярные профили
– основные типы металла
– возможность создания своих материалов
– несколько вариантов единиц измерения
– возможность сохранения результатов
– отсутствует реклама
Пользовательское соглашение (EULA): https://www.apple.com/legal/internet-services/itunes/dev/stdeula
“>9 нояб. 2022 г.
Версия 1.5.2
Незначительные изменения в интерфейсе
Оценки и отзывы
Оценок: 147
Неплохо
Нужное приложение. Ещё бы листовой прокат и сортамент добавить
Спасибо за отзыв! Я еще думаю над добавлением стандартов. Но обширная номенклатура может погубить основную идею приложения: легкий, быстрый и минималистичный калькулятор с возможностью добавления своих шаблонов. На западе это приветствуется, а у нас не очень 🙂
Метал
удобненькое приложение,
Спасибо! )
Ни о чём
Нет сортамента, нет ГОСТов.
… Для металлообработки данное приложение бесполезно. Зря потраченные средства (((
Благодарим вас за отзыв, сожалеем что приложение вам не понравилось. Вы можете сохранять ваши популярные расчеты и использовать их в дальнейшем из избранного для вашего удобства.
Подписки
VIP-подписка Полукруг
Предоставление доступа на ежегодной основе
Пробная подписка
VIP-подписка Треугольник
Предоставление доступа на ежегодной основе
Пробная подписка
Разработчик SIARHEI ZINKEVICH указал, что в соответствии с политикой конфиденциальности приложения данные могут обрабатываться так, как описано ниже. Подробные сведения доступны в политике конфиденциальности разработчика.
Сбор данных не ведется
Разработчик не ведет сбор данных в этом приложении.
Конфиденциальные данные могут использоваться по-разному в зависимости от вашего возраста, задействованных функций или других факторов. Подробнее
Подробнее
Информация
- Провайдер
- SIARHEI ZINKEVICH
- Размер
- 5 МБ
- Категория
- Утилиты
- Возраст
- 4+
- Copyright
- © 2019 IE Zinkevich S.
- Цена
- 179,00 ₽
- Поддержка приложения
- Политика конфиденциальности
Поддерживается
Другие приложения этого разработчика
Вам может понравиться
Вычислить эмпирическую формулу при заданных данных массы
ChemTeam: Вычислить эмпирическую формулу при заданных данных массыРассчитать эмпирическую формулу при заданных данных массы
Вернуться к кроту Содержание
Расчет эмпирической формулы при наличии данных о процентном составе
Определение идентичности элемента по бинарной формуле и процентному составу
Определение идентичности элемента по бинарной формуле и массовым данным
Определите формулу гидрата
Пример №1: Образец металлической меди массой 2,50 г нагревают до образования оксида меди.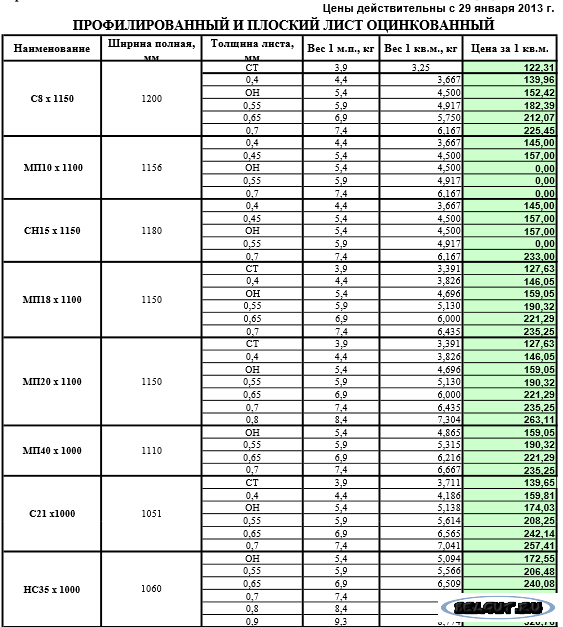
Решение:
1) Определить массу:
Cu —> 2,50 г
O —> 3,13 г − 2,50 г = 0,63 г
2) Определить родинки:
Cu —> 2,50 г / 63,546 г/моль = 0,03934 моль
O —> 0,63 г / 16,00 г/моль = 0,039375 мольЭто молярное соотношение Cu и O 1:1.
3) Напишите эмпирическую формулу:
CuO
Пример #2: Анализ показал, что соединение с молекулярной массой 60 г/моль содержит 12,0 г углерода, 2,0 г водорода и 16,0 г кислорода. Какова молекулярная формула соединения? (калькулятор запрещен!)
Решение:
12,0 г углерода составляет примерно 1 моль углерода; 2,0 г Н составляет около 2 молей, а 16,0 г О составляет около одного моля. Таким образом, эмпирическая формула CH 2 ОМолекулярная масса этой молекулы составляет 30 г/моль, поэтому вы делите 60/30, чтобы найти, во сколько раз вы должны умножить свою эмпирическую формулу.
Ответ в 2 раза выше эмпирической формулы, поэтому молекулярная формула C 2 H 4 O 2
Пример №3: Соединение, состоящее из двух элементов, иридия (Ir) и кислорода (O), было получено в лаборатории путем нагревания иридия на воздухе. Были собраны следующие данные:
Масса тигля: 38,26 г
Масса тигля и иридия: 39,52 г.
Масса тигля и оксида иридия: 39,73 г
Решение:
1) Получить массу каждого элемента:
Ir —> 39,52 − 38,26 = 1,26 г
О —> 39,73 − 39,52 = 0,21 г
2) Получить моли каждого элемента:
Ir —> 1,26 г / 192,217 г/моль = 0,0065551 моль
O —> 0,21 г / 16,00 г/моль = 0,013125 моль
3) Найдите наименьшее отношение целых чисел:
Ir —> 0,0065551 / 0,0065551 = 1
О —> 0,013125/0,0065551 = 2Эмпирическая формула = IrO 2
Между прочим, эта проблема игнорирует любые ошибки, которые могут быть вызваны реакцией Ir с азотом в воздухе.
Пример #4: Соединение содержит 16,7 г иридия и 10,3 г селена. Какова его эмпирическая формула?
Решение:
1) Кроты:
Ir —> 16,7/192,217 = 0,086881
Se —> 10,3/78,96 = 0,130446
2) Поиск наименьшего целочисленного соотношения:
Ir —> 0,086881 / 0,086881 = 1
Se —> 0,130446 / 0,086881 = 1,5
3) Умножить соотношение 1 : 1,5 на два:
2 : 3Ир 2 Се 3
Пример #5: Образец порошка красного фосфора массой 1,000 г был сожжен на воздухе и подвергнут реакции с газообразным кислородом с получением 2,291 г оксида фосфора. Рассчитайте эмпирическую формулу и молекулярную формулу оксида фосфора, если молярная масса равна приблизительно 284 г/моль.
Решение:
1) Рассчитайте количество молей фосфора и кислорода:
P —> 1,000 г / 30,97 г/моль = 0,032289 моль
O —> 1,291 г / 16,00 г/моль = 0,0806875 моль
2) Определить наименьшее целочисленное отношение:
P —> 0,032289 моль / 0,032289 моль = 1
О —> 0,0806875 моль / 0,032289 моль = 2,50
3) Определите эмпирическую формулу:
Р 2 О 5
3) Определите молекулярную формулу:
“вес по эмпирической формуле” = 141,943284 / 142 = 2
П 4 О 10
Пример №6: Образец магнетита содержал 50,4 г железа и 19,2 г кислорода. Вычислите эмпирическую формулу.
Вычислите эмпирическую формулу.
Решение:
1) Перевести граммы в моли:
Fe —> 50,4 г / 55,845 г/моль = 0,9025 моль
O —> 19,2 г / 16,0 г/моль = 1,2 моль
2) Поиск наименьшего целочисленного отношения:
Fe —> 0,9025/0,9025 = 1
О —> 1,2/0,9025 = 1,333) Соотношение, включающее треть (например, 1,33 чуть выше или что-то вроде 2,67), можно рассматривать как дроби со знаменателем, равным 3. Вот так:
Fe —> 3/3
О —> 4/34) Умножьте на три, чтобы получить целые числа:
Fe —> 3
О —> 4Эмпирическая формула Fe 3 O 4
Пример #7: Если одна молекула с эмпирической формулой C 3 H 7 имеет массу 1,428 x 10¯ 22 г, определите молекулярную формулу соединения.
Решение:
1) Определить массу одного моля:
(1,428 x 10¯ 22 г/молекула) (6,022 x 10 23 молекул/моль) = 86,0 г/моль2) Определить “вес эмпирической формулы:”
С 3 Н 7 = 43,13) Определите молекулярную формулу:
86,0 / 43,1 = 2С 6 Н 14
Пример #8: Какова эмпирическая формула и молекулярная формула молочной кислоты, если процентный состав составляет 40,00% C, 6,71% H, 53,29% O, а приблизительная молярная масса составляет 90 г/моль?
Решение:
1) Предположим, что присутствует 100 г соединения.
Это превращает проценты в массу.
2) Расчет молей:
C —> 40,00 г / 12,011 г/моль = 3,33
Н —> 6,71 г / 1,008 г/моль = 6,66
О —> 53,29 г / 16,00 г/моль = 3,333) Разделить на наименьшее значение:
С —> 3,33/3,33 = 1
Г —> 6,66/3,33 = 2
О —> 3,33/3,33 = 1Эмпирическая формула = CH 2 O
4) Эмпирическая формула веса
12 + 2 + 16 = 305) Какова молекулярная формула?
90/30 = 3 (в молекулярной формуле три «единицы» эмпирической формулы)С 3 Н 6 О 3
Пример #9: Образец 0,338 г сурьмы полностью прореагировал с 0,295 г газообразного хлора с образованием хлорида сурьмы. Определите эмпирическую формулу хлорида сурьмы.
Решение:
Sb —> 0,338 г / 121,760 г/моль = 0,002776 моль
Cl —> 0,295 г / 35,453 г/моль = 0,008321 моль0,008321 моль / 0,002776 моль = 3
SbCl 3
Обратите внимание на использование атомной массы хлора, а не молекулярной массы Cl 2 .
Нас интересует, сколько атомов Cl связано с одним атомом Sb, а не сколько молекул Cl 2 связано с одним Sb. Если вы используете 70,906 г / моль, вы получаете 1,5 хлора на одну Sb (и забывая, что это 1,5 Cl 2 молекул), вы заключаете, что формула Sb 2 Cl 3 .
Пример #10: Когда элемент сурьма Sb нагревается с избытком серы, происходит реакция с образованием соединения, содержащего только сурьму и серу. При дальнейшем нагревании избыток серы выгорает с образованием газообразного диоксида серы SO 2 , а оставшееся вещество представляет собой чистое соединение сурьмы и серы. В одном эксперименте использовали 2,435 г сурьмы, а масса чистого соединения сурьмы и серы составила 3,397 г. Какова эмпирическая формула соединения сурьмы и серы?
Решение:
1) Рассчитайте массу прореагировавшей серы:
3,397 − 2,435 = 0,962 г2) Расчет молей:
Sb —> 2,435 г / 121,76 г/моль = 0,0200 моль
С —> 0,962 г / 32,065 г/моль = 0,0300 моль3) Разделить на наименьшее:
0,02 / 0,02 = 1
0,03/0,02 = 1,54) Умножьте на 2, чтобы получить целочисленное соотношение
Сб 2 С 3Комментарий: вы видите, что отношение 0,2 к 0,3 такое же, как отношение 2 к 3, и таким образом вы получаете эмпирическую формулу.
«Деление на наименьшее» — классический способ решения задач такого типа.
Пример #11: Было обнаружено, что образец оксида железа массой 4,628 г содержит 3,348 г железа и 1,280 г кислорода. Какова простейшая формула этого соединения?
Решение:
1) Определите количество молей каждого элемента:
железо: 3,348 г / 55,845 г/моль = 0,05995 моль = 0,06 моль
кислород: 1,280 г / 16,00 г/моль = 0,08 моль2) Нам нужно наименьшее отношение целых чисел между 0,06 и 0,08:
0,06/0,06 = 1 0,08/0,06 = 1,33333) Умножить на 3:
3/3 х 3 = 3
4/3 х 3 = 4Fe 3 О 4
Другой способ приблизиться к этому — увидеть, что 0,06 к 0,08 — это отношение 6 к 8, а затем уменьшить его до 3 к 4.
Пример №12: Образец магния массой 1,00 грамма сжигают в избытке кислорода с образованием оксида массой 1,66 грамма.
Какова эмпирическая формула полученного оксида?
Решение:
1) Преобразовать массу в моли:
Мг —> 1,00 г / 24,305 г/моль = 0,041144 моль
O —> 0,66 г / 16,00 г/моль = 0,04125 моль2) Разделить на наименьшее значение:
Мг —> 0,041144 / 0,041144 = 1
О —> 0,04125 / 0,041144 = 13) Эмпирическая формула:
МдОПример #13: При анализе 2,500 г неизвестного соединения обнаружено, что 0,758 г составляют кальций, 0,530 г азот и 1,212 г кислород. Найдите эмпирическую формулу и идентичность этого соединения (предположим, что эмпирическая и молекулярная формулы совпадают).
Решение:
1) Определите количество молей каждого элемента:
0,758 г Ca / 40,0784 г Ca/моль = 0,018913 моль Са
0,530 г N / 14,00672 г N/моль = 0,037839 моль N
1,212 г О / 15,99943 г О/моль = 0,0757527 моль О2) Разделить на наименьшее количество молей:
0,018913 моль Ca / 0,018913 моль = 1,000
0,037839 моль N / 0,018913 моль = 2,001
0,0757527 моль О / 0,018913 моль = 4,0053) Эмпирическая и молекулярная формула и идентичность:
CaN 2 O 4или более условно:
Ка(НО 2 ) 2
нитрит кальция
Пример #14: После сильного нагревания 0,194 г урана образовали 0,233 г соединения с кислородом.
Определите эмпирическую формулу.
Решение:
1) Моли урана:
0,194 г / 238,0289 г/моль = 0,00081503 моль2) Моли кислорода:
0,233 г – 0,194 г = 0,039 г0,039 г / 15,9994 г/моль = 0,0024376 моль
3) Разделить на меньшее число молей:
0,00081503 моль / 0,00081503 моль = 1,000
0,0024376 моль / 0,00081503 моль = 2,9914) Эмпирическая формула:
УО 3Пример №15: Соединение с приблизительной молекулярной массой 123 г/моль содержит только углерод, водород, бром и кислород. Анализ показывает, что соединение содержит в 8 раз больше углерода, чем водорода по массе. Какова может быть его формула?
Решение:
1) Сначала углерод и водород:
С —> 8 г
Н —> 1 гC —> 8 г/12 г/моль = 0,67 моль
H —> 1 г / 1 г/моль = 1 мольС —> 0,67 моль х 3 = 2
Н —> 1 моль х 3 = 3Эмпирическая формула CH: C 2 H 3 .
2) У нас нет информации о Br и O, так что придется гадать.
Допустим, 1 Br и 1 O. Каков вес C 2 H 3 OBr?Ответ: 122,9487 г/моль.
Самый разумный ответ на эту задачу C 2 H 3 ОБр.
Пример №16: В эксперименте по определению формулы оксида ртути были получены следующие результаты. Он разлагается на элементы при нагревании.
Масса пустой пробирки = 15,45 г
Масса пробирки + оксид ртути = 17,61 г.
Объем кислорода, собранного при RTP = 120 млПо результатам опыта определите молекулярную формулу этого оксида ртути
Решение:
1) Масса оксида:
17,61 − 15,45 = 2,16 г2) Определите количество молей, а затем массу O 2 , полученного при разложении:
RTP имеет следующие значения: 25,0 °C и 1,00 атм.(1,00 атм) (0,120 л) = (n) (0,08206 л атм/моль К) (298 К)
n = 0,0049072 моль
Масса O 2 —> (0,0049072 моль) (32,00 г/моль) = 0,157 г
3) Масса Hg в оксиде:
2,16 − 0,157 = 2,003 г4) Разделите каждую массу на соответствующую атомную массу:
рт.ст. = 2,003/200,6 = 0,01 моль
O = 0,157/16,00 = 0,01 2 также 0,157 г O
молярное отношение Hg к O составляет 1:1
5) Эмпирическая формула:
HgOПример №17: Соединение состоит из 0,722 грамма магния и 0,278 грамма азота. Что такое эмпирическая формула?
Решение:
Определить моли Mg и N:
Мг —> 0,722 г / 24,3 г/моль = 0,0297 моль
N —> 0,278 г / 14,0 г/моль = 0,019857 моль2) Соотношение молей следует изменить на наименьшее целочисленное отношение. Разделите количество каждого моля на наименьшее значение:
Мг —> 0,0297 моль / 0,019857 моль = 1,5
Н —> 0,019857 моль / 0,019857 моль = 13) Соотношение должно состоять из целых чисел:
мг —> 1,5 х 2 = 3
Н —> 1 х 2 = 24) Эмпирическая формула:
Мг 3 Н 2Пример #18: Органическое соединение содержит 21,20% углерода, 5,30% водорода, а остальное мышьяк и кислород.
Из 0,500 г этого соединения было получено 0,802 г арсената магния-аммония, MgNH 4 AsO 4 . Рассчитайте (а) массовые проценты мышьяка и кислорода в этом органическом соединении и (б) его эмпирическую формулу.
Решение:
1) Определить массовую долю As в MgNH 4 AsO 4 :
мол. масса MgNH 4 AsO 4 —> 181,2616 ед.
атомный вес мышьяка —> 74,922 ед.массовых процента As —> 74,922 u / 181,2616 u = 0,4133363 (оставить десятичное значение)
2) Определить массу Аз в массе 0,802 г:
(0,802 г) (0,4133363) = 0,3314957 г3) Определить массовую долю мышьяка в органическом соединении:
0,3314957 г / 0,500 г = 0,66299 = 66,30%4) Определите массовую долю кислорода:
100 – (21,20 + 5,30 + 66,30) = 7,20%5) Начните вычисление эмпирической формулы, предполагая, что присутствует 100 г соединения.
Поэтому,
углерод —> 21,20 г
водород —> 5,30 г
кислород —> 7,20 г
мышьяк —> 66,30 г6) Определить родинки:
углерод —> 21,20 г / 12,011 г/моль = 1,76505 моль
водорода —> 5,30 г/1,008 г/моль = 5,25794 моль
кислород —> 7,20 г / 16,00 г/моль = 0,450 моль
мышьяк —> 66,30 г / 74,922 г/моль = 0,88492 моль7) Разделить на наименьшее:
углерод —> 1,76505 моль / 0,450 моль = 3,92
водорода —> 5,25794 моль/0,450 моль = 11,68
кислород —> 0,450 моль / 0,450 моль = 1
мышьяк —> 0,88492 моль / 0,450 моль = 1,978) Эмпирическая формула:
С 4 Н 12 Как 2 ОПример #19: Соединение ксенона и фтора получают взаимодействием 0,526 г ксенона с избытком газообразного фтора. Образовавшееся соединение весило 0,678 г. Определите молекулярную формулу.
Решение:
1) Определить массу прореагировавшего фтора:
0,678 г − 0,526 г = 0,152 г2) Определите количество молей каждого элемента, входящего в состав соединения:
Xe —> 0,526 г / 131,293 г/моль = 0,0040063 моль
F —> 0,152 г / 18,998403 г/моль = 0,0080007 мольОбратите внимание на использование атомной массы F, а не молекулярной массы F 2
3) Выразите молярное отношение через небольшие целые числа:
Xe —> 0,0040063 моль / 0,0040063 моль = 1
F —> 0,0080007 моль / 0,0040063 моль = 24) Молекулярная формула XeF 2
Дополнительный пример: Какое соотношение масс будет получено при анализе метанола?
C H O А. 3г 1г 4г Б. 3г 2г 8г С. 6г 8г 16г D. 12 г 8 г 32 г Решение:
1) Формула метанола:
CH 3 OH2) Это означает следующее соотношение атомов:
один углерод: четыре водорода: один кислород3) Используйте атомные массы каждого элемента, чтобы получить соотношение масс для вышеуказанного соотношения атомов:
12 грамм C : 4 грамма H : 16 грамм O4) Мы ищем ответ, который имеет вес в соотношении 12 : 4 : 16. В наименьших терминах это соотношение равно:
3 : 1 : 4Вариант ответа А
Вернуться к кроту Содержание
Расчет эмпирической формулы при наличии данных о процентном составе
Определение идентичности элемента по бинарной формуле и процентному составу
Определение идентичности элемента по бинарной формуле и массовым данным
Определите формулу гидрата
Как рассчитать массовую долю металла в нечистом веществе?
Для ответа на этот вопрос мы рассмотрим сульфит натрия (Na 2 SO 3 ) и его титрованием перманганатом калия (KMnO 4 ). Для этого нужны кислые условия.
Для этого нужны кислые условия.
В этом примере нам нужно знать несколько вещей:
Что 1,5 г нечистого вещества были растворены и превращены в раствор объемом 100 см 3 .
25 см 3 этого раствора титровали против 35,1 см 3 0,015
молдм -3 KMnO 4 – .
Шаг 1) Сначала нам нужно сбалансировать уравнение реакции Na 2 SO 3 с KMnO 4 .
Сначала используйте ионные полууравнения, чтобы вычислить изменение степени окисления.
MN0 4 – + 2H + + 5E – -> MN 2+ + H 2 O
в MN0 4 – Ман. (из-за того, что кислород равен -2), а в Mn 2+ он имеет степень окисления +2. Водород и кислород не меняют степень окисления. Это означает, что степень окисления в целом изменилась на -5, поэтому должно быть 5e 9.0204 – с левой стороны, чтобы сбалансировать это.
В уравнении другой половины мы видим, что
SO 3 2- + H 2 O -> SO 4 – + 2H + + 2E –
+ + 2E – 9000. 3 2- сера имеет степень окисления +4, а в SO 4 2- имеет степень окисления +6. Водород и кислород опять же не меняются. Это означает, что степень окисления в целом изменилась на +2, поэтому должно быть 2e – с правой стороны, чтобы сбалансировать это.
Из этих двух уравнений мы можем сделать полное ионное уравнение, которое написано как
2MNO 4 – + 6H + + 5SO 3 2--> 2MN 2 + + 5SO 4 2- + 3H 2 O
Шаг 2) Рассчитайте количество молей MnO 4 – .
Conc = моль/объем и, следовательно, моли = conc x объем
Моли = 0,015 x 0,0371 Будьте осторожны для преобразования единиц из CM 3 в DM 3 Здесь
= 5,565×10 -4
Шаг 3) . SOLE The SOLES 044444204204204204204204204204204204204204204204204204204204204504420450442045044204504420450442045042045042045042. 2- отреагировал.
SOLE The SOLES 044444204204204204204204204204204204204204204204204204204204204504420450442045044204504420450442045042045042045042. 2- отреагировал.
Использование стехиометрических отношений. Мы видим, что 2MNO 4 – реагирует с 5SO 3 2- и, следовательно,
моли, так что 3 2- = 5/2. x Moles mno 2- = 5/2
Mno 2- = 5.5. x Moles mno 2- = 5000
.0049 4 –
= 1,39×10 -3
Шаг 4) Рассчитайте общие моли SO 3 2-
В начале вопроса. масса вещества растворялась в 100 см3, но на титрование было использовано только 25 см3. Поэтому, чтобы получить общее количество молей, нам нужно умножить на 4.
Общее количество молей = 5,565×10-3
Шаг 5) Рассчитать массу присутствующего Na
Поскольку на один Na приходится два атома Na 2 SO 3 , то количество молей SO 3 2- необходимо удвоить, чтобы найти общую массу Na.


 Поэтому,
Поэтому,