Реакция углекислый газ и вода: Углекислый газ (диоксид углерода) – Что такое Углекислый газ (диоксид углерода)?
alexxlab | 10.02.1993 | 0 | Разное
Как превратить углекислый газ в полезную «химию»
Оксид индия вместе с медью неплохо справляется с восстановлением углекислого газа до угарного с помощью водорода.
Принципиальная схема обратной реакции конверсии водяного пара с химическим циклом (RWGS-CL). Илл.: Jun-Ichiro Makiura et.al., Chemical Science 2020.
Открыть в полном размере
‹
›
Основной источник энергии для человечества сейчас – ископаемое топливо. Мы сжигаем уголь, природный газ и нефтепродукты, чтобы получить тепло или выработать электричество. Но при сжигании чего-то, содержащего углерод, обязательно образуется углекислый газ, а он, как известно, способствует такой нехорошей вещи, как глобальное потепление.
Поскольку отказаться здесь и сейчас от использования углеродного топлива мы пока по разным причинам не можем, то приходится делать хоть что-то, чтобы концентрация углекислого газа в атмосфере росла не так быстро.
В молекуле углекислого газа CO2 углерод прочно связан с двумя атомами кислорода. Чтобы от такого окисленного углерода была хоть какая-то химическая польза, от него нужно оторвать хотя бы один атом кислорода – превратить углекислый газ в газ угарный с формулой CO. Но для этого нужно затратить энергию, аналогичную той, которую мы бы получили, окислив угарный газ обратно до углекислого. Закон сохранения энергии, с которым всегда приходится считаться. Значит, для «чудесного» превращения углекислого газа в угарный нам нужен какой-то источник «чистой» энергии, которая не получена путём сжигания углеродного топлива. Предположим, что у нас он есть: какая-нибудь солнечная батарея или мощный ветрогенератор. Пусть даже мы с помощью «зелёного» электролиза получили из воды водород – газ, которым будем «химически» отрывать от углекислого газа один атом кислорода.
Если взять углекислый газ, взять водород, смешать, погреть, потрясти и т.д., то мы, конечно, получим какое-то количество желанного нами угарного газа. Но, во-первых, его будет намного меньше, чем нам бы хотелось, а, во-вторых, это будет угарный газ вместе с исходными веществами и побочными продуктами реакции. Разделить полученную смесь можно, но на всё это потребуется затратить энергию, а её у нас и так дефицит. Чтобы выйти из этого затруднительного положения химики придумали метод, получивший название: обратная реакция конверсии водяного пара с химическим циклом (RWGS-CL).
Её суть состоит в том, чтобы разделить процесс отрыва атома кислорода от углекислого газа и его последующего «присоединения» к водороду на две отдельные стадии. Для этого необходимо использовать третье вещество, в роли которого обычно выступают оксиды металлов. В недавно опубликованной статье в журнале Chemical Science группа исследователей из университета Васэда и корпорации ENEOS предложила использовать для этой цели оксид индия, модифицированный медью.
На первой стадии углекислый газ вступает в реакцию с оксидом индия, который «отрывает» от CO2 один кислород и присваивает его себе. На выходе получается чистый угарный газ, без лишних примесей. Когда оксид индия насыщается кислородом, его регенерируют газообразным водородом, «вытаскивающим» лишний кислород из оксида, в результате чего получается обычная вода, а оксид индия возвращается в «боевое» состояние. Дальше цикл можно повторять. По утверждению авторов работы, главным достоинством такой системы с оксидом индия и медью служит её способность работать при более низких температурах, чем у известных аналогов.
Спасёт ли нас один лишь оксид индия на пару с медью от глобального потепления? По крайней мере, не в обозримом будущем. Даже если весь добываемый на планете металл индий (а это порядка одной тысячи тонн) пустить на борьбу с углекислым газом, то его вклад в понижение количества CO2 в атмосфере будет по приблизительным прикидкам на уровне одной тысячной от ежегодного объёма антропогенных выбросов CO2.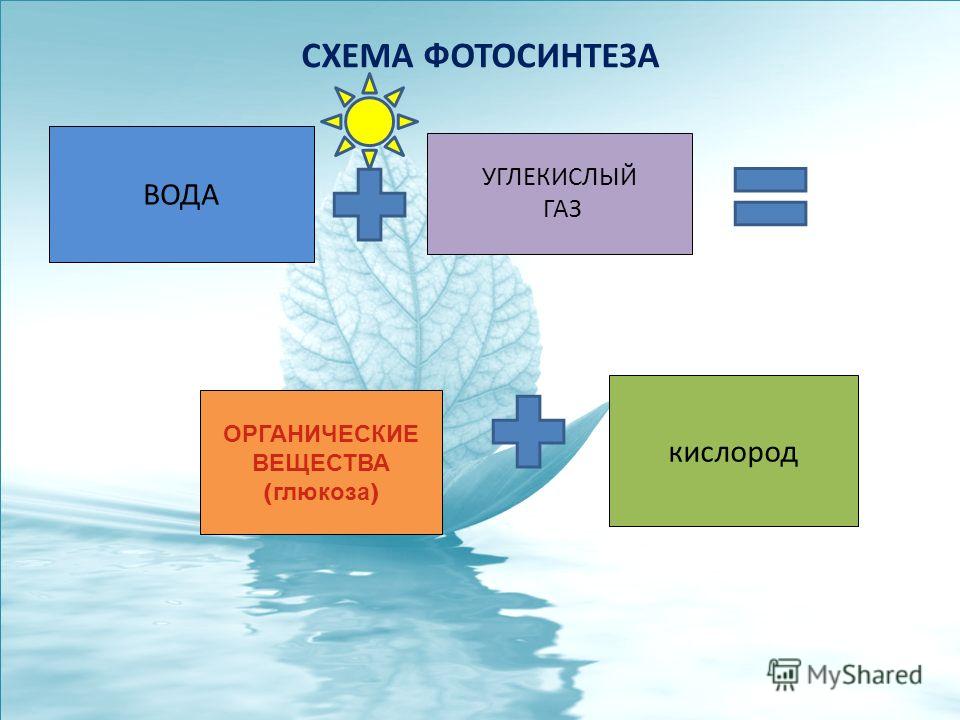
Однако не стоит называть подобные разработки бесполезными. Даже если отбросить такие экзотические, но всё же более-менее реальные задачи, как обеспечение жизнедеятельности колоний на Марсе или Луне, подобные технологии определяют направление возможных поисков решения и земных проблем тоже.
Газированные и энергетические напитки (польза? вред?)
Давайте порассуждаем:
Природная газированная вода известна с древнейших времён и использовалась в лечебных целях. Еще Гиппократ в своем труде велел больным пить ее и купаться в ней. В 18 веке минеральную воду начали разливать в бутылки, развозить и продавать. Однако, она стоила весьма дорого и к тому же быстро выдыхалась. Поэтому позже были предприняты попытки искусственно загазировать воду. Впервые создал газированную воду химик ДЖ. Пристли в 1767году. Промышленное производство начал Якоб Швелл. Он создал промышленную установку, выпускающую газированную воду. С 19 века он стал применять для газирования обычную пищевую соду и газированную воду, что удешевило производство.
С 19 века он стал применять для газирования обычную пищевую соду и газированную воду, что удешевило производство.
Но даже обычный углекислый газ, абсолютно безопасный для человека, в комбинации с водой оказывается вредным для здоровья. Дело в том, что реакция газа с водой дает в результате угольную кислоту, а она, в свою очередь, становится опасным раствором для желудка и ЖКТ, вызывает раздражение и провоцирует воспалительные процессы. Хорошо, что эта кислота быстро распадается на составляющие, но они надолго скапливаются в кишечнике. Когда газ поступает в кишечник – это может привести к застою, нарушению усвоения и переваривания пищи, могут возникнуть приступы боли. Чтобы избежать побочных явлений, газировку лучше потрясти и лишние пузырьки улетучатся. Следует полностью исключить газированные напитки из рациона детей младшего возраста. Углекислый газ является консервантом и обозначается на упаковках как Е290. И если минеральную воду пить полезно, так как она насыщает организм электролитами, то употребление сладких газированных напитков может привести к негативным последствиям. Бензойно-кислый натрий, который входит в состав газированных напитков, используется в качестве консерванта в пищевых продуктах. Консерванты на основе натрия, добавленные в содовую воду, снижают в организме количество калия. У некоторых людей развивается реакция на натрий и могут возникнуть аллергические реакции. Сахар и кислота, содержащиеся в сладких газированных напитках, разрушают зубную эмаль. Когда кариес добирается до нервов, корней и до основы зуба, зуб разрушается. Большинство сладких газированных напитков содержат в себе большое количество кукурузного сиропа с высоким содержанием фруктозы – подсластителя. Этот сироп был связан с увеличением риска метаболического синдрома, который в свою очередь увеличивает риск получить сахарный диабет второго типа или проблемы с сердцем. Кола и сладкие газированные напитки содержат в себе большое количество фосфорной кислоты, которая приводит к образованию камней в почках, а также к проблемам с костями: они становятся более хрупкими, возможно развитие остеопороза.
Бензойно-кислый натрий, который входит в состав газированных напитков, используется в качестве консерванта в пищевых продуктах. Консерванты на основе натрия, добавленные в содовую воду, снижают в организме количество калия. У некоторых людей развивается реакция на натрий и могут возникнуть аллергические реакции. Сахар и кислота, содержащиеся в сладких газированных напитках, разрушают зубную эмаль. Когда кариес добирается до нервов, корней и до основы зуба, зуб разрушается. Большинство сладких газированных напитков содержат в себе большое количество кукурузного сиропа с высоким содержанием фруктозы – подсластителя. Этот сироп был связан с увеличением риска метаболического синдрома, который в свою очередь увеличивает риск получить сахарный диабет второго типа или проблемы с сердцем. Кола и сладкие газированные напитки содержат в себе большое количество фосфорной кислоты, которая приводит к образованию камней в почках, а также к проблемам с костями: они становятся более хрупкими, возможно развитие остеопороза. Выводясь из организма вместе с мочой, фосфорная кислота забирает с собой кальций и другие минералы, необходимые для полноценного функционирования тела. Жестяные банки, в которых продаются сладкие газированные напитки, внутри имеют специальное покрытие из камеди, которое содержит в себе BPA (бисфенол-А). Это вещество вызывает рак и проблемы с системой репродукции: преждевременное половое созревание у детей и другие репродуктивные нарушения. Связь между ожирением и чрезмерным увлечением сладкими газированными напитками уже давно доказана всевозможными исследование и тестами, риск получить ожирение возрастает в 1,6 раз. Сахарный диабет. У любителей сладкой газировки риск получить сахарный диабет второго типа увеличивается на 80%. После того, как человек выпивает стакан сладкой газированной воды, повышается содержание сахара в крови, а печень при этом перерабатывает углеводы в жир. Учёные даже причисляют пристрастие к газированным напиткам, как один из канцерогенных факторов.
Выводясь из организма вместе с мочой, фосфорная кислота забирает с собой кальций и другие минералы, необходимые для полноценного функционирования тела. Жестяные банки, в которых продаются сладкие газированные напитки, внутри имеют специальное покрытие из камеди, которое содержит в себе BPA (бисфенол-А). Это вещество вызывает рак и проблемы с системой репродукции: преждевременное половое созревание у детей и другие репродуктивные нарушения. Связь между ожирением и чрезмерным увлечением сладкими газированными напитками уже давно доказана всевозможными исследование и тестами, риск получить ожирение возрастает в 1,6 раз. Сахарный диабет. У любителей сладкой газировки риск получить сахарный диабет второго типа увеличивается на 80%. После того, как человек выпивает стакан сладкой газированной воды, повышается содержание сахара в крови, а печень при этом перерабатывает углеводы в жир. Учёные даже причисляют пристрастие к газированным напиткам, как один из канцерогенных факторов.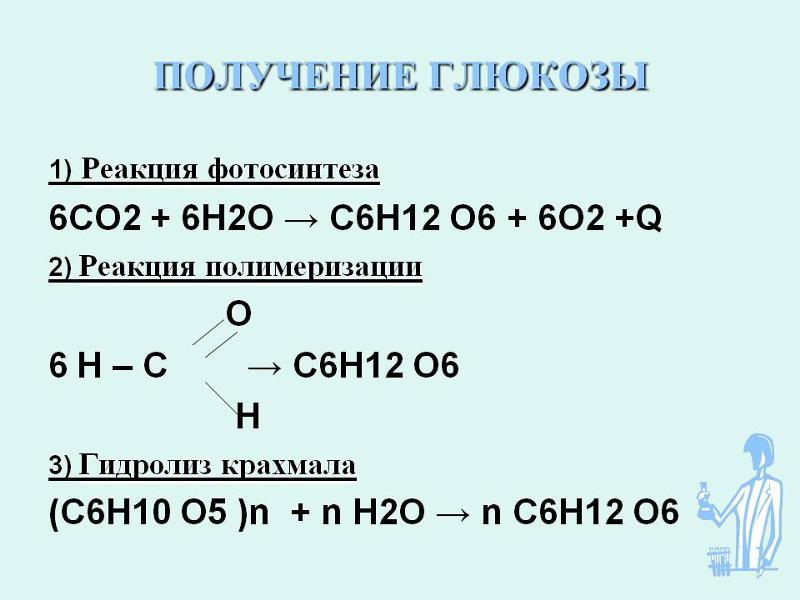
Одним из самых популярных безалкогольных газированных напитков является Пепси – кола.
«Пепси-колу» придумал в 1898 году американский фармацевт Калеб Брэдхем из Нью-Берна. В состав газировки входили пепсин и экстракт орехов колы. Он также приписывал газировке целебные свойства и уверял, что пепсин способствует пищеварению. Привычное название и широкое признание «Пепси-Кола» получила в 1903 году. В 1964 году «Пепси» выпустила диетическую газировку.
После приема стакана «Пепси» происходит следующее:
Через 10 минут после приема 10 чайных ложек сахара (рекомендуемая суточная доза) нанесут удар по поджелудочной железе. Вас не будет тошнить только потому, что фосфорная кислота подавляет действие сахара. Через 20 минут произойдет подъем инсулина в крови. Через 40 минут печень переводит сахар в жиры, происходит поглощение кофеина, повышается артериальное давление, т.к. печень выбрасывает больше сахара в кровь, расширяются зрачки. Еще через 45 минут увеличивается количество гормона дофамина, этот гормон стимулирует центр удовольствия мозга, улучшается настроение, появляется бодрость, снижается сонливость, но через час, полтора человек становится раздражительным, вялым.
Постепенно мозг адаптируется к привычке его владельца пить газировку, начинает производить меньше нужных гормонов, так как теперь их можно получить и искусственным путём, просто выпив колы. Работа рецепторов в «системе поощрения» ухудшается, заставляя для достижения одинакового эффекта выпивать всё больше и больше газировки.
Еще одним популярным напитком является Coca-Cola, она появилась раньше, чем Pepsi. Хотя оба напитка изобрели фармацевты в качестве возбуждающего, веселящего лекарства, способного даже улучшить пищеварение. Кстати, оба аптекарских открытия были запатентованы. Битва между Coca Cola и Pepsi началась в 1898 году. В начале своего векового пути «колы» имели кардинальное различие: Coca-Cola включала в себя кокаин из листьев коки и кофеин из ореха колы; в изготовлении же Pepsi-Cola использовался пепсин кофеин из орехов колы. Объективные границы между напитками начали стираться в 1903 году, когда кокаин запретили использовать в производстве Coca-Cola. Компании, производящие эти напитки, ведут рекламные войны с незапамятных времен. Они сражаются во всем: у кого вкуснее, у кого шире линейка, у кого круче банка. Победителем вышла пепси в 80-х годах, когда максимально приблизилась к своему принципиальному противнику. «Слепые тесты» тогда показали, что потребители предпочитают Pepsi, если пробуют напитки из обычных стаканов и не видят этикетки.
Компании, производящие эти напитки, ведут рекламные войны с незапамятных времен. Они сражаются во всем: у кого вкуснее, у кого шире линейка, у кого круче банка. Победителем вышла пепси в 80-х годах, когда максимально приблизилась к своему принципиальному противнику. «Слепые тесты» тогда показали, что потребители предпочитают Pepsi, если пробуют напитки из обычных стаканов и не видят этикетки.
Энергетические напитки («энергетики», «энерготоники») — безалкогольные или слабоалкогольные напитки.
С древнейших времён люди пользовались природными стимуляторами. На Ближнем Восток это был кофе; в Юго-Восточной Азии и Китае – чай; в Индии пили и чай, и кофе; в Южной Америке – мате, в Африке – орехи кола. На Дальнем Востоке, в Сибири и Монголии и сегодня популярны такие стимулирующие растения, как лимонник китайский, элеутерококк, женьшень, аралия. Были и сильные стимуляторы – например, эфедра – в Азии, и кока – в странах Южной Америки. При этом вред от таких напитков был минимальным – во многом благодаря естественному происхождению и экологической чистоте компонентов.
Энергетические напитки появились на рынке в последней четверти ХХ века, когда один австрийский предприниматель, побывав в Азии, решил открыть их промышленное производство. Первым энергетическим напитком массового производства стал «Red Bull» – тот, который «окрыляет». Новый напиток быстро завоевал популярность потребителей, наряду с «Кока-колой» и «Пепси», производители которых тут же сориентировались, и выпустили на рынок свои варианты энергетических напитков – «Burn» и «Adrenaline Rush».
В чем польза? Энергетические напитки позволяют быстро зарядиться энергией и практически мгновенно получить мощный заряд бодрости на несколько часов. Польза от употребления энергетических напитков вроде бы существенная, но в то же время эффект является временным – с длительностью, в зависимости от конкретного состава. Но у каждого действия должна быть обратная сторона, и не всегда такая же радужная и привлекательная. Главными составляющими энергетических эликсиров нашего времени являются:
Таурин. Синтез вещества происходит в желчном пузыре, участвуя в ряде обменных процессов и улучшая питание клеток. Считается безвредным в малых количествах, но не в тех, в которых его могут употреблять в составе современных энергетиков.
Синтез вещества происходит в желчном пузыре, участвуя в ряде обменных процессов и улучшая питание клеток. Считается безвредным в малых количествах, но не в тех, в которых его могут употреблять в составе современных энергетиков.
Кофеин. Может заменяться теином или матеином. В основном служит для повышения умственной и физической работоспособности, усиливая реакцию и память. При этом увеличивается частота пульса, повышается уровень артериального давления (АД), во многих случаях возможно развитие аритмии.
Теобромин. Довольно сильный стимулятор.
Мелатонин. Обеспечивает уровень жизнедеятельности, активности, суточного ритма человека.
Витамины и глюкоза
Действительно, на первый взгляд, безалкогольные энергетики не так уж страшны – основу большинства таких напитков составляют кофеин, сахар, вкусовые добавки, витамины. Однако угроза – в концентрации этих веществ. В одной банке энергетика объемом 300 миллилитров огромная концентрация кофеина, как в семи чашках кофе, это огромный удар по нервной системе, сердечно – сосудистой системе, который не проходит бесследно. Следует отметить и то, что энергетики являются сильногазированными напитками, с угольной кислотой в составе. Благодаря ей, компоненты, входящие в состав напитков, усваиваются гораздо быстрее, и необходимый эффект достигается достаточно оперативно. По закону производители указывают на этикетках или таре точный состав производимого напитка, как и безопасное количество продукта для употребления.
Следует отметить и то, что энергетики являются сильногазированными напитками, с угольной кислотой в составе. Благодаря ей, компоненты, входящие в состав напитков, усваиваются гораздо быстрее, и необходимый эффект достигается достаточно оперативно. По закону производители указывают на этикетках или таре точный состав производимого напитка, как и безопасное количество продукта для употребления.
Правила употребления
– Не превышайте суточную дозу кофеина – это примерно две баночки среднестатистического энергетика. Прием более двух банок подряд может навредить здоровью, а потому вместо желаемого эффекта вы ощутите побочные действия.
– По окончании действия энергетика организму необходим отдых для восстановления ресурсов.
– Не употребляйте напитки после занятий спортом – они являются мочегонными, в результате наступает обезвоживание и может подниматься давление.
– Напитки категорически нельзя употреблять беременным, детям и подросткам, пожилым людям, при гипертонии, заболеваниях сердечно-сосудистой системы, глаукоме, нарушении сна, повышенной возбудимости и чувствительности к кофеину.
– Многие напитки очень калорийны. Если вы употребляете энергетики в спортзале, пейте их только до тренировки. Если в ваши планы входит лишь восстановить силы, а худеть вы не собираетесь, можете употреблять такие тоники и до, и после занятий.
– Нельзя смешивать тоники с алкоголем (как часто делают, например, посетители ночных клубов). Кофеин повышает давление, а в сочетании с алкоголем его эффект многократно усиливается. В результате у человека может наступить гипертонический кризис.
Специалисты в области здоровья и медицины утверждают, что тоники – не больше, чем витаминизированные заменители кофе, только более опасные для здоровья. Так что решать, употреблять тоники или нет, предстоит вам.
Клинические исследования воздействия энергетических напитков на организм человека проведут на базе Научно-исследовательского института питания Российской академии медицинских наук. Добровольцами выступят члены Московского городского отделения Всероссийской общественной организации «Молодая гвардия Единой России». Такое решение было принято в ходе круглого стола «Энергетические напитки: лимонад или отрава?», который прошел в Московской городской Думе.
Такое решение было принято в ходе круглого стола «Энергетические напитки: лимонад или отрава?», который прошел в Московской городской Думе.
Реакция диоксида углерода с известковой водой
В этой статье мы подробно обсудим и ответим на все вопросы, связанные с реакцией оксида меди и серной кислоты. Но прежде чем перейти к вопросам и соответствующим ответам на них, сначала позвольте познакомить вас с серной кислотой и оксидом меди. Серная кислота — сильная кислота, образующаяся при окислении растворов диоксида серы. Формула серной кислоты. Эта кислота в больших количествах используется в промышленности и лабораториях в качестве реагента. Концентрированная форма серной кислоты является плотной, маслянистой и коррозионно-активной. Другой сложный оксид меди представляет собой соединение, которое образуется, когда два элемента, медь и кислород, реагируют друг с другом. Его формула CuO.
Реакция оксида меди с серной кислотой
Смешивание оксида меди и серной кислоты представляет собой эксперимент, включающий нерастворимый оксид металла , который реагирует с разбавленной кислотой с образованием растворимой соли . Оксид меди (II) представляет собой черное твердое вещество, которое при реакции с серной кислотой образует химическое вещество голубовато-голубого цвета, называемое сульфатом меди II. Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Оксид меди (II) представляет собой черное твердое вещество, которое при реакции с серной кислотой образует химическое вещество голубовато-голубого цвета, называемое сульфатом меди II. Оксид меди (II) реагирует с серной кислотой с образованием воды и сульфата меди (II). Эту реакцию можно классифицировать как реакцию двойного замещения или реакцию нейтрализации. Сульфат меди приобретает ярко-синий цвет
Написание уравнения оксида меди + серная кислота
Эту химическую реакцию можно записать следующим образом: ) Чтобы узнать, как сделать сульфат меди в домашних условиях, ознакомьтесь с этой статьей.
Что происходит, когда медь реагирует с концентрированной серной кислотой?
Восстановительный потенциал разбавленной серной кислоты выше, чем у водорода. Медь не способна вытеснять водород из неокисляющих кислот, например соляной или разбавленной серной кислоты. Другими словами, можно сказать, что медь не реагирует с разбавленной серной кислотой. Однако он реагирует с концентрированной серной кислотой, потому что серная кислота в концентрированной форме является окислителем. При нагревании меди с концентрированной серной кислотой происходит окислительно-восстановительная реакция, и кислота превращается в диоксид серы. Уравнение этой химической реакции приведено ниже:
Однако он реагирует с концентрированной серной кислотой, потому что серная кислота в концентрированной форме является окислителем. При нагревании меди с концентрированной серной кислотой происходит окислительно-восстановительная реакция, и кислота превращается в диоксид серы. Уравнение этой химической реакции приведено ниже:
Какое сбалансированное уравнение для оксида меди и серной кислоты?
Балансное уравнение оксида меди и серной кислоты приведено ниже:
Почему оксид меди и серная кислота окрашиваются в синий цвет?
Все мы знаем, что реакция оксида меди + серная кислота приводит к химическому веществу синего цвета. Но задумывались ли вы когда-нибудь, почему реакция оксида меди с серной кислотой приводит к химическому веществу синего цвета? Что ж, мы подробно ответим на этот вопрос здесь. Оксид меди представляет собой твердое вещество черного цвета. Когда он реагирует с серной кислотой, он производит химическое вещество голубовато-синего цвета, известное как сульфат меди. Синий цвет обусловлен образованием растворимой соли. Ионы меди и сульфата диссоциируют, когда сульфат меди растворяется в воде. Хотя эффект не меняется, однако характер расщепления между t2g и eg-орбиталями в этом новом комплексе таков, что он поглощает красновато-оранжевый свет. Из-за этого поглощения вы увидите раствор голубоватого цвета.
Синий цвет обусловлен образованием растворимой соли. Ионы меди и сульфата диссоциируют, когда сульфат меди растворяется в воде. Хотя эффект не меняется, однако характер расщепления между t2g и eg-орбиталями в этом новом комплексе таков, что он поглощает красновато-оранжевый свет. Из-за этого поглощения вы увидите раствор голубоватого цвета.
Растворяет ли серная кислота медь?
Нет, серная кислота не может растворить медь. Однако, если наблюдается растворение, это может быть вызвано одной из следующих двух причин:
- Существует вероятность того, что поверхность порошка металлической меди частично окислена до . Серная кислота может растворить окисленную поверхность меди
- Образование вихря при перемешивании. Небольшое количество воздуха (кислорода), введенное в выщелачивающий раствор, действовало как окислитель.
Какая соль образуется при взаимодействии оксида меди с соляной кислотой?
Реакция меди и соляной кислоты невозможна. Однако оксид меди может реагировать с этой кислотой. Когда металл реагирует с кислотой, происходит окислительно-восстановительная реакция. Из-за более высокого восстановительного потенциала меди по сравнению с водородом она не может реагировать с неокисляющими кислотами, такими как серная кислота и соляная кислота.
Однако оксид меди может реагировать с этой кислотой. Когда металл реагирует с кислотой, происходит окислительно-восстановительная реакция. Из-за более высокого восстановительного потенциала меди по сравнению с водородом она не может реагировать с неокисляющими кислотами, такими как серная кислота и соляная кислота.
Но оксид меди – это не металл, а оксид металла. Оксиды металлов являются основными веществами, которые могут реагировать с кислотами с образованием соли и воды. Эти кислотно-щелочные реакции также известны как нейтрализация и не являются окислительно-восстановительными по своей природе.
Будучи слабым основанием, оксид меди легко реагирует с HCl с образованием растворимого хлорида меди и воды. Уравнение этой химической реакции приведено ниже:
Видео с вопросами: определение химической формулы вещества, образующегося при растворении двуокиси углерода в воде
Стенограмма видео
правильная химическая формула продукта, или продуктов, мы получаем, когда углекислый газ
растворяется в воде: СО2 плюс Н3О реагируют с образованием холостого хода.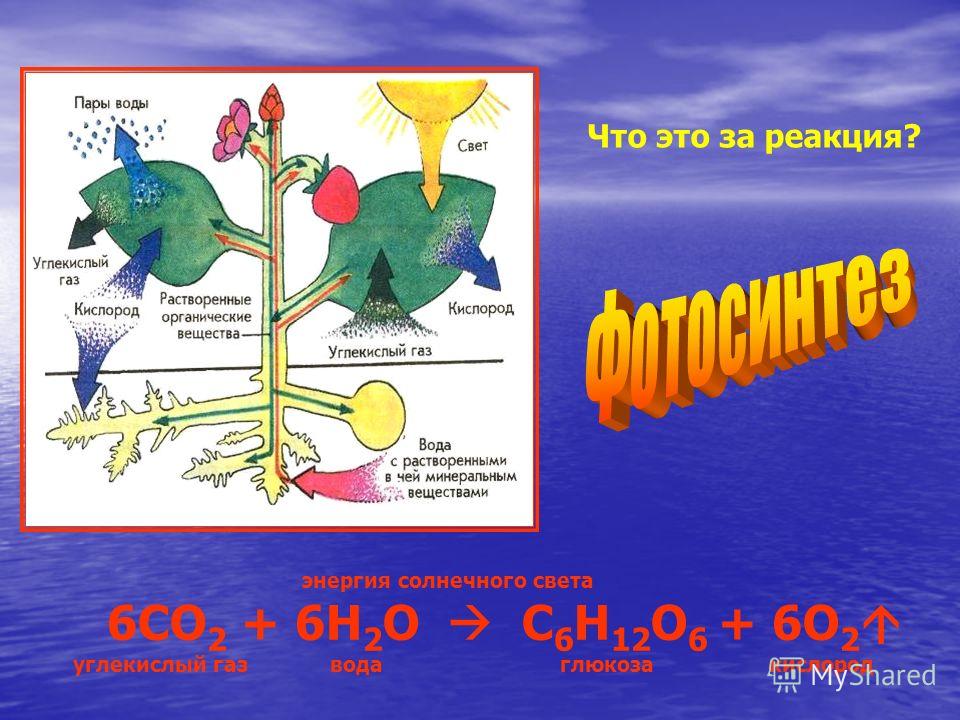 (A) CO3 плюс h3, (B) CO плюс h3CO2,
(C) O3 плюс h3 плюс C, (D) Ch3O плюс O2, (E) h3CO3.
(A) CO3 плюс h3, (B) CO плюс h3CO2,
(C) O3 плюс h3 плюс C, (D) Ch3O плюс O2, (E) h3CO3.
В этом вопросе нам дается неполное химическое уравнение для химической реакции. В химическом уравнении реагенты всегда появляются слева от стрелки реакции, а продукты появляются справа. Нам говорят, что имена реагентами химической реакции являются углекислый газ и вода. CO2 – это химическая формула углекислый газ, а h3O — химическая формула воды.
Чтобы правильно ответить на вопрос,
мы должны определить химическую формулу продукта или продуктов этого
реакция. Углекислый газ является разновидностью
химическое соединение, называемое оксидом. Существует два основных типа оксидов.
соединения: оксиды неметаллов и оксиды металлов. Оксид неметалла представляет собой ковалентную
соединение, содержащее кислород элемента и другой неметаллический элемент. Оксид металла представляет собой ионное соединение.
который содержит металлический элемент и кислород.
Оксид металла представляет собой ионное соединение.
который содержит металлический элемент и кислород.
Оксиды неметаллов и оксиды металлов обладают различными химическими свойствами. При растворении оксида неметалла в воды образуется новое соединение, называемое кислотой. Образуется другое соединение при растворении оксида металла в воде. При растворении оксида металла в воды образуется щелочь. Вот почему химики называют неметалл оксиды кислотными оксидами, а оксиды металлов называют основными оксидами.
Определим тип оксида углекислый газ есть. Молекула углекислого газа содержит один атом углерода и два атома кислорода. И углерод, и кислород неметаллы элементы. Это означает, что углекислый газ является оксид неметалла или кислотный оксид.
Теперь мы знаем, что когда углерод
диоксид растворяется в воде, образуется кислота.
Просматривая варианты ответов,
мы можем видеть, что есть только два варианта, которые содержат кислоту, варианты (B) и
(Э). При выборе (B) мы знаем, что
химическая формула h3CO2 представляет собой кислоту, потому что атомы водорода записываются
перед другими неметаллическими элементами. Точно так же в выборе (E) мы знаем
что химическая формула h3CO3 представляет собой кислоту, потому что атомы водорода
также пишется перед другими неметаллическими элементами.

