Сходные свойства меди и железа: Сходство и различия меди и железа
alexxlab | 15.10.1984 | 0 | Разное
Аморфные и нанокристаллические магнитомягкие сплавы
- Наша продукция
- Аморфные и нанокристаллические магнитомягкие сплавы
Аморфные магнитомягкие сплавы
Аморфные сплавы – новый особый класс прецизионных сплавов, отличающийся от кристаллических сплавов структурой, способом изготовления, областью существования на температурно-временной диаграмме и свойствами.
В 60-х годах эксперименты по быстрому охлаждению металлических расплавов, которые проводились с целью получения субмикроскопической структуры металла, обнаружили, что в некоторых случаях кристаллическая решётка в металле вообще отсутствует, а расположение атомов характерно для бесструктурного, аморфного тела. Структура аморфных сплавов подобна структуре замороженной жидкости и характеризуется отсутствием дальнего порядка в расположении атомов. Оказалось, что у аморфного металла совсем другие, не сходные свойства с металлом кристаллическим. Он становится в несколько раз прочнее, повышается его стойкость к коррозии, меняются электромагнитные характеристики и даже одна из самых устойчивых констант – модуль упругости. В отличие от сплавов с кристаллической структурой, технология получения которых имеет серьёзные проблемы, связанные с антагонизмом свойств компонентов на этапе кристаллизации, в аморфных сплавах прекрасно соединяются, уживаются все необходимые компоненты. При сверхбыстром охлаждении сплав затвердевает, прежде чем компоненты-антагонисты успевают проявить свой антагонизм. Это открывает широчайшие возможности поиска оптимальных комбинаций компонентов для получения конкретных свойств. Аморфные сплавы получили название металлических стёкол. Интерес к ним стремительно возрастает.
Он становится в несколько раз прочнее, повышается его стойкость к коррозии, меняются электромагнитные характеристики и даже одна из самых устойчивых констант – модуль упругости. В отличие от сплавов с кристаллической структурой, технология получения которых имеет серьёзные проблемы, связанные с антагонизмом свойств компонентов на этапе кристаллизации, в аморфных сплавах прекрасно соединяются, уживаются все необходимые компоненты. При сверхбыстром охлаждении сплав затвердевает, прежде чем компоненты-антагонисты успевают проявить свой антагонизм. Это открывает широчайшие возможности поиска оптимальных комбинаций компонентов для получения конкретных свойств. Аморфные сплавы получили название металлических стёкол. Интерес к ним стремительно возрастает.
Прежде всего, исследователей заинтересовали ферромагнитные свойства сплавов на основе железа, никеля и кобальта. Магнитомягкие свойства металлических стёкол в основном оказались лучше свойств пермаллоев, притом эти свойства более стабильны.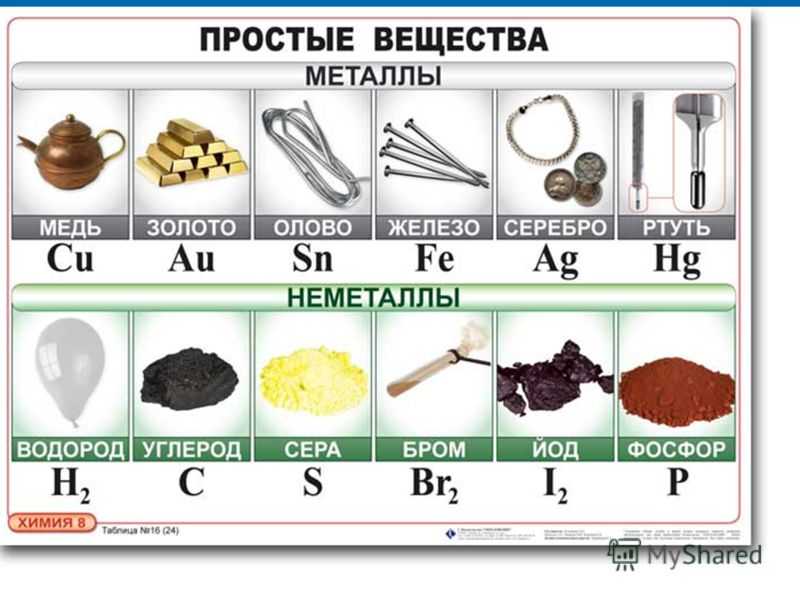 Аморфное состояние сплавов достигается подбором химического состава и использованием специальной технологии охлаждения из расплава со скоростью выше критической, определённой для каждого состава. Отсутствие дислокаций приводит к тому, что металлические стёкла по прочности превосходят самые лучшие легированные стали. Высокая твёрдость влечёт за собой их великолепную износостойкость. Другое важнейшее преимущество аморфных металлических сплавов – их исключительно высокая коррозионная стойкость. Во многих весьма агрессивных средах (морской воде, кислотах) металлические стёкла вообще не корродируют. Например, скорость коррозии аморфного сплава, содержащего железо, никель и хром, в растворе соляной кислоты практически равна нулю. По-видимому, основная причина такой высокой коррозионной стойкости аморфных сплавов состоит в том, что, не имея кристаллической решётки, они лишены и характерных “дефектов” кристаллов – дислокаций и, главное, границ между зёрнами. Высокая плотность упаковки атомов в кристалле вблизи этих “дефектов” уменьшается столь резко, что вдоль них легко проникают в металл “вражеские агенты”.
Аморфное состояние сплавов достигается подбором химического состава и использованием специальной технологии охлаждения из расплава со скоростью выше критической, определённой для каждого состава. Отсутствие дислокаций приводит к тому, что металлические стёкла по прочности превосходят самые лучшие легированные стали. Высокая твёрдость влечёт за собой их великолепную износостойкость. Другое важнейшее преимущество аморфных металлических сплавов – их исключительно высокая коррозионная стойкость. Во многих весьма агрессивных средах (морской воде, кислотах) металлические стёкла вообще не корродируют. Например, скорость коррозии аморфного сплава, содержащего железо, никель и хром, в растворе соляной кислоты практически равна нулю. По-видимому, основная причина такой высокой коррозионной стойкости аморфных сплавов состоит в том, что, не имея кристаллической решётки, они лишены и характерных “дефектов” кристаллов – дислокаций и, главное, границ между зёрнами. Высокая плотность упаковки атомов в кристалле вблизи этих “дефектов” уменьшается столь резко, что вдоль них легко проникают в металл “вражеские агенты”. Важно, что бездефектная структура аморфного сплава придаётся той тонкой окисной плёнке, которая образуется на его поверхности на начальных стадиях коррозионного процесса и в дальнейшем защищает металл от прямого контакта с “агрессором”. Специфичность технологий позволяет изготавливать аморфные сплавы в виде лент толщиной менее 40 мкм.
Важно, что бездефектная структура аморфного сплава придаётся той тонкой окисной плёнке, которая образуется на его поверхности на начальных стадиях коррозионного процесса и в дальнейшем защищает металл от прямого контакта с “агрессором”. Специфичность технологий позволяет изготавливать аморфные сплавы в виде лент толщиной менее 40 мкм.
Для изготовления аморфных сплавов в виде лент обычно используется способ охлаждения, при котором струя жидкого металла с определённой скоростью направляется на поверхность быстро вращающегося цилиндра, изготовленного из материала с высокой теплопроводностью. Микропровод с аморфной структурой изготавливается путём расплавления токами высокой частоты металла, заключённого в стеклянную трубку с коническим дном, с вытягиванием и охлаждением тонкого капилляра, заполненного металлом. Аморфные сплавы при нагревании переходят в кристаллическое состояние. Для стабильной работы изделий из аморфных сплавов необходимо, чтобы их температура не превышала для каждого сплава максимальной рабочей температуры (Т раб max). В настоящее время наибольшее распространение получили магнитомягкие аморфные сплавы, в которых сочетаются высокие магнитные и механические свойства. Магнитомягкие аморфные сплавы – ферромагнитные сплавы с узкой петлёй гистерезиса. Особенностью магнитомягких аморфных сплавов по сравнению с кристаллическими является большое (около 20 %) содержание немагнитных элементов, как бор, кремний, углерод, фосфор и проч., необходимых для сохранения аморфной структуры. Наличие этих элементов снижает максимальные значения индукции насыщения в аморфных сплавах по сравнению с кристаллическими и увеличивает температурный коэффициент магнитных свойств. Эти же элементы увеличивают электросопротивление, повышают твёрдость и прочность аморфных сплавов, а также их коррозионную стойкость. В радио- и электротехнических изделиях с начала восьмидесятых годов стали широко применяться аморфные материалы, которые используются вместо пермаллоев, ферритов, электротехнических сталей, магнитодиэлектриков.
В настоящее время наибольшее распространение получили магнитомягкие аморфные сплавы, в которых сочетаются высокие магнитные и механические свойства. Магнитомягкие аморфные сплавы – ферромагнитные сплавы с узкой петлёй гистерезиса. Особенностью магнитомягких аморфных сплавов по сравнению с кристаллическими является большое (около 20 %) содержание немагнитных элементов, как бор, кремний, углерод, фосфор и проч., необходимых для сохранения аморфной структуры. Наличие этих элементов снижает максимальные значения индукции насыщения в аморфных сплавах по сравнению с кристаллическими и увеличивает температурный коэффициент магнитных свойств. Эти же элементы увеличивают электросопротивление, повышают твёрдость и прочность аморфных сплавов, а также их коррозионную стойкость. В радио- и электротехнических изделиях с начала восьмидесятых годов стали широко применяться аморфные материалы, которые используются вместо пермаллоев, ферритов, электротехнических сталей, магнитодиэлектриков.
Нанокристаллические магнитные сплавы
Вторым представителем нового класса метастабильных быстроохлаждённых сплавов и активным соперником аморфных сплавов являются нанокристаллические сплавы. Их особенность – сверхмелкокристаллическая структура. Размер кристаллов (наночастицы) в этих сплавах составляет от 1 до 10 нм. Нанокристаллические и аморфные сплавы – ближайшие родственники. Их «родство» основано на двух обстоятельствах. Во – первых, это структурное сходство. Как известно, структура аморфных сплавов имеет ближний порядок, т. е. состоит из упорядоченных микрогруппировок атомов, размеры которых близки к размерам нанозёрен нанокристаллических сплавов. Во – вторых, это технология получения. В настоящее время наиболее распространённым методом получения наноструктуры является регулируемая кристаллизация из исходного аморфного состояния.
Их особенность – сверхмелкокристаллическая структура. Размер кристаллов (наночастицы) в этих сплавах составляет от 1 до 10 нм. Нанокристаллические и аморфные сплавы – ближайшие родственники. Их «родство» основано на двух обстоятельствах. Во – первых, это структурное сходство. Как известно, структура аморфных сплавов имеет ближний порядок, т. е. состоит из упорядоченных микрогруппировок атомов, размеры которых близки к размерам нанозёрен нанокристаллических сплавов. Во – вторых, это технология получения. В настоящее время наиболее распространённым методом получения наноструктуры является регулируемая кристаллизация из исходного аморфного состояния.
Таким образом, «материнской» основой нанокристаллического сплава является сплав аморфный.
Структура нанокристаллического сплава представляет собой двухфазную систему, одной из фаз которой являются нанокристаллы, а другой – остаточная аморфная матрица. Свойства наносплава зависят от состава, размера и количества нанокристаллов, а также их соотношения с аморфной фазой. Основой экономичного сырья являются кремний и железо. Имея высокую индукцию насыщения (1.2 Т), хорошую температурную стабильность в широком диапазоне температур от -60 до 180ºС, новый нанокристаллический материал имеет отличные характеристики в высокочастотной области на уровне аморфных сплавов на основе кобальта. При этом новый сплав является намного более экономичным. Точное управление параметрами отжига навитых из ленты тороидов позволяет в широких пределах регулировать требуемые свойства материала (например, форму петли гистерезиса, уровень магнитной проницаемости, коэффициент прямоугольности, удельные потери). Одновременно, хорошее качество по доступной цене становится все более весомым показателем конкурентоспособности нанокристаллического материала в сравнении с ферритами и пермаллоями.
Основой экономичного сырья являются кремний и железо. Имея высокую индукцию насыщения (1.2 Т), хорошую температурную стабильность в широком диапазоне температур от -60 до 180ºС, новый нанокристаллический материал имеет отличные характеристики в высокочастотной области на уровне аморфных сплавов на основе кобальта. При этом новый сплав является намного более экономичным. Точное управление параметрами отжига навитых из ленты тороидов позволяет в широких пределах регулировать требуемые свойства материала (например, форму петли гистерезиса, уровень магнитной проницаемости, коэффициент прямоугольности, удельные потери). Одновременно, хорошее качество по доступной цене становится все более весомым показателем конкурентоспособности нанокристаллического материала в сравнении с ферритами и пермаллоями.
Преимущества
Независимо от варианта применения, при использовании аморфных и нанокристаллических сердечников при проектировании индуктивных компонентов обычно обеспечиваются следующие преимущества:
- Уменьшенный вес
- Уменьшенные потери в меди благодаря сокращению числа витков
- Расширенный температурный диапазон от -60 до 125º С
- Повышенная стабильность свойств и надёжность
- Высокая точность для измерительных устройств
- Повышение КПД устройства
Сравнительные характеристики аморфных и нанокристаллических магнитомягких материалов относительно традиционных:
| МАТЕРИАЛ _________ СВОЙСТВА | Электротех. | Пермаллой | Феррит Mn-Zn | Аморфный | Нанокристаллический | ||
| 50 Ni | 80 Ni | На осн. Со | На осн. Fe | На осн. Fe | |||
| Амплитуда магн. индукции, Вm (T) | 2,0 | 1,55 | 0,74 | 0,5 | 0,58 | 1,56 | 1,16 |
| Коэрцитивная сила, Нс (Э) | 0,5 | 0,15 | 0,03 | 0,1 | 0,005 | 0,03 | 0,01 |
| Начальная проницаемость, µi | 1500 | 6000 | 40000 | 3000 | 60000 | 5000 | 70 000 |
| Максимальная проницаемость, µm | 20000 | 60000 | 200000 | 6000 | 1000000 | 50000 | 600 000 |
| Удельное сопротивление, p (µО/см) | 50 | 30 | 60 | 1000000 | 120 | 130 | 130 |
| Температура Кюри, Тс (°C) | 750 | 500 | 500 | 140 | 255 | 415 | 560 |
| Температура кристаллизации, Тх (°C) | – | – | – | – | 530 | 550 | 515 |
| Предельная рабочая температура, Т (°C) | 100 | 90 | 150 | 180 | |||
Оптим. область рабочих частот, f (кГц) область рабочих частот, f (кГц) | 0…1 | 0…10 | 10… | 10…100000 | |||
ПАО “МСТАТОР” выпускает большую номенклатуру лент из аморфных и нанокристаллических сплавов АМАГ шириной от 1 до 30 мм и толщиной от 15 до 25 мкм для поставок заказчикам и использования в собственном производстве тороидальных магнитопроводов и законченных электромагнитных компонентов, представленных в разделе Продукция.
Консультация по услугам
Менеджеры компании с радостью ответят на ваши вопросы и произведут расчет стоимости услуг и подготовят индивидуальное коммерческое предложение.
Задать вопрос
Наши партнёры
Сплавы на основе меди | Статья от ГК Велунд Сталь Москва
Одним из металлов, сыгравших в развитии человечества огромную роль была медь – металл красно-розового цвета. Ее было легко добыть, потому что она часто встречалась в самородном виде, для плавления нужна была не очень высокая температура в 1083 градуса, легко обрабатывалась, а орудия труда, посуда, украшения и оружие из нее получались гораздо лучше, чем из камня и глины.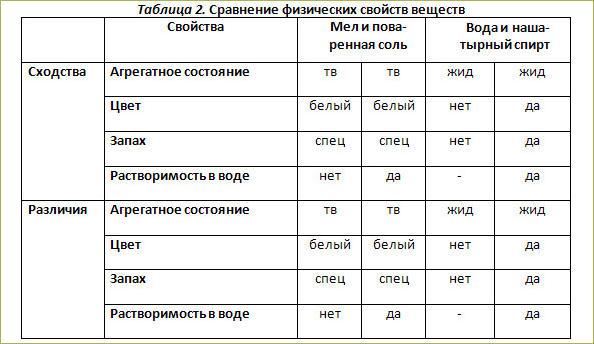
Для сплавов меди существует своя классификация. Они подразделяются на бронзы, латуни и медно-никелевые сплавы. Все зависит от того, какие элементы добавляются в медь. Для латуни – это цинк, для бронзы любой другой элемент, исключая никель и цинк.
Бронза – первое изобретение древних металлургов
Кто первый додумался добавить в медь мышьяк, истории неизвестно. Случилось это за 5000 лет до н.э. Этот сплав сейчас называют мышьяковистой бронзой. Достоинства нового сплава сразу принесли ему популярность. Он был прочный, ковкий, из него можно было делать все, что угодно, начиная от оружия до орудий труда. Олово стали добавлять много позже, когда выяснилось, что мышьяк ядовит и здоровья кузнецам не прибавляет и стоит дороже чем олово. Оловянная бронза была очень востребована. Меняя соотношение меди и олова, можно было получить колокольную бронзу или пушечную.
Сегодня известно множество видов бронзы. Различным путем было выяснено, что добавляя в медь разные элементы или лигатуры – сплавы, содержащие легирующие элементы, можно получить металл с совершенно новыми свойствами. Так появились:
- Алюминиевая бронза – сплав меди с алюминием, иногда с добавками марганца, железа, кремния или никеля. По цвету схожа с золотом, поэтому ее часто используют в бижутерии и монетном деле, где она известна еще как северное золото, потому что из нее отлиты монеты достоинством в 10, 20 и 50 евроцентов. Также из этой бронзы льют декоративные элементы. Прочная, стойкая к коррозии, солевым растворам и почти не окисляемая, алюминиевая бронза нашла широкое применение в судостроении, где из нее делают гребные винты и подшипники, авиационной промышленности, нефтехимической и в системах водоснабжения;
- Бериллиевая бронза, обладающая немагнитными свойствами и таким интересным свойством как отсутствием искрения.
 Поэтому из нее делают инструменты – молотки, гаечные ключи, зубила и др. для взрывоопасных производств типа шахт, зерновых элеваторах и нефтедобыче.
Поэтому из нее делают инструменты – молотки, гаечные ключи, зубила и др. для взрывоопасных производств типа шахт, зерновых элеваторах и нефтедобыче.
Существуют и другие виды бронз – кремнистая, кадмиевая, марганцевая и магниевая. Эти элементы, добавленные в нужной пропорции, дают меди различные свойства.
Латунь и ее разновидности
Получают латунь, смешивая в различных пропорциях медь и цинк, иногда добавляя присадки в виде никеля, марганца или алюминия. В зависимости от этого получают латунь деформируемую или литейную. Известна еще латунь ювелирная.
Латунь широко распространена. Она легко поддается обработке, не очень дорога, хорошо противостоит коррозии. Область применения ее необычайно широка. Фурнитура для мебели, значки, медали, патронные гильзы, авиа- и судостроение, химическая промышленность, ювелирное дело. Делают из нее самовары, различные змеевики и конденсаторные трубы, детали для часов, радиаторы автомашин и многое другое.
Медное золото
Да, есть и такое – французское. Это медный сплав, имеющий в составе медь, цинк и олово. По блеску и цвету он весьма схож с натуральным золотом. Под стать ему сплав, называющийся абиссинским или эфиопским золотом. В него, кроме всех перечисленных элементов, добавляется от 0,5 до 1 процента настоящего золота, благодаря чему сплав не тускнеет.
Мельхиор, куниаль и другие
С медно-никелевыми сплавами мы сталкиваемся ежедневно за обедом или ужином. Из мельхиора делают качественные столовые приборы, ничем не уступающие серебряным по внешнему виду. Хотя некоторые из них все же покрывают тончайшим слоем серебра. Он не реагирует на магниты, устойчив к коррозии. Мельхиор одно время даже называли новым серебром и чеканили из него разменную монету. Сейчас это считается дорогим удовольствием, поэтому из мельхиора делают памятные и коллекционные монеты, декоративные украшения, преобразователи тепла в электричество и детали для лодок, потому что мельхиор не боится морской воды.
Сплав нейзильбер похож на мельхиор, только в него добавлен еще цинк. Нашел применение в изготовлении монет, государственных знаков отличия, столовых приборов, хирургических инструментов.
Сверхустойчивый к коррозии куниаль соединяет в себе медь, никель и алюминий. Используется в криогенике, из него делают пружины для точных механизмов и гребные винты.
Есть еще два вида сплава меди с никелем и марганцем. Это манганин и константан. По сути это один и тот же сплав, но его изобретение оспаривают между собой немцы и американцы.
Никитин Б. А. Избранные труды. — 1956 — Электронная библиотека «История Росатома»
Никитин Б. А. Избранные труды. — 1956 — Электронная библиотека «История Росатома»Главная → Указатель произведений
ЭлектроннаябиблиотекаИстория Росатома
Ничего не найдено.
Загрузка результатов…
Закладки
Обложка12345678910 пустая1112131415161718192021222324252627282930313233343536373839404142434445464748495051525354555657585960616263646566676869707172737475767778798081828384858687888990919293949596979899100101102103104105106107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137138139140141142143144145146147148149150151152153154155156157158159160161162163164165166167168169170171172173174175176177178179180181182183184185186187188189190191192193194195196197198199200201202203204205206207208209210211212213214215216217218219220221222223224225226227228229230231232233234235236237238239240241242243244245246247248249250251252253254255256257258259260261262263264265266267268269270271272273274275276277278279280281282283284285286287288289290291292293294295296297298299300301302303304305306307308309310311312313314315316317318319320321322323324325326327328329330331332333334335336337338339340341342343344345346347348349350 пустая351
Увеличить/уменьшить масштаб
По ширине страницы
По высоте страницы
Постранично/Разворот
Поворот страницы
Навигация по документу
Закладки
Поиск в издании
Структура документа
Скопировать текст страницы
(работает в Chrome 42+,
Microsoft Internet Explorer и Mozilla FireFox
c установленным Adobe Flash Player)
Добавить в закладки
Текущие страницы выделены рамкой.
Содержание
ОбложкаОбложка
1Титульные листы
3Старик И. Е.
От редактора 5Вдовенко В. М.
Борис Александрович Никитин (очерк научной деятельности)11I. Исследования явлений изоморфизма и изоморфного соосаждения
11Никитин Б. А., Хлопин В. Г.
К вопросу о фракционированной кристаллизации радиоактивных веществ в свете исследования теории этих процессов. I. Равновесие в системе бромид бария— бромид радия—бромистоводородная кислота и вода при t = 0° и 25° C 29Никитин Б. А.
Применение метода радиоактивных индикаторов для решения вопроса о существовании и структуре гриммовских смешанных кристаллов нового рода 52Никитин Б. А.
Изоморфное замещение в ионных решетках простых соединений 61Никитин Б. А., Иоффе Э. М.
Распределение в системах с аномальными смешанными кристаллами. I. Система NH 4Cl—FeCl{3}—H{2}O и NH4Cl—MnCl2—H{2}O 69Никитин Б. А., Иоффе Э. М.
Распределение в системах с аномальными смешанными кристаллами. II. Системы типа неорганическая соль—органический краситель 76
II. Системы типа неорганическая соль—органический краситель 76Никитин Б. А., Иоффе Э. М.
Распределение в системах с аномальными смешанными кристаллами. III. О равновесии между аномальными смешанными кристаллами и раствором 82Никитин Б. А.
Изоморфизм и твердые растворы. (К 150-летию со дня рождения Э. Митчерлиха)104II. Исследования по химии благородных газов
104Никитин Б. А.
Гидрат радона 113Никитин Б. А.
Исследование в области молекулярных соединений благородных газов 165Никитин Б. А.
Исследования по химии инертных газов. I. О гидратах аргона и неона 175Никитин Б. А.
Исследования по химии инертных газов. II. Отделение инертных газов друг от друга химическим путем 182Никитин Б. А.
Исследования по химии инертных газов. IV. Соединение радона с фенолом 190Никитин Б. А.
Исследования в области молекулярных соединений 211Никитин Б. А.
А.
Никитин Б. А., Иоффе Э. М.
О возможности образования благородными газами соединений с бромистым и хлористым алюминием 218Никитин Б. А., Ковальская М. П., Пушленков М. Ф.
К методике термического анализа систем, имеющих летучий компонент 224Никитин Б. А., Ковальская М. П.
О соединениях благородных газов и их аналогов фенолом 232Никитин Б. А., Иоффе Э. М.
О соединении радона с пара-хлорфенолом 234Никитин Б. А., Пушленков М. Ф.
О соединении сероводорода с фенилгидразином241III. Изучение химических и физико-химических свойств радиоактивных элементов
241Никитин Б. А., Эрбахер О.
Определение растворимости сульфата радия в воде при 20° 251Никитин Б. А., Эрбахер О.
К вопросу о значении закона действующих масс. I. Растворимость сульфата радия в растворах серной кислоты и сульфата натрия 255Никитин Б. А., Толмачев П. И.
К вопросу о значении закона действующих масс. II. Количественное определение растворимости сульфата радия в растворах сульфата натрия и в воде 264
II. Количественное определение растворимости сульфата радия в растворах сульфата натрия и в воде 264Никитин Б. А.
Об одной качественной реакции на радий 266Никитин Б. А.
Исследования по аналитической химии радия. Реакция чистого радия 274Никитин Б. А., Вдовенко В. М.
Об адсорбции радия на стекле 281Никитин Б. А., Герлинг Э. К.
О выделении радона из урановых минералов 285Никитин Б. А., Иоффе Э. М.
Об адсорбции радона на угле в динамических условиях 291Никитин Б. А., Полесицкий А. Е.
Новый метод выделения радиотория и радия D и очистка солей радия294IV. Работы по изучению распространенности радия в природных водах
294Никитин Б. А., Хлопин В. Г.
К вопросу о содержании радия в нефтяных водах Грозненского района 299Никитин Б. А., Комлев Л. В.
Содержание радия в буровых водах Бакинского нефтяного района и Дагестанской области 312Никитин Б. А.
Содержание радия в буровых водах нефтепромыслов Ферганской области 315Никитин Б. А., Мятелкин П. В.
В.
Никитин Б. А., Меркулова М. С.
Радий в пластовых водах и нефтях нефтяного месторождения Биби-Эйбат335О теоретическом обосновании физико-химического анализа
335Никитин Б. А.
Линия состава соединения в диаграммах состав—свойство345Библиография
348Содержание
351Концевая страница
Обращаясь к сайту «История Росатома — Электронная библиотека»,
я соглашаюсь с условиями использования представленных там материалов.
Правила сайта (далее – Правила)
- Общие положения
- Настоящие правила определяют порядок и условия использования материалов, размещенных на сайте www.biblioatom.ru (далее именуется Сайт), а также правила использования материалов Сайтом и порядок взаимодействия с Администрацией Сайта.
- Любые материалы, размещенные на Сайте, являются объектами интеллектуальной собственности (объектами авторского права или смежных прав, а также прав на средства индивидуализации).
 Права Администрации
Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
Права Администрации
Сайта на указанные материалы охраняются законодательством о правах на результаты интеллектуальной деятельности.
- Использование материалов, размещенных на Сайте, допускается только с письменного согласия Администрации Сайта или иного правообладателя, прямо указанного на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Права на использование и разрешение использования материалов, размещенных на Сайте, принадлежащих иным правообладателям, нежели Администрация Сайта, допускается с разрешения таких правообладателей или в соответствии с условиями, установленными такими правообладателями. Никакое из положений настоящих Правил не дает прав третьим лицам на использование материалов правообладателей, прямо указанных на конкретном материале, размещенном на Сайте, или в непосредственной близости от указанного материала.
- Настоящие Правила распространяют свое действие на следующих пользователей: информационные агентства, электронные и печатные средства массовой информации, любые физические и юридические лица, а также
индивидуальные предприниматели (далее — «Пользователи»).

- Использование материалов. Виды использования
- Под использованием материалов Сайта понимается воспроизведение, распространение, публичный показ, сообщение в эфир, сообщение по кабелю, перевод, переработка, доведение до всеобщего сведения и иные способы использования, предусмотренные действующим законодательством Российской Федерации.
- Использование материалов Сайта без получения разрешения от Администрации Сайта не допустимо.
- Внесение каких-либо изменений и/или дополнений в материалы Сайта запрещено.
- Использование материалов Сайта осуществляется на основании договоров с Администрацией Сайта, заключенных в письменной форме, или на основании письменного разрешения, выданного Администрацией Сайта.
- Запрещается любое использование (бездоговорное/без разрешения) фото-, графических, видео-, аудио- и иных материалов, размещенных на Сайте, принадлежащих Администрации Сайта и иным правообладателям
(третьим лицам).

- Стоимость использования каждого конкретного материала или выдача разрешения на его использование согласуется Пользователем и Администрацией Сайта в каждом конкретном случае.
- В случае необходимости использования материалов Сайта, права на которые принадлежат третьим лицам (иным правообладателям, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от них), Пользователи обязаны обращаться к правообладателям таких материалов для получения разрешения на использование материалов.
- Обязанности Пользователей при использовании материалов Сайта
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома»
(www.
 biblioatom.ru)
biblioatom.ru)
- в интернете или иных формах использования в электронном виде не на материальных носителях, Пользователи в каждом случае использования материалов обязаны разместить гиперссылку на Сайт — электронная библиотека «История Росатома» (www.biblioatom.ru), гиперссылка должна являться активной и прямой, при нажатии на которую Пользователь переходит на конкретную страницу Сайта, с которой заимствован материал.
- Ссылка на источник или гиперссылка, указанные в пп. 3.1.1 и 3.1.2. настоящих Правил, должны быть помещены Пользователем в начале используемого текстового материала, а также непосредственно под используемым аудио-, видео-, фотоматериалом, графическим материалом Администрации Сайта.
- в печатных изданиях или в иных формах на материальных носителях Пользователи обязаны в каждом случае использования материалов указать источник – электронная библиотека «История Росатома»
(www.
- Размеры шрифта ссылки на источник или гиперссылки не должны быть меньше размера шрифта текста, в котором используются материалы Сайта, либо размера шрифта текста Пользователя, сопровождающего аудио-,
видео-, фотоматериалы и графические материалы Сайта, а также цвет ссылки должен быть идентичен цветам ссылок на Сайте и должен быть видимым Пользователю.

- Использование материалов с Сайта, полученных из вторичных источников (от иных правообладателей, нежели Администрация Сайта, о чем прямо указано на таких материалах либо в непосредственной близости от них), возможно только со ссылкой на эти источники и, в случае необходимости, установленной такими источниками (правообладателями), — с их разрешения.
- Не допускается переработка оригинального материала (произведения), взятого с Сайта, в том числе сокращение материала, иная его переработка, в том числе приводящая к искажению его смысла.
- 3.1. При использовании материалов Сайта в любых целях при наличии разрешения Администрации Сайта, ссылка на Сайт обязательна и осуществляется в следующем виде:
- Права на материалы третьих лиц, урегулирование претензий
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование
прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.

- В случае, если в обозначении авторства материалов в соответствии с п. 4.1. настоящих Правил содержится ошибка, или в случае использования материала с предполагаемым или реальным нарушением прав
третьих лиц, или в иных спорных случаях использования объектов интеллектуальной собственности, размещенных на Сайте, в том числе в случае, когда права третьего лица тем или иным образом нарушаются с
использованием Сайта, применяется следующая схема урегулирования претензий третьих лиц к Администрации Сайта:
- в адрес Администрации Сайта по электронной почте на адрес [email protected] направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем.
 В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
В претензии также указывается адрес
страницы
Сайта, которая содержит данные, нарушающие права, и излагается полное описание сути нарушения прав;
- Администрация Сайта обязуется рассмотреть надлежаще оформленную претензию в срок не менее 5 (пяти) рабочих дней с даты ее получения по электронной почте. Администрация Сайта обязуется уведомить заявителя о результатах рассмотрения его заявления (претензии) посредством отправки письма по электронной почте на адрес, указанный заявителем, а также направить ответ в письменном виде на адрес, указанный заявителем (в случае неуказания такового адреса отправки, обязательство по предоставлению письменного ответа на претензию с Администрации Сайта снимается). В том числе, Администрация Сайта вправе запросить дополнительные документы, свидетельства, данные, подтверждающие законность предъявляемой претензии. В случае признания претензии правомерной, Администрация Сайта примет все возможные меры, необходимые для прекращения нарушения прав заявителя и урегулирования претензии;
- Администрация Сайта в любом случае предпринимает все возможные меры к скорейшему удовлетворению обоснованных претензий третьих лиц и стремиться к максимально скорому урегулированию всех
спорных
вопросов.

- в адрес Администрации Сайта по электронной почте на адрес [email protected] направляется претензия, содержащая информацию об объекте интеллектуальной собственности, права на который
принадлежат
заявителю и который используется незаконно посредством Сайта или с нарушением правил использования, или иным образом права заявителя как обладателя исключительного права на объект интеллектуальной
собственности, размещенный на Сайте, нарушены посредством Сайта, с приложением документов, подтверждающих правомочия заявителя, данные о правообладателе и копия доверенности на действия от лица
правообладателя, если лицо, направляющее претензию, не является руководителем компании правообладателя или непосредственно физическим лицом — правообладателем.
- Материалы, права на которые принадлежат третьим лицам, размещенные на Сайте, размещены либо с разрешения правообладателя, полученного Администрацией Сайта, либо, в случае, если таковое использование
прямо не запрещено правообладателем, в соответствии с Законодательством РФ в информационных целях с обязательным указанием имени автора, материал которого используется, и источника заимствования.
- Прочие условия
- Администрация Сайта оставляет за собой право изменять настоящие Правила в одностороннем порядке в любое время без уведомления Пользователей. Любые изменения будут размещены на Сайте. Изменения вступают в силу с момента их опубликования на Сайте.
- По всем вопросам использования материалов Сайта Пользователи могут обращаться к Администрации Сайта по следующим координатам: [email protected]
- Во всем, что не урегулировано настоящими Правилами в отношении вопросов использования материалов на Сайте, стороны руководствуются положениями Законодательства РФ.
СогласенНе согласен
Амфотерные металлы, что это в химии
Амфотерные тела – это такие вещества, которые напоминают своим строением, характеристиками металлические элементы. К тому же им свойственна и химическая двойственность.
Амфотерные тела – это не металлы, а их формы: оксиды, соли и т. д. Ряд оксидов может сочетать в себе 2 свойства и при определенных условиях проявлять параметры как кислот, так и щелочей.
Известными не понаслышке амфотерными материалами является алюминий, хром, цинк и т. д.
Впервые сам термин «амфотерность» появился в начале 19 столетия. На тот период химические компоненты классифицировали на основании их похожих свойств, которые можно наблюдать во время протекания реакций.
Амфотерные металлы: особенности, виды
Перечень амфотерных металлов немалый, причем далеко не все из них являются чистыми амфотерными, а лишь условными.
Вещества все обозначены в таблице Менделеева под определенными порядковыми номерами. Так, железо, бериллий, хром и стронций считаются основными аморфными элементами. Также типичным и распространенным в природе представителем является алюминий.
Металл алюминий повсеместно применяется в быту и промышленности в самых различных областях. Его используют для изготовления фюзеляжей самолетов, кухонной посуды, автомобильных кузовов, электрических приборов, электронной техники, приборов для тепловых сетей. Алюминий отличается от других металлов тем, что всегда остается химически активным. На поверхности стабильно располагается оксидная пленка, которая защищает материал от окисления. Благодаря этому при нормальных условиях и возникновении реакций металл с восстановительным веществом. Алюминий вступает в реакцию с кислородом, если предварительно был разделен на более мелкие фракции. Также для такой манипуляции потребуются повышенные температуры. Примечательно, что сама реакция продуцирует уйму тепловой энергии. Если повысить температуру до 200 ºC, то прореагировать алюминий может и с серой. При смешивании с различными металлами алюминий может давать различные функциональные сплавы с получением дополнительных свойств.
Его используют для изготовления фюзеляжей самолетов, кухонной посуды, автомобильных кузовов, электрических приборов, электронной техники, приборов для тепловых сетей. Алюминий отличается от других металлов тем, что всегда остается химически активным. На поверхности стабильно располагается оксидная пленка, которая защищает материал от окисления. Благодаря этому при нормальных условиях и возникновении реакций металл с восстановительным веществом. Алюминий вступает в реакцию с кислородом, если предварительно был разделен на более мелкие фракции. Также для такой манипуляции потребуются повышенные температуры. Примечательно, что сама реакция продуцирует уйму тепловой энергии. Если повысить температуру до 200 ºC, то прореагировать алюминий может и с серой. При смешивании с различными металлами алюминий может давать различные функциональные сплавы с получением дополнительных свойств.
Не при всех условиях вещество вступает с реакцию с водородом.
Еще один типичный представитель амфотерных металлов – железо, который располагается под номером 26 в Таблице и находится между марганцем и кобальтом.
Железо считается одним из самых доступных элементов, залежи которого расположены в земной коре. Он одновременно является компонентом бело-серебристого цвета с хорошей ковкостью при высоких температурах. В то же время вещество может быть коррозировать при сильном нагревании. А в случае помещения его в среду чистого кислорода можно ожидать воспламенения и даже перегорания железа. Также, находясь на открытом воздухе, железо под воздействием высокой влажности начинает стремительно окисляться и даже ржаветь. А в процессе горения в массе с кислородом железо дает определенную окалину – это и есть его оксид.
Свойства амфотерных веществ
Главные характеристики этих веществ заключены в самом понятии амфотерности. Так, в своем обычном состоянии при подходящих условиях внешней среды большинство металлов являются твердыми веществами. При этом ни один металл не растворим в обычной воде. А щелочные же основания могут выделяться только после начала некоторых химических реакций. И тогда в процессе соли в составе метала начинают реагировать. Необходимо обратить внимание, что правила безопасности требуют повышенной осторожности во время наблюдения за такими реакциями.
И тогда в процессе соли в составе метала начинают реагировать. Необходимо обратить внимание, что правила безопасности требуют повышенной осторожности во время наблюдения за такими реакциями.
В процессе соединения амфотерных материалов с кислотными реагентами или оксидами они показывают химическую реакцию, характерную для оснований. В случае, когда металлы реагируют с основаниями, регистрируются, наоборот кислотные характеристики.
Если амфотерные гидроксиды подвергнуть нагреванию, то в результате они распадутся на оксид и воду.
Отметим, что амфотерные материалы обладают самыми различными свойствами, которые изучаются научными светилами до сих пор. Свойства также можно разобрать, сравнивая их с характеристиками обычных материалов. Так, многие металлы демонстрируют малый потенциал ионизации, что наделяет их свойствами восстановителя во время реакции.
Амфотерные тела демонстрируют сразу 2 свойства: окислительное и восстановительное. При этом некоторые соединения имеют отрицательный уровень окисления.
Все металлы, представленные в таблице Менделеева, образуют основные оксиды и гидроксиды.
Интересный момент – металлы могут окисляться далеко не со всеми кислотами в реакциях. Само окисление может не давать взаимодействие с азотной кислотой.
Простые амфотерные материалы имеют различную структуру и характеристики.
Некоторые вещества имеют такие характеристики, что их принадлежность к определенному классу можно выявить даже визуально. Так, мы сразу понимаем, что медь и алюминий – это металл.
Неметалл и металл: в чем же разница
Известно, что металлы выделяют электроны со своего внешнего электронного поля (облака). В свою очередь неметаллы притягивают такие электроны.
Также металлы хорошо проводят электроток и тепло, в отличие от неметаллов, полностью лишенных таких свойств.
Основания амфотерных маметиралов
При располагающих условиях основания нерастворимы в воде, можно сказать, являются довольно слабыми электролитами. Образуются они в результате химической реакции солей металла и щелочной жидкости. Такая химическая реакция опасна для лаборанта, поэтому для получения гидроксидов необходимо вводить едкие вещества осторожно, капля за каплей.
Образуются они в результате химической реакции солей металла и щелочной жидкости. Такая химическая реакция опасна для лаборанта, поэтому для получения гидроксидов необходимо вводить едкие вещества осторожно, капля за каплей.
Амфотерные материалы реагируют с кислотами в роли оснований. В случае когда гидроксид цинка реагирует с соляной кислотой, то на выходе получится хлорид цинка. При реакции с основаниями материалы, напротив, выступают кислотами.
Почему алмаз останется самым дорогим камнем
Ученые сжигают алмазИстория искусственных алмазов полна драматизма и по сей день таит в себе немало загадок. Недавняя статья академика Сергея Стишова в журнале “Успехи физических наук” проливает свет на некоторые из них. Но изучение алмазов далеко до завершения.
Французский естествоиспытатель XVIII века Лавуазье остроумно показал, из чего сделан алмаз. Он сфокусировал солнечный луч на кристалл в запаянной колбе, и когда тот сгорел, в емкости остался только углекислый газ. Получается, что алмаз — из углерода. Казалось, все просто: надо придумать, как сажу, которой было много в те времена, или графит, превратить в кристалл. Но не тут-то было.
Получается, что алмаз — из углерода. Казалось, все просто: надо придумать, как сажу, которой было много в те времена, или графит, превратить в кристалл. Но не тут-то было.
Алмаз — самый твердый минерал в природе, а графит — самый мягкий. Оба из углерода. Как графит превратить в алмаз? Физики измерили теплоемкость обоих минералов, провели термодинамические расчеты и получили уравнение кривой перехода. К 1930-м стало ясно, что для синтеза алмаза нужны очень высокие давления и температуры, недостижимые на том уровне техники.
Реальный прорыв случился в послевоенные годы. Задачу решали в трех технически развитых странах, не имевших еще в те годы собственных месторождений алмазов: Швеция, США и СССР. Их приходилось закупать за рубежом.
Задачу синтеза алмаза советское государство поставило в 1947-м. Но дело двигалось со скрипом, пока в 1955-м в Nature не появилась статья “Рукотворный алмаз”. Авторы — ученые из General Electric, в том числе Трейси Холл. Компания производила лампы накаливания, и для вытягивания вольфрамовых нитей использовали алмазные фильеры. После этой публикации шведская компания ASEA заявила, что синтезировала алмаз еще в 1953-м.
Компания производила лампы накаливания, и для вытягивания вольфрамовых нитей использовали алмазные фильеры. После этой публикации шведская компания ASEA заявила, что синтезировала алмаз еще в 1953-м.
В Советском Союзе этой проблемой занимались Институт кристаллографии под руководством Алексея Шубникова и лаборатория высоких давлений, которую возглавлял Леонид Верещагин. Между этими организациями развернулась жесткая конкуренция. Победил Верещагин.
Как пишет академик Стишов, Верещагин организовал несколько групп, которые работали изолированно, а полной картиной владел только он. Не последнюю роль, видимо, в этой истории сыграло то, что американцы понемножку обнародовали детали установок и процесса синтеза. Как бы то ни было, искусственный алмаз в лаборатории, которая к тому времени стала Институтом физики высоких давлений, получили в 1960 году. Какой из групп принадлежит пальма первенства, неясно.
За это выдающееся достижение Леонид Верещагин с коллегами получили звания и награды, в то время как Трейси Холл ушел из GE, обиженный на критику. Кстати, в 1990-е выяснилось, что один из кристаллов, представленный в статье Холла и соавторов, был не синтетическим, а природным — его использовали как затравку для роста.
Кстати, в 1990-е выяснилось, что один из кристаллов, представленный в статье Холла и соавторов, был не синтетическим, а природным — его использовали как затравку для роста.
Картинка: фазовая диаграмма показывает, при каких условиях графит превращается в алмаз. Это экстремальные для земных недр значения: давления 50-60 тысяч атмосфер, температура более 1000 градусов. Источник: РИА Новости
После того как в мире научились синтезировать мелкие технические алмазы, встал вопрос: а как вырастить крупные кристаллы ювелирного качества? В СССР к этой теме в 1978 году подключили Институт геологии и геофизики СО АН в Новосибирске (теперь — Институт геологии и минералогии).
Алмаз растет в экстремальных условиях при давлении 50-60 тысяч атмосфер и температуре 1400-1500 градусов Цельсия, которые нужно поддерживать часами и сутками. За рубежом для этого используют аппарат Belt с мощным прессом, разработанный тем самым Холлом из GE.
В Новосибирске пошли другим путем: создали беспрессовый аппарат “разрезная сфера”, или БАРС. В его сердцевине — два слоя пуансонов, в том числе из карбида вольфрама, а в них вложена ячейка высокого давления. Туда помещают металлический сплав, графит и затравочный кристаллик алмаза.
Ученые продолжали совершенствовать оборудование, пока наконец в 1990 году группа Юрия Пальянова не синтезировала ювелирные кристаллы весом 1,5 карата. Эти разработки аттестованы за рубежом и признаны во всем мире.
Фото: Многопуансонные аппараты высокого давления “разрезная сфера” (БАРС). Источник: Институт геологии и минералогии им. В.С. Соболева СО РАН/Ю.Н.Пальянов
Выращивать крупные ювелирные алмазы очень сложно и затратно, поэтому они вряд ли в обозримом будущем вытеснят природные. Другое дело — высокотехнологическое применение. Для этого, как выяснилось, природные алмазы недостаточно качественные.
Для этого, как выяснилось, природные алмазы недостаточно качественные.
У алмаза очень подходящие для твердотельной микроэлектроники свойства. Алмаз — это широкозонный полупроводник, устойчивый к высоким температурам, радиации, с теплопроводностью в пять раз больше, чем у меди. Чтобы этим воспользоваться, нужны очень чистые кристаллы высочайшего качества и с заданными свойствами. В природе такие не встречаются: мешают микровключения, примеси других атомов, дефекты кристаллической решетки.
“Речь идет прежде всего о высококачественных монокристаллах. Нужны очень низкая плотность дислокаций и дефектов упаковки, а еще лучше без них, с контролируемым набором дефектно-примесных центров и концентрацией, которые в конечном итоге определяют свойства кристаллов. Есть очень перспективные направления, где нужны алмазы, легированные определенными примесями. Причем некрупные. Таких алмазов нет в природе”, — рассказывает РИА Новости Юрий Пальянов, заведующий лабораторией экспериментальной минералогии и кристаллогенезиса ИГМ СО РАН.

Значит, нужно вырастить. И снова в лидерах — специалисты из Новосибирска. Они научились контролируемо легировать алмаз различными элементами: азотом, бором, фосфором, германием, оловом, никелем, кобальтом, медью и даже самарием, придавая им различные свойства. Эти исследования поддерживает Российский научный фонд.
Картинка: кристаллы алмазов, выращенные с использование различных добавок. Это перспективные элементы для высокотехнологичных приборов. Источник: Институт геологии и минералогии им. В.С. Соболева СО РАН/Ю.Н.Пальянов
Например, если добавить бор в ячейку высокого давления, где растет алмаз, кристалл выйдет синим, а главное, он будет обладать свойствами полупроводника p-типа.
“Полупроводниковые алмазы, легированные фосфором, пока синтезированы только в системе фосфор-углерод. Мы первые получили кристаллы в системе германий-углерод, они содержат германий-вакансионные оптические центры”, — продолжает исследователь.

Для этого создали еще более экстремальные условия: температура 1500-1900 градусов, давление — 70 тысяч атмосфер. Германиевые алмазы интересны как источники одиночных фотонов в кубитах квантовых компьютеров.
Выращенные группой Пальянова алмазы используют как элементы в ИК Фурье-спектрометрах, для рентгеновской оптики, как детекторы ионизирующего излучения, элементы алмазных наковален, в хирургических скальпелях.
Картинка: кристаллик алмаза, легированный германием. Справа — кристаллическая решетка с встроенным атомом германия (красный). Перспективный материал для квантового компьютера. Источник: Институт геологии и минералогии им. В.С. Соболева СО РАН/Ю.Н.Пальянов
В синтезе алмазов — небывалый прогресс. Наверное, ученые выяснили и то, как этот минерал образуется в недрах? Оказывается, единой точки зрения на этот счет нет.
Своеобразным окошком в подземную лабораторию служат кимберлиты — породы, возникшие в результате прорыва глубинного материала в земную кору. Именно они служат источником ювелирных алмазов. Кимберлиты — это карбонатно-силикатная матрица, куда впечатаны куски (ксенолиты) из мантии. Считается, что там образуются алмазы, об этом говорят включения в них глубинных минералов.
“Одно из наших направлений — экспериментальное моделирование процессов образования алмазов в природе. Мы создаем приближенные к естественным карбонатные, карбонат-силикатные, сульфидные расплавы, а также флюиды системы C-O-H-N-S. Это помогает понять механизм образования алмаза в земных недрах. Нам впервые удалось синтезировать алмазы в карбонатных средах при температурах и давлениях, как в природе, и опубликовать это в Nature“, — говорит ученый.
Есть несколько гипотез происхождения алмазов. Скорее всего, кристаллы растут в недрах на разной глубине, из разных расплавов и флюидов.
Скорее всего, кристаллы растут в недрах на разной глубине, из разных расплавов и флюидов.
“За последние десять лет добавилось много информации. Активно изучают сверхглубинные алмазы и в некоторых моделях обосновывают глубину образования до 600 километров. Показано, что с глубины 250 километров мантия становится настолько восстановленной, что в ней может существовать металлическое железо. Поскольку окисленные породы земной коры, в том числе с карбонатами, погружаются в мантию, они способны взаимодействовать с железо-содержащими породами. В 2013 году мы смоделировали такой процесс и получили фабрику разных алмазов. Наиболее вероятный механизм раскрывается в нашей статье в PNAS“, — заключает Юрий Пальянов.
Теги
Науки о Земле
ГДЗ (ответы) Химия 7 класс Григорович А.В. §4 Вещества и их физические свойства » Допомога учням
Другие задания смотри здесь. ..
..
Контрольные вопросы
Вопрос 1 Что означают и чем отличаются термины «физическое тело», «вещество», «материал»? Физическое тело — это предмет, который имеет постоянные массу, форму и объем. Тела состоят из веществ. Вещества или их смеси, которые человек использует для изготовления тел, называют материалами. Часто названия материалов и веществ совпадают.
Вопрос 2 Что понимают под свойствами веществ? Это признаки, по которым различные вещества отличаются друг от друга или сходны между собой. Выделяя главные признаки веществ, мы сможем их описывать, различать и правильно применять.
Вопрос 3 Какие свойства веществ относят к физическим? Цвет, запах, вкус, температура кипения и плавления, плотность, способность проводить электрический ток и теплоту, растворимость в воде, пластичность.
Вопрос 4 В каких агрегатных состояниях может находиться вещество? Охарактеризуйте каждое из них.
В твердом состоянии частички вещества плотно закреплены в определенных положениях, они не могут перемещаться относительно друг друга, а только колеблются вокруг определенного положения, поэтому твердые вещества почти не сжимаются, не могут течь и сохраняют форму.
В жидком состоянии молекулы также расположены плотно, но они более свободны и могут перемещаться относительно друг друга, поэтому жидкие вещества также почти не сжимаются, но могут течь и приобретать форму сосуда, в котором хранятся.
В газообразном состоянии молекулы вещества находятся на значительных расстояниях друг от друга и свободно двигаются, поэтому газообразные вещества легко сжимаются и расширяются и занимают весь объем сосуда, в котором хранятся, приобретая его форму.
Вопрос 5 Назовите процессы изменения агрегатного состояния:
а) из твердого в жидкое — плавление;
б) из жидкого в газообразное — испарение;
в) из твердого в газообразное — возгонка;
г) из жидкого в твердое — крисстализация;
д) из газообразного в жидкое — конденсация.
Задания для усвоения материала
Упражнение 1 Выберите правильное утверждение о воде:
а) жидкость с плотностью 1 г/см3, плохо проводит электрический ток;
б) жидкость с характерным запахом и плотностью 0,9 г/см3;
в) твердое вещество желтого цвета с температурой плавления 0 °С.
Ответ: а)
Упражнение 2 Выпишите отдельно названия веществ и тел:
| Вещества: | Тела: |
|
б) стекло в) вода д) железо ж) алюминий |
а) ножницы г) тетрадь е) ложка
|
Упражнение 3 Чем отличаются:
а) тела одинаковой формы, изготовленные из разных веществ;
Отличаются физическими свойствами.
б) тела разной формы, изготовленные из одного вещества?
Имеют одинаковые физические свойства.
Упражнение 4 Опишите физические свойства алюминия, сахара, поваренной соли по таким же признакам, как в лабораторном опыте. Для ответа воспользуйтесь данными из таблицы Приложения 1.
|
Характеристика вещества |
Алюминий
|
Сахар
|
Поваренная соль |
|
Агрегатное состояние Металлический блеск Цвет Запах Электропроводность Теплопроводность Твердость Растворимость в воде Плотность t0 кипения t0 плавления |
Твердый Нет |
Твердый 1,59 г/см3 |
Твердый Нет |
Упражнение 5 По каким признакам можно распознать железо среди других металлов? Притягивается магнитом.
Упражнение 7 По каким свойствам можно отличить:
а) соль от сахара; По вкусу
б) медь от золота; По цвету
в) песок от железа? По магнитным свойствам железа
Упражнение 8 Заполните таблицу по приведенному образцу, распределив названия тел и соответствующих им веществ и материалов по столбикам:
| Тело | Материал | Вещество |
|
памятник стакан сковорода стул тетрадь авторучка |
бронза стекло чугун дерево бумага пластмасса |
медь и олово
железо целлюлоза целлюлоза
|
Упражнение 9 Назовите типы агрегатных переходов:
а) кубик льда в стакане превратился в жидкую воду; Плавление
б) при высоком давлении воздух становится жидким; Конденсация
в) если кусочек «сухого льда» оставить на воздухе, то через какое-то время он бесследно исчезнет; Возгонка
г) если капля расплавленного металла падает на землю, то она становится твердой; Крисстализация
д) если кожу протереть одеколоном, то в скором времени на ней не останется и следа жидкости. Испарение
Испарение
Упражнение 10 Объясните, на каких свойствах веществ основано их использование:
а) из меди изготавливают электрические провода;
Электропроводность.
б) из золота делают ювелирные украшения;
Цвет, металлический блеск, химическая стойкость.
в) ванилин добавляют в кондитерские изделия;
Запах.
г) из алюминия изготавливают фольгу;
Пластичность.
д) из графита изготавливают стержни для карандашей.
Хрупкость.
Упражнение 11 Объясните, почему гвозди изготавливают из железа, а не из свинца. Свинец ― мягкий металл, легко гнется.
Почему памятники изготавливают из бронзы или гранита, а не из стекла?
Стекло хрупкое.
Упражнение 12* Почему вещества имеют разные свойства? Почему свойства некоторых веществ сходны? Могут ли два вещества иметь одинаковые температуры плавления, одинаковую плотность, одинаковый цвет? Выскажите свои предположения. Каждое вещество имеет свой уникальный набор атомов или молекул, которые определяют все ее свойства. Молекулы различных веществ, не похожи, часто они отличаются очень существенно, так и созданные ими вещества отличаются по свойствам.
Каждое вещество имеет свой уникальный набор атомов или молекул, которые определяют все ее свойства. Молекулы различных веществ, не похожи, часто они отличаются очень существенно, так и созданные ими вещества отличаются по свойствам.
Другие задания смотри здесь…
Сравнение элементов периодической таблицы | Сравните железо и медь
Сравните железо и медь
Сравните железо и медь на основе их свойств, атрибутов и фактов из периодической таблицы. Сравните элементы по более чем 90 свойствам. Все элементы подобных категорий обнаруживают много сходств и различий в своих химических, атомных, физических свойствах и использовании. Эти сходства и различия следует знать, изучая элементы таблицы Менделеева. Вы можете изучить подробное сравнение между железом и медью с наиболее надежной информацией об их свойствах, атрибутах, фактах, использовании и т. д. Вы можете сравнить Fe и Cu более чем по 90 такие свойства, как электроотрицательность, степень окисления, атомные оболочки, орбитальная структура, электросродство, физические состояния, электрическая проводимость и многое другое.
26 Fe Iron
Swap Copper vs Iron
Periodic Table Element Comparison
29 Cu Copper
Facts
| Name | Iron | Copper |
| Atomic Number | 26 | 29 |
| Атомный символ | Fe | Cu |
| Atomic Weight | 55.845 | 63.546 |
| Phase at STP | Solid | Solid |
| Color | Gray | Copper |
| Metallic Classification | Переходный металл | Переходный металл |
| Группа в периодической таблице | группа 8 | группа 11 |
| Название группы | iron family | copper family |
| Period in Periodic Table | period 4 | period 4 |
| Block in Periodic Table | d -block | d -block |
| Electronic Configuration | [Ar] 3d6 4s2 | [Ar] 3d10 4s1 |
| Структура электронной оболочки (количество электронов на оболочку) | 2, 8, 14, 2 | 2, 8, 18, 1 Точка плавления 2 | 1811 K | 1357. 77 K 77 K |
| Boiling Point | 3134 K | 3200 K |
| CAS Number | CAS7439-89-6 | CAS7440-50-8 |
| Neighborhood Elements | Соседние Элементы Железа | Соседние Элементы Меди |
История
| История | Элемент Железо был открыт Неизвестно в 500 году до н.э. Железо получило свое название от английского слова (ferrum на латыни). | Элемент Медь был обнаружен на Ближнем Востоке в 9000 году до нашей эры. Медь получила свое название от английского слова (лат. cuprum). |
| Discovery | Unknown (Before 5000 BCE) | Middle East (9000 BCE) |
| Isolated | Egypt (4000 BCE) | Anatolia (6000 BCE) |
Presence: Abundance in Природа и вокруг нас
Частей на миллиард (ppb) по массе / по атомам (1ppb = 10^-7 %)
| Abundance in Universe | 1100000 / 20000 | 60 / 1 |
| Abundance in Sun | 1000000 / 30000 | 700 / 10 |
| Abundance in Meteorites | 220000000 / 77000000 | 110000 /31000 |
| Изобилие в земной коре | 63000000 /23000000 | 68000 /22000 |
| В океанах | 3 / 0,33 | |
| в океанах | 3 / 0,33 | |
. 0021 0021 | 3 / 0.29 | |
| Abundance in Humans | 60000 / 6700 | 1000 / 99 |
Crystal Structure and Atomic Structure
| Atomic Volume | 7.0923 cm3/mol | 7.124 cm3 /MOL |
| Атомный радиус | 156 PM | 145 PM |
| Ковалентный радиус | 125 PM | 138 PM |
| VAN DER DER LACLIUS | 138 PM | |
| VAN DER LAALS | 138 PM | |
| .0021 | – | 140 pm |
| Atomic Spectrum | ||
| Lattice Constant | 286.65, 286.65, 286.65 pm | 361.49, 361.49, 361.49 pm |
| Lattice Angle | π/2 , π/2, π/2 | π/2, π/2, π/2 |
| Space Group Name | Im_ 3m | Fm_ 3m |
| Space Group Number | 229 | 225 |
| Crystal Structure | Body Centered Cubic | Face Centered Cubic |
Atomic and Orbital Properties
| Atomic Number | 26 | 29 |
| Number of Electrons (with no заряд) | 26 | 29 |
| Количество протонов | 26 | 29 |
| Массовое число | 5.40021 | 63.546 |
| Number of Neutrons | 30 | 35 |
| Shell structure (Electrons per energy level) | 2, 8, 14, 2 | 2, 8, 18, 1 |
| Electron Configuration | [Ar] 3d6 4s2 | [Ar] 3d10 4s1 |
| Valence Electrons | 3d6 4s2 | 3d10 4s1 |
| Oxidation State | 2, 3 | 1, 2 |
| Символ атомного термина (квантовые номера) | 5D4 | 2S1/2 |
| Структура оболочки |
ISOTOPES и ядер 9003
. 40004 -й натуральные натуральные.
Altable. стабильные природные изотопы.
| Known Isotopes | 45Fe, 46Fe, 47Fe, 48Fe, 49Fe, 50Fe, 51Fe, 52Fe, 53Fe, 54Fe, 55Fe, 56Fe, 57Fe, 58Fe, 59Fe, 60Fe, 61Fe, 62Fe, 63Fe, 64Fe, 65Fe , 66Fe, 67Fe, 68Fe, 69Fe, 70fe, 71fe, 72FE | 52CU, 53cu, 54cu, 55cu, 56cu, 57cu, 58cu, 59cu, 60cu, 61cu, 62cu, 63cu, 64cu, 65cu, 66cu, 67cu, 68cu, 69cu, 65cu, 66cu, 67cu, 68cu, 69cu, 71cu, 71cu, 72cu, 72cu, 72cu, 72cu, 72cu, 71cu, 71cu, 71cu, 71cu, 71cu, 71cu, 71cu, 71cu, 71C , 73cu, 74cu, 75cu, 76cu, 77cu, 78cu, 79cu, 80cu |
| стабильные изотопы | . | |
| Нейтронное сечение | 2,56 | 3,78 |
| Neutron Mass Absorption | 0.0015 | 0.0021 |
Chemical Properties: Ionization Energies and electron affinity
| Valence or Valency | 3 | 2 |
| Electronegativity | 1.83 Pauling Scale | 1,9 Шкала Полинга |
| Сродство к электрону | 15,7 кДж/моль | 118,4 кДж/моль |
| Энергии ионизации | 1 -й: 762,5 кДж/моль 2 -е: 1561,9 кДж/моль 3 -е: 2957 кДж/моль 4th: 5290 кДж/моль 5th: 7240 кдж/моль 6: . 7th: 12060 кДж/моль 8th: 14580 кДж/моль 9th: 22540 кДж/моль 10th: 25290 кДж/моль 11 -й: 28000 кДж/моль 12th: 31920 KJ/Mol 13th 13th . : 34830 кДж/моль 14-я: 37840 кДж/моль 15-я: 44100 кДж/моль 16-я: 47206 кДж/моль 17th: 122200 кДж/моль 18th: 131000 кДж/моль 19th: 140500 кДж/моль 20th: 152600 кДж/моль 21 -й: 163000 кДж/моль 22nd: 173600 KJ/MOL 9 23rd: 188100 kJ/mol 24th: 195200 kJ/mol 25th: 851800 kJ/mol 26th: 895161 kJ/mol | 1st: 745. 2nd: 1957.9 kJ/mol 3-я: 3555 кДж/моль 4-я: 5536 кДж/моль 5-я: 7700 кДж/моль 6th: 9900 кДж/моль 7th: 13400 кДж/моль 8th: 16000 кДж/моль 9th: 19200 кДж/моль 10th: 22400 кДж/моль 11th: 25600 кДж/моль 12th 12th. : 35600 кДж/моль 13th: 38700 кДж/моль 14th: 42000 кДж/моль 15th: 46700 кДж/моль 16th: 50200 кДж/моль 17th: 53700 KJ/Mol 18th: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 61100: 53700 кДж/моль . кДж/моль 19-я: 64702 кДж/моль 20-я: 163700 кДж/моль 21-я: 174100 кДж/моль 22 -й: 184900 кДж/моль 23 -й: 198800 кДж/моль 24th: 210500 кДж/моль 25th: 222700 кДж/моль 26th: 239100 кДж/моль 27th: 249660 KJ/MOL 9 999999999999999999999999999999999999999999799. 9 9 9 9 9 9 9 9 9 4 4 4 4 4 4 4 4 4 4 9 28th: 1067358 kJ/mol 29th: 1116105 kJ/mol |
Physical Properties
| Density | 7. 874 g/cm3 874 g/cm3 | 8.92 g/cm3 | |
| Molar Volume | 7.0923 см3/моль | 7,124 см3/моль | |
Elastic Properties | |||
| Young Modulus | 211 | 130 | |
| Shear Modulus | 82 GPa | 48 GPa | |
| Bulk Modulus | 170 GPa | 140 GPa | |
| Коэффициент Пуассона | 0,29 | 0,34 | |
Твердость – испытания для измерения твердости элемента | |||
| 4 MPa | 3 MPa | ||
| Vickers Hardness | 608 MPa | 369 MPa | |
| Brinell Hardness | 490 MPa | 874 MPa | |
Electrical Properties | |||
| Electrical Conductivity | 10000000 С/м | 500 С/м | |
| Устойчивость | 9,7E-8 м ω | 1,7E-8 М | |
СУПЕРКОНДА. 0021 0021 | – | – | |
. K | 0.0000165 /K | ||
Magnetic Properties | |||
| Magnetic Type | Ferromagnetic | Diamagnetic | |
| Curie Point | 1043 K | – | |
| Mass Magnetic Susceptibility | – | -1.08e-9 m3/kg | |
| Molar Magnetic Susceptibility | – | -6.86e-11 m3/mol | |
| Volume Magnetic Susceptibility | – | -0.00000963 | |
Оптические свойства | |||
| Рефрактивный индекс | – | – | |
| – | |||
| Speed of Sound | 4910 m/s | 3570 m/s | |
Thermal Properties – Enthalpies and thermodynamics
| Melting Point | 1811 K | 1357. 77 K 77 K |
| кипящая точка | 3134 K | 3200 K |
| Критическая температура | – | – |
| Суперконкуртирующая точка | – | |
| .0021 | – | |
| . | ||
| Теплота сгорания | – | – |
Нормативно-правовое регулирование и здоровье – Параметры и рекомендации по охране здоровья и безопасности
| CAS7439-89-6 | CAS7440-50-8 | |
| RTECS Number | RTECSNO4565500 | RTECSGL5325000 |
| DOT Hazard Class | 4.1 | 4.1 |
| DOT Numbers | 3089 | 3089 |
| EU Номер | – | – |
| NFPA Пожарный рейтинг | 1 | 1 |
| NFPA Опасности | – | |
NFPA. 0021 0021 | – | |
| NFPA Health Rating | 1 | 1 |
| NFPA Reactivity Rating | 0 | 0 |
| AutoIgnition Point | 100 °C | – |
| Flashpoint | – | – |
Сравнить с другими элементами
Сравнить железо со всеми элементамигруппы 8 0005Compare Iron with allPeriod 4 elementsIron vs GermaniumIron vs NickelIron vs BromineIron vs ScandiumIron vs ArsenicIron vs CobaltIron vs CalciumIron vs ChromiumIron vs SeleniumIron vs KryptonIron vs VanadiumIron vs ZincIron vs PotassiumIron vs TitaniumIron vs ManganeseIron vs CopperIron vs Gallium Compare Iron with allTransition Metal elementsIron vs NickelIron vs RutheniumIron vs RhodiumIron vs ZirconiumIron vs RoentgeniumIron vs DarmstadtiumIron vs DubniumIron vs SeaborgiumIron vs CadmiumIron vs TungstenIron vs ScandiumIron vs TantalumIron vs SilverIron vs RheniumIron vs NiobiumIron vs CobaltIron vs MolybdenumIron vs MercuryIron vs ChromiumIron против железа иттрия против железа иридия против железа хассия против ванадия железа против цинка железа против технеция железа против платины железа против мейтнера железа против коперниция железа против титана железа против марганца железа против железа железа против меди железа против палладия железа против гафния железа против осмия железа против золота железа v s РезерфордийЖелезо против бория | Compare Copper with allGroup 11 elementsCopper vs RoentgeniumCopper vs SilverCopper vs Gold Compare Copper with allPeriod 4 elementsCopper vs GermaniumCopper vs NickelCopper vs BromineCopper vs ScandiumCopper vs ArsenicCopper vs CobaltCopper vs CalciumCopper vs ChromiumCopper vs SeleniumCopper vs KryptonCopper vs VanadiumCopper vs ZincCopper vs PotassiumCopper vs TitaniumCopper vs MarganeseCopper vs IronCopper vs Gallium Compare Copper with allTransition Metal elements Copper vs NickelCopper vs RutheniumCopper vs RhodiumCopper vs ZirconiumCopper vs RoentgeniumCopper vs DarmstadtiumCopper vs DubniumCopper vs SeaborgiumCopper vs CadmiumCopper vs TungstenCopper vs ScandiumCopper vs TantalumCopper vs SilverCopper vs RheniumCopper vs NiobiumCopper vs CobaltCopper vs MolybdenumCopper vs MercuryCopper Медь против хрома, медь, иттрий, медь, иридий, медь, хассий, медь, ванадий, медь, цинк, медь, технеций, медь, платина, медь, мейтнерий, медь, коперниций, медь, титан, медь, марганец, медь, железо, медь, медь, палладий, медь, гафний, медь, осмий, медь, золото, медь, Резерфорд. |
Железо и медь – Сравнение – Свойства
В этой статье сравниваются основные термические и атомные свойства железа и меди, двух сопоставимых химических элементов из периодической таблицы. Он также содержит основные описания и применения обоих элементов. Железо против меди.
Сравните железо с другим элементом
Сравните медь с другим элементом
Железо и медь – об элементах
Железо
Железо — металл первого переходного ряда. По массе это самый распространенный элемент на Земле, образующий большую часть внешнего и внутреннего ядра Земли. Это четвертый по распространенности элемент в земной коре. Его изобилие на скалистых планетах, таких как Земля, связано с его обильным образованием в результате синтеза звезд большой массы.
Медь
Медь — мягкий, ковкий и пластичный металл с очень высокой тепло- и электропроводностью. Свежая открытая поверхность чистой меди имеет красновато-оранжевый цвет. Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах. для измерения температуры.
Медь используется как проводник тепла и электричества, как строительный материал и как составная часть различных металлических сплавов, таких как стерлинговое серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет, и константан, используемый в тензодатчиках и термопарах. для измерения температуры.
Источник: www.luciteria.com
Железо и медь – Применение
Железо
Железо используется во многих отраслях, таких как электроника, производство, автомобилестроение, строительство и строительство. Железо является наиболее широко используемым из всех металлов, на его долю приходится более 90% мирового производства металлов. Его низкая стоимость и высокая прочность часто делают его предпочтительным материалом для противостояния нагрузкам или передачи сил, например, для изготовления машин и станков, рельсов, автомобилей, корпусов кораблей, бетонных арматурных стержней и несущих конструкций зданий. . Поскольку чистое железо довольно мягкое, его чаще всего комбинируют с легирующими элементами для изготовления стали. Стали представляют собой сплавы железа с углеродом, которые могут содержать заметные концентрации других легирующих элементов. Добавление небольшого количества неметаллического углерода к железу меняет его большую пластичность на большую прочность. Из-за своей очень высокой прочности, но все же значительной ударной вязкости, а также способности сильно изменяться при термической обработке сталь является одним из наиболее полезных и распространенных сплавов железа в современном использовании. Существуют тысячи сплавов с различным составом и/или термической обработкой. Механические свойства чувствительны к содержанию углерода, которое обычно составляет менее 1,0 мас.%.
. Поскольку чистое железо довольно мягкое, его чаще всего комбинируют с легирующими элементами для изготовления стали. Стали представляют собой сплавы железа с углеродом, которые могут содержать заметные концентрации других легирующих элементов. Добавление небольшого количества неметаллического углерода к железу меняет его большую пластичность на большую прочность. Из-за своей очень высокой прочности, но все же значительной ударной вязкости, а также способности сильно изменяться при термической обработке сталь является одним из наиболее полезных и распространенных сплавов железа в современном использовании. Существуют тысячи сплавов с различным составом и/или термической обработкой. Механические свойства чувствительны к содержанию углерода, которое обычно составляет менее 1,0 мас.%.
Медь
Исторически сложилось так, что сплав меди с другим металлом, например оловом, для получения бронзы впервые начали практиковать примерно через 4000 лет после открытия выплавки меди и примерно через 2000 лет после того, как «природная бронза» стала широко использоваться. Древняя цивилизация находится в бронзовом веке либо путем производства бронзы путем выплавки собственной меди и сплавления с оловом, мышьяком или другими металлами. Основными областями применения меди являются электрические провода (60%), кровля и водопровод (20%), а также промышленное оборудование (15%). Медь используется в основном в чистом виде, но когда требуется большая твердость, ее вводят в такие сплавы, как латунь и бронза (5% от общего использования). Медь и сплавы на ее основе, включая латуни (Cu-Zn) и бронзы (Cu-Sn), широко используются в различных промышленных и общественных целях. Некоторые из распространенных применений латунных сплавов включают бижутерию, замки, петли, шестерни, подшипники, гильзы для боеприпасов, автомобильные радиаторы, музыкальные инструменты, электронную упаковку и монеты. Бронза или бронзоподобные сплавы и смеси использовались для изготовления монет в течение более длительного периода. до сих пор широко используется для пружин, подшипников, втулок, направляющих подшипников автомобильных трансмиссий и аналогичных фитингов, и особенно распространен в подшипниках небольших электродвигателей.
Древняя цивилизация находится в бронзовом веке либо путем производства бронзы путем выплавки собственной меди и сплавления с оловом, мышьяком или другими металлами. Основными областями применения меди являются электрические провода (60%), кровля и водопровод (20%), а также промышленное оборудование (15%). Медь используется в основном в чистом виде, но когда требуется большая твердость, ее вводят в такие сплавы, как латунь и бронза (5% от общего использования). Медь и сплавы на ее основе, включая латуни (Cu-Zn) и бронзы (Cu-Sn), широко используются в различных промышленных и общественных целях. Некоторые из распространенных применений латунных сплавов включают бижутерию, замки, петли, шестерни, подшипники, гильзы для боеприпасов, автомобильные радиаторы, музыкальные инструменты, электронную упаковку и монеты. Бронза или бронзоподобные сплавы и смеси использовались для изготовления монет в течение более длительного периода. до сих пор широко используется для пружин, подшипников, втулок, направляющих подшипников автомобильных трансмиссий и аналогичных фитингов, и особенно распространен в подшипниках небольших электродвигателей. Латунь и бронза являются распространенными конструкционными материалами в современной архитектуре и в основном используются для кровли и облицовки фасадов из-за их внешнего вида.
Латунь и бронза являются распространенными конструкционными материалами в современной архитектуре и в основном используются для кровли и облицовки фасадов из-за их внешнего вида.
Железо и медь – сравнение в таблице
| Элемент | Железо | Медь |
| Плотность | 7,874 г/см3 | 8,92 г/см3 |
| Предел прочности при растяжении | 540 МПа | 210 МПа |
| Предел текучести | 50 МПа | 33 МПа |
| Модуль упругости Юнга | 211 ГПа | 120 ГПа |
| Шкала Мооса | 4,5 | 3 |
| Твердость по Бринеллю | 490 МПа | 250 МПа |
| Твердость по Виккерсу | 608 МПа | 350 МПа |
| Точка плавления | 1538 °С | 1084,62 °С |
| Точка кипения | 2861 °С | 2562 °С |
| Теплопроводность | 80,2 Вт/мК | 401 Вт/мК |
| Коэффициент теплового расширения | 11,8 мкм/мК | 16,5 мкм/мК |
| Удельная теплоемкость | 0,44 Дж/г К | 0,38 Дж/г К |
| Теплота плавления | 13,8 кДж/моль | 13,05 кДж/моль |
| Теплота испарения | 349,6 кДж/моль | 300,3 кДж/моль |
металлов.
 Общие свойства. Добыча и классификация металлов
Общие свойства. Добыча и классификация металловКогда сформировалась земля, расплавленная масса содержала множество различных металлов, которые сегодня мы извлекаем и используем в огромных количествах. Большинство металлов при расплавлении соединяются с горными породами, образуя металлические руды. Наиболее распространенными из них являются бокситы, из которых добывают алюминий, и железные руды, из которых добывают железо. Сегодня в обрабатывающей промышленности добывается и используется более семидесяти различных металлов. Некоторые из них, например, медь и свинец, можно использовать в чистом виде, чтобы воспользоваться их природными свойствами. Но часто мы комбинируем разные металлы или металл с другими материалами для образования сплавов. Создавая сплавы, мы можем изменять свойства металла в соответствии с нашими конкретными потребностями.
Металлы и сплавы можно использовать по-разному. Они важны для транспорта, телекоммуникаций, машиностроения, строительства и обрабатывающей промышленности.
Общие свойства всех металлов
Физические свойства :
Металлы твердые, нелипкие, холодные и гладкие, очень часто блестящие и прочные. Они также пластичны и податливы, не ломаются легко. Металлы являются очень хорошими проводниками электричества, звука и тепла. При повышении температуры они расширяются, а при понижении всегда сжимаются. Их можно легко сваривать с другими металлами.
Химические свойства :
Металлы реагируют с кислородом в воде и воздухе. Это называется окислением или ржавлением и представляет собой красновато- или желтовато-коричневое чешуйчатое покрытие оксида железа, которое образуется на железе или стали, особенно в присутствии влаги.
Экологические свойства :
Большинство металлов подлежат вторичной переработке, а некоторые металлы, такие как свинец или ртуть, токсичны и представляют опасность для человека и окружающей среды.
Добыча металлов
Существует два типа шахт для добычи металлов:
- Открытая добыча, которая используется, когда минерал находится близко к поверхности.

- Подземная добыча, которая используется, когда минерал находится глубоко под поверхностью.
Для извлечения полезных ископаемых из породы используются экскаваторы, буры, взрывчатые вещества. Полезные ископаемые разделяются на руду и пустую породу.
Классификация металлов
Металлы можно разделить на две основные группы: черные металлы – это те, которые содержат железо, и цветные металлы, которые не содержат железа.
Черные металлы
Чистое железо малопригодно в качестве конструкционного материала, поскольку оно слишком мягкое и пластичное. Когда железо остывает и переходит из жидкого состояния в твердое, большинство атомов в металле упаковываются плотно друг к другу в упорядоченные слои. Некоторые, однако. смещаются, создавая слабые места, называемые дислокациями. Когда кусок железа подвергается нагрузке, слои атомов в этих областях скользят друг по другу, и металл деформируется. Это начинает объяснять пластичность мягкого железа. Однако, добавляя углерод к железу, мы можем производить целый ряд сплавов с совершенно разными свойствами. Мы называем эти углеродистые стали. Сплав представляет собой смесь двух или более химических элементов, а основным элементом является металл.
Это начинает объяснять пластичность мягкого железа. Однако, добавляя углерод к железу, мы можем производить целый ряд сплавов с совершенно разными свойствами. Мы называем эти углеродистые стали. Сплав представляет собой смесь двух или более химических элементов, а основным элементом является металл.
Углеродистые стали: их свойства и применение
Мягкая сталь: содержание углерода от 0,1% до 0,3%. Свойства : менее пластичен, но тверже и прочнее железа, серого цвета, легко подвергается коррозии. Использование : балки или балки, винты, гайки и болты, гвозди, строительные леса, кузова автомобилей, складские помещения, бочки для масла.
Среднеуглеродистая сталь содержит от 0,3% до 0,7% углерода. Свойства : более твердый и менее пластичный, чем мягкая сталь, прочный и обладает высокой прочностью на растяжение. Использование : используется для производства изделий, которые должны быть прочными и износостойкими, таких как шестерни, инструменты, ключи и т. д.
д.
Высокоуглеродистая сталь содержит от 0,7 % до 1,3 % углерода. Свойства : Очень твердый и хрупкий материал. Использование : Используется для режущих инструментов и изделий, которые должны выдерживать износ, таких как гильотина, пружины и т. д.
Нержавеющая сталь – это сплавы железа и хрома. Доступен широкий ассортимент сталей с содержанием хрома от 13% до 27%. Свойства : Хром предотвращает ржавление благодаря оксидной пленке. Пластичность, твердость и прочность на растяжение. Это также блестящий привлекательный металл. Использование : Столовые приборы, раковины, трубы, детали автомобилей и т. д.
Серый чугун представляет собой сплав железа (94%), углерода (3%), кремния (2%) и некоторых следов магния, серы и фосфора. Свойства: хрупкий, но чрезвычайно твердый и стойкий, корродирует из-за ржавчины. Использование: поршни, детали машин, уличные фонари, сливные крышки, инструменты.
Другие химические элементы могут быть добавлены в сталь для улучшения или достижения определенных свойств. Вот несколько примеров:
Вот несколько примеров:
- Кремний делает сплав магнитным и повышает эластичность.
- Марганец делает сплав более твердым и жаростойким. Он используется для изготовления нержавеющей стали.
- Никель повышает прочность и предотвращает коррозию.
- Вольфрам делает сталь более твердой, жаростойкой и предотвращает коррозию.
- Хром делает сплав более твердым и прочным, а также более стойким к ржавчине.
Цветные металлы
Это металлы, не содержащие железа. У них много применений, но они часто дороги, потому что их труднее извлечь.
Алюминий
Это самый распространенный металл в земной коре, после стали он является наиболее широко используемым из всех металлов сегодня. Свойства : Серебристо-белый цвет, легкий, очень устойчивый к коррозии, мягкий, ковкий и пластичный, низкой плотности, хороший проводник как электричества, так и тепла. Использование : высоковольтные линии электропередач, самолеты, автомобили, велосипеды, изделия из легких металлов. кровельные и оконно-дверные блоки, отделка, кухонный инвентарь и банки для питья.
Использование : высоковольтные линии электропередач, самолеты, автомобили, велосипеды, изделия из легких металлов. кровельные и оконно-дверные блоки, отделка, кухонный инвентарь и банки для питья.
Медь
Это чистый металл, который является третьим по важности металлом в мире по объему потребления. Свойства : красновато-коричневый металл, пластичный и умеренно прочный, очень хороший проводник электричества и тепла, очень легко подвергается коррозии. Использование : электрические провода, телефонные линии, цилиндр и трубы для горячей воды для бытовых нужд, сердцевина автомобильного радиатора, украшения, архитектура.
Латунь
Этот термин “ латунь ” охватывает широкий спектр медно-цинковых сплавов. Свойства : Золотого цвета. Обладает очень хорошими антикоррозионными свойствами и устойчив к износу. Использование : Изделия кустарного промысла, ювелирные изделия, сантехника, конденсаторы и турбины.
Магний
Блестящий и серебристо-белый. Свойства : Очень легкий, мягкий и податливый, но не очень пластичный. Очень сильно реагирует с кислородом. Использование : Фейерверки, аэрокосмическая промышленность, автомобильная промышленность.
Олово
Это блестящий белый металл. Свойства : Не окисляется при комнатной температуре, очень мягкий. Применение : Мягкая пайка, оловянная фольга и жесть.
Свинец
Серебристо-серый металл. Свойства : Мягкий и податливый. Он токсичен при вдыхании его паров. Использование : Батареи, используется в качестве добавки к стеклу для придания твердости и веса.
Бронза
Это сплав меди и олова. Свойства : Высокая устойчивость к износу и коррозии. Использование : Лодочные гребные винты, фильтры, церковные колокола, скульптуры, подшипники и шестерни.
Цинк
Голубовато-серый блестящий металл. Свойства : Антикоррозийный, не очень твердый, слабый при низких температурах. Использование : Кровля, сантехника, потому что останавливает коррозию.
Spanish Terms
Lead – plomo
Zinc – cinc
Tin – estaño
Copper – cobre
Bronze – bronce
Brass – latón
Aluminium – aluminio
Magnesium – magnesio
Сталь – acero
Железо – hierro
расплавленное – fundido
Руда – Минерал/Мена
сплав – Aleación
Gangue – Ganga
Ferrous – Ferrrosos
Cool – Enfriar
Слабость – Debilidad
Corrodes – Corroer
. – Debilidad
– Debilidad
– Corroer
. – DEBILIDAD
– CORROER
. – DEBILIDAD
. нержавеющая сталь – неокисляемая
прочность на растяжение – tracción
столовые приборы – cuberteria
труба – tuberia
мойка – fregadero
слив – drenaje
подшипники и шестерни – rodamientos y engranajes
Гребные винты для лодок — helices de barco
блестящие — brillante
Применение железа, меди, алюминия, цинка
Общий список применений всех этих элементов может быть достаточно длинным, чтобы вам стало скучно его читать, поэтому мы его сократим. на несколько разных частей, чтобы учащимся было легче понять важность каждого металла и его использование. Давайте поговорим об использовании цинка; во-первых, цинк используется в процессе гальванизации, в котором железо и стальные стержни погружаются в горячий расплавленный цинк, чтобы покрыть его слоем цинка.
Использование алюминия
Говоря об использовании алюминия, есть один сценарий использования, в котором алюминий не может быть превзойден, и это производство фюзеляжей самолетов. Алюминий — это легкий металл, который легко принимает форму самолета, сохраняя при этом жесткость металла и обеспечивая безопасность пассажиров на высоте более 30 000 футов. С другой стороны, большинство жестяных банок, используемых для хранения продуктов питания и безалкогольных напитков, изготовлены из алюминия. Большинство кухонных принадлежностей, которые вы используете в повседневной жизни для приготовления пищи, также сделаны из алюминия. Основная причина, по которой вся эта разнообразная кухонная утварь изготавливается из алюминия, заключается в его низкой плотности и нетоксичности. Кроме того, теплопроводность довольно высока, и то же самое касается температуры плавления. Таким образом, вы можете без проблем использовать этот элемент на своей кухне.
В чем сходство железа, меди и алюминия
Все эти три элемента являются металлами, но имеют разную молекулярную массу и атомный вес, а также атомный номер. Точно так же все они имеют блеск, и все три являются хорошими проводниками электричества. Все они могут быть использованы для создания кольца благодаря их резонансному свойству. Наконец, все три из них податливы и могут легко ржаветь при контакте с воздухом.
Точно так же все они имеют блеск, и все три являются хорошими проводниками электричества. Все они могут быть использованы для создания кольца благодаря их резонансному свойству. Наконец, все три из них податливы и могут легко ржаветь при контакте с воздухом.
В результате все три из них должны иметь слой покрытия для защиты от ржавчины.
Алюминий Свойства и применение
Алюминий является наиболее распространенным металлом, присутствующим в земной коре, но его трудно найти в несвязанном виде. В процессе добычи мы можем найти его в таких минералах, как бокситы и криолиты. Кроме того, эти минералы, содержащие алюминий, называются алюмосиликатами. Нет сомнений в том, что большинство из нас видели алюминий в своей жизни, поскольку это тот металл, который мы видим повсюду, от наших кухонь до самолетов и мусорных баков.
Алюминий, когда он не окрашен, присутствует в серебристо-белой форме. Это легкий металл, которому можно легко придать любую форму и размер в зависимости от требований, и он остается в этой форме все остальное время. Температура плавления алюминия составляет 660 градусов по Цельсию. В результате емкости из алюминия нецелесообразно ставить в микроволновую печь. С другой стороны, говоря о температуре кипения, элемент начнет кипеть при 2519 градусах Цельсия.
Температура плавления алюминия составляет 660 градусов по Цельсию. В результате емкости из алюминия нецелесообразно ставить в микроволновую печь. С другой стороны, говоря о температуре кипения, элемент начнет кипеть при 2519 градусах Цельсия.
Для чего нужен алюминий?
Мы можем быстро разработать 10 способов использования меди, так как она присутствует в таком большом количестве и имеет различные применения. Но наиболее важным преимуществом меди является электрооборудование, например, проводка электрических компонентов и обмотки двигателя. Еще одно применение алюминия — изготовление монет. Это обычно встречается по всему миру. В результате его стоимость невелика, и он используется для изготовления монет и других скульптур. В бронзе также содержится медь, что позволяет ей быстро затвердевать. Проводимость как тепла, так и электричества делает его идеальным для проводов, передающих электричество и сигналы. Это были основные области применения алюминия.
Интересные факты о меди, алюминии и цинке
Основные области применения алюминия, а также меди и цинка описаны ниже.
Во-первых, медь используется в качестве защиты от молнии, поскольку она является хорошим проводником электричества. Он берет молнию с вершины здания и толкает ее вниз к земле.
Кроме того, алюминий — единственный металл, который не ржавеет и весит втрое меньше стали.
Аналогичным образом, цинк обладает свойством самовосстановления, так как его покрытие жертвует собой, подвергаясь гальванической реакции для защиты стали, на которую оно нанесено.
Это были некоторые из применений железа, меди, алюминия и цинка.
Основные элементы: железо, медь и цинк
Железо, медь, алюминий и цинк являются основными элементами при изучении химии. Эти важные элементы вводятся на уроках химии гораздо раньше в школах. Однако их свойства и характеристики в основном изучаются у металлов и неметаллов VIII класса, главы 3. Эта глава предписывается Центральным советом среднего образования и поэтому имеет значительный вес на экзамене.
Эти важные элементы вводятся на уроках химии гораздо раньше в школах. Однако их свойства и характеристики в основном изучаются у металлов и неметаллов VIII класса, главы 3. Эта глава предписывается Центральным советом среднего образования и поэтому имеет значительный вес на экзамене.
Существуют различные типы элементов, а медь, цинк и железо относятся к категории элементов блока D. Эти элементы находятся в третьей группе до 12-й группы современной таблицы Менделеева. Элементы D-блока также называют переходными элементами или переходными металлами. Алюминиевый элемент относится к категории P-блочных элементов. Это те элементы, у которых последний электрон находится на P-орбиталях. Эти элементы находятся в группах 13, 14, 15, 16 и 17, за исключением гелия.
Атомный номер меди 29, атомный номер цинка 30, атомный номер железа 26 и атомный номер алюминия 13. Железо, цинк, медь и алюминий подпадают под категорию металлов и, следовательно, являются проводниками электричества от умеренных до хороших. Они обладают различными физическими и химическими свойствами, и все они чрезвычайно полезны в промышленных и бытовых областях.
Они обладают различными физическими и химическими свойствами, и все они чрезвычайно полезны в промышленных и бытовых областях.
Основные понятия, необходимые для лучшего понимания этих элементов:
Физические свойства металлов и неметаллов
Химические свойства металлов
Что происходит, когда металлы сжигают на воздухе?
Что происходит, когда металлы реагируют с водой?
Что происходит, когда металлы реагируют с кислотами?
Как металлы реагируют с растворами солей других металлов?
Серия «Реактивность»
Как реагируют металлы и неметаллы?
Properties of Ionic Compounds
Occurrence of Metals
Extraction of Metals
Enrichment of Ores
Extracting Metals Low in the Activity Series
Extracting Metals in the Middle of Серия мероприятий
Извлечение металлов к началу серии мероприятий
Очистка металлов
Электролитическое рафинирование
Коррозия
Предотвращение коррозии
Каковы свойства и применение меди?
Вслед за статьей о железе, опубликованной в прошлом месяце, следующий выпуск серии «Металлы и их свойства» будет посвящен меди. Хотя ранее мы немного говорили об этом металле в нашей статье «Различные металлы и их свойства», теперь мы рассматриваем его более подробно.
Хотя ранее мы немного говорили об этом металле в нашей статье «Различные металлы и их свойства», теперь мы рассматриваем его более подробно.
Как и в случае с железом, знание всех свойств меди может помочь вам понять, можно ли ее переработать. Как эксперты по переработке металлолома, мы стремимся предоставить точную и полезную информацию о черных и цветных металлах, которые могут помочь вам получить более глубокое понимание мира переработки!
Что такое медь?Как химический элемент, медь представлена символом Cu в периодической таблице и имеет атомный номер 29. Как металл, медь пластична и пластична и ценится за ее высокую тепло- и электропроводность. Медь встречается в природе, но ее самый большой источник находится в таких минералах, как халькопирит и борнит, и вы можете легко идентифицировать ее по красновато-золотому цвету.
Медь производится массивными звездами, ее также можно найти в коре нашей планеты. Самая большая масса найденной меди весила впечатляющие 420 тонн!
Этот элемент также является ключевой частью анатомии человека и животных. У людей медь обычно содержится в печени, мышцах и костях, при этом значения 1,4 мг и 2,1 мг меди на килограмм веса находятся в пределах нормальных параметров.
У людей медь обычно содержится в печени, мышцах и костях, при этом значения 1,4 мг и 2,1 мг меди на килограмм веса находятся в пределах нормальных параметров.
Название этого металла происходит от древнеанглийского «coper», которое, в свою очередь, происходит от латинского «Cyprium aes», что означает «металл с Кипра».
Медь восходит к доисторическим временам, поскольку она была известна некоторым из древнейших цивилизаций мира. Считается, что это был первый металл, который начали обрабатывать люди (самое раннее его использование около 9 г.000 г. до н.э.), так как его можно найти в относительно чистых формах — это означает, что этот металл не обязательно нужно извлекать из руды.
Исторически медь также использовалась в качестве пигмента, поскольку было известно, что она придает синий или зеленый цвет таким минералам, как азурит и малахит.
Этот металл первым был выплавлен из руды (около 5000 г. до н.э.), первым был отлит в форму с помощью формы (около 4000 г. до н.э.) и первым был сплавлен с оловом для получения бронзы (около 3500 г. до н.э.). ).
до н.э.) и первым был сплавлен с оловом для получения бронзы (около 3500 г. до н.э.). ).
Медь обладает множеством свойств, которые делают ее необходимой для современной металлургии и очень полезной в различных отраслях промышленности и секторах. К числу наиболее востребованных свойств меди и ее сплавов относятся следующие:
- Патина – зеленый слой медного купороса, образующийся на поверхности металла в результате коррозии; однако этот слой является защитным и предотвращает дальнейшее разрушение металла.
- Стойкость к коррозии – этот металл очень устойчив к коррозии, а медные сплавы были обнаружены в почти идеальном состоянии после тысячелетнего захоронения.
- Пластичность и пластичность – с медью легко работать, в основном при изготовлении и соединении.
- Антибактериальный – соединения меди используются в качестве бактериостатических средств и фунгицидов, а также в качестве консервантов для древесины.
 Гигиенические свойства этого металла делают его полезным для замедления роста бактерий, таких как кишечная палочка, легионелла и MRSA.
Гигиенические свойства этого металла делают его полезным для замедления роста бактерий, таких как кишечная палочка, легионелла и MRSA. - Прочность – одним из важнейших механических свойств меди является прочность. Медь — прочный металл, как и ее сплавы, поскольку они не разрушаются и не становятся хрупкими при воздействии температур ниже 0 o
- Немагнитный – это цветной металл, что делает его пригодным, например, для военных целей.
- Легко легировать – еще одним свойством, которое делает медь столь востребованной, является ее способность легко сплавляться с другими металлами, такими как цинк, олово и никель.
- Проводимость – медь является отличным электрическим и тепловым проводником, поэтому ее часто используют для электропроводки.
Одним из интересных фактов о меди является то, что, как упоминалось выше, ее можно сплавлять с различными типами металлов. Следующий список ни в коем случае не является исчерпывающим, вместо этого он фокусируется на некоторых из наиболее часто используемых сплавов:
Следующий список ни в коем случае не является исчерпывающим, вместо этого он фокусируется на некоторых из наиболее часто используемых сплавов:
Бронза – образуется при сплаве меди с небольшим1120 олова , открытие этого нового металла привело к началу так называемого бронзового века.
Латунь – при сплаве меди с цинком получается латунь, которая обычно имеет желтый цвет и используется для широкого спектра применений, например, для изготовления музыкальных инструментов.
Мельхиор – образуется при сплаве меди с никелем , который создает более прочный металл, используемый, среди прочего, для производства монет, скобяных изделий, морской техники и вооружений.
Стерлинговое серебро – широко используется в ювелирных изделиях, серебро образуется при добавлении других металлов, таких как медь, к серебру .
Таким образом, существует множество применений медных сплавов, от повседневных предметов до промышленных применений, таких как оружие.
Медь имеет широкий спектр применения.
Поскольку этот металл очень хорошо проводит тепло и электричество, он используется в электрическом оборудовании, таком как проводка, разъемы и двигатели. Медь также часто используется в строительстве (например, в сантехнике) и в промышленном оборудовании.
Его также можно найти в гребных винтах лодок, днищах кастрюль, резервуарах для воды, полах с подогревом, автомобильных радиаторах, телевизорах, компьютерах и многом другом. Антибактериальные свойства меди и ее сплавов делают их невероятно полезными для приготовления пищи, сантехнических систем, дверных ручек и больниц. Сульфат меди можно найти в сельском хозяйстве как яд и альгицид при очистке воды.
Медь, латунь или бронза также могут использоваться для украшения, например, украшений, статуй и частей зданий (например, кровли).
Переработка меди Мы твердо верим в то, что вносим свой вклад в защиту окружающей среды, и это также относится к переработке меди. В конце концов, если нам не придется, например, добывать, очищать или производить медь, воздействие на окружающую среду будет меньше. И одна из замечательных особенностей этого металла заключается в том, что его можно перерабатывать без потери качества и производительности, а это означает, что его можно легко использовать для других целей.
В конце концов, если нам не придется, например, добывать, очищать или производить медь, воздействие на окружающую среду будет меньше. И одна из замечательных особенностей этого металла заключается в том, что его можно перерабатывать без потери качества и производительности, а это означает, что его можно легко использовать для других целей.
Спрос Европы на медь все больше и больше удовлетворяется за счет вторичной переработки. Считается, что 41,5% меди, используемой в Европе, приходится на переработку, что является хорошей новостью, учитывая, что мировой спрос на этот металл сейчас выше, чем когда-либо.
В 2011 году было повторно использовано 2,1 миллиона тонн меди, и, поскольку мы все больше зависим от нее (для наших компьютеров, солнечных систем, двигателей, электропроводки и т. д.), у ее переработки нет недостатков! Даже энергия, используемая для извлечения меди, будет снижена, что, в свою очередь, приведет к уменьшению выбросов таких газов, как CO 2 , в атмосферу.
Применение меди делает ее востребованным металлом во многих отраслях промышленности. В Morecambe Metals мы считаем, что знание свойств металлов может помочь вам узнать больше о материалах, которые вы используете в своей отрасли или проектах. Поскольку наше общество становится все более экологически сознательным, крайне важно сосредоточиться на устойчивых способах использования металла, таких как переработка.
Чтобы узнать больше об этой или любых других наших услугах, не стесняйтесь обращаться к нам или звонить по телефону 01524 69191. Вы также можете следить за нами на Facebook и LinkedIn, чтобы быть в курсе наших последних новостей.
Факты, символы, свойства, соединения, применение
Факты о меди
Медь представляет собой химический элемент или красновато-коричневый переходный металл группы 11 или IB периодической таблицы с символом Cu и атомным номером 29 , Это мягкий, прочный и блестящий металл с высокой тепло- и электропроводностью. Медь помогает в образовании гемоглобина (переносчика кислорода) в организме животного.
Медь помогает в образовании гемоглобина (переносчика кислорода) в организме животного.
Металл образует гранецентрированную кубическую кристаллическую решетку. Он встречается в нашей среде в виде свободного металлического состояния или легко извлекаемых руд.
Бронза, сплав меди и олова, используется человечеством в истории с бронзового века. Медь содержится в гемоцианине в крови каракатиц и таких растениях, как зеленый горошек.
Кто открыл медь?
Археологическое открытие острова, а именно Кипра в восточной части Средиземного моря, славится своими медными рудниками. Название меди происходит от латинского названия Cuprum через Cyprium.
Свойства меди
В химии физические и химические свойства монет или благородных металлов, таких как Cu, Ag и Au, очень похожи.
| Медь | |||
| Химический символ | Медь | ||
| Дискавери | Историческая эпоха | ||
| Название производное от | Староанглийское слово coper и латинское слово Cyprium aes, означающее металл с Кипра | ||
| Основной изотоп | 29 Медь 63 | ||
| Степени окисления | +1 и +2 | ||
| Номер CAS | 7440-50-8 | ||
| Периодические свойства | |||
| Атомный номер | 29 | ||
| Атомный вес | 63,546 | ||
| Электрон на оболочку | 2, 8, 18, 1 | ||
| Электронная конфигурация | [Ar] 3d 10 4s 1 | ||
| Группа | 11 | ||
| Период | 4 | ||
| Блок | крестовина | ||
| Физические свойства | |||
| Состояние при 20 °C | Твердый | ||
| Место встречи | 1084,6 °С | ||
| Точка кипения | 2560 °С | ||
| Плотность | 8,95 г/см 3 | ||
| Молярная теплоемкость | 24,440 Дж моль -1 К -1 | ||
| Кристаллическая структура | гранецентрированная кубическая (ГЦК) | ||
| Удельное электрическое сопротивление | 16,78 нОм·м | ||
| Атомные свойства | |||
| Атомный радиус (несвязанный) | 1,96 Å | ||
| Ковалентный радиус | 1,22 Å | ||
| Электроотрицательность | 1,90 (шкала Полинга) | ||
| Сродство к электрону | 119,16 кДж моль −1 | ||
| Энергии ионизации (кДж моль −1 ) | 1-й | 2-й | 3-й |
| 745,48 | 1957,92 | 3554. 61 61 | |
Медь в таблице Менделеева
Валютный металл, медь, серебро и золото помещаются в группу-11 или группу-1B периодической таблицы.
Все эти металлы содержат электронную конфигурацию валентной оболочки ns 1 (n−1)d 10 с заполненной подоболочкой d. Из-за наличия не полностью заполненной d-подоболочки в степени окисления +2 или +3 они называются переходными металлами.
Химические свойства
В ранней менделеевской чеканке периодической таблицы такие металлы, как Cu, Ag и Au, помещаются рядом с щелочными металлами. И щелочной металл, и металл для денег или монет имеют один электрон на самой внешней s-орбитали, а +1 является обычной степенью окисления или состоянием.
Физические и химические свойства этих двух семейств сильно различаются. Щелочные металлы представляют собой мягкие низкоплавкие высокоэлектроположительные элементы, в то время как чеканные или благородные металлы представляют собой относительно тугоплавкие и сравнительно менее электроположительные металлы. Поэтому монетные металлы помещены в группу 11 современной периодической таблицы.
Поэтому монетные металлы помещены в группу 11 современной периодической таблицы.
Металлы 11 группы имеют высокую энергию первой ионизации и меньшие ионные радиусы. Участие d-электронов в металлической связи влияет на более высокую температуру плавления меди.
Ион Cu(II) более стабилен, чем ион Cu(I) в водном растворе. Это связано с небольшим размером и, следовательно, чрезвычайно высокой энергией гидратации Cu (II) по сравнению с Cu (I), которая компенсирует вторую энергию ионизации меди.
Где добывают медь?
Медь присутствует в земной коре в количестве 68 частей на миллион, что немного меньше, чем у никеля.
Самородная медь (минералы базальтовых листьев) и восстановленная форма соединений металлов, таких как сульфиды, карбонаты, арсениды и хлориды, встречаются в различных местах мира.
В основном встречается в Северной и Южной Америке, Чили (ведущий мировой производитель), Конго и российских округах. В Индии два основных месторождения медной руды находятся в Бихаре (Сингбхум) и Раджастхане (Алвар, Аджмер и Кхетри).
Медные руды
Основные руды металла указаны ниже в таблице,
| Медная руда | Химическая формула |
| Халькопирит | CuFeS 2 |
| Куприт | Медь 2 О |
| Ковеллит | CuS |
| Халькоцит | Медь 2 С |
| Малахит | [CuCO 3 , Cu(OH) 2 ] |
| Борнит | 2 Cu 2 S, CuS, FeS |
| Дигенит | Медь 9 Ю 5 |
| Диоптаза | CuSiO 2 (ОН) 2 |
Процесс извлечения меди
Медь извлекается в основном из сульфидной руды в процессе самовосстановления. Низкое качество (0,5 процента меди) превращается в высокое качество (15-20 процентов меди) для высокой производительности металла. Для этого используется процесс пенной флотации.
Для этого используется процесс пенной флотации.
Основными стадиями извлечения меди являются,
Плавка меди
Руда обжигается и плавится (около 1400 °С) с добавлением кремнезема в отражательной печи. FeS предпочтительно окисляется до Cu 2 S из-за более основных свойств железа.
Оксид железа образует заготовку с кремнеземом. Расплавленная масса отделяется для формирования верхнего слоя. Нижний слой содержит медный штейн (Cu 2 S и FeS).
Самовосстановление
- Расплавленный штейн дополнительно окисляется воздухом для окисления оставшегося железа.
- Добавляется больше кремнезема, который образует шлак, содержащий оксид железа.
- После удаления шлака сульфид металла окисляется воздухом с образованием Cu 2 O, который в сочетании с оставшейся частью Cu 2 S образует медь путем самовосстановления.
Cu 2 S + 2 Cu 2 O → 6 Cu + SO 2
Рафинирование меди электролизом
Неочищенный металл очищают электролизом в ванне с подкисленным раствором сульфата с использованием сырой меди в качестве анода и чистой меди в качестве катода. Примеси из анода используются для извлечения золота, серебра и платины.
Примеси из анода используются для извлечения золота, серебра и платины.
Химические соединения
В состояниях +1 или +2 медь образует различные типы оксидов, гидроксидов, галогенидов, сульфатов, карбонатов, нитратов и комплексных соединений.
Степень окисления меди
Степень Cu (II) является основной степенью окисления металлической меди с конфигурацией d 9 . Cu (I) имеет замкнутую конфигурацию 3d 10 и сильно стабилизируется по обменной энергии.
Твердые соединения в состоянии +1 термодинамически стабильны при умеренной температуре. Следовательно, Cu 2 O образуется при высоких температурах из CuO, а CuBr 2 разлагается при нагревании с образованием CuBr.
Большое количество химических соединений образуется в состояниях +1 и +2 металлической меди.
Cu (III) является изоэлектронным с никелем (II), но в этом состоянии известно лишь несколько соединений.
Оксиды меди
Оксиды меди существуют в двух формах: черный оксид меди (CuO) и красный оксид меди (Cu 2 O) со степенями окисления +2 и +1 соответственно.
- Оксид черного цвета (CuO) образуется при нагревании Cu с кислородом. Термическое разложение карбоната, нитрата или гидроксида — лучший способ получения оксида меди.
- Красный оксид Cu (I) или оксид меди (Cu 2 O) образуется при восстановлении щелочных растворов Cu (II) мягкими восстановителями, такими как глюкоза. Встречается в природе в виде куприта и используется для изготовления рубинового стекла.
Гидроксид меди (II)
Синий осадок гидроксида меди (II) получают добавлением щелочи к водному раствору Cu(II). Осадок темнеет при стоянии из-за дегидратации гидроксида до оксида. Он растворяется в щелочи с образованием [Cu(OH) 4 ] −2 .
В растворе аммиака образует темно-синий цвет [Cu(NH 3 ) 4 (H 2 O) 2 ] +2 . Темно-синий раствор называется реактивом Швейцера. Он используется для растворения целлюлозы и изготовления купраммониевой вискозы.
Галогениды меди
Только белый фторид, желтый хлорид и черный бромид известны в степени окисления +2. Благодаря восстановительным свойствам йод восстанавливает CuI 2 с образованием Cu 2 I 2 .
Гидратированные галогениды получают растворением CuCO 3 или Cu(OH) 2 в галогеноводородах. CuF плохо охарактеризован.
Другие галогениды Cu (I) представляют собой бесцветные твердые вещества, нерастворимые в воде. Хлорид меди получают восстановлением меди (II) металлической медью или диоксидом серы в соляной кислоте.
Сульфат и нитрат
Сульфат меди (CuSO 4 , 5H 2 O) получают растворением металлолома в разбавленной серной кислоте в присутствии воздуха и кристаллизацией.
Нитрат получают в виде темно-синего расплывающегося кристаллического твердого вещества Cu(NO 3 ) 3 , 3H 2 O под действием азотной кислоты в растворе Cu(II).
Соединения меди (III)
Из-за большего размера и более высокого значения суммы первой, второй и третьей энергии ионизации Cu (III) образует несколько химических соединений.
Простых образцов галогенидов нет, но бледно-зеленый K 3 CuF 6 может быть получен действием фтора в смеси хлорида калия и CuCl 2 при 250 °С.
Твердое соединение купрата (III), подобное KCuO 2 , образуется при нагревании смеси CuO с супероксидом щелочного металла в присутствии молекулы кислорода.
Использование меди
- Медь является хорошим проводником электричества и широко используется в производстве проводов, кабелей, генераторов, трансформаторов, двигателей и любого другого электрического оборудования.
- Также используется для изготовления посуды, трубок и денежных монет.
- Медные сплавы, такие как латунь, бронза, константан, манганин и монал, широко используются в различных бытовых и промышленных целях благодаря их высокой механической прочности и коррозионной стойкости.

Использование медных сплавов
Латунь представляет собой сплав меди. Его получают путем сплавления меди с цинком и другими металлами, такими как алюминий, никель и свинец.
Как правило, он содержит от 57 до 97 процентов меди, а остальную часть составляет цинк или другие металлы, которые изменяют механическую прочность и химические свойства.
Латунь в основном используется в бытовом оборудовании, статуях, судовых гребных винтах и подшипниках.
| Медный сплав | |
| Сплав | Состав |
| Латунь | 70 % Cu и 30 % Zn |
| Металл Muntz | 60 % Cu и 40 % Zn |
| Дельта-металл | 55 % Cu, 40 % Zn и 5 % Fe |
Дельта-металл твердый как сталь и устойчив к морской воде. Используется для изготовления корабельных гребных винтов и подшипников.

