Силумин википедия: HTTP status 402 – payment required, требуется оплата
alexxlab | 29.05.1986 | 0 | Разное
8. 2. Литейные сплавы на основе алюминия. Материалы для ювелирных изделий
8. 2. Литейные сплавы на основе алюминия
Некоторые ювелирные изделия, такие как предметы быта, курительные наборы, столовые приборы, оружейные накладки, элементы перьевых и шариковых ручек, а также бижутерия, поверхность которых анодируется или обрабатывается катодно-импульсной бомбардировкой (под золото), выполняются методом литья из алюминиево-кремниевых сплавов (силуминов) с высокими литейными свойствами.
Согласно диаграмме состояния системы Al – Si (рис. 8.3) кремний не образует с алюминием химических соединений и присутствует в сплавах алюминия в элементарном виде. Но по своим физическим свойствам кремний близок к химическим соединениям, он обладает высокой твердостью (HRC 106) и так же, как и они, хрупок.
Несмотря на заметную и переменную растворимость, кремний не придает алюминию способность к упрочнению термической обработкой, что связано с неблагоприятным характером распада твердого раствора кремния в алюминии. Растворяясь в алюминии, кремний несколько упрочняет его, незначительно снижая при этом пластические свойства. Алюминиевый сплав, содержащий даже 10–12 % Si, остается достаточно пластичным.
Растворяясь в алюминии, кремний несколько упрочняет его, незначительно снижая при этом пластические свойства. Алюминиевый сплав, содержащий даже 10–12 % Si, остается достаточно пластичным.
Рис. 8.3. Диаграмма состояния системы AI – Si.
Силумины подразделяют на двойные (или простые), легированные только кремнием, и специальные, в которых помимо кремния содержатся в небольшом количестве другие легирующие компоненты (Mg, Си, Mn, Ni). Силумины относятся к числу эвтектических или доэвтектических сплавов. Без учета влияния других компонентов (кроме Si) их структура представляет собой либо эвтектику ? + Si (АЛ2), либо первичные кристаллы ? + эвтектика ? + Si (АЛ4, АЛ9, АЛБ).
Кремний имеет переменную растворимость в алюминии, которая возрастает от <0,1 % при комнатной температуре до 1,65 % при эвтектической температуре (577 °C). Поэтому нагревом алюминиево-кремниевых сплавов до температуры, близкой к эвтектической, и быстрым охлаждением можно получить пересыщенный твердый раствор кремния в алюминии, который при последующем старении распадается с выделением дисперсных частиц кремния.
Единственный способ несколько повысить их прочность и пластичность – измельчение эвтектических кристаллов кремния, которое может быть достигнуто двумя путями: 1) увеличением скорости охлаждения при кристаллизации, 2) введением в сплавы малых добавок (сотые доли процента) щелочных металлов (натрия, лития, стронция). Первый путь дает хорошие результаты. Однако он находит ограниченное применение в изготовлении тонкостенных ювелирных отливок с мелкими деталями рельефа, которые могут не залиться при литье в металлический кокиль или при литье под давлением. Второй путь – модифицирование структуры силуминов малыми добавками – более универсален. Модифицированием структуры обычно называют изменение, улучшение структуры при введении малых добавок не вследствие образования каких-либо новых структурных составляющих, а в результате влияния этих добавок на величину и форму структурных составляющих, образованных другими компонентами.
На практике широко применяют модифицирование силуминов натрием или смесью его солей (60 % NaF + 25 % NaCl + 15 % Na3AlF6 или 40 % NaF + 45 % NaCl + 15 % NagAlF6 и др.), которые одновременно используют в качестве рафинирующих флюсов).
Рис. 8.4. Структура эвтектического силумина (11,7 % Si): а – сплав не модифицирован: б – сплав модифицирован натрием.Введение 0,01 % Na в сплавы Al – Si приводит к резкому измельчению кристаллов эвтектического кремния, поскольку присутствующий в расплаве натрий при кристаллизации адсорбируется на поверхности кристаллов кремния и препятствует их дальнейшему росту.
Присутствие натрия в силуминах вызывает, кроме того, сдвиг эвтектической точки в сторону более высоких концентраций кремния, поэтому эвтектические и заэвтектические до модифицирования сплавы после модифицирования становятся доэвтектическими, и в них вместо кремния появляются дендриты ?-твердого раствора, которые при кристаллизации становятся ведущей фазой. На рис. 8.4 показаны структуры немодифицированного и модифицированного силумина с 11,7 % кремния.
8.4 показаны структуры немодифицированного и модифицированного силумина с 11,7 % кремния.
На рис. 8.5 показано влияние способа охлаждения при кристаллизации и модифицирования натрием на механические свойства двойных алюминиево-кремнистых сплавов.
Рис. 8.5. Механические свойства сплавов AI – Si в зависимости от содержания кремния:
1 – сплав модифицированный литье в землю, 2 – сплав немодифицированный, литье в землю, 3 – сплав немодифицированный, литье в кокиль.Для ювелирного литья применяют сплав АЛ2. Плотность эвтектического силумина АЛ2 составляет 2,66 г/см3. Он имеет высокую коррозионную стойкость в воздушной атмосфере, включая атмосферу морского воздуха. Небольшие добавки марганца и магния дополнительно повышают коррозионную стойкость. Высокие литейные свойства силуминов определяют их хорошую свариваемость, что важно при сборке ювелирных изделий. Термически не-упрочняемый эвтектический силумин АЛ2 имеет высокую пластичность, но невысокие прочностные характеристики. Существенное преимущество сплава АЛ2 – малый интервал кристаллизации (близкий к нулю), поэтому в отливках не образуется усадочной пористости, что очень важно при доводочных операциях – шлифовке и полировке ювелирных отливок, так как при механической обработке усадочная пористость вскрывается и ухудшает поверхность изделия. В ювелирном литье указанные дефекты не допускаются.
Небольшие добавки марганца и магния дополнительно повышают коррозионную стойкость. Высокие литейные свойства силуминов определяют их хорошую свариваемость, что важно при сборке ювелирных изделий. Термически не-упрочняемый эвтектический силумин АЛ2 имеет высокую пластичность, но невысокие прочностные характеристики. Существенное преимущество сплава АЛ2 – малый интервал кристаллизации (близкий к нулю), поэтому в отливках не образуется усадочной пористости, что очень важно при доводочных операциях – шлифовке и полировке ювелирных отливок, так как при механической обработке усадочная пористость вскрывается и ухудшает поверхность изделия. В ювелирном литье указанные дефекты не допускаются.
В художественном литье образование концентрированных усадочных раковин (что характерно для сплавов с малым интервалом кристаллизации) вызывает трудности при отливке средних и сложных по конфигурации отливок. В этом случае применяют упрочняемый термообработкой сплав АЛ4, который по сравнению со сплавом АЛ2 имеет значительно меньшую концентрированную усадочную раковину, что важно при отливке барельефов, скульптур и пр.
Состав алюминиевых литейных сплавов, применяемых в ювелирном и художественном литье
Сплавы второй группы имеют низкую линейную усадку (1–1,4 %), высокую жидкотекучесть ?50—420 мм) и нулевую склонность к образованию горячих трещин. Сплавы хорошо обрабатываются резанием, хорошо шлифуются и полируются.
Технология анодирования сплавов на основе алюминия следующая. Алюминиевую отливку с хорошо подготовленной поверхностью (обезжиренной, шлифованной и полированной) и свинцовый катод помещают в охлаждаемую ванну с раствором серной кислоты (плотность 200–300 г/л). Процесс протекает при плотностях тока 10–50 мА на 1 см2 отливки (требуемое напряжение источника до 50—100 В). Температура электролита – до +20 °C. Образующаяся при повышенных температурах окисная пленка бесцветная, что позволяет окрашивать ее любыми красителями. При пониженных температурах пленка окрашивается в золотистый цвет (под золото).
В электродуговом методе, получившем название конденсация ионной бомбардировкой (КИБ), используется вакуумная камера, в которой размещен катод (рис. 8.6). В результате приложенного напряжения между корпусом камеры и катодом возникает электрическая дуга. Из катодного пятна вылетают ионы, электроны и нейтральные частицы.
Рис 8.6. Схема нанесения покрытий методом КИБ:
1 – катод; 2 – нейтральные частицы; 3 – электроны; 4 – ионы; 5 – отливка.Широкое распространение получили покрытия из нитрида титана, которые удачно имитируют позолоту. Причем, регулируя параметры процесса, можно добиться полного сходства с золотом различных проб. Такие покрытия отличаются прочным сцеплением с материалом изделия и высокой износостойкостью. При нанесении покрытий методом КИБ предъявляются очень жесткие требования к качеству поверхности изделий: на ней не должно быть загрязнений, таких как ржавчина, масло и другие неметаллические материалы.
Данный текст является ознакомительным фрагментом.
Установки электролиза алюминия
Установки электролиза алюминия Вопрос. Какие конструкции в корпусах установки электролиза должны иметь электрическую изоляцию?Ответ. Должны иметь металлические перекрытия поперечных каналов токопроводов, а на участках между смежными электролизерами эти перекрытия
Установки электролитического рафинирования алюминия
Легче алюминия и прочнее стали
Легче алюминия и прочнее стали
Исследование свойств различных композиционных материалов показало, что не только по прочности, но и по другим физико-механическим свойствам они превосходят каждый компонент, входящий в их состав. Созданы композиционные материалы,
Созданы композиционные материалы,
13.4.1.1. Биологические датчики на основе нанопроволок
13.4.1.1. Биологические датчики на основе нанопроволок Известно, что электрический заряд многих биомолекул (включая белки и ДНК) меняется в зависимости от их функционального состояния, что может быть использовано для их детектирования специально спроектированными
Покрытия из драгоценных металлов, алюминия, люстровых красок
Покрытия из драгоценных металлов, алюминия, люстровых красок Существует несколько способов нанесения драгоценных металлов на стекло. Широко известен прием наклеивания на холодную поверхность стекла листочков сусального золота, но у него имеется существенный
5.1. Литейные свойства
5.1. Литейные свойства
Литейные свойства двух– и трехкомпонентных сплавов можно оценить по положению их на диаграмме состояния. Закономерности изменения литейных свойств определяются при построении кривых состав – литейное свойство в совокупности с диаграммой
Закономерности изменения литейных свойств определяются при построении кривых состав – литейное свойство в совокупности с диаграммой
7. Сплавы на основе меди
7. Сплавы на основе меди Медь – элемент первой группы периодической системы, атомная масса – 63,54, порядковый номер – 29, температура плавления – 1083 °C, кипения – 2360 °C. Она имеет кубическую гранецентрированную решетку с параметром а = 0,361 нм (3,61 ?). Плотность – 8,93 г/см2.
7.4. Сплавы меди, имитирующие золотые и серебряные сплавы
7.4. Сплавы меди, имитирующие золотые и серебряные сплавы С целью удешевления художественных изделий при производстве недорогих украшений широко используются томпак, латунь, мельхиор, нейзильбер; при изготовлении художественных изделий – бронзы.Сплавы меди с цинком,
8.
 Сплавы на основе алюминия
Сплавы на основе алюминия8. Сплавы на основе алюминия Алюминиевые сплавы классифицируют по технологии изготовления (деформируемые и литейные), способности к термической обработке (упрочняемые и неупрочнямые) и свойствам (рис. 8.1). Рис. 8.1. Диаграмма состояния алюминий – легирующий элемент
8.1. Деформируемые сплавы на основе алюминия
8.1. Деформируемые сплавы на основе алюминия К сплавам, не упрочняемым термической обработкой, относятся сплавы АМц и АМг (табл. 8.1).Сплавы отличаются высокой пластичностью, хорошей свариваемостью и высокой коррозионной стойкостью.Сплавы АМц относятся к системе Al – Мп
9. Сплавы на основе цинка
9. Сплавы на основе цинка
Цинк широко используют для изготовления бижутерии. Застежки, молнии, пуговицы, элементы недорогих бус, декоративные накладки на подарочные папки и ружья, личные украшения (цепочки), ювелирные шкатулки и т. п. выполняются из цинковых сплавов. В
п. выполняются из цинковых сплавов. В
4.13.6. Отделка алюминия
4.13.6. Отделка алюминия Этот металл обладает множеством достоинств, благодаря которым его охотно применяют мастера декоративного искусства. Он легок, мягок, пластичен, имеет красивый серебристый цвет. Но алюминий с трудом поддается химической обработке. Существующие ныне
44. Алюминий; влияние примесей на свойства алюминия; деформируемые и литейные алюминиевые сплавы
44. Алюминий; влияние примесей на свойства алюминия; деформируемые и литейные алюминиевые сплавы Алюминий отличают низкая плотность, высокие тепло– и электропроводность, хорошая коррозийная стойкость во многих средах за счет образования на поверхности металла плотной
неуместная находка | Страница 2
vilgeforce
- #21
Насчет “зачем” – все просто. Силумин делать. Там, кажись, процентов 40 кремния по массе. А силумин много где юзают. Еще, кажется, в качестве раскислителей для стали. Применений много, причем именно технического кремния.
Силумин делать. Там, кажись, процентов 40 кремния по массе. А силумин много где юзают. Еще, кажется, в качестве раскислителей для стали. Применений много, причем именно технического кремния.
lord_of_disgust
- #22
силумины содержат до 26% кремния, верно…
и очень сильно используются в авиастроении
- #23
Для раскисления в черной металлургии используют ферросилиций,вот его и посмотреть
силумины- сплавы алюминия с цинком, кремния там %5-7,
Baron
- #24
Значитца так. Графитовых дуг токосъёмников для пантографов не существует. Сотрёт мгновенно, вспомните блин, “Сопротивление материалов”, чему, блин, сейчас в институтах учат… Щётки не стирает потому, что скользят они по отполированному коллектору, смазанному, к тому же, графитовой пылью… Прямоугольные угольные бруски на желдорпутях могли быть чем угодно, но пожалуй, не щётками с электровозов и тепловозов (у тепловозов электропередача, там дизель непосредственно колёса не крутит). Потому как чинят движки с разборкой только в депо, да при капиталке, вскрытие движков – это вообще вещь редкая…
Графитовых дуг токосъёмников для пантографов не существует. Сотрёт мгновенно, вспомните блин, “Сопротивление материалов”, чему, блин, сейчас в институтах учат… Щётки не стирает потому, что скользят они по отполированному коллектору, смазанному, к тому же, графитовой пылью… Прямоугольные угольные бруски на желдорпутях могли быть чем угодно, но пожалуй, не щётками с электровозов и тепловозов (у тепловозов электропередача, там дизель непосредственно колёса не крутит). Потому как чинят движки с разборкой только в депо, да при капиталке, вскрытие движков – это вообще вещь редкая…
Elektronik
- #25
>>Значитца так. Графитовых дуг токосъёмников для пантографов не существует
Графитовых дуг токосъёмников для пантографов не существует
Друг, а может тебе такой токосъёмник домой принести? Графитовый, в полном сборе?
Там на металлической раме стоят ГРАФИТОВЫЕ пластины ;D
З.Ы.
Природнвй кремний:
vilgeforce
- #26
Pedro написал(а):
Для раскисления в черной металлургии используют ферросилиций,вот его и посмотреть
силумины- сплавы алюминия с цинком, кремния там %5-7,Нажмите для раскрытия…
Может, и ферросилиций, точно уж не помню. Но в силумине кремния побольше, правда, разные источники по разному указывают. Wikipedia говорит, что до 22%. Но, по внешнему виду что-то не очень похож.
Но в силумине кремния побольше, правда, разные источники по разному указывают. Wikipedia говорит, что до 22%. Но, по внешнему виду что-то не очень похож.
Jimmy
- #27
Возможное место их назначения. Список хим предприятий http://www.all-chemical.ru/%D1%85%D0%B8%D0%BC%D0%B8%D1%8F_m5r22c747_5662.htm
http://www.citi-group.ru/
http://www.o-metals.ru/%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB_m5r22c794_5280.htm ( вазможно то же самое что и в 1 ссылке)
computer
- #28
Elektronik написал(а):
>>Значитца так.
Графитовых дуг токосъёмников для пантографов не существует
Друг, а может тебе такой токосъёмник домой принести? Графитовый, в полном сборе?
Там на металлической раме стоят ГРАФИТОВЫЕ пластины ;DНажмите для раскрытия…
Elektronik, респект! Кстати про кусок графита на жд путях- это операция ОМП!=)))
lord_of_disgust
- #29
в силумине содержится до 26% Si и еще куча компонентов… вот.
кстати на фото изображен похожий камушек, но не такой как у нас. .. что то здесь не то.. скажите кто-нибудь, а природный кремний
.. что то здесь не то.. скажите кто-нибудь, а природный кремний
??? хорошо обрабатывается,
??? насколько он хрупок…
??? и царапает ли стекло?
Sauron
- #30
по фотке очень похоже на чистый кремний
“…темно-серое, почти черное твердое вещество с металлическим блеском. типичный полупроводник. облдает большой твердостью.химически стоек.”
Калининградский ПАДОНАК
- #31
lord_of_disgust написал(а):
да.
. забыл добавить…
все ето происходит в калининградской области…Нажмите для раскрытия…
Млин, я тож из Кёнига , и недалеко от сортировки живу. Да, на путях там всякая байда валялась, в тч и камешки странные, на руду похожие. Тож собирал когда то.
А по поводу перевозки чего то стрёмного – так кто ж будет через две границы стрёмный груз вести, если тока морем его к нам привозят и жд транспортом до потребителя доставляют. Хотя дорого, рентабельнее использовать авто транспорт от порта, учитывая протяжённость области 300 км.
BookMaster
- #32
вот вам онлайн определитель минералов – и в бой http://www. kubera.narod.ru/kluch/1-10.htm
kubera.narod.ru/kluch/1-10.htm
а вот тут http://www.debryansk.ru/~tfizik/kluch/main.htm как собственно им пользоваться
lord_of_disgust
- #33
прошлой ночью мило беседовал с человеком из мексики и его сестрой по скайпу
под утро я им решил показать свою галлерею на gallery.kanet.ru , где я разместил фотографии имеющихся образцов… все хорошо было, пока он не увидел эти образцы…
сказал что знает, что это… и сразу слинял)
:-\в определителе нет этого… думаю обсуждение продолжается)
Последнее редактирование:
swoop
- #34
оо. ..уже камушек завесой тайны окутывает…
..уже камушек завесой тайны окутывает…
это кусок фошысцкого…кремния который ешё в 1945 на подлодке..
в амазонку доставили….
lord_of_disgust
- #35
Ахахаха.
Поликристаллический кремний.
Сырье для производства монокристаллического кремния и пекоторых конечных продуктов полупроводниковой промышленности.
Правда в калининграде такого производства нет.
saiLor
- #36
Ты все эти годы его изучал чтоли?
Боди KingArms vs G&P
Red_Light
перемещено из AirSoft – Обзоры, Впечатления
Поломалась любимая игрушка…
В связи с образованием трещин после падения привода в тушке от GP (трещина в правом ухе и в серьге) хочу поменять это боди на кингармовское. Качество исполнения GP меня как-то не порадовало – не прочностью а литьём:
– щель между рессиверами
– люфт “серьги” между “цшами”..
Это было изначально а после появления трещин тока усилилось.
Отсюда вытекающие вопросы –
1. бокс от GP нормально встанет в боди от КА? Так-же интересна установка классик-армейского гира.
2. высота планок на флэт-топе и рисе одинакова у GP и KA? Вопрос вытекает из сравнения рессиверов CA и GP – классикармейский выше и рис на фронтсете не совпадает по высоте с планкой рессивера(не критично, но раздражает)
3. Фронтсер от G&P нормально встанет в тушку от KA? Фронт – SAM-R – свободновывешенный ствол и рис. Взаимозаменяемость фурнитуры так-же интересна.
4. Прочность боди кингармс. Я так понял, что они алюминиевые – должны быть прочнее, чем силуминовые GP и CA.
5. Если есть более достойные на ваш взгляд варианты – поделитесь пожалуйста! Критерии отбора простые – нужна тушка-флэттоп, хорошего качества и высокой прочности. По геометрии схожая с GP(см п.2,3)
Исходная тушка GP была такая –
http://www.wgcshop.com/wgc2008/main/product_detail1.php?search_From=category&item=GP-MB-183&search=special&rs=Metal%20Bodies
после падения дала трещину правое ухо нижнего рессивера и появилась продольная трещина серьги верхнего. Щель между рессиверами стала совсем некрасивой и боди стало люфтить.
Тушка от кингармс видится такой
http://redwolfairsoft.com/redwolf/airsoft/ProductDetail?prodID=23737
Заранее спасибо! Надеюсь на дельные советы)
Red_Light
прошу модератора перенести в ветку AirSoft – промахнулся случайно((((
перемещено из AirSoft – Обзоры, Впечатления
Red_Light
Господа кастомизаторы – неужели никто с тушками кингармс не сталкивался??? Или все ответы на столько очевидны, что вопрос сам по себе излишен?…)
Eros
Сталкивался. Насчет алюминия – оч. сильно сомневаюсь. Алюминиевый сплав, пожалуй. По прочности сказать не могу, но не думаю. что шибко прочнее СА и ГиП.
Все перетрубации внутренностей возможны, насчет разности высот флэттопа не знаю.
Red_Light
спасибо Eros! Хоть немного инфы…
Eros
Вот забыл написать: боди КА легче боди ГиП, причем существенно.
Red_Light
хм…
вопрос тогда – а алюминий ведь легче, чем силумин, так?
Red_Light
вопрос снят. .
.
познавательная минута гугловеденья дала результат
Алюминий – Википедия
Плотность: 2698,9 кг/м3 2,6989 г/см3
с другого сайта
Плотность большинства силуминов. 2650 кг/м-меньше плотности чистого алюминия (2700 кг/м% Они хорошо свариваются. Хорошо обрабатываются резанием только силумины, легированные медью.
Дюралюминий – Википедия
Фирменное название дюра́ль (DuralR) в русском языке стало по преимуществу разговорным и профессионально-жаргонным.
Плотность сплава 2500-2800 кг/м³
понятно что того, что называется силумином, как и алюминием много разновидностей, но судя по найденным данным силумины сильно тяжелее алюминия быть не могут. Скорее будет наоборот. А вот дюраль может быть значительно легче алюминия и силумина. Может-ли так быть, что кингармовская тушка сработана из дюрали?…
Seifer39
Госпадиии… все тушки это силумин, из люминя тока фрезированые JP от мадбула и верхний ВЛТОРовский ресивер от дайтака. Остальное это литьё, силумин.
Остальное это литьё, силумин.
Red_Light
G&P Troy Type (MUR) Aluminum Upper and Lower Receiver for Marui M4 / M16 Series AEG (Sand)
Constructed via Aluminum Die-Casting, the Troy Type metal receiver by G&P is extremely rugged and features exceedingly smooth line
два раза в описании фигуляет слово люминий. Врут и не краснеют…
http://redwolfairsoft.com/redwolf/airsoft/ProductDetail?prodID=27848
или у буржуевъ понятия “люминь” и “си-люминь” слились воедино?….
Seifer39
Силумин это алюминиевый сплав 😊
Red_Light
да, конечно! но алюминий и алюминиевый сплав – это не одно и то-же. Написано – Aluminum Upper and Lower Receiver…
собсна, это не выражение желания поспорить, или доказать что-либо. Просто констатация факта – написано алюминий, на деле – силумин. ..
..
Памятник 49 коммунарам — Википедия
Памятник 49 коммунарам — памятник в Ленинском районе Севастополя в сквере у южного входа на кладбище Коммунаров, выше братской могилы. Памяти 49 большевиков подпольщиков и участников революционного движения в Севастополе — жертвам белогвардейского террора[3]. Открыт 22 ноября 1937 года.
Содержание
Show / HideАрхитектура
Создан по проекту архитектора М. А. Садовского, скульпторов Л. С. Смерчинского (барельефы на пилоне), С. С. Карташева[4]. Представляет собой массивный призматический пилон из балаклавского розового мраморовидного известняка, установленный на трёхступенчатом пьедестале. На лицевой стороне укреплена мраморная доска с именами 49 погибших подпольщиков. На пилоне — надпись-посвящение и барельефы из силумина на темы революции и Гражданской войны. Общая высота — 6,5 м[4].
Является объектом культурного наследия народов РФ регионального значения.
Список 49 коммунаров
Мраморная доска с именами 49 коммунаров
Список содержит фамилии и инициалы 49 коммунаров, расстрелянных Вооружёнными силами Юга России в Крыму в 1919—1920-х годах, в том виде, в каком они указаны на памятной доске.
| Расстреляны 24 января 1920 года (9 чел.) | Расстреляны 12 марта 1920 года (11 чел.) | Расстреляны 5 мая 1920 года (5 чел.) | Расстреляны 26 — 27 июня 1920 года (7 чел.) | Расстреляны 24 июля 1920 года (3 чел.) | Расстреляны в разное время (14 чел.) |
|---|---|---|---|---|---|
| Макаров В. В. Бунаков А. Н. Севастьянов И. А. Шулькина Л. Х. Киянченко М. С. Ашевский И. И. Вайнблат И. М. Иоффе М. З. Ключников (Крючков) С. С. | Шестаков (Крылов) Н. Губаренко И. Авдеев Н. Гинзбург (Кибург) Федан Н. Гитин Я. Гевлич К. Петров Ф. Гинзбург М. Глоголев С. Клепин Наливайко И. | Торговицкий Р. Лакота К. Кряжев Ф. Синчук П. Рябов (Цветков) Я. | Айзенштейн Е. И. Цыганков В. П. Юртаев Д. Я. Мезин П. А. Левченко Х.  З. З.Румянцев А. И. Голубев (Храмцев) | Старосельский Г. Мишко Г. Свентицкий Е. | Сигель Л. Петрова П. Садовский И. Параскева С. Томашевский И. Джепаридзе В. Дроздов И. Леви В. Рябоконь В. Нежука В. Яценко А. Гуляев К. Колокольников А. Мурзак Ф. |
Литература
- Каменная летопись Севастополя / В. Г. Шавшин. — Севастополь-Киев: ДС-Стрим, 2004. — 128 с. — ISBN 966-96305-1-7.
- Смутное время: Севастополь в 1917—1920 годах / Е. Б. Алтабаева. — Севастополь: Телескоп, 2004. — 384 с. — ISBN 966-96413-2-2.
Примечания
- ↑ Данный географический объект расположен на территории Крымского полуострова, бо́льшая часть которого является объектом территориальных разногласий между Россией, контролирующей спорную территорию, и Украиной, в пределах признанных большинством государств — членов ООН границ которой спорная территория находится. Согласно федеративному устройству России, на спорной территории Крыма располагаются субъекты Российской Федерации — Республика Крым и город федерального значения Севастополь.
 Согласно административному делению Украины, на спорной территории Крыма располагаются регионы Украины — Автономная Республика Крым и город со специальным статусом Севастополь.
Согласно административному делению Украины, на спорной территории Крыма располагаются регионы Украины — Автономная Республика Крым и город со специальным статусом Севастополь. - ↑ 1 2 http://www.memento-sevastopol.ru/objects/153.html
- ↑ Согласно надписи-посвящению, установленной на пилоне памятника.
- ↑ 1 2 Крымский виртуальный некрополь. Кладбище Коммунаров, Севастополь, пл. Восставших. Сорок девять большевиков подпольщиков и участников революционного движения в Севастополе (1920) Коммунаров (неопр.). Дата обращения: 6 января 2021. Архивировано 7 января 2021 года.
Если не указано иное, содержание доступно по лицензии CC BY-SA 3.0. Images, videos and audio are available under their respective licenses.
This article uses material from the Wikipedia article Памятник 49 коммунарам, which is released under the Creative Commons Attribution-ShareAlike 3. 0 license (“CC BY-SA 3.0”); additional terms may apply. (view authors).
0 license (“CC BY-SA 3.0”); additional terms may apply. (view authors).
🌐 Wiki languages: 1,000,000+ articlesEnglishРусскийDeutschItalianoPortuguês日本語Français中文العربيةEspañol한국어NederlandsSvenskaPolskiУкраїнськаTiếng Việt
🔥 Top trends keywords Русский Wiki:
Заглавная страницаВоенно-учётная специальностьГруппа ВагнераСноуден, ЭдвардСлужебная:ПоискВторжение России на Украину (2022)Мобилизация в России (2022)ИжевскКатегории годности к военной службеПригожин, Евгений ВикторовичРоссияYouTubeМелони, ДжорджаВоенное положение в РоссииNASAMSПутин, Владимир ВладимировичВКонтактеСоединённые Штаты АмерикиМассовое убийство в школе «Колумбайн»Дом ДраконаПотери сторон в период вторжения России на УкраинуРежим контртеррористической операцииДагестанУткин, Дмитрий ВалерьевичМассовое убийство в гимназии № 175Залужный, Валерий ФёдоровичВоенное положениеВооружённые силы Российской ФедерацииM142 HIMARSУкраинаХ-59Список стран по численности вооружённых сил и военизированных формированийЖуравко, Алексей ВалерьевичДамер, ДжеффриРоссийско-украинская войнаБратья ИталииАтомные бомбардировки Хиросимы и НагасакиМоскваТактическое ядерное оружиеМобилизацияСписок умерших в 2022 годуВторая чеченская войнаПатрушев, Дмитрий НиколаевичПускепалис, Сергей ВитаутоГерасимов, Валерий ВасильевичVK (компания)Санкт-ПетербургНАТОЗеленский, Владимир АлександровичПервая чеченская войнаЕлизавета IIТяжёлая огнемётная системаПервая мировая войнаКонтрнаступление в Харьковской области (2022)Организация Договора о коллективной безопасностиВооружённый конфликт в Донбассе (апрель 2014 — февраль 2022)Рош ха-ШанаМассовое убийство в школе № 88Ядерное оружиеСтрелков, Игорь ИвановичКазахстанНаселение ЛатвииРусский языкНаселение РоссииЯндексЯдерный клубПатрушев, Николай Платонович26 сентябряGoogle (компания)Пушкин, Александр СергеевичПоджоги военкоматов в России (2022)Референдумы о присоединении к России оккупированных территорий Украины (2022)RobloxРадио «Свобода»2021 годБерлускони, СильвиоВоздвижение Креста ГосподняСубъекты Российской ФедерацииАфганская война (1979—1989)🡆 More
Related topics
Афганский казан – зачем он нужен и как в нем готовить
Афганские казаны появились на нашем рынке сравнительно недавно, но практически сразу стали пользоваться большой популярностью. Как и следовало ожидать, первыми интерес к необычной посудине проявили мужчины. И это были не только охотники, путешественники и любители пикников на природе. Городские жители, ценители вкусной и полезной еды, тоже довольно быстро заметили достоинства новой кухонной утвари. А их у афганского котелка, который еще называют афганказан, немало.
Как и следовало ожидать, первыми интерес к необычной посудине проявили мужчины. И это были не только охотники, путешественники и любители пикников на природе. Городские жители, ценители вкусной и полезной еды, тоже довольно быстро заметили достоинства новой кухонной утвари. А их у афганского котелка, который еще называют афганказан, немало.
Блюда в афганском казане получаются томлеными, быстро готовятся. Даже самые жесткие виды мяса и кости диких животных тушатся в нем до мягкости за считанные минуты. Фактически афганский казан – это ничто иное, как хорошо всем нам знакомая скороварка. Только круглой, обтекаемой формы, да стенки, как самого котелка так и его крышки, значительно толще, чем у кастрюли скороварки.
Предусмотренные конструкцией клапана для стравливания лишнего пара, ручка на крышке, винт и прижимная планка – все это роднит афганский котелок с кастрюлей скороваркой. Однако еда в нем получается намного вкуснее и ароматнее, что приближает его к узбекскому казану.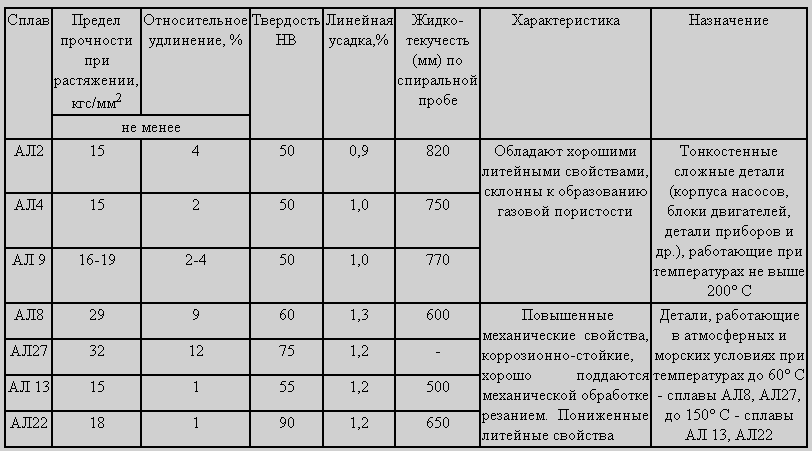
Афганский казан удобно брать с собой на природу, потому что в нем можно готовить еду на костре. Правда, нужно будет учесть один момент: время от времени котелок придется сдвигать с открытого огня, давая остыть и выйти лишнему пару. Для этой цели в походных условиях используют плоский камень или просто сдвигают котелок на траву.
Удобно готовить в нем и на любых плитах в кухне обычной квартиры. Что значительно проще, Чем на костре, ведь в любой момент можно уменьшить, выключить и вновь зажечь огонь под котелком.
Ни готовка на костре, ни тем более приготовление еды на кухне не доставляют особых хлопот. Ведь чтобы мясо в афганском казане протушилось до полной готовности требуется всего минут 20, редко 30. Таким образом, налицо экономия времени и энергии на готовку пищи для всей семьи.
Внимание! Продуктами и жидкостью афганский казан заполняется не более чем на две трети объема, чтобы оставалось место для пара. Таким образом – афганказан объемом 5 литров позволит приготовить супа или тушеного блюда в количестве 3 литра и не более.
Если вы решили купить афганский казан, то правильно подготовить его к первому использованию просто необходимо.
Во-первых, это нужно, чтобы он служил долго-долго и достался вашим детям, а то и внукам.
Во-вторых, важно вычистить его от промышленных масел и смазки.
В-третьих, полезно обжечь афганский котелок с маслом, чтобы пища в нем не пригорала.
Как подготовить афганский казан к первому использованию
Новый афганский казан нужно предварительно собрать, прикрутив все детали к крышке согласно приложенной инструкции.
1. Ручку приворачиваем на место.
2. Все клапана для стравливания пара одеваем на отводные трубки таким образом, чтобы они свободно двигались вверх-вниз и кругом. Их предназначение – стравливать лишний пар через крохотные отверстия. Если пар не будет свободно выходить из котелка при кипении, может случится большая неприятность: крышку сорвет. Фактически в наших руках мини- паровой котел с давлением пара в одну-две атмосферы. Поверьте, даже 1 кг давления пара на квадратный сантиметр поверхности – это большая разрушительная сила. Поэтому убедитесь, что ничто не мешает клапанам вращаться и подниматься-опускаться. Кроме того, посмотрите, чтобы отверстия для стравливания пара ничем не забились. Это можно сделать обычной швейной иглой.
Поверьте, даже 1 кг давления пара на квадратный сантиметр поверхности – это большая разрушительная сила. Поэтому убедитесь, что ничто не мешает клапанам вращаться и подниматься-опускаться. Кроме того, посмотрите, чтобы отверстия для стравливания пара ничем не забились. Это можно сделать обычной швейной иглой.
3. Клапана для стравливания пара должны крутиться вокруг своей оси и иметь свободный ход верх-вниз в пределах проточенной канавки на отводных трубках. Эту проточку отлично видно на трубочках крышки.
4. Предохранительный клапан уже вмонтирован в крышку котелка и его трогать не надо. Он сработает, если клапана для стравливания пара по какой-то причине не сработали и давление пара внутри котелка стало критическим. В этом случае плавкая вставка расплавиться и пар беспрепятственно выйдет из закрытого казана наружу. Так обеспечивается техника безопасности при неправильной эксплуатации или в непредвиденных случаях.
Первым делом моем котелок и крышку моющим раствором и губкой изнутри и снаружи.
Наполняем котелок водой на две трети объема и ставим на огонь. После того как, клапана начнут стравливать пар, кипятим на медленном огне еще 20 минут.
Снимаем афганский котелок с огня или просто выключаем газ и ждем, когда вода в нем остынет. В это время пар выходит из клапанов, пока внутри совсем не прекратиться кипение.
Можно ускорить процесс стравливания пара, осторожно приподняв один из клапанов. Однако следует иметь в виду, что вы сами и ваша рука должна находится в некотором отдалении от выхода пара, чтобы избежать ожогов. В качестве подручного инструмента можно использовать ложку, вилку, нож или деревянную палочку. Стоит чуть приподнять ими клапан, как выход пара ускорится, пар быстрее покинет внутренность котелка и крышку можно будет легко открыть и слить кипяток.
Внимание! До тех пор, пока весь пар не выйдет из афганского казана, нельзя пытаться поднять крышку. Она крепко держится внутренним давлением и силовые попытки ее отодрать, приведут к несчастному случаю. Дождитесь, пока пар не перестанет выходить через клапана, открутите винт и крышка сама легко поднимется.
Дождитесь, пока пар не перестанет выходить через клапана, открутите винт и крышка сама легко поднимется.
Поскольку афганский казан не чугунный, а алюминиевый, то есть сделан не из такого пористого металла, как чугун, процесс обжига с маслом можно пропустить.
Но, поскольку производитель рекомендует, поступаем следующим образом:
1. Внутрь котелка наливаем небольшое количество любого растительного масла (Для примера – на 5 литровый казан вполне достаточно 100 грамм).
2. Закладываем пару сырых луковиц, нарезанных кубиками или полукольцами.
3. Кипятим минут 10. Снимаем с огня и покатаем по столу наш афганский казан таким образом, чтобы, пожаренный и пропитанный растительным маслом, лук коснулся всей внутренней поверхности котелка, включая самый его верх.
4. После того, как пар вышел, открываем крышку и выбрасываем отработавший свое маслянно-жареный лук. Он выполнил свою задачу, помог обработать стенки нового котелка и в пищу не годен.
5. Протираем сухой салфеткой внутреннюю поверхность от лишнего масла и вуаля! Наш новый афганский казан готов к долгой и верной службе.
Какие блюда можно готовить в афганском казане
Поскольку афганский котелок только с виду экзотический и необычный, фактически это обычная кастрюля, только с толстыми стенками и обтекаемыми боками. А значит готовить в ней можно все привычные нам блюда: плов, супы, каши, овощи, мясо, птицу.
По такому же принципу изготавливаются чугунки для русской печи. Обтекаемая форма дает пламени облизывать посудину со всех сторон равномерно. Пар, образующийся внутри емкости, быстро и мягко подвергает продукты тепловой обработке. За очень небольшое время все ингредиенты успевают пропитаться внутренними соками и ароматами, достичь мягкости и сохранить сочность.
Принцип готовки один: все подготовленные продукты загружают в афганский казан одновременно, в соответствии с рецептурой и ставят на огонь на указанное время.
Все, что вы готовите дома на каждый день или на праздничный стол – все то же самое можно приготовить в афганском котелке, кроме, пожалуй, десертов и выпечки. Даже компот из сухофруктов на несколько минут станет вкусным, ароматным и сохранит максимум полезности.
Вам не нужно думать, где купить афганский казан в Москве, Санкт-Петербурге или в России с доставкой. Вы сможете посетить раздел нашего интернет магазина и выбрать казан того объема, который удовлетворит потребностям вашей семьи.
Наш консультант ответит на все ваши вопросы, в том числе и сколько афганский казан стоит за штуку и сколько в него в реальности входит литров.
Жесткая вода и накипь. Структура, свойства и способы минимизации ущерба (Steanlab Review) / Хабр
Что остается делать темными зимними вечерами в самоизоляции кроме как не перечитывать старые подшивки советских журналов. В зависимости от специализации, у кого-то это журнал Квант, у кого-то Техника Молодежи. В моем случае, из-за профессиональной деформации, подходит только «Химия и жизнь». И вот в одном из номеров этого журнала я натолкнулся на душераздирающее письмо читателя (КДПВ — это оно). И подумал, а ведь действительно, сколько вроде бы не написано на различных сайтах и сайтиках про известковый налет от жесткой воды, а все так же он появляется то в увлажнителях воздуха, то в бойлерах, то даже в радиаторе автомобиля. И все также люди начинают искать ответы, пробуя все подряд рекомендации. Проблема есть (если уж даже Китай тратит 0,2% ВВП страны на борьбу с накипью,
В моем случае, из-за профессиональной деформации, подходит только «Химия и жизнь». И вот в одном из номеров этого журнала я натолкнулся на душераздирающее письмо читателя (КДПВ — это оно). И подумал, а ведь действительно, сколько вроде бы не написано на различных сайтах и сайтиках про известковый налет от жесткой воды, а все так же он появляется то в увлажнителях воздуха, то в бойлерах, то даже в радиаторе автомобиля. И все также люди начинают искать ответы, пробуя все подряд рекомендации. Проблема есть (если уж даже Китай тратит 0,2% ВВП страны на борьбу с накипью,
). А если есть проблема, попробуем решить, вложить, используя терминологию читателя ХиЖ «средства в борьбу». Под катом — про жесткую воду, накипь и множество явлений (чаще негативных) которые с этим всем связаны.
Пояснения по тексту. Лонгрид, по сути, компиляция из ранее опубликованных на Patreon заметок, которыми я на протяжении недель терроризировал читателей своего телеграм-канала LAB66, привыкших только к коронавирусным темам.Поэтому встречающейся иногда ссылкой вида [Canonical link] я указываю на заметку, которая была ранее опубликована как отрывок из хабра-черновика.
Для того, чтобы было понятно, почему к.т.н. Л.В. Данилов так волнуется за накипь, в спойлер я спрячу картинку с описанием проблем, к которым накипь может привести и приводит (возможно, кто-то до сих пор с такими проблемами не встречался). Список — далеко не исчерпывающий.
Краткий перечень проблем, связанных с известковыми отложениями из-за жесткой воды
Большинство описанного применимо к быту рядового жителя абсолютно любой из стран (и на Сицилии такие проблемы можно встретить, и в микрорайоне Гомеля). Хотя проблема замечательно масштабируется и на промышленные предприятия (проблемы с трубопроводами/котлами/арматурой на ТЭС и ТЭЦ), на автотранспорт (радиаторы системы охлаждения двигателя, стеклоомыватели и их арматура), на системы увлажнения и кондиционирования воздуха, на водоподводящее оборудование ферм и теплиц.
Так что не зря, ох не зря волновался советский инженер в 70-х годах… Со многими из его выводов, я, кстати, полностью согласен (например, по поводу включения пункта по борьбе с накипью в инструкцию к электроприборам):
К.т.н Л.В. Данилов про накипь full
журнал Химия и жизнь, №7 за 1973 год, рубрика «Из писем в редакцию» Л.В.Данилов. Снимайте накипь — экономьте энергию! с. 88
Важное обращение! Если вдруг сам к.т.н. Л.В. Данилов, или его дети/внуки/правнуки вдруг прочитают эту статью — пожалуйста, свяжитесь со мной. Если ваше дедушка/прадедушка жив я был бы очень благодарен, если бы вы поинтересовались, как изменилось его мнение по поводу накипи (если конечно изменилось). Ведь статья «с историей» — х2 от обычной статьи…
В общем, несмотря на кажущуюся простоту, проблема образования накипи актуальна и во многих областях техники до сих пор на 100% не решена. Разбираемся вместе.
Разбираемся вместе.
краткий путеводитель по самым животрепещущим вопросам
Статья — очередное «много букв», поэтому найти ответ на свой маленький простой вопрос будет тяжело, а пробегая по диагонали вообще можно все упустить. Поэтому я некоторые ключевые вещи вынес в импровизированный «путеводитель» (или faq, уж как кому удобнее):
как жесткая вода влияет на волосы, а как на кожу
кусок мыла в общественном месте — источник передачи инфекции
зачем в старину волосы мыли золой
в чем преимущество бессульфатных шампуней («SLS free»)
почему постиранные в жесткой воде ткани грубеют?
из чего состоит накипь
как накипь вредит электроприборам
вода корродирует трубы или образует накипь, как это оценить?
способы получения мягкой воды
что в составе таблеток для удаления накипи в стиральной машине (Calgon и т.п.)
почему в аккумулятор нельзя залить водопроводную воду
ингибиторы образования накипи (антискаланты)
почему не нужно покупать новый «картридж-умягчитель» в утюг или увлажнитель воздуха
кислоты для удаления накипи + как женский гель-пилинг из магазина косметики может помочь в очистке дорогостоящего котла от накипи
почему вредно пить дистиллированную воду
не стоит использовать мягкую/умягченную воду для полива комнатных растений и растений в теплицах
почему жесткая вода важна для приготовления настоящего кофе
вред мягкой воды
что такое «мочевой камень» и как он связан с минеральной водой
1.
 Intro. С чего все начинается…
Intro. С чего все начинается…Начинается все ожидаемо с воды, с самого распространенного и универсального растворителя на Земле. Из-за своей универсальности (=высокая сольватационная способность) в воде растворяются и газы. А один из наиболее распространенных газов — это углекислый газ, он же диоксид углерода, он же CO2. При подходящем давлении/температуре углекислый газ (он все же кислотный оксид) реагирует с водой с образованием слабой угольной кислоты H2CO3. Растворимость этой кислоты увеличивается при понижении температуры и повышении давления. Любое колебание давления/температуры приводит к тому, что угольная кислота диссоциирует с образованием бикарбонат (~гидрокарбонат) ионов и ионов гидроксония.
Слабые растворы угольной кислоты (именно благодаря ей ощущается кисловатый вкус минеральной воды) проникая из водоносного горизонта в толщи горных пород и различных отложений минералов размывают последние и насыщаются ионами металлов (=выщелачивают), в основном кальция («доноры» — кальцит/мел, гипс) и магния («донор» — доломит). В итоге вся вода поступающая из ручьев, озер и скважин, может рассматриваться как разбавленные растворы бикарбоната кальция Ca(HCO3)2 и бикарбоната магния Mg(HCO3)2. Кстати, дождь, содержащий растворенный «парниковый» диоксид углерода, может также реагировать с карбонатом кальция и уносить уже в толщу почвы ионы металлов. Огромный объем уноса кальция в подземные воды обеспечивают кислотные дожди…
В итоге вся вода поступающая из ручьев, озер и скважин, может рассматриваться как разбавленные растворы бикарбоната кальция Ca(HCO3)2 и бикарбоната магния Mg(HCO3)2. Кстати, дождь, содержащий растворенный «парниковый» диоксид углерода, может также реагировать с карбонатом кальция и уносить уже в толщу почвы ионы металлов. Огромный объем уноса кальция в подземные воды обеспечивают кислотные дожди…
1.1 Про
Логично что неорганические ионы, попадая в воду, изменяют ее свойства. И к этим новым свойствам привыкает все живое. Для того, чтобы оценить примерное количество расстворенных ионов используют термин «минерализация». Общая минерализация (англ. Total Dissolved Solids (TDS) — показатель количества содержащихся в воде растворённых веществ (неорганические соли, органические вещества). Также этот показатель называют содержанием твёрдых веществ или общим солесодержанием.
Содержащиеся в водах природных источников соли металлов ~ катионы кальция Са2+, магния Mg2+, стронция Sr2+, бария Ва2+, железа Fe2+ и Fe3+, марганца Mn2+) именуют общей жёсткостью воды. При этом в природных водах превалирует содержание соединений с кальцием и магнием – сумма концентраций данных элементов значительно больше концентрации всех других представленных частиц и даже их суммарной величины. Поэтому общая жёсткость обычно представляется, как сумма катионов кальция и магния в воде, выраженная в эквивалентных весах. В мало- и среднеминерализованных водах обычно ионы кальция преобладают над ионами магния. С ростом минерализации содержание ионов кальция быстро снижается, и обычно не превышает 1 г/л. Содержание ионов магния в высокоминерализованных водах может достигать нескольких граммов, а в соленых – нескольких десятков граммов. Существует закономерность — при увеличении минерализации соотношения ионов выравниваются.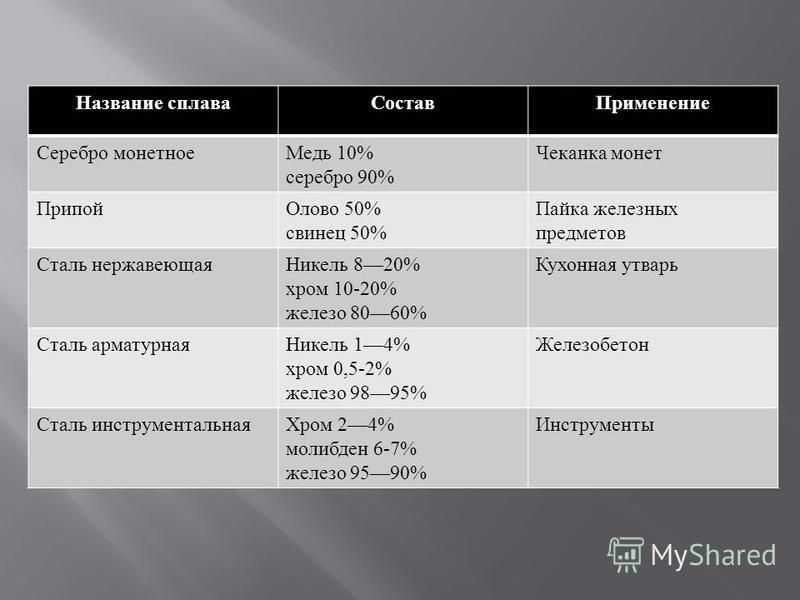
Наиболее часто упоминаемые разновидности понятия жёсткость — это жесткость временная и постоянная. Первый вид объясняется нахождением в воде гидрокарбонатов кальция Са(НСО3)2 и содержащегося в более незначительных количествах магния Mg(НСО3)2, в редких ситуациях – Fe(НСО3)2. Название «временная» определяется тем, что её можно ликвидировать, осуществив нагрев воды до температуры 60 – 100 °С. Кроме представленных видов выделяют также карбонатный и некарбонатный тип жёсткости. Приведенная ниже картина иллюстрирует наличие каких солей отвечает за тот или иной тип жесткости воды.
Откуда взялся термин _жесткая_вода_
Рассуждать об этимологии словосочетания «жесткая вода» сложно. Термин этот сложился исторически, из-за особенностей воздействия воды с высоким содержанием катионов кальция/магния на продукты питания/ткани/кожу-волосы и т.п. На на StackExchange например есть целая ветка, посвященная поиску ответа на этот вопрос. Одним из самых ранних упоминаний в англоязычной литературе термина «жесткая вода» (~«hard water») можно считать 1660 год — F. Brooke tr. V. Le Blanc World Surveyed 18 с “…the water was sharp and hard, but nothing brackish…” или, например, упоминание вThe History of the Royal-Society of London, for the Improving of Natural Knowledge by Thomas Sprat от 1667 года. Что ж до русскоязычных источников — то здесь ничего толком не известно, если вдруг кто-то из филологов такой информацией владеет — поделитесь, я с радостью дополню статью.
Одним из самых ранних упоминаний в англоязычной литературе термина «жесткая вода» (~«hard water») можно считать 1660 год — F. Brooke tr. V. Le Blanc World Surveyed 18 с “…the water was sharp and hard, but nothing brackish…” или, например, упоминание вThe History of the Royal-Society of London, for the Improving of Natural Knowledge by Thomas Sprat от 1667 года. Что ж до русскоязычных источников — то здесь ничего толком не известно, если вдруг кто-то из филологов такой информацией владеет — поделитесь, я с радостью дополню статью.
Как уже говорилось, временная жесткость называется временной потому, что может снижаться при нагревании (кипячении) воды за счет перехода растворимых бикарбонатов в нерастворимые карбонаты. Постоянная жесткость кипячением не убирается, хотя сульфаты и фосфаты кальция в определенных условиях также могут кристаллизоваться, образуя отложения на стенках промышленных аппаратов в виде ангидрита, гипса, полуводного сульфата кальция, гидросиликата и гидроксиапатита. Об этом явлении я остановлюсь отдельно.
Об этом явлении я остановлюсь отдельно.
Существует еще и следующая закономерность — поверхностная вода обычно имеет меньшую жесткость, поскольку она разбавляется в значительной степени осадками и талыми водами. Этим объясняется и факт сезонных изменений показателей общей жесткости для поверхностных вод (наибольшие значения в конце зимы, а наименьшие – в период паводка). Состав подземных вод более постоянен, меньше изменяется в течение года (особенно артезианских источников) и обычно имеет бОльшие значения, чем у поверхностной воды, по общей жесткости.
Для численного выражения жесткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м3), однако, на практике для измерения жесткости используются т.н. «градусы жесткости» и миллиграммы эквивалента на литр (мг-экв/л). В Республике Беларусь и в РФ жесткость воды измеряют в «градусах жесткости» (°Ж), за рубежом приняты другие единицы измерения.
1 °Ж = 1 мг-экв/л = 1 ммоль/ дм3 Са2+ = 20,04 мг; 1 ммоль Mg2+ = 12,16 мг (т.е. в 1 литре воды жесткостью 1 °Ж содержится 20 мг кальция и 12 мг магния).
Что же касается перевода из одного градуса в другой, то существует следующая шкала перевода: 1 °Ж (Беларусь, Россия)= 5,005 °fH (Франция)= 2,804 dGH, °dH (Германия)= 2,924 gpg (США)= 50,05 ppm, mg/L (США)= 3,511 °e, °Clark (Великобритания)
Что же дальше с этим делать — зависит от страны. Градусы измерены, а вот какую воду считать жесткой, какую мягкой — каждый решает для себя. Cм. рисунок под спойлером
Разница отношения к жесткой воде в России и в Германии
взято отсюда
В общем считают, что вода до 2 °Ж — мягкая, от 2-10 °Ж — это вода средней жесткости, а >10 °Ж — это жесткая вода. Более развернутую шкалу используют т. н. «фильтровщики» — специалисты в области фильтрации. По их классификации выходит следующее:
н. «фильтровщики» — специалисты в области фильтрации. По их классификации выходит следующее:
— 0-1,5 мг-экв/л (0-1,5°Ж) – мягкая вода
— 1,5-2 мг-экв/л (1,5-2°Ж)– оптимальная питьевая вода
— 2-5 мг-экв/л (2-5°Ж)– жесткая вода
— 5-7 мг-экв/л (5-7°Ж)– сверхжесткая вода
— > 7 мг-экв/л (> 7°Ж)– не питьевая вода, за пределами рекомендованных значений.
Некоторые DIY-исследователи качества питьевой воды советуют при отсутствии специального оборудования и реактивов измерять жесткость воды с помощью «высоты столба пены».
Развлекаемся с куском хозяйственного мыла
Вам потребуется:
— дистиллированная вода (можно купить канистру на автозаправке)
— хозяйственное мыло (60% или 72%)
— весы (электронные или чашечные с набором грузов) и линейка
— цилиндрический стакан
— литровая банка или прозрачная мерная емкость
1. Отмерьте один грамм хозяйственного мыла и измельчите его (например на электронных весах). Положите мыло в стакан.
Отмерьте один грамм хозяйственного мыла и измельчите его (например на электронных весах). Положите мыло в стакан.
2. Нагрейте дистиллированную воду на плите (кипятить не нужно) и аккуратно перелейте в стакан с мылом. Мыло должно раствориться.
3. Долейте в стакан с мыльным раствором еще дистиллированной воды. Если на упаковке мыла указана концентрация 60% долейте до общей высоты жидкости в стакане — 6 см. Если 72% — до 7 см. В каждом сантиметровом слое раствора окажется такое количество мыла, которого достаточно, чтобы связать в одном литре воды все соли жесткости, если их концентрация 1°dH (немецкий градус жесткости). Перевести °dH в мг.экв/л можно по такой таблице:
Градусы dH__Характер воды__Жесткость в мг-экв/л
0–4°__Очень мягкая__до 1,5 мг-экв/л
5–8°__Мягкая__1,5–4 мг-экв/л
9–12°__Средней жесткости__4–8 мг-экв/л
13–22°__Жесткая__8–12 мг-экв/л
23–34°__Очень жесткая__выше 12 мг-экв/л
4. Налейте 0,5 л холодной воды из под крана в банку или мерную емкость.
5. Медленно переливайте мыльный раствор из стакана в банку и плавно помешивайте, пока в банке не появится белая пена. Пена означает, что мыло связало соли жесткости.
6. Измерьте высоту оставшегося в стакане мыльного раствора и вычтите из исходной высоты.
Каждый сантиметр перелитого в банку раствора связал в полулитре водопроводной воды количество солей жесткости, соответствующее 2°dH. Если вы налили в банку 2 см мыла и в вашей воде появилась пена — значит, жесткость вашей воды 4 °dH. Это примерно 1,5 мг-экв/л.
Я предлагаю не спешить и не гоняться за градусами жесткости, а дочитать до раздела, посвященного оценке качества воды. Там и станет понятнее, что воду нужно оценивать комплексно, а не «гнаться за градусом».
1.2 Жесткая вода VS Человек&Машина
Сложно однозначно оценивать такой параметр как влияние жесткости воды на человека, потому что результат будет отличаться в зависимости от того, спроецируем ли мы его на здоровье человека, или же на «здоровье» механизмов и инженерных систем. Рассмотрим каждый пункт в отдельности.
Рассмотрим каждый пункт в отдельности.
1.2.1. ЧЕЛОВЕК И ЕГО ЗДОРОВЬЕ
И кальций, и магний являются важными биогенными минералами (микроэлементами), необходимыми для функционирования живых организмов (в т.ч. и организма человека). В день человек должен потреблять около 1000 мг кальция и 200-400 мг магния. Если представить, что вы ежедневно выпиваете два литра жесткой воды (или жидкости, произведенной на основе этой воды), то количество полученных таким образом кальция и магния составит 5-20% от нормы. В свете того, что Всемирная организация здравоохранения еще в 2011 году отметила, что не имеется достаточно данных для установления нижних (и верхних) пределов жёсткости воды, можно считать что наличие солей жесткости в воде — это обязательное условие нормальной жизнедеятельности человека. Национальный исследовательский совет США же вообще предложил считать, что жесткая вода служит пищевой добавкой кальция и магния.
Каких либо подтвержденных выраженных влияний жесткости воды на органы и ткани человека пока не существует. Есть различные фрагментарные исследования, которые проведены в определенных регионах и не масштабируются на другие регионы. Можно вспомнить исследования, которые проводились еще в 80-х годах прошлого века в Великобритании, в результате которых было установлено, что при использовании в городах умягченной питьевой водой смертность от сердечно-сосудистых заболеваний на 10-15% выше, чем в местах, где вода средней жесткости (около 170 мг/л). Работы с подобными результатами есть и на примере Франции, Швеции и т.д. В США исследователи связывают употребление жесткой воды с благотворным воздействием на сердечно-сосудистую систему — жесткость отрицательно коррелирует с атеросклеротическим заболеванием сердца.
Есть различные фрагментарные исследования, которые проведены в определенных регионах и не масштабируются на другие регионы. Можно вспомнить исследования, которые проводились еще в 80-х годах прошлого века в Великобритании, в результате которых было установлено, что при использовании в городах умягченной питьевой водой смертность от сердечно-сосудистых заболеваний на 10-15% выше, чем в местах, где вода средней жесткости (около 170 мг/л). Работы с подобными результатами есть и на примере Франции, Швеции и т.д. В США исследователи связывают употребление жесткой воды с благотворным воздействием на сердечно-сосудистую систему — жесткость отрицательно коррелирует с атеросклеротическим заболеванием сердца.
Добиться гиперкальциемии (превышение содержания кальция в организме) с помощью только употребления жесткой (или даже очень жесткой) воды тяжело. Потому что лишний кальций у здоровых людей выводится через почки, и только нарушение функций почек может поставить здоровье человека под угрозу. Ситуация с магнием похожа: сложно представить, чтобы избыточное количество этого элемента приносило вред человеку со здоровыми почками. Лишь иногда употребление более 250 мг магния в день (для такого количества пришлось бы выпить пять-десять литров очень жесткой воды) производит на здорового человека небольшой слабительный эффект, да и организм через некоторое время к нему адаптируется. Плюс ко всему большая магниевая жесткость придает воде горький привкус (содержание катионов Mg2+ более 100 мг/л) и при всем желании выпить больше чем нужно не получится. В общем, использование воды разной минерализации — вопрос привычки. Жители меловых холмов или те, кто вырос у берега моря, где подземные воды тоже соленые пьют жесткую воду каждый день. НО! Но дело меняется, если в организме возникают болезнетворные микробы, вырабатывающие аммиак (Proteus, Xanthomonas, Pseudomonas, Klebsiella, Staphylococcus и Mycoplasma, куда ж без них…). Тогда поступление высоких доз магния в организм может спровоцировать образование не самого приятного минерала — струвита.
Ситуация с магнием похожа: сложно представить, чтобы избыточное количество этого элемента приносило вред человеку со здоровыми почками. Лишь иногда употребление более 250 мг магния в день (для такого количества пришлось бы выпить пять-десять литров очень жесткой воды) производит на здорового человека небольшой слабительный эффект, да и организм через некоторое время к нему адаптируется. Плюс ко всему большая магниевая жесткость придает воде горький привкус (содержание катионов Mg2+ более 100 мг/л) и при всем желании выпить больше чем нужно не получится. В общем, использование воды разной минерализации — вопрос привычки. Жители меловых холмов или те, кто вырос у берега моря, где подземные воды тоже соленые пьют жесткую воду каждый день. НО! Но дело меняется, если в организме возникают болезнетворные микробы, вырабатывающие аммиак (Proteus, Xanthomonas, Pseudomonas, Klebsiella, Staphylococcus и Mycoplasma, куда ж без них…). Тогда поступление высоких доз магния в организм может спровоцировать образование не самого приятного минерала — струвита. Про него подробнее в разделе накипь (-ей).
Про него подробнее в разделе накипь (-ей).
Про легионеллу в накипи и жизнь-на-куске-мыла
1.2.2. МЫЛО, НАКИПЬ И БАКТЕРИИ [Canonical link — Пневмония от увлажнителя воздуха и душевой лейки…]
В разделе, посвященному влиянию жесткой воды и последствий ее взаимодействия с человеком хотелось бы упомянуть и про такую вещь как легионеллез. Wikipedia-напомню, что это такое.
Легионеллёз («болезнь легионеров») — острое инфекционное заболевание, обусловленное различными видами микроорганизмов, относящихся к роду Legionella. Заболевание протекает, как правило, с выраженной лихорадкой, общей интоксикацией, поражением лёгких, центральной нервной системы, органов пищеварения, возможно развитие синдрома полиорганной недостаточности <…>
Имеем достаточно суровое заболевание быстро приводящее к смертельному исходу. Первый, наиболее известный случай заражения бактерией легионелла произошел в гостинице «Bellevue-Stratford» в Филадельфии в 1976 году. В этой гостинице проходила встреча около 4500 военных ветеранов из «Американского Легиона», из них 182 человека неожиданно заболели, симптомы болезни были похожи на обычное воспаление легких. Примененные стандартные для такого случая антибиотики оказались неэффективными, и 29 заболевших умерли. Поскольку происхождение болезни было неизвестно, анализировалась в том числе версия покушения на американских военных героев. Прошло немало времени прежде, чем определили, что болезнь вызвана бактерией широко распространенной в природе, которая до сих пор не была выявлена. От названия «Американский легион», в котором служили жертвы и у которых первый раз обнаружили бактерию, ее назвали «Legionella pneumophila», а болезнь, которую она вызывает «легионеллез».
Первый, наиболее известный случай заражения бактерией легионелла произошел в гостинице «Bellevue-Stratford» в Филадельфии в 1976 году. В этой гостинице проходила встреча около 4500 военных ветеранов из «Американского Легиона», из них 182 человека неожиданно заболели, симптомы болезни были похожи на обычное воспаление легких. Примененные стандартные для такого случая антибиотики оказались неэффективными, и 29 заболевших умерли. Поскольку происхождение болезни было неизвестно, анализировалась в том числе версия покушения на американских военных героев. Прошло немало времени прежде, чем определили, что болезнь вызвана бактерией широко распространенной в природе, которая до сих пор не была выявлена. От названия «Американский легион», в котором служили жертвы и у которых первый раз обнаружили бактерию, ее назвали «Legionella pneumophila», а болезнь, которую она вызывает «легионеллез».
Самая масштабная в Европе эпидемия легионеллеза, известная до настоящего времени, имела место в апреле 1985 года в Главной районной больнице в городе Страффорд в Великобритании, где из 101 человека заболевших легионеллезом, умерли 28. В обоих случаях, как доказано позже, причиной был кондиционер. Источником заражения стал биоаэрозоль, содержавший бактерии легионеллы, который поступал в помещение из системы кондиционирования.
В обоих случаях, как доказано позже, причиной был кондиционер. Источником заражения стал биоаэрозоль, содержавший бактерии легионеллы, который поступал в помещение из системы кондиционирования.
Из всего множества разновидностей легионеллеза достаточно распространенный вариант — это понтиакская лихорадка, или лихорадка Понтиак. Основное отличие этой клинической формы в том, что она протекает без развития пневмонии и похожа на обычный грипп. Выздоровление, как правило происходит спонтанно и поэтому болезнь часто не диагностируется. Инфекция, вызванная легионеллой, не передается от человека к человеку, хотя один возможный случай был зарегистрирован.
Решил я упомянуть про это заболевание потому, что оно косвенно связано с жесткой водой и прямо — с образующейся из жесткой воды накипи. С расширением хозяйственной деятельности человека легионеллы, помимо естественной среды обитания получили в подарок искусственную — созданную человеком. Это все водные системы, где циркулирует вода оптимальной температуры. Что является оптимальным температурным диапазоном — см. таблицу ниже:
Что является оптимальным температурным диапазоном — см. таблицу ниже:
Легионеллы размножаются в теплой стоячей воде. Они могут умеренно размножаться в воде с температурой от 20 до 45 °C и буйствовать в воде диапазона 32-44 °C. При температурах выше 50 °C рост приостанавливается, а при 70 °C бактерия погибает практически мгновенно. В естественных условиях такие температурные диапазоны редки. А вот в искусственных встречаются очень часто в системе горячего водоснабжения, в душевых и ванных комнатах, в банях, в бассейнах с гидромассажем, резервуарах с горячей водой и испарительных конденсаторах систем кондиционирования воздуха. Условия для размножения появляются потому что возникает дилемма — с одной стороны, вода 45-50 °C наиболее комфортна для мытья, а с другой — обеспечивает лучшие условия для развития легионеллы.
Восприятие температуры воды человеком взято из работы G. Brundrett Legionella and building services (1992):
где, а — субъективное восприятие домохозяйками температуры воды (проверка путем погружения рук), б — теплоощущение человека при принятии душа (на примере взрослых мужчин), в — типичное предпочтение потребителем температуры горячей воды.
Т.е. мы имеем налицо противоречие, с одной стороны нужно попасть в предпочитаемый большинство жителей температурный диапазон, с другой — не дать развиться легионеллам. Европейские производители бойлеров и водонагревателей стараются делать так, чтобы температура воды хотя бы иногда поднималась выше 55-60 °C и пастеризовала все оборудование от легионеллы. В посудомоечных машинах как правило температура выдерживается на уровне 55 °C, повышение до 60 °C вызывает усиленное осаждение известковых отложений (об этом ниже), а температуры выше 70 °C в присутствии агрессивных компонентов моющих смесей могут привести к повреждению покрытий посуды.
Наибольшую опасность с точки зрения образования биоаэрозолей легионеллы представляют душевые кабины, бани типа турецких, общественные душевые в общежитиях и т.п… На рисунке показан механизм заражения:
Сначала легионеллы размножаются в трубах, колонизируя простейших (амебы и т.п.) или биопленки/минеральные отложения (А). Затем связанная с биопленкой легионелла во время принятия душа смещается током воды из трубы в душевую лейку (B) и превращается в биоаэрозоль (С). Ну а биоаэрозоль вдыхается (D) и оседает в альвеолах легких человека (Е).
Ну а биоаэрозоль вдыхается (D) и оседает в альвеолах легких человека (Е).
В трубы водоснабжения легионеллы могут попадать разными путями, чаще всего с простейшими (амебы, лямблии и т.д.) или их цистами (пункт 1 на рисунке ниже).
Попав в водопроводные трубы простейшие адсорбируются на известковых отложениях и/или покрывающих их биопленках (слизи) — пункт 2 на рисунке. Патогенные легионеллы могут образовывать собственные колонии внутри труб (пункт 3а) либо попадать в организм простейших (3b). После попадания в организм носителя легионелла может либо уничтожить своего носителя, либо вместе с носителем попасть в цисты. Трансфер из биопленки в водопроводную воду также может происходить разными путями, например за счет уноса биопленок током воды (4а). Там бактерии могут присутствовать как в виде цист простейших (4b), либо в виде т.н. репликационных вакуолей организма-носителя (4с). После уноса потоком воды этот «бактериальный материал» может либо попасть в питьевую/хозяйственную воду к человеку, либо же образовать колонии дальше по течению воды в трубопроводе. Колония может образоваться не только в душевой лейке, но и в аэраторе крана, в мойке и т.п.
Колония может образоваться не только в душевой лейке, но и в аэраторе крана, в мойке и т.п.
В общем любая система где имеется а)вода температурой от 20 до 50 градусов, б)имеется подходящая биопленка с твердой минеральной матрицей (накипь в виде известковых или других инертных отложений) и в)имеется возможность диспергирования капель воды до состояния аэрозоля — любая такая система может в потенциале служить источником заражения человека легионеллезом. Легионелла высеивается из жидкостей кондиционеров, промышленных и бытовых систем охлаждения, бойлерных и душевых установок, оборудования для респираторной терапии (CPAP), увлажнителей воздуха, спа-бассейнов/джакузи. Так что при случае следует проверить увлажнители воздуха/душевые лейки на наличие накипи/биопленок (слизи) и провести соответствующую обработку.
Про обработку для борьбы с накипью мы будет еще говорить дальше, а вот на биопленке/слизи в увлажнителях воздуха, парогенераторах, генераторах пара для бань типа “хамам” я скажу сейчас. Упомянутые выше предметы требуют обязательного регулярного удаления биопленок (слизи). Добиться уничтожения и бактерий и простейших и грибов можно проверенными средствами — перекисью водорода (см. статью Про перекись водорода и жука-ракетчика) и гипохлоритом натрия (см. статью Что в Белизне тебе моей или Справочное пособие по гипохлориту натрия («хлорке»)). Но в отличие от душевой лейки, которая просто может прекратить работать, потому что забилась слизью и накипью, тот же увлажнитель воздуха разбирать и дезинфицировать владельцы почему-то не спешат. В таком случае можно посоветовать каждый раз, заправляя это устройство водой добавлять туда пару капель средства, препятствующего биообрастанию. Часто используется раствор метиленовой сини («синька») или бриллиантового зеленого («зеленка»), но если при наружном использовании эти вещества не оказывают никакого вредного действия, то вот мнения насчет того, как эти красители взаимодействуют с легкими в аэрозольной форме пока разнятся.
Упомянутые выше предметы требуют обязательного регулярного удаления биопленок (слизи). Добиться уничтожения и бактерий и простейших и грибов можно проверенными средствами — перекисью водорода (см. статью Про перекись водорода и жука-ракетчика) и гипохлоритом натрия (см. статью Что в Белизне тебе моей или Справочное пособие по гипохлориту натрия («хлорке»)). Но в отличие от душевой лейки, которая просто может прекратить работать, потому что забилась слизью и накипью, тот же увлажнитель воздуха разбирать и дезинфицировать владельцы почему-то не спешат. В таком случае можно посоветовать каждый раз, заправляя это устройство водой добавлять туда пару капель средства, препятствующего биообрастанию. Часто используется раствор метиленовой сини («синька») или бриллиантового зеленого («зеленка»), но если при наружном использовании эти вещества не оказывают никакого вредного действия, то вот мнения насчет того, как эти красители взаимодействуют с легкими в аэрозольной форме пока разнятся.
Я лично, до выяснения всех причин, решил не рисковать. Одно время для ингибирования биообрастания активно использовались соли серебра/меди (например добавка в каждую «заправку» увлажнителя по пару капель раствора медного купороса (~сульфат меди) или нитрата серебра (~ляпис). Обрастание действительно снижалось на порядки (но! не полностью), увеличивать же дозу не хотелось ибо не известно как аэрозоли тяжелых металлов будут взаимодействовать с легкими. В итоге все же скрепя сердце пришлось раз в неделю проводить «прогревание» деталей увлажнителя в закипевшей воде (т.е. 60 °C<T<100 °C), а в дальнейшем вообще планируется переход на увлажнитель воздуха «кипящего типа». Ведь владельцы увлажнителей основанных на кипении воды — могут не переживать, ни биопленкам, ни легионелле в кипящей воде выжить не получится. Зато… зато накипь! 🙂 Поэтому переключаться не стоит.
Одно время для ингибирования биообрастания активно использовались соли серебра/меди (например добавка в каждую «заправку» увлажнителя по пару капель раствора медного купороса (~сульфат меди) или нитрата серебра (~ляпис). Обрастание действительно снижалось на порядки (но! не полностью), увеличивать же дозу не хотелось ибо не известно как аэрозоли тяжелых металлов будут взаимодействовать с легкими. В итоге все же скрепя сердце пришлось раз в неделю проводить «прогревание» деталей увлажнителя в закипевшей воде (т.е. 60 °C<T<100 °C), а в дальнейшем вообще планируется переход на увлажнитель воздуха «кипящего типа». Ведь владельцы увлажнителей основанных на кипении воды — могут не переживать, ни биопленкам, ни легионелле в кипящей воде выжить не получится. Зато… зато накипь! 🙂 Поэтому переключаться не стоит.
Косвенно с легионеллой, которая может жить в известковых отложениях в душевых лейках и т.п. (даже «которой нужны известковые отложения, чтобы жить») связан и такой вопрос как «могут ли бактерии жить на куске мыла?», безопасно ли пользоваться твердым мылом в общественных туалетах и комнатах общего пользования.
Общепринятым мнением является мнение о том, что на мыле ничего жить не может, и распространять инфекцию оно так же не может. Но в пример хотелось бы привести интересную статью, в которой исследователи проверили мыло общего пользования из 18 различных стоматологических клиник на предмет бактериального обсеменения. Оказалось, что кусок мыла — это целая вселенная, на котором может обитать до 8 различных родов микроорганизмов (грамположительные и грамотрицательные бактерии, аэробные бактерии, анаэробные бактерии и грибы. Фактически, кусок мыла в общественном месте — это аккумулятор микрофлоры (или «зоопарк», как кому приятнее воспринимать) — сводится на нет вся цель мытья рук и увеличивается риск перекрестного заражения. Наверное поэтому и CDC и ВОЗ чаще всего в своих рекомендациях, касающихся мытья рук, рекомендуют использовать жидкое мыло, в специальных дозаторах, препятствующих накоплению микрофлоры и ее трансферу (локтевые дозаторы и т.п.). Можно использовать также одноразовые мыльные таблетки или хирургические скрабы.
Дополнительно, на случай комментария «так то мыло в поликлинике, дома то все иначе» — приведу в пример статью в которой была проанализирована микрофлора кускового мыла, используемого в домашних условиях. Оказалось, что на влажном, часто используемом мыле бактерий живет гораздо больше, чем на мыле сухом, редко используемом. Основными выделенными бактериями были стафилококки и энтеробактерии. Так что повара-шаурмисты, которых уволили из минской школы где произошло массовое отравление детей шаурмой, могли быть и не виноваты. Нужно просто было использовать вместо общего хозяйственного мыла жидкое да в дозаторе.
1.2.3 ВЛИЯНИЕ ЖЕСТКОЙ ВОДЫ НА КОЖУ [Canonical link — Жесткая вода и кожа]
В народе (и у копирайтеров-косметологов) считается, что сыпь, зуд, сухость, шелушение может образовываться из-за образования нерастворимых стеаратов кальция/магния и осаждения их на коже. Потом из-за этого кожа не только преждевременно стареет, но и становится чувствительной к раздражениям и расположенной к аллергическим реакциям. Также из-за гиперчувствительности к стеаратам некоторые специалисты связывают употребление жесткой воды в домашних условиях с повышенной экземой у детей.
Также из-за гиперчувствительности к стеаратам некоторые специалисты связывают употребление жесткой воды в домашних условиях с повышенной экземой у детей.
Некий смысл в этом безусловно есть, т.к. действительно, жесткая вода взаимодействует с традиционным мылом, т.е. натриевыми солями стеариновой/пальмитиновой кислот. В результате образуется белый осадок (“мыльный камень”) вместо образования пены. Основным компонентом такой накипи является стеарат кальция, поменьше стеарата магния.
2C17H35COO– + Ca2+ → (C17H35COO)2Ca↓
2C17H35COO– + Mg2+ → (C17H35COO)2Mg↓
Лайфхак на заметку: но несмотря на все выше сказанное, основной компонент «мыльного камня» — стеарат кальция — является зарегистрированной пищевой добавкой E470. Это раз. А два — напомню, что именно стеараты являются прекрасными смазками (стеарат лития, например — это литиевая смазка, литол по-нашему).Так что никто не мешает не раздражаться по поводу «мыльного камня», а собрать его да смазать петли в ванной 🙂 В мировом масштабе стеарат кальция используется как смазка в карандашах и мелках, при производстве бумаги (предупреждает пыление и растрескивание) и т.п.
После минутки занимательной науки не грех перейти и к основам биохимии&физиологии и показать, что не все так и просто. Знания понадобятся для того, чтобы объяснить как жесткость воды воздействует на кожу и волосы. Два этих объекта объединены в один подпункт потому, что с точки зрения химика близки по своему химическому устройству (=состоят из белка кератина). Правда кератиновой кожа становится только в самом своем верхнем слое («ороговевшая», аля т.н. «натоптыши» или мозоли), после того, как закончился процесс эпителиальной дифференциации. Это важный процесс, его нужно взять на заметку. Чтобы было проще понять его важность — напомню, как устроен верхний защитный слой кожи у человека (см. картинку).
картинку).
Расшифровка картинки
Наиболее понятная аналогия для объяснения устройства кожного покрова — это кирпичная стена. Элементарная единица в стене — это кирпич, а в человеческой коже — клетка кератиноцит. На такой тип клеток в человеческом организме приходится 90% клеток эпидермиса (=наружного слоя кожи).
В «стене» человеческой кожи существует несколько слоев. Первый — «фундамент» — это базальный слой. Он состоит из цилиндрических кератиноцитов и межклеточного пространства, в котором циркулирует лимфатическая жидкость. В этом слое за счет «профориентации» стволовых клеток в кератиноциты происходит регенерация эпидермиса.
За базальным слоем следует шиповатый (или остистый) слой. Кератиноциты здесь кубические, уплощающиеся к периферии. Клетки связаны между собой через межклеточные связывающие элементы — десмосомы (если вспомнить про аналогию с кирпичной стеной, то десмосомы — это прутья арматуры). В этом слое формируются первичные фрагменты кератиновых нитей (из них в конце концов образуются роговые чешуйки отшелушивающейся кожи). За шиповатым слоем следует слой зернистый.
В этом слое формируются первичные фрагменты кератиновых нитей (из них в конце концов образуются роговые чешуйки отшелушивающейся кожи). За шиповатым слоем следует слой зернистый.
Зернистый слой — это один или два ряда кератиноцитов (на ладонях и подошвах — до семи), овальной формы, расположенных параллельно поверхности кожи. Важность слоя заключается в том, что именно здесь содержатся кератиносомы, или ламеллярные гранулы (гранулы Одланда). Они содержат различные липиды (если вспомнить аналогию с кирпичной стеной, липиды — это цемент), которые высвобождаясь в межклеточное пространство, придают коже гидрофобность, препятствуя потере влаги. Кроме липидов здесь синтезируются и основные кожные белки — кератин, лорикрин, филаггрин, инволюкрин и кератолинин. Белок филаггрин выступает в роли базы, на которой агрегируются нити кератина. А уже к полученному композиту присоединяются белки, полисахариды, липиды, аминокислоты, которые высвобождаются при начинающемся здесь распаде ядер и органелл. Этот «коктейль» имеет свое название — кератогиалин. Гранулы этого соединения и придают кератиноцитам данного слоя зернистый вид.
Этот «коктейль» имеет свое название — кератогиалин. Гранулы этого соединения и придают кератиноцитам данного слоя зернистый вид.
Над зернистым слоем располагается блестящий слой. Здесь у кератиноцитов практически полностью разрушается ядро, клеточные органеллы и десмосомы, связывающие клетки между собой. Плоские «неживые» кератиноциты которые начинают формироваться в блестящем слое называются корнеоцитами. С переходом от блестящего к последнему, роговому слою, кератиноциты полностью заполняются продольно расположенными кератиновыми фибриллами, спаянными смесью филаггрина с липидами из гранул Одланда и смещаются в наружный роговой слой.
Ну и наконец Его Величество Роговой слой кожи. Слой, который в прямом смысле слова открыт миру. Толщина слоя на ладонях и подошвах достигает 600 мкм и более. Он состоит из пластов уплощенных ороговевших корнеоцитов (=из закончивших дифференцировку кератиноцитов), которые расположенны друг на друге в виде колонок. Межклеточные щели заполнены жировым слоем, состоящим из эквимолярных концентрации холестерина, фосфолипидов и керамидов, упакованных в многослойные липидные пластины. Помимо липидных пластин корнеоциты рогового слоя удерживаются и особым видом «арматуры» — корнеодесмосомами, состоящими из белка корнеодесмозина (которого в обычных десмосомах нижних слоев кожи нет, он синтезируется в где-то примерно в области блестящего слоя).
Помимо липидных пластин корнеоциты рогового слоя удерживаются и особым видом «арматуры» — корнеодесмосомами, состоящими из белка корнеодесмозина (которого в обычных десмосомах нижних слоев кожи нет, он синтезируется в где-то примерно в области блестящего слоя).
«стена кожи» представляет собой преграду на пути к потере воды и проникновения раздражителей / аллергенов. Она состоит из кирпичей, представляющих собой скрепленные вместе корнеоциты. В качестве стержней арматуры выступают корнеодесмосомные соединения, а в роли бетона — липидные ламели. Подвижность кирпичей верхнего слоя — это шелушение кожи.
Если кратко обобщить, то получится следующее: в нижних слоях эпидермиса
корнеоциты постоянно делятся и, дифференцируясь, пассивно перемещаются в поверхностные слои, где завершается их жизненный путь. На поверхности кожи клетки получают название корнеоцитов (~или роговых чешуек, в русской транскрипции). Весь процесс кератинизации продолжается 3—4 недели (на подошвах стоп — быстрее).
В эпидермисе кожи происходят постоянно взаимосвязанные процессы роста, развития и гибели кератиноцитов (= роговые чешуйки в норме постоянно сшелушиваются, заменяясь новыми). Благодаря этому в эпидермисе существует регулярно обновляющийся слой, который отличается механической и химической устойчивостью, высокой гидроизолирующей способностью, плохой теплопроводимостью и непроницаемостью для бактерий и их токсинов (=барьерная функция).
Процесс дифференциации кератиноцитов из стволовых клеток, «взросления» и гибели (=отшелушивания чешуек кожи) находится под влиянием множества факторов. Например, он зависит от градиента содержания ионов кальция в разных слоях кожи. Изменение концентрации кальция указывает кератиноциту кем он должен быть и в каком слое кожи должен находится. Наиболее низкий уровень Ca2+ в базальном слое, затем он медленно растет к верхнему зернистому слою, где достигает максимума. В роговом слое уровень резко падает. Именно кальций регулирует экспрессию генов дифференцирования в кератиноцитах, например тех, которые кодируют формирование белков рогового слоя кожи. К примеру, если что-то произошло и нарушился внешний жировой барьер кожи, градиент кальция смещается и запускается секреция содержимого ламеллярных тел в зернистом слое –> защитный барьер восстанавливается, старая кожа без липидов отшелушивается. Изменение распределения кальция в «живых» слоях эпидермиса ингибирует процесс «взросления» кератиноцитов и запускает процесс роста для компенсации потерянных (=отшелушившихся) клеток. При нанесении на кожу экзогенного кальция — процесс восстановления ингибируется, т.е. жесткая вода с преобладанием кальция уменьшает образование «кожных липидов», и препятствует шелушению кожи. Другие ионы также активно участвуют в гомеостазе кожи.
Именно кальций регулирует экспрессию генов дифференцирования в кератиноцитах, например тех, которые кодируют формирование белков рогового слоя кожи. К примеру, если что-то произошло и нарушился внешний жировой барьер кожи, градиент кальция смещается и запускается секреция содержимого ламеллярных тел в зернистом слое –> защитный барьер восстанавливается, старая кожа без липидов отшелушивается. Изменение распределения кальция в «живых» слоях эпидермиса ингибирует процесс «взросления» кератиноцитов и запускает процесс роста для компенсации потерянных (=отшелушившихся) клеток. При нанесении на кожу экзогенного кальция — процесс восстановления ингибируется, т.е. жесткая вода с преобладанием кальция уменьшает образование «кожных липидов», и препятствует шелушению кожи. Другие ионы также активно участвуют в гомеостазе кожи.
Здесь мы имеем следующую картину: сухая кожа -> низкая способность удерживать влагу -> нарушение барьерной функции (повышенная проницаемость) — > увеличение потока ионов внутрь эпидермиса — > нарушение ионных градиентов (как в случае кальция) — > запуск механизма восстановления барьерной функции -> шелушение отмершей кожи.
Ионы магния также ингибируют процесс восстановления барьерной функции, хотя из-за огромного гидратного радиуса (про это в разделе «влияние на волосы») проникают в эпидермис гораздо слабее кальция. В подтверждение слов о пользе магния можно упомянуть статью, в которой добровольцы с заведомо сухой кожей 6 недель умывались водопроводной водой и 5% раствором воды из Мертвого моря (6 г/л ионов магния). Водопроводная вода не оказала никакого эффекта, вот от соленой воды Израиля улучшилась влажность кожи, уменьшилась шероховатость и покраснений. Исследователи предполагают, что высокая концентрация магния соли и (в меньшей степени) соли кальция в сочетании с гидрокарбонат-ионами предложены в качестве основных факторов, способствующих улучшению состояния кожи.
Замечание про важность рН кожи: не зря на картинке вместе с градиентом кальция упомянут и градиент рН. Этот показатель для рогового слоя играет важную роль в сохранении барьерной функции кожи, а значит также влияет на процессы биосинтеза липидов и отшелушивания рогового слоя. Также низкое (кислотное) значение рН оказывает противомикробное действие, уменьшая количество колоний патогенных микроорганизмов на коже.
Также низкое (кислотное) значение рН оказывает противомикробное действие, уменьшая количество колоний патогенных микроорганизмов на коже.
Забегая вперед, скажу, что умягчая воду, мы нарушаем ее буферные свойства, и увеличиваем щелочность. Увеличение щелочности — повышает рН кожи и а)обезоруживает кожу перед патогенными микроорганизмами, б)запускает процессы восстановления градиента рН, которые в итоге все равно будут выражаться в преждевременном отшелушивании рогового слоя, в) превращает волосы в анионообменную смолу, которая начинает интенсивно умягчать окружающую воду и адсорбировать на себя ионы жесткости (но об этом далее). Поэтому самый лучший вариант — выдерживать воду для умывания в нейтральном диапазоне рН (~7), или хотя бы подкислять воду для ополаскивания для поддержания гомеостаза кожи.
Рассматривать волосы отдельно от кожи изначально не планировалось. Потому что самые продвинутые трихологи давно уже рекомендуют при выборе шампуня выбирать
средство для кожи головы, а не для волос. В Японии, например, большинство шампуней ориентированы именно на работу с кожей головы, а не с «роговыми пластинами» (=волосы). Постараюсь объяснить почему так. Если кожа — объект живой и саморегулирующийся, то вот волосы живыми назвать сложно. Каждый волос состоит из трех слоев — кутикулы, коркового слоя и мозгового вещества в центре. Все процессы увлажнения волос и т.п. происходят за счет капиллярных явлений, смачивания и т.п.
В Японии, например, большинство шампуней ориентированы именно на работу с кожей головы, а не с «роговыми пластинами» (=волосы). Постараюсь объяснить почему так. Если кожа — объект живой и саморегулирующийся, то вот волосы живыми назвать сложно. Каждый волос состоит из трех слоев — кутикулы, коркового слоя и мозгового вещества в центре. Все процессы увлажнения волос и т.п. происходят за счет капиллярных явлений, смачивания и т.п.
1.2.4 ВЛИЯНИЕ ЖЕСТКОЙ ВОДЫ НА ВОЛОСЫ [Canonical link — Жесткая вода и волосы]
Как я уже говорил ранее, основной строительный материал волос — кератин — один из основных структурообразующих белков из класса склеропротеидов. Структурообразующие белки тела человека еще называют фибриллярными белками (или волокнистыми, они имеют вытянутую, нитеобразную форму).
Кератин нерастворим в воде, он обладает способностью разбухать и размягчаться под действием воды. Это заметно, например, когда ногти слегка размягчаются в воде и снова затвердевают после испарения воды. То же происходит с кератинами кожи и волос. Кстати, скорлупа куриного яйца состоит грубо говоря из «накипи» и кератина. Если растворить известь скорлупы яйца в кислоте, то остается мягкая пленка, состоящая из кератина, из кератина состоит и пленка, которая находится внутри скорлупы. Состав волос- 65-95% кератин (25 аминокислот, 18 идентифицируемые количества), липиды, пигменты и микроэлементы. Структура же самого волоса показана ниже:
То же происходит с кератинами кожи и волос. Кстати, скорлупа куриного яйца состоит грубо говоря из «накипи» и кератина. Если растворить известь скорлупы яйца в кислоте, то остается мягкая пленка, состоящая из кератина, из кератина состоит и пленка, которая находится внутри скорлупы. Состав волос- 65-95% кератин (25 аминокислот, 18 идентифицируемые количества), липиды, пигменты и микроэлементы. Структура же самого волоса показана ниже:
Почему каждый волос – это маленькое дерево
Если внимательно посмотреть на картинку с устройством волоса, то несложно заметить сходство с разрезом ствола дерева. Несмотря на отличия в составе биополимеров (белки у человека, против полисахаридов у деревьев) супрамолекулярная структура похожа. Каждый волос — это маленькое дерево. И принципы обеспечения жесткости одинаковы.
Каждый из ваших волос растет из отдельного волосяного фолликула (волосяной сумки или волосяной луковицы) — части волоса, скрытой под кожей головы. Именно эта органелла является формально живой, сами волосы — что-то напоминающее отмершую кору дерева. Внутри этого форменного элемента находятся клетки, которые постоянно делятся и выталкивают друг друга наружу. Достигнув верхней части луковицы, они образуют шесть концентрических слоев. Три внутренних слоя становятся волосом, состоящими из кутикулы, коркового слоя и мозгового вещества (хотя мозговое вещество присутствует не всегда, особенно в тонких волосах). Три внешних слоя становятся выстилкой фолликула.
Именно эта органелла является формально живой, сами волосы — что-то напоминающее отмершую кору дерева. Внутри этого форменного элемента находятся клетки, которые постоянно делятся и выталкивают друг друга наружу. Достигнув верхней части луковицы, они образуют шесть концентрических слоев. Три внутренних слоя становятся волосом, состоящими из кутикулы, коркового слоя и мозгового вещества (хотя мозговое вещество присутствует не всегда, особенно в тонких волосах). Три внешних слоя становятся выстилкой фолликула.
Внешний слой — кутикула — это чешуйчатый (по аналогии с рыбьей чешуей) защитный слой волоса. Чешуйки обладают способностью набухать и двигаться. Кутикула состоит из пяти-десяти слоев непигментированных уплощенных роговых клеток (полностью ороговевших) толщиной от 0,2 до более 0,5 мкм и длиной от 20 до 70 мкм. Они образуют единый слой ячеек, расположенный как черепица на крыше с множеством перекрытий. Эти чешуйки соединены своего рода межклеточной материцей липопротеинового типа, называемой мембрано-клеточным комплексом/membrano-cellular complex (MCC).
Мембранно-клеточный комплекс, состоящий из керамидов, связанных с кератином, обеспечивает прочную адгезию между соседними чешуйками волоса. Нужна эта связка (белок+липиды) для того, чтобы предотвратить попадание внутрь волоса воды или каких-то инородных веществ. Считается, что каждая из отдельных чешуек кутикулы окружена липидным слоем, который иногда называют эпикутикулой.
Кора/кортекс или корковый слой — это основной слой волоса, на него приходится порядка 90% от общего веса. В отличие от кутикулы, состоящей из аморфного кератина, корковый слой состоит из пучков продольно ориентированных макрофибрилл кератина, связанных межклеточным липопротеидным цементом, который составляет от 5 до 7% от общего веса волоса. Каждая из этих макрофибрилл представляет собой цилиндрическую единицу диаметром от 0,1 до 0,4 мкм. Они образованы из белковых микрофибрилл. Каждая микрофибрилла представляет собой набор из семи скрученных протофибрилл, образованных из четырех пептидных цепей, свернутых в спираль: это спираль альфа-кератина. Длинные кератиновые волокна скрепляются между собой прочными дисульфидными (cм. молекулярную модель волоса на картинке ниже) и слабыми водородными связями.
Длинные кератиновые волокна скрепляются между собой прочными дисульфидными (cм. молекулярную модель волоса на картинке ниже) и слабыми водородными связями.
Фибриллярные белки образуют последовательно организованные супрамолекулярные ансамбли с размерами масштабируемыми от 1 нм до нескольких микрометров. Именно эта сложная надмолекулярная организация коркового слоя отвечает за механические и физические свойства волос. Корковый слой отвечает также и за цвет волос — в корковых клетках обнаруживаются пигментные гранулы меланина, придающие волосам окрашивание.
Мозговое вещество, присутствующее только в более густых типах волос, является самым внутренним слоем волос. Он состоит из аморфного кератина и прозрачных вакуолей, заполненных воздухом. Если кто-то разрезал птичье перо и видел его внутреннее устройство — знайте, центр вашего волоса похож на цент пера птицы.
Замечание про жировой слой волос: как и в случае с кожей, липидный слой в волосах выполняет защитную функцию и обеспечивает барьерную функцию. Все липиды волоса можно разделить на три основных группы — структурные липиды, свободные эндогенные липиды и поверхностные липиды. Общее содержание липидов в волосах зависит от возраста, пола и происхождения пациента. Наибольшую долю в объеме липида волоса занимают поверхностные жиры. Состав их аналогичен составу секрета сальных желез кожи головы — триглицериды (41% масс.), свободные жирные кислоты (16%), сложные эфиры воска (25%) и сквален (12%). Кстати соотношение сквален / холестерин в поверхностной гидролипидной пленке является зеркалом биологической активности сальных желез и эпидермиса и иногда используется специализированными трихологическими/дерматологическими лабораториями для изучения состояния кожи головы. Структурные жиры входят в состав межклеточного липопротеинового комплекса (MCC) и присутствуют на поверхности чешуек как эпикутикула. Многие из них жестко связаны с клетками волоса. В основном это свободные жирные кислоты (по большей части 18-метилэйкозановая кислота ~ 18-MEA), керамиды (сфигнолипиды) и холестеринсульфат.
Все липиды волоса можно разделить на три основных группы — структурные липиды, свободные эндогенные липиды и поверхностные липиды. Общее содержание липидов в волосах зависит от возраста, пола и происхождения пациента. Наибольшую долю в объеме липида волоса занимают поверхностные жиры. Состав их аналогичен составу секрета сальных желез кожи головы — триглицериды (41% масс.), свободные жирные кислоты (16%), сложные эфиры воска (25%) и сквален (12%). Кстати соотношение сквален / холестерин в поверхностной гидролипидной пленке является зеркалом биологической активности сальных желез и эпидермиса и иногда используется специализированными трихологическими/дерматологическими лабораториями для изучения состояния кожи головы. Структурные жиры входят в состав межклеточного липопротеинового комплекса (MCC) и присутствуют на поверхности чешуек как эпикутикула. Многие из них жестко связаны с клетками волоса. В основном это свободные жирные кислоты (по большей части 18-метилэйкозановая кислота ~ 18-MEA), керамиды (сфигнолипиды) и холестеринсульфат. Фосфолипиды среди структурных жиров отсутствуют.
Фосфолипиды среди структурных жиров отсутствуют.
Определенная часть жиров находится в организованном супрамолекулярном состоянии (ламеллярная периодичность структурированных липидных бислоев). Изначально многие исследователи предполагали, что липиды волос организованны так же, как и липиды в роговом слое кожи (см. ранее пункт про корнеоциты, гранулы Одланда и жировые ламели-пластины). Но на сегодняшний день считается, что ламеллярные липиды волос представлены в виде гранул или «липидных кристаллов», отличных от ламелей кожи. И ни состав, ни происхождение этих липидов до сих пор не выяснены. Интересным фактом является то, что по данным некоторых исследований организованная фракция волосяных липидо представляет собой бислои производных жирных кислот, в том числе и стеарата кальция (того самого «мыльного камня» или «стеаратной смазки»). Важно то, что стеарат кальция придает липидному слою определенную стабильность кристаллической упаковки и отвечает за функцию структурирования и организации поверхностного липидного компонента, а также играет основную роль в процессах диффузии ионов металлов из водных растворов в волосы человека.
Жировой слой обеспечивает а)придает волосам непроницаемость б)обеспечивает сцепление слоев между собой в)обеспечивает смазку волос ~ придает им эластичность и блеск.
На деле исследований влияния сугубо жесткой воды на характеристики волос немного (чаще изучают накопление каких-нибудь экотоксинов). Те исследования влияния солей жесткости на волосы что имеются сходятся в том, что жесткая вода на нормальные здоровые волосы не влияет. Лишний раз этот тезис подтверждает и статья в международном трихологическом журнале. Ученые провели исследование, в котором сравнили прочность на разрыв волос, обработанных жесткой водой и волос, обработанных дистиллированной водой. Общая продолжительность обработки составляла 10 минут, но исследование проводилось в течение месяца. После окончания обработки ученые исследовали прочность на разрыв и эластичность волос. В результате было установлено, что не существует заметной разницы в эластичности и прочности между волосами вымытыми в жесткой воде и волосами вымытыми в дистиллированной воде.
Но волосы способны забирать из воды кальций/магний (до 10000 ppm) во время гигиенических процедур. Рано или поздно из-за изменения супрамолекулярной структуры поверхностного слоя гладкая здоровая кутикула может превратиться в шероховатую. Визуальное подтверждение этого механизма (=«образование накипи на волосах») показано в статье. Рисунок ниже:
На SEM-снимке видно, что волосы, обработанные водой с высоким содержанием солей кальция и магния выглядят неровными с большим количеством минеральных отложений. Волосы, обработанные мягкой водой, имеют относительно однородную поверхность с меньшим количеством минеральных отложений. Авторы предполагают, что отложения солей на поверхности волос могут в выступать как своеобразные абразивы и вызывать нарушение целостности соседних волос, что приводит сначала к обезвоживанию волоса, а потом и уменьшению толщины волоса.
Логично предположить, что чем выше жесткость воды (=чем больше солей жесткости), тем сильнее будет этот эффект осаждения/абразивности и т. д. Но! Внезапно оказывается что все абсолютно не так.
д. Но! Внезапно оказывается что все абсолютно не так.
Волосы на самом деле способны адсорбировать ионы из водной среды. Чаще всего накопление происходит во внешних гранях кутикулы, где доступно больше анионных групп, с которыми могут связаться ионы. Поскольку изоэлектрический pH волос равен 3,67, при любом другом более высоком значении рН поверхность волоса несет отрицательный заряд и может притягивать катионы кальция и магния (да и любые другие ионы металлов). В дальнейшем они вполне могут себе диффундировать через эпикутикулу и закрепляться в толще волоса.
Чаще всего количество реакционноспособных участков на поверхности волоса, а значит и сорбционная емкость волоса, зависит от количества карбоксильных групп. А количество это находится в прямой зависимости от рН волос — с ростом рН наблюдается усиление ионизации карбоксильных и аминогрупп (электростатически связанных с карбоксильными группами). В противоположность положительно заряженным ионам металлов, неметаллы (например хлорид-ионы) связываются с волосами при более низком pH, за счет того, что карбоксильные группы волос теряют свою активность из-за протонирования.
В целом при одинаковых экспериментальных рН для нормальных (немодифицированных) волос могут наблюдаться различные уровни сорбции катионов металлов функциональными группами кератина, это может зависеть от электростатических взаимодействий, количества водородных связей, эффектов сольватации, конформационных изменений и наличия заметных уровни противоионов. Разные параметры ионизации белковых групп = разная способность связывать катионы.
Для волос же НЕнормальных (модифицированных), т.е. прошедших химическую обработку волос (окрашивание, завивка, выпрямление и т.п.) ситуация немного отличается. При травлении волоса (щелочными аммиачно-пероксидными композициями) пептидные и дисульфидные связи внутри волос и 18-метилэйкозановой кислоты (18-MEA) на поверхности волос будут расщепляться. Это «оголит» анионные карбоксилатные и сульфонатные (цистеиновые) группы которые сделают волосы идеальной катионообменной смолой (см. далее раздел про умягчение воды катионообменными смолами).
Из хороших новостей можно упомянуть то, что волосы, как и любая другая ионообменная смола обладает ограниченной сорбционной емкостью. Поглощение кальция из жесткой и очень жесткой воды одинаково конечно, т.е. связывающая способность волос ограничена химическим состоянием волос (=зависит от того, насколько часто их химически treatment). Независимо от концентрации ионов в воде волосы достигают насыщения (закрытия всех анионных групп) и не связываются после точки насыщения.
Поглощение кальция из жесткой и очень жесткой воды одинаково конечно, т.е. связывающая способность волос ограничена химическим состоянием волос (=зависит от того, насколько часто их химически treatment). Независимо от концентрации ионов в воде волосы достигают насыщения (закрытия всех анионных групп) и не связываются после точки насыщения.
Интересный факт: волосы сорбируют на себе больше кальция чем магния (примерно в соотношении 3:1). Это связано с тем, что у этих ионов различные гидратные радиусы. Катионы меньшего размера обладают бОльшими, плотно удерживаемыми гидратными оболочками из-за высокой плотности заряда. Для крупных катионов все с точностью до наоборот. Так как кальций имеет больший ионный радиус и меньший радиус гидратации чем магний (см. рисунок), то первый легче адсорбируется на полиэлектролитах ~ поврежденных волосах.
Если подвести краткий итог, то можно сказать следующее. Ионы кальция и магния могут вступать во взаимодействие с липидным слоем волос и внедрятся в его глубинную структуру (в виде солей), но по данным некоторых исследований именно эти соли выполняют структурообразующую функцию. Для здоровых и немодифицированных волос влияние жесткой воды практически неощутимо. Но ситуация кардинально меняется, если волосы ранее подвергались химической обработке. Тогда они начинают выступать в качестве адсорбента и накапливать кутикулой соли жесткости, постепенно минерализуясь и превращаясь в «наждачную бумагу» (или в аналог кораллового рифа, там тоже происходит постепенная минерализация). Т.е. связывающая способность волос зависит только от их химического состояния, и не зависит от того, насколько жесткая вода используется для мытья. Волосы будут сорбировать ионы и из мягкой и из жесткой воды одинаково. Жесткую они, фактически, таким образом будут умягчать. Как не дико это звучит, но помыть голову водой без мыла раз, собрать эту воду и помыть еще раз — выглядит достаточно перспективным с точки зрения химии вариантом :). При прочих равных параметрах, волосы людей, которые пользуются водой с более высоким рН (щелочной) будут содержать в себе и на себе больше солей жесткости, чем волосы тех, кто пользуется водой с нейтральной или слабокислой средой.
Для здоровых и немодифицированных волос влияние жесткой воды практически неощутимо. Но ситуация кардинально меняется, если волосы ранее подвергались химической обработке. Тогда они начинают выступать в качестве адсорбента и накапливать кутикулой соли жесткости, постепенно минерализуясь и превращаясь в «наждачную бумагу» (или в аналог кораллового рифа, там тоже происходит постепенная минерализация). Т.е. связывающая способность волос зависит только от их химического состояния, и не зависит от того, насколько жесткая вода используется для мытья. Волосы будут сорбировать ионы и из мягкой и из жесткой воды одинаково. Жесткую они, фактически, таким образом будут умягчать. Как не дико это звучит, но помыть голову водой без мыла раз, собрать эту воду и помыть еще раз — выглядит достаточно перспективным с точки зрения химии вариантом :). При прочих равных параметрах, волосы людей, которые пользуются водой с более высоким рН (щелочной) будут содержать в себе и на себе больше солей жесткости, чем волосы тех, кто пользуется водой с нейтральной или слабокислой средой. И конечно же эта закономерность будет усугубляться со степенью использования химической обработки волос (крашение, выпрямлени и т.п.). А используемая в наших городах умягченная вода (или вода после некоторых станций обезжелезивания, использующих отечественные «катализаторы») часто имеет очень высокий уровень щелочности, вот и сделайте выводы…
И конечно же эта закономерность будет усугубляться со степенью использования химической обработки волос (крашение, выпрямлени и т.п.). А используемая в наших городах умягченная вода (или вода после некоторых станций обезжелезивания, использующих отечественные «катализаторы») часто имеет очень высокий уровень щелочности, вот и сделайте выводы…
А ты, %username%, уже присоединился к движению НЕТ_SLS?
1.2.5 МЯГКОСТЬ ПАВ И ШАМПУНИ БЕЗ СЛЕЗ [Canonical link — Про «шампунь без сульфата»]
В моем случае, за какую химию не возмись — в итоге получится коллоидная. Поэтому к любимой теме — теме поверхностно-активных веществ…
Как ранее упоминалось, жировой слой в коже является защитным барьером. Используя ПАВ, мы этот барьер убираем и запускаем встроенные механизмы компенсации. Поэтому очень часто сухость от мытья кожи обусловлена не жесткостью воды, а влиянием ПАВ. Ведь после того, как ПАВ убрали защитный жир, они проникают в глубокие слои эпидермиса и оказывают действие на него следующим образом:
- Связываются с белками кожи и денатурируют их (как? — см.
 статью)
статью) - Солюбилизируя и дезорганизуя липидные ламели рогового слоя кожи (как? — см. статью)
- Проникая через нарушенный липидный барьер и взаимодействуя с клетками дермы
Замечание про «бабушкино средство для мытья волос»
: c помощью которого умягчали жесткую воду. Я про пропускание воды для умывания через слой золы. Здесь есть принципиальная разница с использованием т.н. «щелока»
Щёлок — водный настой древесной золы, состоящий в растворе в основном из карбонатов калия (поташ) и натрия (сода). Обладает сильнощелочной реакцией. Поэтому раньше использовался для мытья и стирки вместо мыла, для выделки кож и т. д.
Сам настой с одной стороны за счет высокой щелочной реакции работает как ПАВ, омыляя жиры (см. статью Избранные главы коллоидной химии. «Мыльная энциклопедия»), а с другой выступает в роли своеобразного умягчителя жесткой воды убирая в осадок катионы кальция и магния. Так что логично, что таким настоем в дошампуневые времена в деревнях ополаскивали волосы перед окончанием мытья в бане — для смягчения и пушистости. Но, как уже упоминалось ранее, вода с повышенным рН нарушает кожный гомеостаз и ослабляет антибактериальные свойства кожи.
Так что логично, что таким настоем в дошампуневые времена в деревнях ополаскивали волосы перед окончанием мытья в бане — для смягчения и пушистости. Но, как уже упоминалось ранее, вода с повышенным рН нарушает кожный гомеостаз и ослабляет антибактериальные свойства кожи.
В целом любое моющее средство оказывает на кожу некоторое дубящее действие. Например, можно посмотреть работу, в которой было изучено взаимодействие шампуней и мыл с лаурет сульфатом натрия (SLS) с кожей. Установлено, что остатки SLS, оставшиеся на коже после мытья а)изменили вторичную структуру белка, б)солюбилизировали липиды рогового слоя и в) повысили pH поверхности кожи. Так что жесткая вода виновата только в том, что некоторые анионные ПАВ связываются с ионами металлов и оседают на коже как в случае с мылом, но они не так заметны.
Напомню, что относительно кожи, эффект раздражения/разрушения усиливается в ряду неионогенные ПАВ->амфотерные ПАВ->анионные ПАВ->катионные ПАВ (пруф). Т.е. наиболее ядреными являются всенароднолюбимые ЧАС-ы. В статье авторы определили ингибирующие концентрации нескольких технически значимых поверхностно-активных веществ для кератиноцитов. Проверяли лаурилсульфат натрия (SLS), лауретсульфат натрия (SLES), кокоамфоацетат натрия (SCAA), кокамидопропилбетаин (CAPB) и лаурилгликозид/кокогликозид, т.е. все то, что встречается в 99% косметических средств и средств по уходу за кожей. В результате оказалось, что применение ПАВ изменяет уровни экспрессии для ферментов, участвующих в биосинтезе мембранных компонентов, таких как холестерин, керамиды и жирные кислоты. Используя ПАВ мы лишаем свою кожу важных барьерных функций. А в статье исследовали конкретно рассмотрели влияние ПАВ на жиры рогового слоя.
В статье авторы определили ингибирующие концентрации нескольких технически значимых поверхностно-активных веществ для кератиноцитов. Проверяли лаурилсульфат натрия (SLS), лауретсульфат натрия (SLES), кокоамфоацетат натрия (SCAA), кокамидопропилбетаин (CAPB) и лаурилгликозид/кокогликозид, т.е. все то, что встречается в 99% косметических средств и средств по уходу за кожей. В результате оказалось, что применение ПАВ изменяет уровни экспрессии для ферментов, участвующих в биосинтезе мембранных компонентов, таких как холестерин, керамиды и жирные кислоты. Используя ПАВ мы лишаем свою кожу важных барьерных функций. А в статье исследовали конкретно рассмотрели влияние ПАВ на жиры рогового слоя.
Если говорить про частности, то у людей анионные ПАВ чаще всего приводят к дерматитам (доп.инфо), или т.н. афтозным язвам, аля афты/стоматиты и т.п. (доп.инфо).
Ожидаемо, что зная про взаимодействие жесткой воды с самыми распространенными моющими и косметическими средствами на основе лауретсульфата натрия общество проголосовало за бессульфатные шампуни (признаюсь — я тоже это сделал). Правда выбор таких вещей крайне невелик. На рисунке показаны структуры групп специализированных поверхностно-активных веществ, которые используются в продвинутых шампунях и которые нужно искать на первых местах в списке ингредиентов вместо «LAURETH SULFATE», который является самым популярным анионным ПАВ везде.
Правда выбор таких вещей крайне невелик. На рисунке показаны структуры групп специализированных поверхностно-активных веществ, которые используются в продвинутых шампунях и которые нужно искать на первых местах в списке ингредиентов вместо «LAURETH SULFATE», который является самым популярным анионным ПАВ везде.
Алкилглицеридсульфаты являются мягкими ПАВ и при этом вполне сравнимы по моющей способности/способности к пенообразованию с заклеймленными лаурил- и лауретсульфтами. Кокомонглицерид сульфат (I) прекрасно пенится и отлично совместим с кожей в целом и с кожей головы в частности. Но из-за наличия сульфатной группы этот ПАВ чаще всего в «без сульфатов» составы не проскакивает.
В качестве распространенной альтернативы основным анионным ПАВ в специальных «мягких» шампунях и шампунях «без сульфатов» используются различные карбоксилаты. Эфиры карбоксилатов, например та же лаурет-5 карбоновая кислота (II) отлично растворимы в воде по сравнению с привычными карбоксилатами (хозяйственное мыло тоже карбоксилат), и при этом намного менее чувствительны к жесткости воды. Обеспечивают мягкость кожи и хорошие пенообразующие свойства. Карбоксилаты глюкозы, например, лаурилглюкоза карбоксилат (III) обеспечивают мягкость, сравнимую с мягкостью, которую дают неионные ПАВ на основе глюкозы (например, алкилполиглюкозиды — X), но обладают улучшенными пенообразующими свойствами. Другие карбоксилаты (например, ацилглутаматы~лауроилглутамат натрия~IV) и ацилсаркозинат~лауроилсаркозинат натрия~V) — также обеспечивают хорошую мягкость кожи. Кроме того иногда небольшая добавка алкилглутамата к привычной системе из сульфата ацилового эфира и кокамидопропилбетаина снижает ингибирование триптического фермента рогового слоя лаурилэфирсульфатом натрия и предотвращает сухость кожи, вызванную ПАВ.
Обеспечивают мягкость кожи и хорошие пенообразующие свойства. Карбоксилаты глюкозы, например, лаурилглюкоза карбоксилат (III) обеспечивают мягкость, сравнимую с мягкостью, которую дают неионные ПАВ на основе глюкозы (например, алкилполиглюкозиды — X), но обладают улучшенными пенообразующими свойствами. Другие карбоксилаты (например, ацилглутаматы~лауроилглутамат натрия~IV) и ацилсаркозинат~лауроилсаркозинат натрия~V) — также обеспечивают хорошую мягкость кожи. Кроме того иногда небольшая добавка алкилглутамата к привычной системе из сульфата ацилового эфира и кокамидопропилбетаина снижает ингибирование триптического фермента рогового слоя лаурилэфирсульфатом натрия и предотвращает сухость кожи, вызванную ПАВ.
Сульфонаты можно рассматривать как альтернативу первичным анионным поверхностно-активным веществам для продуктов, не содержащих SLES. Существует множество подклассов сульфонатов, включая таураты, сульфоацетаты, сульфосукцинаты и изетионаты. Таураты (например, метилкокоилтаурат натрия) эффективны в качестве основных анионных поверхностно-активных веществ для шампуней.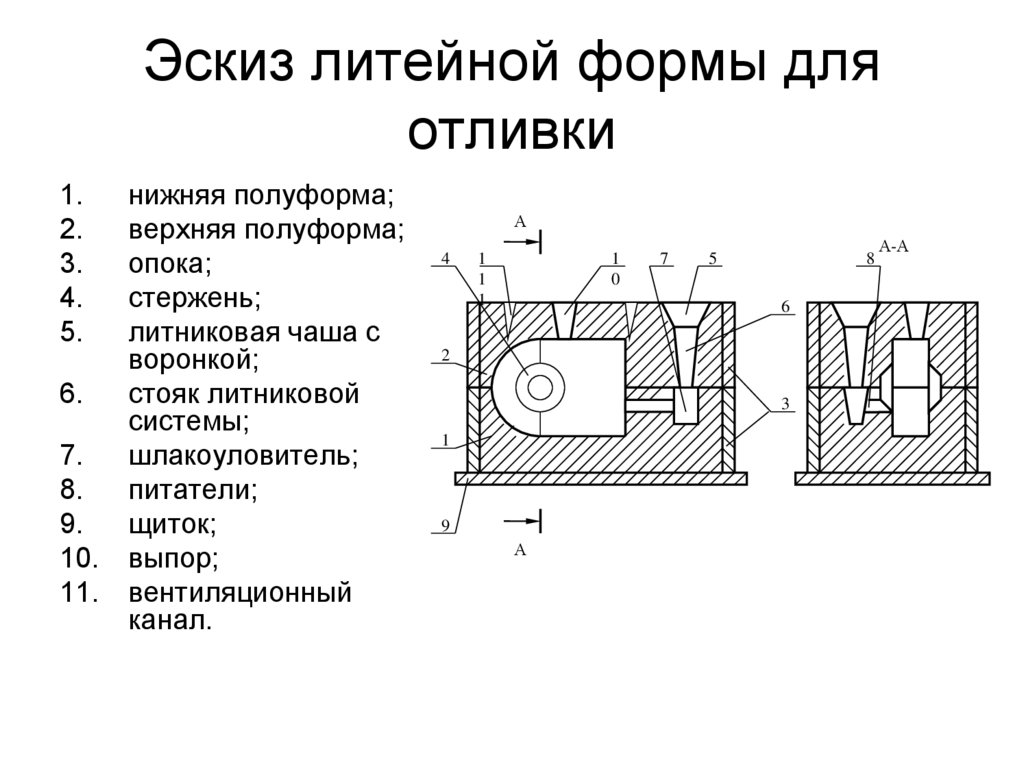 Они обладают хорошей мгновенной пеной и химически стабильны в широком диапазоне pH. Сульфоацетаты (например, лаурилсульфоацетат натрия) и сульфосукцинаты (например, лаурилсульфосукцинат динатрия) можно использовать в более мягких шампунях, не содержащих SLES. В отличие от тауратов, ацильная хвостовая группа сульфоацетатов и сульфосукцинатов присоединяется к головной группе через сложноэфирную связь, что делает их химически менее стабильными. Сульфосукцинаты очень мягки для кожи и глаз и широко используются в детских шампунях «без слез».Однако их нелегко загустить, что увеличивает стоимость составов. Изетионаты (например, лауроилизетионат натрия и лауроилметилизетионат натрия) традиционно использовались для изготовления синтетических мыльных брусков с моющими средствами и гелей для душа и оказывали мягкое воздействие на кожу. В последнее время они вызвали большой интерес как подходящие заменители сульфатов в шампунях «без сульфатов». Они хорошо работают как первичные поверхностно-активные вещества и дают хорошую пену.
Они обладают хорошей мгновенной пеной и химически стабильны в широком диапазоне pH. Сульфоацетаты (например, лаурилсульфоацетат натрия) и сульфосукцинаты (например, лаурилсульфосукцинат динатрия) можно использовать в более мягких шампунях, не содержащих SLES. В отличие от тауратов, ацильная хвостовая группа сульфоацетатов и сульфосукцинатов присоединяется к головной группе через сложноэфирную связь, что делает их химически менее стабильными. Сульфосукцинаты очень мягки для кожи и глаз и широко используются в детских шампунях «без слез».Однако их нелегко загустить, что увеличивает стоимость составов. Изетионаты (например, лауроилизетионат натрия и лауроилметилизетионат натрия) традиционно использовались для изготовления синтетических мыльных брусков с моющими средствами и гелей для душа и оказывали мягкое воздействие на кожу. В последнее время они вызвали большой интерес как подходящие заменители сульфатов в шампунях «без сульфатов». Они хорошо работают как первичные поверхностно-активные вещества и дают хорошую пену. Изетионаты обычно лучше всего использовать при pH от 6,0 до 8,0 для предотвращения гидролиза сложноэфирной связи, которая присоединяет головную группу к ацильной цепи. Перспективным вариантом является лауроилметилизетионат натрия. Он лучше растворяется в воде, чем лауроилизетионат натрия, при этом работает в более широком диапазоне рН и может загущаться хлоридом натрия.
Изетионаты обычно лучше всего использовать при pH от 6,0 до 8,0 для предотвращения гидролиза сложноэфирной связи, которая присоединяет головную группу к ацильной цепи. Перспективным вариантом является лауроилметилизетионат натрия. Он лучше растворяется в воде, чем лауроилизетионат натрия, при этом работает в более широком диапазоне рН и может загущаться хлоридом натрия.
В дополнение к различным специализированным анионным поверхностно-активным веществам, широкий спектр неионных поверхностно-активных веществ может также включаться в различные мягкие шампуни и шампуни без слез. Правда это зачастую повышает стоимость конечно продукта. В большинстве случаев неионные ПАВ вводятся как вторичные поверхностно-активные вещества. Популярные классы неионогенных веществ для шампуней — это алкилполиглюкозиды и ацилглюкамиды. Алкилполиглюкозиды (например, кокоглюкозид и лаурилглюкозид) обычно включают для повышения мягкости и большей «экологичности» состава. Алкилполиглюкозиды являются очень хорошими солюбилизаторами масел и могут быть используется в шампунях для глубокого очищения (т. н. «детоксы»). Пенообразующие свойства алкилполиглюкозидов не такие сильные, как у алкилсульфатов или сульфатов алкиловых эфиров и кроме того эти ПАВ теряют стабильность при pH < 5. Ацилглюкамиды (например, кокоилметилглюкамид) также получают в основном из природных возобновляемых источников, они считаются мягкими ПАВ и как утверждают производители, пенятся лучше, чем алкилполиглюкозиды, при добавлении в составы на основе сульфата алкилового эфира.
н. «детоксы»). Пенообразующие свойства алкилполиглюкозидов не такие сильные, как у алкилсульфатов или сульфатов алкиловых эфиров и кроме того эти ПАВ теряют стабильность при pH < 5. Ацилглюкамиды (например, кокоилметилглюкамид) также получают в основном из природных возобновляемых источников, они считаются мягкими ПАВ и как утверждают производители, пенятся лучше, чем алкилполиглюкозиды, при добавлении в составы на основе сульфата алкилового эфира.
В Беларуси например местная косметическая компания Белита выпускает лишь один вид бессульфатного шампуня, который стоит дороже чем всякие Head&Shoulders и все такое (на самом деле всего порядка 10 BYN, т.е. 4$). В состав «Белита Organic» входят: кокамидопропилбетаин, динатрия кокоамфодиацетат, натрия лаурил глюкоза карбоксилат, лаурил глюкозид, PEG-120 метил глюкоза триолеат, лимонная кислота, поликватерниум-10, тетрасодиум глютамат диацетат.
Та же «экологичная» Natura Siberica может называться «без SLЕS» формально, т.к. например в составе уже содержит лаурет сульфат магния (! — «готовый мыльный камень»), кокамид DEA, кокамидопропилбетаин, лаурил глюкозид. MLES != SLES, но мы то знаем…
MLES != SLES, но мы то знаем…
Вообще возможно (теоретически) следующее допущение: «мягкий шампунь» = «шампунь без слез» = «sulfate free~без сульфатов». Но практически, производители идут на разные ухищрения, вроде разбавления сульфатов кокамидопроприлбетаинов и заменой лауретсульфата натрия на лаурет сульфат магния. В общем, нужно все равно сверятся с составом.
Так что как в отделе косметики для взрослых я не искал, так ничего интересного и не нашел (несмотря на очень порядочный разброс цен с примерно одинаковыми составами). Пришлось пойти в отдел косметики для детей/младенцев. Уж для этой категории то «без слез» актуальнее всего чего только можно. Каково же было мое удивление, когда составы детских шампуней практически продублировали составы шампуней для взрослых (но цена меньше ибо гораздо меньше объем). Здесь уж я не удержался (дети все-таки) и сфотографировал ассортимент, а потом его кратко проанализировал. На картинке ниже зелеными рамками обведены мягкие ПАВ, о которых я упоминал в заметке. Красные рамки = табу (~будут вызывать раздражение слизистой и оказывать все эффекты ПАВ на белки кожи и т.п.)
Красные рамки = табу (~будут вызывать раздражение слизистой и оказывать все эффекты ПАВ на белки кожи и т.п.)
Что мы видим? Видим то, что красные рамки отсутствуют только у брендовых шампуней — номера 2-3-7 (а это Shauma KIDS Vegan (для девочек/для мальчиков) и детский шампуньJohnson&Johnson). Отечественные производители идут на всяческие ухищрения, в основном разбавляют дешевый лаурет сульфат «следами» (на самом деле не известно сколько там чего конкретно) мягких ПАВ, и используют вместо натриевой соли соль магниевую и аммония и т.п. Интересный ход — использование кокомидопропил бетаина и кокоамфоацетата натрия, которые являются амфотерными ПАВ и имеют слабую пенообразующую способность (почти как настойка мыльного корня). Учитывая что остальные мягкие ПАВ тоже не особо пенятся, создать эффект «настоящего» шампуня тяжело. Потому что нужно держать уровень цены. Подытоживая можно сказать следующее — мягкие шампуни найти можно. Пока еще можно в детском отделе. Но если импортозамещение будет и дальше иметь место быть — нашей коже (и липидному барьеру на ней) придется туго. И при всем этом я еще не касался катионных ПАВ (ЧАСы), которые, как указывалось выше, даже хуже чем анионные «сульфаты-и-все-все-все». Не трогал, потому что пандемия же… А четвертичные аммониевые соединения — одни из видных «коронавирусных» бойцов.
Но если импортозамещение будет и дальше иметь место быть — нашей коже (и липидному барьеру на ней) придется туго. И при всем этом я еще не касался катионных ПАВ (ЧАСы), которые, как указывалось выше, даже хуже чем анионные «сульфаты-и-все-все-все». Не трогал, потому что пандемия же… А четвертичные аммониевые соединения — одни из видных «коронавирусных» бойцов.
Из простыни текста следует что, жесткая вода может действовать на кожу (!) изменяя градиенты концентраций ионов в эпидермисе и вызывая соответственный биологический ответ. Но! Но во-первых, процесс изменения градиента под воздействием «внешних» ионов должен протекать длительное время (=в жесткой воде нужно жить), а во-вторых кальций и магний вызывают ингибирование процесса шелушения кожи. Т.е. если наблюдаются какие-то эффекты, которые, как вам кажется, связаны с жесткой водой — попробуйте заменить моющее средство. Скорее всего причина раздражения и/или сухости кожи в том, что ПАВ денатурируют кожные белки, или какие-то компоненты изменяют рН кожи.
1.2.6 СТИРКА/МОЙКА
Как уже упоминалось ранее, «стирка и мытье» — это основной камень преткновения, когда разговор заходит про жесткую воду. При стирке в жёсткой водой сложно достигнуть эффекта отбеливания, невозможно качественно отполоскать бельё, что приводит к потере исходного цвета ткани: белые ткани приобретают сероватый оттенок, цветные – тускнеют. В волокнах одежды могут накапливаться отложения, из-за чего они становятся грубее (возникновение шероховатостей и т.п.) и могут вызывать раздражение для чувствительной кожи. Все это заставляет конечного потребителя использовать больше моющего средства, дольше стирать вещи, расходовать больше электроэнергии.
Если с обычным мылом все примерно ясно (=выпадает осадок, мыло расходуется вхолостую, не на удаление грязи, а на удаление ионов кальция/магния из воды), то насчет других ПАВ информация разнится. В целом, в присутствии солей жесткости поверхностное натяжение растворов анионных ПАВ существенно меняется — увеличивается для раствора олеата натрия, и уменьшается для растворов додецилбензолсульфоната натрия (LAS, «сульфонол») и лаурил сульфата натрия. В случае неионных ПАВ соли жесткости не оказывают никакого влияния на поверхностное натяжение. В случае анионных ПАВ образуются нерастворимые осадки (вроде Ca(LAS)2, которые осаждаются на волокнах хлопчатобумажной ткани и не удаляются после полоскания. На рисунке показана хлопчатобумажная ткань для полотенец до и после стирки в растворе сульфонола в жесткой и дистиллированной воде.
В случае неионных ПАВ соли жесткости не оказывают никакого влияния на поверхностное натяжение. В случае анионных ПАВ образуются нерастворимые осадки (вроде Ca(LAS)2, которые осаждаются на волокнах хлопчатобумажной ткани и не удаляются после полоскания. На рисунке показана хлопчатобумажная ткань для полотенец до и после стирки в растворе сульфонола в жесткой и дистиллированной воде.
В итоге из-за осаждения нерастворимых соединений на ткани изменяются ее механические свойств (возрастает жесткость и шероховатость) и водопоглощение. С увеличение жесткости воды увеличивается и толщина отложений. Стоит отметить, что исследования проводились на индивидуальных ПАВ, что довольно таки редкое явление в современном мире. Чаще всего в большинстве распространенных моющих средств и порошков используются комбинации ПАВ, а также комплексообразователи (о них будет расказано далее). Ну а в целом, если есть проблема с расходом моющих средств из-за жесткой воды — лучше для стирки использовать неионогенные ПАВ.
1.2.7 ТАМ ГДЕ ЖЕСТКАЯ ВОДА — ДРУГ
Оперируя тезисом «жесткая вода = проблема» я все время пытался найти вред, который наносит жесткая вода человеку. Подразумевалось, что мягкая вода — друг и помощник. Но это не так, мягкая вода (в зависимости, конечно же, от степени ее мягкости) не только вымывает минералы из организма человека, но и способствует коррозии (подробнее про это в разделе об оценке качества воды). Например, мягкая вода с жесткостью менее 2 мг-экв/л (<2°Ж) имеет низкую кислотно-щелочную буферность, которую обеспечивают гидрокарбонаты и может, в зависимости от уровня рН и ряда других факторов, оказывать сильное коррозионное воздействие на водопроводные трубы. Поэтому, в ряде применений (особенно в теплотехнике) иногда приходится проводить специальную обработку воды с целью достижения оптимального соотношения между жесткостью воды и ее коррозионной активностью (балансировку воды).
С этими же буферными свойствами связано и то, что жесткая вода больше подходит для приготовления кофе. Например, согласно пресс-релизу Американского химического общества, с жесткой водой вкус кофе получается более насыщенным, так как кофеин связывается с магнием во время варки. Эта тем вообще достаточно обширна и лучше всего описана в книге Максвелла Колонна-Дэшвуда и Кристофера Хэндона «Вода для кофе. Наука. История. Руководство» (в англ. Maxwell Colonna Dashwood, Christopher H Hendon — Water For Coffee). Там же авторы даже предлагают специальную диаграмму, для рассчета подходящей жесткости воды. А не могу назвать себя кофеманом, если таковые специалисты имеются среди читателей — проверьте и отпишитесь в комментариях.
Например, согласно пресс-релизу Американского химического общества, с жесткой водой вкус кофе получается более насыщенным, так как кофеин связывается с магнием во время варки. Эта тем вообще достаточно обширна и лучше всего описана в книге Максвелла Колонна-Дэшвуда и Кристофера Хэндона «Вода для кофе. Наука. История. Руководство» (в англ. Maxwell Colonna Dashwood, Christopher H Hendon — Water For Coffee). Там же авторы даже предлагают специальную диаграмму, для рассчета подходящей жесткости воды. А не могу назвать себя кофеманом, если таковые специалисты имеются среди читателей — проверьте и отпишитесь в комментариях.
кофе-табличка
Подбор подходящей жесткости для варки кофе. Взято отсюда
Максимальная общая жесткость и минимальная карбонатная жесткость (точка А) = Не экстрагируются сильные кислоты, кислотность в кофе получается очень приглушенной.
Максимальная карбонатная жесткость и минимальная общая жесткость (точка B) = Не экстрагируются сложные вкусоароматические вещества. Не сформировалось тело напитка. Буфер нейтрализовал слабые положительные кислоты.Вкус плоский, едкий, пережаренный.
Не сформировалось тело напитка. Буфер нейтрализовал слабые положительные кислоты.Вкус плоский, едкий, пережаренный.
Минимальная общая жесткость и минимальная карбонатная жесткость (точка С) = Вода становится слишком пустой. Она не может извлечь нужное количество соединений из кофе из-за недостаточного количества минералов. Плохо сформированное тело кофе. Вкус пустой, слегка уксусный.
Максимальная карбонатная жесткость и максимальная общая жесткость (точка D) = Из-за максимальной KH вероятность образования накипи резко возрастает. Чтобы компенсировать такую высокую буферную способность, требуется очень высокая экстракция, поэтому GH тоже должна быть высокой. Из-за высокого содержания минеральных веществ вода быстро переэкстрагирует кофе. Вкус горький, терпкий, пустой.
По аналогичным кофейным причинам, жесткая вода может пригодится тем, кто варит пиво, подробнее про все нюансы в статьях один и два.
На этом рассмотрение «малых зол» жесткой воды закончено, далее перейдем к «большому злу» в виде влияния последствий использования жесткой воды на бытовую технику и водопроводы.
2. Про Ее Вездесущество Накипь
К этому важному и всеобъемлющему явлению в нашей жизни тоже нужно подойти издалека. Чтобы стало понятно, что возникает она не на простом месте. Если говорить глобально, то причиной возникновений отложений в воде является то, что все соли растворяются по разному. Существует т.н. «нормальная» растворимость и растворимость «ретроградная» или «обратная». Соли с «нормальной» растворимостью лучше растворяются в воде с повышением температуры, и, таким образом, скорее всего будут осаждаться на холодных поверхностях. Соединения с «обратной» растворимостью лучше растворяются при охлаждении и формировать отложения будут на теплых поверхностях. У большинства привычных соединений растворимость увеличивается с ростом температуры (эндотермическая реакция растворения). Если вы хотите получить раствор с высоким содержанием хлорида натрия, следует подогревать воду, в которой ведется растворение. Для получения раствора с максимально возможной концентрацией карбоната кальция жесткую воду следовало бы охлаждать. Такими же свойствами обладает и карбонат магния, сульфат кальция и еще некоторые соли, излишек которых при изменении температуры осаждается в виде накипи на теплообменную поверхность.
Такими же свойствами обладает и карбонат магния, сульфат кальция и еще некоторые соли, излишек которых при изменении температуры осаждается в виде накипи на теплообменную поверхность.
Пример из жизни. Если взять один литр очень жесткой воды, в котором содержится 340 мг кальция и в этом литре воды растворится углекислый газ, образовав 510 мг карбонат-иона, то в растворе окажется при 100°С (растворимость 2 мг/л) 848 мг «лишнего» карбоната кальция. После кристаллизации этого карбоната из 1 м3 воды на 1 м2 теплообменной поверхности образуется слой накипи толщиной 0,3 мм. Осаждения всего «избыточного» карбоната кальция из 100 м3 воды с такой жесткостью покроет 1 м2 теплообменной поверхности слоем накипи в 30 мм.
Что добавляет масла в огонь, так это то, что карбонат кальция может иметь кучу различных, т.н. «полиморфных» модификаций для которых отличаются температурные коэффициенты, кинетические параметры осаждения и т. д. и т.п. Отличаются параметры = изменяется стабильность твердых фаз при различных условиях = образуется разные виды накипи. Это важно потому что зная своего врага в лицо с ним легче бороться.
д. и т.п. Отличаются параметры = изменяется стабильность твердых фаз при различных условиях = образуется разные виды накипи. Это важно потому что зная своего врага в лицо с ним легче бороться.
2.1. ВВЕДЕНИЕ В МИНЕРАЛОГИЮ НАКИПИ [Canonical link — Минералогия накипи]
Как уже было сказано ранее, любой карбонат кальция может существовать в виде различных полиморфных форм, каждая из которых образует отложения своего типа (с различной механической прочностью и т.п.). Наиболее распространенными являются три полиморфа — кальцит, арагонит и ватерит (на картинке слева направо).
Среди них арагонит и кальцит являются более термодинамически стабильными структурами, и они чаще всего встречаются в природе. Стабильность и образование этих фаз сильно зависят от температуры и концентрации. Кальцит особенно стабилен при комнатной температуре, арагонит может образовываться при высоких температурах. Ватерит, также известный как μ-CaCO3, встречается в природе реже, потому что это наименее термодинамически стабильный полиморф, который может быстро превращаться в кальцит и арагонит в водном растворе (в арагонит — за 60 минут при 60 °C, в кальцит — за 24 часа при комнатной температуре), кроме того ватерит встречается при более высоких уровнях пересыщенности раствора. Термодинамическая стабильность фаз карбоната кальция в водных растворах увеличивается в порядке ватерита-арагонита-кальцита, а растворимость этих фаз уменьшается в том же порядке.
Термодинамическая стабильность фаз карбоната кальция в водных растворах увеличивается в порядке ватерита-арагонита-кальцита, а растворимость этих фаз уменьшается в том же порядке.
Зависимость растворимости полиморфных форм карбоната кальция от температуры
Кроме того, существуют три гидратированных полиморфа, включая моногидрокальцит (CaCO3хH2O), гексагидратную форму (CaCO3х6H2O) или минерал икаит, а также аморфный карбонат кальция. Аморфный карбонат кальция образуется как промежуточная фаза перед превращением в одну из основых кристаллических фаз, сам по себе он является термодинамически нестабильным и может самопроизвольно кристаллизоваться при суспендировании в водном растворе при комнатной температуре.
Ватерит и арагонит принадлежат к гексагональной (сферической или дискообразной) и ромбической (игольчатой) кристаллической структуре, кальцит принадлежит к гексагонально-ромбоэдрической системе, которая может реализоваться в любой из более чем 300 различных форм, например ромбоэдрические (кубические), усеченно-призматические, скаленоэдрические (розетчатые), сферолитовые и цепочечные агломерации.
Кристаллические структуры (a) кальцита, (b) арагонита и © фатерита. Атомы Ca отображаются в виде больших желтых шариков, а карбонатные группы показаны серыми (углерод) и красными (кислород) шарами.
Зачем нужны все эти минералогические подробности? А нужны они потому, чтобы было ясно, что от формы в которую перейдет карбонат кальция будет зависеть «жесткость» скелета слоя накипи и то, насколько тяжело этот слой будет удалить.
На механизмы образования накипи могут влиять многие факторы, начиная от скорости потока воды, и заканчивая присутствием различных микропримесей. Например, в статье показано, что добавление ионов цинка Zn2+ или меди Cu2+ в воду позволяет контролировать рост отложений карбоната кальция. В обычных условиях наиболее термодинамически стабильным является кальцит, но в присутствии Mg2+, Ni2+, Co2+, Fe3+, Zn2+ и Cu2+ арагонит стабилизируется и становится основной фазой. Что это дает? Дает это то, что из-за игольчатой структуры образуется накипь с более подвижной (=легче удалять) стуруктурой.
Что это дает? Дает это то, что из-за игольчатой структуры образуется накипь с более подвижной (=легче удалять) стуруктурой.
Кстати, тот самый сопутствующий везде кальцию ион магния также способствует образованию арагонита, а не кальцита. Во многих работах подтверждается, что добавка магния заметно подавляет зародышеобразование и рост кристаллов кальцита и иногда вызывает образование игольчатых магнезиальных кальцитов. Введение иона магния, имеющего меньший ионный радиус по сравнению с ионом кальция, вызывает заметную деформацию решетки на поверхности кальцита, препятствуя дальнейшему росту кристаллов.
Помимо старого доброго карбоната кальция в домах, могут иметь место и отложения более сложной структуры, например такие, как возникают в нефтегазовых трубопроводах.
Часто такие неорганические отложения образуются при смешивании пластовой воды с различными рассолами. Происходит перенасыщение и последующее отложение неорганических солей. Наиболее распространенными типами неорганических отложений, известных в нефтегазовой промышленности, являются карбонаты и сульфаты, часто встречаются сульфиды. В целом все очень сильно зависит от характеристик воды. Например, магнетит или феррит никеля образуются из очень чистой воды с низким содержанием железа. В обычной жизни такие минералы встретить сложно, наверное только в том случае, если использовать «советы знатоков» по смыванию накипи силикатным клеем и т.п. Накипь не смоем, а вот пару-тройку новых минералов в трубы добавим…
В целом все очень сильно зависит от характеристик воды. Например, магнетит или феррит никеля образуются из очень чистой воды с низким содержанием железа. В обычной жизни такие минералы встретить сложно, наверное только в том случае, если использовать «советы знатоков» по смыванию накипи силикатным клеем и т.п. Накипь не смоем, а вот пару-тройку новых минералов в трубы добавим…
Грозная мочА или заметка про струвит
Нельзя, говоря про накипи и отложения, не упомянуть и такой «рукотворный» (в некотором роде) минерал, как струвит. Он же магний-аммиак-фосфатный комплекс MgNH4PO4·6H2O. Минерал это представляет собой пирамидальные кристаллы от белого до коричневого цвета. Минерал мягкий (твердость по Моосу = 1,5-2), плохо растворимый в нейтральных и щелочных условиях, но легко растворимый в кислоте. Назван в честь известного географа Генриха Кристиана Готфрида фон Струве (НЕ путать, с Фридрихом Георгом Вильгельмом Струве, чья дуга Струве).
Струвит формирует отложения в унитазах и писуарах (т.н. «мочевой камень»), а также составляет примерно 10% камней, образующихся в мочевом пузыре и почках. Образованию этото минерал в основном обязан болезнетворным бактериям, которые вырабатывают аммиак, гидролизуя мочевину. Щелочная среда мочи и высокий унос магния (например из-за диеты с высоким содержанием магния~растительной диеты~высоко-минерализованной «жесткой воды»). На картинке ниже кристаллы, которые формирует минерал при разных рН (мерная шкала — 100 мкм)
В отличие от человеческих уролитов, в которых струвит не является основным минералом, у животных он превалирует (у собак, в частности).
Уролит (лат. Urolithus, англ. Urolite — мочевой камень) — твёрдый биогенный минеральный конкремент в моче животных и человека.
Накопление кристаллов струвита у домашних кошек наблюдается даже при отсутствии болезнетворных бактерий. Причиной тому является белок кауксин (англ. сauxin). Этот белок выделяется с мочой из клеток почечных канальцев. Единственные млекопитающие, у которых в моче присутствует кауксин — это кошки. В 2008 году было установлено, что кауксин в моче кошек может выступать в качестве матрицы, на которой формируются кристаллы струвита и быть одной из причин образования мочевых камней у кошек. Симптомы струвитообразования включают затрудненное мочеиспускание (которое часто ошибочно принимается за запор) и/или кровь в моче (гематурия). Хорошая новость для всех кошатников в том, что если раньше для удаления кристаллов «струвитной накипи» требовалась операция, то теперь достаточно специальной «безмагниевой» диеты с низким рН продуктов.
сauxin). Этот белок выделяется с мочой из клеток почечных канальцев. Единственные млекопитающие, у которых в моче присутствует кауксин — это кошки. В 2008 году было установлено, что кауксин в моче кошек может выступать в качестве матрицы, на которой формируются кристаллы струвита и быть одной из причин образования мочевых камней у кошек. Симптомы струвитообразования включают затрудненное мочеиспускание (которое часто ошибочно принимается за запор) и/или кровь в моче (гематурия). Хорошая новость для всех кошатников в том, что если раньше для удаления кристаллов «струвитной накипи» требовалась операция, то теперь достаточно специальной «безмагниевой» диеты с низким рН продуктов.
2.2 НАКИПЬ, ТЕПЛОПРОВОДНОСТЬ И ПОТЕРИ ЭЛЕКТРИЧЕСТВА [Canonical link — Минералогия накипи]
Карбонаты кальция и магния откладываются в виде грязно-белых твердых частиц на внутренних поверхностях труб и теплообменников. В результате накипь ограничивает поток воды в трубах. В бойлерах отложения снижают эффективность нагрева и обуславливают перегрев металлических компонентов. В системе под давлением такой перегрев может привести к выходу котла из строя. Основная проблема накипи в том, что у нее низкая теплопроводность, а значит значительно снижается интенсивность теплообмена, возникает большой перерасход топлива и перегрев металлических поверхностей.
В бойлерах отложения снижают эффективность нагрева и обуславливают перегрев металлических компонентов. В системе под давлением такой перегрев может привести к выходу котла из строя. Основная проблема накипи в том, что у нее низкая теплопроводность, а значит значительно снижается интенсивность теплообмена, возникает большой перерасход топлива и перегрев металлических поверхностей.
Образование накипи приводит к огромным эксплуатационным потерям, во многом напоминающим коррозию. Например, по одной из оценок, потери из-за загрязнения теплообменников в промышленно развитых странах составляют около 0,25% их ВВП. В другой статье экономические потери из-за загрязнения котлов и турбин на коммунальных предприятиях Китая были оценены в 4,68 миллиарда долларов (на 2006 год), что составляет около 0,169% ВВП страны.
В целом в зарубежной «рекламной периодике» достаточно много картинок и постеров, показывающих, как связана накипь и затраты конечного пользователя
Например вот так
Мне встретилась интересная статья, где исследователи провели моделирование потерь на примере усредненных трубчатого и пластинчатого теплообменников из меди и стали. Было принято, что в накипи на теплообменниках присутствуют формы кальцита, арагонита, доломита и смеси всего выше перечисленного. На картинке кристаллы кальцита (а), арагонита (б), ватерина (в) и доломита (г):
Было принято, что в накипи на теплообменниках присутствуют формы кальцита, арагонита, доломита и смеси всего выше перечисленного. На картинке кристаллы кальцита (а), арагонита (б), ватерина (в) и доломита (г):
Теплопроводности отложений этих минералов следующие:
Для рассчетов использовалось допущение о том что используются пластинчатый и трубчатый теплообменники из меди (теплопроводность 395 Вт/мK) и нержавеющей стали (теплопроводность 26 Вт/мK). Для пластинчатого теплообменника толщина принималось равной 3 мм, для трубчатого — внутренний диаметр равен 10 мм, внешний диаметр 13 мм. На картинке под спойлером показаны потери теплопередачи на теплообменниках в зависимости от толщины слоя накипи
потери теплопередачи vs слой накипи
Далее исследователи взяли условное среднее энергопотребление (для Словении, но думаю что у нас оно примерно такое же) для электрического бойлер = 1080 кВтч/год, для посудомоечной машины = 410 кВтч/год, и для стиральной машины = 300 кВтч/год и рассчитали потребление энергии с учетом слоя накипи на нагревательных элементах. Под спойлером — графики:
Под спойлером — графики:
потребление энергии vs слой накипи
Выводы получились следующие. При слое накипи на теплообменнике всего в 3 мм теплопередача снижается на 25–60% в случае пластинчатого теплообменника, или на 10-50% в случае трубчатого теплообменника (т.е. трубчатые немного эффективнее в этом плане). Также исследователи выяснили, что после 300 циклов стирки при 95 °С на ТЭНе образуется слой накипи в 15 мм. Бойлер и посудомоечная машина оказались устойчивее, у них на теплообменниках накипь составила от 3 до 5 мм. Авторы предлагают такое допущение «если считать, что в каждой из 670 000 семей в Словении есть одна стиральная машина, один бойлер и одна посудомоечная машина, то из-за выпадения накипи в год будет наблюдаться перерасход энергии равный 10 000 кВтч. Цифры огромные. Честно говоря, прочитав эту статью я подумал что не стоит „гоняться за журавлем“ в небе в день Земли, нужно просто сесть и убрать накипь с теплообменников бытовой техники…
3.
 Оценка качества воды
Оценка качества воды Ну вот, с врагами рода человеческого определись (=гештальт „кто виноват“ закрыт). Теперь самое время переходит к пункту „что делать“. И здесь первое что нужно — это оценить качество используемой воды. Сделать это не так то и просто (если уж подходить серьезно).
Очень часто многие из продавцов фильтров или „экспертов водоканала“ выдают с важными лицами цифры по жесткости воды (=градусы жесткости) и многозначительно предлагают установить фильтры от „карманной“ фирмы. Поэтому чаще всего рядовой житель города с жесткой водой толком не понимает, что эти цифры ему дают. А дело здесь в том, что само по себе показание жесткой воды неинформативно. Как я упоминал выше потому что если вода слишком мягкая — это коррозия, слишком жесткая — это накипь. Для того, чтобы понять кто есть когда, градусов жесткости недостаточно, нужны специальные индексы. О них далее.
Итак, при отстутствии детальных лабораторных данных, ТТХ воды допускается определять по индексу насыщения карбонатом кальция. Одним из параметров, применяемых для оценки систем водоснабжения на вероятность коррозии или на вероятность образования отложений карбоната кальция, является индекс стабильности Ланжелье.
Одним из параметров, применяемых для оценки систем водоснабжения на вероятность коррозии или на вероятность образования отложений карбоната кальция, является индекс стабильности Ланжелье.
Индекс Ланжелье (LSI)
В 1936г. американский ученый Ланжелье (W.F. Langelier) предложил использовать разработанную им формулу для оценки термостабильности раствора. Формула основана на определении степени насыщения раствора карбонатом кальция. Нестабильность раствора приводит или к образованию накипи или к коррозии. Индекс по сей день используется специалистами по водоподготовке. Для определения индекса Ланжелье необходимы следующие параметры:
— текущее значение рН воды (водородный показатель) при температуре 25°C,
— общее солесодержание воды в г/л (по сухому остатку или производное от электрической — проводимости воды) = TDS в мг/л или проводимость раствора (в mS/m), умноженная на 7,
— температура раствора в °C,
— жесткость по карбонату кальция (содержание кальция Ca2+) в мг/л,
— общая щелочность по HCO3– в мг/л.
С помощью формул определяются вспомогательные коэффициенты и рассчитывается промежуточное значение — pHs. Фактически индекс Ланжелье — это разница между измеренным рН0 воды в системе и значением рНs воды, который бы был при равновесном насыщении данной воды карбонатом кальция (рНs = pH насыщения).
LSI = pH0 – pHs, где
pH0 — значение водородного показателя, измеренное с помощью рН-метра;
pHs — значение водородного показателя в предполагаемых условиях насыщения данной воды карбонатом кальция.
pHs = (9.3 + A + B) – (C + D)
A = (Log10 [TDS=общее солесодержание воды] – 1) / 10
B = -13.12 x Log10 (°C + 273) + 34.55
C = Log10 [жесткость по карбонату кальция (содержание кальция Ca2+)] – 0.4
D = Log10 [общая щелочность в эквиваленте карбоната кальция]
Если LSI = 0, вода считается нейтральной или находится в состоянии химического равновесия. В противном случае, когда LSI <0, вода имеет тенденцию к коррозии, а при LSI> 0 вода является перенасыщенной карбонатом кальция, и может происходить образование накипи. Для тех, кому лень все рассчитывать вручную — есть калькулятор для рассчета индекса Ланжелье
В противном случае, когда LSI <0, вода имеет тенденцию к коррозии, а при LSI> 0 вода является перенасыщенной карбонатом кальция, и может происходить образование накипи. Для тех, кому лень все рассчитывать вручную — есть калькулятор для рассчета индекса Ланжелье
Иногда для упрощенных рассчетов может хватить и экспресс-таблицы:
Таблица для экспресс-расчета LSI
Тесно связан с индексом Ланжелье и индекс стабильности Ризнара.
Индекс стабильности Ризнара (RSI)
В 1944г. Ризнер (Ryzner) обратил внимание на то, что слой накипи на поверхности металла может препятствовать коррозии. Основываясь на коэффициентах расчета индекса Ланжелье, Ризнер предложил свою формулу расчета стабильности раствора. Формула расчета индекса стабильности Ризнера:
RSI = 2pHs – pH0
Его значение показывает:
2pHs – pH0 > 6 раствор склонен к коррозии
2pHs – pH0 = 6 раствор стабилен
2pHs – pH0 < 6 раствор склонен к образованию накипи
Для упрощения расчетов также имеется специальный калькулятор. Индексы Ланжелье и Ризнара нужно использовать при составлении планов на водоподготовку (подбор ингибиторов коррозии, умягчителей, антискалантов) или при желании установить установки обратного осмоса. Обобщенная таблица, учитывающая два индекса (LSI/RSI) одновременно показана ниже:
Индексы Ланжелье и Ризнара нужно использовать при составлении планов на водоподготовку (подбор ингибиторов коррозии, умягчителей, антискалантов) или при желании установить установки обратного осмоса. Обобщенная таблица, учитывающая два индекса (LSI/RSI) одновременно показана ниже:
Справедливости ради отмечу, что существуют и другие, менее распространенные (и реже применяемые на практике) индексы — см. под спойлером
Менее известные индексы для описания свойств воды
Для чистоты эксперимента стоит упомянуть следующие оценочные индексы:
1. Индекс накипеобразования Пукориуса = Puckorius Scaling Index (PSI)
Индекс Пукориуса представляет собой уточненный вариант индекса Ризнара, который показывает взаимосвязь между состоянием насыщения и образованием отложений за счет включения буферной емкости воды в расчет. Индекс действителен для температур до 93 ° C.
PSI = 2(pHEQ) — pHs
в этом уравнение pHs рассчитывается так же, как и в двух предыдущих случаях.
pHEQ = 1.465 — log [общая щелочность] + 4.54
PSI < 4,5 — вода имеет тенденцию к образованию накипи;
4,5 < PSI < 6,5 — вода находится в оптимальном, сбалансированном диапазоне
PSI > 6,5 — вода обладает коррозионным потенциалом
2. Индекс Ларсона-Скольда = Larson-Skold Index = Larson Ratio = (LI~LR)
Индекс Ларсона-Скольда используется для описания коррозионного воздействия воды на трубы из мягкой стали и представляет собой отношение концентраций хлорид- и сульфат-ионов к концентрации бикарбонат- и карбонат-ионов.
LR~CI = ([ Cl– ] + [ SO42- ])/([ HCO3– ] + [ CO32- ]), где
[Cl–] — концентрация хлорид-ионов в мэкв/литр
[SO42-] — концентрация сульфат-ионов мэкв/литр
[ HCO3– ] + [ CO32- ] общая щелочность
LI < 0,8 — вода не агрессивна; хлориды и сульфаты не будут мешать естественному образованию накипи
0,8 <LI <1,2 — вода агрессивна умеренно
LI > 1,2 — вода имеет сильный коррозионный характер. скорость коррозии будет возрастать с увеличением индекса
скорость коррозии будет возрастать с увеличением индекса
3. Индекс агрессивности воды = aggressive index (AI)
Индекс агрессивности (AI) был предложен для упрощения выбора подходящего материала для трубопроводов по перекачке воды в передающих линиях распределительных сетей. Изначально акцент делался на асбоцементных трубах и воде с температурой от 4 до 27 °C. AI рассчитывается как функция pH, концентрации кальция и щелочности.
AI=pH+log[(общая щелочность в мг/л)(кальциевая жесткость в мг/л) )]
AI > 12 — вода не обладает выраженным коррозионным потенциалом
10 < AI < 12 — вода обладает умеренным потенциалом коррозии
AI < 10 — вода является очень агрессивной
Существуют еще индексы Стиффа-Дэвиса, Оддо-Томпсона, индекс CR4 и т.п. тысячи их… Я считаю, что для большинства бытовых задач (т.е. НЕ для ТЭЦ) Ланжелье и Ризнара вполне достаточно.
При рассчетах индексов самое сложное — определить содержание ионов кальция. рН/TDS/температура — давно уже не проблема, на aliexpress продаются универсальные приборы, позволяющие, конечно, с некоторой погрешностью (все же это не Hanna, вроде той, что я измерял электропроводность меда в своей статье), но измерять параметры.
рН/TDS/температура — давно уже не проблема, на aliexpress продаются универсальные приборы, позволяющие, конечно, с некоторой погрешностью (все же это не Hanna, вроде той, что я измерял электропроводность меда в своей статье), но измерять параметры.
Наиболее сложным будет определить содержание ионов кальция, т.к. наиболее точный вариант может дать только титрование воды с трилоном-Б и индикатором мурексидом. Еще помочь с определением могут тест-полоски, которые продаются во многих городах и селах и основаны на все том же упрощенном титровании воды с помощью трилона-Б и индикатора.
Позволю себе небольшое лирическое отступление в сторону кофе. Точнее кофейных пятен. Тем более, что косвенно то, о чем я напишу связанно с вопросами определения минералогического состава воды.
Суть в том, что в 2017 году ученые из Мичиганского университета в своем докладе на съезде Американского химического общества описали способ, благодаря которому можно определять примеси в воде по «кофейным кольцам». Оказалось, что высохшие пятна (»кофейные кольца” ~ coffee-ring effect, они же «кольца в ванной» ~ bathtub rings) от разной по составу воды сильно отличаются друг от друга. Ученые надеются, что если составить картотеку таких отпечатков, то можно будет узнавать о растворенных веществах по «кофейным кольцам». Для этого понадобилась бы только фотография одной высохшей капельки воды. В принципе, все «нейросетевики» ищущие интересную идею могут взять на заметку.
Оказалось, что высохшие пятна (»кофейные кольца” ~ coffee-ring effect, они же «кольца в ванной» ~ bathtub rings) от разной по составу воды сильно отличаются друг от друга. Ученые надеются, что если составить картотеку таких отпечатков, то можно будет узнавать о растворенных веществах по «кофейным кольцам». Для этого понадобилась бы только фотография одной высохшей капельки воды. В принципе, все «нейросетевики» ищущие интересную идею могут взять на заметку.
На картинке ниже следы капель воды из-под крана в двух зданиях Мичиганского университета: левая капля осталась от жесткой воды, правая — от более мягкой
Фактически получается некий аналог «народной» микрофлюидики. Подробнее особенности технологии можно оценить на видео:
Ну вот, разобравшись с технологиями и индексами самое время переходить к практике борьбы с накипью и отложениями.
4. Профилактика появления накипи
Допустим индекс Ланжелье (или Ризнара, кому что удобнее) мы посчитали и увидели, что вода наша очень сильно склонна к образованию накипи (если вдруг она склонна к коррозии — то читать нужно О простых вещах-сложно. «Cпящая сталь». Чем смазать заржавевшие болты или Не WD-40 единым…). В таком случае проще всего не бороться с накипью, а предотвратить ее появление. Сделать это можно несколькими путями:
«Cпящая сталь». Чем смазать заржавевшие болты или Не WD-40 единым…). В таком случае проще всего не бороться с накипью, а предотвратить ее появление. Сделать это можно несколькими путями:
— сделать технологическую воду мягкой
— использовать ингибиторы накипеобразования
— использовать антинакипь-поверхности (=поверхности к которым не могут прикрепится кристаллы карбоната кальция).
4.1. УМЯГЧЕНИЕ ВОДЫ
В зависимости от того, для каких технологических целей нам нужна мягкая вода и какие нужны объемы — есть различные варианты решения задачи. Технологических подчеркнуто потому что ранее мы определились, что для организма жесткая вода — пищевая добавка и источник природных минералов. Для использования же воды в качестве растворителя или хладогента возможно придется освоить водоподготовку.
Водоподготовка — обработка воды, поступающей из природного водоисточника, для приведения её качества в соответствие с требованиями технологических потребителей.Может производиться на сооружениях или установках водоподготовки для нужд коммунального хозяйства, практически во всех отраслях промышленности (например, теплогенерирующих предприятий).
1. Термоумягчение и реагентная очистка
При небольших объемах потребления воды десятилетиями самым простым способом умягчения воды (удаления карбонатной жесткости) является кипячение. В результате нагревания гидрокарбонаты кальция и магния разлагаются с образованием накипи:
Ca(HCO3)2 → CaCO3 ↓ + CO2 + h3O
Mg(HCO3)2 → MgCO3 ↓ + CO2 + h3O
Про дистиллированную воду
4.1.1. ДИСТИЛЛИРОВАННАЯ ВОДА [Canonical link — Мороз, вода и аккумулятор автомобиля]
Если воду кипятить, а потом пар собирать и конденсировать, то можно полностью очистить воду от примесей и получить дистиллированную воду.
Подобный эффект наблюдается в природе (см. Круговорот воды в природе) поэтому дождевая вода и является мягкой, пройдя цикл испарения, конденсации и выпадения осадков. Аналогичного результата можно добится и с помощью процедуры вымораживания. Для этого необходимо просто постепенно замораживать воду. Когда останется примерно 10% жидкости от первоначального количества, необходимо слить не замершую воду, а лёд растопить и использовать. Все соли жесткости остаются в незамерзшей воде. Наряду с дистилляцией, это один из способов опреснения высокоминерализованных вод до питьевого качества. Ну и как «резервный вариант» на случай проблем с водой (=топить снежную шубу из морозильника).
Круговорот воды в природе) поэтому дождевая вода и является мягкой, пройдя цикл испарения, конденсации и выпадения осадков. Аналогичного результата можно добится и с помощью процедуры вымораживания. Для этого необходимо просто постепенно замораживать воду. Когда останется примерно 10% жидкости от первоначального количества, необходимо слить не замершую воду, а лёд растопить и использовать. Все соли жесткости остаются в незамерзшей воде. Наряду с дистилляцией, это один из способов опреснения высокоминерализованных вод до питьевого качества. Ну и как «резервный вариант» на случай проблем с водой (=топить снежную шубу из морозильника).
Где в быту может понадобится именно дистиллированная (а не просто умягченная) вода? Конечно же в свинцовых аккумуляторных батареях.Я думаю большинство помнит из школьных уроков химии/физики или даже от отца/деда автолюбителя, что в аккмулятор можно заливать ТОЛЬКО дистиллированную воду. Если залить что-то неподходящее вроде водопроводной воды, то в итоге ионные примеси могут резко сократить срок службы свинцово-кислотных аккумуляторов и добавить других проблем. В таблице ниже показаны каких именно:
В таблице ниже показаны каких именно:
Помимо замены испрившейся воды в электролите свинцовых аккумуляторов желательно дистиллированную воду использовать и в автомобильных системах охлаждения, поскольку ионы примесей могут связываться с антикоррозионными присадками антифризов и нивелировать их действие. Аналогичный совет может касаться и стеклоомывателей.
Дистиллированную воду желательно заливать в комнатные увлажнители и в системы увлажнения кислорода (CPAP)
Constant Positive Airway Pressure, CPAP — режим искусственной вентиляции лёгких постоянным положительным давлением. СИПАП-терапия была предложена и введена в клиническую практику в 80-х годах для лечения обструктивного апноэ сна
Но вот пить дистиллированную воду НЕ РЕКОМЕНДУЕТСЯ! По той же причине, по которой жесткая вода — полезна для организма (см. ранее). Еще в далеком 1982 году ВОЗ провела исследование влияния деминерализованной воды на организм и установила, что такая вода (рАвно как и деионизованная, и дистиллированная) повышает диурез и выводит (=вымывает) электролиты из организма, и, что особенно опасно, критически понижает концентрацию калия в сыворотке крови.
Кстати, для орошения в теплицах мягкая вода тоже не подходит, из-за ее склонности к защелачиванию почв…
P.S. еще раз напомню всем, кто покупает дистиллированную воду в супермаркетах — раскошельтесь (2-5$) на портативный кондуктометр, это гораздо дешевле замены аккумулятора на новый.
И каждый раз покупая воду чтобы «долить в аккумулятор» — проверяйте электропроводность. Для дистиллированной воды она должна быть не выше 5 мкСм/см. В наших реалиях даже вода может быть фальшивой…
С постоянной жесткостью (некарбонатной) бороться простым термоумягчением сложнее (да что сложнее, попросту невозможно), и на этот случай пригодятся химические методы. Самые распространенные химические умягчители — это гашеная известь Ca(OH)2, кальцинированная сода Na2CO3 (Важно! Это НЕ питьевая сода, которая гидракарбонат натрия NaHCO3 и используется в кулинарии), или фосфат натрия Na3PO4. Все эти соединения переводят «ионы жесткости» в нерастворимые осадки. С гашеной известью протекают следующие реакции:
Все эти соединения переводят «ионы жесткости» в нерастворимые осадки. С гашеной известью протекают следующие реакции:
CO2+ Ca(OH)2 → CaCO3↓ + h3O
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 ↓ + 2h3O
Mg(HCO3)2 + Ca(OH)2 → 2MgCO3↓ + 2h3O
MgSO4 + Ca(OH)2 → Mg(OH)2↓ + CaSO4
MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2
С содой следующие:
CaCl 2 + Na 2 CO 3 → CaCO 3↓ + 2NaCl
MgSO 4 + Na 2 CO 3 → MgCO 3↓ + Na 2 SO 4
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Ну и парочку для ортофосфата:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3
3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4
4.2. Катионирование и обратный осмос
Если объемы воды превышают границы «пару ведер», то приходится использовать уже более технологичные решения, нежели осаждение с помощью кальцинированной соды. На помощь приходит метод «катионирования». В нем используются специальные гранулированные полимеры (ионообменные смолы), способные поглощать катионы солей жесткости (кальций, магний, железо, марганец и т. д.) и выдавать вместо них катионы водорода или натрия/калия (в зависимости от типа смолы). Это т.н. «катиониты». Принцип их работы — показан на картинке ниже:
д.) и выдавать вместо них катионы водорода или натрия/калия (в зависимости от типа смолы). Это т.н. «катиониты». Принцип их работы — показан на картинке ниже:
При правильно подобранной ионообменной смоле жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 °Ж, при двухступенчатом — до 0,01 °Ж. Ионообменные смолы могут забирать и анионы (хлориды, сульфаты и т.д. и т.п.), такие вещества называются — аниониты и используются реже катионитов. Основной недостаток метода катионирования в том, что когда все доступные ионы Na+/H+ заменены ионами кальция или магния, смолу необходимо «перезарядить», вытеснив ионы Ca2+ и Mg2+ с использованием раствора хлорида натрия или гидроксида натрия (в зависимости от типа используемой смолы). Для анионных смол для регенерации обычно используется раствор гидроксида натрия или гидроксида калия. Основной недостаток еще и в том, что регенерационные растворы солей потом сбрасываются в сточные воды, вот вам и засоление почв/вод (соотносимое, кстати, по объемам с засолением от зимней посыпки дорог солью).
Кстати, в последнее время метод катионирования от промышленных установок перекочевал даже в небольшие приборы вроде утюгов и комнатных увлажнителей воздуха. На картинке пример отпаривателя Phillips и умягчающего картриджа для него:
Как правило, датчик в приборе измеряет электропроводность воды (или общее солесодержание~TDS) и просит «заменить умягчающий фильтр» (который далеко не пару копеек стоит). Все же что нужно — это просто регенерировать фильтр с помощью раствора поваренной соли (самый распространенный вариант) либо натриевой щелочи (средство «Крот»). Кстати, в качестве соли лучше использовать специальную соль без добавок иода и фтора, которая продается в тех же отделах строительных супермаркетов, где продаются и всевозможные фильтры для воды. Называется все это добро «соль для умягчителей воды».
В один раздел с катионирование введен и такой метод как обратный осмос. Суть его в том, что при прохождении через полупроницаемые мембраны (как правило, полиамидные) вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Аналогичный результат дает и электродиализ, когда ионы удаляются из воды под действием электрического поля и специальных мембран. Методы эти прекрасны и могут при должном желании давать деионизованную воду (=вообще без ионов), но… Но любая мембрана в жесткой воде проработает недолго, ровно до тех пор, пока образующаяся накипь не забьет поры. А значит — для самого профессионального водоочистного оборудования все равно придется подавать предварительно умягченную (до какого-то уровня) воду.
Эффективность очистки может достигать 99,9 %. Аналогичный результат дает и электродиализ, когда ионы удаляются из воды под действием электрического поля и специальных мембран. Методы эти прекрасны и могут при должном желании давать деионизованную воду (=вообще без ионов), но… Но любая мембрана в жесткой воде проработает недолго, ровно до тех пор, пока образующаяся накипь не забьет поры. А значит — для самого профессионального водоочистного оборудования все равно придется подавать предварительно умягченную (до какого-то уровня) воду.
4.3. ХЕЛАТИРОВАНИЕ И ИНГИБИРОВАНИЕ НАКИПЕОБРАЗОВАНИЯ
4.3.1. Комплексообразователи [Canonical link — Чувство равновесия и Трилон-Б в майонезе]
Совсем не обязательно полностью убирать ионы жесткости из воды (осаждение в осадок или ионообменной смолой), можно их связать в хорошо растворимые соединения — комплексы. Внутри такой вот органической «каракатицы» ионы могут находится достаточно долго.
Ровно до тех пор, пока не изменится рН. В водном растворе катионы металлов окружены защитными оболочками хелатирующего агента, который изменяет заряд иона с положительного на отрицательный и не позволяет им взаимодействовать с тем же мылом и образовывать нерастворимый «мыльный камень». Невозможно и осаждение с участием других анионов.
В водном растворе катионы металлов окружены защитными оболочками хелатирующего агента, который изменяет заряд иона с положительного на отрицательный и не позволяет им взаимодействовать с тем же мылом и образовывать нерастворимый «мыльный камень». Невозможно и осаждение с участием других анионов.
Комплексообразователи активно используются в качестве in sutu «умягчителей» воды в различных стиральных порошках, шампунях, мылАх и прочей косметической продукции. Чаще всего используется либо этилендиаминтетрауксусная кислота (ЭДТА) в виде тетранатриевой соли (Трилон-Б), либо лимонная кислота, либо нитрилотриуксусная кислота (она же Трилон-АС~Trilon AS~NTA-H3). Кстати, на заметку, Трилон-А — это тринатриевая соль нитрилотриуксусной кислоты (NTA-Na3). Может еще использоваться и тринатриевая соль метилглициндиуксусной кислоты (Трилон-М~Trilon M~MGDA-Na3). Умягчителей я взял в кавычки, потому что по-сути, никакого умягчения (т.е. изъятия ионов из объема) не происходит, хелатирование мало влияет на содержание минералов в воде, кроме как делает их «более растворимыми» (=«снижает сродство катионов к образованию накипи/осадка»).
Стоит также отметить, что в последнее время из-за опасений по поводу огромных количеств комплексов ЭДТА попадающих в окружающую среду (и их токсичности для водных организмов) наблюдается переход на более биоразлагаемые комплексообразователи, вроде диацетата тетранатрия глутамата, тринатрийэтилендиаминдисукцината или фитата натрия/фитиновой кислоты.
Про фитиновую кислоту вспомним еще разок
Про фитиновую кислоту я упоминал давным-давно, в серии своих фитохимических заметок. Не зря видимо мне сразу понравилась симметричная форма этого химического соединения. Возможно в будущем именно фитиновая кислота заменит весь трилон-Б.
Пока же можно почитать статью Заметки фитохимика. Банановая шкурка наносит ответный удар и вспомнить про антипитательные вещества, выводящие из организма человека кальций… Кстати, фитиновая кислота содержится в отрубях и связывает в комплексы не только кальций, но и магний, железо и цинк…
Еще раз напомню, что
хелаты применяются только для технологической воды, в питьевую воду в аховых количествах попадать они не должны. Потому что достаточно быстро смогут вытянуть из организма все
Потому что достаточно быстро смогут вытянуть из организма все
микроэлементы. Тот же комплекс который Трилон-Б образует с кальцием, в кругах любителей антидотов еще называется «тетацин кальция» и ему вполне под силу вместе с вредным свинцом убрать и нужный цинк, медь, железо и т.п.
На потенциал хелатирования влияют pH, молярное отношение хелата к иону металла и присутствие конкурирующих ионов металлов, способных образовывать комплексы с ЭДТА. Константы стабильности для различных комплексов металл-ЭДТА значительно различаются, и любой металл, способный образовывать прочный комплекс с ЭДТА, будет по крайней мере частично замещать другой металл. Из металлов-микроэлементов Fe3+ наиболее стабилен (log k = 25,1), за ним следуют Cu2+ с 18,4, Zn2+ с 16,1, Fe2+ с 14,6, Ca2+ с 10,6, Mg2+ с 8,7 и Na+ с 1,7.
Ситуация несколько усложняется тем, что каждый металл имеет оптимальный pH для образования хелата. Под спойлером показаны допустимые уровни рН для некоторых комплексных соединений металл-ЭДТА.
Под спойлером показаны допустимые уровни рН для некоторых комплексных соединений металл-ЭДТА.
Устойчивость комплексов Металл-ЭДТА как функция рН
В биологических системах Ca2+ обычно наиболее доступен для хелатирования. Цинк является следующим по доступности. Далее скорее всего сработает ряд: медь> железо> марганец> кобальт. В общем, призываю помнить про микроэлементы 🙂
как Трилон из майонеза разрушает вестибулярный аппарат
Самое интересное, что мало кто помнит, что тот же кальцит в кубиках постоянно пристутствует в организме человека. В роли т.н. отолитов
Отолиты (от греч. οὖς, (род. п. ωτος) — «ухо» и λἰθος — «камень») — твёрдые образования, расположенные на поверхности клеток, воспринимающих различные механические раздражения; часть органа равновесия у всех позвоночных и человека <...>
Картинка должна помочь представить, где именно локализованы кристаллы кальцита у человека.
Локализованы они в лабиринте внутреннего уха. Т.н. отолитовый аппарат представлен двумя сообщающимися камерами лабиринта (саккулус и утрикулус) плюс система полукружных каналов, которая включает три кольцевых канала, которые выходят из утрикулуса и затем впадают в него, располагаясь в трех взаимоперпендикулярных плоскостях. В каждой камере отолитового аппарата и в каждом полукружном канале имеется скопление рецепторов — волосковых клеток - макула, которая покрыта желатинообразной массой – купулой. Эта масса образована преимущественно мукополисахаридами. Купула покрывает волосковые клетки наподобие подушки и содержит отложения кристаллов кальцита, которые придают ей дополнительный вес. В полукружных каналах желатинообразная масса не содержит кристаллов кальция и полностью перекрывает просвет канала.
Каждый рецептор волосковая клетка несет на своей поверхности от 60 до 80 тонких выростов цитоплазмы (стереоцилий) и одну ресничку (киноцилию) которые реагируют на движение отолитов. При вертикальном положении головы макула утрикулуса располагается горизонтально. Когда голова наклоняется в сторону, утяжеленная отолитами желатинообразная мембрана под действием силы тяжести соскальзывает в сторону наклона. Это скольжение приводит к изгибанию стереоцилей волосковых клеток. Наклон стереоцилей сопровождается (в зависимости от направления) повышением или снижением частоты нервных импульсов в чувствительных нейронах вестибулярного ганглия. Макула саккулуса располагается вертикально и действует так же, как макула утрикулуса.
При вертикальном положении головы макула утрикулуса располагается горизонтально. Когда голова наклоняется в сторону, утяжеленная отолитами желатинообразная мембрана под действием силы тяжести соскальзывает в сторону наклона. Это скольжение приводит к изгибанию стереоцилей волосковых клеток. Наклон стереоцилей сопровождается (в зависимости от направления) повышением или снижением частоты нервных импульсов в чувствительных нейронах вестибулярного ганглия. Макула саккулуса располагается вертикально и действует так же, как макула утрикулуса.
При резком линейном ускорении тела купула саккулуса или утрикулуса за счет сил инерции смещается в направлении, противоположном направлению движения, что также приводит к изменению электрической активности рецепторов. Угловое ускорение оценивается за счет полукружного канала, фактически замкнутой трубки, заполненной эндолимфой. В расширенной части канала его внутренняя стенка выстлана волосковыми клетками, а расположенная над ними купула полностью перекрывает просвет канала. При повороте головы полукружные каналы поворачиваются вместе с ней, а эндолимфа в силу своей инерции в первый момент времени остается на месте. В результате этого возникает разность давлений по обе сторону купулы, и она прогибается в направлении, противоположном движению. Это вызывает деформацию стереоцилей и изменение активности нейронов. При вращении головы только в горизонтальной, сагитальной или фронтальной плоскости активируются рецепторы только одного соответствующего канала. При сложном вращении головы активируются рецепторы всех трех каналов. Информация от них поступает в центральную нервную систему и на основании анализа данных реконструируется истинная картина перемещения головы.
При повороте головы полукружные каналы поворачиваются вместе с ней, а эндолимфа в силу своей инерции в первый момент времени остается на месте. В результате этого возникает разность давлений по обе сторону купулы, и она прогибается в направлении, противоположном движению. Это вызывает деформацию стереоцилей и изменение активности нейронов. При вращении головы только в горизонтальной, сагитальной или фронтальной плоскости активируются рецепторы только одного соответствующего канала. При сложном вращении головы активируются рецепторы всех трех каналов. Информация от них поступает в центральную нервную систему и на основании анализа данных реконструируется истинная картина перемещения головы.
Вдаваться в физиологию работы вестибулярной системы долго смысла нет, потому что здесь нас интересуют сугубо «вестибулярные камни» — биогенные кристаллы кальцита. Эти объекты относятся к биоминералам и на 90% состоят из карбоната кальция. У людей отолиты являются единственным примером биоминерала на основе кальцита, который участвует в физиологических процессах. Неорганическое вещество срастается с органическими молекулами (гликопротеины и гликозаминогликаны) и формирует нанокомпозит. На рисунке ниже показан внешний вид отолита человека (A) и его трехмерная модель (B). Масштабная линейка на рисунке А равна 5 мкм.
Неорганическое вещество срастается с органическими молекулами (гликопротеины и гликозаминогликаны) и формирует нанокомпозит. На рисунке ниже показан внешний вид отолита человека (A) и его трехмерная модель (B). Масштабная линейка на рисунке А равна 5 мкм.
Отолиты саккулуса и отолиты утрикулуса имеют идентичное строение — цилиндрическое выпуклое «тело» и концевые ромбоэдрические грани. Средний размер отолита составляет около 10 мкм. В кристаллах не наблюдается разделения плотностей (=нет ядра), хотя выпуклая область является более пористой за счет менее упорядоченной структуры и наличия пор. На дифрактограммах рентгеновского рассеяния отолиты показывают рефлексы аналогичные любым другим монокристаллам кальцита (из карьера или из накипи в чайнике). А значит, как и любой другой кальцит, кальцит во внутреннем ухе будет растворятся и деградировать под влиянием изменения рН или реакций с комплексообразователями. Получить кислый рН в организме тяжело (см. ацидоз), все же один большой буферный раствор, как никак. А вот с комплексообразователем сложнее, плюс, как уже было упомянуто ранее, комплекс ЭДТА-кальций более стабилен в щелочной среде.
А вот с комплексообразователем сложнее, плюс, как уже было упомянуто ранее, комплекс ЭДТА-кальций более стабилен в щелочной среде.
В статье авторы исследовали поведение отолитов (как естественного происхождения, так и синтетических моделей) и установили, что да, действительно кристаллы претерпевают изменение микротопологии поверхности, под воздействием кислот и комплексообразователей (того же Трилона-Б). Картинка ниже показывает изменение искусственного отолита (композит желатин-кальцит) в растворе Трилона-Б с концентрацией 0,107 моль/л. Масштабная линейка в (A): 500 мкм, в (B): 200 мкм и в ©: 100 мкм.
В первую очередь растворяется выпуклая часть кристалла, и он теряет свою симметричность. Казалось бы, ну и пусть. Но не тут то было. Утратившие симметричность отолиты утрачивают способность к однородному «роевому» движению в желатиновой матрице при наличии ускорения. Т.е. более легкие движутся быстрее, более тяжелые — медленнее. Вместо однородного потока наблюдается хаотичный (см. картинку):
картинку):
Это накладывает эффект на сцепление отолитов с волосковыми клетками и вносит погрешности в данные, которые наш акселерометр передает в мозг. В результате — проблемы с пространственной ориентацией, ошибочные оценки ускорений и т.д. и т.п. Подобный эффект деградации наблюдается в пожилых людей, как последствие естественного процесса старения. НО! Но если сильно злоупотреблять комплексообразователями (в т.ч. и в виде пищевых добавок Трилона-Б) — почувствовать на своей шкуре можно и в достаточно молодом возрасте.
Счастье в том, что соли ЭДТА слабо сорбируются кишечником. Около 80–95% дозы выводится с фекалиями через 24 часа. За сутки в ЖКТ в среднем впитывается от 2 до 4% (детектируется в тканях и моче) вещества за счет пассивной диффузии. Вещество в основном распределяется во внеклеточных жидкостях, что достаточно сильно ограничивает его способность хелатировать внутриклеточные металлы. В целом опасность действительно мала, но а)кроме Трилона-Б существуют и другие комплексообразователи, в т. ч. растительные (фитиновая кислота), и б) «капля камень точит» так что расслабляться рано
ч. растительные (фитиновая кислота), и б) «капля камень точит» так что расслабляться рано
4.3. 2. Ингибиторы накипеобразования («антискаланты»)
Комплексообразователи работают на опережение, не давая ионам вступать во взаимодействие. А есть еще класс соединений, которые включаются на другом временном промежутке — когда нерастворимые соединения уже образовались и находятся в виде суспензии/взвеси в толще воды. Цель т.н. ингибиторов накипеобразования или антискалянтов — не дать твердым микрочастицам осесть и агломерироваться в монолиты накипи. Предотвращение оседания достигается за счет адсорбции антискалянтов на поверхности криталлов, ингибирования зародышеобразования у кристаллов, снижение скорости осаждения, либо изменения геометрии кристаллов. В качестве органических антискалянтов можно привести примеры полимеров акриловой и малеиновой кислот, сополимеры сульфоновой кислоты, поливинилсульфонаты и другие органические полиэлектролиты.
Из-за обилия сложной органической химии такие соединения оказывают крайне негативное воздействие на обитателей водной среды (в основном, на рыбу). Поэтому с конца 1990-х годов активно разрабатываются экологически безопасные и биоразлагаемые ингибиторы накипеобразования на основе полисахаридов. В качестве примера реально работающего ЭКО-антискалянта можно привести карбоксиметилинулин (CMI).
Соединение это было выделенно из корней Inula helenium, он же девясил высокий. Самое интересное — что работает совсем неплохо.
замечание про инулин от беларуских клюквоводов
Есть у нас в Беларуси «гастрономическое» достояние в виде клюквы в сахаре, от компании ПКФ «Аржаница». На упаковке гордо красовалась надпись «содержит олигофруктозу»:
Мы с моей ассистенткой как-то раз сели и написали на предприятие рекламацию, мол, к чему тут эта надпись-то. Пишите уже тогда «содержит инулин» или «из лучшего беларусского топинамбура». Что интересно, производитель нам ответил, дескать «старые запасы в старых упаковках, после ребрендинга упаковки таких ляпов уже нет». Ну вроде все нормально, но осадочек остался 🙂
Пишите уже тогда «содержит инулин» или «из лучшего беларусского топинамбура». Что интересно, производитель нам ответил, дескать «старые запасы в старых упаковках, после ребрендинга упаковки таких ляпов уже нет». Ну вроде все нормально, но осадочек остался 🙂
Другой интересный метод предотвращения образования накипи в промышленном водоснабжении — это дозирование следовых концентраций ионов металлов. Этот способ вполне можно интерполировать и на какое-нибудь приусадебное хозяйство с его контуром отопления. Суть его в том, что в присутствии некоторых ионов наблюдатся нарушение механизма формирования полиморфных форм карбоната кальция. Ионы адсорбируются на кристаллах карбоната кальция, блокируют центры роста и снижают скорость осаждения. Кроме того, может наблюдаться образование фазы менее стабильного арагонита, вместо привычного кальцита.
Cводная таблица ингибиторов роста кристаллов кальцита
На этом же принципе работают т. н. «электролитические антискалянты». Только в отличие от устройств механической подачи растворов, примеси генерируются на месте за счет электролиза.
н. «электролитические антискалянты». Только в отличие от устройств механической подачи растворов, примеси генерируются на месте за счет электролиза.
Накипь как важный датчик изменения качества питьевой воды за десятилетия:
Интересный подход был обнаружен в статье. В ней ребята из Томского политехнического университета использовали минералогический анализ отложений на чайниках и посуде жителей своего города. Делалось это для того, чтобы определить долгосрочное, т.н. «хроническое» накопление металлов. В итоге удалось установить, что такой метод является очень перспективным методом оценки качества питьевой воды в определенных регионах (= метод в копилку гражданской науки) и экологических и геохимических условий на исследуемых территориях. В карбонатной матрице из кальцита и арагонита повышенные концентрации других химических элементов формировали собственных формы минералов, которые легко детектировались методами рентгеновской диффракции. Самое интересно, что удалось установить, что повышенное содержание некоторых элементов и минералов в известковом налете не всегда подтверждалось анализом текущего химического состава воды. Т.е. солевые образования питьевой воды являются отложениями, которые могут предоставить информацию о долгосрочном накопление химических элементов (в т.ч. и радиоактивных).
Самое интересно, что удалось установить, что повышенное содержание некоторых элементов и минералов в известковом налете не всегда подтверждалось анализом текущего химического состава воды. Т.е. солевые образования питьевой воды являются отложениями, которые могут предоставить информацию о долгосрочном накопление химических элементов (в т.ч. и радиоактивных).
Кроме сугубо химических (ну или электрохимических) ингибиторов накипеобразования существует и такая штука как ингибиторы накипеобразования, основанные на физических принципах. Например, на магнитной обработке воды, или на ультразвуковой обработке воды. Производители таких устройств утверждают, что за счет воздействия их приборов, образующиеся частицы накипи (карбонаты и т.п.) не могут прикреплятся к трубам/поверхностям и образовывать накипь. Часто такие приборчики называются «кондиционерами для воды».
Пока можно сказать одно — подтвержденной эффективности их работы я не нашел. Принцип плацебо в случае накипи пока работает плохо, все же в трубе «наблюдателя» (по аналогии с квантовым миром) найти сложно. Хотя иногда в исключительных условиях и для неких исключительных отложений эффект все же наблюдается.
Принцип плацебо в случае накипи пока работает плохо, все же в трубе «наблюдателя» (по аналогии с квантовым миром) найти сложно. Хотя иногда в исключительных условиях и для неких исключительных отложений эффект все же наблюдается.
4.3.3. СЛАБООБРАСТАЮЩИЕ И САМООЧИЩАЮЩИЕСЯ ПОВЕРХНОСТИ
Для объективности стоит отметить, что в некоторых местах, где появление отложений должно быть категорически исключено, есть возможность использовать трубы и арматуру с самоочищающимися свойствами (~слабообрастающие поверхности). Такие материалы препятствуют отложению загрязнений на своей поверхности. Это могут быть как объекты с низкой поверхностной энергией, например, за счет покрытия слоем фторопласта, так и объекты со специфичной микротопологией поверхности (см. эффект лотоса).
Интересный факт. Внутренняя поверхность кровеносного сосуда — это еще одна естественная устойчивая к обрастанию поверхность. Эндотелий состоит из непрерывного монослоя эндотелиальных клеток с морфологией, напоминающей морфологию листа лотоса. Отрицательно заряженная гликопротеиновая оболочка клеток эндотелия отталкивает тромбоциты и лейкоциты. Эти же клетки выделяют биоактивные вещества, которые ингибируют тромбоз и пролиферацию гладкомышечных клеток. На картинке — как это выглядит под электронным микроскопом (снимок артерии свиньи):
Отрицательно заряженная гликопротеиновая оболочка клеток эндотелия отталкивает тромбоциты и лейкоциты. Эти же клетки выделяют биоактивные вещества, которые ингибируют тромбоз и пролиферацию гладкомышечных клеток. На картинке — как это выглядит под электронным микроскопом (снимок артерии свиньи):
5. Разрушители накипи (и/или других отложений)
Если профилактика не сработала и отложения на предметах/в трубах появились, то ничего не поделаешь — придется их удалять. Для удаления известковых разводов/накипи на любых объектах чаще всего применяют два подхода:
- Механическое удаление
- Удаление с помощью химических соединений
Методы эти применяются в краткосрочной перспективе и достаточно эффективны на случай умеренного образования накипи (бытовое применение). Если речь идет о системах отопления/охлаждения или нефтегазовой отрасли, то более целесообразно (в т. ч. экономически) использование ингибиторов накипеобразования (антискалантов).
ч. экономически) использование ингибиторов накипеобразования (антискалантов).
Для механического удаления накипи используются любые подходящие инструменты — от губок и скребков, до сверл и перфораторов. Единственное, на что стоит обратить внимание — материал скребка/губки должен быть мягче, чем материал из которого сделан объект покрытый накипью. Соблюдая это нехитрое правило можно избежать царапин и ухудшения внешнего вида нашего объекта. В промышленных масштабах используется очистка с помощью струй воды под высоким давлением, обработку металлическими шариками, ультразвуковые или абразивные методы очистки.
Но наиболее дешевый и простой метод удаления отложений — это химическая обработка, для которой используются кислоты различной природы (обзор доступных в магазинах РБ, немногочисленных вариантов — см. в приложении А). Кратко пройдусь по компонентам из которых состоят over 99% всех «антинакипинов» (и бытовых и промышленных):
5.1. НЕОРГАНИЧЕСКИЕ КИСЛОТЫ
Из-за необходимости строго соблюдения правил техники безопасности сильные неорганические кислоты используются в основном в промышленных системах. Хотя на кону очень высокая эффективность удаления отложений (=высокая скорость растворения)
Хотя на кону очень высокая эффективность удаления отложений (=высокая скорость растворения)
Соляная кислота — HCl
Информация
Наиболее распространенный (за счет промывки технологических систем, бойлеров и т.д) вид разрушителя накипи, компонент многих преобразователей ржавчины (с функцией удаления накипи). В промышленных системах используется ингибированная 1-2% соляная кислота. Ингибирование необходимо для того, чтобы не допустить коррозии металлов. В качестве ингибитора чаще всего используется добавка уротропина (=«сухое горючее») порядка 15-20 г/л раствора «разрушителя отложений». При удалении отложений в котлах и бойлерах соляная кислота часто используется с добавками бифторида аммония (для растворения отложений кремнезема SiO2). Для использования в бытовых условиях подходит только в случае «больше ничего нет». Требует острожного обращения, использования средств индивидуальной защиты (кожа/глаза/дыхание). Реагирует с тканями на основе натуральных волокон, строительным раствором, бетоном, газосиликатными блоками, красками на основе извести (=«побелка»). Может разрушать узоры на керамической плитке и портить хромированную фурнитуру.
Может разрушать узоры на керамической плитке и портить хромированную фурнитуру.
Плавиковая кислота — HF
Информация
Не используется для удаления накипи в быту из-за своей опасности, но при этом является широко распространенным компонентом для промывки технологического оборудования и удаления накипи из трубопроводов и теплообменников. Несмотря на высокую опасность концентрированной кислоты, при разбавлении до рабочих концентраций (<1%) представляет не бОльшую опасность, чем аналогичный раствор соляной кислоты. Преимущество плавиковой кислоты в том, что она очень эффективно растворяет не только карбонатную накипь, но и смешанные отложения (оксиды железа/кремнезем), но после обработки требуется дополнительная нейтрализация сточных вод известью (для нейтрализации непрореагировавшей кислоты и осаждения фторида кальция/гидроксида железа). Чаще всего используются растворы ингибированной плавиковой кислоты. В качестве ингибиторов используются алкилтиомочевины, органические амины, бензотриазол и меркаптобензимидазолы.
В качестве ингибиторов используются алкилтиомочевины, органические амины, бензотриазол и меркаптобензимидазолы.
Серная кислота — H2SO4
Информация
Иногда используется для удаления отложений ибо «есть же аккумуляторный электролит». По своим свойствам похожа на соляную кислоту, накипь удаляет достаточно быстро, но так же требует очень осторожного обращения и средств индивидуальной защиты (особенно кожа и глаза). Реагирует со строительным раствором, бетоном, газосиликатными блоками, красками на основе извести (=«побелка»). Может разрушать узоры на керамической плитке. Известен способ удаления и предотвращения образования накипи путем обработки ее раствором смеси соляной и серной кислот. Однако этот способ не обеспечивает достаточной защиты от коррозии и требует введения в раствор ингибирующих добавок.
Фосфорная кислота — H3PO4
Информация
Кислота слабее всех ранее упомянутых, основной подкислитель в Coca-Cola. Благодаря этому многие советуют в качестве разрушителя накипи использовать этот напиток. В промышленных разрушителях накипи используется достаточно редко, чаще всего в комбинации с азотной кислотой (1-0,5% раствор смеси кислот). Фосфорная кислота в этом тандеме выступает как ингибитор коррозионной активности азотной кислоты. В бытовых средствах встречается в комбинации с другими кислотами.
Благодаря этому многие советуют в качестве разрушителя накипи использовать этот напиток. В промышленных разрушителях накипи используется достаточно редко, чаще всего в комбинации с азотной кислотой (1-0,5% раствор смеси кислот). Фосфорная кислота в этом тандеме выступает как ингибитор коррозионной активности азотной кислоты. В бытовых средствах встречается в комбинации с другими кислотами.
Важно! При использовании разрушителей накипи на основе сильных неорганических кислот в быту никогда не допускайте их контакта с хлорными отбеливателями (см. Что в Белизне тебе моей или Справочное пособие по гипохлориту натрия («хлорке») пункт Опасное соседство — НЕсовместимая бытовая химия)
5.2. ОРГАНИЧЕСКИЕ КИСЛОТЫ
Органические кислоты в основном используются в быту, хотя есть варианты и промышленных средств для удаления накипи/ржавчины. Для комплексных отложений органические кислоты подходят не все и не всегда.
Муравьиная кислота
Информация
Очень эффективный разрушитель накипи. Из-за резкого неприятного запаха требует использования средств индивидуальной защиты дыхания. Часто используется в ингибированном состоянии. Концентрация муравьиной кислоты должна быть не более 15% из-а ограниченной растворимости формиата кальция и возможности выпадения в осадок.
Из-за резкого неприятного запаха требует использования средств индивидуальной защиты дыхания. Часто используется в ингибированном состоянии. Концентрация муравьиной кислоты должна быть не более 15% из-а ограниченной растворимости формиата кальция и возможности выпадения в осадок.
Уксусная кислота
Информация
Знакомый и привычный всем «уксус». Из недостатков — очень медленное действие в обычных условиях (т.е. без нагрева) и неприятный запах, который достаточно сложно удалить, особенно с полимерных поверхностей. Из плюсов — прекрасно очищает хромированные изделия (краны и т.п.). Несмотря на то, что в продаже при желании можно найти и 100% кислоту («ледяная уксусная кислота») для удаления накипи нужно использовать растворы концентрацией <15% из-за ограниченной растворимости ацетата кальция (=выпадает в осадок). Часто в продвинутых антинакипинах используется смесь уксусной и муравьиной кислот. Комбинация уксусной кислоты (5 мас.%) и муравьиной кислоты (7 мас.%) примерно в 4 раза более эффективна при растворении кальцита, чем 10 мас.% раствор уксусной кислоты.
Комбинация уксусной кислоты (5 мас.%) и муравьиной кислоты (7 мас.%) примерно в 4 раза более эффективна при растворении кальцита, чем 10 мас.% раствор уксусной кислоты.
Лимонная кислота
Информация
Самое популярное средство для бытового удаления накипи. Комплексообразователь. Из недостатков — очень медленное действие в обычных условиях (т.е. без нагрева) и ограниченная растворимость цитрата кальция (0,0018 моль / 1000 г воды), которая уменьшается с повышением температуры. В целом лимонная кислота подходит для удаления накипи из стиральных машин, с изделий из алюминия или смешанных материалов. При использовании лимонной кислоты для удаления ржавчины следует учитывать, что для предотвращения переосаждения ржавчины из очищающего раствора необходимо всегда выдерживать примерно 0,5% избыток лимонной кислоты. Есть и более продвинутый вариант, не требующий расчетов количества реагентов и т.п. Необходимо для очистки использовать смесь раствора лимонной кислоты с раствором аммиака. Для удаления карбонатных отложений и ржавчины достаточно в большинстве случаев 3-5% раствора кислоты. Вот в этот раствор необходимо добавлять нашатырный спирт до тех пор, пока рН итогового раствора не будет равен 3,5-4. Такой состав (=аммоний цитратный) удаляет отложения гораздо быстрее, чем индивидуальная лимонная кислота. Еще одно замечание касается того случая, когда раствор лимонной кислоты используется для очистки от отложений уязвимых легкоокисляемых металлов (особенно при повышенной температуре и/или высокой скорости циркуляции раствора разрушителя накипи). В таком случае для предотвращения нежелательного окисления нужно также использовать ингибиторы коррозии — уротропин или тиомочевину.
Для удаления карбонатных отложений и ржавчины достаточно в большинстве случаев 3-5% раствора кислоты. Вот в этот раствор необходимо добавлять нашатырный спирт до тех пор, пока рН итогового раствора не будет равен 3,5-4. Такой состав (=аммоний цитратный) удаляет отложения гораздо быстрее, чем индивидуальная лимонная кислота. Еще одно замечание касается того случая, когда раствор лимонной кислоты используется для очистки от отложений уязвимых легкоокисляемых металлов (особенно при повышенной температуре и/или высокой скорости циркуляции раствора разрушителя накипи). В таком случае для предотвращения нежелательного окисления нужно также использовать ингибиторы коррозии — уротропин или тиомочевину.
Сульфаминовая кислота
Информация
Наиболее часто применяемый в коммерческих бытовых разрушителях накипи компонент. Из плюсов — не повреждает хромированную фурнитуру и не повреждает рисунки на керамике. Средства на основе сульфаминовой кислоты очень эффективны при очистке от накипи небольших объектов (иногда требуется замачивание или оборачивание тряпкой, пропитанной раствором кислоты). В большинстве случаев сульфаминовая кислота используется совместно с анионным ПАВ и солями аммония (сульфат аммония). Неплохо зарекомендовали себя составы содержащие помимо сульфаминовой кислоты и ПАВ, ингибитор коррозии — уротропин, и хелатирующий агент — соли ЭДТА, кислый виннокислый калий и т.п.
Средства на основе сульфаминовой кислоты очень эффективны при очистке от накипи небольших объектов (иногда требуется замачивание или оборачивание тряпкой, пропитанной раствором кислоты). В большинстве случаев сульфаминовая кислота используется совместно с анионным ПАВ и солями аммония (сульфат аммония). Неплохо зарекомендовали себя составы содержащие помимо сульфаминовой кислоты и ПАВ, ингибитор коррозии — уротропин, и хелатирующий агент — соли ЭДТА, кислый виннокислый калий и т.п.
Гидроксиуксусная кислота (Гликолевая кислота)
Информация
Гидроксиуксусная кислота используется для очистки котлов с компонентами из нержавеющей стали. Этот разрушитель ржавчины часто используется в сверхкритических и прямоточных котлах. Гликолевая кислота не справляется с отложениями, в которых есть ионы меди. Интересно то, что готовые растворы гликолевой кислоты (приличной концентрации) можно купить в… магазинах женской косметики, где она используется как «гель-пилинг» или «Отшелушивающий агент»:
Этилендиаминтетрауксусная кислота (ЭДТА~EDTA-H4~Тrilon BS)
Информация
Мать всея хелатирующих агентов. Из преимуществ — работа при низкой температуре, безопасность и простота использования. Из недостатков — крайне слабая растворимость в воде и сложность утилизации отходов. Для удаления накипи используется не столько сама кислота (EDTA-H4), сколькое ее натриевые соли: привычный «народный» Трилон-Б~Trilon B~EDTA-Na4, Трилон-БД~Trilon BD~EDTA-H2Na2, редкий Трилон-Д~Trilon D~EDTA-HNa3, а также соли, в которых вместо иона натрия ион аммония: Трилон-БАТ~Trilon BAT~EDTA-H(NH4)3 и Трилон-БАК~Trilon BAQ~EDTA-(NH4)4. За рубежом для очистки котлов с естественной циркуляцией чаще всего используется Trilon BAQ (с pH 9, т.к. большинство хелатирующих агентов эффективны в щелочном растворе). ЭДТА является наиболее устойчивым разрушителем накипи и особенно хорош для вариантов, в которых нужно удалять отложения ржавчины (накипь со всемозможными оттенками желтого-красного-кориченового). Причем процесс очистки может продолжаться достаточно долго, например в случае очистки радиатора можно использовать циркуляционный насос, который будет гонять комплексообразователь по кругу часами.
Из преимуществ — работа при низкой температуре, безопасность и простота использования. Из недостатков — крайне слабая растворимость в воде и сложность утилизации отходов. Для удаления накипи используется не столько сама кислота (EDTA-H4), сколькое ее натриевые соли: привычный «народный» Трилон-Б~Trilon B~EDTA-Na4, Трилон-БД~Trilon BD~EDTA-H2Na2, редкий Трилон-Д~Trilon D~EDTA-HNa3, а также соли, в которых вместо иона натрия ион аммония: Трилон-БАТ~Trilon BAT~EDTA-H(NH4)3 и Трилон-БАК~Trilon BAQ~EDTA-(NH4)4. За рубежом для очистки котлов с естественной циркуляцией чаще всего используется Trilon BAQ (с pH 9, т.к. большинство хелатирующих агентов эффективны в щелочном растворе). ЭДТА является наиболее устойчивым разрушителем накипи и особенно хорош для вариантов, в которых нужно удалять отложения ржавчины (накипь со всемозможными оттенками желтого-красного-кориченового). Причем процесс очистки может продолжаться достаточно долго, например в случае очистки радиатора можно использовать циркуляционный насос, который будет гонять комплексообразователь по кругу часами. И можно не бояться за повреждение металла (в отличие от HCl). Нужно однако помнить, что помимо железа ЭДТА может извлекать и медь (важно для медных трубок). Для бытового использования в состав средств помимо комплексообразователя часто входит еще и другие компоненты (например, известен состав средства для удаления накипи с эмалированной и металлической поверхности: адипиновая кислота 28-32 вес.%, сода кальцинированная 6-8 вес.%, ЭДТА до 100 вес.%). Вместо адипиновой кислоты могут использоваться любые многоосновные органические кислоты (янтарная, глутаровая, щавелевая) или их смеси в равных количествах.
И можно не бояться за повреждение металла (в отличие от HCl). Нужно однако помнить, что помимо железа ЭДТА может извлекать и медь (важно для медных трубок). Для бытового использования в состав средств помимо комплексообразователя часто входит еще и другие компоненты (например, известен состав средства для удаления накипи с эмалированной и металлической поверхности: адипиновая кислота 28-32 вес.%, сода кальцинированная 6-8 вес.%, ЭДТА до 100 вес.%). Вместо адипиновой кислоты могут использоваться любые многоосновные органические кислоты (янтарная, глутаровая, щавелевая) или их смеси в равных количествах.
Замечание про CIP-мойку
. Есть такая область, где удаление накипи происходит фактически каждый день (в противоположность бытовым условиям, когда за «разрушитель накипи» приходится браться тогда, когда чайник уже можно нести в геологический музей). Это т.н. CIP-мойка (cleaning-in-place, т.е. «мыть на месте») — метод автоматической очистки внутренних поверхностей труб, резервуаров, оборудования, фильтров и связанных с ними фитингов без серьезной разборки. CIP обычно используется для такого оборудования, как трубопроводы, резервуары и наполнители. При таком способе очистки используется мощный турбулентный поток жидкости, проходящий через трубопроводы. До 1950-х годов закрытые системы разбирались и чистились вручную. Появление CIP стало благом для отраслей, которым требовалась частая внутренняя очистка своего оборудования (= отрасли, требующие высокого уровня гигиены — производство молочных продуктов и напитков, пивоварение, пищевые производства, фармацевтика и косметика). Логично, что имеются свои рекомендации у производителей химии для CIP на случай отложений (на мембранах обратного осмоса, например). Прислушиваться к ним или нет — личное дело каждого. Но лучше, чем «CIP»-еры в удалении накипи навряд ли кто-то разбирается. Смотрим, что же рекомендуется:
CIP обычно используется для такого оборудования, как трубопроводы, резервуары и наполнители. При таком способе очистки используется мощный турбулентный поток жидкости, проходящий через трубопроводы. До 1950-х годов закрытые системы разбирались и чистились вручную. Появление CIP стало благом для отраслей, которым требовалась частая внутренняя очистка своего оборудования (= отрасли, требующие высокого уровня гигиены — производство молочных продуктов и напитков, пивоварение, пищевые производства, фармацевтика и косметика). Логично, что имеются свои рекомендации у производителей химии для CIP на случай отложений (на мембранах обратного осмоса, например). Прислушиваться к ним или нет — личное дело каждого. Но лучше, чем «CIP»-еры в удалении накипи навряд ли кто-то разбирается. Смотрим, что же рекомендуется:
△ Удаление неорганических отложений (карбонат кальция, сульфат кальция, сульфат бария, сульфат стронция), оксидов/гидроксидов металлов (железа, марганца, никеля, меди, цинка) и неорганических коллоидных отложений → используем 2% р-р лимонной кислоты или в случае сильного обрастания → 0,5% р-р соляной силоты
△ Удаление отложений сульфата кальция и органических отложений природного происхождения легкой и средней степени обрастания → используем 2% р-р триполифосфата + 0,8% р-р трилона Б
△ Удаление высоких уровней отложений органических природного происхождения → используем 2% р-р триполифосфата + 0,025% натриевой соли додецилбенолсульфоната
△ Удаление налета оксидов/гидроксидов металлов (в основном железа) и в меньшей степени отложений сульфата кальция, сульфата бария и сульфата стронция → используем 1% р-р гидросульфита натрия
△ Удаление органического налета природного происхождения, коллоидных отложений смешанной органической/неорганической природы, и биологического материала (грибы, плесень, слизи и биопленки) → используем 0,1% р-р гидроксида натрия + 0,03% додецилсульфат натрия
△ Удаление полимеризовавшегося кремнезема → используем 0,1% р-р гидроксида натрия
5.
 3. Эффективность кислотных средств для удаления накипи
3. Эффективность кислотных средств для удаления накипиНесмотря на обилие рекомендаций по выбору кислот для удаления накипи, не слишком часто встречаются сравнительные характеристики эффективности удаления накипи. Чаще всего выбор кислот происходит либо эмпирически («пальцем в небо»), либо исходя из экономических соображений. Например, на основании данных из приложения А (обзор средств против накипи, найденных в рамках отдельно взятого микрорайнона столицы Беларуси) распределение используемых кислот выглядит следующим образом:
Лимонная кислота — явный лидер. Второе место — сульфаминовая кислота, и бронза поровну делится между фосфорной, муравьиной и соляной кислотами. Отмечу, что ни в одном составе я не встретил упоминания ингибитора коррозии, хотя многие средства заявлены как универсальные.
С точки зрения химии, в реакции растворения кальцита протоны кислот атакуют нерастворимые карбонаты. Соответственно, чем больше протонов генерирует кислота, тем больше кальцита может быть растворено. Этот параметр характеризует такая вещь, как сила кислоты, или константа кислотности (рКа). Чем выше константа кислотности или меньше pKa, тем сильнее кислоты и степень их диссоциации. Сильные кислоты, такие как HCl, полностью диссоциируют в растворе, слабые кислоты диссоциируют частично и, следовательно, не могут растворить такое же количество минерала. Чтобы сравнить силу кислот — см. под спойлером значения:
Этот параметр характеризует такая вещь, как сила кислоты, или константа кислотности (рКа). Чем выше константа кислотности или меньше pKa, тем сильнее кислоты и степень их диссоциации. Сильные кислоты, такие как HCl, полностью диссоциируют в растворе, слабые кислоты диссоциируют частично и, следовательно, не могут растворить такое же количество минерала. Чтобы сравнить силу кислот — см. под спойлером значения:
Микро-справочник pKa/Ka
Сравнение рКа из работы
Количество протонов (для эквимолярных количеств кислот) из работы
Во время реакции растворения накипи равновесие сдвигается вправо (протоны расходуются) и рН системы повышается. Если система закрыта и выделяющийся СO2 остается в растворе, то он образует угольную кислоту. Угольная кислота выступает в качестве буфера и держит рН от 4,0 до 6,0. В этом диапазоне pH слабые кислоты диссоциируют слабо => эффективность «антинакипа» слабая => стоимость растворения одинаковой массы условного кальцита с использованием слабой кислоты значительно выше, чем при использовании сильной неорганической кислоты. Аналогичным действием обладают любые условия, которые изменяют растворимость CO2 в воде (температура, давление и т.п.)
Аналогичным действием обладают любые условия, которые изменяют растворимость CO2 в воде (температура, давление и т.п.)
Ди- и трикарбоновые органические кислоты за счет обладания большим количеством гидрокисльных групп также обладают определенным преимуществом. Если смотреть с точки зрения стехиометрии, то эталонная соляная кислота (1 моль) растворяет 0,5 моль кальцита
2HCl + CaCO3 → CaCl2 + CO2 + H2O
При этом 1 моль дикарбоновой кислоты (щавелевая, малоновая, янтарная, глутаровая, адипиновая) растворяет 1 моль кальцита.
R(COOH)2 + CaCO3 → CaR(COO)2 + CO2 + H2O
про царицу антинакипинов – адипинку
Интересный артефакт. Адипиновая кислота в RU Википедия указана чуть ли не главной по удалению накипи.
Мне лично не понятно, на основании чего «химик википедии» сделал такой вывод, так как по химическим показателям «ничего не предвещало» и кислота абсолютно ординарная по отношению к карбонату кальция (см. далее). Возможно дело в том, что адипиновая кислота — объект крупнотоннажного химического производства, используется для получения нейлона~полиамида и грех ее не употребить. С такой позиции — понятно, кто является спонсором статьи в Википедии…
далее). Возможно дело в том, что адипиновая кислота — объект крупнотоннажного химического производства, используется для получения нейлона~полиамида и грех ее не употребить. С такой позиции — понятно, кто является спонсором статьи в Википедии…
Ну а трикарбоновые кислоты (лимонная) еще эффективнее и растворяют 1,5 моль кальцита:
2R(COOH)3 + 3CaCO3 → Ca32R(COO)3 + 3CO2 + 3H2O
Все было бы предельно ясно, если бы эффективность растворения зависела только от рН, рКа да стехиометрии. Важный фактор — это растворимость соли, которая образуется в результате реакции кислоты и кальцита. Растворимость зависит от температуры и других факторов и может приводит к образованию «вторичной накипи» (=переосаждение), где остаток угольной кислоты в минерале заменит остаток органической кислоты и т.п. Ранее я уже упоминал про это ограничение, когда описывал муравьиную и уксусную кислоты. Для удаления накипи они обычно используются в концентрациях менее 9% и 13% соответственно. Делается это для того, чтобы избежать осаждения формиата кальция или ацетата кальция (хотя уксусную кислоту, особенно с постоянным подогревом, можно использовать до концентрации 25%). Растворимость солей — один из важнейших ограничивающих факторов при выборе кислот для удаления минеральных отложений.
Для удаления накипи они обычно используются в концентрациях менее 9% и 13% соответственно. Делается это для того, чтобы избежать осаждения формиата кальция или ацетата кальция (хотя уксусную кислоту, особенно с постоянным подогревом, можно использовать до концентрации 25%). Растворимость солей — один из важнейших ограничивающих факторов при выборе кислот для удаления минеральных отложений.
Сравнение растворимости некоторых солей кальция
Взято из работы
В таблице ниже сведены теоретические расчеты «растворяющей способности кислот» (как неорганических, вроде эталонной HCl, так и слабых органических) на образцы кальцита. Использовались следующие кислоты: соляная, метансульфоновая (MSA), муравьиная, малеиновая, уксусная, молочная, сульфаминовая, гликолевая, этилендиамминтетрауксусная (и ее соль Трилон-Б).
* — полная растворимость, ** — данные по растворимости варьируются от «слабой» до «высокой», *** — для расчетов взята высокая растворимость.
Что в итоге удалось выяснить. Во-первых ЭДТА (и ее соли) несмотря на свои хелатирующие способности, очень слабо влияет на изменение массы минерала. Во-вторых метансульфоновая кислота растворяет столько же карбоната кальция, как и соляная кислота (количество близкое к теоретически рассчитанному). Дальше идет сульфаминовая (растворяет половину кальцита относительно соляной кислоты) и уксусная кислота — 1/3 кальцита относительно кальцита, растворяемого соляной кислотой. Малеиновая и молочная кислота прекращали работу из-за выпадения осадков солей. За одно и то же время соляная и метансульфоновая кислота расходовались полностью, сульфаминовая и уксусная кислота сохраняли реакционную способность. Интересно, что в отношении коррозионной способности метансульфоновая кислота показала наибольшую активность, затем шла сульфаминовая кислота, соляная кислота, молочная, малеиновая и уксусная. В принципе, данные полученные в работе, подтверждают выводы из статьи, где авторы установили, что муравьиная и уксусная кислоты оказывают наибольшее влияние на минералы элементов I и II групп (магний, кальций, стронций, барий), а щавелевая, лимонная и ЭДТА воздействовали на минералы элементов d-блока (хром, марганец, железо, медь, цинк, кадмий, золото, серебро, ртуть и т. д.).
д.).
Т.е. если накипь по большей части состоит из кальцита — логично использовать уксусную кислоту, а лучше всего смесь муравьиной и уксусной кислот. Если накипь состоит из разномастных минералов и окрашена в разные цвета (например, красно-коричневый, ищем свой вид ржавчины в статье), то в смеси с основными «боевыми» кислотам необходимо использовать комплексообразователи (вроде лимонной кислоты или солей ЭДТА).
ЭДТА и движение за биоразлагаемость
На территориях пост-СССР есть уверенность в том, что Трилон-Б заменит любую кислоту при удалении накипи. Как я писал ранее — это совершенно не так, эта соль ЭДТА будет работать доооолго-доооолго и требует
постоянной рециркуляциираствора (и нагревание ситуацию не улучшит). Есть у меня даже особая картинка по этому поводу (связана с удалением накипи в бойлерах, Н-не удаляет, П-удаляет полностью):
Что для реставрации монет хорошо, то для очистки чайника совсем никак. Кстати недавно в магазине я заметил средство MrMuscle от мыльного налета (читатель теперь уже знает, что это за мыльный налет). Посмотрел интереса ради состав:
Кстати недавно в магазине я заметил средство MrMuscle от мыльного налета (читатель теперь уже знает, что это за мыльный налет). Посмотрел интереса ради состав:
Ничего фантастического из Hi-End химии я там не нашел. Привычные уже неионогенные ПАВ да амфотерные ПАВ. Но еще был замечен редкий гость в наших краях Na4 иминодисукцинат — весьма посредственный комплексообразователь, который забирает немного меньше (230 мг) кальция чем Трилон-Б (280 мг). Основное же его преимущество — экологичность. По уровню биоразлагаемости с этим компонентом могут сравнится разве что нитрилотриуксусная кислота (NTA), которая считается канцерогенной), β-аланиндиуксусная кислота и метилглициндиуксусная кислота (Трилон M), которые стоят бешеных денег. Вот вам пример западного подхода. Наш брат бы навалил копеечного Трилон-Б да и был таков…
Отдельного внимания заслуживают «объекты несмовместимые с антинакипинами». Как правило сюда относятся поверхности НЕ устойчивые к кислотам — алюминий, цинк и оцинкованные изделия, медь и латунь, некоторые неблагородные металлы, эмалированные изделия и поверхности, мрамор, голубоватый песчаник, натуральный камень, стеклокерамика, анодированные покрытия. Кислоты, даже самые слабые, будут повреждать такие материалы, а значит их использовать нельзя. Хотя, например в случае использования лимонной кислоты и алюминия неплохо показывают себя ингибиторы коррозии из агариновой кислоты (или агарицина). В случае меди при обработке лимонной кислотой в качестве ингибитора коррозии используется краситель Fast Green FCF. Без кислот в чистом остатке остаются комплексообразователи+щадящее механическое воздействие. Кстати, комплексообразователи~хелатирующие кислоты (уже упомянутая ранее лимонная и этилендиамминтетрауксусная) нужно с осторожностью использовать при очистке позолоченных и посеребренных объектов. В этом случае целесообразнее использовать какую-нибудь простую неорганическую кислоту (соляную или серную), которая точно не вступит во взаимодействие.
Кислоты, даже самые слабые, будут повреждать такие материалы, а значит их использовать нельзя. Хотя, например в случае использования лимонной кислоты и алюминия неплохо показывают себя ингибиторы коррозии из агариновой кислоты (или агарицина). В случае меди при обработке лимонной кислотой в качестве ингибитора коррозии используется краситель Fast Green FCF. Без кислот в чистом остатке остаются комплексообразователи+щадящее механическое воздействие. Кстати, комплексообразователи~хелатирующие кислоты (уже упомянутая ранее лимонная и этилендиамминтетрауксусная) нужно с осторожностью использовать при очистке позолоченных и посеребренных объектов. В этом случае целесообразнее использовать какую-нибудь простую неорганическую кислоту (соляную или серную), которая точно не вступит во взаимодействие.
Так что при удалении накипи нужно определить что вам нужно. Если нужно быстро удалить огромные объемы смешанных отложений из труб — тогда целесообразнее использовать соляную (метансульфоновую, если удасться ее где-то найти) или сульфаминовую кислоту. Если необходимо убрать накипь из тонких труб системы охлаждения/котла или бойлера — можно осторожно использовать муравьиную кислоту или «горячий аммиак-цитрат» = in situ приготовленный цитрат аммония. Для «тонких» условий с большим количеством ржавчины — самый «толерантный» антинакипин — ЭДТА, лучше в виде (NH4)4ЭДТА.
Если необходимо убрать накипь из тонких труб системы охлаждения/котла или бойлера — можно осторожно использовать муравьиную кислоту или «горячий аммиак-цитрат» = in situ приготовленный цитрат аммония. Для «тонких» условий с большим количеством ржавчины — самый «толерантный» антинакипин — ЭДТА, лучше в виде (NH4)4ЭДТА.
Кстати, мой любимый «технологический антинакипин» — это уже упомянутый «аммиак-цитрат» (к 5% раствору лимонной кислоты добавляется нашатырный спирт до тех пор, пока рН смеси не станет 4-5). Работать он у меня может и при комнатных температурах (т.е. не требует обязательного кипячения). Секрет — добавка примерно 1% бифторида аммония. Естественно, что из-за фторидов такой состав применять для пищевой посуды запрещено категорически. Без использования добавок можно попробовать обработать нашатырным спиртом насыщенный раствор лимонной кислоты (~60 г/100 г воды) до рН 4. Полученный раствор в дальнейшем разбавлять до нужной концентрации (~10% неплохо работает без подогрева).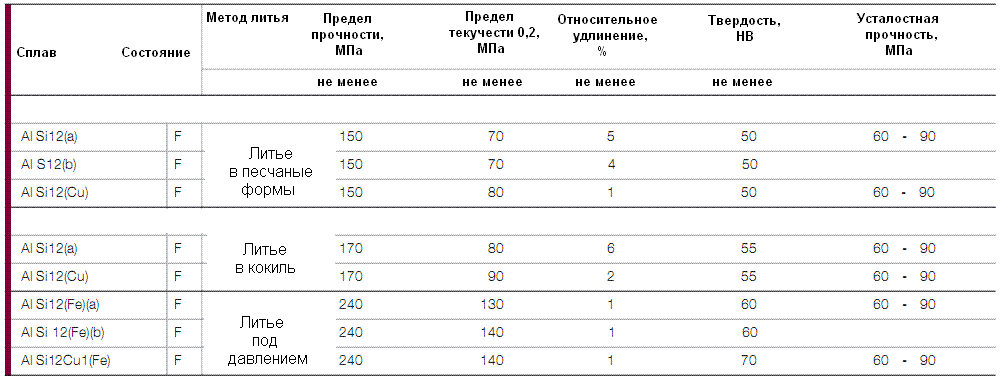
На это закругляюсь. Для тех, кто читает только введение и вывод пригодится вот это =>
краткий путеводитель по самым животрепещущим вопросам
Всем же остальным — просто посоветую подписаться на tg-канал LAB-66 и внимательно следить за обновлениями/задавать возникающие вопросы.
ПРИЛОЖЕНИЕ
Приложение А — Ассортимент антинакипин-средств в беларуских магазинах (критическая ревьюшка)
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
Langelier, W.F. Chemical equilibria in water treatment. J. Am. Water Works Assoc. 1946, 38, 169–178.
Ryznard, J.W. A new index for determining amount of calcium carbonate scale formed by a water. J. Am. Water. Works Assoc. 1944, 36, 472–486.
Puckorius, P.R.; Loretitsch, G.R. Cooling water scale and scale indices: What they mean—How to use them effectively—How they can cut treatment costs, IWC 99–47. In Proceedings of the International Water Conference, Pittsburgh, PA, USA, 18 October 1999; pp. 378–387.
In Proceedings of the International Water Conference, Pittsburgh, PA, USA, 18 October 1999; pp. 378–387.
Puckorius, R.; Brooke, J.M. A new practical index for calcium carbonate scale prediction in cooling systems. Corrosion 1991, 47, 280–284.
Larson, T.E.; Skold, R.V. Laboratory Studies Relating Mineral Quality of Water to Corrosion of Steel and Cast Iron; ISWS C-71; Illinois State Water Survey: Champaign, IL, USA, 1958; pp. 43–46
J. D. Rodriguez-Blanco, S. Shaw, and L.G. Benning, Nanoscale 3, 265-271 (2011).
M. A. Popescu, R. Isopescu, C. Matei, G. Fagarasan, and V. Plesu, Adv. Powder Technol. 25, 500-507 (2014).
S. Muryanto, A.P. Bayuseno, W. Sediono, and W. Mangestiyono, Educ. Chem. Eng. 7, e78-e84 (2012).
H. S. Ras and S. Ghizellaoui, Energy Procedia 18, 1511-1522 (2012).
Zeppenfeld, K. (2010). Prevention of CaCO3 scale formation by trace amounts of copper (II) in comparison to zinc (II). Desalination, 252(1-3), 60–65.
T. Waly, M.D. Kennedy, G.-J. Witkamp, G. Amy, and J.C. Schippers, Desalination 284, 279-287 (2012).
Cornwell, P. A. (2017). A review of shampoo surfactant technology: consumer benefits, raw materials and recent developments. International Journal of Cosmetic Science, 40(1), 16–30.
Z. Amjad (Ed.), Mineral Scale Formation and Inhibition: Proceedings of an American Chemical Society Symposium, Washington, D.C., 1994.
Meyer, H. J. (1984). The influence of impurities on the growth rate of calcite. Journal of Crystal Growth, 66(3), 639–646.
Gutjahr, A., Dabringhaus, H., & Lacmann, R. (1996). Studies of the growth and dissolution kinetics of the CaCO3 polymorphs calcite and aragonite II. The influence of divalent cation additives on the growth and dissolution rates. Journal of Crystal Growth, 158(3), 310–315.
Wada, N., Yamashita, K., & Umegaki, T. (1995). Effects of divalent cations upon nucleation, growth and transformation of calcium carbonate polymorphs under conditions of double diffusion. Journal of Crystal Growth, 148(3), 297–304.
Journal of Crystal Growth, 148(3), 297–304.
Nancollas, G. H., & Sawada, K. (1982). Formation of Scales of Calcium Carbonate Polymorphs: The Influence of Magnesium Ion and Inhibitors. Journal of Petroleum Technology, 34(03), 645–652.
Zhang, G., Ge, J., Sun, M., Pan, B., Mao, T., & Song, Z. (2007). Investigation of scale inhibition mechanisms based on the effect of scale inhibitor on calcium carbonate crystal forms. Science in China Series B: Chemistry, 50(1), 114–120.
Capitán-Vallvey, L. F., Fernández-Ramos, M. D., Álvarez de Cienfuegos Gálvez, P., & Santoyo-González, F. (2004). Calcium selective test strip for water and milk. The Analyst, 129(8), 783–788.
Cameron, B. A. Detergent considerations for consumers: laundering in hard water — How much extra detergent is required. J. Extension 49, 1-11 (2011).
Abeliotis, K.; Candan, C.; Amberg, C.; Ferri, A.; Osset, M.; Owens, J.; Stamminger, R. Impact of water hardness on consumers’ perception of laundry washing result in five European countries. Int. J. Consumer Stu. 39, 60-66(2015).
Int. J. Consumer Stu. 39, 60-66(2015).
Okada, N.; Fujii, T.; Okuyama, H. Removal of Oily Soils (Part 2) The relation of yellowing and residue with hard ions on fabrics. J. Home Econ. Jpn. 27, 215-220 (1976).
Purohit, P., Chandar, P., Vilinska, A., Ananthapadmanabhan, K. P., & Somasundaran, P. (2014). Effect of mixed surfactants on stratum corneum: a drying stress and Raman spectroscopy study. International Journal of Cosmetic Science, 36(4), 379–385.
Ananthapadmanabhan, K. P., Moore, D. J., Subramanyan, K., Misra, M., & Meyer, F. (2004). Cleansing without compromise: the impact of cleansers on the skin barrier and the technology of mild cleansing. Dermatologic Therapy, 17(s1), 16–25.
Chaumont, A., Voisin, C., Sardella, A., & Bernard, A. (2012). Interactions between domestic water hardness, infant swimming and atopy in the development of childhood eczema. Environmental Research, 116, 52–57
Young, S. L., & Matijević, E. (1977). Precipitation phenomena of heavy metal soaps in aqueous solutions. Journal of Colloid and Interface Science, 61(2), 287–301.
Precipitation phenomena of heavy metal soaps in aqueous solutions. Journal of Colloid and Interface Science, 61(2), 287–301.
Tanaka, A., Matsuda, A., Jung, K., Jang, H., Ahn, G., Ishizaka, S., … Matsuda, H. (2014). Ultra-pure Soft Water Ameliorates Atopic Skin Disease by Preventing Metallic Soap Deposition in NC/Tnd Mice and Reduces Skin Dryness in Humans. Acta Dermato Venereologica, 0.
Tommaso, D. D., & de Leeuw, N. H. (2010). Structure and dynamics of the hydrated magnesium ion and of the solvated magnesium carbonates: insights from first principles simulations. Phys. Chem. Chem. Phys., 12(4), 894–901.
Tansel, B., Sager, J., Rector, T., Garland, J., Strayer, R. F., Levine, L., … Bauer, J. (2006). Significance of hydrated radius and hydration shells on ionic permeability during nanofiltration in dead end and cross flow modes. Separation and Purification Technology, 51(1), 40–47.
Noble, R. E. (1999). Uptake of calcium and magnesium by human scalp hair from waters of different geographic locations. Science of The Total Environment, 239(1-3), 189–193.
Science of The Total Environment, 239(1-3), 189–193.
Hinners, T. A., Terrill, W. J., Kent, J. L., & Colucci, A. V. (1974). Hair-Metal Binding. Environmental Health Perspectives, 8, 191.
Bertrand, L., Doucet, J., Simionovici, A., Tsoucaris, G., & Walter, P. (2003). Lead-revealed lipid organization in human hair. Biochimica et Biophysica Acta (BBA) — General Subjects, 1620(1-3), 218–224.
Matsumoto, K., & Funaba, M. (2008). Factors affecting struvite (MgNh5PO4·6h3O) crystallization in feline urine. Biochimica et Biophysica Acta (BBA) — General Subjects, 1780(2), 233–239.
Kamal, M. S., Hussein, I., Mahmoud, M., Sultan, A. S., & Saad, M. A. S. (2018). Oilfield scale formation and chemical removal: A review. Journal of Petroleum Science and Engineering, 171, 127–139.
Basso, M., Simonato, M., Furlanetto, R., & De Nardo, L. (2017). Study of chemical environments for washing and descaling of food processing appliances: An insight in commercial cleaning products. Journal of Industrial and Engineering Chemistry, 53, 23–36.
Journal of Industrial and Engineering Chemistry, 53, 23–36.
Olajire, A. A. (2015). A review of oilfield scale management technology for oil and gas production. Journal of Petroleum Science and Engineering, 135, 723–737.
Lazo, D. E., Dyer, L. G., & Alorro, R. D. (2017). Silicate, phosphate and carbonate mineral dissolution behaviour in the presence of organic acids: A review. Minerals Engineering, 100, 115–123.
Ohgaki, K., Makihara, Y., Morishita, M., Ueda, M., & Hirokawa, N. (1991). Solute clusters in aqueous citric acid solutions. Chemical Engineering Science, 46(12), 3283–3287.
Морально поддержать автора, сейчас одного из когорты беларуских репрессированных ученых, можно подписав Открытое письмо (если %username% имеет какое-либо отношение к науке).
А еще можно стать патроном, или поблагодарить за информацию традиционными способами:
YooMoney 410018843026512, 5536 0800 1174 5555
крипта биткоин : 3QRyF2UwcKECVtk1Ep8scndmCBoRATvZkx
крипта эфир : 0x3Aa313FA17444db70536A0ec5493F3aaA49C9CBf
Материалы — Официальная вики Dual Universe
В Dual Universe материалы — это физические вещества, из которых состоят многие воксели игрового мира. Природные материалы с планет и других источников обычно называются материалами ландшафта. Они могут быть добыты и собраны игроками с помощью наноформера и снова размещены с помощью инструмента добычи в альтернативном режиме. Переработанные материалы, наряду со сплавами, создаются из ресурсов и других ингредиентов, и их можно использовать в режиме строительства для создания конструкций.
Природные материалы с планет и других источников обычно называются материалами ландшафта. Они могут быть добыты и собраны игроками с помощью наноформера и снова размещены с помощью инструмента добычи в альтернативном режиме. Переработанные материалы, наряду со сплавами, создаются из ресурсов и других ингредиентов, и их можно использовать в режиме строительства для создания конструкций.
Содержание
- 1 Рафинированные материалы
- 1.1 Продукты
- 1.2 Свойства материалов
- 1.3 Список свойств сотовых материалов
- 2 Материалы местности
- 2.1 Список материалов ландшафта
- 3 Каталожные номера
Очищенные материалы
Многие материалы не могут быть найдены естественным образом в мире; они должны быть созданы из ресурсов и других ингредиентов. Переработанные материалы представляют собой чистую форму руды и затем превращаются в катализаторы, продукты, соты и топливо. Эти материалы используются для формирования структуры Конструктов с использованием различных Строительных Инструментов. Их также можно использовать в крафте для создания компонентов или элементов.
Эти материалы используются для формирования структуры Конструктов с использованием различных Строительных Инструментов. Их также можно использовать в крафте для создания компонентов или элементов.
Продукты
Очищенное сырье составляет основу продуктов. Продукт – это материал, полученный путем смешивания нескольких чистых материалов. Он включает в себя металлические сплавы, полимеры, композитные материалы и стекло. Продукты создаются с использованием единиц плавильного завода, химической промышленности или стекловаренной промышленности.
Свойства материалов
Каждый материал обладает различными свойствами, благодаря которым он лучше подходит для различных целей. В зависимости от свойств материала и рецептов, для которых они могут быть использованы, некоторые материалы могут больше подходить для строительства или крафта. Например, железо можно использовать для строительства, как и любой другой материал, но оно наиболее полезно в качестве ресурса для крафта, потому что его можно использовать для создания других материалов, таких как сталь, которая прочнее. Некоторые материалы больше подходят для использования в Honeycomb для защиты элементов и ядра корабля от атак из-за более высокого сопротивления. Для изготовления некоторых потребуется несколько других редких материалов или механизмов. Эти материалы очень высокого класса и ценны, часто с особыми свойствами, и их можно использовать для создания продвинутых Элементов. [1] Соты могут быть изготовлены в различные типы, используя один и тот же материал, что дает различный внешний вид, см. таблицу идентификации сот для получения подробной информации.
Некоторые материалы больше подходят для использования в Honeycomb для защиты элементов и ядра корабля от атак из-за более высокого сопротивления. Для изготовления некоторых потребуется несколько других редких материалов или механизмов. Эти материалы очень высокого класса и ценны, часто с особыми свойствами, и их можно использовать для создания продвинутых Элементов. [1] Соты могут быть изготовлены в различные типы, используя один и тот же материал, что дает различный внешний вид, см. таблицу идентификации сот для получения подробной информации.
Список свойств сотовых материалов
| Значок | Имя | Масса: кг/м3 | л.с./м3 | Антивещество Сопротивление | Электромагнитный Сопротивление | Кинетический Сопротивление | Термик Сопротивление | Компоненты для крафта |
|---|---|---|---|---|---|---|---|---|
| Аль-Ли | 40 | 1800 | 0,60 | 0,60 | 0,50 | 0,70 | ||
| Алюминий | 50 | 2250 | 0,35 | 0,30 | 0,15 | 0,20 | Боксит (65 л) | |
| Кирпич | 8 | 360 | 0,10 | 0,10 | 0,10 | 0,10 | ||
| Кальций | 50 | 2250 | 0,45 | 0,40 | 0,25 | 0,30 | Известняк (65 л) | |
| Углерод | 25 | 1125 | 0,20 | 0,15 | 0,30 | 0,35 | Уголь (65 л) | |
| Углеродное волокно | 4 | 180 | 0,10 | 0,10 | 0,10 | 0,10 | ||
| Хром | 75 | 3375 | 0,25 | 0,45 | 0,30 | 0,40 | Хромит (65 л) | |
| Кобальт | 75 | 3375 | 0,45 | 0,65 | 0,50 | 0,60 | Кобальтит (65 л) | |
| Бетон | 12 | 540 | 0,10 | 0,10 | 0,10 | 0,10 | ||
| Медь | 100 | 4500 | 0,40 | 0,30 | 0,45 | 0,25 | Малахит (65 л) | |
| Дюралюминий | 40 | 1800 | 0,50 | 0,40 | 0,50 | 0,60 | ||
| Фтор | 25 | 1125 | 0,50 | 0,45 | 0,60 | 0,65 | Криолит (65 л) | |
| Золото | 100 | 4500 | 0,50 | 0,50 | 0,65 | 0,45 | Золотые самородки (65 л) | |
| Титановый сплав | класса 5 | 40 | 1800 | 0,75 | 0,65 | 0,75 | 0,85 | |
| Инконель | 60 | 2700 | 0,60 | 0,70 | 0,60 | 0,50 | ||
| Железо | 100 | 4500 | 0,30 | 0,20 | 0,35 | 0,15 | Гематит (65 л) | |
| Литий | 25 | 1125 | 0,40 | 0,35 | 0,50 | 0,55 | Петалит (65 л) | |
| Мангаллой | 60 | 2700 | 0,75 | 0,85 | 0,75 | 0,65 | ||
| Марганец | 75 | 3375 | 0,55 | 0,75 | 0,60 | 0,70 | Родонит (65 л) | |
| Стареющая сталь | 60 | 2700 | 0,70 | 0,80 | 0,70 | 0,60 | ||
| Мрамор | 10 | 450 | 0,10 | 0,10 | 0,10 | 0,10 | ||
| никель | 75 | 3375 | 0,35 | 0,55 | 0,40 | 0,50 | Гарниерит (65 л) | |
| Ниобий | 100 | 4500 | 0,70 | 0,60 | 0,75 | 0,55 | Колумбит (65 л) | |
| Пластик | 20 | 900 | 0,40 | 0,40 | 0,40 | 0,40 | ||
| Ск-Ал | 40 | 1800 | 0,70 | 0,60 | 0,70 | 0,80 | ||
| Скандий | 50 | 2250 | 0,65 | 0,60 | 0,45 | 0,50 | Колбекит (65 л) | |
| Кремний | 75 | 3375 | 0,15 | 0,35 | 0,20 | 0,30 | Кварц (65 л) | |
| Силумин | 40 | 1800 | 0,40 | 0,30 | 0,40 | 0,50 | ||
| Серебро | 100 | 4500 | 0,50 | 0,40 | 0,55 | 0,35 | Акантит (65 л) | |
| Натрий | 25 | 1125 | 0,30 | 0,25 | 0,40 | 0,45 | Натрон (65 л) | |
| Нержавеющая сталь | 60 | 2700 | 0,50 | 0,60 | 0,50 | 0,40 | ||
| Сталь | 60 | 2700 | 0,40 | 0,50 | 0,40 | 0,30 | ||
| Сера | 50 | 2250 | 0,55 | 0,50 | 0,35 | 0,40 | Пирит (65 л) | |
| Титан | 25 | 1125 | 0,60 | 0,55 | 0,70 | 0,75 | Ильменит (65 л) | |
| Ванадий | 50 | 2250 | 0,75 | 0,70 | 0,55 | 0,60 | Ванадинит (65 л) | |
| Дерево | 6 | 270 | 0,10 | 0,10 | 0,10 | 0,10 |
[2] [3]
Материалы ландшафта
Материалы ландшафта — это природные материалы, такие как почва, камень, песок, снег и т. д., полученные с планет, лун и астероидов. Они могут быть собраны игроками с помощью инструментов, поддерживающих режим раскопок, таких как Mining Tool или Terraforming Tool, и после сбора снова размещены с помощью Mining Tool в альтернативном режиме. Эти материалы составляют огромное количество естественных вокселей, встречающихся в игровом мире.
д., полученные с планет, лун и астероидов. Они могут быть собраны игроками с помощью инструментов, поддерживающих режим раскопок, таких как Mining Tool или Terraforming Tool, и после сбора снова размещены с помощью Mining Tool в альтернативном режиме. Эти материалы составляют огромное количество естественных вокселей, встречающихся в игровом мире.
Список материалов местности
| Значок | Имя |
|---|---|
| Лесная почва | |
| Лунная почва | |
| Рок | |
| Песок | |
| Снег | |
| Почва |
Ссылки
- ↑ JC Baillie, «Dual Universe GDC 2017 Meetup», Отметка времени: 30:20. https://www.youtube.com/watch?v=supFNqs-IpA. 28.02.2017.
- ↑ Канал Dual Universe на YouTube, «Обновления дневника разработчиков Dual Universe — апрель 2017 г.
 | Предварительное альфа-видео», Отметка времени: 2:12, https://www.youtube.com/watch?v=GVJyfKNeOao. 10.05.2017.
| Предварительное альфа-видео», Отметка времени: 2:12, https://www.youtube.com/watch?v=GVJyfKNeOao. 10.05.2017. - ↑ Dual Universe: MMO с одним осколком в космосе встречает Minecraft — Отметка времени 04:48: https://www.youtube.com/watch?v=W8cLaCn5A94. 4 марта 2017 г.
Français
Контент сообщества доступен по лицензии CC BY-NC-SA 3.0, если не указано иное.
Как использовать «силумин» в предложении – WriteBetter
118 точный
« Компактный
W ikipedia 500|$|Другие виды использования {{элементного}} бария {{второстепенные} и}} включают добавку к силумин (алюминий –кремниевые сплавы), который улучшает их структуру, {{а также}} … ✕
Прочие области применения элементарного бария незначительны и включают добавку к силумину (алюминиево-кремниевые сплавы), улучшающую их структуру, а также…
W ikipedia 2500|$|icon – кремний чистотой 95–99%. Около 55% мирового потребления кремния металлургической чистоты идет на производство алюминиево-кремниевых сплавов (силуминовых сплавов) для литья алюминиевых деталей, в основном для использования в автомобильной промышленности. Важность кремния в литье алюминия заключается в том, что значительно большое количество (12%) кремния в алюминии образует эвтектическую смесь, которая затвердевает с очень небольшим тепловым сжатием. ✕
Около 55% мирового потребления кремния металлургической чистоты идет на производство алюминиево-кремниевых сплавов (силуминовых сплавов) для литья алюминиевых деталей, в основном для использования в автомобильной промышленности. Важность кремния в литье алюминия заключается в том, что значительно большое количество (12%) кремния в алюминии образует эвтектическую смесь, которая затвердевает с очень небольшим тепловым сжатием. ✕
Свойства кремния можно использовать для модификации сплавов с другими металлами, кроме железа. […] “Металлургический” […] кремний кремний 9чистота 5–99 %. Около 55% мирового потребления кремния металлургической чистоты идет на производство алюминиево-кремниевых сплавов ( сплавы силумина ) для литья алюминиевых деталей, в основном для использования в автомобильной промышленности. Важность кремния в литье алюминия заключается в том, что значительно большое количество (12%) кремния в алюминии образует эвтектическую смесь, которая затвердевает с очень небольшим тепловым сжатием. Это значительно уменьшает разрывы и трещины, образующиеся из-за напряжения, когда литейные сплавы охлаждаются до твердости. Кремний также значительно улучшает твердость и, следовательно, износостойкость алюминия.
Это значительно уменьшает разрывы и трещины, образующиеся из-за напряжения, когда литейные сплавы охлаждаются до твердости. Кремний также значительно улучшает твердость и, следовательно, износостойкость алюминия.
W ikipedia 50|$|Корпус из медного силуминового {{алюминиевого}} сплава. ✕
Медь силумин корпус из алюминиевого сплава.
R поиск 40|$|Исследование, {{представляет}} результаты исследования новых марок силуминов, содержащих: 7, 0 ÷ 17, 0 % Si, 4, 0 % Ni, 4, 0 % Cu и 0, 5 % Cr, Mo, W каждый {{а также}} V. Испытания на воздействие проводились ou ✕
В исследовании представлены результаты исследования новых марок силумины , содержащие: 7,0 ÷ 17,0 % Si, 4,0 % Ni, 4,0 % Cu и 0,5 % Cr, Mo, W каждого, а также V. – добавка сурьмы, модификация стронцием и фосфором, процессы пересыщения и старения – на микроструктуру и твердость силуминов . Выявлено, что исследованных силуминов, в зависимости от состояния, характеризуются твердостью в пределах 80 ÷ 180 HB…
Выявлено, что исследованных силуминов, в зависимости от состояния, характеризуются твердостью в пределах 80 ÷ 180 HB…
R search 40|$| }} исследования кристаллизации, {{микроструктуры}} и механических свойств гипо-, гипер- и эвтектических силуминов с добавками: Cr, Mo, W и V в количестве около 0,05 % представлены. Влияние Sb, Sr и P вместе с Ti + B на ✕
В работе представлены результаты исследований кристаллизации, микроструктуры и механических свойств гипо-, гипер- и эвтектических силуминов с добавками: Cr, Mo, W и V в количестве около 0,05 %. . Приведено влияние Sb, Sr и P совместно с Ti + B на процесс кристаллизации силуминов . Представлены результаты: испытаний микроструктуры, Rm, Rp 0, 2, А 5 и НВ силуминов после дисперсионного твердения и термической обработки при температуре 560 °С/3 мин и охлаждения водой…
R поиск 40|$|Проанализированы {{основные}} {{подходы}} модификации силуминов. Результаты {{влияния}} различных комплексных модификаторов на структуру и свойства алюминиево-кремниевых сплавов ✕
Результаты {{влияния}} различных комплексных модификаторов на структуру и свойства алюминиево-кремниевых сплавов ✕
Проанализированы основные подходы к модифицированию силуминов . Представлены результаты влияния различных комплексных модификаторов на структуру и свойства алюминиево-кремниевых сплавов. Перспективы производства 9Проанализировано 0879 силуминов , отличающихся не только прочностными, но и пластическими свойствами.
W ikipedia 5000|$|Силумин — это {{группа}} легких, {{высокопрочных}} алюминиевых сплавов на основе системы алюминий-кремний. . Алюминиево-кремниевые сплавы содержат ✕
Силумин — группа легких высокопрочных алюминиевых сплавов на основе алюминиево-кремниевой системы. Алюминиево-кремниевые сплавы содержат от 3 до 25% кремния. Литье является основным применением алюминиево-кремниевых сплавов, но их также можно использовать в процессах быстрого отверждения и в порошковой металлургии. Сплавы, применяемые методом порошковой металлургии, а не литьем, могут содержать еще больше кремния, до 50 %. Силумин обладает высокой коррозионной стойкостью, что позволяет использовать его во влажной среде.
Сплавы, применяемые методом порошковой металлургии, а не литьем, могут содержать еще больше кремния, до 50 %. Силумин обладает высокой коррозионной стойкостью, что позволяет использовать его во влажной среде.
W ikipedia 5000|$|Другие виды использования {{элементарного}} бария {{незначительные}} и включают добавку в силумин (сплавы алюминия и кремния), улучшающую их структуру, { {а также}} … ✕
Прочие области применения элементарного бария незначительны и включают добавку к силумину (сплавы алюминия и кремния), улучшающую их структуру, а также …
W ikipedia 5000|$|с силиконом. Варианты алюминиево-кремниевых сплавов {{предназначенные}} для литья (и поэтому {{не включенные}} в серию 4000) также известны как силумин. ✕
… серии 4000 сплав с кремнием. Разновидности алюминиево-кремниевых сплавов, предназначенные для литья (и поэтому не входящие в серию 4000), также известны как силумин .
R поиск 40|$|В работе {{представлены}} результаты анализа кристаллизации и микроструктуры нелегированных силуминов, содержащих: 2, 0 ÷ 6, 0 % Si и легирующих добавок, ориентировочно: 4,0 % Ni, 4,0 % Cu и 0,5 % Mg, знание которых ✕
В работе представлены результаты анализа кристаллизации и микроструктуры нелегированных силуминов , содержащих: 2,0 ÷ 6,0 % Si и легирующих добавок, ориентировочно: 4,0 % Ni, 4 , 0 % Cu и 0,5 % Mg, о которых известно еще очень мало. Доказано, что в нелегированных силуминах , увеличение концентрации кремния вызывает увеличение времени кристаллизации эвтектической смеси α+ и измельчение дендритов α-фазы. Это также вызывает повышение температуры кристаллизации эвтектической смеси α+. Легирующие добавки: Ni, Cu и Mg снижают примерно на 30°С температуры ликвидуса и солидуса 9°С.0879 силуминов и увеличить время их кристаллизации примерно на 100 сек. по сравнению с нелегированными силуминами . Вызвано кристаллизацией дополнительных фаз Al 3 NiCu, Mg 2 Si и Al 2 Cu. Никель, медь и магний улучшают микроструктуру отливок…
Вызвано кристаллизацией дополнительных фаз Al 3 NiCu, Mg 2 Si и Al 2 Cu. Никель, медь и магний улучшают микроструктуру отливок…
R исследование 40|$|предложено}} механизм {{влияния}} режимов деформации на зернистую структуру и крупность фаз, определяющих повышение пластичности для силуминов и низколегированных сталей. В частности, знакопеременный характер деформации при винтовой прокатке (ВП) обеспечивает уменьшение размера зерна в 5 – 6 раз по сравнению с ✕
Предложена рабочая гипотеза механизма влияния режимов деформации на зернистую структуру и крупность фаз, определяющих повышение пластичности силуминов , и низколегированных сталей. В частности, знакопеременный характер деформации при винтовой прокатке (ВП) обеспечивает уменьшение размера зерна в 5-6 раз по сравнению с продольной прокаткой. Для заэвтектических силуминов с ГВ можно получить полигонизированную субзернистую структуру, увеличить зернистость α-твердого раствора и крупность кристаллов кремния, придав им глобулярную форму, и тем самым обеспечить способность к обработке под давлением. Важную роль в повышении деформационной способности 9Силумин 0879 отличается новой технологией модифицирующей обработки расплава и оптимальными температурно-скоростными режимами деформации. © 2013 Springer Science+Business Media New York…
Важную роль в повышении деформационной способности 9Силумин 0879 отличается новой технологией модифицирующей обработки расплава и оптимальными температурно-скоростными режимами деформации. © 2013 Springer Science+Business Media New York…
R search 40|$|В {{данной работе}} {{результаты}} {{исследований}} заэвтектических силуминов {{для использования в качестве}} портов движка были показаны. Новое представление о механизме взаимодействия фосфора при модифицировании заэвтектики ✕
В работе представлены результаты исследований заэвтектики силуминов для использования в качестве моторных портов. Показано новое представление о механизме взаимодействия фосфора при модифицировании заэвтектических силуминов . Согласно этой гипотезе влияние фосфора является результатом местного переохлаждения, вызванного испарением и разгерметизацией паров фосфора. На основании предложить принципиальную схему возникновения локального переохлаждения в результате испарения фосфора на микроучастках с различной концентрацией кремния исследуемых сплавов Al-Si. ..
..
W ikipedia 50|$|В числовой {{обозначение}} системе Алюминиевой ассоциации силумин {{соответствует}} сплавы двух систем: 3xxx, алюминиево-кремниевые сплавы, также содержащие магний и/или медь, и 4xx.x – Binary alu ✕
В системе цифровых обозначений Алюминиевой ассоциации силумин соответствует сплавам двух систем: 3xxx, алюминиево-кремниевым сплавам, также содержащим магний и/или медь, и 4xx.x – Бинарные алюминиево-кремниевые сплавы. Медь повышает прочность, но снижает коррозионную стойкость.
W ikipedia 50|$|scous when жидкий, который вместе с его низкой стоимостью, поскольку оба компонента относительно дешевы в извлечении, делает его очень хорошим сплавом для литья. Силумин с хорошей литейной способностью может дать более прочную готовую отливку, чем потенциально более прочный сплав, который {{труднее}} отливать. ✕
Добавление кремния к алюминию также делает его менее вязким в жидком состоянии, что вместе с его низкой стоимостью, поскольку оба составных элемента относительно дешевы в извлечении, делает его очень хорошим сплавом для литья. Силумин с хорошей литейной способностью может давать более прочную готовую отливку, чем потенциально более прочный сплав, который сложнее отливать.
Силумин с хорошей литейной способностью может давать более прочную готовую отливку, чем потенциально более прочный сплав, который сложнее отливать.
W ikipedia 5000|$| автомобиль {{был оснащен}} шестицилиндровым рядным двигателем Tatra 17 с жидкостным охлаждением […] и мощностью 35 л.с. (26 кВт). Блок изготовлен из силумина, а головки блока цилиндров из алюминия. Это была первая Татра с аккумуляторной батареей зажигания. Максимально достижимая скорость тяжелого автомобиля массой 1130 кг составляла 100 ✕
Первоначально автомобиль оснащался шестицилиндровым рядным двигателем Tatra 17 с верхним расположением распредвала […] жидкостного охлаждения мощностью […] 35 л.с. (26 кВт). Блок был изготовлен из силумина и ГБЦ из алюминия. Это была первая Татра с аккумуляторной батареей зажигания. Максимально достижимая скорость тяжелого автомобиля массой 1130 кг составляла 100 км/ч. Всего до 25 сентября 1926 г. было изготовлено 205 машин.
было изготовлено 205 машин.
R поиск 40|$|Назначение. Как правило, {{вторичные}} силумины {{характеризуются}} более низким качеством, чем их первичные аналоги. При изготовлении сплавов большое количество интерметаллидов, ✕
Цель. Как правило, вторичные силумины характеризуются более низким качеством, чем их первичные аналоги. При производстве сплавов игнорируется большое количество интерметаллидов, прежде всего на основе железа, в их составе. Для достижения оптимального уровня свойств необходим поиск путей адаптации рафинировочно-модифицирующей, термической и лазерной обработки к особенностям структуры вторичных сплавов Al-Si. Методология. Исследования проводились с использованием стандартных методов металлографического анализа, определения литейных, механических и служебных свойств сплавов по ротационным планам многофакторных экспериментов. Результаты. Установлено, что при производстве вторичных 9 необходима рафинирующая модифицирующая обработка. 0879 силуминов , так как позволяет эффективно воздействовать на выделения железосодержащих фаз, изменяя их морфологию, размеры и распределение, и повышать эффективность дальнейшей обработки в твердом состоянии. Установлено, что стандартные режимы термообработки не являются оптимальными для вторичных силуминов . Лазерная обработка показала высокую эффективность в повышении прочности, износостойкости, коррозионной и кавитационной стойкости вторичных сплавов Al-Si, а повышенное содержание железа способствовало дополнительному твердорастворному упрочнению. Оригинальность. Установлено, что после рафинирующе-модифицирующей обработки фаза Al 5 SiFe, кристаллизующаяся в виде длинных вытянутых пластин, превращается в фазу Al 15 (FeMn) 3 Si 2 скелетной или полиэдрической формы. Связь между содержанием железа во вторичном силуминов и время выдержки при термообработке, обеспечивающее оптимум механических свойств. Доказано, что присутствие железосодержащих интерметаллидов Al 5 SiFe приводит к уменьшению глубины упрочненного слоя при лазерной обработке.
0879 силуминов , так как позволяет эффективно воздействовать на выделения железосодержащих фаз, изменяя их морфологию, размеры и распределение, и повышать эффективность дальнейшей обработки в твердом состоянии. Установлено, что стандартные режимы термообработки не являются оптимальными для вторичных силуминов . Лазерная обработка показала высокую эффективность в повышении прочности, износостойкости, коррозионной и кавитационной стойкости вторичных сплавов Al-Si, а повышенное содержание железа способствовало дополнительному твердорастворному упрочнению. Оригинальность. Установлено, что после рафинирующе-модифицирующей обработки фаза Al 5 SiFe, кристаллизующаяся в виде длинных вытянутых пластин, превращается в фазу Al 15 (FeMn) 3 Si 2 скелетной или полиэдрической формы. Связь между содержанием железа во вторичном силуминов и время выдержки при термообработке, обеспечивающее оптимум механических свойств. Доказано, что присутствие железосодержащих интерметаллидов Al 5 SiFe приводит к уменьшению глубины упрочненного слоя при лазерной обработке. Установлено, что с увеличением концентрации железа скорость коррозии вторичных силуминов через 3…
Установлено, что с увеличением концентрации железа скорость коррозии вторичных силуминов через 3…
R поиск 40|$|Силумины {{широко}} используются в автомобилестроении. , {{авиационной}} и судостроительной промышленности; с удельным весом почти в три раза ниже ✕
Силумины широко применяются в автомобильной, авиационной и судостроительной промышленности; Имея удельный вес почти в три раза ниже удельного веса чугуна, силумины могут характеризоваться высокими механическими свойствами. Кроме того, они обладают хорошими литейными свойствами, хорошей обрабатываемостью и хорошей теплопроводностью. я. е. свойства, требуемые для деталей машин, работающих в условиях высоких температур и значительных нагрузок. Механические свойства силумины можно модернизировать, осуществляя соответствующим образом подобранную термическую обработку. В работе представлено влияние процессов модифицирования и термической обработки на механические свойства сплава ЭН-АЦ-AlSi 9 Cu 3 (Fe). Исследуемый сплав подвергался типичным процессам модификации и рафинирования, а также последующей термической обработке. Температурный диапазон операций термообработки определяли на основе кривых метода АПД. Полученные результаты касаются зарегистрированных кривых плавления и затвердевания методом АПД и испытаний на прочность. На основании проведенных испытаний определен диапазон параметров термообработки, обеспечивающий получение наилучших возможных механических свойств EN AC-AlSi 9.Сплав Cu 3 (Fe)…
Исследуемый сплав подвергался типичным процессам модификации и рафинирования, а также последующей термической обработке. Температурный диапазон операций термообработки определяли на основе кривых метода АПД. Полученные результаты касаются зарегистрированных кривых плавления и затвердевания методом АПД и испытаний на прочность. На основании проведенных испытаний определен диапазон параметров термообработки, обеспечивающий получение наилучших возможных механических свойств EN AC-AlSi 9.Сплав Cu 3 (Fe)…
R исследование 40|$|В работе {{представлены}} результаты исследования методом АПД гипо-, около- и гиперутектических силуминов кристаллизация, содержащая следующие легирующие добавки: Mg, Ni, Cu, Cr, Mo, W, V. Показано, что в зависимости от их концентрации ✕
В данной работе представлены результаты исследования методом АПД гипо-, около- и гиперутектические силумины кристаллизации , содержащие следующие легирующие добавки: Mg, Ni, Cu, Cr, Mo, W, V. Показано, что в зависимости от их концентрации могут кристаллизоваться доэвтектические или эвтектические многокомпонентные фазы содержащие эти легирующие добавки. Выявлено, что любая последующая закристаллизовавшаяся фаза зарождается и растет вблизи границы раздела жидкая/бывшая закристаллизовавшаяся фаза. В многофазное соединение попадает также кремний, что приводит к уменьшению его количества и дроблению в эвтектической смеси. В результате он получает высокую твердость силумины в плане 110 – 220 HB…
Показано, что в зависимости от их концентрации могут кристаллизоваться доэвтектические или эвтектические многокомпонентные фазы содержащие эти легирующие добавки. Выявлено, что любая последующая закристаллизовавшаяся фаза зарождается и растет вблизи границы раздела жидкая/бывшая закристаллизовавшаяся фаза. В многофазное соединение попадает также кремний, что приводит к уменьшению его количества и дроблению в эвтектической смеси. В результате он получает высокую твердость силумины в плане 110 – 220 HB…
Вт икипедия 50|$|иний-кремниевый (медь-силуминовый) сплав – как у более ранних фотоаппаратов Nikon FM (введена в 1977) и FE (1978). Nikon FE2 и FA 1983 года также имели конструкцию из силуминового сплава, как и Nikon FM3A ограниченного производства 2001 года, хотя конструкция корпуса отличается от модели к модели. ✕
Фотокамера FM2 относится к классическим компактным зеркальным фотокамерам Nikon серии F и изготовлена из того же материала — медно-алюминиево-кремниевого (медно-силуминового) сплава — что и более ранняя камера Nikon FM (представленная в 1977) и FE (1978). Nikon FE2 и FA 1983 года также имели конструкцию из сплава силумин , как и Nikon FM3A ограниченного производства 2001 года, хотя конструкция корпуса отличается от модели к модели.
Nikon FE2 и FA 1983 года также имели конструкцию из сплава силумин , как и Nikon FM3A ограниченного производства 2001 года, хотя конструкция корпуса отличается от модели к модели.
W ikipedia 5000|$|h Встроенные плавники были вкручены в термообработанные головки из сплава Y. Поршни также были из термообработанного сплава Y. Картер был отлит из термообработанного сплава силумин, а некоторые мелкие детали – из магниевого сплава. Одноходовой коленчатый вал из двух частей {{был соединен}} с поршнями с главным шатуном из сплава Y-образного сечения с цельным большим концом, который нес о ✕
Это был обычный радиальный двигатель с воздушным охлаждением: стволы из азотированной стали со встроенными ребрами были ввинчены в головки из термообработанного Y-образного сплава. Поршни также были из термообработанного сплава Y. Картер отлит из термообработанного силумина сплава , а некоторые мелкие детали – из магниевого сплава. Одноходовой коленчатый вал, состоящий из двух частей, был соединен с поршнями с помощью главной тяги из сплава Y-образного сечения с цельной большой головкой, на которой находились остальные восемь поршневых шатунов.
Одноходовой коленчатый вал, состоящий из двух частей, был соединен с поршнями с помощью главной тяги из сплава Y-образного сечения с цельной большой головкой, на которой находились остальные восемь поршневых шатунов.
W ikipedia 5000|$|Алюминиево-кремниевые сплавы (называемые силуминовыми сплавами) {{интенсивно}} {{используются}} {{используются} в литейной промышленности}} {{алюминиевых}} сплавов, где кремний { {является наиболее}} важной добавкой t ✕
Алюминиево-кремниевые сплавы (называемые сплавами силумина ) широко используются в литейной промышленности алюминиевых сплавов, где кремний является единственной наиболее важной добавкой к алюминию для улучшения его литья характеристики. Поскольку литой алюминий широко используется в автомобильной промышленности, это использование кремния, таким образом, является крупнейшим промышленным использованием (около 55% от общего количества) […] «металлургического качества» [. ..] чистого кремния (поскольку это очищенный кремний добавляют к чистому алюминию, тогда как ферросилиций никогда не очищают перед добавлением в сталь).
..] чистого кремния (поскольку это очищенный кремний добавляют к чистому алюминию, тогда как ферросилиций никогда не очищают перед добавлением в сталь).
R search 40|$|Цель: В работе {{представлены}} результаты исследований силуминов с добавками Mg, Ni, Cu, Cr, Mo и W. силумины, содержащие Mg, Cu и Ni, хорошо известны и широко используются в конструкции ✕
Цель: В работе представлены результаты исследований, проведенных на силуминах с добавками Cu, Cr, Mo и W. Силумины , содержащие Mg, Cu и Ni, хорошо известны и широко используются в конструкции машин и оборудования. Дизайн/методология/подход: Добавки Cr, Mo и W еще не были тщательно исследованы. Они считаются новым семейством инновационных литейных алюминиевых сплавов. Выводы: В системах Al-Si они образуют силициды, такие как Cr 3 Si, Mo 3 Si, W 3 Si и интерметаллические фазы Al 13 Cr 4 Si 4, Al 12 Mo, Al 12 W и AlWSi. Силициды кристаллизуются в кубической решетке с параметрами, близкими к алюминию и кремнию. Ограничения/выводы исследования: Следовательно, они могут выступать в качестве субстратов для кристаллизации и образовываться в виде отдельных фаз. Исследования под микроскопом и микрорентгеноспектральный анализ линейного и точечного распределения элементов подтвердили наличие указанных фаз. Сочетание двух элементов, т.е. грамм. Было обнаружено, что Cr и Mo или Cr и W вызывают образование сложных силицидных слоев Mo 3 Si и (Cr, Mo) 3 Si или Cr 3 Si, а также (W, Cr) 3 Si. Оригинальность/ценность: присутствие силицидов было указано как возможный источник измельчения фаз α(Al) и β(Si). Выделения этих фаз и интерметаллических фаз способствуют высокой степени силумины закалка. Характерной особенностью является то, что зарождение и кристаллизация последующих фаз происходит на границах фаз, образующихся между ранее осажденной фазой и твердым раствором α. Проведенные к настоящему времени исследования показали, что в силуминах комплекса при высоких температурах кристаллизуются силициды и перитектические фазы Al 12 W, AlWSi, Al 12 Mo и Al 13 Cr 4 Si 4.
Ограничения/выводы исследования: Следовательно, они могут выступать в качестве субстратов для кристаллизации и образовываться в виде отдельных фаз. Исследования под микроскопом и микрорентгеноспектральный анализ линейного и точечного распределения элементов подтвердили наличие указанных фаз. Сочетание двух элементов, т.е. грамм. Было обнаружено, что Cr и Mo или Cr и W вызывают образование сложных силицидных слоев Mo 3 Si и (Cr, Mo) 3 Si или Cr 3 Si, а также (W, Cr) 3 Si. Оригинальность/ценность: присутствие силицидов было указано как возможный источник измельчения фаз α(Al) и β(Si). Выделения этих фаз и интерметаллических фаз способствуют высокой степени силумины закалка. Характерной особенностью является то, что зарождение и кристаллизация последующих фаз происходит на границах фаз, образующихся между ранее осажденной фазой и твердым раствором α. Проведенные к настоящему времени исследования показали, что в силуминах комплекса при высоких температурах кристаллизуются силициды и перитектические фазы Al 12 W, AlWSi, Al 12 Mo и Al 13 Cr 4 Si 4. Фазы α или β являются следующими кристаллизуются с последующей сложной эвтектикой α + β + Al(Si, Cr, Mo, W, Fe). Далее кристаллизуются фазы Mg 2 Si, Al 3 Ni и Al 2 Cu. 9Представленные здесь силумины 0879 характеризуются высокими механическими свойствами: Rp 0, 2 = 320 – 420 МПа, Rm = 400 – 520 МПа, А 5 = 0,5 – 5,0 % и повышенной твердостью 145 – 210 HB. Будут проведены дальнейшие исследования по оптимизации химического состава силуминов и параметров процесса дисперсионного твердения для получения сплавов, характеризующихся оптимальным сочетанием прочности, пластичности и твердости…
Фазы α или β являются следующими кристаллизуются с последующей сложной эвтектикой α + β + Al(Si, Cr, Mo, W, Fe). Далее кристаллизуются фазы Mg 2 Si, Al 3 Ni и Al 2 Cu. 9Представленные здесь силумины 0879 характеризуются высокими механическими свойствами: Rp 0, 2 = 320 – 420 МПа, Rm = 400 – 520 МПа, А 5 = 0,5 – 5,0 % и повышенной твердостью 145 – 210 HB. Будут проведены дальнейшие исследования по оптимизации химического состава силуминов и параметров процесса дисперсионного твердения для получения сплавов, характеризующихся оптимальным сочетанием прочности, пластичности и твердости…
R поиск 40|$|Термодинамический дан анализ}} процессов образования пузырей водорода на кристаллизующихся фазах и образования Al 2 O 3 при твердении силуминов. Показано, что наиболее эффективными центрами образования и роста водородных пузырьков являются более ровные поверхности кристаллов o ✕
Приведен термодинамический анализ процессов образования пузырьков водорода на кристаллизующихся фазах и образования Al 2 O 3 при твердении силуминов . Показано, что наиболее эффективными центрами образования и роста водородных пузырьков являются более ровные поверхности кристаллов α- и β-фазы.
Показано, что наиболее эффективными центрами образования и роста водородных пузырьков являются более ровные поверхности кристаллов α- и β-фазы.
R поиск 40|$|управление компьютером. Исследование показало, что использование формы, охлаждаемой струей водяного тумана, позволяет формировать микроструктуру заэвтектических силуминов. Широкий диапазон температур затвердевания заэвтектических силуминов увеличивает потенциальное воздействие изменения скорости охлаждения от размера, количества и морфологии доэвтектического кремния и эвтектики α+β (Al+Si) … ✕
Работа является продолжением исследований по использованию водяного тумана для повышения эффективности литья алюминиевых сплавов с использованием многоточечной системы водяного охлаждения. В работе представлены результаты исследования процесса кристаллизации и микроструктуры синтетического заэвтектического сплава AlSi 20. Отливки изготавливались в постоянных формах, охлаждаемых струей водяного тумана. Исследование проводилось для немодифицированного сплава AlSi 20 и модифицированного фосфором, титаном и бором на исследовательской станции, позволяющей осуществлять последовательное многоточечное охлаждение с помощью специальной программы компьютерного управления. Исследование показало, что использование формы, охлаждаемой струей водяного тумана, позволяет формировать микроструктуру заэвтектических силумины. Широкий диапазон температур затвердевания заэвтектических силуминов увеличивает потенциальное влияние изменения скорости охлаждения на размер, количество и морфологию доэвтектического кремния и эвтектики α+β (Al+Si) …
Исследование проводилось для немодифицированного сплава AlSi 20 и модифицированного фосфором, титаном и бором на исследовательской станции, позволяющей осуществлять последовательное многоточечное охлаждение с помощью специальной программы компьютерного управления. Исследование показало, что использование формы, охлаждаемой струей водяного тумана, позволяет формировать микроструктуру заэвтектических силумины. Широкий диапазон температур затвердевания заэвтектических силуминов увеличивает потенциальное влияние изменения скорости охлаждения на размер, количество и морфологию доэвтектического кремния и эвтектики α+β (Al+Si) …
Вт ikipedia 5000|$|тор […] “Солекс” […] и бесконтактная система зажигания на микроконтроллере (что и снижает расход топлива и улучшает подачу масла), силумин радиатор и многие другие. В 1993, переходная игра была выпущена со штатным двигателем ВАЗ-2121. ✕
ВАЗ-21213 (первоначальное название [. ..] “Тайга” […] не прижилось) – рестайлинговая модель […] “Нива” […] 1993 г. с переработанная задняя часть кузова с малой погрузочной высотой (иная форма задних дверей и задних фонарей), более мощный и тяговитый двигатель ВАЗ-21213 (1,7 л, 81,8 л.с., 125 Нм) с карбюратором […]” Solex ” […] и бесконтактная система зажигания на микроконтроллере (что и снижает расход топлива и улучшает подачу масла), 9Радиатор 0879 Силумин и многие другие. В 1993 году была выпущена переходная игра со штатным двигателем ВАЗ-2121.
..] “Тайга” […] не прижилось) – рестайлинговая модель […] “Нива” […] 1993 г. с переработанная задняя часть кузова с малой погрузочной высотой (иная форма задних дверей и задних фонарей), более мощный и тяговитый двигатель ВАЗ-21213 (1,7 л, 81,8 л.с., 125 Нм) с карбюратором […]” Solex ” […] и бесконтактная система зажигания на микроконтроллере (что и снижает расход топлива и улучшает подачу масла), 9Радиатор 0879 Силумин и многие другие. В 1993 году была выпущена переходная игра со штатным двигателем ВАЗ-2121.
W ikipedia 5000|$|icon кремний чистотой 95-99%. Около 55% мирового потребления кремния металлургической чистоты идет на производство алюминиево-кремниевых сплавов (силуминовых сплавов) для литья алюминиевых деталей, в основном для использования в автомобильной промышленности. Важность кремния в литье алюминия заключается в том, что значительно большое количество (12%) кремния в алюминии образует эвтектическую смесь, которая затвердевает с очень небольшим тепловым сжатием. ✕
✕
Свойства кремния можно использовать для модификации сплавов с другими металлами, кроме железа. […] “металлургический” […] кремний – это кремний чистотой 95-99%. Около 55% мирового потребления кремния металлургической чистоты идет на производство алюминиево-кремниевых сплавов ( сплавы силумина ) для литья алюминиевых деталей, в основном для использования в автомобильной промышленности. Важность кремния в литье алюминия заключается в том, что значительно большое количество (12%) кремния в алюминии образует эвтектическую смесь, которая затвердевает с очень небольшим тепловым сжатием. Это значительно уменьшает разрывы и трещины, образующиеся из-за напряжения, когда литейные сплавы охлаждаются до твердости. Кремний также значительно улучшает твердость и, следовательно, износостойкость алюминия.
W ikipedia 5000|$|, FM, FM2n имеет {{давнюю}} {{репутацию}} надежности и долговечности. Он имеет чрезвычайно прочный корпус из медно-алюминиево-кремниевого (силуминового) сплава. […] Пленочный транспорт FM2 состоит из высокопрочных закаленных металлических шестерен и движущихся частей, установленных на блоках шарикоподшипников. Камера ✕
[…] Пленочный транспорт FM2 состоит из высокопрочных закаленных металлических шестерен и движущихся частей, установленных на блоках шарикоподшипников. Камера ✕
Как и ее предшественница FM, FM2n имеет давнюю репутацию надежной и долговечной. Он имеет чрезвычайно прочный корпус из меди-алюминия-кремния ( 9силумин 0879) сплав . […] Пленочный транспорт FM2 состоит из высокопрочных закаленных металлических шестерен и движущихся частей, установленных на блоках шарикоподшипников. Высокопрочные вертикальные металлические лепестки затвора камеры с прецизионной конической формой изначально были изготовлены из легкого титана (более поздние лепестки затвора FM2 были сделаны из алюминия), а механизм зеркала / затвора вращается на самосмазывающихся подшипниках. В рычажном механизме зеркала используется тот же механизм, что и в профессиональной F2 от Nikon, с некоторыми современными улучшениями, призванными еще больше уменьшить эффекты вибрации и отскока зеркала. FM2 также оснащен знаменитой сборкой Nikon с жесткими допусками и минимальным объемом смазки, что означает, что он будет надежно работать при экстремальных температурах от −40 °C до +50 °C.
R search 40|$|bjected}} модификации нанопорошком вольфрама во время литья. Содержание нанопорошка W в количестве 0,1 масс. % в расплаве силуминов приводит к изменению размеров дендритного алюминия, {{а также по}} изменению морфологии и уменьшению размеров Fe-содержащих фаз… ✕
Проведены исследования фазового состава сплавов Al-Si, модифицированных нанопорошком вольфрама в процессе литья. Содержание нанопорошка W в количестве 0,1 масс. % в расплаве силуминов приводит к изменению размеров дендритов алюминия, а также к изменению морфологии и уменьшению размеров Fe-содержащих фаз…
R поиск 40|$| показаны {материалы для}} изготовления оклейки {{препаратов для}} силуминов – карбонатов кальция и стронция с точки зрения экологической безопасности. Принципиальная возможность использования дисперсии ✕
Перспективные материалы для изготовления рафинирующих препаратов для 9Показаны силумины 0879 – карбонаты кальция и стронция с точки зрения экологической безопасности. Принципиальная возможность использования дисперсных карбонатов в составе рафинирующих смесей подтверждена исследованием процесса поздней модификации с помощью моделирования FLOW-3D. Высокая эффективность рафинирующей смеси с эффектом модификаторов подтверждена промышленными испытаниями…
Принципиальная возможность использования дисперсных карбонатов в составе рафинирующих смесей подтверждена исследованием процесса поздней модификации с помощью моделирования FLOW-3D. Высокая эффективность рафинирующей смеси с эффектом модификаторов подтверждена промышленными испытаниями…
R исследование 40|$|Аннотация. В {{структуре}} литейных силуминов (сплавов Al-Si) содержится большая доля эвтектики (40 – 75 %), которые, как отмечалось выше, повышают текучесть и снижают склонность к ✕
Резюме. В структуре отливки силуминов (сплавы Al-Si) содержится большая доля эвтектики (40 – 75 %), которые, как уже отмечалось выше, повышают текучесть и снижают склонность к образованию трещин и микропористости. В связи с этим свойства α-фазы, с одной стороны, а также количество, морфология, размер и распределение эвтектического кремния, с другой стороны, являются наиболее существенными факторами, влияющими на механические свойства отливки. ..
..
W ikipedia 5000|$|ion в экстремальных условиях и в ежедневных отчетах о надежности ремонтных мастерских и обзорах журналов). Он имеет чрезвычайно прочный корпус из медного силуминового сплава. Электроника хорошо защищена внутри корпуса и очень высокого качества, включая гибкие схемы. Транспорт пленки FM3A состоит из высокопрочных закаленных металлических шестерен и движущихся частей, установленных на блоках шарикоподшипников. В вертикальном металлическом затворе используются прецизионные конические лезвия из высокопрочного алюминиевого сплава и безмасляная самосмазка 9.0880 ✕
Модель FM3a отличается высоким качеством изготовления и материалов. Он разделяет преимущества FM и FM2N, которые обычно считаются двумя из самых надежных камер из когда-либо созданных (как с точки зрения работы в экстремальных условиях, так и в ежедневных отчетах о надежности от ремонтных мастерских и обзорах журналов). Он имеет чрезвычайно прочный корпус из сплава меди и силумина . Электроника хорошо защищена внутри корпуса и очень высокого качества, включая гибкие схемы. Транспорт пленки FM3A состоит из высокопрочных закаленных металлических шестерен и движущихся частей, установленных на блоках шарикоподшипников. В вертикальном металлическом затворе используются прецизионные конические лезвия из высокопрочного алюминиевого сплава и безмасляные самосмазывающиеся подшипники. Направляющие рельсы изготовлены из нержавеющей стали. Зеркало изготовлено из титана. Он значительно снижает вероятность виньетирования на супертелеобъективах с фокусным расстоянием до 800 мм и использует тот же механизм, что и в Nikon Pro F2, с некоторыми улучшениями, предназначенными для дальнейшего уменьшения эффектов вибрации и отражения зеркала.
Электроника хорошо защищена внутри корпуса и очень высокого качества, включая гибкие схемы. Транспорт пленки FM3A состоит из высокопрочных закаленных металлических шестерен и движущихся частей, установленных на блоках шарикоподшипников. В вертикальном металлическом затворе используются прецизионные конические лезвия из высокопрочного алюминиевого сплава и безмасляные самосмазывающиеся подшипники. Направляющие рельсы изготовлены из нержавеющей стали. Зеркало изготовлено из титана. Он значительно снижает вероятность виньетирования на супертелеобъективах с фокусным расстоянием до 800 мм и использует тот же механизм, что и в Nikon Pro F2, с некоторыми улучшениями, предназначенными для дальнейшего уменьшения эффектов вибрации и отражения зеркала.
W ikipedia 50|$|g направление обеспечивает идеальный баланс движущихся частей. Цилиндры были изготовлены из чугуна KS (Kolbenschmidt), стенки цилиндров были заделаны в корпус двигателя из сплава силумин. Единственными вещами, которые можно было визуально идентифицировать как детали двигателя, были головки цилиндров из сплава с несколькими ребрами охлаждения и выхлопные трубы, расположенные между спицами переднего колеса из литого сплава. Эти плоские спицы были разработаны, чтобы служить функциональным охлаждающим вентилятором. Двухступенчатая трансмиссия была построена как дифференциальная и использовала шестерни с наклонным зацеплением. Сцепление было изготовлено из обычных дисков сцепления. Сцепление (с пружинами по внешнему кругу) располагалось перед коробкой передач. Трансмиссия приводилась в действие стальными тросами с ножным приводом. Ко всем частям двигателя был обеспечен легкий доступ для проведения сервисных работ. после ре ✕
Единственными вещами, которые можно было визуально идентифицировать как детали двигателя, были головки цилиндров из сплава с несколькими ребрами охлаждения и выхлопные трубы, расположенные между спицами переднего колеса из литого сплава. Эти плоские спицы были разработаны, чтобы служить функциональным охлаждающим вентилятором. Двухступенчатая трансмиссия была построена как дифференциальная и использовала шестерни с наклонным зацеплением. Сцепление было изготовлено из обычных дисков сцепления. Сцепление (с пружинами по внешнему кругу) располагалось перед коробкой передач. Трансмиссия приводилась в действие стальными тросами с ножным приводом. Ко всем частям двигателя был обеспечен легкий доступ для проведения сервисных работ. после ре ✕
В трехцилиндровом двухтактном двигателе использовался Drehschieber («поворотный клапан», поворотный диск с впускными отверстиями для точной синхронизации впуска топливно-воздушной смеси). Топливно-воздушная смесь как обычно подсасывалась разрежением в трех картерах коленчатого вала. Drehschieber определяет синхронизацию впуска для всех трех цилиндров. Двигатель не был радиальным двигателем, связанным с самолетами, и в нем не было необходимости в маховике. Все три кривошипа работали на одну общую шестерню. Такое расположение и отдача поршней в направлении вращения обеспечили идеальный баланс движущихся частей. Цилиндры были изготовлены из чугуна KS (Kolbenschmidt) и стенки цилиндров были заделаны в Корпус двигателя из сплава силумин . Единственными вещами, которые можно было визуально идентифицировать как детали двигателя, были головки цилиндров из сплава с несколькими ребрами охлаждения и выхлопные трубы, расположенные между спицами переднего колеса из литого сплава. Эти плоские спицы были разработаны, чтобы служить функциональным охлаждающим вентилятором. Двухступенчатая трансмиссия была построена как дифференциальная и использовала шестерни с наклонным зацеплением. Сцепление было изготовлено из обычных дисков сцепления. Сцепление (с пружинами по внешнему кругу) располагалось перед коробкой передач.
Drehschieber определяет синхронизацию впуска для всех трех цилиндров. Двигатель не был радиальным двигателем, связанным с самолетами, и в нем не было необходимости в маховике. Все три кривошипа работали на одну общую шестерню. Такое расположение и отдача поршней в направлении вращения обеспечили идеальный баланс движущихся частей. Цилиндры были изготовлены из чугуна KS (Kolbenschmidt) и стенки цилиндров были заделаны в Корпус двигателя из сплава силумин . Единственными вещами, которые можно было визуально идентифицировать как детали двигателя, были головки цилиндров из сплава с несколькими ребрами охлаждения и выхлопные трубы, расположенные между спицами переднего колеса из литого сплава. Эти плоские спицы были разработаны, чтобы служить функциональным охлаждающим вентилятором. Двухступенчатая трансмиссия была построена как дифференциальная и использовала шестерни с наклонным зацеплением. Сцепление было изготовлено из обычных дисков сцепления. Сцепление (с пружинами по внешнему кругу) располагалось перед коробкой передач. Трансмиссия приводилась в действие стальными тросами с ножным приводом. Ко всем частям двигателя был обеспечен легкий доступ для проведения сервисных работ. После демонтажа двигателя — пришлось открутить всего два болта и кое-какую проводку — все важные детали оказались в пределах досягаемости.
Трансмиссия приводилась в действие стальными тросами с ножным приводом. Ко всем частям двигателя был обеспечен легкий доступ для проведения сервисных работ. После демонтажа двигателя — пришлось открутить всего два болта и кое-какую проводку — все важные детали оказались в пределах досягаемости.
R поиск 40|$|{{Микроструктура}} и микротвердость {{алюминия}} и силумина аК 12 с содержанием железа от 0 до 12 мас. %, произведенных литьем в песчаные формы и литьем в моль, были исследованы. Для Al–Si–Fe и Al–Si–F ✕
Микроструктура и микротвердость алюминия и силумина аК 12 с содержанием железа от 0 до 12 мас. %, произведенных литьем в песчаные формы и литьем в моль, были исследованы. Для систем Al–Si–Fe и Al–Si–Fe–Mn участки поверхностей ликвидуса, соответствующие промышленным состава силумина рассчитаны с использованием обновленной термодинамической модели системы Al-Si-Fe и базы данных COST-507. Для промышленного силумина оценена площадь первичной кристаллизации железосодержащих фаз а и b. Доказано, что марганец способствует образованию железосодержащей а-фазы в коммерческом силумине .
Доказано, что марганец способствует образованию железосодержащей а-фазы в коммерческом силумине .
R поиск 40|$|укус выполнен. Установлено, что {{содержание}} нанопорошка вольфрама в количестве 0,1 масс. % в расплаве приводит силуминов к увеличению предела прочности при растяжении и ударной вязкости в среднем на 40 %, а относительного удлинения – в 1,5 – 2 раза… ✕
Проведены исследования механических свойств сплавов Al-Si, модифицированных нанопорошком вольфрама в процессе литья. Установлено, что содержание нанопорошка вольфрама в количестве 0,1 масс. % в расплаве силуминов приводит к увеличению предела прочности при растяжении и ударной вязкости в среднем на 40 %, а относительного удлинения – в 1,5 – 2 раза…
R поиск 40|$| Улучшение {{свойств}} силуминов в рамках классических методов {{связано}} с изменением морфологии осаждения кремния посредством: процесса модификации а1 ✕
Улучшение свойств силуминов в рамках классических методов связано с изменением морфологии осаждения кремния за счет: процесса модифицирования сплава, поддержания соответствующей температуры перегрева и заливки в формы, а также совершенствования плавки лечебные процессы. Полученная структура отливки оказывает непосредственное влияние на механические и технологические свойства деталей машин, поэтому использование знаний о кристаллизации для управления кинетикой кристаллизации отливок с целью оптимизации полученной структуры и внедрение современных методов термической обработки позволяют значительно улучшить механических и технологических свойств, становится важным фактором. На изменение предела прочности оказывает влияние дисперсионное твердение с выдержкой сплава вблизи температуры солидуса, заключающееся в нагреве отлитых образцов до температуры растворения, выдержке при этой температуре, охлаждении в холодной воде (20 0 С) и последующей операции искусственного старения. Rm выбранного гипоэвтектоида силумины. Выбор подходящих параметров дисперсионного твердения является условием получения положительных результатов в плане повышения предела прочности при растяжении Rm и влияет на его экономические аспекты…
Полученная структура отливки оказывает непосредственное влияние на механические и технологические свойства деталей машин, поэтому использование знаний о кристаллизации для управления кинетикой кристаллизации отливок с целью оптимизации полученной структуры и внедрение современных методов термической обработки позволяют значительно улучшить механических и технологических свойств, становится важным фактором. На изменение предела прочности оказывает влияние дисперсионное твердение с выдержкой сплава вблизи температуры солидуса, заключающееся в нагреве отлитых образцов до температуры растворения, выдержке при этой температуре, охлаждении в холодной воде (20 0 С) и последующей операции искусственного старения. Rm выбранного гипоэвтектоида силумины. Выбор подходящих параметров дисперсионного твердения является условием получения положительных результатов в плане повышения предела прочности при растяжении Rm и влияет на его экономические аспекты…
R поиск 40|$|he {{применение}} of компьютерная методика {{для оценки}} влияния химического состава на дисперсную усадочную микропористость доэвтектических литых силуминов Производство компьютерной техники для оценки состава химического состава на роззоне микропорообразования scurczową podeutektycznych silumi ✕
The application of a computer technique to assess the impact of chemical composition on dispersed shrinkage microporosity of hypoeutectic cast silumins Wykorzystanie techniki komputerowej do oceny wpływu składu chemicznego na rozproszoną mikroporowatość skurczową podeutektycznych siluminów odlewniczych This article presents the possibility of decreasing дисперсная усадочная микропористость в отливках из доэвтектических легирующих силуминов , в результате сужения – в пределах норм или ТУ – содержания отдельных элементов химического состава: легирующих добавок и/или примесей. Этот относительно простой и в то же время недорогой метод часто может привести к быстрому устранению данного вида дефектов отливок и улучшению их герметичности. Для ориентации химического состава на оптимальное содержание была проведена компьютерная статистическая обработка (с использованием Statistica Ver. 9программного обеспечения) с применением цифр, прямо связанных с усадочной микропористостью, а также косвенно связанных с температурным интервалом кристаллизации (ΔT = T лик – T sol). Эти данные взяты из литературы и программного обеспечения MAGMASoft® для моделирования процессов заливки и затвердевания отливок. Достигнутые результаты проверены в промышленных условиях…
Этот относительно простой и в то же время недорогой метод часто может привести к быстрому устранению данного вида дефектов отливок и улучшению их герметичности. Для ориентации химического состава на оптимальное содержание была проведена компьютерная статистическая обработка (с использованием Statistica Ver. 9программного обеспечения) с применением цифр, прямо связанных с усадочной микропористостью, а также косвенно связанных с температурным интервалом кристаллизации (ΔT = T лик – T sol). Эти данные взяты из литературы и программного обеспечения MAGMASoft® для моделирования процессов заливки и затвердевания отливок. Достигнутые результаты проверены в промышленных условиях…
Porsche Type 901 (1964) – Гоночные автомобили
Главная
Раллийные автомобили
Гоночные автомобили
Ралли Акрополь
Технологии
Автомобили и омологация
Аэродинамика
Двигатель
Коробка передач
I. C.E.A.L.
C.E.A.L.
Гоночные автомобили
Поиск на сайте
Последние изменения
Менеджер сайта
Редактировать это меню
Сгиб
Содержание
Технические характеристики
Размеры
Конструкционные материалы
Головка блока цилиндров
Всасывание
Зажигание
Охлаждение и смазка
Настройки крутящего момента
Используемые модели и мощность
Чертежи
Porsche Type 901
Представлен в 1964 г.
Щелкните здесь
Щелкните здесь, чтобы просмотреть регистрационные номера
Размеры
Расположение цилиндров: оппозитные 6 цилиндров или V6 с углом включения 180º и оппозитным расположением поршней
Тактов: 4
Топливо: бензин
Диаметр цилиндра x Ход поршня: 80,0 мм x 66,0 мм, 3,150″ x 2,598″
Объем: 1991 куб.см, 121,5 куб.см
Строительные материалы
Картер из сплава силумина. Картер из магниевого сплава для 901/20, 901/21 и 901/22 . Расстояние между отверстиями 118 мм, гильзы цилиндров из чугуна с ребрами для воздушного охлаждения
Расстояние между отверстиями 118 мм, гильзы цилиндров из чугуна с ребрами для воздушного охлаждения
Головка из алюминиевого сплава с полусферической камерой сгорания Коленчатый вал из кованой стали
с 8 коренными подшипниками скольжения диаметром 57 мм, диаметр большой шейки 57 мм
стальных шатунов, расстояние между центрами 130 мм, диаметр подшипника шатуна 61 мм цепной привод
2 клапана/цил. – Всего 12 клапанов.
1964-1968: Диаметр впускного клапана 39 мм, диаметр выпускного клапана 35 мм.
1969+: Диаметр впускного клапана 42 мм, диаметр выпускного клапана 38 мм.
901/20, 901/21 и 901/22: Полый выпускной клапан, заполненный натрием
Всасывание
Код двигателя, всасывание
901/01: 6 карбюраторов Solex 40 PI
901/05: 2 карбюратора Weber 40 IDS 3C-1
901/09: Bosch Kugelfisher Mechanical многоточечный впрыск топлива
901/20: 2 карбюратора Weber 46 IDA 3C (список деталей)
901/21: Bosch с «импульсным впрыском» D-Jetronic, механическая система впрыска топлива с использованием впрыскивающего насоса Kugelfischer PL. Щелкните здесь
Щелкните здесь
901/22: 2 карбюратора Weber 46 IDA 3C (список деталей)
901/30: 2 карбюратора Weber 40 IDS 3C-1
Зажигание
электронная одиночная искра, катушки Bosch и топливные насосы Bendix
Magnetti Marelli двойные свечи/цилиндр для двигателей 901/20, 901/21 и 901/22
порядок зажигания 1-6-2-4-3-5
Источник
Охлаждение и смазка
с воздушным охлаждением, диаметром 245 мм, 11 лопастным центробежным вентилятором, направляющими аппаратами, термостатом и отсечными воздушными заслонками
Сухой картер с 1 масляным радиатором. Объем масла 11 л
Настройки крутящего момента
Нажмите здесь
| Год | Модель, двигатель | Индукция | Степень сжатия | Клапаны | Мощность | Крутящий момент |
|---|---|---|---|---|---|---|
| 1964 | Порше 911 Тип О, 901/01 | 6 карбюраторов Solex 40 PI | 9,0:1 | И39, Е35 | 130 л. с. (96 кВт) при 6100 об/мин с. (96 кВт) при 6100 об/мин | 173 Нм (128 фут-фунтов) при 4200 об/мин |
| 1966 | Порше 911 Тип О, 901/05-06 | 2 карбюратора Weber 40 IDS 3C-1 | 9,0:1 | И39, Е35 | 130 л.с. (96 кВт) при 6100 об/мин | 173 Нм (128 фут-фунтов) при 4200 об/мин |
| 1966 | Порше 911 S тип О, 901/02 | 2 карбюратора Weber 40 IDS 3C-1 | 9,8:1 | И42, Е38 | 158 л.с. (118 кВт) при 6600 об/мин | 179 Нм (132 фунт-фут) при 5200 об/мин |
| 1967 | Порше 911 S тип А, 901/02-08 | 2 карбюратора Weber 40 IDS 3C-1 | 9,8:1 | И42, Е38 | 158 л.с. (118 кВт) при 6600 об/мин | 179 Нм (132 фунт-фут) при 5200 об/мин |
| 1967 | Порше 911 Т тип А, 901/03 | 2 карбюратора Weber 40 IDT 3C | 8,6:1 | И42, Е38 | 110 л.с. (81 кВт) при 5800 об/мин | 157 Нм (116 фут-фунтов) при 4200 об/мин |
| 1968 | Порше 911 L тип А Тарга, 901/06 | 2 карбюратора Weber 40 IDS 3C-1 | 9. 0:1 0:1 | И39, Е35 | 130 л.с. (96 кВт) при 6100 об/мин | 173 Нм (128 фут-фунтов) при 4200 об/мин |
| 1968 | Порше 911 S тип А Тарга, 901/08 | 2 карбюратора Weber 40 IDS 3C-1 | 9,8:1 | И42, Е38 | 158 л.с. (118 кВт) при 6600 об/мин | 179 Нм (132 фунт-фут) при 5200 об/мин |
| 1969 | Porsche 911 E тип B, 901/09 или 901/11 | Бош Кугельфишер МФИ | 9.1:1 | И42, Е38 | 140 л.с. (104 кВт) при 6500 об/мин | 176 Нм (130 фут·фунтов) при 4500 об/мин |
| 1969 | Порше 911 S тип B, 901/10 | Бош Кугельфишер МФИ | 9,9:1 | И45, Е39 | 170 л.с. (127 кВт) при 6800 об/мин | 183 Нм / 135 фут·фунтов при 5500 об/мин |
| Гоночные двигатели | ||||||
| 1964 | Порше 904, 901/20 | 2 карбюратора Weber 46 IDA 3C | 10,3:1 | И42, Е38 | 200 л. с. / 149 кВт при 8000 об/мин с. / 149 кВт при 8000 об/мин | 190 Нм / 140 футо-фунтов при 6000 об/мин |
| 1966 | Порше 906, 901/20 | 2 карбюратора Weber 46 IDA 3C | 10,3:1 | И42, Е38 | 210 л.с. / 157 кВт при 8000 об/мин | 196 Нм / 145 футо-фунтов при 6000 об/мин |
| 1966 | Порше 906Е, 901/21 | Бош Кугельфишер МФИ | 10,3:1 | И42, Е38 | 220 л.с. / 164 кВт при 8100 об/мин | 206 Нм / 152 футофунтов при 6400 об/мин |
| 1966 | Порше 910, 901/21 | Бош Кугельфишер МФИ | 10,3:1 | И42, Е38 | 220 л.с. / 164 кВт при 8100 об/мин | 206 Нм / 152 футофунтов при 6400 об/мин |
| 1967 | Порше 907, 901/21 | Бош Кугельфишер МФИ | 10,3:1 | И42, Е38 | 220 л.с. / 164 кВт при 8100 об/мин | 206 Нм / 152 футофунтов при 6400 об/мин |
| 1967 | Порше 911R, 901/22 | 2 карбюратора Weber 46 IDA 3C | 10,3:1 | И42, Е38 | 210 л. с. / 157 кВт при 8000 об/мин с. / 157 кВт при 8000 об/мин | 206 Нм / 152 футофунтов при 6200 об/мин |
| 1967 | Порше 911 S, 901/30 | 2 карбюратора Weber 40 IDS 3C-1 | 9,9:1 | И42, Е38 | 170 л.с. / 127 кВт при 6800 об/мин | 195 морских миль / 144,0 футофунтов при 5200 об/мин |
| 1968 | Порше 911, 901/30 | 2 карбюратора Weber 40 IDS 3C-1 | 9,9:1 | И42, Е38 | 150 л.с. / 112 кВт при 6500 об/мин | |
| 1968 | Порше 911 Т/ Порше 911 С, 901/30 | 2 карбюратора Weber 46 IDA 3C | 9,9:1 | И42, Е38 | 180 л.с. / 134 кВт при 6800 об/мин | 195 морских миль / 144,0 футофунтов при 5200 об/мин |
| 1970 | Порше 911, 901/30 | 2 карбюратора Weber 46 IDA 3C | 9,9:1 | И42, Е38 | 180 л.с. / 134 кВт при 6800 об/мин | 195 морских миль / 144,0 футофунтов при 5200 об/мин |
| 1970 | Порше 914/6, 901/22 | 2 карбюратора Weber 46 IDA 3C | 10,3:1 | И42, Е38 | 210 л. с. / 157 кВт при 8000 об/мин с. / 157 кВт при 8000 об/мин | 206 Нм / 152 футофунтов при 6200 об/мин |
| 1970 | Порше 914/6, 901/30 | 2 карбюратора Weber 46 IDA 3C | 10,3:1 | И42, Е38 | 200 л.с./8000 об/мин | 206 Нм / 152 футофунтов при 6200 об/мин |
Источник
Двигатель 901/22
Источник
Магниевый блок номер детали 901.101.102.1R для двигателя 901/11
Источник
Карбюраторы Weber 40 IDS 3C
Чертежи
Источник
Источник
Weber 40 IDA 3C
Источник
Solex 40 PI-1
Источник
ТНВД для механического импульсного впрыска D-jetronic
Версия страницы: 67, последнее редактирование: 23 сент. 2021 21:09
Редактировать Теги История Файлы Распечатать Инструменты сайта + Options
Если не указано иное, содержание этой страницы находится под лицензией Creative Commons Attribution-ShareAlike 3. 0 License
0 License
История бренда Gaggia и его кофемашин
1930 Работая в семейном кафе-баре «Caffè Achille» на виале Премуда (Милан), Акилле Гаджиа сразу понял, что предпочтения клиентов меняются и что необходимо усовершенствовать весь процесс экстракции кофе в поисках лучшего вкуса и внешнего вида. результата в чашке. В то время кофе был настолько горьким, что Ахилл говорил, что это было похоже на «прогулку по туманному Милану». Он начал день за днем работать на складе бара, изучая и экспериментируя с новыми процессами экстракции и ища идеальный эспрессо.
1936
Благодаря встрече с инженером Антонио Кремонезе, разделявшим его стремление улучшить экстракцию кофе, Ахилл смог усовершенствовать свои исследования и изобрел систему «торкио» (переименованную в «Лампо»). Он окончательно отказался от использования пара, и, наконец, бариста могли точно контролировать процесс прохождения горячей воды под давлением через молотый кофе.
1938 5 сентября 19 г.38, Ахилл подал патент №. 365726 для “Лампо”. Этот разрушительный механизм использовал давление горячей воды вместо пара и готовил вкусный эспрессо с мягким слоем «натуральной пенки». Настоящая революция! Этот момент знаменует собой начало современной эры эспрессо.
1939 Чтобы продвигать новый дозатор для кофейной пенки, Gaggia представила «Lampo» на выставке Fiera Campionaria (Ярмарка образцов) в Милане в 1939 году. Целью Ахилла было продать новые группы владельцам баров, чтобы заменить те, что стоят на старых кофемашинах. К сожалению, реализовать эту идею было непросто: единственным решением было производство кофемашин с этой инновационной системой.
1947
Акилле Гаггия зарегистрировал свой второй патент на рычажно-поршневой заварочный механизм. Легенда гласит, что эта идея пришла ему в голову после того, как он увидел поршневой двигатель джипа американской армии, в котором использовалась гидравлическая система. В новом патенте подразумевалась пружина, нагруженная рычагом, которая проталкивала поршень через фильтр: таким образом, горячая вода под высоким давлением проходила через молотый кофе, извлекая все его чудесные ароматы. Бариста мог приготовить сливочный и ароматный эспрессо всего за 25-30 секунд, а массовое производство патента было не за горами…
Легенда гласит, что эта идея пришла ему в голову после того, как он увидел поршневой двигатель джипа американской армии, в котором использовалась гидравлическая система. В новом патенте подразумевалась пружина, нагруженная рычагом, которая проталкивала поршень через фильтр: таким образом, горячая вода под высоким давлением проходила через молотый кофе, извлекая все его чудесные ароматы. Бариста мог приготовить сливочный и ароматный эспрессо всего за 25-30 секунд, а массовое производство патента было не за горами…
1948
Акилле Гаджиа в сотрудничестве с предпринимателем Карло Эрнесто Валенте основал «Officine Faema Brevetti Gaggia» и смог произвести свою первую эспрессо-машину: Tipo Classica. Это была технологическая и эстетическая революция: горизонтально развитая, с красивыми рычагами, безошибочно узнаваемым слоганом и логотипом и формой, позволяющей ставить более одной группы подряд. Бариста стал настоящим артистом, двигая рычагами, как настоящий артист на сцене.
1949 Эспрессо Gaggia уникален: запатентованный механизм экстрагирует натуральные кофейные масла и создает вкусный кремовый слой на поверхности напитка. Вскоре Гаджиа установил свои машины в самых элегантных миланских барах, таких как Motta и Biffi, а на их окнах повесили привлекательные большие рекламные щиты с надписью «Crema caffè di caffè naturale». Тенденция эспрессо началась…
1950
При поддержке инженера Армандо Мильорини компания Achille спроектировала и произвела различные серии, такие как мод. Esportazione, Internazionale, Spagna и Treno отличаются элегантными линиями и эффектным дизайном. Впервые бариста смотрел на клиентов во время приготовления эспрессо, а задняя часть машин представляла собой новый способ общения с клиентами. Уже блестяще ориентированный на маркетинг, Акилле воспользовался случаем и первым разместил здесь свой уникальный слоган «Crema caffè naturale – Funziona senza steame».
1952
После различных исследований, направленных на то, чтобы предложить тот же эспрессо, что и в барах, не выходя из дома, Gaggia выпустила свою первую кофемашину для домашнего использования: Gilda. Полностью и тщательно изготовленный вручную, приводимый в действие давлением поршня, он обязан своим названием, как гласит легенда, культовой интерпретации Риты Хейворт «Gilda» (1946).
За этой моделью последовала вариация «Типо-Ирис» и знаменитая и незабвенная «Типо-Гильда 54», получившая название «кроличьи уши».
1955
Начало распространения эспрессо-машин по всему миру. Когда кофе часто готовили из цикория и эссенций, Gaggia был главным героем настоящей революции. В знаменитом «Moka Bar», который открыла Джина Лоллобриджида, «Bar Italia», «Sirocci Bar», «El Cubano» и «The French House», машины Gaggia сверкали на прилавках и обслуживали даже 1000 человек в день. Инновационные «эспрессо с натуральной пенкой» и капучино порадовали молодежь, а также самых известных писателей, писателей и актеров.
Инновационные «эспрессо с натуральной пенкой» и капучино порадовали молодежь, а также самых известных писателей, писателей и актеров.
1956 Gaggia – настоящий культовый бренд. Датская кейтеринговая компания «Oluf Brønnum» создала «мобильную столовую» точно такой же формы, как и Gaggia «Tipo Internazionale».
1957 Благодаря многим эмигрировавшим итальянцам культура эспрессо достигла Африки, Америки и Австралии. В Милане Gaggia запустила «Tipo-America», предназначенную для повышения эффективности рычажной системы. Позже появился «Autono-Matic» с революционными гидравлическими рабочими группами, которые постепенно заменили рычаг, упрощая приготовление эспрессо.
1961
Акилле Гаджиа преждевременно скончался, и управление перешло к его сыну Камилло и деловому партнеру Армандо Мильорини.
1962 Высокий успех, достигнутый компанией, привел к решению перенести производство в более крупные здания, чтобы удовлетворить растущие потребности во всем мире: «Gaggia S.p.A.» открылся в Робекко-суль-Навильо (Милан).
1968 Дизайн и исследования материалов с каждым днем становились все более важными, и Gaggia начала сотрудничать с дизайнерами, экспериментируя с линиями и комбинациями. Первый проект такого рода — «Тел 70», созданный вместе с Джузеппе де Готценом. Он был доступен в разных цветах, с литым силуминовым кузовом, горизонтальным теплообменником и двумя оболочками, пересекаемыми неоновой трубкой. Еще одно сотрудничество с де Готценом было для «Modello 80», выпущенного в 1919 году.75.
1977
Желание Gaggia стать частью повседневной жизни семей, принося в их дома тот же эспрессо, что и в кофейнях, возросло. Первой выпущенной моделью была «Duo», но именно с незабываемой «Baby Gaggia» мечта стала реальностью. Разработанная совместно с японским дизайнером Макио Хасуике, это была первая эспрессо-машина массового производства. Благодаря уникальному компактному дизайну и высокому качеству эспрессо Baby Gaggia сразу же вошла в дома и сердца итальянцев, став must have!
Первой выпущенной моделью была «Duo», но именно с незабываемой «Baby Gaggia» мечта стала реальностью. Разработанная совместно с японским дизайнером Макио Хасуике, это была первая эспрессо-машина массового производства. Благодаря уникальному компактному дизайну и высокому качеству эспрессо Baby Gaggia сразу же вошла в дома и сердца итальянцев, став must have!
1980 80-е: годы ярких красок, многочисленных эстетических новшеств и пластики. Пластичность этого материала привела к экспериментам с новыми сочетаниями форм и цветов. Gaggia с каждым днем все больше сосредотачивалась на новом бизнесе и запустила «Baby re-design», «Espresso», «Gran Gaggia», «Dandy» и «Fantastico» для домашнего использования. Понятно, что компания стремилась стать лидером этого нового рынка.
1991
Gaggia представила рынку «Классику». Эта бытовая эспрессо-машина с корпусом из нержавеющей стали и смелыми линиями идеально сочетает в себе давние профессиональные традиции Gaggia с неподвластным времени дизайном. С самого начала любимый во всем мире, Classic всегда был самым продаваемым символом традиций, надежности и качества бренда.
С самого начала любимый во всем мире, Classic всегда был самым продаваемым символом традиций, надежности и качества бренда.
1993 С этого года до 1998, Gaggia сосредоточилась на расширении ассортимента продукции и работала с различными дизайнерами и архитекторами над запуском новых моделей, отличающихся инновационной эстетикой. Помимо ручных кофемашин «Paros» и «Carezza», Gaggia создала свою первую автоматическую эспрессо-машину «Automatica Gaggia».
1999 Когда контрольный пакет акций группы был приобретен Saeco, Gaggia смогла расширить свое предложение полностью автоматических эспрессо-машин. Компания запустила «Syncrony Digital», «Syncrony Logic», «Titanium» и «Platinum». Началась новая эра бытовых машин: по нажатию кнопки она автоматически перемалывает, утрамбовывает и варит эспрессо прямо в чашке!
2007
Производственная площадка Gaggia была перенесена из Робекко-суль-Навильо (Милан) в Гаджо-Монтано (Болонья), в штаб-квартиру Saeco International.
2009 Другая эра началась, когда контрольный пакет акций Gaggia вместе с Saeco Group был продан компании Royal Philips Electronics. Голландская транснациональная корпорация осознала потенциал компании и последовательно инвестировала в развитие бренда.
2013 По случаю празднования 75-летия патента Акилле Гаджиа Группа обновляет ассортимент продукции и обновляет бренд с целью укрепления конкурентных позиций Gaggia на рынке бытовых эспрессо-машин. Это возвращение к историческому логотипу GAGGIA MILANO, который подчеркивает прочную связь с традициями, ценностями компании и родным городом. Что касается портфолио продуктов, то с годами Gaggia запускает различные новые линейки.
2018
Как и прежде, спустя 80 лет после подачи заявки на знаменитый патент, мы каждый день работаем и разрабатываем со страстью, чтя уникальную традицию любви к итальянскому эспрессо.
Википедия, бесплатная энциклопедия
Из Википедии, бесплатная энциклопедия
Перейти к навигацииПерейти к поиску
Из сегодняшней избранной статьи
Филипп VI Французский
Девятка0879 Перемирие в Кале было заключено королем Англии Эдуардом III и королем Франции Филиппом VI (на фото) 28 сентября 1347 года. После десяти лет войны обе страны были истощены в финансовом и военном отношении, и Папа Климент VI заключил перемирие, чтобы продлится до 7 июля 1348 года. Черная смерть привела к возобновлению перемирия в 1348, 1349 и 1350 годах. Перемирие эффективно ограничило боевые действия, но не остановило ни повторные морские столкновения, ни боевые действия меньшего масштаба. В 1351 г. перемирие было продлено на один год, но в январе 1352 г. снова разгорелись полномасштабные бои. 6 апреля 1354 года новое перемирие и наброски постоянного мирного договора были согласованы как Гинесский договор. Однако затем король Франции Иоанн II решил провести серию амбициозных наступлений в течение сезона кампании 1355 года и расторг договор. Было согласовано еще одно продление Калеского перемирия до 24 июня, когда оно окончательно истекло. Война возобновилась в октябре 1355 г. ( Эта статья является частью избранной темы: Столетняя война, 1345–1347 .)
Было согласовано еще одно продление Калеского перемирия до 24 июня, когда оно окончательно истекло. Война возобновилась в октябре 1355 г. ( Эта статья является частью избранной темы: Столетняя война, 1345–1347 .)
Недавно опубликовано:
- Боруйтис
- 1940 Обязательный футбольный матч между Палестиной и Ливаном
- Красная славка
Знаете ли вы, …
Озеро Тулайно
- … что в 1937 году воду из озера Тулайно (на фото) перевозили полозом, верхом, двадцатью осликами, крытой повозкой упряжка мулов, дилижанс, поезд, машина и самолет в Долину Смерти, чтобы отметить открытие шоссе?
- … что The Last of Us Part I содержит три предустановки специальных возможностей для тех, кому требуются слуховые, двигательные или визуальные средства?
- … что Эрл М. Чайлз , бизнесмен и филантроп из Портленда, штат Орегон, был также сенатором правления Университета Людвига-Максимилиана в Мюнхене, Германия?
- .
 .. что новелла Чайны Мьевиля Этот переписчик колеблется между первым и третьим лицом, чтобы передать травму, которую пережил главный герой?
.. что новелла Чайны Мьевиля Этот переписчик колеблется между первым и третьим лицом, чтобы передать травму, которую пережил главный герой? - … что развитие порта Танджунг Апи-Апи привело к скандалу со взяточничеством, в котором был замешан действующий губернатор ?
- … что Открытая благотворительная организация предоставила гранты на самые разные цели, от предотвращения рецессии до вакцин против рака для собак?
- … тот украинский баритон Даниил Матвиенко , магистр математики, выступил в партии Деметрия в опере Бриттена Сон в летнюю ночь во Франкфуртской опере?
- … что Univel был попыткой начала 1990-х конкурировать с Microsoft на рынке настольных компьютеров, но один отраслевой консультант сказал о цели компании: «Они мечтают»?
В новостях
Джорджия Мелони
- Правоцентристская коалиция получила большинство мест на всеобщих выборах в Италии (на фото лидер Братьев Италии Джорджия Мелони) .

- Кения Элиуд Кипчоге устанавливает новый мировой рекорд на Берлинском марафоне.
- В австралийском футболе по правилам сезон AFL завершается победой Джилонга над Sydney Swans в Гранд-финале .
- После смерти Махсы Амини , арестованной за то, что она не носила хиджаб в соответствии с государственными стандартами, по меньшей мере 50 человек убиты во время протестов в Иране.
В этот день
28 сентября
Вильгельм Завоеватель
- 1066 — Вильгельм Завоеватель (на фото) и его флот из примерно 600 кораблей высадились в Певенси, Суссекс, положив начало норманнскому завоеванию Англии .
- 1924 — Группа летчиков ВВС США приземлилась в Сиэтле, штат Вашингтон, чтобы совершить первое воздушное кругосветное плавание .
- 1963 – Ура! , который сейчас считается одной из самых важных работ Роя Лихтенштейна, дебютировал на выставке в галерее Лео Кастелли в Нью-Йорке.

- 2006 – Тайфун Xangsane миновал Манилу и унес жизни более 300 человек, в основном на Филиппинах и во Вьетнаме.
- 2012 г. – Война в Сомали: силы Сомалийской национальной армии и их союзники из АМИСОМ и Раскамбони начали наступление против «Аш-Шабааб» в последнем крупном оплоте последнего в Кисмайо.
- Эйвери Брандейдж ( б. 1887)
- Луи Пастер ( д. 1895)
- Горячкина Александра ( р. 1998)
Другие юбилеи:
Сегодняшняя избранная фотография
Банкноты Национального банка были банкнотами США, выпущенными национальными банками, зарегистрированными федеральным правительством США. Банкноты обычно обеспечивались облигациями, депонированными банком в Казначействе США. Кроме того, банки должны были поддерживать фонд погашения в размере пяти процентов от любого непогашенного остатка банкнот в золоте или «законных деньгах». Оформление банкнот кредит: Управление денежного контролера и Бюро гравировки и печати; отсканировано Эндрю Шивой Недавно добавлено:
|
M 196 R, M 196 S, Applications Wikipedia, the free encyclopedia » 7Pedia
Motor vehicle engine
| Mercedes-Benz 22 M 196 | |
|---|---|
| Overview | |
| Производитель | Daimler-Benz |
| Производство | 1954-1955 |
. (182 куб. С) [2] (182 куб. С) [2] | |
| поршневой ход |
|
| Valvetrain | Desmodromic Valvetrain, DOWNHINDER, DOLVERVER. [3] [4] |
| Горение | |
| Принцип работы | Четырехтактный OTTO |
| Топливная система | Прямая инъекция топлива |
| Тип топлива |
|
| Oil system | Dry sump |
| Output | |
| Power output |
|
| Полученное время | 6674 |
.
| |
Двигатель Mercedes-Benz M 196 представляет собой безнаддувный рядный восьмицилиндровый гоночный двигатель, разработанный, разработанный и произведенный Daimler-Benz; и использовался как в гонках на спортивных автомобилях, так и в гонках Формулы-1, между 1954 и 1955. [7] [8] [9] [10] [11] Daimler-Benz изготовил две версии двигателя: M 196 R 5, объемный, 2. и M 196 S рабочим объемом 3,0 литра.
Mercedes отказался от участия в автоспорте после катастрофы в Ле-Мане 1955 года. Это был их последний двигатель Формулы-1, и Mercedes не возвращался в автоспорт в качестве производителя двигателей до 1994 года, когда они поставили двигатели команде Sauber Formula One. [12]
Это был их последний двигатель Формулы-1, и Mercedes не возвращался в автоспорт в качестве производителя двигателей до 1994 года, когда они поставили двигатели команде Sauber Formula One. [12]
Contents
- 1 M 196 R
- 2 M 196 S
- 3 Applications
- 4 References
M 196 R
1954 Mercedes-Benz W196
Mercedes- Benz W196, управляемый Стирлингом Моссом на Фестивале скорости в Гудвуде 2009
Проблемы с воспроизведением этого файла? См. справку по медиа.
Новые правила Формулы-1 1954 года допускали выбор двигателей без наддува – до 2,5 литров или 0,75 литров с наддувом. Ожидаемый целевой диапазон для конкурирующих двигателей составлял от 250 до 300 л.с. (19от 0 до 220 кВт).
При представлении на Гран-при Франции 1954 года десмодромные клапаны объемом 2496 куб. см (152,3 куб. дюйма) (76,0 × 68,8 мм) с прямыми клапанами 8 M 196 R обеспечивали мощность 256 л. с. (188 кВт). M 196 был единственным двигателем F1 с непосредственным впрыском топлива, что давало ему значительное преимущество перед другими карбюраторными двигателями. [13] [14] [15]
с. (188 кВт). M 196 был единственным двигателем F1 с непосредственным впрыском топлива, что давало ему значительное преимущество перед другими карбюраторными двигателями. [13] [14] [15]
Для сезона 1955 года компания Daimler-Benz усовершенствовала свой двигатель M 196 R, уменьшив длину впускного коллектора, [16] немного увеличив мощность двигателя до 265 л. ПС (195 кВт). [5]
M 196 S
Для гоночного автомобиля W 196 S двигатель M 196 был расточен и имеет ход поршня до 78 мм каждый (78,0 × 78,0 мм), а степень сжатия была уменьшена с ε=12 до примерно ε =9. Последнее позволило использовать стандартизированный бензин (98 RON) вместо высокооктанового гоночного топлива, необходимого для M 196 R [6] M 196 S имеет выходную мощность 276 л.с. (203 кВт) при 7000 об / мин и производит максимальный крутящий момент 31,7 кп·м (311 Н·м) при 5 950 об/мин. Это эквивалентно BMEP 1,31 МПа (190 фунт-сил/дюйм 2 ).


 Графитовых дуг токосъёмников для пантографов не существует
Графитовых дуг токосъёмников для пантографов не существует . забыл добавить…
. забыл добавить…  Согласно административному делению Украины, на спорной территории Крыма располагаются регионы Украины — Автономная Республика Крым и город со специальным статусом Севастополь.
Согласно административному делению Украины, на спорной территории Крыма располагаются регионы Украины — Автономная Республика Крым и город со специальным статусом Севастополь. Поэтому встречающейся иногда ссылкой вида [Canonical link] я указываю на заметку, которая была ранее опубликована как отрывок из хабра-черновика.
Поэтому встречающейся иногда ссылкой вида [Canonical link] я указываю на заметку, которая была ранее опубликована как отрывок из хабра-черновика. Так что никто не мешает не раздражаться по поводу «мыльного камня», а собрать его да смазать петли в ванной 🙂 В мировом масштабе стеарат кальция используется как смазка в карандашах и мелках, при производстве бумаги (предупреждает пыление и растрескивание) и т.п.
Так что никто не мешает не раздражаться по поводу «мыльного камня», а собрать его да смазать петли в ванной 🙂 В мировом масштабе стеарат кальция используется как смазка в карандашах и мелках, при производстве бумаги (предупреждает пыление и растрескивание) и т.п. статью)
статью) Может производиться на сооружениях или установках водоподготовки для нужд коммунального хозяйства, практически во всех отраслях промышленности (например, теплогенерирующих предприятий).
Может производиться на сооружениях или установках водоподготовки для нужд коммунального хозяйства, практически во всех отраслях промышленности (например, теплогенерирующих предприятий). ..>
..> | Предварительное альфа-видео», Отметка времени: 2:12, https://www.youtube.com/watch?v=GVJyfKNeOao. 10.05.2017.
| Предварительное альфа-видео», Отметка времени: 2:12, https://www.youtube.com/watch?v=GVJyfKNeOao. 10.05.2017. .. что новелла Чайны Мьевиля Этот переписчик колеблется между первым и третьим лицом, чтобы передать травму, которую пережил главный герой?
.. что новелла Чайны Мьевиля Этот переписчик колеблется между первым и третьим лицом, чтобы передать травму, которую пережил главный герой?

 Банкноты в целом не были законным платежным средством, но подходили почти для всех платежей федеральному правительству и от него. Они были упразднены как тип валюты федеральным правительством в 1930-х годов, когда валюта Соединенных Штатов была объединена в банкноты Федерального резерва, банкноты Соединенных Штатов и серебряные сертификаты. Эти девять банкнот номиналом от 1 до 1000 долларов были выпущены различными банками по всей стране как часть либо оригинальной, либо серии банкнот Национального банка 1875 года.
Банкноты в целом не были законным платежным средством, но подходили почти для всех платежей федеральному правительству и от него. Они были упразднены как тип валюты федеральным правительством в 1930-х годов, когда валюта Соединенных Штатов была объединена в банкноты Федерального резерва, банкноты Соединенных Штатов и серебряные сертификаты. Эти девять банкнот номиналом от 1 до 1000 долларов были выпущены различными банками по всей стране как часть либо оригинальной, либо серии банкнот Национального банка 1875 года. с. (195 кВт) (M 196 R, 1955) [5]
с. (195 кВт) (M 196 R, 1955) [5]