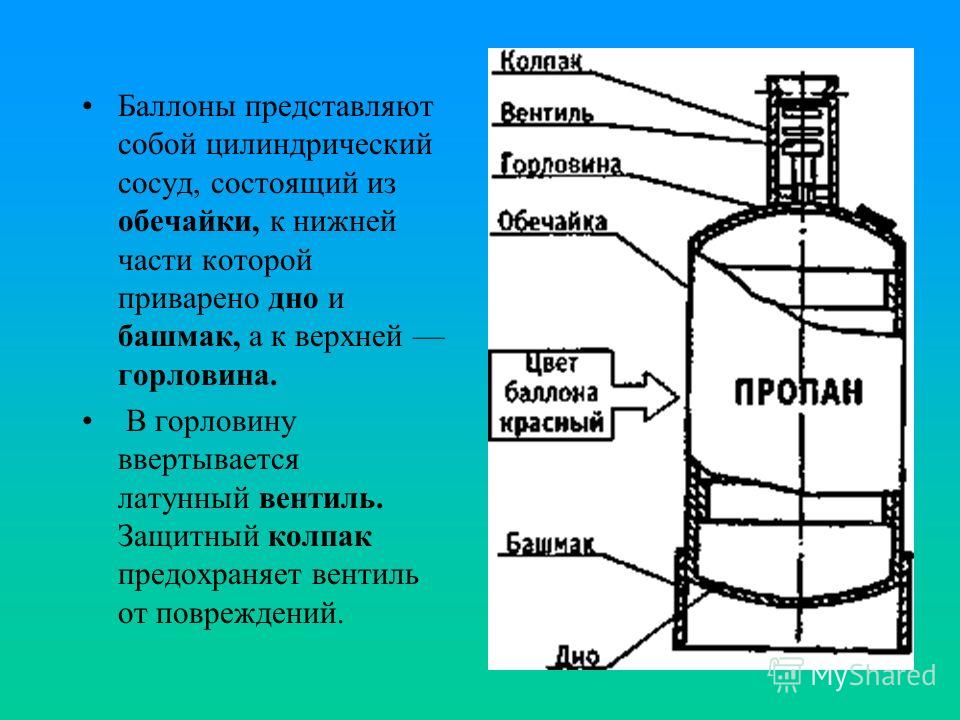
Сколько кубов пропана в 50л баллоне: Сколько кубов газа в 50 литровом баллоне?
alexxlab | 29.04.2023 | 0 | Разное
Как рассчитать «время заполнения воздушного резервуара» с помощью простой логики
Если вам необходимо рассчитать, сколько времени потребуется для заполнения воздушного резервуара, вы попали в нужное место.
Допустим, у вас есть ресивер для воздуха или другой сосуд под давлением подходящего номинала, и вы хотите выяснить, сколько времени потребуется, чтобы довести давление до определенного уровня с помощью воздушного компрессора известной производительности (CFM).
В этой статье мы расскажем вам, как рассчитать время наполнения воздушного бака, используя здравый смысл и минимальные формулы.
3 вещи, которые вам нужно знать, чтобы начать работу
- Атмосферный воздух на уровне моря имеет абсолютное давление 14,7 фунтов на квадратный дюйм.
- Назовите это 15 фунтов на квадратный дюйм для приблизительной оценки
- Важно использовать psia, когда рассматриваются любые коэффициенты давления
- фунтов на квадратный дюйм означает «манометрическое давление + 15 фунтов на квадратный дюйм».

- Примеры: Если манометр показывает «0», абсолютное давление составляет около 15 фунтов на квадратный дюйм абс.
- Если манометр показывает «100», абсолютное давление составляет около 115 фунтов на квадратный дюйм
- Воздух по сути является идеальной пружиной:
- Производительность компрессора относится к объему атмосферного воздуха, который он может всасывать и «перерабатывать» (т. е. сжимать или сжимать) за заданный промежуток времени
Например, компрессор на 30 кубических футов в минуту втянет примерно столько воздуха за минуту:
… И выдавит его вниз и выпустит по трубе или шлангу под высоким давлением.
Как рассчитать время заполнения воздушного резервуара Вопросы
Имея в виду эту справочную информацию, мы можем рассчитать вопросы «время, чтобы заполнить воздушный резервуар», используя простую логику. В следующих примерах мы демонстрируем логику, которую один из инженеров по воздушным компрессорам VMAC использовал для ответа на эти вопросы, чтобы вы могли воспроизвести аналогичную логику в своих собственных расчетах.
Пример 1
Сколько времени потребуется компрессору 15 CFM, чтобы заполнить 100-галлонный резервуар от 0 до 120 фунтов на кв. дюйм?
Дополнительная справочная информация- 1 галлон равен примерно 232 кубическим дюймам
- 1 кубический фут равен 12 х 12 х 12 = 1728 кубических дюймов
- 1 фут³ = 1728/232 = 7,5 галлона
- Резервуар 100/7,5 = около 13 фут³
- Следовательно, для запуска в баке имеется 13 фут3 атмосферного воздуха.
- В резервуаре находится 135/15 x 13 = 117 фут³ атмосферного воздуха, когда он достигает целевого давления 120 фунтов на кв. дюйм (135 фунтов на кв. дюйм)
- Разница составляет 117-13 = 104 кубических фута
- Компрессор 15 CFM каждую минуту перерабатывает 15 футов³ атмосферного воздуха:
- За одну минуту получается 15 футов³
- За две минуты получается 30 футов³
- За четыре минуты получается 60 футов³
- За семь минут получается 105 куб.
 футов
футов
- Таким образом, 104 фут3 / 15 фут3 в минуту = 6,9 минут.
Это займет около 7 минут.
Пример 2
Сколько времени потребуется компрессору производительностью 120 кубических футов в минуту, чтобы набрать 1 милю 6-дюймовой трубы сортамента 40 (снятой для испытаний) с давлением до 30 фунтов на кв. дюйм от нуля?
Дополнительная справочная информация- Внутренний диаметр трубы 6,07 дюйма
- Площадь круга составляет примерно ¾ площади окружающего его квадрата
- (6,07 х 6,07) х 0,75 = 27,6
- Труба имеет площадь примерно 28 дюймов
- В одном квадратном футе (фут²) 144 квадратных дюйма.
- Площадь = 28/144 = 0,19 фут²
- Объем трубы – это просто площадь круга, умноженная на длину.
- Объем = 0,19 x 5280 футов (1 миля) = 1000 футов³
- Для запуска в трубе находится 1000 фут3 атмосферного воздуха
- В трубе будет находиться 45/15 x 1000 = 3000 фут³ атмосферного воздуха, когда давление достигнет целевого значения 30 фунтов на кв.

- Разница составляет 3000 – 1000 = 2000 футов³
- Компрессор 120 CFM каждую минуту перерабатывает 120 футов³ атмосферного воздуха:
- За одну минуту получается 120 футов³
- За восемь минут получается 960 футов³
- За шестнадцать минут получается 1920 футов³
- За семнадцать минут получается 2040 футов³
- Следовательно, 2000 футов³ / 120 футов³ в минуту = 16,7 минут
Это займет около 17 минут.
Пример 3
Сколько времени потребуется компрессору на 30 кубических футов в минуту, чтобы заполнить 35-галлонный резервуар с манометрического давления 110 фунтов на кв. дюйм до 145 фунтов на кв. дюйм?
Time To Fill Logic
- Как мы видели в примере 1, в кубическом футе содержится около 7 ½ галлонов. Таким образом, 35 галлонов примерно равны 5 фут3 .
- При давлении 145 фунтов/кв.
- Аналогично, при давлении 110 фунтов на кв.
 дюйм в резервуаре будет 125/15 x 5 = 42 фут³ атмосферного воздуха
дюйм в резервуаре будет 125/15 x 5 = 42 фут³ атмосферного воздуха - Разница 11 фут³
- Компрессор производительностью 30 кубических футов в минуту перерабатывает 30 футов³ атмосферного воздуха каждую минуту.
- За 10 секунд производит 5 фут³ (1/6 из 30)
- За 20 секунд он производит 10 футов³
Для восстановления давления в резервуаре до 145 фунтов на кв. дюйм потребуется около 20 секунд.
Имея некоторые базовые знания о вашем компрессоре, давлении воздуха и необходимом количестве воздуха, вычисление времени заполнения может быть относительно простым – без использования сложных формул.
Хотите больше? Вам также может понравиться:
Определение размера резервуара воздушного ресивера
ChemTeam: Стехиометрия: Объем (газа) Примеры
ChemTeam: Стехиометрия: Объем (газа) Примеры Стехиометрия
Объем-объем Примеры
(объем газа, а не раствора)
Датчики №1–10
Вернуться в меню стехиометрии
Краткое введение: Ключевым моментом, на который следует обратить внимание, являются условия температуры и давления. Если они остаются постоянными, вы можете обращаться с объемами так же, как с родинками. Это связано с тем, что в условиях постоянных Т и Р объемы прямо пропорциональны молям. Это обсуждается в нескольких решениях проблем ниже.
Если они остаются постоянными, вы можете обращаться с объемами так же, как с родинками. Это связано с тем, что в условиях постоянных Т и Р объемы прямо пропорциональны молям. Это обсуждается в нескольких решениях проблем ниже.
Хотя подавляющее большинство задач стехиометрии на основе объема сформулированы в терминах постоянных T и P, это не обязательно. Вы можете увидеть это в задачах 1b и 9 чуть ниже. Если у вас есть изменяющиеся условия T и P, вы, в общем, будете делать так:
(1) Преобразовать объем в моли, используя PV = nRT и исходный набор T и P
(2) Используйте отношение и пропорцию для определения молей другого вещества, связанного с проблемой.
(3) Используйте PV = nRT с новыми T и P, а также молями вещества из шага 2. Вы рассчитаете новый объем.
Будьте готовы! Ваш учитель может показать ситуацию, когда T и P не меняются, а затем проверить ситуацию, когда T и P меняются.
Пример №1: Уравнение сгорания метана:
CH 4 + 2O 2 —> 2H 2 O + CO 2
(a) Если на СТП сжечь 50,0 л метана, какой объем двуокиси углерода будет произведен на СТП?
(b) Если сжечь 50,0 л метана на НТП, какой объем газообразной воды образуется на НТП?
Решение (а):
Поскольку все происходит в STP, объемы прямо пропорциональны молям используемого реагента и произведенного продукта. Почему? Рассмотрим PV = nRT. Перепишите это как:
Почему? Рассмотрим PV = nRT. Перепишите это как:
н/В = П/РТВсе в правой части постоянно, поэтому отношение n:V также должно быть постоянным. Это означает, что объем прямо пропорционален количеству молей газа.
Поскольку существует молярное соотношение 1:1 между CH 4 и CO 2 , ответ 50,0 л
Решение (б):
1) Используйте PV = nRT для определения молей метана:
(1,00 атм) (50,0 л) = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (298 К)n = 2,044665 моль
Примечание: в этой задаче я принимаю комнатную температуру равной 25,0 °C, поскольку RTP означает комнатную температуру и давление.
2) Используйте молярное соотношение метан:вода:
1 к 2 как 2,044665 моль к хх = 4,08933 моль произведенной воды
3) Используйте PV = nRT для расчета объема водяного пара при нормальных условиях:
(1,00 атм) (V) = (4,08933 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (273 K)В = 91,6 л (до трех цифр)
Пример №2: Учитывая следующее уравнение:
C(т) + 2H 2 (г) —> CH 4 (г)
Сколько литров водорода необходимо для производства 20,0 л метана?
Решение:
1) P и T не являются частью этой задачи:
Это потому, что в задаче вообще не упоминаются Т или Р.Мы должны считать их постоянными. Если мы предположим, что они изменились, но не знаем значений, проблема не может быть решена.
2) Сформулируйте гипотезу Авогадро (используя моли, а не молекулы):
Равные объемы газа при одинаковых температуре и давлении содержат одинаковое число молей
3) Укажите молярное соотношение водорода и метана:
2:1
4) Используйте соотношение и пропорцию:
2 моля водорода соответствует 1 молю метана, поскольку x литров водорода соответствует 20,0 л метанах = 40,0 л водорода
Пример №3: 2,35 л газообразного кислорода реагирует с 3,72 л газообразного водорода с образованием воды. Сколько литров лишнего реагента останется? Если бы на самом деле было произведено 2,50 л воды, каков был бы выход в процентах?
Решение:
1) Сбалансированное химическое уравнение:
2H 2 + O 2 —> 2H 2 O
2) Определите лимитирующий реагент:
кислород: 2,35/1 = 2,35
водорода: 3,72/2 = 1,86Водород является лимитирующим реагентом.
Обратите внимание, что в задаче не упоминается ни температура, ни давление. Это означает, что все происходит при неизменной температуре и давлении. Следовательно, эти два значения остаются постоянными и выпадают из рассмотрения. Нам не нужны моли, потому что при постоянной температуре и давлении объемы прямо пропорциональны количеству молей.
Кроме того, мы не можем даже вычислить моли, так как не знаем ни температуры, ни давления.
3) Использовать H 2 :O 2 молярное соотношение:
2 равно 1, как 3,72 равно xИспользуется 1,86 л кислорода.
2,35 − 1,86 = 0,49 л непрореагировавшего кислорода остается
4) Выход в процентах:
Производится 3,72 л воды.2,50 / 3,72 = 67,2%
Пример #4: Сколько воздуха необходимо (в м 3 , при 25,0 °C, 1,00 атм) для полного сжигания 10,0 молей пропана (C 3 H 8 ).
Решение:
1) Сжигание пропана:
C 3 H 8 + 5O 2 —> 3CO 2 + 4H 2 O
2) Определить количество молей чистого кислорода, необходимое для сжигания 10,0 моль пропана:
1 соответствует 5, как 10,0 соответствует хx = 50,0 моль необходимого кислорода
3) Используйте PV = nRT для перевода молей кислорода в литры кислорода при условиях, указанных в задаче:
(1,00 атм) (V) = (50,0 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (298 K)В = 1222,694 л
4) Преобразовать в требуемый объем воздуха:
1222,694 л / 0,21 = 5822,35 л
5) Перевести в кубические метры:
5822,35 L = 5822,35 дм 31 м 3 = 1000 дм 3
(5822,35 дм 3 ) (1 м 3 / 1000 дм 3 ) = 5,82 м 3 (до трех знаков фиг.
)
Пример #5: Пропан (C 3 H 8 ) сгорает в кислороде с образованием углекислого газа и водяного пара. Какой объем углекислого газа образуется при потреблении 2,80 л кислорода.
Решение:
Поскольку T или P не указаны, мы предполагаем, что реакция происходит при постоянной температуре и давлении.Это означает, что коэффициенты сбалансированного уравнения представляют объемное соотношение, в котором реагируют вещества.
5 объемов O 2 произведут 3 объема CO 2
Отсюда находим:
5/3 равно 2,8/xх = 1,68 л
Если бы мы предположили, что Т и Р изменились в ходе реакции, мы не смогли бы решить задачу. Однако не делайте этого предположения. Ваш учитель был бы недоволен.
Пример №6: Метан горит по следующему уравнению:
CH 4 + 2O 2 —> CO 2 + 2H 2 O
Рассчитайте объем воздуха, необходимый для сжигания 10,0 л метана при одинаковых температуре и давлении. Предположим, что воздух содержит 20,0 процентов кислорода по объему.
Предположим, что воздух содержит 20,0 процентов кислорода по объему.
Решение:
Коэффициенты дают молярное соотношение, при котором реагируют метан и кислород при одинаковых T и P.1 соответствует 2, как 10.0 соответствует х
x = требуется 20,0 л чистого кислорода.
20,0 л / 0,20 = требуется 100,0 л воздуха.
Пример № 7: Монооксид азота реагирует с кислородом в соответствии с приведенным ниже уравнением:
2NO(г) + O 2 (г) —> NO 2 (г)
Сколько литров NO (реагирующего с избытком кислорода) требуется для получения 3,0 литров NO 2 ?
Решение:
1) Указать соответствующее соотношение объемов:
2:1
2) Напишите соотношение и пропорцию:
2 соответствует 1, поскольку x соответствует 3,0 лx = 6,0 л NO требуется
К настоящему времени вы должны знать, что означает отсутствие упоминания о температуре или давлении для решения проблемы. (Подсказка: это означает, что они остаются постоянными на протяжении всей задачи, поэтому они выпадают из рассмотрения.)
(Подсказка: это означает, что они остаются постоянными на протяжении всей задачи, поэтому они выпадают из рассмотрения.)
Пример #8: Если стехиометрические количества X и Y поместить в герметичный гибкий контейнер с начальным объемом 30,0 л при нормальных условиях, какой объем Z будет произведен? (X, Y и Z находятся в газообразном состоянии)
2X + Y —> Z
Решение:
Поскольку все они являются газами, молярное отношение равно объемному отношению:
2X + Y = 30,0 лX : Y = 2 : 1 = 20 л : 10 л
n(Y) = n(Z)
, следовательно, v(Y) = v(Z) = 10,0 л произведенного Z.
Пример #9: 200,0 литров H 2 , реагирующих при 25,0 °C и 751,0 Торр, сколько литров O 2 потребуется при стандартной температуре?
Решение:
1) Уравнение:
2H 2 (ж) + O 2 (ж) —> 2H 2 O(л)
2) Используйте PV = nRT для расчета молей водорода:
(751,0 торр / 760,0 торр/атм) (200,0 л = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (298 К)n = 8,0818 моль
3) Используйте H 2 : O 2 молярное соотношение:
2 к 1 как 8,0818 мл к хx = 4,0409 моль O 2 требуется
4) Используйте PV = nRT для расчета необходимого объема O 2 при SPT:
(1,00 атм) (V) = (4,0409 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (273 K)В = 90,52 л
Пример № 10: Готовят смесь из 12,0 л NH 3 и 12,0 л Cl 2 , измеренных при одинаковых условиях. Эти вещества реагируют по следующему уравнению:
Эти вещества реагируют по следующему уравнению:
2 NH 3 (г) + 3 Cl 2 (г) —> N 2 (г) + 6 HCl(г)
Каков объем каждого газа после завершения реакции (NH 3 , Cl 2 , N 2 и HCl соответственно)? Предположим, что конечные объемы измеряются в идентичных условиях.
Решение:
1) Нужен лимитирующий реагент:
аммиак: 12/2 = 6
хлор: 12 / 3 = 4У нас есть победитель! хлор.
Помните, я могу обращаться с томами так же, как с кротами. Это связано с тем, что при постоянных T и P объемы прямо пропорциональны количеству молей.
2) Конечный объем аммиака:
2 равно 3, а x равно 12x = 8,0 л использованного аммиака
Остаточный объем: 12,0 л − 8,0 л = 4,0 л
3) Конечный объем хлора:
Ноль!
4) Конечный объем азота:
3 соответствует 1, как 12 соответствует хх = 4,0 л
5) Конечный объем HCl:
3 соответствует 6, как 12 соответствует хх = 24,0 л
Пример бонуса: Сколько литров O 2 производятся (на НТП), когда достаточное количество KO 2 реагирует с 75,0 л диоксида углерода при −25,0 °C и 215 кПа?
4KO 2 (s) + 2CO 2 (g) —> 2K 2 CO 3 (s) + 3O 2 (g)
Решение №1:
1) Определить, сколько молей СО 2 присутствует:
PV = нРТ(215 кПа) (75,0 л) = (n) (8,31447 л кПа/моль К) (248 К)
n = 7,820121 моль
2) Определить количество молей полученного O 2 :
2 7,820121 моль ––– = –––––––––– 3 х х = 11,73018 моль
3) Определить объем на STP:
PV = нРТ(101,325 кПа) (В) = (11,73018 моль) (8,31447 л кПа/моль К) (273 К)
В = 263 л (до трех знаков фиг.
)
Решение №2:
1) Определить объем CO 2 на СТП (используя комбинированный газовый закон):
П 1 В 1 П 2 В 2 ––––– = ––––– Т 1 T 2
(215 кПа) (75,0 л) (101,325 кПа) (В 2 ) ––––––––––––––– = –––––––––––––––– 248 К 273 К В 2 = 175,1838 Д
2) Определить объем O 2 , произведенный на СТП:
2 175.



 футов
футов
 дюйм в резервуаре будет 125/15 x 5 = 42 фут³ атмосферного воздуха
дюйм в резервуаре будет 125/15 x 5 = 42 фут³ атмосферного воздуха Мы должны считать их постоянными. Если мы предположим, что они изменились, но не знаем значений, проблема не может быть решена.
Мы должны считать их постоянными. Если мы предположим, что они изменились, но не знаем значений, проблема не может быть решена.
 )
) )
)