Соединения с аргоном: Газ аргон — свойства, сферы применения, температура плавления и замерзания, технический состав, давление
alexxlab | 24.06.2023 | 0 | Разное
Ключевые свойства аргона для широкого применения в промышленности
14.04.2022
Инертные газы не вступают в реакцию с другими веществами, не участвуют в синтезе химических соединений, не поддерживают процессы горения. И тем не менее, такие газы широко применяются в промышленности, где их физико-химические свойства максимально востребованы и актуальны. Один из таких газов – аргон. Его задействуют в сварочных операциях, раскрое металла, химических реакциях, на пищевых производствах, при сборке электроники и т. д.
Свойства и характеристики газа аргона
Важнейшее отличительное качество аргона – его инертность, то есть неспособность вступать в любые химические реакции. Этот газ тяжелее воздуха, практически не растворяется в воде, при нормальных условиях бесцветный, не имеет вкуса и запаха, не подвержен горению, отличается низкой теплопроводностью. Аргон не ядовит, его доля в воздушной массе составляет 0,9 % объема. Газ имеет плотность 1,784 кг/м3, температура кипения в ректификационной установке -185,8 °C. Благодаря доступности получения и низкой стоимости потребность заказать аргон с доставкой возникает у множества промышленных предприятий, строительных компаний и научно-исследовательских центров.
Благодаря доступности получения и низкой стоимости потребность заказать аргон с доставкой возникает у множества промышленных предприятий, строительных компаний и научно-исследовательских центров.
Применение аргона в различных отраслях
Аргон востребован во многих отраслях промышленности, в народном хозяйстве и даже в быту. Его применение распространено в следующих сферах:
- пищевое производство – при помощи газа из резервуаров вытесняют кислород и воду для долгого хранения продукции, добавка в виде аргона также применяется в производстве упаковки продовольственных товаров;
- металлообработка – аргон создает защитную среду, благодаря которой металлы и сплавы не вступают в реакцию с кислородом во время сварки, также газ используют при плазменном раскрое и резке;
- изготовление осветительного оборудования – с применением аргона люминесцентные лампы и лампы накаливания становятся более долговечными и эффективными;
- сборка стеклопакетов – газом заполняют светопрозрачные конструкции для лучшей тепло- и звукоизоляции окон;
- медицина – аргон задействуют в методах щадящей хирургии, при остановке кровотечений;
- химическая отрасль – используя аргон, специалисты анализируют чистоту веществ, обрабатывают металлы и расплавы.

Как лучше приобретать аргон?
Потребителям доступен аргон двух видов: в сжиженном и газообразном состоянии, в зависимости от сферы применения и условий эксплуатации. Наиболее выгодный вариант покупки – обмен баллонов с аргоном. Обменивая старые баллоны, клиент сразу же получает аттестованные заполненные емкости, готовые к эксплуатации. В случае если заказчик впервые приобретает газ, ему необходимо купить новую заполненную емкость, также готовую к использованию. В дальнейшем баллон используют для обмена. При необходимости у компании-поставщика технических газов можно приобрести дополнительное газобаллонное оборудование, например горелки.
плотность, формула, газ, атомная, молекулярная масса
Аргон – это химический элемент, занимающий в периодической таблице Д.И. Менделеева место под номером 18. Инертный, по-другому благородный, одноатомный газ аргон, который, при нормальных условиях не вступает в химические реакции и является чистым веществом, незаменим во многих сферах человеческой деятельности.
В данной статье рассказывается о его физических и химических свойствах, областях применения, технике безопасности при использовании.
Содержание
- Происхождение названия
- Распространенность
- Во вселенной
- Распространение в природе
- Физические свойства
- Химические свойства
- Атомная и молекулярная масса
- Изотопы
- Ионы
- Молекула и атом
- Молярная масса
- Получение
- Биологическая роль
- Область применения
- Окраска баллона
- Зависимость давления аргона в баллоне от температуры
- Техника безопасности при работе с аргоном
Происхождение названия
Впервые с аргоном во второй половине XVIII века столкнулся английский ученый Кавендиш при изучении состава воздуха.
Во время проведения эксперимента после удаления с помощью химических реакций кислорода и азота в трубке оставался небольшой пузырек газа, который не реагировал на внешние воздействия. Его размер составлял около 1/120 первоначального объема. Понять причину этого Кавендишу не удалось.
Его размер составлял около 1/120 первоначального объема. Понять причину этого Кавендишу не удалось.
И только более чем через столетие, на исходе XIX века, совместные усилия ученых Рэлея и Рамзая, также англичан, привели к ликвидации белого пятна в периодической таблице.
Они заинтересовались разницей в весе двух объемов азота, равных 1 л, один из которых был получен из воздуха, другой – в результате химической реакции. Эта разница составляла 1,6 мг и не могла быть отнесена на счет погрешности измерения.
Ученые предположили, что в первом случае, кроме азота, присутствует неизвестный газ, что и подтвердил последующий спектральный анализ. Поскольку этот газ оказался химически неактивным, то есть не вступал в какие-либо реакции, то и название он получил соответствующее.
В переводе с древнегреческого языка ἀργός (читается как «аргос») – медленный, ленивый.
Несколько позднее, также с помощью спектрального анализа, были открыты и другие инертные газы, присутствующие в составе атмосферы, хотя и в значительно меньших, чем аргон, количествах.
Распространенность
Температура кипения аргона при атмосферном давлении очень низка, поэтому на Земле его можно встретить лишь в виде газа.
По количеству в составе атмосферного воздуха, которое составляет около 1%, элемент уступает лишь азоту и кислороду, и это в несколько десятков раз больше, чем общее количество других инертных газов – ксенона, криптона, гелия, неона.
Поэтому он наиболее популярен. А такого содержания в воздухе вполне достаточно для промышленной добычи, тем более что после использования газ практически полностью возвращается в атмосферу, не вступая в какие-либо реакции по причине своей инертности.
Чтобы понять, как добывают аргон, необходимо учесть, что температуры кипения кислорода и азота различны и равны, соответственно, 90 °К (-183 °С) и 77 °К (-196 °С). В то же время аргон закипает при температуре, большей, чем азот, и меньшей, чем кислород.
В то же время аргон закипает при температуре, большей, чем азот, и меньшей, чем кислород.
Данную физическую особенность и используют инженеры, чтобы получить газ в чистом виде. Происходит это при низкотемпературной ректификации воздуха, то есть разделения его на азот и кислород путем многократного ожижения и испарения. Аргон в этом процессе появляется в качестве побочного продукта.
Во вселенной
В окружающей наш мир материи аргона немного – всего 0,02% от общей массы.
Ученые обнаружили его входящим вместе с еще одним инертным газом – неоном в состав некоторых звезд, а также планетарных туманностях – оболочках ионизированных газов, образующихся вокруг звезд на исходе их существования.
Рис. 1. Планетарная туманностьРаспространение в природе
На нашей планете, кроме атмосферы, аргон содержится в земной коре и морской воде, но в значительно меньшей степени – его количество составляет лишь тысячные доли процента от общей массы.
Физические свойства
1 см3 аргона в газообразном состоянии при стандартных условиях весит 1,78×10-3г, что означает, что его плотность равна 1,78×10-3г/см3.
То есть аргон тяжелее, чем воздух, который имеет плотность 1,2×10-3г/см3. Поэтому при попадании в атмосферу из какой-либо емкости, например, газового баллона, аргон будет занимать объем в нижней части помещения, вытесняя оттуда воздух и постепенно с ним смешиваясь.
Температура конденсации аргона, то есть его кипения, в условиях атмосферного давления равна 87,3 °К (-185,9 °С). При температуре 83,8 °К (– 189,3 °С) жидкость отвердевает. Плотность аргона в жидком состоянии при давлении в одну атмосферу равна 1,39х103 кг/м3.
Химические свойства
Рис. 2.Аргон в таблице Менделеева и его формула.Аргон является инертным газом, не имеющим ни запаха, ни вкуса, ни цвета и в периодической таблице занимает место среди других неметаллов в столбце с прочими благородными газами. Его химическая формула – Ar (первые две буквы латинского слова argon).
Атомная и молекулярная масса
Атомной массой называется средняя масса существующих в земных условиях изотопов с учетом их распространенности. Для аргона она составляет 39,948. Его молекулярная масса равна атомной.
Для аргона она составляет 39,948. Его молекулярная масса равна атомной.
Изотопы
Изотопы – это разновидности атомов с одинаковым зарядом ядра и различной массой. На Земле существуют следующие изотопы аргона:
- 40Ar с ядром, состоящим из 18 протонов и 22 нейтронов в земной атмосфере представлен наиболее всего – 99,6% от общего количества газа;
- 36Ar (18 нейтронов) – 0,337%;
- 38Ar (20 нейтронов) – 0,063%.
Источником изотопа 40Ar является изотоп калия 40К, являющийся радиоактивным и попадающий на поверхность земли вместе с продуктами извержения вулканов.
Также существуют изотопы, создаваемые искусственно. Их масса может иметь значение от 30 до 55 атомных единиц, но они нестабильны. Наиболее устойчивым является 39Ar с периодом полураспада, составляющим 269 лет, самые неустойчивые существуют в течение десятков наносекунд.
Ионы
Для того чтобы оторвать от атома электрон, необходимо потратить энергию, которая называется энергией ионизации.
Для создания катиона (положительно заряженного иона) Ar+ потребуется 1520 кДж/моль. Это можно осуществить с помощью пропускания через газ электрических разрядов.
Молекула и атом
Атом имеет положительно заряженное ядро, в состав которого входит 18 протонов. Вокруг ядра по трем орбитам вращаются 18 электронов – 2 на первой, на второй и третьей – по 8.
Рис. 3. Планетарная модель атома ArТаким образом, внешняя орбита заполнена электронами полностью. Именно этим объясняется отсутствие каких-либо химических соединений с участием аргона – при нормальных условиях он существует только в свободном виде.
Такое свойство присуще всем остальным инертным газам – у каждого из них внешняя электронная орбита заполнена полностью.
Молекула по этой же причине состоит из одного атома и так же, как и атом, обозначается – Ar.
Читать также: Виды аттестации сварщиков
Молярная масса
Один моль – это 6,02х1023 молекул данного вещества. Величина 6,02х1023 называется числом Авогадро и обозначается как NA. Молярная масса, определяющая свойства аргона, как и любого газа – это масса одного моля. Для аргона она равна 39,948 г/моль.
Величина 6,02х1023 называется числом Авогадро и обозначается как NA. Молярная масса, определяющая свойства аргона, как и любого газа – это масса одного моля. Для аргона она равна 39,948 г/моль.
Получение
Чаще всего аргон получают с помощью криогенной ректификации воздуха. Для этого воздух сначала тщательно очищают от частиц пыли, прогоняя через несколько фильтров, осушают, затем сжимают при помощи компрессоров до перехода в состояние жидкости.
Последнюю отправляют в ректификационную колонну – устройство, в котором при различных температурах происходит последовательное испарение азота, аргона и кислорода.
Аргонная фракция, содержащая 12%, аргона, подвергается еще одной ректификации, в результате чего доля газа в смеси доходит до 85%, остальное приходится на кислород с небольшим количеством азота.
Рис. 4. Оборудование для разделения воздухаТакой газ называют сырым аргоном и уже из него получают чистый аргон, который в зависимости от количества оставшихся примесей в соответствии с ГОСТ 10157-62 может быть трех марок:
- марка А – объемный процент содержания аргона, не менее 99,99%.
 Применяется при сварке титановых сплавов, нержавеющей стали, конструкционной стали – при повышенных требованиях к прочности;
Применяется при сварке титановых сплавов, нержавеющей стали, конструкционной стали – при повышенных требованиях к прочности; - марка Б – не менее 99,96%. Используется во время сварки алюминия, менее активных, чем титан, цветных металлов;
- марка В – не менее 99,90%. Востребована при работе с жаростойкими сплавами, алюминиевыми материалами, конструкционными сталями. Часто используется совместно с углекислым газом и кислородом.
Еще один способ получения аргона – при синтезировании аммиака. Побочным продуктом реакции является продувочный газ, содержащий до 20% аргона, причем стоимость его получения заметно ниже.
Читать также: реестр НАКС поиск сварщиков по фамилии
Биологическая роль
Под биологической ролью элемента подразумевается его участие в жизнедеятельности каких-либо организмов. Аргон в таких процессах участия не принимает, следовательно, этой роли не выполняет.
Область применения
Аргон применяется в самых различных областях деятельности человека. В первую очередь востребовано отсутствие его химическая активности.
В первую очередь востребовано отсутствие его химическая активности.
Наиболее широко газ используется при сварке – для создания вокруг дуги газового слоя, оттесняющего атмосферные кислород и азот. Поскольку этот газ тяжелее воздуха, то применять его лучше при использовании нижнего положения.
Аргон растекается над поверхностью материала, вытесняя вверх кислород с азотом, и прикрывает не только область расплава, но также и нагретую часть поверхности.
Это важно во время работы с металлами, отличающимися активностью при высокой температуре, например, такими как титан. Аргон также используют во время сварки высоколегированных и нержавеющих сталей. Неметаллы обычно соединяют с использованием газовой сварки.
Использование инертного газа дает возможность увеличить температуру дуги, а это сказывается на проплавлении шва, который приобретает форму кинжала и позволяет в один проход соединять куски металла большой толщины.
В связи с тем, что в отсутствие кислорода шов получается значительно более ровным и прочным, аргон востребован при изготовлении ответственных конструкций в строительстве: высоких зданий, железнодорожных и автомобильных мостов.
Швы высокого качества востребованы в химическом и пищевом машиностроении, атомной промышленности, аэрокосмической сфере. Нефте- и газопроводы также сооружаются с применением аргонной сварки.
В электронике инертность аргона также находит применение. Его закачивают в колбы осветительных и радиоламп – для защиты, соответственно, нити накаливания или электродов, используют при выращивании полупроводниковых кристаллов.
В сфере производства продуктов питания газ применяется в качестве вытеснителя (в первую очередь, присутствующего в воздухе кислорода). Его закачивают в герметичные упаковки с продуктами с целью увеличения срока хранения.
Низкое значение теплопроводности аргона дает возможность применять его в качестве теплоизолятора – в оконных рамах, гидрокостюмах.
Способность излучать фиолетовый свет при нагревании находит применение в рекламных афишах и надписях.
Рис. 5. Свечение аргонаДругие области применения:
- пожаротушение;
- лазеры;
- хирургические операции
и многое другое.
Полезная стать – Технология ручной дуговой сварки
Окраска баллона
При использовании баллонов для хранения газов за каждым из них закреплен цвет, в который окрашена сама емкость, а также цвет полосы, нанесенной по окружности на ее образующую вблизи горловины. Баллон, предназначенный для аргона, окрашен в серый цвет, при этом цвет полоса и надпись – зеленые.
Рис. 6. 40-литровый баллон с аргономДля транспортировки жидкого аргона применяются специальные емкости типа сосуда Дьюара и цистерны.
Полезная статья – Технология сварки труб
Зависимость давления аргона в баллоне от температуры
При заправке давление аргона в баллоне составляет порядка 150 атм. Однако в соответствии с законами физики все газы при нагревании расширяются. Если отсутствует возможность для расширения, что и наблюдается в замкнутом объеме, то при повышении температуры давление внутри него будет нарастать. В случае идеального газа соблюдается следующая зависимость:
где P – давление внутри замкнутого объема;
Т – абсолютная температура газа по шкале Кельвина, которая выше температуры по шкале Цельсия на 273°, то есть
где t – температура по шкале Цельсия.
Зависимость давления реального газа в баллоне от температуры приведена в таблице:
| Температура, °С | Давление, атм |
| -30 | 111,8 |
| -20 | 120,5 |
| -10 | 127,5 |
| 0 | 135,6 |
| +10 | 144,3 |
| +20 | 151,3 |
| +30 | 158,2 |
Таким образом, при увеличении температуры на 60 ° (от -30 °С до +30 °С) давление аргона в баллоне растет более чем на 40%.
ДЛЯ СПРАВКИ: аргон в 40-литровом баллоне при давлении 150 атм и комнатной температуре весит около 7,5 кг. При этом вес баллона, изготовленного из углеродистой стали, составляет 58,5 кг.
Техника безопасности при работе с аргоном
Газ не является ни токсичным, ни взрывоопасным, тем не менее, попадание излишнего количества аргона в воздух ведет к уменьшению в нем процентной доли кислорода, а это уже опасно для здоровья и жизни человека и может привести к кислородной недостаточности.
В обычном атмосферном воздухе содержится 20,9% кислорода, уменьшение его доли до 18% ведет к появлению головной боли и сонливости, при значении менее 15–16% человек теряет сознание.
В случае вдыхания аргона, так же как и других инертных газов, возникает мгновенное удушье и потеря сознания, чреватые летальным исходом.
Поэтому во время работы в замкнутом пространстве должны отсутствовать какие-либо утечки газа через уплотнения в соединениях трубопроводов или трещины в шлангах.
С особым вниманием за этим нужно следить при проведении сварки в слабопроветриваемых помещениях, а также приямках, где газ может скапливаться, поскольку тяжелее воздуха. Перед началом работы следует проверить содержание кислорода в окружающем пространстве – оно должно быть не менее 19%.
Читать также: Как настроить полуавтомат для сварки
В противном случае необходимо надеть изолирующий противогаз, который предотвращает какой-либо контакт органов дыхания с окружающим воздухом. Работы в таких условиях проводят два человека.
Работы в таких условиях проводят два человека.
Первая помощь в случае отравления газообразным аргоном заключается в эвакуации пострадавшего на свежий воздух, проведении искусственного дыхания, использовании кислородной подушки.
Жидкий аргон при попадании на тело человека может вызвать ожоги, поэтому, работая с ним, необходимо надевать защитные очки и спецодежду, способную предохранить поверхность тела от контакта с ним.
Да
80.72%
Нет
19.28%
Проголосовало: 249
Свои вопросы вы можете оставить в комментариях, и наши специалисты Вам помогут найти ответ.
Стабильное соединение аргона | Nature
Abstract
Инертные газы имеют особенно стабильную электронную конфигурацию, состоящую из полностью заполненных s и p валентных орбиталей. Это делает эти элементы относительно нереакционноспособными, и они существуют при комнатной температуре в виде одноатомных газов. Полинг предсказал 1 в 1933 г. , что более тяжелые инертные газы, валентные электроны которых экранированы остовными электронами и, таким образом, менее прочно связаны, могут образовывать стабильные молекулы. Это предсказание подтвердилось в 1962 путем получения гексафтороплатината ксенона, XePtF 6 , первого соединения, содержащего атом благородного газа 2,3 . С тех пор теоретически был предсказан и получен ряд различных соединений, содержащих радон, ксенон и криптон 4,5,6,7,8 . Хотя ожидается, что более легкие благородные газы неон, гелий и аргон будут реакционноспособными при подходящих условиях 9,10 , они остаются тремя последними долгоживущими элементами периодической таблицы, для которых не известно стабильное соединение. Здесь мы сообщаем, что фотолиз фтористого водорода в твердой матрице аргона приводит к образованию фторгидрида аргона (HArF), который мы идентифицировали, исследуя сдвиг положения колебательных полос при изотопном замещении с помощью инфракрасной спектроскопии.
, что более тяжелые инертные газы, валентные электроны которых экранированы остовными электронами и, таким образом, менее прочно связаны, могут образовывать стабильные молекулы. Это предсказание подтвердилось в 1962 путем получения гексафтороплатината ксенона, XePtF 6 , первого соединения, содержащего атом благородного газа 2,3 . С тех пор теоретически был предсказан и получен ряд различных соединений, содержащих радон, ксенон и криптон 4,5,6,7,8 . Хотя ожидается, что более легкие благородные газы неон, гелий и аргон будут реакционноспособными при подходящих условиях 9,10 , они остаются тремя последними долгоживущими элементами периодической таблицы, для которых не известно стабильное соединение. Здесь мы сообщаем, что фотолиз фтористого водорода в твердой матрице аргона приводит к образованию фторгидрида аргона (HArF), который мы идентифицировали, исследуя сдвиг положения колебательных полос при изотопном замещении с помощью инфракрасной спектроскопии. Обширный ab initio расчеты показывают, что HArF является внутренне стабильным из-за значительных ионных и ковалентных вкладов в его связывание, тем самым подтверждая расчетные предсказания 11,12,13 о том, что аргон должен образовывать стабильные гидридные частицы со свойствами, аналогичными свойствам аналогичного соединения ксенона и криптона, о которых сообщалось ранее 14,15,16,17,18 .
Обширный ab initio расчеты показывают, что HArF является внутренне стабильным из-за значительных ионных и ковалентных вкладов в его связывание, тем самым подтверждая расчетные предсказания 11,12,13 о том, что аргон должен образовывать стабильные гидридные частицы со свойствами, аналогичными свойствам аналогичного соединения ксенона и криптона, о которых сообщалось ранее 14,15,16,17,18 .
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Соответствующие статьи
Статьи открытого доступа со ссылкой на эту статью.
Нейропротекция дофаминовых нейронов ксеноном против эксайтотоксических воздействий низкого уровня не воспроизводится другими благородными газами.
- Дебора Ле Ног
- , Жереми Лаво
- … Патрик Пьер Мишель
Реакционная способность He с ионными соединениями под высоким давлением
- Чжэнь Лю
- , Хорхе Ботана
- … Мао-шэн Мяо
Связь с природой Открытый доступ 05 марта 2018 г.
Варианты доступа
Подпишитесь на этот журнал
Получите 51 печатный номер и доступ в Интернете
199,00 € в год
всего 3,90 € за выпуск
Узнайте больше
Возьмите напрокат или купите эту статью
5
Узнать больше
Цены могут облагаться местными налогами, которые рассчитываются при оформлении заказа
Рисунок 1: Инфракрасное поглощение HArF в твердом аргоне при 7,5 К.
Ссылки
Pauling, L. Формулы сурьмяной кислоты и антимонатов. Дж. Ам. хим. соц. 55 , 1895–1900 (1933).
Артикул КАС Google Scholar
Bartlett, N. Ксенон гексафторплатинат(V) Xe + [PtF6] – . Проц. хим. соц. 218 (1962).
Graham, L., Graudejus, O., Jha, N., K. & Bartlett, N. О природе XePtF6. Координ. хим. Ред. 197 , 321–334 (2000).
Артикул КАС Google Scholar
Холлоуэй, Дж. Х. и Хоуп, Э. Г. Последние достижения в области химии инертных газов. Доп. неорг. хим.
Артикул Google Scholar
Нельсон Л.Ю. и Пиментел Г.
 К. Инфракрасное обнаружение дихлорида ксенона. Неорг. хим. 6 , 1758–1759 (1967).
К. Инфракрасное обнаружение дихлорида ксенона. Неорг. хим. 6 , 1758–1759 (1967).Артикул КАС Google Scholar
Turner, J.J. & Pimentel, G.C. Фторид криптона: получение методом матричной изоляции. Наука 140 , 974–975 (1963).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Бондыбей, В. Е. Матричная изоляция Поиск переходных частиц. Диссертация, Унив. Калифорния, Беркли (1971).
Google Scholar
- Штейн, Л. Удаление ксенона и радона из загрязненной атмосферы диоксигенилгексафторантимонатом, O2SbF6. Природа 243 , 30–32 (1973).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Френкинг Г. и Кремер Д.
 Химия элементов инертных газов гелия, неона и аргона. Факты и теоретические предсказания. Структура. Склеивание 73 , 17–95 (1990).
Химия элементов инертных газов гелия, неона и аргона. Факты и теоретические предсказания. Структура. Склеивание 73 , 17–95 (1990).Артикул КАС Google Scholar
Френкинг Г., Кох В., Кремер Д., Гаусс Дж. и Либман Дж. Ф. Связывание неона и аргона в катионах первого ряда NeX + и ArX + (X = Li- Не). J. Phys. хим. 93 , 3410–3418 (1989).
Артикул КАС Google Scholar
Pettersson, M., Lundell, J. & Räsänen, M. Нейтральный инертный газ, содержащий молекулы с переносом заряда в твердых матрицах I: HXeCl, HXeBr, HXeI и HKrCl в Kr и Xe. J. Chem. физ. 102 , 6423–6431 (1995).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Рунеберг, Н., Петтерссон, М. Хрящев, Л.
 , Лунделл, Дж. и Расанен, М. Теоретическое исследование HArF: наблюдаемое нейтральное соединение аргона. J. Chem. физ. (отправлено).
, Лунделл, Дж. и Расанен, М. Теоретическое исследование HArF: наблюдаемое нейтральное соединение аргона. J. Chem. физ. (отправлено).Wong, M. W. Предсказание метастабильного соединения геолия: H He F. J. Am. хим. соц. 122 , 6289–6290 (2000).
Артикул КАС Google Scholar
Петтерссон, М., Лунделл, Дж. и Расанен, М. Новые нейтральные молекулы, содержащие инертные газы. евро. Дж. Неорг. хим. 729–737 (1999).
Петтерссон, М., Хрячев, Л., Лунделл, Дж. и Расанен, М. Химическое соединение, образованное из воды и ксенона: HXeOH. Дж. Ам. хим. соц. 121 , 11904–11905 (1999).
Артикул КАС Google Scholar
Петтерссон М., Хряхчев Л., Лунделл Дж., Йолкконен С. и Расанен М. Фотохимия HNCO в твердом ксеноне: Фотоиндуцированное и термически активированное образование HXeNCO.
 J. Phys. хим. А 104 , 3579–3583 (2000).
J. Phys. хим. А 104 , 3579–3583 (2000).Артикул КАС Google Scholar
Петтерссон М., Ниеминен Дж., Хрящев Л. и Расанен М. Механизм образования и ИК-индуцированного разложения HXeI в твердом Xe.
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Лоренц, М., Расанен, М. и Бондибей, В. Е. Нейтральные гидриды ксенона в твердом неоне и их внутренняя стабильность. J. Phys. хим. А 104 , 3770–3774 (2000).
Артикул КАС Google Scholar
Хант, Р. Д. и Эндрюс, Л. Фотолиз фтористого водорода в твердом аргоне. Матричные инфракрасные спектры (HF)2, (HF)(DF) и (DF)2. J. Chem. физ. 82 , 4442 –4448 (1985).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Хряхчев Л.
, Петтерссон М. и Расанен М. О самоограничении УФ-фотолиза в твердых телах инертных газов и некоторых его последствиях для матричных исследований. Хим. физ. лат. 288 , 727–733 (1998).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Томпсон, К.А. и Эндрюс, Л. Комплексы благородных газов с BeO: инфракрасные спектры Ng-BeO (Ng = Ar, Kr, Xe). Дж. Ам. хим. соц. 116 , 423–424 (1994).
Артикул КАС Google Scholar
Френкинг Г., Кох В., Гаусс Дж. и Кремер Д. Стабильность и характер притягивающих взаимодействий в HeBeO, NeBeO и ArBeO и сравнение с аналогами NGLiF, NGBN и NGLiH (NG = Он, Ар). Теоретическое исследование. Дж. Ам. хим. соц. 110 , 8007–8016 (1988).
Артикул КАС Google Scholar
Evans, C.
 J. & Gerry, M.C.L. Химическая связь благородного газа с металлом? Микроволновые спектры, структуры и сверхтонкие константы Ar-CuX (X = F, Cl, Br). J. Chem. физ. 112 , 9363–9374 (2000).
J. & Gerry, M.C.L. Химическая связь благородного газа с металлом? Микроволновые спектры, структуры и сверхтонкие константы Ar-CuX (X = F, Cl, Br). J. Chem. физ. 112 , 9363–9374 (2000).Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Evans, CJ & Gerry, MCL. Микроволновые спектры и структуры Ar-AgX (X = F, Cl, Br). J. Chem. физ. 112 , 1321–1329 (2000).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Johns, JWC Спектры протонированных инертных газов. Дж. Мол. Спектроск. 106 , 124–133 (1984).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Dunning, TH Jr & Hay, PJ. Ковалентное и ионное состояния монофторидов инертных газов. J. Chem. физ. 69 , 134–149 (1978).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Бресслер К.
 , Лоуренс В. Г. и Швентнер Н. Спектроскопия эксиплексов фторида аргона и фторида криптона в матрицах инертных газов. J. Chem. физ. 105 , 10178–10188 (1996).
, Лоуренс В. Г. и Швентнер Н. Спектроскопия эксиплексов фторида аргона и фторида криптона в матрицах инертных газов. J. Chem. физ. 105 , 10178–10188 (1996).Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Чабан Г.М., Юнг Дж.О. и Гербер Р.Б. Ab initio расчеты ангармонических колебательных состояний многоатомных систем: электронная структура в сочетании с колебательным самосогласованным полем. J. Chem. физ. 111 , 1823–1829 (1999).
Артикул ОБЪЯВЛЕНИЯ КАС Google Scholar
Скачать ссылки
Благодарности
Мы благодарим P. Pyykkö за обсуждения. Работа выполнена при поддержке Академии Финляндии.
Информация об авторе
Авторы и организации
Химический факультет, а/я 55 (А.И.Виртасен аукио 1), FIN-00014 Хельсинкский университет, Финляндия
Леонид Линнон Хриахтчев, Ника Петтерсеберг, Ника Петтерсесен Рясянен
Авторы
- Хрячев Леонид
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Nino Runeberg
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Jan Lundell
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
- Маркку Рясянен
Просмотр публикаций автора
Вы также можете искать этого автора в PubMed Google Scholar
Автор, ответственный за корреспонденцию
Маркку Расанен.
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
60 лет химии благородных газов
- Феличе Грандинетти
Природа (2022)
Атомная электроотрицательность на основе твердости и подхода с плавающей сферической гауссовой орбитой
- Варша Кумари
- Тануприя Сингх
- Танмой Чакраборти
Журнал математической химии (2022)
Возвращаясь к производным отрицательного дипольного момента молекул HNgX.

- Вагнер Э. Рихтер
- Леонардо Дж. Дуарте
- Рой Э. Брунс
Счета по теоретической химии (2020)
Параметрическая характеристика медно-металлических покрытий, полученных методом гальваники в сверхкритическом аргоне
- Хо-Чиао Чжуан
- Хорхе Санчес
JOM (2020)
Нейропротекция дофаминовых нейронов ксеноном против эксайтотоксических воздействий низкого уровня не воспроизводится другими благородными газами.

- Дебора Ле Ног
- Жереми Лаво
- Патрик Пьер Мишель
Журнал нейронной передачи (2020)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Аргон (произносится как /ˈɑrgɒn/) — химический элемент, обозначаемый символом Ar . Аргон имеет атомный номер 18 и является третьим элементом в 18-й группе периодической таблицы (благородные газы). Дополнительные рекомендуемые знания
Характеристики Аргон имеет примерно такую же растворимость в воде, как газообразный кислород, и в 2,5 раза более растворим в воде, чем газообразный азот. Этот высокостабильный химический элемент не имеет цвета, запаха, вкуса и нетоксичен как в жидкой, так и в газообразной форме. Хотя аргон является инертным газом, было обнаружено, что он способен образовывать некоторые соединения. Например, исследователи Хельсинкского университета в 2000 г. сообщили о создании гидрофторида аргона (HArF), метастабильного соединения аргона с фтором и водородом. в настоящее время ограничены HArF, аргон может образовывать клатраты с водой, когда его атомы захвачены решеткой молекул воды. [2] Также аргонсодержащие ионы, напр. ArH+ и комплексы в возбужденном состоянии, например АрФ хорошо известны. Теоретические расчеты на компьютерах показали несколько соединений аргона, которые должны быть стабильными, но пути синтеза которых в настоящее время неизвестны. История Аргон (греч. αργόν означает «ленивый» в связи с его химической неактивностью) [3] [4] [5] не обнаружено до 1894 лорда Рэлея и сэра Уильяма Рамзи в эксперименте, в котором они удалили весь кислород и азот из образца воздуха. ПриложенияСуществует несколько различных причин, по которым аргон используется в конкретных приложениях:
Другие инертные газы, вероятно, также подходят для большинства этих применений, но аргон намного дешевле. Аргон недорогой, так как он является побочным продуктом производства жидкого кислорода и жидкого азота, оба из которых используются в больших промышленных масштабах.
Следующей наиболее распространенной причиной использования аргона является его низкая теплопроводность. Используется для теплоизоляции в энергосберегающих окнах. Аргон также используется из-за особого способа ионизации и излучения света. Он используется в плазменных шарах и калориметрии в экспериментальной физике элементарных частиц. Синие аргоновые лазеры используются в хирургии для сваривания артерий, разрушения опухолей и исправления дефектов глаз. [11] В микроэлектронике для распыления используются ионы аргона. Наконец, есть ряд различных применений. Аргон-39, с периодом полураспада 269 лет, использовался для ряда приложений, в первую очередь для датирования ледяных кернов и грунтовых вод. Соотношение аргон-40/калий-40 используется при датировании магматических пород. Процедуры криохирургии, такие как криоабляция, используют сжиженный аргон для разрушения раковых клеток. В хирургии он используется в процедуре, называемой «коагуляция с усилением аргоном», которая представляет собой форму электрохирургии с помощью аргонно-плазменного луча. ВозникновениеАргон составляет 0,934% по объему и 1,29% по массе атмосферы Земли, а воздух является основным сырьем, используемым промышленностью для производства продуктов очищенного аргона. Аргон выделяют из воздуха путем фракционирования, чаще всего путем криогенной фракционной перегонки — процесса, в ходе которого также получают очищенный азот, кислород, неон, криптон и ксенон. [13] Марсианская атмосфера, напротив, содержит 1,6% аргона-40 и 5 частей на миллион аргона-36. Облет планеты Меркурий космическим зондом “Маринер” в 19 г.73 обнаружил, что Меркурий имеет очень тонкую атмосферу с 70% аргона, которая, как полагают, является результатом выбросов газа как продукта распада радиоактивных материалов на планете. В 2005 году зонд Huygens также обнаружил присутствие аргона-40 на Титане, крупнейшем спутнике Сатурна. СоединенияПолный октет электронов аргона указывает на полные подоболочки s и p. Этот полный внешний энергетический уровень делает аргон очень стабильным и чрезвычайно устойчивым к связыванию с другими элементами. До 1962, аргон и другие благородные газы считались химически инертными и неспособными образовывать соединения; однако с тех пор были синтезированы соединения более тяжелых благородных газов. В августе 2000 года исследователи из Хельсинкского университета образовали первые соединения аргона. При освещении ультрафиолетовым светом замороженного аргона, содержащего небольшое количество фтористого водорода, образовывался гидрофторид аргона (HArF). [15] Стабилен до 40 кельвинов (-233 °C). Открытие дифторида аргона (ArF 2 ) был объявлен в 2003 году. Но это не подтверждено и, скорее всего, неверно. Изотопы Основными изотопами аргона, обнаруженными на Земле, являются 40 Ar (99,6%), 36 Ar (0,34%) и 38 Ar (0,06%). В атмосфере Земли 39 Ar образуется под действием космических лучей, в основном с 40 Ar. В подземной среде он также образуется в результате захвата нейтронов 39 К или альфа-излучения кальцием. 37 Ar образуется при распаде 40 Ca в результате подземных ядерных взрывов. Период полувыведения составляет 35 дней. [16] Потенциальные опасности Хотя аргон нетоксичен, он не удовлетворяет потребности организма в кислороде и является простым удушающим средством. Люди по ошибке задохнулись, вдыхая аргон. 9 Миддо, Джон; Бледсо, Гэри. Дополнительная литература
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


 948(1) g·mol −1
948(1) g·mol −1  )
) Аргон присутствует в атмосфере Земли в количестве чуть менее 1%, что делает его самым распространенным благородным газом на Земле. Его полная внешняя оболочка делает аргон стабильным и устойчивым к связыванию с другими элементами. Температура его тройной точки 83,8058 К является определяющей фиксированной точкой в Международной температурной шкале 19°.90.
Аргон присутствует в атмосфере Земли в количестве чуть менее 1%, что делает его самым распространенным благородным газом на Земле. Его полная внешняя оболочка делает аргон стабильным и устойчивым к связыванию с другими элементами. Температура его тройной точки 83,8058 К является определяющей фиксированной точкой в Международной температурной шкале 19°.90. Аргон инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре.
Аргон инертен в большинстве условий и не образует подтвержденных стабильных соединений при комнатной температуре. [6] Аргон также был обнаружен в 1882 году благодаря независимым исследованиям Х. Ф. Ньюолла и В. Н. Хартли. Каждый наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов. Символ аргона теперь Ar , но до 1957 года это было 9.0097 А . [7]
[6] Аргон также был обнаружен в 1882 году благодаря независимым исследованиям Х. Ф. Ньюолла и В. Н. Хартли. Каждый наблюдал новые линии в цветовом спектре воздуха, но не мог определить элемент, ответственный за эти линии. Аргон стал первым открытым представителем благородных газов. Символ аргона теперь Ar , но до 1957 года это было 9.0097 А . [7]  Другие инертные газы (кроме гелия) также производятся таким же образом, но аргон является самым обильным, так как его концентрация в атмосфере самая высокая.
Основная масса применений аргона возникает просто потому, что он инертен и относительно дешев. Аргон используется:
Другие инертные газы (кроме гелия) также производятся таким же образом, но аргон является самым обильным, так как его концентрация в атмосфере самая высокая.
Основная масса применений аргона возникает просто потому, что он инертен и относительно дешев. Аргон используется:
 [10] Аргон также используется в техническом подводном плавании с аквалангом для надувания сухого гидрокостюма, поскольку он инертен и обладает низкой теплопроводностью.
[10] Аргон также используется в техническом подводном плавании с аквалангом для надувания сухого гидрокостюма, поскольку он инертен и обладает низкой теплопроводностью. Процедура сопряжена с риском возникновения газовой эмболии у пациента и привела к смерти одного человека в результате несчастного случая такого типа. [12]
Процедура сопряжена с риском возникновения газовой эмболии у пациента и привела к смерти одного человека в результате несчастного случая такого типа. [12]  [14]
[14]  Встречающийся в природе 40 К с периодом полураспада 1,25×10 9 лет, распадается до стабильного 40 Ar (11,2%) путем захвата электронов и испускания позитронов, а также до стабильного 40 Ca (88,8%) через бета-распад. Эти свойства и соотношения используются для определения возраста горных пород. [16]
Встречающийся в природе 40 К с периодом полураспада 1,25×10 9 лет, распадается до стабильного 40 Ar (11,2%) путем захвата электронов и испускания позитронов, а также до стабильного 40 Ca (88,8%) через бета-распад. Эти свойства и соотношения используются для определения возраста горных пород. [16] 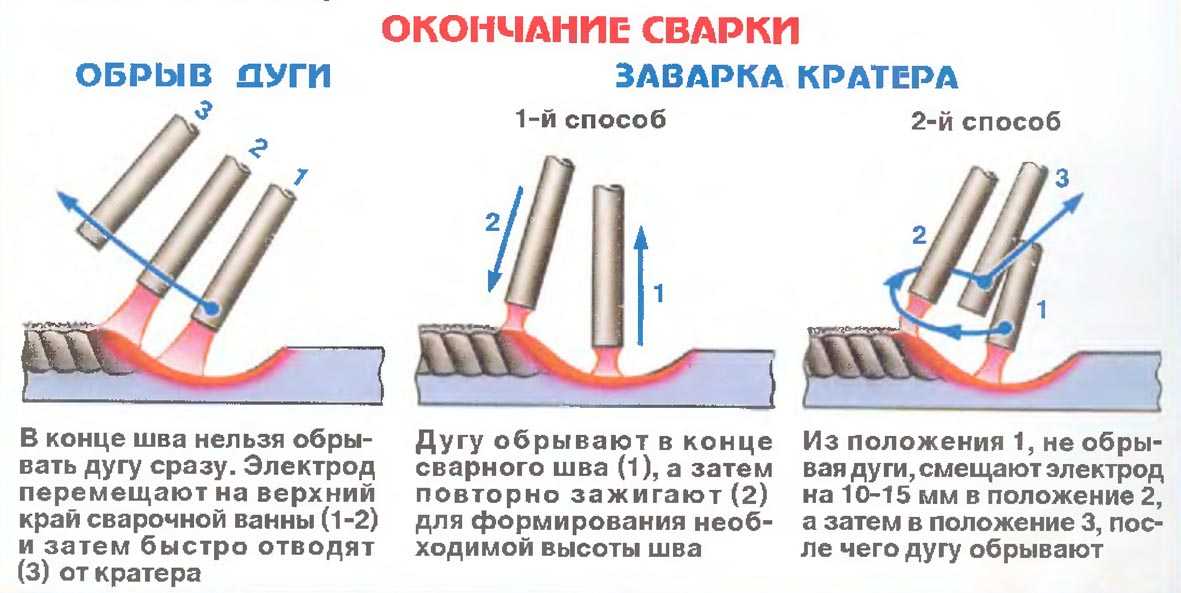 «Помощник сварщика задохнулся в инертной аргоном трубе (FACE AK-94-012)». Департамент общественного здравоохранения штата Аляска. 23 июня 1994 г. Проверено 3 сентября 2007 г.
«Помощник сварщика задохнулся в инертной аргоном трубе (FACE AK-94-012)». Департамент общественного здравоохранения штата Аляска. 23 июня 1994 г. Проверено 3 сентября 2007 г.