Состав атома аргона: Строение атома аргона – ответ на Uchi.ru
alexxlab | 31.03.2023 | 0 | Разное
Состав и строение атома
Состав ядра и электронное строение атома
Атом – частица со сложной структурой. В его центре находится положительно заряженное ядро, состоящее из протонов и нейтронов. Принято считать, что:
– масса протона равна 1, m(протона) = 1. Заряд протона равен +1, Z(протона) = +1.
– масса нейтрона равна 1, m(нейтрона) = 1. Заряд нейтрона равен 0, Z(нейтрона) = 0.
(Подсказка: нейтрон = нейтральный, это значит, что его заряд 0).
Обобщаем:
– в ядре находятся протоны и нейтроны,
– ядро заряжено положительно,
– заряд одного протона +1, заряд одного нейтрона 0.
То есть, заряд ядра обусловлен общим зарядом протонов. Каждый химический элемент имеет своё количество протонов. Сколько протонов находится в ядре, можно определить по порядковому номеру элемента в Периодической Системе Химических Элементов Д. И.Менделеева (далее ПСХЭ). Например, атом натрия в ПСХЭ помещён под номером 11. Это значит, что протонов в его ядре 11, а заряд ядра +11.
И.Менделеева (далее ПСХЭ). Например, атом натрия в ПСХЭ помещён под номером 11. Это значит, что протонов в его ядре 11, а заряд ядра +11.
Краткая запись: Zя(Na) = +11.
Задание №1. Укажите заряды ядер для атомов бора, хлора, азота, тантала.
Вокруг ядра по условным траекториям, которые называют орбитами (или энергетическими уровнями), «вращаются» электроны (рис.1, «Планетарная модель»):
Рис.1 Такая модель называется «Планетарной» или моделью Резерфорда
Движение электронов по орбитам не хаотично, а имеет свой определённый порядок. Этот порядок описывается законами квантовой механики. Каждый электрон характеризуется своей энергией. Какой энергией обладает электрон, зависит от того, насколько далеко он находится от ядра.
Чем дальше электрон от ядра – тем меньше у него энергии.
Представьте себе магнит, вокруг которого расположены металлические стружки. Чем дальше от магнита находятся эти стружки, тем слабее они притягиваются к нему и тем меньшая энергия нужна, чтобы удалить их от магнита.
Чем дальше от магнита находятся эти стружки, тем слабее они притягиваются к нему и тем меньшая энергия нужна, чтобы удалить их от магнита.
Электроны, имеющие одинаковую энергию, принадлежат одному и тому же энергетическому уровню. Сколько электронов максимально («лимит» уровня) может быть на одном уровне, рассчитывают по формуле:
N = 2n2, (1)
N – число электронов,
n – номер энергетического уровня.
На первом уровне (n = 1) может быть N = 2×12 = 2 электрона.
Вообще, на первом уровне может располагаться и один электрон, но лишь в том случае, когда он у атома всего один. Так, например, выглядит строение атома водорода:
Рис. 2. Строение атома водорода
На втором (n = 2): N = 2×22 = 8 электронов.
Так, восемь электронов на втором уровне – это предел уровня. Больше электронов, чем восемь, на этом уровне быть не может. Меньше – пожалуйста. Пример – атом фтора:
Рис. 3. Строение атома фтора
На третьем (n = 3): N = 2×32 = 18 электронов.
На четвёртом (n = 4): N = 2×42 = 32 электрона.
На пятом (n = 5): N = 2×52 = 50 электронов.
И так далее.
Чтобы определить, сколько энергетических уровней в конкретном атоме, необходимо посмотреть, в каком периоде ПСХЭ находится элемент.
Например, атом хлора расположен в третьем периоде ПСХЭ, поэтому он имеет три энергетических уровня, на которых в сумме расположено 17 электронов.
Задание №2. С помощью ПСХЭ определите заряд ядра, количество протонов, электронов и энергетических уровней для элементов с номерами 28, 56, 3, 1, 37.
Форму записи, указанную на рисунках 2 и 3, можно представить в более простом виде:
H (+1), 1e–. (Рис. 2)
F (+9), 2e–, 7e–. (Рис. 3)
У нас получится записать в подобном виде строения атомов с порядковыми номерами от первого, водорода, до восемнадцатого, аргона:
Рис. 4. Строение атома аргона
Казалось бы, записать строение атома калия должно быть проще простого: K (+19), 2e–, 8e–, 9e–. Но вот недоразумение! Калий находится в четвёртом периоде, следовательно, у него должен заполнятся уже четвёртый уровень, но остаётся место ещё на третьем! Как быть?
На самом деле, всё достаточно просто. Как уже было сказано, электроны одного уровня имеют одинаковую энергию. Эта энергия определяется усилием (энергетическим), которое нужно приложить, чтобы электрон с уровня «выбить». В пределах одного уровня величина этой энергии тоже может колебаться. По таким колебаниям уровень разделяют на подуровни. Известно, что:
В пределах одного уровня величина этой энергии тоже может колебаться. По таким колебаниям уровень разделяют на подуровни. Известно, что:
Первый уровень, самый близкий к ядру, включает в себя только один подуровень. Он называется 1s. «1» означает номер уровня, s – первая буква слова «sharp», что в переводе с английского означает «резкий, острый». Такое названия подуровень получил в ходе физико-химических исследований. Каждый подуровень состоит из нескольких орбиталей – мест, где нахождение электрона максимально вероятно. Кстати, нельзя определить его точное местонахождение (об этом сказал Вернер Карл Гейзенберг, немецкий физик-теоретик в 1927 году).
1s-подуровень может вместить всего два электрона. Запись выглядит так: 1s2. Как можно догадаться, раз у атома водорода всего один-единственный электрон, то и запись для него будет несколько другая: 1s1.
Чуть выше мы говорили о том, что электроны, подобно планетам, вращаются вокруг ядра. Безусловно, эта модель довольно приблизительно описывает поведение электронов в атоме. Вспомним также, что планеты (= электроны) не только двигаются вокруг Солнца (= ядро), но ещё имеют собственную ось вращения. Так и электроны – способны «вращаться» вокруг своей оси, причём в двух направлениях – по часовой стрелке и против неё. Природа такого поведения объясняется законами квантовой механики, а собственный момент вращения электрона был назван спином (от английского spin – «вращение», «вращать»). Поскольку направлений движения два, то говорят, что электрон имеет полуцелый спин (1/2).
Безусловно, эта модель довольно приблизительно описывает поведение электронов в атоме. Вспомним также, что планеты (= электроны) не только двигаются вокруг Солнца (= ядро), но ещё имеют собственную ось вращения. Так и электроны – способны «вращаться» вокруг своей оси, причём в двух направлениях – по часовой стрелке и против неё. Природа такого поведения объясняется законами квантовой механики, а собственный момент вращения электрона был назван спином (от английского spin – «вращение», «вращать»). Поскольку направлений движения два, то говорят, что электрон имеет полуцелый спин (1/2).
Вернёмся к 1s-подуровню. Два его электрона должны иметь разные спины, то есть, если один «вращается» по часовой стрелке, то другой – обязательно против. Этот принцип был сформулирован в 1925 году швейцарским учёным Вольфгангом Паули и носит его имя (принцип Паули, рис.5). Балее строгая формулировка этого принципа такова: на каждой орбитали могут находиться не более двух электронов с противоположными спинами.
Рис.5. Распределение электронов на 1s-подуровне в соответствии с принципом Паули
Второй уровень содержит два подуровня: 2s и 2p. 2s-подуровень отличается по энергии от 1s-подуровня, он ведь дальше от ядра. Стоит запомнить, что лимит любого s-подуровня – 2 электрона. Больше двух такой подуровень вместить не может.
Название p-подуровня происходит от английского слова «principal», то есть «главный». Лимит p-подуровня – уже 6 электронов. На этом подуровне может быть и меньшее количество электронов, в том случае, когда в самом атоме их немного; но шести быть не может точно. Однако, когда электронов на p-подуровне меньше, чем 6, они будут распределяться в соответствии с правилом, сформулированным немецким учёным Фридрихом Хундом в 1925 году: в пределах одного подуровня электроны распределяются так, чтобы их суммарный спин был максимален.
Рис. 6а. Правильное распределение трёх электронов на 2p-подуровне. Каждый спин электрона 1/2, суммарный: 3/2.
6а. Правильное распределение трёх электронов на 2p-подуровне. Каждый спин электрона 1/2, суммарный: 3/2.
Рис.6б. Неправильное распределение трёх электронов на 2p-подуровне. Спины двух электронов равны 1/2, а спин одного электрона: -1/2, суммарный спин: 1/2.
Правило Хунда и принцип Паули выполняются для всех уровней и подуровней.
Третий уровень вмещает в себя три подуровня: 3s, 3p и 3d. «d» произошло от слова «diffuse» – «расплывчатый». Его лимит – 10 электронов.
И, наконец, четвёртый уровень содержит уже четыре подуровня: 4s, 4p, 4d и 4f. f произошло от слова «fundamental» – «фундаментальный». Вместимость 4f-подуровня – 14 электронов.
Если говорить о пятом уровне и следующих за ним, то там будут и другие подуровни. В их изучении пока нет необходимости.
Подуровни отличаются друг от друга по энергиям:
Рис. 7. Относительное энергетическое расположение подуровней. Здесь каждый квадрат – ячейка, в которой могут расположиться два электрона.
7. Относительное энергетическое расположение подуровней. Здесь каждый квадрат – ячейка, в которой могут расположиться два электрона.
4s-подуровень (рис.5) обладает энергией, более низкой, чем 3d-подуровень. То есть, 4s-подуровень будет заполнен раньше, чем 3d. Поэтому электроны калия выстраиваются в следующем порядке:
1s2 2s2 2p6 3s2 3p6 4s1.
Или: K (+19), 2e–, 8e–, 8e–,1e–.
Или:
Рис. 8. Строение атома калия
Задание №3. Запишите строение атомов кальция, скандия и алюминия тремя разными способами, как это написано для калия выше.
Шпаргалка.
Приложение. Тест «Строение атома. Электронная оболочка атома»
1. Элемент третьего периода I группы главной подгруппы ПСХЭ – это:
1) натрий 2) калий 3) кальций 4) углерод
2. Элемент второго периода II группы главной подгруппы ПСХЭ – это:
Элемент второго периода II группы главной подгруппы ПСХЭ – это:
1) рубидий 2) кальций 3) бериллий 4) ксенон
3. Верны ли следующие высказывания?
А. Ядро атома состоит из протонов и электронов.
Б. Заряд ядра атома равен порядковому номеру элемента в периодической системе химических элементов Д.И.Менделеева.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения не верны
4. Соотнесите:
Атомы химических элементов
А) Al Б) Br В) Fe Г) Se
Число протонов в ядре атома
1) 34 2) 56 3) 13 4) 35 5) 27 6) 26
5. Соотнесите:
Химический элемент
А) магний Б) водород В) сера Г) натрий
Обозначение химического элемента
1) 2) 3) 4) 5) 6)
6. Соотнесите:
Химический элемент
А) бром Б) кислород В) марганец Г) хром
Количество электронов в атоме.
1) 25 2) 8 3) 35 4) 24 5) 80 6) 16
7. Число энергетических уровней (электронных слоев) в электронной оболочке атома равно
1) номеру группы 2) номеру периода 3) заряду ядра 4) порядковому номеру
8. В электронной оболочке атома магния число энергетических уровней равно:
1) 1 2) 2 3) 3 4) 4
9. Атому фосфора соответствует электронная схема:
1) 2) 3) 4)
10. Одинаковое число электронов на внешнем уровне имеют атомы:
1) F и Br 3) Se и P
2) S и Cl 4) K и Ca
Особенности горения алифатических и ароматических гетероциклических соединений в среде аргона, диоксида углерода и водяного пара
Развитие новых технологий экологически чистой утилизации токсичных органических отходов, основанной на их окислении в сверхкритической воде (Т > 647 K, Р > 22.1 МПа), сдерживается отсутствием данных по кинетике и механизмам окисления индивидуальных органических веществ.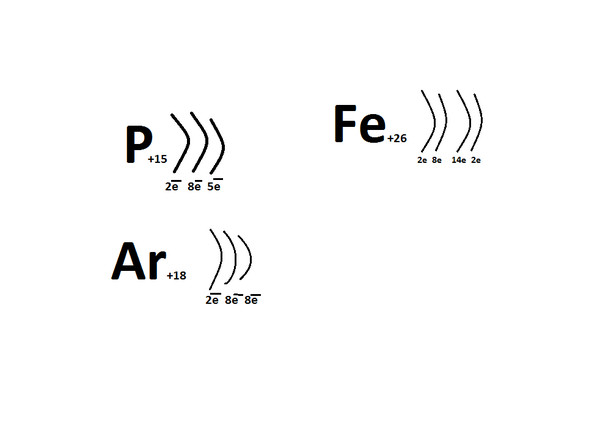 С использованием разработанной нами методики инициирования окисления впервые получены экспериментальные данные по кинетике тепловыделения, составу и выходу продуктов окисления алифатических соединений (пропан, пропен и изопропанол) в среде аргона, диоксида углерода и водяного пара, а также ароматических соединений (бензол, пиррол, пиридин, тиофен и дибензотиофен) в среде водяного пара и аргона в условиях высокой плотности компонентов реакционной смеси. Установлено, что окисление топлив протекает по механизмам газо-фазных и гетерогенных реакций. Температура самовоспламенения алифатических соединений в среде аргона увеличивается в последовательности: C3H6 < C3H7OH < C3H8 и коррелирует с изменением энергии отрыва атома Н от молекулы топлива. Окисление пропана в среде аргона и водяного пара, а также окисление изопропанола в среде аргона и диоксида углерода протекает по механизму цепно-теплового взрыва. Выявлены механизмы участия молекул h3O и CO2 в окислении топлив. Из временных зависимостей температуры реакционных смесей, из-меряемой с помощью Pt-Rh/Pt термопары, следует, что температура самовоспламенения ароматических соединений в водяном паре увеличивается в последовательности: C4h5S < C6H6 < C12H8S < C5H5N < C4h5NH.
С использованием разработанной нами методики инициирования окисления впервые получены экспериментальные данные по кинетике тепловыделения, составу и выходу продуктов окисления алифатических соединений (пропан, пропен и изопропанол) в среде аргона, диоксида углерода и водяного пара, а также ароматических соединений (бензол, пиррол, пиридин, тиофен и дибензотиофен) в среде водяного пара и аргона в условиях высокой плотности компонентов реакционной смеси. Установлено, что окисление топлив протекает по механизмам газо-фазных и гетерогенных реакций. Температура самовоспламенения алифатических соединений в среде аргона увеличивается в последовательности: C3H6 < C3H7OH < C3H8 и коррелирует с изменением энергии отрыва атома Н от молекулы топлива. Окисление пропана в среде аргона и водяного пара, а также окисление изопропанола в среде аргона и диоксида углерода протекает по механизму цепно-теплового взрыва. Выявлены механизмы участия молекул h3O и CO2 в окислении топлив. Из временных зависимостей температуры реакционных смесей, из-меряемой с помощью Pt-Rh/Pt термопары, следует, что температура самовоспламенения ароматических соединений в водяном паре увеличивается в последовательности: C4h5S < C6H6 < C12H8S < C5H5N < C4h5NH.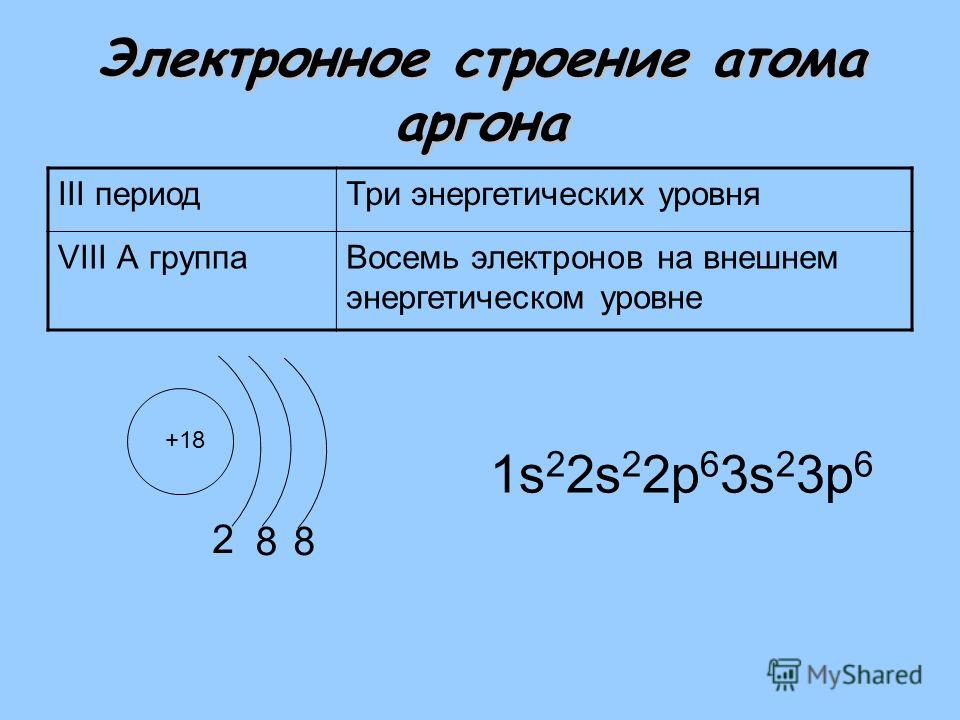
ИТ СО РАН. Руководитель работы – Федяева Оксана Николаевна в.н.с., д.х.н., профессор РАН. Исполнители – Востриков Анатолий Алексеевич гл.н.с., д.ф.-м.н., профессор; Артамонов Денис Олегович ведущий инженер; Шишкин Андрей Валентинович с.н.с., к.х.н.; Сокол Михаил Яковлевич м.н.с. Тел. +7 (383) 330-80-94.
Изучение газообразного аргона, заключенного в двумерный массив крошечных «клеток»
Художественное изображение атома аргона (Ar), запертого в наноклетке с каркасом из кремния (Si)-кислорода (O). Предоставлено: Брукхейвенская национальная лаборатория. Ученые из Брукхейвенской национальной лаборатории Министерства энергетики США (DOE) только что закончили эксперимент с двумерной (2D) структурой, которую они синтезировали для исследования катализа, когда, к своему удивлению, они обнаружили, что атомы газообразного аргона застряли внутри. наноразмерные поры структуры. Аргон и другие инертные газы ранее были захвачены трехмерными (3D) пористыми материалами, но их иммобилизация на поверхностях была достигнута либо путем охлаждения газов до очень низких температур для их конденсации, либо путем ускорения ионов газа для их непосредственной имплантации.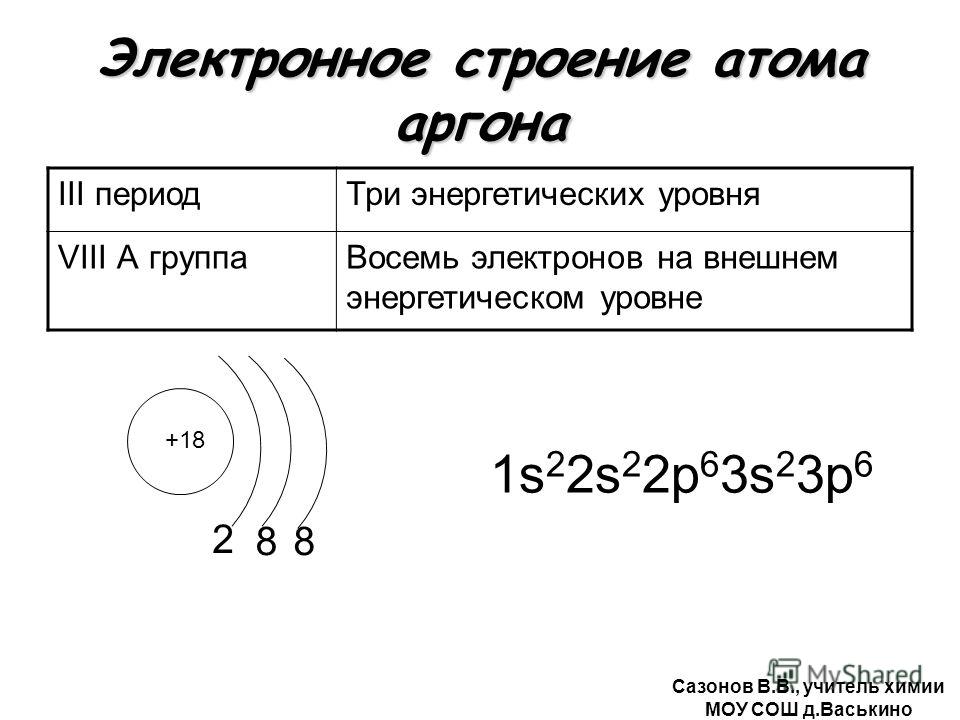
«Мы первая команда, которая улавливает благородный газ в двумерной пористой структуре при комнатной температуре», — сказал Анибал Боскобойник, материаловед из Брукхейвенского лабораторного центра функциональных наноматериалов (CFN), пользовательского центра Управления науки Министерства энергетики, где часть исследования было проведено.
Это достижение, о котором сообщается в статье, опубликованной сегодня в журнале Nature Communications , позволит ученым использовать традиционные инструменты исследования поверхности, такие как рентгеновская фотоэлектронная и инфракрасная отражательно-абсорбционная спектроскопия, для детального изучения отдельных атомов газа в замкнутом пространстве. . Знания, полученные в результате таких исследований, могут помочь в разработке, выборе и улучшении адсорбирующих материалов и мембран для улавливания таких газов, как радиоактивный криптон и ксенон, образующихся на атомных электростанциях.
Группа ученых из Брукхейвенской лаборатории, Университета Стоуни-Брук и Национального университета Сан-Луиса в Аргентине синтезировала двумерные алюмосиликатные пленки (состоящие из алюминия, кремния и кислорода) на поверхности металлического рутения.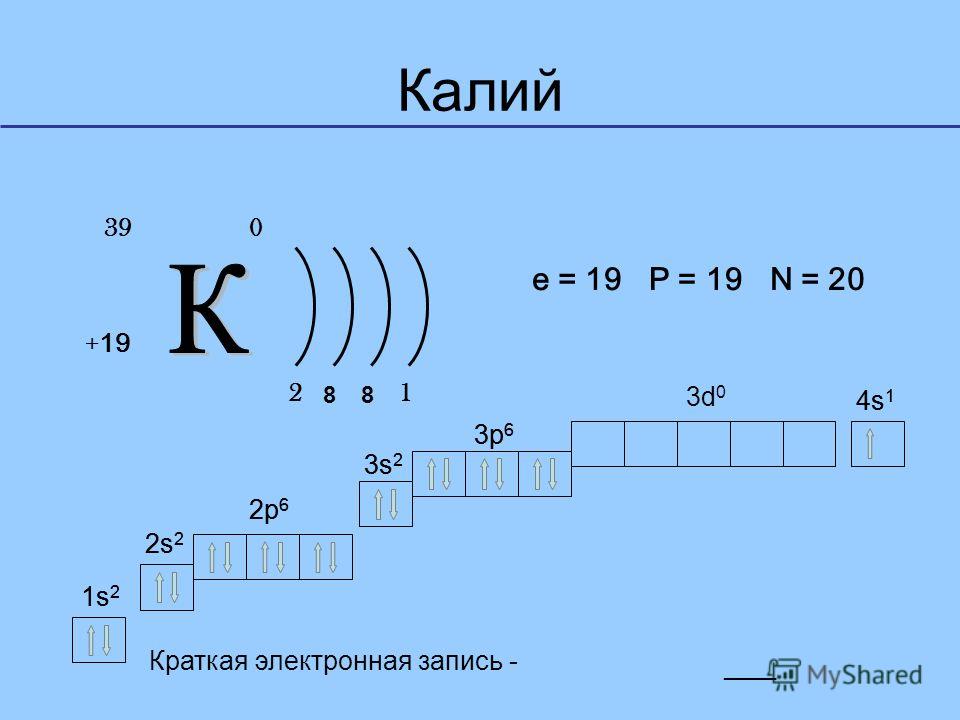 Ученые создали эту двухмерную модель каталитического материала для изучения химических процессов, происходящих в промышленно используемом трехмерном катализаторе (так называемом цеолите), который имеет решетчатую структуру с открытыми порами и каналами размером с небольшие молекулы. Поскольку каталитически активная поверхность заключена в эти полости, ее трудно исследовать с помощью традиционных инструментов исследования поверхности. Двумерный аналог материала имеет тот же химический состав и активную зону, что и трехмерный пористый цеолит, но его активная часть открыта на плоской поверхности, к которой легче получить доступ с помощью таких инструментов.
Ученые создали эту двухмерную модель каталитического материала для изучения химических процессов, происходящих в промышленно используемом трехмерном катализаторе (так называемом цеолите), который имеет решетчатую структуру с открытыми порами и каналами размером с небольшие молекулы. Поскольку каталитически активная поверхность заключена в эти полости, ее трудно исследовать с помощью традиционных инструментов исследования поверхности. Двумерный аналог материала имеет тот же химический состав и активную зону, что и трехмерный пористый цеолит, но его активная часть открыта на плоской поверхности, к которой легче получить доступ с помощью таких инструментов.
Чтобы подтвердить, что атомы аргона были захвачены этими «наноклетками», ученые подвергли двумерный материал воздействию газообразного аргона и измерили кинетическую энергию и количество электронов, выброшенных с поверхности после попадания на нее рентгеновского луча. Они провели эти исследования на бывшем Национальном источнике синхротронного света I (NSLS-I) и на его преемнике, NSLS-II (оба объекта Управления науки Министерства энергетики США в Брукхейвене), с помощью прибора, разработанного и эксплуатируемого CFN. Поскольку энергии связи основных электронов уникальны для каждого химического элемента, результирующие спектры показывают присутствие и концентрацию элементов на поверхности. В отдельном эксперименте, проведенном в CFN, они направляли луч инфракрасного света на поверхность, вводя газ аргон. Когда атомы поглощают свет с определенной длиной волны, их колебательные движения претерпевают изменения, характерные для молекулярной структуры и химических связей этого элемента.
Поскольку энергии связи основных электронов уникальны для каждого химического элемента, результирующие спектры показывают присутствие и концентрацию элементов на поверхности. В отдельном эксперименте, проведенном в CFN, они направляли луч инфракрасного света на поверхность, вводя газ аргон. Когда атомы поглощают свет с определенной длиной волны, их колебательные движения претерпевают изменения, характерные для молекулярной структуры и химических связей этого элемента.
Чтобы лучше понять, как сам каркас способствует образованию каркаса, ученые исследовали механизм захвата силикатными пленками, которые по структуре аналогичны алюмосиликатам, но не содержат алюминия. В данном случае они обнаружили, что не весь аргон попадает в клетки — небольшое его количество попадает на границу между каркасом и поверхностью рутения. Этот интерфейс слишком сжат в алюмосиликатных пленках, чтобы аргон мог протиснуться внутрь.
Изучив адсорбцию, ученые исследовали обратный процесс десорбции путем постепенного повышения температуры до тех пор, пока атомы аргона полностью не высвободятся с поверхности при температуре 350 градусов по Фаренгейту.
В другом эксперименте по инфракрасной спектроскопии, проведенном в Химическом отделении Брукхейвена, они исследовали, как присутствие аргона в клетках влияет на прохождение молекул монооксида углерода через каркас. Они обнаружили, что аргон ограничивает количество молекул, адсорбирующихся на поверхности рутения.
«Помимо улавливания малых атомов клетки можно использовать в качестве молекулярных сит для фильтрации окиси углерода и других малых молекул, таких как водород и кислород», — сказал первый автор Цзянь-Цян Чжун, научный сотрудник CFN.
Хотя их основной целью в будущем будет продолжение исследования цеолитных каталитических процессов на двумерном материале, ученые заинтересованы в изучении влияния различных размеров пор на способность материалов улавливать и фильтровать молекулы газа.
“По мере того, как мы стремимся лучше понять материал, продолжают появляться интересные и неожиданные находки”, – сказал Боскобойник. «Возможность использовать методы исследования поверхности, чтобы понять, как ведет себя отдельный атом газа, когда он заключен в очень маленьком пространстве, открывает перед исследователями множество интересных вопросов».
«Возможность использовать методы исследования поверхности, чтобы понять, как ведет себя отдельный атом газа, когда он заключен в очень маленьком пространстве, открывает перед исследователями множество интересных вопросов».
Дополнительная информация: Цзянь-Цян Чжун и др., Иммобилизация одиночных атомов аргона в наноклетках двумерных модельных систем цеолита, Nature Communications (2017). DOI: 10.1038/ncomms16118
Предоставлено Брукхейвенская национальная лаборатория
Цитата : Изучение газообразного аргона, заключенного в двумерный массив крошечных «клеток» (17 июля 2017 г.) получено 28 февраля 2023 г. из https://phys.org/news/2017-07-argon-gas-two-Dimension-Array-Tiny.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Первые молекулы инертных газов, обнаруженные в космосе – Physics World
Аргон был выкован в обреченной звезде, которая стала Крабовидной туманностью. (Предоставлено: НАСА, ЕКА, Дж. Хестер и А. Лолл (Университет штата Аризона))Международная группа астрономов случайно обнаружила первые космические молекулы, содержащие благородный газ аргон. Удивительное открытие в обломках взорвавшейся звезды раскрывает изотопный состав элемента, подтверждая давние предсказания о том, что аргон образуется в таких обреченных звездах.
Когда-то называемые инертными газами, элементы в последнем столбце периодической таблицы имеют закрытые внешние оболочки электронов, которые обычно не позволяют им обмениваться электронами с другими атомами с образованием молекул. Однако в 1962 году химики открыли молекулы, содержащие ксенон, и теперь вместо этого называют эти элементы благородными газами. Но никто никогда не видел в космосе молекулу благородного газа, хотя один из таких газов — гелий — является вторым по распространенности элементом во Вселенной.
Майк Барлоу, астроном из Университетского колледжа Лондона, и его коллеги использовали космическую обсерваторию Гершеля для изучения остатков сверхновых, включая хорошо известную Крабовидную туманность. Это произошло, когда у массивной звезды в 6500 световых годах от Земли в созвездии Тельца закончилось топливо, вызвав яркий взрыв, свидетелями которого наши предки были в 1054 году.
В поисках обычных молекул
Барлоу и его коллеги хотели наблюдать за пылью Крабовидной туманности, которая излучает тепло в дальнем инфракрасном диапазоне, который регистрирует Гершель. Они также искали в спектрах Гершеля линии от обычных молекул, таких как монооксид углерода.
Ученые так и не нашли эти молекулы. Вместо этого они увидели две загадочные эмиссионные линии — одну с длиной волны 243 микрона, другую с длиной волны 486 микрон, то есть ровно в два раза длиннее. «Это было явное доказательство того, что это была простая двухатомная молекула — два атома, вращающихся друг вокруг друга», — говорит Барлоу.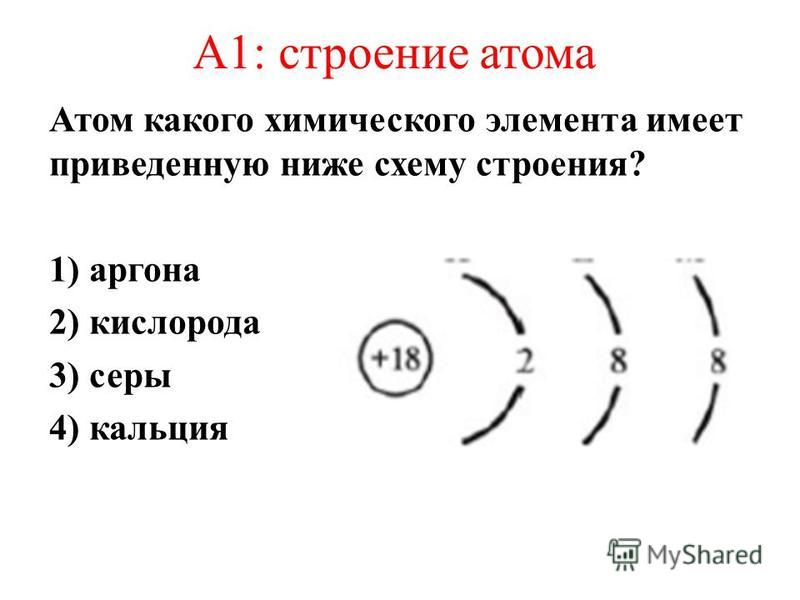 Не сумев найти совпадение с обычными двухатомными молекулами, ученые поняли, что обнаружили молекулярный ион гидрида аргона, химическая формула которого ArH + .
Не сумев найти совпадение с обычными двухатомными молекулами, ученые поняли, что обнаружили молекулярный ион гидрида аргона, химическая формула которого ArH + .
«Это очень удивило нас, — говорит Барлоу. «Никто не предсказал молекулу. Мы называем это открытие случайным, чтобы оно звучало более научно, но это была случайность — удачное открытие». Необычная молекула, вероятно, образуется, когда однократно ионизированный аргон — атом аргона с отсутствующим одним из электронов — встречается с молекулярным водородом (H 2 ) и захватывает атом водорода.
Аргон (атомный номер 18) — одиннадцатый по распространенности элемент во Вселенной и третий по распространенности газ в атмосферах Венеры, Земли и Марса. Элемент составляет 0,93% воздуха, которым мы дышим. Большая часть земного аргона представляет собой аргон-40, который образуется в результате распада радиоактивного калия-40 в горных породах.
Более легкий изотоп аргона
Мы называем это открытие случайным, чтобы оно звучало более научно, но это было случайное открытие
Майк Барлоу, Университетский колледж Лондона
Но теоретики давно предсказали, что массивные звезды должны производить большие количества более легкого изотопа аргона, аргона-36, который имеет равное количество протонов и нейтронов. Другие астрономы уже обнаружили атомы аргона в Крабовидной туманности. «Но прямых доказательств того, что это был аргон-36, не было», — говорит Барлоу, потому что атомные спектральные линии разных изотопов аргона имеют почти одинаковые длины волн, что затрудняет их различение.
Другие астрономы уже обнаружили атомы аргона в Крабовидной туманности. «Но прямых доказательств того, что это был аргон-36, не было», — говорит Барлоу, потому что атомные спектральные линии разных изотопов аргона имеют почти одинаковые длины волн, что затрудняет их различение.
Однако для молекул задача проста, потому что молекулы, содержащие разные изотопы аргона, излучают излучение с заметно разными длинами волн. Таким образом, молекулы гидрида аргона выявили изотопный состав элемента: это аргон-36, как и предсказывает теория.
Подтверждение заветных верований
«Приятно видеть, что заветные верования подтверждаются», — говорит астроном Стэн Вусли, эксперт по сверхновым из Калифорнийского университета в Санта-Круз, который не участвовал в открытии. В начале своей жизни массивная звезда сияет, превращая водород в гелий, как это делает Солнце. Затем звезда начинает сжигать гелий, превращая его в углерод и кислород, из которых в конечном итоге образуются еще более тяжелые элементы. Аргон возникает на стадии сжигания кислорода, когда одно ядро кислорода-16 сталкивается с другим, образуя серу-32. Ядро серы находится в возбужденном состоянии и обычно испускает частицу гелия-4, превращаясь в кремний-28. Частицы гелия-4 ударяются о ядра кремния-28 и серы-32, образуя аргон-36, а также кальций-40.
Аргон возникает на стадии сжигания кислорода, когда одно ядро кислорода-16 сталкивается с другим, образуя серу-32. Ядро серы находится в возбужденном состоянии и обычно испускает частицу гелия-4, превращаясь в кремний-28. Частицы гелия-4 ударяются о ядра кремния-28 и серы-32, образуя аргон-36, а также кальций-40.
Вусли говорит, что время образования аргона зависело от самой звезды, которая, по мнению астрономов, родилась в 8-16 раз массивнее Солнца. Если меньшая цифра верна, он говорит, что элемент возник в основном из сверхновой. Если вместо этого звезда родилась с большей массой, она создала большую часть своего аргона до взрыва, в течение последних нескольких месяцев своей жизни.
Массивные звезды также должны производить меньшее количество другого изотопа аргона, аргона-38. Если ученые смогут его обнаружить, они смогут сравнить его содержание с содержанием аргона-36. «Это прямая проверка теории ядерных реакций в сверхновых», — говорит Барлоу. Он надеется использовать наземные телескопы для поиска в Крабовидной туманности более тяжелого изотопа аргона, потому что космическая обсерватория Гершеля недавно прекратила наблюдения.

