Сплав железа и меди: Сплав железа и меди: область применения
alexxlab | 07.12.2022 | 0 | Разное
Сплав железа и меди: область применения
Из этого материала вы узнаете:
- Сплав железа и меди в чистом виде – редкость
- Классификация сплавов меди
- Характеристики сплавов меди
- Основные сферы применения сплавов меди
- Самые распространенные сплавы меди
Сплав железа и меди как таковой не существует. Причины – разные температуры плавления и свойства растворимости. По сути, получается нечто вроде слоеного пирога. Однако и такой результат смешивания двух металлов с успехом используется в самых разных сферах.
Большее распространение получили сплавы меди с другими металлами: алюминием, оловом, свинцом, с добавлением никеля и др. О свойствах медных сплавов, а также интересные факты о сплаве железа и меди вы узнаете из нашего материала.
Сплав железа и меди в чистом виде – редкость
Существование сплава железа и меди вполне возможно. Фазовая диаграмма с этими двумя элементами имеет следующий вид:
На ней заметно, что фазовые поля «ααFe» и «Cu» значительно сужаются к краям диаграммы. Это значит, что в одном веществе нельзя растворить большое количество другого.
Это значит, что в одном веществе нельзя растворить большое количество другого.
Растворимость железа в фазах меди и меди в фазах железа ограничена. Так, в фазе аустенита (гамма-Fe) можно растворить не более 18% меди. Для этого необходима высокая температура (около +1400 °С), которая резко должна смениться комнатной для предотвращения повторного разделения. Все, что получится в других условиях, – двухфазная смесь, которую нельзя назвать сплавом железа и меди.
Также по диаграмме заметно, что возникновение интерметаллических соединений невозможно. Если именно их вы подразумевали под сплавом, то ошибались.
Следовательно, сплав имеет эвтектоидную микроструктуру со сменяющими друг друга слоями материала, насыщенного железом и медью. Точная микроструктура и формула сплава железа и меди зависит от составных компонентов.
Лигатура медь-железо имеет формулу CuFe. Ее используют для алюминиевой бронзы и определенных латунных сплавов в роли рафинера. Также сфера применения лигатуры распространяется на повышение качества других сплавов, а именно улучшение коррозионной стойкости медно-никелевых сплавов и механических свойств низколегированных медных сплавов.
VT-metall предлагает услуги:
Есть несколько разновидностей сплавов железа и меди, в которых доля железа варьируется от 1% до 2,5%. Медные сплавы отличаются высокой прочностью, благодаря которой могут использоваться в трубках конденсаторов и электрических контактах с хорошей электропроводностью (около 65 % IAC).
Это сплавы вариации серии C19xxxx, например, C19200, C19500, C19600.
Классификация сплавов меди
Медь – это крайне значимый материал, который сопровождал человечество практически всю жизнь. Первобытные люди использовали в качестве орудий труда именно медные изделия. При этом способы обработки металла в разные времена отличались.
Раньше было принято обрабатывать медь холодным методом, о чем говорят археологические находки в пределах современной Северной Америки. Традиции по использованию меди сохранялись еще до приезда Христофора Колумба. Медную руду начали добывать около 7 тысяч лет назад, и благодаря податливости материала он быстро стал востребованным. Даже спустя столько лет медь не теряет своей актуальности.
Даже спустя столько лет медь не теряет своей актуальности.
Металл отличается красноватым цветом, который ему придает кислород. Если этот компонент полностью убрать, то оттенок станет желтым. Насыщенность цвета также зависит от валентности. Так, карбонаты меди имеют выраженный синий либо зеленый тон. Начищенная медь придаст металлу яркий блеск.
По электропроводимости медь занимает почетное второе место, уступая лишь серебру. Благодаря своим качествам ее используют в электронике. Однако важно помнить недостатки металла. Один из основных – плохое взаимодействие с кислородом. На свежем воздухе медь покрывается пленкой, связанной с процессом окисления.
Медный оксид можно получить прокаливанием гидрокарбоната меди либо нитрата на воздухе. Данное соединение способно окисляющим образом влиять на органические соединения.
Медный купорос дает растворение материала в серной кислоте. Сфера применения полученного вещества – химическая промышленность. Медный купорос используют и для профилактики вредителей на огороде.
Примеси способны по-разному воздействовать на характер медного сплава. По данному критерию выделяется три группы:
- Первая группа включает в себя соединения, создающие твердые вещества. Среди них: сурьма, цинк, железо, олово, фосфор, сурьма, никель и др.
- Во вторую группу входят соединения, имеющие низкую растворимость в меди. Из-за их наличия обработка давлением становится сложнее. Однако стоит отметить, что электропроводность остается практически неизменной. Пример таких соединений – свинец и висмут.
- В третьей группе содержатся вещества, создающие вместе с медью хрупкие соединения (кислород, сера).
Характеристики сплавов меди
Сплав меди может иметь разные характеристики, которые зависят от примесей и их количества. Например, прочность, коррозионную стойкость, низкий коэффициент трения. На практике часто используются смеси меди с магнием, цинком, марганцем и алюминием. При этом в промышленности можно найти и другие варианты сплавов.
Чтобы определить состав по Межгосударственному стандарту, необходимо использовать классификацию из специальной таблицы. Там указана маркировка меди и перечислены ее главные характеристики:
- Так, в марках М1 и М1р, М2 и М2р, М3 и М3р содержание меди одинаковое, а буква «р» означает наличие фосфора (до 0,04% от общего количества вещества) и меньшее количество кислорода (до 0,01%). В марках с обычным количеством кислорода его доля составляет от 0,05 до 0,08%.
- В марках М00 и М1 содержится как минимум 99,9% меди.
- Марка М0 состоит из меди на 99,95%.
- Для М0б содержание металла – около 99,97%.
- Вещество с обозначением М2 состоит из меди на 99,7%.
- Для марки М3 характерна доля металла, составляющая 99,5%.
- В марке М4 основное вещество занимает 99% от общего количества сплава.
- Буква «б» в составе марки означает полное отсутствие кислорода. Так, в М0б его нет, а в М0 содержится около 0,02%.

Основные характеристики сплавов с содержанием меди:
- Способность сопротивляться коррозии
- Прочность, что позволяет использовать материал в промышленных целях. Так, при высоких удельных и знакопеременных нагрузках часто применяют детали из сплава меди с железом и марганцем.
- Антифрикционность, что дает сплаву устойчивость к трению. Так, например, бронза применяется в производстве подшипников даже без использования смазки. Это происходит именно благодаря идеально гладкой поверхности. Сплав железа с медью и серебром также обладает хорошими антифрикционными свойствами.
- Теплопроводность и электропроводность.
 Эти свойства позволяют делать из медного сырья электропроводные кабели.
Эти свойства позволяют делать из медного сырья электропроводные кабели.
Медные сплавы могут использоваться в разных сферах деятельности: в самолето- и судостроении, ювелирном деле, при создании часовых механизмов и других приспособлений, в которых вероятно возникновение трения двух парных компонентов.
Если говорить о сплавах, в которых также есть железо, то на практике чаще всего применяют сплав из меди, железа и олова, сплав из меди, алюминия и железа, а также сплав из меди, цинка и железа.
Основные сферы применения сплавов меди
В производстве используется как медь в чистом виде (катодная медь), так и полуфабрикаты, сделанные на ее основе. Особенно это касается катанок, проката и других промышленных изделий. Характеристики и сфера применения зависят от доли примесей в общем продукте. В марке может содержаться от 10 до 50 добавок.
Чтобы сделать высокоточный и чистый металл, потребуется медь именно той марки, в которой нет кислорода. Для криогенной промышленности его отсутствие – важнейший критерий.
Рассмотрим их более подробно:
- М00 и М0 могут использоваться для создания высокочастотных и электропроводниковых деталей. Полученные изделия обычно создаются на заказ и считаются дорогими.
- М001ф и М001бб подойдут для изготовления электрических шин и медной проволоки с маленьким диаметром сечения.
- М1 и марки с таким же содержанием меди (М1р, М1ф, М1ре) используются в качестве проводников электрического тока. Небольшое количество олова позволяет их задействовать в производстве высококачественной бронзы. Также их часто включают в состав прутьев для сварки чугуна и электродов.
- М2, М2р и М2к – идеальный вариант для деталей, производимых в криогенной промышленности. Так как литой прокат подвергается обработке под давлением, для него тоже подойдут перечисленные марки.
- Из М3, М3р и М3к создают плоский и прессованный прокат, а также проволоку для электромеханической сварки деталей из чугуна и меди.

Самые распространенные сплавы меди
В сплавах меди и железа последнее выступает легирующим компонентом. Также таковым может выступать золото, марганец или цинк. Их доля в общем количестве составляет менее 10 %. Единственное исключение из правил – латунь. Ее концентрация может быть больше заявленной, конкретное число будет зависеть от условий применения.
Среди основных видов медных сплавов следует выделить:
- Смесь меди и железа. Для обоих металлов характерны похожие химические показатели. Основное отличие заключается в температуре плавления, поэтому сплав железа и меди имеет пористую структуру.
- Смесь с оловом. Сплав меди и олова использовали еще в давние времена. Так, в Древней Греции из смеси создавали настоящие произведения искусства, которые сейчас являются огромной ценностью для людей. Разумеется, современные характеристики сплава значительно отличаются от тех, которые существовали тысячи лет назад. Во многом это связано с улучшенными методиками производства.
 Сейчас для создания сплава применяются дуговые электропечи, а защита от окисления обеспечивается вакуумом. Закаливание смеси позволяет достичь высокого уровня пластичности и прочности.
Сейчас для создания сплава применяются дуговые электропечи, а защита от окисления обеспечивается вакуумом. Закаливание смеси позволяет достичь высокого уровня пластичности и прочности.
Рекомендуем статьи
- Сплавы железа: известные и не очень разновидности
- Сплав железа с никелем: его свойства и особенности
- Углеродистые конструкционные стали: виды и преимущества
- Алюминиевая бронза . Это смесь алюминия и меди, которая имеет коррозионную стойкость и способность к деформации. Ее используют в производстве деталей, которые планируется подвергать воздействию высокой температуры.
- Смесь меди со свинцом. Для материала характерна антифрикционность и высокая прочность, по большей части обеспечиваемая свинцом.
- Латунь. Сплав содержит два или три основных компонента.
- Нейзильбер. Так называют сплав, где содержится медь, цинк и никель, доля которого составляет 6–34 %.
 Несмотря на то, что материал дешевле мельхиора, он имеет такие же качества и внешние признаки.
Несмотря на то, что материал дешевле мельхиора, он имеет такие же качества и внешние признаки.
Сплавы из меди активно используются в автомобилестроении и производстве оборудования аграрного и химического назначения. Устойчивость к коррозии позволяет применять смеси в создании сверхпроводниковой техники.
Мягкая медь отлично подойдет для деталей, которые имеют трудновыполнимый узор. Она обладает всеми необходимыми свойствами, в первую очередь – вязкостью и пластичностью. Проволока из такого сплава будет отлично гнуться, а еще ее можно паять вместе с золотыми и серебряными поверхностями. Также смеси хорошо взаимодействуют с эмалью, при этом не расслаиваясь и не растрескиваясь.
Медь – металл, который действительно необходим в современных условиях. С ним получаются широко используемые сплавы железа и меди, алюминия и меди, олова и меди и не только. Антикоррозионные, антифрикционные и теплопроводные свойства позволяют применять смеси в производстве деталей.
Почему следует обращаться именно к нам
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.
Определение понятия сплавов. Сплавы на основе железа и меди
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
(Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Тема: Определение понятия сплавов. Сплавы на основе железа и меди.
Раздел: 9.2В Металлы и сплавыТема: Определение понятия
сплавов.
Сплавы на основе железа и меди.
НИШ ФМН г.Семей
Учитель химии: Бекжанова Г.К.
Цели обучения:
– сделать вывод о преимуществах сплавов
– знать известные издревне сплавы медь и бронзу
– знать сплавы железа: чугун и сталь, а также
процентное содержание углерода в них
Как по вашему мнению, почему
металлические объекты древности из меди
и бронзы так долго могут существовать и
внешний вид их в целом не испортился?
Ответ на
вопрос:
По причине низкой химической активности.
Работа с ассоциативной
картой
СПЛАВЫ
Возможные варианты
ответов при работе с
ассоциативной картой
СПЛАВЫ
прочность
металлы
Смеси
металлов
Чугун,
сталь
Работа в группах над
вопросом:
Сплавы в нашей
жизни
Постерная
защита
Что собой
представляют сплавы?
Металлические сплавы — кристаллические тела,
полученные при сплавлении металлов с другими
металлами или неметаллами.

Составляющие части сплава называются
компонентами.
Число компонентов может быть равно двум,
трем, четырем и более.
Работа с образцами
металлов и сплавов
Задание: изучите образцы металлов и
сплавов и ответьте на вопрос: имеются ли
существенные отличительные особенности
между сплавами и чистыми металлами по их
внешнему виду и на ощупь?
Распространенный способ
получения сплавов
При этом образуются
системы трёх типов:
• Механическая смесь
• Твердый раствор
• Химическое соединение
Растворение металлов
друг в друге в
расплавленном
состоянии
Что представляет собой
механическая смесь?
Механическую смесь образуют
металлы, которые различаются
размерами атомов (ионов) и
строением кристаллической решетки.
Каждый металл кристаллизуется
отдельно.
Например: сплав олова и свинца
(третник), у которого низкая
температура плавления.
ЧТО ЕСТЬ ТВЕРДЫЙ РАСТВОР ?
Сплавы, образованные металлами, имеющими
сходные по размерам атомы (ионы) и
одинаковые по типу кристаллические решетки,
называются твёрдыми растворами.

Например, сплав никеля и меди; сплав меди и
алюминия.
Что представляет собой
химическое
соединение?
Атомы расплавленных металлов могут образовывать
друг с другом или с атомами неметаллов, входящих в
состав сплава, химические соединения.
Например, известны такие химические соединения как
магний с кремнием Mg2Si, железа с углеродом Fe3C.
Состав соединений. Образующихся между атомами
металлов, изменяется и не соответствует известным
правилам валентности элементов.
Описание зависимости свойств
сплавов от структуры
Многие физические и механические свойства сплавов четко
зависят от структуры, однако некоторые технологические
свойства, такие, как литейные (т. е. способность обеспечить
хорошее качество отливки) или свариваемость, зависят не
столько от структуры, сколько от того, в каких температурных
условиях проходило затвердевание сплавов.
Так, например, стоматологические сплавы золота, отлитые в
форму и быстро охлажденные в воде, будут иметь вид твердого
раствора, отличающегося характерной мягкостью, ковкостью и
меньшей прочностью, чем сплавы с упорядоченным
расположением атомов
Виды кристаллических решеток
сплавов
Кристаллическая решетка сплава может быть:
1) либо обычно очень сложной, составленной молекулами самого химического
соединения; схематическая картина такой решетки представлена на рис.
 1;
1;здесь атомы разных компонентов представлены белыми и черными кружками;
такую решетку называют молекулярной;
2) либо составленной из атомов отдельных компонентов, занимающих
определенные места в решетке и представленных в определенных
количественных отношениях; схема такой решетки (соединение NiAl)
показана на рис.2.
Рис.1 Схема
молекулярной
кристаллической
решетки сплавов
Рис.2 Схема
атомной
кристаллической
решетки
Отличаются ли физические свойства металлов
в сплавах от тех, когда они находятся в
независимом состоянии?
Перечислите «ПЛЮСЫ»
сплавов и «МИНУСЫ» на
примере некоторых
металлов.
Типичные физические свойства чистого металла в
сплаве изменяются. В большинстве случаев свойства
чистого металла не соответствуют необходимым
практическим требованиям.
«МИНУСЫ» некоторых металлов:
• Al – металл с низкой прочностью
и поэтому не выдерживает
сильного нагревания,
возникающего при трении;
• Au – в чистом виде мягкий,
ломкий металл.
 Изделия из него
Изделия из негопластичны;
• Fe – на воздухе ржавеет и не
обладает необходимой
твердостью.
«ПЛЮСЫ» сплавов:
• Твёрдость металла в сплаве
повышается;
• Температура металлов в сплаве
понижается, что дает возможность
получать легкоплавкие соединения,
например при пайке деталей;
• Улучшается прочность металлов в
сплаве;
• Улучшается пластичность металлов
в сплаве.
В сплавах металлы приобретают
необходимые качества
По назначению сплавы
бывают
конструкционные
инструментальные
специальные
В промышленности также используются жаропрочные,
легкоплавкие и коррозионностойкие сплавы, термоэлектрические и
магнитные материалы, а также аморфные сплавы.
Конструкционные сплавы:
• сталь
• чугун
• дюралюминий
Конструкционные со специальными свойствами
(например, искробезопасность, антифрикционные
свойства):
• бронза
• латунь
Для измерительной и электронагревательной
аппаратуры:
манганин
нихром
Для заливки подшипников:
баббит
Важнейшие
промышленные
сплавы:
сплавы меди — бронза и латунь
сплавы алюминия – дуралюмин, силумин
сплавы железа – чугун и сталь
Сплавы меди
БРОНЗА – это смесь
меди и олова
ЛАТУНЬ – это смесь
меди и цинка
Как правило в любой
бронзе в
незначительных
количествах
присутствуют добавки:
цинк, свинец, фосфор
и др.

Латунь с содержанием
от 5 до 20% цинка
называется красной
(томпаком), а с
содержанием 20-36%
Zn – желтой (альфалатунью).
Из истории изготовления бронзы
Еще очень давно человек стал задумываться, как сделать инструменты из меди
более прочными. Чтобы добиться этого, человек начал соединять медь с разными
другими металлами. Чаще люди экспериментировали, смешивая медь с оловом,
вследствие чего получилась бронза – один из наидревнейших сплавов, когда либо сделанных человеком.
Таким образом, бронза стала известной для человека давно. В разных частях мира
её плавили по-своему. Так, в Западной Африке в бронзовых изделиях ученые
нашли 40% олова. В то время в Средней Азии количество олова в изделиях очень
редко превышало 20%.
Интересно, что народы Южной и Центральной Америки почти не знали бронзы.
Больше всего они пользовались золотом и серебром.
В наше время к бронзе добавляют чуть – чуть свинца и цинка. При этих добавках
она становится более текучей и мягкой.
 Из этого сплава можно изготовлять
Из этого сплава можно изготовлятьразличные предметы, например: скульптуры, медали, и даже корабельные винты.
Современные изделия из бронзы
и латуни
Современный смеситель для
ванной, материал:
бронза/медь
Кухонная мойка из
бронзы
Латунь в
электротехнике
Сплавы железа
СТАЛЬ
Сплавы железа с углеродом,
содержащие его до 2%,
называются сталями. В
состав легированных сталей
входят и другие элементы хром, ванадий, никель.
ЧУГУН
Чугуном называется
сплав железа с 2-4%
углерода. Важным
компонентом чугуна
является также
кремний.
Из чугуна можно отливать самые разнообразные и очень
полезные изделия, например крышки для люков,
трубопроводную арматуру, блоки цилиндров двигателей. В
правильно выполненных отливках достигаются хорошие
механические свойства материала.
Изделия из чугуна и стали
Посуда из
чугуна
Чугунные и
стальные отливки
Радиатор чугунный
отопительный
Домашнее задание: составьте
кроссворд по изученному
материалу, т.
 е. Сплавы. История
е. Сплавы. Историясплавов. Виды сплавов.
Структура сплавов. Получение
сплавов. Применение сплавов.
Преимущества сплавов. Изделия
из сплавов.
Оцени свою работу!
-Старался! Всё получилось!
– Старался,но ошибался в
некоторых заданиях!
Ничего не получилось, но я буду
стараться и работать дальше над
своими проблемами!
Общая рефлексия по
всему уроку
Урок был
скучным и
неинтересным!
Мне всё понятно,
урок прошёл
интересно,мне
понравилось!
Я ничего не
понял, ждал
скорейшего
окончания
урока!
Использованные
источники
1.А.П. Гаршин Общая и неорганическая химия в
схемах, рисунках, таблицах. М., 2011.
2.И.Нугуманов, Р.Жумадилова, Ж.Кембебаева
Химия, 9 класс. Алматы, 2009.
English Русский Правила
Десульфурация сплава Cu–Fe, полученного из медного шлака, и влияние на форму меди в материалах сплава
(Базель). 2022 авг.; 15 (15): 5110.
Опубликовано онлайн 2022 22 июля.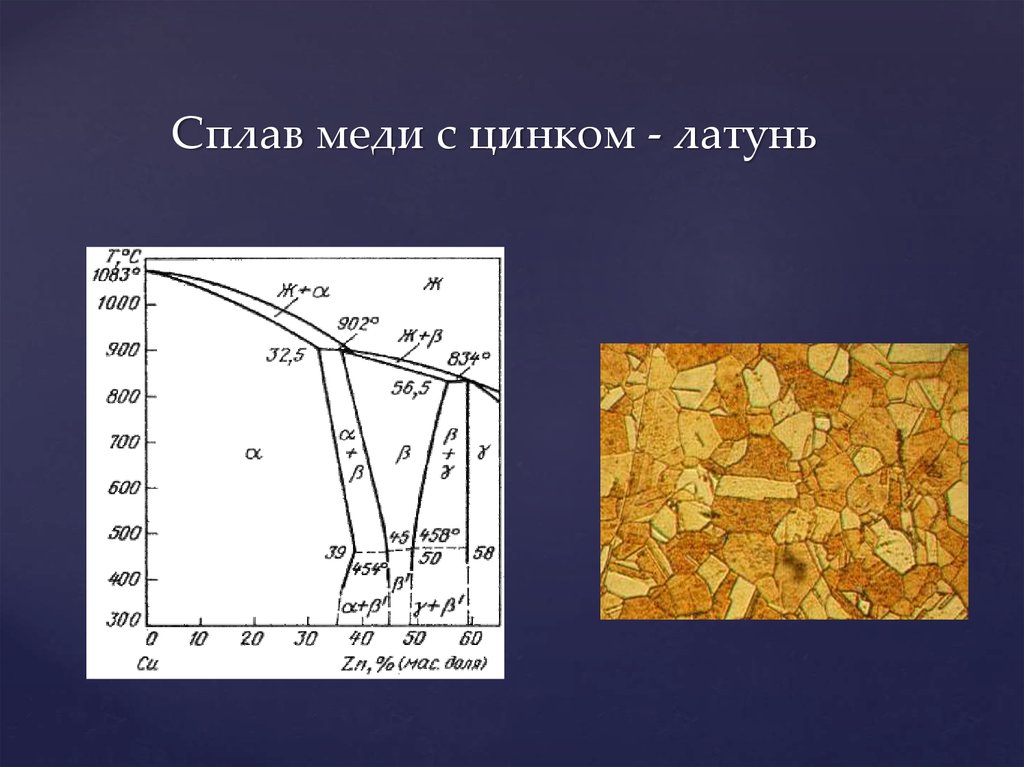 DOI: 10.3390/MA15155110
DOI: 10.3390/MA15155110
, 1 , 1, * и 2
Ricardo Jelres, Academeman Editor, Norman Toro, Toro, Toro, Toro, Toro, Toro, Toro, Toro, Toro, Toro, Toro. Редактор и Эдельмира Гальвес, академический редактор
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности
Для реализации высокоэффективного использования медного шлака предлагается способ получения сплава Cu-Fe путем восстановления медного шлака. Сера в сплаве существует в виде штейновых включений, что отличается от серы в расплавленном чугуне. Реакция CaO с Cu 2 S затруднена. Необходимо добавить восстановитель для ускорения десульфурации. Чтобы избежать введения других элементов, добавки Fe–Mn и CaC 2 использовали в качестве десульфураторов для десульфурации сплава Cu–Fe. Рассчитана термодинамика реакции десульфурации и изучен экспериментальный процесс. Установлено, что свободная энергия Гиббса реакций сероочистки для Fe–Mn отрицательна, а CaC 2 может снизить содержание серы в сплаве до 0,0013% и 0,0079% соответственно. Процесс десульфурации повлиял на форму меди в сплаве. Часть меди в этом сплаве существует в виде наномедных сфер, и обнаружено, что размер сфер увеличивается после десульфурации. Восстановители могут облегчить процесс десульфурации стабильных сульфидов.
Процесс десульфурации повлиял на форму меди в сплаве. Часть меди в этом сплаве существует в виде наномедных сфер, и обнаружено, что размер сфер увеличивается после десульфурации. Восстановители могут облегчить процесс десульфурации стабильных сульфидов.
Ключевые слова: десульфурация, медный шлак, Cu–Fe, Fe–Mn, CaC 2 , наномедные сферы
Эмпирический опыт показал, что из 1 тонны меди образуется примерно 2–3 тонны медеплавильного шлака [1,2]. Мировое производство медных шлаков составляет 30 млн т [1,2]. Такое большое количество медного шлака оказывает огромное давление на окружающую среду, ресурсы и энергию.
Медный шлак является ценным вторичным ресурсом и содержит около 40 % железа и 0,3–5 % меди [3,4,5,6]. В настоящее время основным методом утилизации медных шлаков является извлечение меди флотацией, извлечение железа восстановлением или магнитной сепарацией, а затем подготовка строительных материалов [7,8,9].,10]. Эрденебольд и др. исследовали восстановление железа из медных шлаков [11,12,13]. Бусолик и др. получен сплав Cu–Fe из медного шлака с целью снижения содержания меди и получения железа [14]. Хео и др. восстановленное железо из шлака, извлечение Fe составило около 90 мас.% [15]. Чжан и др. изучали восстановление оксидной системы железа и меди водородом, не проводя исследований извлечения металлов [16]. Немногие исследователи сосредотачиваются как на извлечении меди, так и на извлечении железа.
исследовали восстановление железа из медных шлаков [11,12,13]. Бусолик и др. получен сплав Cu–Fe из медного шлака с целью снижения содержания меди и получения железа [14]. Хео и др. восстановленное железо из шлака, извлечение Fe составило около 90 мас.% [15]. Чжан и др. изучали восстановление оксидной системы железа и меди водородом, не проводя исследований извлечения металлов [16]. Немногие исследователи сосредотачиваются как на извлечении меди, так и на извлечении железа.
Медь неизбежно примешивается к железу, извлеченному путем восстановления, и медь в железе вызывает горячую хрупкость в процессе термообработки. Разделение меди и железа затруднено, что вносит большие трудности в последующую переработку. Наша исследовательская группа предложила новый способ получения сплава Cu–Fe путем восстановления медного шлака [1,2]. Медь и железо могут быть использованы в качестве сырья для получения медьсодержащей стали или медьсодержащего чугуна, а медь и железо в шлаках используются комплексно [17,18]. В процессе плавки меди медный шлак образуется в процессе приготовления штейна. Поэтому основной формой меди в шлаке является смешанный штейн, а основной формой – Cu 2 С [18]. Для применения сплава Cu–Fe необходимо изучить процесс десульфурации.
В процессе плавки меди медный шлак образуется в процессе приготовления штейна. Поэтому основной формой меди в шлаке является смешанный штейн, а основной формой – Cu 2 С [18]. Для применения сплава Cu–Fe необходимо изучить процесс десульфурации.
В настоящее время десульфураторы расплавленного железа в основном включают десульфураторы кальция, такие как CaO, CaC 2 и CaCO 3 , и десульфураторы металлов, такие как Mg, Al и Mn. Фрейзмут использовал CaC 2 для десульфурации чугуна, показав хороший эффект десульфурации [19]. Вайнман и др. изучали высокопрочную низкоуглеродистую ферритную сталь на основе Cu–Fe–Mn [20]. S в сплаве Cu–Fe, полученном из медного шлака, в основном существует в форме Cu 2 S, который более стабилен и имеет более низкую свободную энергию Гиббса, чем FeS. Сера в расплавленном чугуне может образовывать сульфид кальция, регулируя щелочность шлака или добавляя оксид кальция. Однако Cu 2 S трудно реагирует с CaO. Согласно результатам расчетов термодинамики, свободная энергия Гиббса реакции между Cu 2 S и CaO больше нуля.
Согласно результатам расчетов термодинамики, свободная энергия Гиббса реакции между Cu 2 S и CaO больше нуля.
Восстановительные условия могут способствовать реакции десульфурации. Металлические восстановители при десульфурации вводят другие элементы, что влияет на утилизацию сплава Cu-Fe. Сплав Cu–Fe может быть использован для получения медьсодержащей антибактериальной нержавеющей стали или медьсодержащего высокохромистого износостойкого чугуна. Требуется определенное содержание марганца. САС 2 может разлагаться на пары кальция и углерод при высокой температуре. Марганец и кальций, как восстановители, могут ускорить процесс десульфурации.
В зависимости от различных компонентов целевого продукта десульфуризатор металлов может получать соответствующие продукты из сплавов в процессе десульфурации. После тщательного изучения литературы мы не нашли подобных исследований с использованием сплава Fe–Mn или CaC 2 в качестве реагентов для десульфурации сплава Cu–Fe.
2.1. Материалы
Сплав Cu-Fe и шлак, используемые в этом эксперименте, были получены путем восстановления медного шлака, и их химический состав показан на рис. Микрофотография СЭМ и результаты ЭДС сплава Cu-Fe, использованного в эксперименте, показаны в [21,22]. В электронном микроскопе видно, что основной матрицей металла является сплав на основе меди и железа, который существует в виде перлита. Содержание серы в металле высокое, составляет 1,32 % и существует в виде FeS и Cu 9 .0021 2 S. В серо-белая область – область накопления Cu (4), серая область – включение FeS и Cu 2 S (2), серо-черная область – область накопления FeS (3). Агентами десульфурации являются Fe–65 мас.% Mn (от производителя Anyang) и CaC 2 (от производителя Tianjin).
Открыть в отдельном окне
Электронный микроскоп из сплава Cu–Fe.
Таблица 1
Состав сплава Cu–Fe и шлака после восстановления (мас.%).
| Composition | Fe | Cu | C | S | CaO | Al 2 O 3 | SiO 2 |
|---|---|---|---|---|---|---|---|
| Cu–Fe alloy | 88. 10 10 | 8.02 | 1.69 | 1.23 | – | – | – |
| Slag after reduced | 3.29 | – | – | 0.22 | 38,55 | 4,73 | 45,65 |
Открыть в отдельном окне
2.
 2. Экспериментальные процедуры
2. Экспериментальные процедуры Эксперимент по десульфурации проводили в печи сопротивления. Схематическая диаграмма показана на . Реакцию проводили в тигле из глинозема. Верхняя часть глиноземного тигля была покрыта графитовой втулкой, чтобы предотвратить повышение уровня жидкости и ее перелив, что создавало угрозу безопасности. Всего в глиноземный тигель было добавлено 40 г сплава Cu–Fe, 34 г хвостов и 15 г CaO. Только CaO затруднял удаление серы из сплава Cu–Fe. Свободная энергия Гиббса реакции десульфурации CaO показана на рис. CaO может реагировать с FeS, но трудно реагирует с Cu 2 S. Оксид кальция использовался для регулировки щелочности, чтобы она была выше 2,0, что полезно для десульфурации. В качестве десульфураторов добавляли соответствующие количества ферромарганца и оксида кальция. Заданная температура составляла 1698 К. После повышения температуры до 1698 К температуру поддерживали в течение 2 ч, а затем охлаждали до комнатной температуры с помощью печи. Весь процесс был защищен газом аргоном.
Весь процесс был защищен газом аргоном.
Открыть в отдельном окне
Свободная энергия Гиббса реакции сероочистки CaO.
2.3. Методы характеризации
Составы образцов сплавов определяли с помощью атомно-эмиссионной спектрометрии с индуктивно-связанной плазмой (Prodigy, Optima 4300 DV, Lehman, NY, USA). Состав образцов шлака и хвостов определяли с помощью атомно-абсорбционного спектрофотометра (SU-Z2700, Токио, Япония). Хвост представляет собой шлак после сероочистки. Содержание C и S в образцах шлака и металла определяли с помощью анализатора серы (G4 ICARUS, Bruker Ltd., Карлсруэ, Германия). Микроструктуру образцов сплава определяли с помощью СЭМ (SU-8010, Hitachi, Токио, Япония), ускоряющее напряжение и ток пучка которых составляли 20 кВ и 20 мкА соответственно. Термодинамические расчеты проводились с использованием FactSage (FactSage 7.5, Thermfact/CRCT и GTTTechnologies, Монреаль и Аахен, Канада и Германия) с базами данных чистых веществ (FactPS), оксидов (FToxid), сплавов и сульфидов (FTmisc) [1,23]. .
.
3.1. Десульфурация Fe–65 мас.% Mn
Часть Mn окислится, а часть перейдет в металл. В избытке добавляли Fe–Mn в качестве десульфуратора. Соотношение опытного сырья следующее: сплав Cu–Fe 40 г, хвост 34 г, CaO 15 г, Fe 7,2 г–65 мас.% Mn (атомное отношение Mn к S равно 5). Полученные результаты химического анализа сплава и хвоста после сероочистки представлены на рис. Содержание S уменьшилось с 1,23 мас.% до 0,24 мас.%; степень десульфурации составила 80,49%. Сплав Fe–Mn обладал хорошей десульфурирующей способностью. показан микроскопический анализ сплава после десульфурации с помощью СЭМ. Видно, что основная матрица сплава представляет собой богатую железом фазу, а медные шарики объединяются в богатую медью фазу.
Открыть в отдельном окне
Электронный микроскоп сплава Cu–Fe после десульфурации Fe–Mn.
Таблица 2
Состав сплава Cu–Fe и хвостов после десульфурации Fe–Mn (мас.%).
| Composition | Mn | Cu | S | CaO | Al 2 O 3 | SiO 2 |
|---|---|---|---|---|---|---|
| Cu–Fe alloy | 1. 46 46 | 9.51 | 0.24 | – | – | – |
| Tailings | 7.84 | – | 0.90 | 55.10 | 3.14 | 30.43 |
Открыть в отдельном окне
Растворимость меди в железе относительно высока, при понижении температуры растворимость меди постепенно снижается. В сплавах Cu–Fe наблюдается жидкость с метастабильным состоянием. В зависимости от состава сплава две жидкие фазы разделяются при переохлаждении расплава ниже определенной температуры. После десульфурации фазы Fe и фазы Cu все еще существуют, а фаза Cu 2 S и фаза FeS исчезают. В богатой медью фазе видно, что присутствует определенная фаза MnS. MnS имеет более низкую свободную энергию Гиббса и более стабилен, чем Cu 9.0021 2 S и FeS. Таким образом, предполагается, что реакция десульфурации Fe-Mn медьсодержащего чугуна при 1698 K (1425 °C) может быть описана следующим уравнением: 1)
В сплавах Cu–Fe наблюдается жидкость с метастабильным состоянием. В зависимости от состава сплава две жидкие фазы разделяются при переохлаждении расплава ниже определенной температуры. После десульфурации фазы Fe и фазы Cu все еще существуют, а фаза Cu 2 S и фаза FeS исчезают. В богатой медью фазе видно, что присутствует определенная фаза MnS. MnS имеет более низкую свободную энергию Гиббса и более стабилен, чем Cu 9.0021 2 S и FeS. Таким образом, предполагается, что реакция десульфурации Fe-Mn медьсодержащего чугуна при 1698 K (1425 °C) может быть описана следующим уравнением: 1)
Mn + FeS = MnS + Fe
(2)
показывает свободную энергию Гиббса реакции десульфурации Mn с Cu 2 S и FeS. Значение свободной энергии Гиббса отрицательно. В этом эксперименте S реагировал с Mn с образованием MnS, большая часть которого перешла в шлаковую фазу, а часть была захвачена матрицей. Возможная причина этого заключается в том, что небольшого количества Fe-Mn недостаточно для реакции со всей серой, присутствующей в чугуне. При низком содержании ферромарганца недостаточно эффекта сероочистки; поэтому мы увеличили количество Fe-Mn до 30 г, из которых содержание S было снижено до 0,0013%, демонстрируя высокую десульфурирующую способность.
При низком содержании ферромарганца недостаточно эффекта сероочистки; поэтому мы увеличили количество Fe-Mn до 30 г, из которых содержание S было снижено до 0,0013%, демонстрируя высокую десульфурирующую способность.
Открыть в отдельном окне
Свободная энергия Гиббса реакции десульфурации Mn.
3.2. Десульфурация CaC
2 Соотношение экспериментального сырья следующее: 40 г сплава Cu–Fe, 34 г хвостов, 15 г CaO и 10 г CaC 2 (атомное отношение Ca к S равно 8). ). Результаты химического анализа десульфурированного Cu–Fe и хвостов показаны на рис. Можно видеть, что содержание серы упало до 0,0079%, что указывает на хорошие характеристики десульфурации CaC 9.0021 2 . Десульфурация CaC 2 в расплавленном чугуне также изучалась предыдущими исследователями [24,25]. Они обнаружили, что по мере протекания реакции десульфурации вокруг CaC 2 образовался слой CaS толщиной около 120 мкм, а между слоем CaS и оставшимися частицами CaC 2 был обнаружен тонкий графитовый слой. Они считали, что в высокотемпературных условиях CaC 2 разлагается на пары кальция и слой графита. Пары кальция вступают в реакцию с серой в расплавленном чугуне с образованием слоя CaS и графита. Слой графита и слой CaS постепенно утолщаются и образуют барьер, уменьшающий диффузию паров кальция и ход реакции десульфурации. В процессе кинетических исследований была изучена реакция десульфурации CaC 2 контролировалась диффузией, а уменьшение размера частиц карбида кальция способствовало реакции десульфурации [25]. Уравнение реакции CAC 2 Декомпозиция является следующим:
Они считали, что в высокотемпературных условиях CaC 2 разлагается на пары кальция и слой графита. Пары кальция вступают в реакцию с серой в расплавленном чугуне с образованием слоя CaS и графита. Слой графита и слой CaS постепенно утолщаются и образуют барьер, уменьшающий диффузию паров кальция и ход реакции десульфурации. В процессе кинетических исследований была изучена реакция десульфурации CaC 2 контролировалась диффузией, а уменьшение размера частиц карбида кальция способствовало реакции десульфурации [25]. Уравнение реакции CAC 2 Декомпозиция является следующим:
CAC 2 = CA + 2C
(3)
∆G = ∆G θ + RTLN (стр CA /P θ + RTLN (стр CA /P θ + )
(4)
Таблица 3
Состав сплава Cu–Fe и хвостов после десульфурации CaC 2 (мас.%).
| Composition | Cu | S | Ca | Al 2 O 3 | SiO 2 |
|---|---|---|---|---|---|
| Cu–Fe alloy | 7. 85 85 | 0.0079 | – | – | – |
| Tailings | – | 0.95 | 43.87 | 2.67 | 25.87 |
Open in a separate window
При разных температурах пары кальция имеют разное парциальное давление. По мере протекания реакции парциальное давление паров кальция снижается, и реакция продолжается в направлении образования паров кальция, что способствует разложению CaC 2 .
Уравнение реакции десульфурации CaC 2 следующее: + 2С
(6)
Ca + Cu 2 S = CaS + 2Cu
(7)
Ca + FeS = CaS + Fe
(8)
Свободная энергия реакции десульфурации Ca1C002 2 показан в . CaC 2 и Ca могут реагировать с FeS и Cu 2 S. Cu 2 S было относительно трудно восстановить. СЭМ-микроструктура сплава Cu–Fe после десульфурации CaC 2 показана на рис. Металлическая матрица представляет собой богатую железом фазу, которая существует в виде перлита. Большое количество богатой медью фазы примешивается к металлической матрице, а серосодержащая фаза исчезает.
Открыть в отдельном окне
Свободная энергия Гиббса реакции десульфурации CaC 2 .
Открыть в отдельном окне
Электронный микроскоп сплава Cu–Fe после десульфурации CaC 2. .
3.3. Влияние десульфурации на существующую форму меди в сплаве
Кроме того, в ходе экспериментов в металле были обнаружены наномедные сферы. Наномедные сферы диспергированы в перлите и на стенках из феррита и цементита, что является типичным изображением для наноразмерных сферических частиц. Результаты показаны в . Проведен ЭДС-анализ сплава Cu–Fe. Основным компонентом белой сферической формы была медь. Поскольку сплав представлял собой матрицу, богатую железом, результаты точечного сканирования показывают, что в сплаве также было железо. До десульфурации диаметр наномедных сфер был небольшим, менее 100 нм. После десульфурации по-прежнему оставалось большое количество наномедных сфер, распределенных в перлите, но диаметр увеличивался до 200–800 нм и более по стенке цементита. Из-за разных температур плавления меди и железа железо сначала затвердевает в процессе охлаждения. Когда жидкая медь достигает равновесия на поверхности твердого железа, соотношение между краевым углом смачивания и межфазным натяжением соответствует уравнению Юнга.
Наномедные сферы диспергированы в перлите и на стенках из феррита и цементита, что является типичным изображением для наноразмерных сферических частиц. Результаты показаны в . Проведен ЭДС-анализ сплава Cu–Fe. Основным компонентом белой сферической формы была медь. Поскольку сплав представлял собой матрицу, богатую железом, результаты точечного сканирования показывают, что в сплаве также было железо. До десульфурации диаметр наномедных сфер был небольшим, менее 100 нм. После десульфурации по-прежнему оставалось большое количество наномедных сфер, распределенных в перлите, но диаметр увеличивался до 200–800 нм и более по стенке цементита. Из-за разных температур плавления меди и железа железо сначала затвердевает в процессе охлаждения. Когда жидкая медь достигает равновесия на поверхности твердого железа, соотношение между краевым углом смачивания и межфазным натяжением соответствует уравнению Юнга.
Открыть в отдельном окне
Открыть в отдельном окне
Наномедные сферы в Cu-Fe ( a ) до десульфурации, ( b ) после десульфурации Fe-Mn и ( c ) после десульфурации CaC 2 .
Перепецко и др. сообщают, что когда содержание Fe в сплавах Fe–Cu превышает 65 мас. %, эти сплавы и другие фазы не могут достичь условий смачивания критической точки [26]. Салье и Феллеркнипмайер и соавт. измерил коэффициент диффузии Cu в Fe в интервале температур 963–1323 К [27]. Если при охлаждении образуется наномедь, сферы Cu будут расти, но жидкая Cu не может смачивать поверхность фазы, богатой железом, из-за твердой диффузии; капли Cu сжимаются и собираются в сферы на поверхности фазы Fe. Чжан и др. изучали влияние содержания S на контактный угол жидкого шлака и металла [28]. Сера в металле снижает поверхностное натяжение расплавленного железа и увеличивает контактный угол, тем самым влияя на диаметр жидкой меди. Следовательно, уменьшение содержания серы будет способствовать увеличению диаметра наномедных сфер. Наносферы создают препятствия для движения дислокаций, а размер наномеди будет влиять на свойства сплава Cu-Fe.
Исследован процесс десульфурации сплава Cu–Fe, полученного восстановлением медного шлака. Выводы следующие:
Выводы следующие:
(1)
Сера существует в виде Cu 2 S и FeS в сплаве Cu–Fe, а CaO с трудом реагирует с Cu 2 S. Согласно В результате термодинамического расчета значения свободной энергии Гиббса реакции Mn и CaC 2 с Cu 2 S являются отрицательными, и реакция десульфурации может быть проведена.
(2)
Добавление Fe–Mn и CaC 2 может удалить серу из сплава Cu–Fe. Когда добавление Fe-Mn сделало атомное отношение Mn к S 5, содержание S уменьшилось до 0,24%. Когда атомное отношение Mn к S составляло 20,8, содержание S уменьшалось до 0,0013%. Когда атомное отношение Ca к S составляло 8, содержание S уменьшалось до 0,0079%.
(3)
Реакция десульфурации повлияла на форму меди в сплаве Cu-Fe. Наноразмерные медные сферы существовали в сплаве Cu–Fe до и после десульфурации, а диаметр сфер после десульфурации становился больше. Возможная причина этого заключалась в том, что жидкая медь не могла смачивать поверхность фазы, богатой железом, а жидкая медь сжималась и агрегировала в сферическую форму вдоль поверхности фазы, богатой железом.
 По мере уменьшения содержания S краевой угол уменьшался, а размер наномедных сфер увеличивался.
По мере уменьшения содержания S краевой угол уменьшался, а размер наномедных сфер увеличивался.
Это исследование было профинансировано Национальной ключевой программой исследований и разработок Китая, грант № 2020YFC1908803, грантом Национального фонда естественных наук Китая № 52004284, Фондом фундаментальных исследований Центрального университета Министерства образования Китая, грантом № 2020QN55. .
Концептуализация, Б.З., П.Ф. и Т.З.; Формальный анализ, Б.З.; Приобретение финансирования, Б.З.; Расследование, Б.З.; Ресурсы, П.Ф. и Т.З.; Написание — первоначальный вариант, Б.З.; Написание – обзор и редактирование, Б.З. Все авторы прочитали и согласились с опубликованной версией рукописи.
Мы заявляем, что у нас нет коммерческих или ассоциативных интересов, которые представляют собой конфликт интересов в связи с представленной работой.
Примечание издателя: MDPI сохраняет нейтралитет в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
1. Чжан Б., Чжан Т., Доу З. Термодинамическая и экспериментальная оценка извлечения меди, железа, цинка и свинца из медного шлака. Минералы. 2022;12:496. дои: 10,3390/мин12050496. [CrossRef] [Google Scholar]
2. Чжан Б., Чжан Т., Чжан Д. Кинетика восстановления медного шлака H 2 . Минералы. 2022;12:548. doi: 10,3390/мин12050548. [CrossRef] [Google Scholar]
3. Yin Z., Sun W., Hu Y., Zhang C., Guan Q., Wu K. Оценка возможности извлечения меди из хвостов флотацией в лабораторных условиях, ввод в эксплуатацию и промышленные испытания. Дж. Чистый. Произв. 2018; 171:1039–1048. doi: 10.1016/j.jclepro.2017.10.020. [Перекрестная ссылка] [Академия Google]
4. Guo Z., Zhu D., Pan J., Wu T., Zhang F. Улучшение процесса обогащения меди и железа из медного шлака путем модификации расплавленного медного шлака. Металлы. 2016;6:86. doi: 10.3390/met6040086. [CrossRef] [Google Scholar]
5. Лонг Т., Паласиос Дж., Санчес М. Извлечение молибдена из медного шлака. Тецу Хагане-Дж. Железо Сталь инст. Япония. 2012; 98:48–54. doi: 10.2355/tetsutohagane.98.48. [CrossRef] [Google Scholar]
Тецу Хагане-Дж. Железо Сталь инст. Япония. 2012; 98:48–54. doi: 10.2355/tetsutohagane.98.48. [CrossRef] [Google Scholar]
6. Банда В., Морган Н., Экстин Дж. Роль модификаторов шлака в селективном извлечении кобальта и меди из отвального металлургического шлака. Шахтер. англ. 2002;15:899–907. doi: 10.1016/S0892-6875(02)00090-0. [CrossRef] [Google Scholar]
7. Эдвин Р., Шеппер М., Грюярт Э., Де Белье Н. Влияние вторичного медного шлака как вяжущего материала в строительном растворе со сверхвысокими характеристиками. Констр. Строить. Матер. 2016; 119:31–44. doi: 10.1016/j.conbuildmat.2016.05.007. [CrossRef] [Google Scholar]
8. Гюров С., Костова Ю., Кличева Г., Ильинкина А. Термическое разложение пирометаллургических медных шлаков окислением в синтетическом воздухе. Уотер Манаг. Рез. 2011;29: 157–164. doi: 10.1177/0734242X10379495. [PubMed] [CrossRef] [Google Scholar]
9. Cardona N., Coursol P., Vargas J., Parra R. Физическая химия медеплавильных шлаков и потери меди на плавильном заводе пайпоте. Часть 2. Характеристика промышленных шлаков. . Можно. Металл. Q. 2011; 50: 330–340. doi: 10.1179/000844311X13112418194806. [CrossRef] [Google Scholar]
Часть 2. Характеристика промышленных шлаков. . Можно. Металл. Q. 2011; 50: 330–340. doi: 10.1179/000844311X13112418194806. [CrossRef] [Google Scholar]
10. Сухомлинов Д., Авармаа К., Виртанен О., Таскинен П., Йокилааксо А. Медно-шлаковые равновесия отдельных микроэлементов при выплавке черной меди. Часть II. распределения микроэлементов. Шахтер. Обработка доп. Металл. 2020; 41:171–177. дои: 10.1080/08827508.2019.1634561. [CrossRef] [Google Scholar]
11. Erdenebold U., Choi H., Wang J. Восстановление чугуна из медеплавильного шлака восстановительной плавкой. Арка Металл. Матер. 2018;63:1793–1798. [Google Scholar]
12. Erdenebold U., Wang J. Химический и минералогический анализ реформированного шлака при извлечении железа из медного шлака в восстановительной плавке. Арка Металл. Матер. 2021; 66: 809–818. [Google Scholar]
13. Wang J., Erdenebold U. Исследование восстановления медеплавильного шлака углеродом для переработки в металлы и цементное сырье. Устойчивость. 2020;12:1421. дои: 10.3390/su12041421. [CrossRef] [Google Scholar]
2020;12:1421. дои: 10.3390/su12041421. [CrossRef] [Google Scholar]
14. Гаргуль К., Борышко Б., Буковска А. Гидрометаллургическое извлечение свинца из шлаков взвешенной плавки меди непосредственно в черновую. Арка Гражданский мех. англ. 2017;17:905–911. doi: 10.1016/j.acme.2017.04.004. [CrossRef] [Google Scholar]
15. Хео Дж. Х., Ким Б. С., Пак Дж. Х. Влияние добавки СаО на извлечение железа из медеплавильных шлаков твердым углеродом. Металл. Матер. Транс. Б. 2013; 44:1352–1363. doi: 10.1007/s11663-013-9908-7. [Перекрестная ссылка] [Академия Google]
16. Zhang H.P., Li B., Wei Y.G., Wang H., Yang Y.D., Mclean A. Кинетика неизотермического восстановления в системе Fe-Cu-O с использованием h3. ДЖОМ. 2019;71:1813–1821. doi: 10.1007/s11837-019-03402-1. [CrossRef] [Google Scholar]
17. Чжан Б., Ню Л., Чжан Т., Ли З., Чжан Д., Чжэн С. Альтернативное восстановление медного штейна в процессе восстановления медного шлака. ISIJ Междунар. 2017; 57: 775–781. doi: 10. 2355/isijinternational.ISIJINT-2016-631. [CrossRef] [Google Scholar]
2355/isijinternational.ISIJINT-2016-631. [CrossRef] [Google Scholar]
18. Чжан Б., Чжан Т., Ню Л., Лю Н., Доу З., Ли З. Умеренное разбавление медного шлака природным газом. ДЖОМ. 2018;70:47–52. doi: 10.1007/s11837-017-2670-6. [Перекрестная ссылка] [Академия Google]
19. Фрейзмут А. Применение карбида кальция в черной металлургии. Металлург. 1997; 41: 56–60. doi: 10.1007/BF02764762. [CrossRef] [Google Scholar]
20. Вайнман С., Исхейм Д., Колли Р.П., Бхат С.П., Сейдман Д.Н., Файн М.Э. Высокопрочная низкоуглеродистая ферритная сталь, содержащая выделения Cu–Fe–Ni–Al–Mn. Металл. Матер. Транс. А. 2008; 39: 363–373. doi: 10.1007/s11661-007-9417-x. [CrossRef] [Google Scholar]
21. Enneffati M., Rasheed M., Louati B., Guidara K., Barille R. Морфология, УФ-видимое и эллипсометрические исследования ортованадата натрия и лития. Опц. Квант. Электрон. 2019;51:1–19. doi: 10.1007/s11082-019-2015-5. [CrossRef] [Google Scholar]
22. Enneffati M., Louati B., Guidara K. , Rasheed M., Barille R. Характеристика кристаллической структуры и поведение электропроводности переменного тока ортофосфата натрия-кадмия. Дж. Матер. науч. господин. Электрон. 2018;29:171–179. doi: 10.1007/s10854-017-7901-7. [CrossRef] [Google Scholar]
, Rasheed M., Barille R. Характеристика кристаллической структуры и поведение электропроводности переменного тока ортофосфата натрия-кадмия. Дж. Матер. науч. господин. Электрон. 2018;29:171–179. doi: 10.1007/s10854-017-7901-7. [CrossRef] [Google Scholar]
23. Бейл С., Белисл Э., Чартранд П., Дектерой С., Эрикссон Г., Хак К., Юнг И., Канг Ю., Меланкон Дж., Пелтон А. , и другие. Программное обеспечение и базы данных FactSage для термохимии — последние разработки. Кальфад. 2009 г.;32:295–311. doi: 10.1016/j.calphad.2008.09.009. [CrossRef] [Google Scholar]
24. Lindstrom D., Du S.C. Кинетическое исследование десульфурации чугуна с использованием CaO и CaC 2 . Металл. Матер. Транс. Б. 2015; 46:83–92. doi: 10.1007/s11663-014-0195-8. [CrossRef] [Google Scholar]
25. Coudure J.M., Irons G.A. Влияние гранулометрического состава карбида кальция на кинетику десульфурации чугуна. ISIJ Междунар. 1994; 34: 155–163. doi: 10.2355/isijinternational.34.155. [Перекрестная ссылка] [Академия Google]
26. Уайлд Г., Перепецко Ю.Х. Смачивание критической точки на метастабильной химической бинодали в переохлажденных сплавах Fe–Cu. Acta Mater. 1999;47:3009–3021. doi: 10.1016/S1359-6454(99)00165-2. [CrossRef] [Google Scholar]
Уайлд Г., Перепецко Ю.Х. Смачивание критической точки на метастабильной химической бинодали в переохлажденных сплавах Fe–Cu. Acta Mater. 1999;47:3009–3021. doi: 10.1016/S1359-6454(99)00165-2. [CrossRef] [Google Scholar]
27. Salje G., Fellerkniepmeier M. Диффузия и растворимость меди в железе. Дж. Заявл. физ. 1977; 48: 1833–1839. дои: 10.1063/1.323934. [CrossRef] [Google Scholar]
28. Zhang Y., Fruehan R.J. Влияние размера пузырьков и химической реакции на вспенивание шлака. Металл. Матер. Транс. Б. 1995;26:803–812. doi: 10.1007/BF02651727. [CrossRef] [Google Scholar]
Сплавы Cu-Fe | Материалы | Iwatani Corporation
Iwatani предлагает первые в мире медно-железные сплавы с содержанием расплавленного железа от 4,0% до 10% широкий спектр областей, включая системы связи 5G/6G, AI/IoT, использование в медицине/антибактериальных препаратах и оборудование, устанавливаемое на транспортном средстве. Характеристики можно регулировать, изменяя содержание меди и железа, что позволяет нам предлагать решения, подходящие для конкретных областей применения.
Особенности
- 1. Устраняет три основных недостатка традиционных сплавов Cu-Fe (низкая электропроводность, ухудшение пружинящих свойств, растрескивание в результате желтой коррозии)
- 2. Содержание железа от 4,0% до 10% превышает 3,0%, впервые это было достигнуто Традиционно только до 3,0% железа растворялось в меди, но теперь возможно от 4,0% до 10% (впервые в мире).
- 3. Регулируемое содержание меди и железа (Cu60:Fe40 до Cu95:Fe5)
- 4. Сплав железного осаждающего типа (исполнение обеспечивается независимо от железа и меди)
- 5. Подходит для широкого спектра продуктов (например, труб, листов, фольги, проволоки, порошка)
- 6. Отличные характеристики обработки (например, фальцовка, гибка, волочение, нанесение покрытия, лазерная обработка)
- 7. Исключительные антибактериальные свойства (более сильные стерилизующие/антибактериальные свойства, чем у чистой меди)
Типичные химические составы
Типовые характеристики
Применение
| Сварочные материалы | Сварочная проволока и кольца для дуговой сварки
|
|---|



 Эти свойства позволяют делать из медного сырья электропроводные кабели.
Эти свойства позволяют делать из медного сырья электропроводные кабели.
 Сейчас для создания сплава применяются дуговые электропечи, а защита от окисления обеспечивается вакуумом. Закаливание смеси позволяет достичь высокого уровня пластичности и прочности.
Сейчас для создания сплава применяются дуговые электропечи, а защита от окисления обеспечивается вакуумом. Закаливание смеси позволяет достичь высокого уровня пластичности и прочности. Несмотря на то, что материал дешевле мельхиора, он имеет такие же качества и внешние признаки.
Несмотря на то, что материал дешевле мельхиора, он имеет такие же качества и внешние признаки. По мере уменьшения содержания S краевой угол уменьшался, а размер наномедных сфер увеличивался.
По мере уменьшения содержания S краевой угол уменьшался, а размер наномедных сфер увеличивался.