Сравнение серы и меди таблица: Сравните физические свойства меди и серы
alexxlab | 11.06.2023 | 0 | Разное
Технология обогащения медных руд – techade.ru
- Вы здесь:
- Главная
- Статьи
- Медная руда
- Технология обогащения медных руд
- размер шрифта уменьшить размер шрифта увеличить размер шрифта
Оцените материал
- 1
- 2
- 3
- 4
- 5
(3 голосов)
Руды, в которых основным металлом является медь, на 90-95% перерабатываются флотационным методом и лишь 5-10% руд подвергаются металлургической переработке или другим методам обогащения.
Флотация (франц. flottstion, от flotter – плавать на поверхности воды) – это метод обогащения, основанный на различии физико-химических свойств поверхности материалов, их способности смачиваться водой. Одни минералы (гидрофобные) в тонкоизмельченном состоянии в водной среде не смачиваются водой, прилипают к вводимым в воду пузырькам воздуха и всплывают с ними на поверхность, другие минералы (гидрофильные) смачиваются водой не прилипают к пузырькам воздуха и остаются в объеме пульпы.
Из ста семидесяти известных на данный момент медьсодержащих минералов в промышленных масштабах используется около семнадцати (таблица 1). Практически во всех медьсодержащих рудах, так же как и в полиметаллических, имеются сульфиды железа (таблица 2).
Таблица 1. Характеристика основных медных материалов
| Минерал | Формула | Массовая доля Cu, % | Плотность, г/см3 | Твердость |
| Первичные сульфиды | ||||
| Халькопирит | CuFeS2 | 34,6 | 4,1-4,2 | 3-4 |
| Вторичные сульфиды | ||||
| Халькозин | Cu2S | 79,9 | 5,5-5,8 | 2,5-3,0 |
| Ковеллин | CuS | 64,5 | 4,6-4,7 | 1,5-2,0 |
| Борнит | Cu5FeS4 | 63,3 | 4,5-5,3 | 3,0 |
| Блеклые руды (сульфосоли) | ||||
| Тетраэдрит | Cu2Sb4S2 | 45-51 | 4,4-5,1 | 3-4 |
| Теннантит | Cu2As4 | 45-51 | 4,4-5,1 | 3,5 |
| Оксиды | ||||
| Куприт | Cu2O | 88,8 | 5,8-6,2 | 3,5-4,0 |
| Тенорит | CuO | 79,9 | 5,8-6,4 | 3,5-4,0 |
| Карбонаты | ||||
| Малахит | Cu2(CO3)(OH)2 | 57,4 | 3,9-4,1 | 3,5-4,0 |
| Азурит | Cu3(CO3)2(OH)2 | 55,3 | 3,7-3,9 | 3,5-4,0 |
| Силикаты | ||||
| Хризоколла | CuSiO3*nH2O | До 45 | 2,0-2,3 | 2-4 |
| Сульфаты | ||||
| Халькантит | CuSO4*5H2 O | 25,4 | 2,2 | 2,5 |
| Брошантит | Cu2(SO4)(OH)6 | 34,8 | 3,8-3,9 | 3,5-4,0 |
Таблица 2. Характеристика основных сульфидных минералов железа
Характеристика основных сульфидных минералов железа
| Минерал | Формула | Массовая доля, % | Плотность г/см3 | Твердость | |
| железа | меди | ||||
| Пирит | FeS2 | 46,5 | 53,5 | 4,9-5,2 | 6,0-6,5 |
| Марказит | FeS2 | 46,5 | 53,5 | 4,9 | 6,0-6,5 |
| Пирротин | Fe1-xS | 58,8-61,8 | до 41 | – | 3,2-4,5 |
Для легкообогатимых руд с равномерной вкрапленностью медных минералов на фабриках небольшой производительности применяют обычно одностадиальные схемы, которые включают операции измельчения и классификации, основную флотацию, контрольную и одну–три перечистные.
На фабриках большой производительности получили распространение двухстадиальные схемы, по которым после I стадии измельчения до крупности 45–60 % класса –0,074 мм выделяются грубый медный концентрат и пиритсодержащие хвосты. Грубый медный концентрат доизмельчается до 85–95 % класса –0,074 мм и поступает на перечистные операции.
При переработке руд с высоким содержанием первичных шламов и растворимых солей флотацию целесообразно осуществлять в двух циклах – песковом и шламовом. При раздельной флотации создаются наиболее благоприятные условия для флотации крупных и мелких частиц – шламов (отходов продукта, составляющих пылевые и мелочные его части, получаемые в виде осадка при промывке какого-либо рудного материала), которые обычно повышают общий расход реагентов, подавляют флотацию крупных частиц, налипая на них, создают обильную и прочную пену. Схема с раздельной флотацией применяется, например, на Джезказганской фабрике (Казахстан), на фабриках «Бьютт» и «Твин-Бьюттс» (США).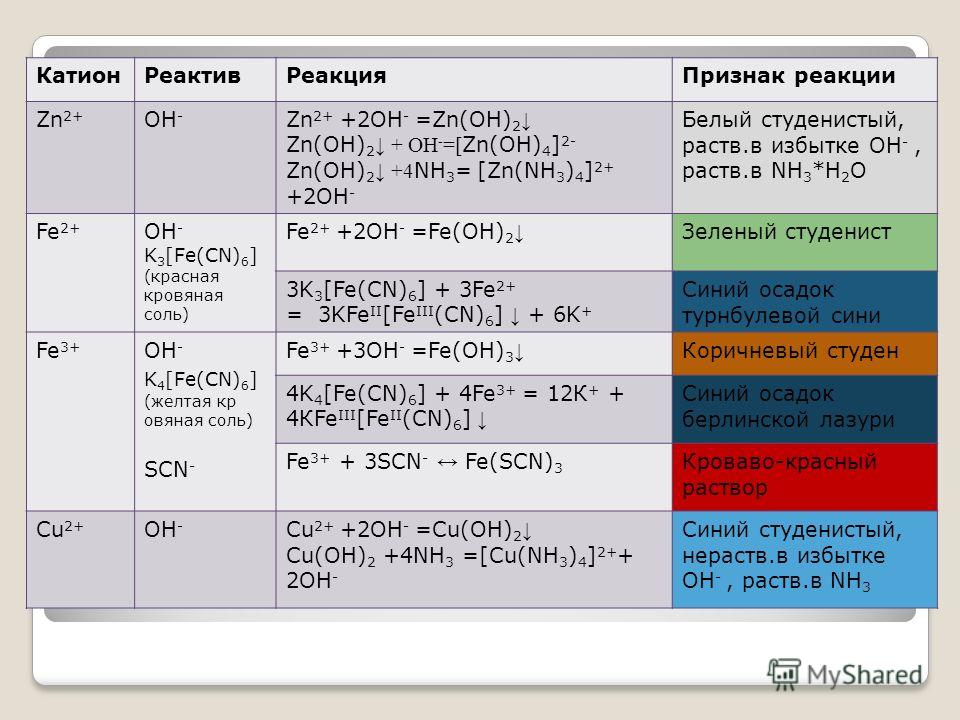
Вкрапленные медные руды (медно-порфировые, медистые песчаники и жильные руды), отличающиеся невысоким содержанием пиритной серы и меди (0,4–2,0 %), в зависимости от содержания пирита могут перерабатываться с получением только медного концентрата или медного и пиритного концентратов. В первом случае применяется коллективная флотация, а во втором – коллективно-селективная или прямая селективная.
По текстурным особенностям медьсодержащие руды подразделяются на массивные, или сплошные, и вкрапленные.
Сплошные руды обычно более богатые, характеризуются высоким содержанием серы, представленной пиритом, в срастании с которым находятся сульфиды меди и цинка. Соотношение меди, цинка и серы, например, в сплошной медно-колчеданной руде достигает 1:1:20 (25). Такими сплошными рудами являются медные и медно-цинковые руды Урала, относящиеся к труднообогатимым рудам.
Вкрапленные руды являются более бедными по содержанию цветных металлов, которое в рядовых рудах не превышает 1–2 %, а в бедных – 0,4–1,0 %. В зависимости от содержания меди в перерабатываемой руде медные руды условно подразделяются на богатые (более 2 % Cu), средние (0,8–2,0 % Cu), бедные (0,5–0,8 % Cu) и забалансовые (менее 0,3 % Cu). Богатые сульфидные руды, содержащие 2–3 % Cu, с высоким содержанием серы (35–42 %) могут иногда направляться непосредственно на плавку в шахтных печах. Однако в мировой практике в настоящее время 80 % Cu извлекается из концентратов, получаемых при обогащении медных руд.
В зависимости от содержания меди в перерабатываемой руде медные руды условно подразделяются на богатые (более 2 % Cu), средние (0,8–2,0 % Cu), бедные (0,5–0,8 % Cu) и забалансовые (менее 0,3 % Cu). Богатые сульфидные руды, содержащие 2–3 % Cu, с высоким содержанием серы (35–42 %) могут иногда направляться непосредственно на плавку в шахтных печах. Однако в мировой практике в настоящее время 80 % Cu извлекается из концентратов, получаемых при обогащении медных руд.
Сульфидные минералы меди (хальелпирит – CuFeS2, халькозин Cu2S, ковеллин CuS, борнит Cu5FeS4) хорошо флотируются сульфгидрильными собирателями (твердые кристаллические вещества имеют характерный запах, не обладают пеноообразующими свойствами, что позволяет регулировать их расходы в широких пределах без нарушения процесса пенообразования) на основе двухвалентной серы в довольно широком диапазоне рН, так как они обладают высокой сорбционной способностью, которая зависит от степени окисленности сульфидной поверхности и содержания меди.
Месторождения медно-порфировых руд по запасам меди являются самыми крупными. На их базе работают крупнейшие медно-обогатительные фабрики производительностью до 90 тыс. тонн руды в сутки и более. В основном к первичным медно-порфировым рудам относятся молибденит-халькопиритовые с невысоким содержанием (2–5 %) пирита. Основные технологические особенности обогащения этих руд:
– одностадийное измельчение до крупности 60–65 % класса –0,074 мм перед коллективной медно-молибденовой флотацией;
– доизмельчение черновых концентратов до 85–90 % класса –0,074 мм с получением богатых медных концентратов;
– создание в коллективной флотации поддерживается рН 10–12 подачей извести для подавления пирита (хотя для флотации молибденита оптимальное значение рН = 7,5–8,0).
Наибольшее распространение для этих руд получила схема с доизмельчением промпродукта и переработкой его в отдельном цикле. Пиритный концентрат из таких руд, как правило, не выделяется (за исключением фабрики «Чукикамата», Чили). Медно-порфировые руды (пирит, халькопирит, халькозин) перерабатываются на Алмалыкской и Балхашской фабриках (Узбекистан, Казахстан).
Для медных руд со средним содержанием пирита применяют как коллективно-селективные, так и прямые селективные схемы. При обогащении по коллективно-селективным схемам отделение медных минералов и пирита от минералов пустой породы происходит при грубом измельчении (до 45–50 % класса –0,074 мм), когда возможно получение хвостов с отвальным содержанием меди. Тогда по схеме коллективно-селективной флотации после измельчения до вышеуказанной крупности проводится коллективная флотация сульфидов меди и железа при рН не выше 7,5 (концентрация свободной СаО не превышает 20–50 г/м3). Получаемый коллективный медно-пиритный концентрат после доизмельчения до 80–95 % класса –0,074 мм перемешивается с известью при рН 12,0–12,5 (400–500 г/м3 свободной СаО) и цианидом для подавления пирита и направляется на медную флотацию.
В качестве собирателей сульфидных медных минералов применяются ксантогенаты (соли ксантогеновой кислоты ROC(=S)SH, средний расход обычно 10–30 г/т) и дитиофосфаты (10 г/т). Широко используется сочетание реагентов-собирателей. Например, при флотации медных руд за рубежом применяется реагент Z-200 (изопропилэтил-тионокарбамат), который является наиболее селективным по отношению к пириту в сочетании с изопропиловым или амиловым ксантогенатами. Часто используется сочетание сульфгидрильных собирателей с аполярными (машинное масло, керосин и т.п.). В СНГ наибольшее распространение получил бутиловый ксантогенат (С5Н9OS2K), который применяется на всех медных фабриках.
Общая доля ксантогенатов, используемых на фабриках США, составляет ~60 %, дитиофосфатов – около 40 %. Подавители минералов пустой породы при флотации медных вкрапленных руд обычно не применяются. Но если в пульпе повышенное содержание шламов, то в основную медную флотацию и в перечистки медного концентрата добавляют жидкое стекло (до 0,4 г/т). Если же в руде присутствуют окисленные медные минералы, то в измельчение и в основную медную флотацию подается сернистый натрий (200–300 г/т)
Подавители минералов пустой породы при флотации медных вкрапленных руд обычно не применяются. Но если в пульпе повышенное содержание шламов, то в основную медную флотацию и в перечистки медного концентрата добавляют жидкое стекло (до 0,4 г/т). Если же в руде присутствуют окисленные медные минералы, то в измельчение и в основную медную флотацию подается сернистый натрий (200–300 г/т)
Требования, которым должны соответствовать медный и пиритный концентраты, представлены в таблице 3 и 4.
Таблица 3. Требования по качеству медного концентрата (по ОСТ 48-77-82)
| Марка концентрата | Содержание, % | ||
| меди, не менее | примесей, не более | ||
| цинка | свинца | ||
| КМ-0 | 40 | 2 | 2,5 |
| КМ-1 | 35 | 2 | 3 |
| КМ-2 | 30 | 3 | 4 |
| КМ-3 | 25 | 5 | 4,5 |
| КМ-4 | 23 | 6 | 4,5 |
| КМ-5 | 20 | 7 | 4,5 |
| КМ-6 | 18 | 8 | 4,5 |
| КМ-7 | 15 | 8,5 | 5,0 |
| ППМ | 12 | 11 | 8 |
Таблица 4. Технические требования к пиритным концентратам, полученным при флотации сульфидных руд (по ГОСТ 444-51 “Колчедан флотационный”)
Технические требования к пиритным концентратам, полученным при флотации сульфидных руд (по ГОСТ 444-51 “Колчедан флотационный”)
Марка колчедана серного флотационного | Массовая доля, % | ||
| серы, не менее | примесей, не более | ||
| свинца и цинка | влаги | ||
| КСФ-1 | 47 | 1 | 3,8 |
| КСФ-2 | 45 | 1 | 3,8 |
| КСФ-3 | 42 | 1 | 3,8 |
| КСФ-4 | 38 | 1 | 3,8 |
Требования к получаемым медным и пиритным концентратам определяются в зависимости от типа руды и принятого метода их металлургической обработки.
Другие материалы в этой категории: « Технология обогащения медно-никелевых руд Минералы медной руды »
Наверх
Joomla SEF URLs by Artio
Популярные статьи
- Обогащение руды
- АРП-1Ц как сепаратор руды
- Гравитационное обогащение золотосодержащих руд
Категории
- Физика (9)
- Радиационная безопасность (3)
- АСУ ТП / технологии (35)
- Спектрометрия/ Метрология (3)
- Горное дело (18)
- Золотая руда (3)
- Обогащение руд (2)
- Железная руда (4)
- Медная руда (12)
- Чёрные и цветные металлы (6)
Облако тэгов
Асу тп Добыча золотоносных руд Золотопиритные руды Медная руда Месторождения Месторождения России Обогащение руд Радиационная безопасность горное дело детекторы железная руда золото золотокварцевая руда золотоносные руды медь никель обогащение руда сульфидные руды технологии флотация цветные металлы черная металлургия чёрные металлы
Сероводород.
 Что это такое? Формула, соединения и примеры
Что это такое? Формула, соединения и примерыПоможем понять и полюбить химию
Начать учиться
Чтобы сдать ОГЭ в 9‑м классе, нужно знать, что такое сероводород, и помнить его химические свойства. Давайте узнаем, что это за вещество, как его получают и в какие реакции оно вступает.
Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора.
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Твоя пятёрка по английскому.
С подробными решениями домашки от Skysmart
Способы получения сероводорода
Сероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов.
При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород:
H2 + S → H2S.
Практический способ получения сероводорода — действие разбавленных кислот на сульфиды:
FeS (тв) + 2HCl (разб) → H2S + FeCl2.
Полный гидролиз, в результате которого выделяется газ и выпадает осадок:
Al2S3 + 6H2O → 3H2S + 2Al(OH)3.

Сероводород можно получить путем нагревания смеси парафина и серы:
С20H42 + 21S → 21H2S + 20C.
Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы:
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S + 4H2O.
Химические свойства сероводорода
Горение
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
Полное горение. Продукты реакции — диоксид серы и вода:
2H2S + 3O2 → 2SO2 + 2H2O.
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
2H2S + O2 → 2S + 2H2O.

Растворимость в воде
Сероводород растворим в воде. Его раствор называют сероводородной водой или сероводородной кислотой. Формула сероводородной кислоты — H2S. Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется.
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
H2S ⇄ H+ + HS−.
HS− ⇄ H+ + S2−.
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
взаимодействие с активными металлами:
H2S + Mg → MgS + H2;
раствор сероводорода реагирует с основными оксидами:
H2S + BaO → BaS + H2O;
взаимодействие со щелочами:
H2S + NaOH → NaHS + H2O;
H2S + 2NaOH → Na2S + 2H2O;
сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
H2S + CuCl2 → CuS↓ + 2HCl.

Взаимодействие с аммиаком
Раствор сероводородной кислоты взаимодействует с аммиаком:
H2S + 2NH3 → (NH4)2S.
Окисление металлов
Сероводород может окислять малоактивные металлы в присутствии кислорода:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O.
Реакции с галогенами
Сероводород вступает в реакции с галогенами:
H2S + Cl2 → S + 2HCl.
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя. При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
в реакции с бромной водой наблюдается обесцвечивание раствора:
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr;
окисление сероводорода подкисленным раствором перманганата калия:
5H2S + 2KMnO4 + 3H2SO4 → 5S + K2SO4 + 2MnSO4 + 8H2O;
сероводород в кислой среде реагирует с дихроматом калия:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O;
взаимодействие с кислотами-окислителями (HNO3, H2SO4):
3H2S + 8HNO3 (разб) → 3H2SO4 + 8NO + 4H2O;
H2S + 8HNO3 (конц) → H2SO4 + 8NO2 + 4H2O;
H2S + H2SO4 (конц) → S + SO2 + 2H2O.

Вопросы для самопроверки
Охарактеризуйте физические свойства сульфида водорода.
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
Схеме превращений S−2 → S+4 соответствует уравнение:
2H2S + O2 → S + 2H2O
H2SO3 + H2O2 → H2SO4 + H2O
PbS + 4H2O2 → PbSO4 + 4H2O
2H2S + 3O2 → 2SO2 + 2H2O
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.
Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Б. Сероводород — восстановитель.
Верно только А
Верно только Б
Оба верны
Оба неверны
Татьяна Сосновцева
К предыдущей статье
247.3K
Валентность
К следующей статье
Химия углерода
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
.
 Сделки. Рис. 1.—Выплавка меди в тиглях без крышки. тот факт, что когда шихта меди переполяризована, это не может быть исправлено простым добавлением закиси меди, а шихта должна быть переработана для отверждения меди. Влияние серы на проводимость меди Сравнение тестов проводимости, организованных в соответствии с возрастающим содержанием серы, показано в таблице 5. 316 СВЯЗЬ СЕРЫ С ПЕРЕПОЛЕНИЕМ МЕДИ Процентная кислородная проводимость 101,90,003 101,3 0,029 100,8 0,022 100,7 0,079 99,8 0,023 100,7 0,016 101,0 0,056 Stock Photo
Сделки. Рис. 1.—Выплавка меди в тиглях без крышки. тот факт, что когда шихта меди переполяризована, это не может быть исправлено простым добавлением закиси меди, а шихта должна быть переработана для отверждения меди. Влияние серы на проводимость меди Сравнение тестов проводимости, организованных в соответствии с возрастающим содержанием серы, показано в таблице 5. 316 СВЯЗЬ СЕРЫ С ПЕРЕПОЛЕНИЕМ МЕДИ Процентная кислородная проводимость 101,90,003 101,3 0,029 100,8 0,022 100,7 0,079 99,8 0,023 100,7 0,016 101,0 0,056 Stock PhotoПодписи предоставлены нашими авторами.
RM ID:Идентификатор изображения:2AGE4Y5
Предварительный просмотр
Детали изображения
Идентификатор изображения:
2AGE4Y5
Размер файла:
9004 МБ Сжатый (МБ)
Полностью откройте файл изображения размер с помощью программного обеспечения для обработки изображений.
Выпуски:
Модель – нет | Собственность – нет Нужен ли релиз?
Размеры:
1864 x 1340 пикселей | 31,6 х 22,7 см | 12,4 х 8,9 дюйма | 150 dpi
Дополнительная информация:
Это изображение является общественным достоянием, что означает, что либо срок действия авторских прав на изображение истек, либо правообладатель отказался от своих авторских прав. Alamy взимает с вас плату за доступ к копии изображения в высоком разрешении.
Это изображение может иметь недостатки, так как оно либо историческое, либо репортажное.
. Сделки. Рис. 1.—Выплавка меди в тиглях без крышки. тот факт, что когда шихта меди переполяризована, это не может быть исправлено простым добавлением закиси меди, а шихта должна быть переработана для отверждения меди. Влияние серы на проводимость меди Сравнение тестов проводимости, организованных в соответствии с возрастающим содержанием серы, показано в таблице 5.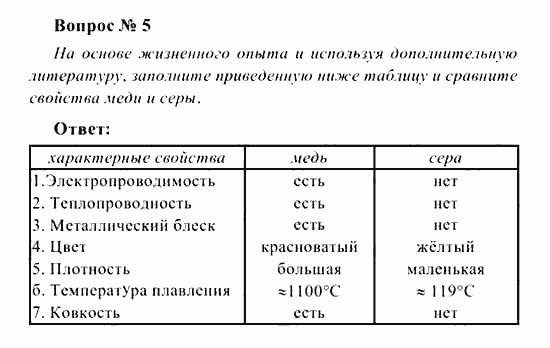 316 СВЯЗЬ СЕРЫ С ПЕРЕПОЛЕНИЕМ МЕДИ Процентная кислородная проводимость 101,90,003 101,3 0,029 100,8 0,022 100,7 0,079 99,8 0,023 100,7 0,016 101,0 0,056 100,2 0,016 100,8 0,113 99,5 0,022 9 0,09,1 19 0,071 9 25 100,3 0,097 99,3 0,034 100,5 0,0S3 98,5 0,093 98,8 0,072 98,6 Катодная медь Медь плавится под флюсом Медь плавится под древесным углем. Сплавы серы. NilNil Nil0.00080.00090.00120.00150.00210.00280.00330.00380.00380.00390.00420.00440.00450.00520.00580.0069. PiQ 2. Медь плавится под хлороводородом и полируется перед заливкой. ОБСУЖДЕНИЕ 317 Поскольку содержание серы в рафинированной меди находится в пределах от 0,001 до 0,004%, нельзя сказать, что на проводимость промышленной меди непосредственно влияет содержащаяся в ней сера. Оксид меди, который необходимо оставить в меди для противодействия сере, снижает проводимость. Это становится более очевидным при сравнении Таблиц 3 и 4, где столбцы с переполюсовкой показывают высокую электропроводность, тогда как столбцы с заданным уровнем, высоким содержанием кислорода, показывают низкую проводимость.
316 СВЯЗЬ СЕРЫ С ПЕРЕПОЛЕНИЕМ МЕДИ Процентная кислородная проводимость 101,90,003 101,3 0,029 100,8 0,022 100,7 0,079 99,8 0,023 100,7 0,016 101,0 0,056 100,2 0,016 100,8 0,113 99,5 0,022 9 0,09,1 19 0,071 9 25 100,3 0,097 99,3 0,034 100,5 0,0S3 98,5 0,093 98,8 0,072 98,6 Катодная медь Медь плавится под флюсом Медь плавится под древесным углем. Сплавы серы. NilNil Nil0.00080.00090.00120.00150.00210.00280.00330.00380.00380.00390.00420.00440.00450.00520.00580.0069. PiQ 2. Медь плавится под хлороводородом и полируется перед заливкой. ОБСУЖДЕНИЕ 317 Поскольку содержание серы в рафинированной меди находится в пределах от 0,001 до 0,004%, нельзя сказать, что на проводимость промышленной меди непосредственно влияет содержащаяся в ней сера. Оксид меди, который необходимо оставить в меди для противодействия сере, снижает проводимость. Это становится более очевидным при сравнении Таблиц 3 и 4, где столбцы с переполюсовкой показывают высокую электропроводность, тогда как столбцы с заданным уровнем, высоким содержанием кислорода, показывают низкую проводимость. Требуется сравнительно большое количество закиси меди, чтобы нейтрализовать следы серы; это объясняет, почему при рафинировании меди газы от свежего топлива часто перекрывают медь в период разливки, а также почему медь нельзя выдержать в печи при надлежащем шаге более нескольких часов. Это также объясняет ограничение перезарядки катодных листов в печь после того, как медь была доработана до нужной ямы 9.0003
Требуется сравнительно большое количество закиси меди, чтобы нейтрализовать следы серы; это объясняет, почему при рафинировании меди газы от свежего топлива часто перекрывают медь в период разливки, а также почему медь нельзя выдержать в печи при надлежащем шаге более нескольких часов. Это также объясняет ограничение перезарядки катодных листов в печь после того, как медь была доработана до нужной ямы 9.0003
Поиск стоковых фотографий по тегам
bobookcentre1800bookdecade1870booksubjectmineralindustries
Applications: Copper Compounds – Copper Sulfate наиболее широко используемая из солей меди. Действительно, он часто является исходным сырьем для производства многих других солей меди. Сегодня в мире насчитывается более 100 производителей, а мировое потребление составляет около 200 000 тонн в год, из которых, по оценкам, примерно три четверти используется в сельском хозяйстве, главным образом в качестве фунгицида.
Производство При производстве сульфата меди первичная медь редко используется в качестве исходного сырья. Медные руды используются в странах, где они добываются. Для большей части мирового производства лом цветных металлов является основным источником. Лом очищают, а расплавленный металл выливают в воду, чтобы получить примерно сферические пористые куски размером с мрамор, которые называются «дробью». Эта дробь растворяется в разбавленной серной кислоте в присутствии воздуха для получения горячего насыщенного раствора, который, если требуются традиционные крупные кристаллы сульфата меди, медленно охлаждается в больших охлаждающих чанах, в которые подвешиваются полоски свинца, чтобы обеспечить поверхность, на которой растут кристаллы. Если желательны гранулированные (снежные) сорта кристаллов, процесс охлаждения ускоряют путем перемешивания раствора в сосудах с водяным охлаждением.
Медные руды используются в странах, где они добываются. Для большей части мирового производства лом цветных металлов является основным источником. Лом очищают, а расплавленный металл выливают в воду, чтобы получить примерно сферические пористые куски размером с мрамор, которые называются «дробью». Эта дробь растворяется в разбавленной серной кислоте в присутствии воздуха для получения горячего насыщенного раствора, который, если требуются традиционные крупные кристаллы сульфата меди, медленно охлаждается в больших охлаждающих чанах, в которые подвешиваются полоски свинца, чтобы обеспечить поверхность, на которой растут кристаллы. Если желательны гранулированные (снежные) сорта кристаллов, процесс охлаждения ускоряют путем перемешивания раствора в сосудах с водяным охлаждением.
Другие методы производства:
- Путем нагрева медного лома с серой для получения сульфида меди, который затем окисляется с образованием сульфата меди.
-
- Путем нагрева медных сульфидных руд с получением оксида меди, который затем обрабатывают серной кислотой с образованием сульфата меди.

-
- Путем медленного выщелачивания на воздухе отвалов бедной руды. Бактериальное действие иногда используется для ускорения процесса. С таких куч стекает раствор медного купороса.
Коммерчески доступный сульфат меди содержит 25 % металлической меди и продается с гарантированной минимальной чистотой 98 % сульфата меди. Он производится в нескольких сортах, варьирующихся от крупных кристаллических кусков диаметром 25 мм и более, из-за которых он и получил название медный камень, до очень тонких порошков, размером почти с тальк. Четыре самых распространенных сорта, основанные на размерах диаметра кристаллов:
- Крупные кристаллы (от 10 мм до 40 мм)
-
- Мелкие кристаллы (от 2 мм до 10 мм)
-
- Гранулированные или снежные кристаллы (менее 2 мм)
-
- Унесенный ветром порошок (менее 0,15 мм)
Сульфат меди — очень универсальное химическое вещество с таким же широким спектром применения в промышленности, как и в сельском хозяйстве. Его основное применение — сельское хозяйство, и эта роль более подробно описана в следующем разделе.
Его основное применение — сельское хозяйство, и эта роль более подробно описана в следующем разделе.
Приблизительно одно поколение назад в промышленности его использовали только в качестве протравы для окрашивания и гальванического покрытия, но сегодня он используется во многих промышленных процессах. Промышленность синтетических волокон нашла ему применение в производстве своего сырья. Металлургическая промышленность использует большие количества сульфата меди в качестве электролита при рафинировании меди, для меднения стальной проволоки перед ее волочением и в различных процессах меднения. В горнодобывающей промышленности применяется в качестве активатора при обогащении пенной флотацией свинцовых, цинковых, кобальтовых и золотых руд. Полиграфия использует его в качестве электролита при производстве гальванопластики и в качестве травильного агента для процесса гравировки. Лакокрасочная промышленность использует его в противообрастающих красках, и он играет роль в окраске стекла.

