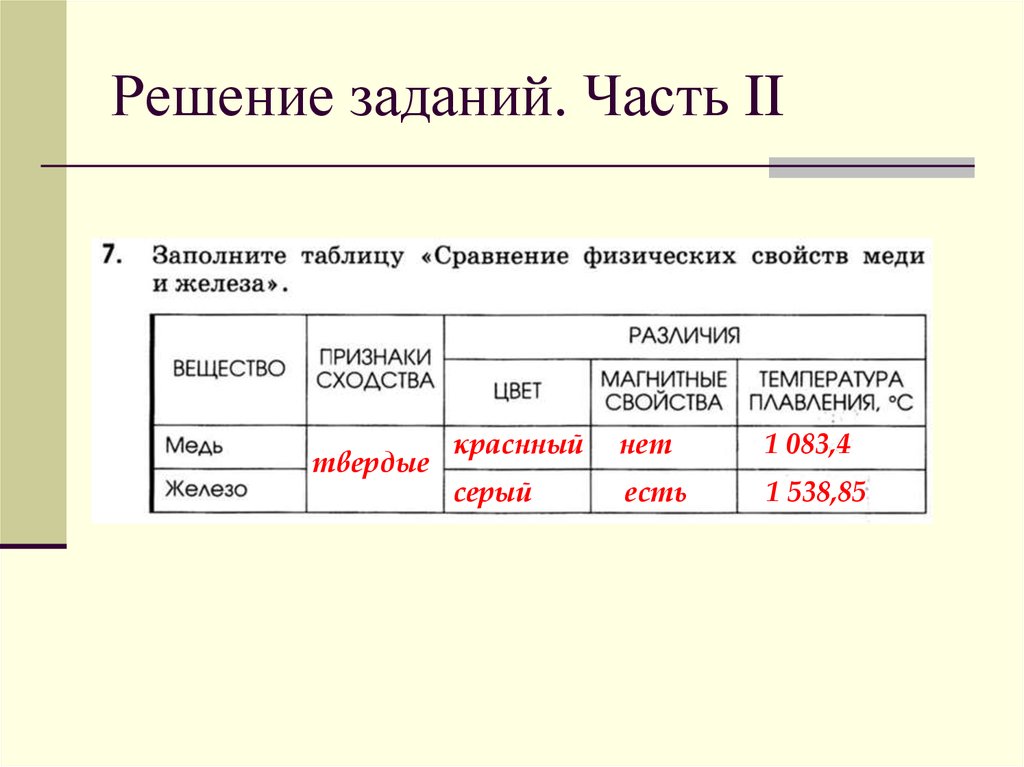
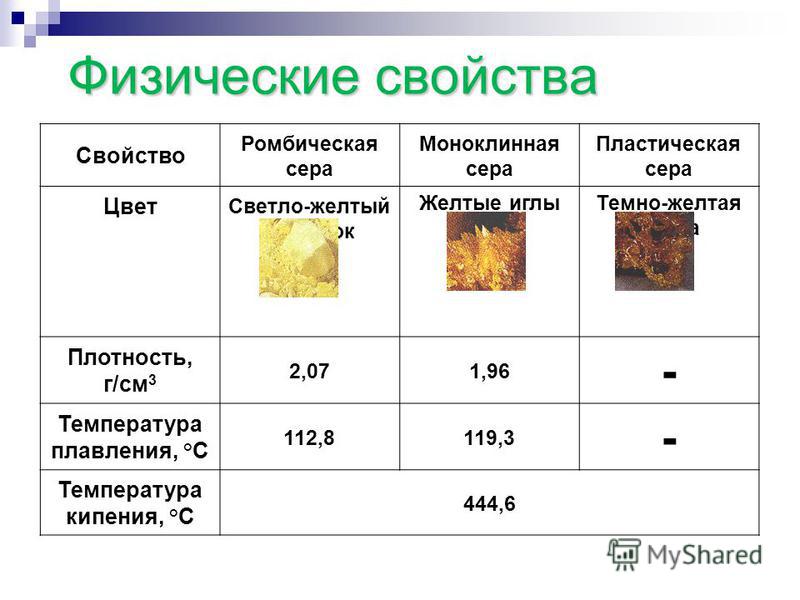
Сравните физические свойства меди и серы таблица 8 класс: Сравните физические свойства меди и серы
alexxlab | 11.04.2023 | 0 | Разное
Сероводород. Что это такое? Формула, соединения и примеры
Поможем понять и полюбить химию
Начать учиться
Чтобы сдать ОГЭ в 9‑м классе, нужно знать, что такое сероводород, и помнить его химические свойства. Давайте узнаем, что это за вещество, как его получают и в какие реакции оно вступает.
Сероводород — это молекулярное соединение с ковалентной полярной связью. По-другому это вещество называется сернистым водородом или сульфидом водорода. Химическая формула сероводорода — H2S.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода. В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора.
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Полезные подарки для родителей
В колесе фортуны — гарантированные призы, которые помогут наладить учебный процесс и выстроить отношения с ребёнком!
Способы получения сероводорода
Сероводород встречается в природе в вулканических газах и водах минеральных источников. Также он образуется в результате разложения белков погибших животных и растений, при гниении пищевых отбросов.
При высокой температуре сера взаимодействует с водородом, в результате образуется газ — сероводород:
H2 + S → H2S.
Практический способ получения сероводорода — действие разбавленных кислот на сульфиды:
FeS (тв) + 2HCl (разб) → H2S + FeCl2.
Полный гидролиз, в результате которого выделяется газ и выпадает осадок:
Al2S3 + 6H2O → 3H2S + 2Al(OH)3.
Сероводород можно получить путем нагревания смеси парафина и серы:
С20H42 + 21S → 21H2S + 20C.
Действие концентрированной серной кислоты на щелочные и щелочноземельные металлы:
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S + 4H 2O.
Химические свойства сероводорода
Горение
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
Полное горение. Продукты реакции — диоксид серы и вода:
2H2S + 3O2 → 2SO2 + 2H2O.
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
2H2S + O2 → 2S + 2H2O.
Растворимость в воде
Сероводород растворим в воде. Его раствор называют
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
H2S ⇄ H+ + HS−.
HS− ⇄ H+ + S2−.
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
взаимодействие с активными металлами:
H2
S + Mg → MgS + H2;раствор сероводорода реагирует с основными оксидами:
H2S + BaO → BaS + H2O;
взаимодействие со щелочами:
H2S + NaOH → NaHS + H2O;
H2S + 2NaOH → Na2S + 2H2O;
сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
H2S + CuCl2 → CuS↓ + 2HCl.

Взаимодействие с аммиаком
Раствор сероводородной кислоты взаимодействует с аммиаком:
H2S + 2NH3 → (NH4)2S.
Окисление металлов
Сероводород может окислять малоактивные металлы в присутствии кислорода:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O.
Реакции с галогенами
Сероводород вступает в реакции с галогенами:
H2S + Cl2 → S + 2HCl.
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя.
в реакции с бромной водой наблюдается обесцвечивание раствора:
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr;
окисление сероводорода подкисленным раствором перманганата калия:
5H2S + 2KMnO4 + 3H2SO4 → 5S + K2SO4 + 2MnSO4 + 8H2O;
сероводород в кислой среде реагирует с дихроматом калия:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4
взаимодействие с кислотами-окислителями (HNO3, H2SO4):
3H2S + 8HNO3 (разб) → 3H2SO4 + 8NO + 4H2O;
H2S + 8HNO3 (конц) → H2SO4 + 8NO2 + 4H2O;
H2S + H2SO4 (конц) → S + SO2 + 2H2O.

Вопросы для самопроверки
Охарактеризуйте физические свойства сульфида водорода.
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
Схеме превращений S −2 → S+4 соответствует уравнение:
2H2S + O2 → S + 2H2O
H2SO3 + H2O2 → H2SO4 + H2O
PbS + 4H2O2 → PbSO4 + 4H2O
2H2S + 3O2 → 2SO2 + 2H2O
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.

Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Верно только А
Верно только Б
Оба верны
Оба неверны
Татьяна Сосновцева
К предыдущей статье
203.7K
Валентность
К следующей статье
Химия углерода
Получите план обучения, который поможет понять и полюбить химию
На вводном уроке с методистом
Выявим пробелы в знаниях и дадим советы по обучению
Расскажем, как проходят занятия
Подберём курс
Лабораторные опыты 8 класс
Лабораторный опыт №1
Рассмотрение веществ с различными физическими свойства.
Цель: рассмотреть образцы простых и сложных веществ и охарактеризовать их физические свойства.
Оборудование, реактивы, материалы: образцы химических веществ: железные опилки, сера S, медный купорос.
Выполнение работы:
Рассмотрите образцы предложенных веществ. Изучите физические свойства предложенных вам веществ и кратко запишите в таблицу.
Определите:
Агрегатное состояние: твердое, жидкое, газообразное.
Цвет и блеск.
Наличие характерного запаха.
Растворимость в воде (небольшое кол-во вещества внесите в пробирку, налейте воды и размешайте), хорошо растворимый, мало растворимый, не растворимый.
Изменение при нагревании.
Название вещества | Агрегатное состояние | Цвет | Наличие характерного запаха | Растворимость в воде | Изменения при нагревании |
Железные опилки | |||||
Сера | |||||
Медный купорос | |||||
Растительное масло | |||||
Поваренная соль | |||||
Уксус |
Вывод:__________________________________________________________________
__________________________________________________________________________________________________________________________________________________
Лабораторный опыт № 2
Разделение смеси с помощью магнита.
Цель: познакомиться со способами разделения смесей, рассмотреть способ разделения смеси с помощью магнита.
Оборудование, реактивы, материалы: железные опилки Fe, порошок серы S , магнит.
Выполнение работы:
1. На один листочек бумаги насыпьте примерно 1 см2 порошкообразной серы, а на другой – столько же железных опилок.
2. Отметьте цвет этих веществ.
3. Смешайте порошки серы и железа. Отметьте цвет этой смеси.
4. Проверьте действие магнита на полученную смесь.
На основании наблюдений сделайте вывод: на каком свойстве железа и серы основано разделение их смеси?
Лабораторный опыт № 3
Примеры физических и химических явлений.
Цель: научиться различать физические явления в окружающем мире, уметь их представлять и использовать; выявить особенные признаки химических превращений, отличающих их от физических явлений.
Оборудование, реактивы, материалы: фарфоровая чаша, пробиркодержатель, парафин, спиртовка, спички, лучинка, пероксид водорода, перманганат калия, серная кислота, карбонат кальция.
Выполнение работы:
1. Плавление парафина.
Закрепите фарфоровую чашу в пробиркодержателе. Положите в чашку кусочек парафина и нагрейте ее в пламени спиртовки до плавления парафина. Потушите пламя. Поставьте чашку на фарфоровую подставку и дождитесь пока парафин затвердеет.
Что произошло с парафином? К каким явлениям следует отнести изменения парафина при нагревании?
2. Взаимодействие серной кислоты с карбонатом кальция.
Налейте в пробирку 2 мл серной кислоты и добавьте карбонат кальция (мел).
Что произошло в результате реакции? К какому явлению можно отнести эти изменения?
3. Взаимодействие пероксида водорода с перманганатом калия.
Налейте в пробирку 1 мл пероксида водорода и насыпьте немного марганцовки. Происходит бурное выделение газа. Опустите в пробирку тлеющую лучинку. Она загорается.
Какой газ выделился? Какие признаки подтверждают, что произошла химическая реакция?
Вывод: в ходе лабораторных опытов ознакомился….
Лабораторный опыт № 4.
Ознакомление с образцами простых и сложных веществ.
Цель: ознакомиться с некоторыми образцами простых и сложных веществ. Научиться разделять простые вещества на металлы и неметаллы.
Реактивы: поваренная соль NaCl, гранулы цинка, железные опилки или гвозди, медный купорос CuSO4 * 5H2O, таблетки активированного угля, сода NaHCO3.
Задания:
1. Рассмотрите внешний вид выданных вам веществ и заполните таблицу:
Название веществ | Внешний вид |
2. Расположите отдельно в ряд простые вещества, а в другой ряд – сложные.
Расположите отдельно в ряд простые вещества, а в другой ряд – сложные.
3. Простые разделите на металлы и неметаллы.
4. Заполните таблицу, распределив вещества по соответствующим колонкам.
Вещество | |||
простое | сложное | ||
металл | неметалл | ||
Сделайте выводы:
Простое вещество – это __________________________________________
Сложное вещество – это __________________________________________
Лабораторный опыт № 5
Ознакомление с образцами оксидов
Цель: научиться определять возможное строение (молекулярное и немолекулярное) на основании его физических свойств.
Реактивы: _____________________________________________________________
______________________________________________________________________________________________________________________________________________
С правилами по ТБ и БЖД во время выполнения работы ознакомлен (а).
Ход работы
1. Рассмотрите образцы различных оксидов.
2. Заполните таблицу.
3. Ответьте на вопросы:
Какие из рассмотренных вами оксидов имеют молекулярное строение, а какие немолекулярное?
По каким признакам это можно определить?
Напишите уравнения реакций получения предложенных вам оксидов.
Оксид (название, формула) | Физические свойства | ||
Агрегатное состояние | Цвет | Запах | |
Оксид меди (II) CuO | |||
… | |||
… | |||
… | |||
Вывод: в ходе выполнения лабораторного опыта я научился …. .
.
Лабораторный опыт № 6
Свойства растворимых и нерастворимых оснований
Цель: изучить опытным путем свойства оснований.
Оборудование: _________________________________________________________
Реактивы: _____________________________________________________________
______________________________________________________________________________________________________________________________________________
С правилами по ТБ и БЖД во время выполнения работы ознакомлен (а).
Задание: опишите физические свойства выданных вам в пробирках образцов оснований: гидроксидов натрия, калия, меди (II), железа (III). Определите, какие из выданных вам оснований являются растворимыми, а какие из них нерастворимы в воде.
Ход работы
1. Рассмотрите выданных в пробирках образцы оснований: гидроксидов натрия, калия, меди (II), железа (III). Определите и запишите в таблицу их физические свойства: агрегатное состояние, цвет, запах.
Определите и запишите в таблицу их физические свойства: агрегатное состояние, цвет, запах.
2. Прилейте в каждую пробирку по 1-2 мл воды и взболтайте. Отметьте в таблице растворимость гидроксидов в воде.
Наблюдаем (в пробирках с какими гидроксидами жидкости мутные, а с какими – прозрачные)
3. Приготовьте фильтр.
4. Отфильтруйте мутные жидкости. К полученным прозрачным растворам добавьте по несколько капель раствора фенолфталеина.
Наблюдаем (как изменилась окраска фенолфталеина, почему).
Формула гидроксида Свойства | NaOH | Ca(OH)2 | Cu(OH)2 | Fe(OH)3 |
Агрегатное состояние | ||||
Цвет | ||||
Запах | ||||
Растворимость в воде |
Вывод: в ходе выполнения лабораторного опыта я научился …. .
.
Лабораторный опыт № 7
Взаимодействие гидроксида цинка с растворами кислот и щелочей
Цель: научиться получать гидроксид цинка и экспериментальным путем доказать его амфотерный характер. Изучить (опытным путем) взаимодействие амфотерных гидроксидов с кислотами и щелочами.
Оборудование: _________________________________________________________
Реактивы: _____________________________________________________________
_______________________________________________________________________
С правилами по ТБ и БЖД во время выполнения работы ознакомлен (а).
Ход работы
Задание № 1
Получите гидроксид цинка (II) и проведите химические реакции этого вещества с растворами гидроксида натрия и с серной кислотой.
Порядок выполнения работы
Получите гидроксид цинка (II).
В две пробирки прилейте по 1 мл р-ра гидроксида натрия. Добавьте в каждую пробирку раствор сульфата цинка (II) (до выпадения белого осадка).
Напишите уравнения проведенной реакции. Определите ее тип.
_____________________________________________________________________
В одну из пробирок с гидроксидом цинка (II) прильем серную кислоту. В другую пробирку добавим избыток р-ра гидроксида натрия и встряхнем пробирки.
Опишите наблюдения ____________________________________________________
_______________________________________________________________________
Напишите уравнения проведенных реакций.
______________________________________________________________________________________________________________________________________________
Задание № 2
Получите гидроксид магния и проверьте, будет ли он реагировать с растворами гидроксида натрия и с серной кислотой. Сравните наблюдения с предыдущими.
Порядок выполнения работы
Получите гидроксид магния.
В две пробирки прилейте по 1 мл р-ра гидроксида натрия. Добавьте в каждую пробирку раствор сульфата магния.
Опишите наблюдения __________________________________________________
Напишите уравнения проведенной реакции.
______________________________________________________________________
К осадку в первой пробирке добавьте кислоту, а к осадку во второй – избыток щелочи.
Опишите наблюдения ____________________________________________________
_______________________________________________________________________
Напишите уравнения проведенных реакций.
______________________________________________________________________________________________________________________________________________
Вывод: в ходе выполнения лабораторного опыта я научился …..
Лабораторный опыт № 8
Действие кислот на индикаторы
Цель: определить действие кислот на индикаторы. Научиться распознавать растворы кислот с помощью индикаторов.
Научиться распознавать растворы кислот с помощью индикаторов.
Оборудование: _________________________________________________________
Реактивы: _____________________________________________________________
_______________________________________________________________________
С правилами по ТБ и БЖД во время выполнения работы ознакомлен (а).
Ход работы
Поместите в штатив 3 пробирки с раствором серной кислоты.
В 1-ю пробирку добавьте несколько капель раствора лакмуса, во 2-ю пробирку – несколько капель раствора фенолфталеина, а в 3-ю – несколько капель раствора метилового оранжевого.
Опишите свои наблюдения.
Можно ли с помощью индикаторов распознать раствор любой кислоты
Вывод: в ходе выполнения лабораторного опыта я научился …..
Лабораторный опыт № 9
Отношение кислот к металлам.
Цель: выяснить (опытным путем) отношение кислот к различным металлам. На основе наблюдений составить ряд активности изученных металлов.
Оборудование: _________________________________________________________
Реактивы: _____________________________________________________________
_______________________________________________________________________
С правилами по ТБ и БЖД во время выполнения работы ознакомлен (а).
Ход работы
Задание: проведите реакции раствора серной кислоты с металлами: магнием, цинком, железом и медью. Сравните поведение разных металлов в кислоте.
Порядок выполнения задания
В четыре пронумерованные пробирки поместите соответственно:
в пробирку 1 – стружку магния;
в пробирку 2 – гранулу цинка;
в пробирку 3 – железную проволоку;
в пробирку 4 – медную проволоку.
В каждую пробирку прилейте по 1 мл серной кислоты.
Опишите свои наблюдения.
Напишите уравнения проведенных реакций. Определите их тип.
Вывод: в ходе выполнения лабораторного опыта я научился …..
Свойства металлов и неметаллов
Мы можем разделить элементы на металлы и неметаллы на основе их химических и физических свойств. Этили определяются как элементы, обладающие такими свойствами, как ковкость, пластичность, звучность и хорошие проводники тепла. и электричество. В то время как неметаллы – это те элементы, которые не податливы, пластичны, звучны и являются плохими проводниками тепла и электричества. На следующем рисунке в периодической таблице выделены металлы и неметаллы, а также металлоиды.
(Изображение будет загружено в ближайшее время)
В этой статье мы подробно обсудим свойства металлов и неметаллов и разницу между ними на основе их свойств (с исключениями).
Что такое металл?
Металл в химии определяется как элемент, который может легко образовывать положительные ионы, называемые катионами, и имеет тенденцию образовывать металлические связи. Металлы отличаются своими химическими и физическими свойствами, такими как ковкость, пластичность, ионизационные и связующие свойства и т. д.
Металлы отличаются своими химическими и физическими свойствами, такими как ковкость, пластичность, ионизационные и связующие свойства и т. д.
Свойства металлов
Примерами металлов являются золото, алюминий, железо, магний и т. д. Они обладают следующими свойствами.
Физические свойства металлов: Некоторые из основных физических свойств металлов приведены ниже.
Металлы можно ковать в тонкие листы. Это значит, что они обладают свойством податливости.
Металлы пластичны. Их можно втянуть в провода.
Металлы являются хорошими проводниками тепла и электричества.
Металлы блестящие, что означает, что они имеют блестящий вид.

Металлы обладают высокой прочностью на растяжение. Это означает, что они могут держать тяжеловесов.
Металлы звонкие. Это означает, что когда мы ударяем их, они издают звонкий звук.
Металлы твердые. Это означает, что их нельзя легко разрезать.
Химические свойства металлов: Некоторые химические свойства металлов приведены ниже.
Металл + кислород Оксид металла
Оксид металла + вода Основание
Пример. Магний представляет собой металл, и при взаимодействии с кислородом он образует оксид магния. Когда мы растворяем оксид магния в воде, получается гидроксид магния. Реакции приведены ниже.
2Mg + O2 2MgO
MgO + h3O Mg(OH)2
Водный раствор оксида металла превращает красную лакмусовую бумажку в синюю.
Реакция с водой – Металлы реагируют с водой. Когда металл реагирует с водой, образуются гидроксид металла и газообразный водород.
Металл + вода Гидроксид металла + водород
Пример. Металлический натрий реагирует с водой с образованием гидроксида натрия и газообразного водорода. Реакция приведена ниже –
Na + h3O NaOH + h3
Металл + Кислота Соль металла + водород
Пример. Металлический магний реагирует с соляной кислотой и образует хлорид магния и водород. Реакция представлена ниже –
Mg + 2HCl MgCl2 + h3
Металл + соль основного металла + водород
Пример. Металлический алюминий реагирует с гидроксидом натрия с образованием алюмината натрия и газообразного водорода. Реакция приведена ниже –
Al + NaOH NaAlO2 + h3
Пример – Железо более реакционноспособно, чем медь. Таким образом, он вытесняет медь из соли. Реакция приведена ниже –
Таким образом, он вытесняет медь из соли. Реакция приведена ниже –
CuSO4 + Fe FeSO4 + Cu
Что такое неметалл?
Неметалл в химии можно определить как химический элемент, который обычно в химической реакции получает электроны при взаимодействии с металлом. Он имеет тенденцию образовывать кислоту в сочетании с кислородом и водородом. Неметаллы демонстрируют большее разнообразие цветов и состояний по сравнению с металлами.
Свойства неметаллов
Примерами неметаллов являются хлор, углерод, бром, сера, фосфор и т. д. Они проявляют следующие свойства:
Физические свойства неметаллов: некоторые из основных физических свойств неметаллы приведены ниже.
Неметаллы нельзя забивать в тонкие листы. Это означает, что они не обладают свойством податливости.
 Вместо этого они хрупкие, так как при ударе молотком распадаются на куски.
Вместо этого они хрупкие, так как при ударе молотком распадаются на куски.Неметаллы не пластичны. Их нельзя втягивать в провода.
Неметаллы являются плохими проводниками тепла и электричества.
Неметаллы не блестят, что означает, что они не блестят. Вместо унылого вида.
Неметаллы имеют низкую прочность на растяжение. Это означает, что они не могут удерживать тяжеловесов.
Неметаллы не звонкие. Это означает, что когда мы ударяем их, они не издают ни звука.
Неметаллы мягкие. Это означает, что их можно легко разрезать ножом.
Химические свойства неметаллов: Некоторые химические свойства элементов приведены ниже.

Неметалл + кислород Оксид неметалла
Оксид неметалла + вода Кислота
Пример. Сера является неметаллом и при взаимодействии с кислородом образует диоксид серы. Когда мы растворяем диоксид серы в воде, получается сернистая кислота. Реакции приведены ниже.
S + O2 SO2
SO2 + h3O h3SO3
Водный раствор оксида неметалла превращает синюю лакмусовую бумажку в красную.
Неметаллы обычно не реагируют с водой.
Неметаллы не реагируют с разбавленными кислотами, хотя могут реагировать с концентрированными кислотами.
Пример – C + конц. 4HNO3 CO2 + 4NO2 + 2h3O
Пример – 4S + 8NaOH Na2SO4 + 3Na2S + 4h3O (при >600 ℃)
Пример. Бром более активен, чем йод. Таким образом, он замещает йод в соединениях йодида калия. Реакция приведена ниже –
Бром более активен, чем йод. Таким образом, он замещает йод в соединениях йодида калия. Реакция приведена ниже –
2KI + Br2 2KBr + I2
Разница между металлами и неметаллами
Мы различаем металлы и неметаллы по их физическим и химическим свойствам. Здесь разница между металлом и неметаллом представлена в виде таблицы с исключениями для лучшего понимания. Приведенные выше физические и химические свойства металлов и неметаллов сравниваются здесь.
Серийный номер | Property | Metal | Nonmetal | Exceptions | |||
1 | Malleability | Malleable | Not malleable | – | |||
2 | Ductility | Ductile | Not ductile | – | |||
3 | Brittle | Not brittle | Brittle | – | |||
4 | Проводимость | Хороший проводник тепла и электричества | Плохой проводник тепла и электричества | Алмаз – неметалл, но хороший проводник тепла. Графит – неметалл, но хороший проводник электричества. | |||
5 | Luster | Listrous | Dull | Diamond and Iodine –1000. | |||
6 | Прочность | Высокая прочность на растяжение | Низкая прочность на растяжение | Натрий и калий являются металлами, но имеют низкую прочность на растяжение. | |||
7 | Sonority | Sonorous | Not sonorous | – | |||
8 | Hardness | Hard | Soft | Натрий и калий — это металлы, но они мягкие и могут резаться ножом. Алмаз — неметалл, но очень твердое вещество. Это самое твердое известное природное вещество. | |||
9 | Reaction with oxygen | Metal + Oxygen Metal oxide 2Mg + O2 2MgO | Nonmetal + Oxygen Nonmetal oxide S + O2 SO2 | – | |||
10 | Реакция с водой | Metal + Water Metal hydroxide + hydrogen Na + h3O NaOH + h3 | No reaction with water | – | |||
11 | Reaction with acid | Металл + кислота Соль металла + водород Mg + 2HCl MgCl2 + h3 | Неметаллы не реагируют с разбавленной кислотой, но реагируют с концентрированной кислотой. С + конц. 4HNO3 CO2 + 4NO2 + 2h3O | – | |||
12 | Reaction with base | Metal + Base Metal salt + hydrogen Al + NaOH NaAlO2 + h3 | React с сильными основаниями и не выделяют газообразный водород. 4S+8NaOH Na2SO4+3Na2S+4h3O0003 | Реакция замещения | Более активный металл вытесняет менее активный металл из его соли. Железо более реакционноспособно, чем Cu. CuSO4 + Fe FeSO4 + Cu | Более активный неметалл вытесняет менее реакционноспособный неметалл из его соли. Бром более активен, чем йод. 2KI + Br2 2KBr + I2
| – |
14 | Nature of oxides | Basic | Acidic | – | |||
15 | The action of oxides on litmus paper | Metal oxides turn red litmus paper в синий. | Оксиды неметаллов превращают синюю лакмусовую бумагу в красную. | – | |||
16 | Реакции оксидов с водой | Оксиды металлов реагируют с водой и образуют соответствующие гидроксиды. MgO + h3O Mg(OH)2 | Оксиды неметаллов реагируют с водой и образуют кислоты. SO2 + h3O h3SO3 | – |
Прочитав эту статью, вы сможете решать задачи по теме. Мы получаем необходимые базовые знания, связанные с металлами и неметаллами. Если вы ищете решения проблем с учебниками NCERT, основанные на этой теме, войдите на веб-сайт Vedantu или загрузите приложение Vedantu Learning. Таким образом, вы сможете получить доступ к бесплатным PDF-файлам с решениями NCERT, а также к примечаниям к изменениям, пробным тестам и многому другому.
Материалы класса 8, металлы и неметаллы
Материалы класса 8, металлы и неметаллы, является главой 4 научной статьи . Это очень интересная глава, объясняющая различные свойства металлов и неметаллов. В этом блоге мы будем обсуждать все важные темы, затронутые в главе!
Содержание
- Физические свойства – материалы класса 8 Металлы и неметаллы
- Химические свойства металлов и неметаллов
- Использование металлов и неметаллов
- Часто задаваемые вопросы о материалах класса 8 Металлы и неметаллы
Физические свойства – Материалы класса 8 Металлы и неметаллы
Металлы – Металлы обладают некоторыми свойствами, которые отличают их от других материалов, например, они твердые, блестящие, ковкие, пластичные, звучные и хорошо проводят тепло и электричество. Примерами металлов являются железо, медь, алюминий, кальций, магний и т. д.
Неметаллы – Неметаллы, такие как уголь и сера, выглядят мягкими и тусклыми. Они не звонкие и являются плохими проводниками тепла и электричества. Примерами неметаллов являются сера, углерод, кислород, фосфор и т. д.
Они не звонкие и являются плохими проводниками тепла и электричества. Примерами неметаллов являются сера, углерод, кислород, фосфор и т. д.
Ковкость – Свойство, благодаря которому их можно выковывать в тонкие листы, является характерным свойством металлов и называется ковкостью.
Пластичность – Свойство металлов, благодаря которому их можно вытягивать в проволоку, называется пластичностью.
Блестящий — Блеск на поверхности металлов называется блеском, поэтому мы знаем, что металлы блестят.
Звонкость – Металлы издают звонкие звуки и считаются звонкими. Неметаллы не звонкие.
Проводимость – Металлические предметы, такие как железный стержень, гвоздь и медная проволока, являются хорошими проводниками тепла и электричества, в то время как скрученный кусок серы и кусок угля являются плохими проводниками, так как не являются металлами.
Некоторые исключения. Такие металлы, как натрий и калий, мягкие и их можно резать ножом. Ртуть — единственный металл, находящийся в жидком состоянии при комнатной температуре.
Такие металлы, как натрий и калий, мягкие и их можно резать ножом. Ртуть — единственный металл, находящийся в жидком состоянии при комнатной температуре.
Класс 8. Примечания по изучению структуры и функций клеток
Химические свойства металлов и неметаллов
Реакция с кислородом – Железо ржавеет в присутствии кислорода или во влажном воздухе, магний аналогично реагирует с кислородом сжигание. В обоих случаях происходит образование оксида. Медные сосуды при длительном воздействии влажного воздуха приобретают тускло-зеленый налет из гидроксида и карбоната меди, представленный формулой 2Cu+h3O+CO2 +O2→Cu(OH)2 + CuCO3. Таким образом, мы обнаруживаем, что горящие металлы реагируют с кислородом с образованием оксидов металлов, которые являются основными по своей природе.
Реакция серы с кислородом приводит к образованию газообразного диоксида серы. При растворении диоксида серы в воде образуется сернистая кислота по формуле – диоксид серы (SO2) + вода (h3O) → сернистая кислота (h3SO3). Оксиды неметаллов обычно имеют кислотную природу.
Оксиды неметаллов обычно имеют кислотную природу.
Реакция с водой – Металлический натрий очень реакционноспособен, и когда он реагирует с кислородом и водой, в ходе реакции выделяется много тепла. Поэтому его обычно хранят в керосине, чтобы предотвратить этот несчастный случай. Некоторые другие металлы, такие как железо, реагируют с водой медленно и не вызывают таких мгновенных реакций. Некоторые металлы реагируют с водой с образованием гидроксидов металлов и газообразного водорода.
Неметаллы обычно не реагируют с водой, хотя они могут быть очень реактивными в воздухе, такие неметаллы хранятся в воде. Например, фосфор загорается на воздухе. Для предотвращения контакта фосфора с кислородом воздуха его хранят в воде, так как это очень реакционный металл.
Реакции с кислотами – Неметаллы обычно не реагируют с кислотами, но металлы реагируют с кислотами и выделяют газообразный водород, который горит с хлопком. Медь не реагирует с разбавленной соляной кислотой даже при нагревании, но легко реагирует с серной кислотой. Металлы реагируют с кислотами с образованием солей металлов и газообразного водорода.
Металлы реагируют с кислотами с образованием солей металлов и газообразного водорода.
Реакции с основаниями — Как и прежде, хлопающий звук указывает на присутствие газообразного водорода, и металлы реагируют с гидроксидом натрия с образованием газообразного водорода. Реакции неметаллов с основаниями намного сложнее. Итак, мы обнаружили, что некоторые металлы реагируют с основаниями с образованием газообразного водорода.
Реакции замещения – Один металл вытесняет другой металл из его соединения в водных растворах. Цинк вытесняет медь из медного купороса, поэтому синяя окраска медного купороса исчезает, а на дне стакана откладывается порошкообразная красная масса меди.
Для облегчения понимания его можно представить следующей формулой: сульфат меди (CuSO4) + цинк (Zn) (синий) → сульфат цинка (ZnSO4) + медь (Cu) (бесцветный) (красный). Цинк может заменить медь, но медь не может заменить цинк, потому что более активный металл может заменить менее активный металл, но менее активный металл не может заменить более активный металл. Это правило применяется в этих реакциях, поскольку цинк более реакционноспособен, он может вытеснять медь, но наоборот не может произойти.
Это правило применяется в этих реакциях, поскольку цинк более реакционноспособен, он может вытеснять медь, но наоборот не может произойти.
Горение пламени, класс 8. Учебные заметки
Использование металлов и неметаллов
Металлы и неметаллы используются в различных вещах, которые мы используем в повседневной жизни, и теперь вы сможете идентифицировать их после изучения их. Металлы обычно используются в производстве машин, автомобилей, самолетов, поездов, спутников, промышленных устройств, кухонной утвари, водогрейных котлов и т. д., потому что свойства, которыми они обладают, подходят для использования в этих вещах.
Неметаллы, такие как воздух, необходимы для нашей жизни, который все живые существа вдыхают во время дыхания, дерево используется в мебели, бумага используется в книгах и так много других неметаллов, которые мы используем в нашей повседневной жизни, которые вы можете легко идентифицировать. самостоятельно.
Читайте также: Уголь и нефть класса 8 Примечания
Часто задаваемые вопросы о материалах класса 8 Металлы и неметаллыЧто такое металлы класса 8?
Металлы – это материалы, которые являются твердыми, блестящими, ковкими, пластичными, звучными и хорошо проводят тепло и электричество.