Степень коррозии металла: ГОСТ 9.908-85* «Единая система защиты от коррозии и старения. Металлы и сплавы.Методы определения показателей коррозии и коррозионной стойкости»
alexxlab | 01.03.2023 | 0 | Разное
Изучение влияния среды на степень коррозии металлов
муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа № 58
Научно-практическая конференция учащихся
«Я исследую мир»
Опытно – экспериментальная работа на тему:
«Изучение влияния среды
на степень коррозии металлов»
Выполнил
Шепилев Марк,
ученик 9 «А» класса
Руководитель
Павленко Светлана
Константиновна,
учитель химии
МБОУ СОШ № 58 г.
Пенза 2015
Содержание
Введение……………………………………………………………………………..3
Глава 1. История изучения коррозии металлов……………………………………5
1.1 Современное понятие о коррозии……………………………………………..6
1.2 Виды коррозии………………………………………………………………….7
Глава 2. Экспериментальные исследования…………………………………………10
2.1 Изучение зависимости скорости коррозии
от присутствия кислорода ……………………………………………………..10
2.2 Изучение влияния электролитов на процесс коррозии……………………….11
2.3 Изучение влияния ингибиторов на процесс коррозии………………………..13
2.4 Экспериментальная часть по созданию «шиферного гвоздя»………………..14
Заключение…………………………………………………………………………..16
Список использованной литературы……………………………………………….17
Приложение…………………………………………………………………. …………18
…………18
Введение
Жизнь человека без металлов невозможна. Лучше всего об этом написал Сычев А.П. и Фадеев Г.Н. в своей книге «Химия металлов»: [4]
«Странно представить себе
в наше время, что люди когда-то могли обходиться без металлов. Допустите на
минуту, что металлы вдруг исчезли из употребления. Пустынный и страшный мир
откроется перед вами. Опустели улицы городов и сел – не стало машин. Вид самих
улиц ужасен. Они завалены обломками бывших железобетонных зданий, мостов. Не
мчатся по рельсам поезда, а в небе не раздается гул моторов.
Потери от коррозии
колоссальны. Каждая шестая домна работает лишь для того, чтобы восполнить
потери металлов, «съеденных» ржавчиной. Но вред, наносимый коррозией, не
сводится только к потере металла вследствие его разрушения (прямые потери),
больший вред наносят косвенные потери. Гибнет труд людей, затраченный на
обработку металла и создание тех или иных машин и механизмов. Кроме того,
немало труда приходится затратить, чтобы заменить «изъеденные» коррозией детали
новыми. Например, для замены проржавевших под землей водопроводных труб
приходится копать глубокие траншеи. В городе для этого надо сначала взломать
асфальт, который лишь иногда лишь недавно был уложен. Чтобы сменить детали,
например, химических или нефтехимических аппаратов, приходится останавливать
производство, а вынужденная остановка даже на сутки обходится большими потерями
готовой продукции. При коррозии загрязняется окружающая среда (например, за
счет утечки газа, нефти), может произойти снижение качества или порча
выпускаемой продукции и т.д. Таким образом, потери от коррозии в сотни раз
превосходят стоимость металла. [1,3]
Но вред, наносимый коррозией, не
сводится только к потере металла вследствие его разрушения (прямые потери),
больший вред наносят косвенные потери. Гибнет труд людей, затраченный на
обработку металла и создание тех или иных машин и механизмов. Кроме того,
немало труда приходится затратить, чтобы заменить «изъеденные» коррозией детали
новыми. Например, для замены проржавевших под землей водопроводных труб
приходится копать глубокие траншеи. В городе для этого надо сначала взломать
асфальт, который лишь иногда лишь недавно был уложен. Чтобы сменить детали,
например, химических или нефтехимических аппаратов, приходится останавливать
производство, а вынужденная остановка даже на сутки обходится большими потерями
готовой продукции. При коррозии загрязняется окружающая среда (например, за
счет утечки газа, нефти), может произойти снижение качества или порча
выпускаемой продукции и т.д. Таким образом, потери от коррозии в сотни раз
превосходят стоимость металла. [1,3]
Актуальность: в промышленно развитых странах
коррозия металлов наносит существенный ущерб экономике каждого государства,
поэтому данные вопросы играют немаловажную роль как в быту, так
и в масштабах целого государства. Проблема коррозии металла сопровождает человека с того самого
момента, как человек научился изготавливать из металла предметы и орудия труда. Каждая шестая домна работает лишь для того, чтобы восполнить
потери металлов, «съеденных» ржавчиной.
Проблема коррозии металла сопровождает человека с того самого
момента, как человек научился изготавливать из металла предметы и орудия труда. Каждая шестая домна работает лишь для того, чтобы восполнить
потери металлов, «съеденных» ржавчиной.
Гипотеза: при помещении железа в щелочную среду скорость коррозии уменьшится.
Новизна: в ходе проведения эксперимента выяснили, что железо в контакте с алюминием, как более активным металлом, коррозии практически не подвергается. Это позволило нам изготовить «шиферный гвоздь» гвоздь, более устойчивый к коррозии во внешней среде.
Объект исследования: железные гвозди
Предмет исследования: влияние условий на степень коррозии железа
Площадка проведения эксперимента: лаборатория МБОУ СОШ № 58 города Пензы.
Цель: исследовать действие факторов окружающей среды на степень коррозии железа.
Задачи:
1. Изучить сущность коррозии, её виды и способы защиты от коррозии.
2. Исследовать зависимость скорости
коррозии от присутствия кислорода .
Исследовать зависимость скорости
коррозии от присутствия кислорода .
3.Исследовать влияние электролитов на процесс коррозии.
4.Исследовать влияние ингибиторов на процесс коррозии.
5. Изготовить «шиферный» гвоздь, устойчивый к коррозии.
Глава 1. История изучения коррозии металлов.
Люди издавна интересовались вопросами защиты от коррозии. Древнегреческий историк Геродот (5 век до нашей эры) и древнеримский ученый Плиний Старший (1 век до нашей эры) упоминают о применении олова для защиты железа от ржавчины.
Средневековые алхимики мечтали о получении
нержавеющего железа. Уже в двадцатых годах 19 века электролитическую коррозию
изучают Г. Дэви и М. Фарадей. С тех пор во многих странах мира было выполнено
очень много работ по коррозии различных металлических материалов. Однако
правильной, научно обоснованной теории электрохимической коррозии не было.
Существовала лишь теория, выдвинутая в 1830 году швейцарским ученым Де ла
Ривом, оказавшаяся неверной, согласно которой подвергаться коррозии может лишь
такой материал, в котором есть инородные включения. В начале тридцатых годов 20
века, советский ученый Фрумкин А.Н., изучая амальгамы металлов, показал, что
активный металл амальгамы растворяется в кислотах, хотя амальгама – это однородное
вещество.
Уже в двадцатых годах 19 века электролитическую коррозию
изучают Г. Дэви и М. Фарадей. С тех пор во многих странах мира было выполнено
очень много работ по коррозии различных металлических материалов. Однако
правильной, научно обоснованной теории электрохимической коррозии не было.
Существовала лишь теория, выдвинутая в 1830 году швейцарским ученым Де ла
Ривом, оказавшаяся неверной, согласно которой подвергаться коррозии может лишь
такой материал, в котором есть инородные включения. В начале тридцатых годов 20
века, советский ученый Фрумкин А.Н., изучая амальгамы металлов, показал, что
активный металл амальгамы растворяется в кислотах, хотя амальгама – это однородное
вещество.
В 1935 году А.И. Шултин объяснил коррозию как
индивидуальных металлов, так и сплавов. Он рассмотрел механизм протекания
процесса коррозии и факторы, влияющие на его скорость. В том же 1935 году Я.В.
Дурдин так же высказал обоснованную им мысль о растворении металлов в кислотах
без наличия инородных включений в них.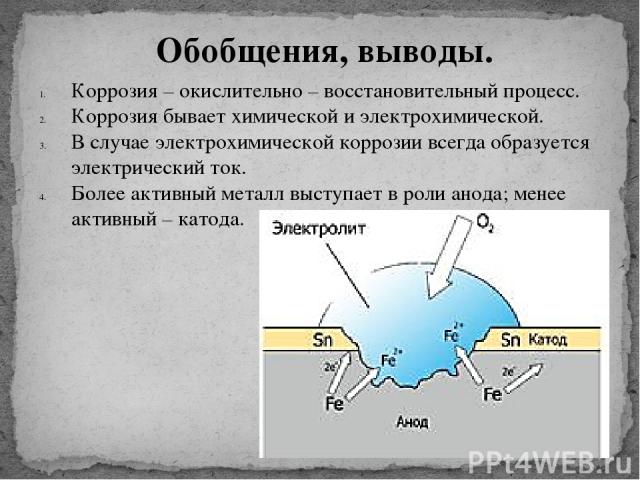
1.1 Современное понятие о коррозии.
Коррозия (от латинского слова «коррозио» – разъедание) – это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой.
Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде:
В
повседневной жизни для сплавов железа (сталей) чаще используют термин «ржавление». Менее известны случаи коррозии полимеров. Применительно к ним существует понятие «старение»,
аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных
осадков, а также биологическая коррозия.
Скорость коррозии, как и всякой химической реакции, очень сильно зависит от
температуры. Повышение температуры на 100 градусов может увеличить скорость
коррозии на несколько порядков. [4]
Менее известны случаи коррозии полимеров. Применительно к ним существует понятие «старение»,
аналогичное термину «коррозия» для металлов. Например, старение резины из-за взаимодействия с кислородом воздуха или разрушение некоторых пластиков под воздействием атмосферных
осадков, а также биологическая коррозия.
Скорость коррозии, как и всякой химической реакции, очень сильно зависит от
температуры. Повышение температуры на 100 градусов может увеличить скорость
коррозии на несколько порядков. [4]
1.2 Виды коррозии
Химическая коррозия протекает
в сухих газах (газовая коррозия) при повышенных температурах и не
сопровождается возникновением электрического тока. Она протекает по механизму
гетерогенных реакций. Газовой коррозии подвергаются металлы при
термической обработке (ковка, прокат), детали двигателей внутреннего сгорания,
арматура печей и т.д.
Она протекает по механизму
гетерогенных реакций. Газовой коррозии подвергаются металлы при
термической обработке (ковка, прокат), детали двигателей внутреннего сгорания,
арматура печей и т.д.
При химической коррозии идет окисление металла без возникновения цепи электрического тока:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3),
4Al + 3O2 = 2Al2O3.
Для поверхности алюминия этот процесс благоприятен, т.к. оксидная пленка плотно прилегает к поверхности металла и нет дальнейшего допуска кислорода к металлу. [2]
Отличительной особенностью химической
коррозии является то, что продукты коррозии (например, оксидные пленки) носят
первичный характер, то есть образуются непосредственно в местах соприкосновения
метала с агрессивной средой. Поэтому скорость коррозионного процесса
определяется не только природой металла, но и свойствами образовавшихся
оксидных пленок. Например, на поверхности щелочных и щелочно-земельных металлов
в процессе окисления кислородом воздуха образуются толстые, рыхлые оксидные
пленки, через которые свободно проникает кислород, поэтому они не защищают
металл от разрушения. А на поверхности цинка, алюминия, никеля, хрома и других
металлов формируются тонкие, эластичные и сплошные оксидные пленки, которые
изолируют металл от контакта с агрессивной средой. Именно эти металлы применяют
в качестве легирующих добавок к стали (для повышения жаростойкости сплавов) и
для нанесения защитных покрытий на изделия, работающие в условиях газовой
коррозии.
Например, на поверхности щелочных и щелочно-земельных металлов
в процессе окисления кислородом воздуха образуются толстые, рыхлые оксидные
пленки, через которые свободно проникает кислород, поэтому они не защищают
металл от разрушения. А на поверхности цинка, алюминия, никеля, хрома и других
металлов формируются тонкие, эластичные и сплошные оксидные пленки, которые
изолируют металл от контакта с агрессивной средой. Именно эти металлы применяют
в качестве легирующих добавок к стали (для повышения жаростойкости сплавов) и
для нанесения защитных покрытий на изделия, работающие в условиях газовой
коррозии.
Химическая коррозия протекает не только в сухих газах, но и в неэлектролитах (бензин, керосин, сероуглерод и т.д.). Например, коррозия бензобаков, нефтепроводов, нефтехимического оборудования.
Электрохимическая коррозия протекает в
растворах электролитов (кислоты, основания, соли, морская и речная вода,
влажная почва, атмосфера любого влажного газа) и сопровождается
возникновением электрического ток. Для возникновения электрохимической коррозии нужно наличие кислорода и
воды. Она протекает по механизму гальванического элемента.
Для возникновения электрохимической коррозии нужно наличие кислорода и
воды. Она протекает по механизму гальванического элемента.
Рассмотрим случай, когда контакта металлов нет, причем металл (железо) находится в воздухе.[4] Некоторые участки поверхности железа служат анодом, на котором происходит его окисление
Fe (тв.) = Fe2+ (водн.) + 2e
Образующиеся при этом электроны перемещаются по металлу к другим участкам поверхности, которые играют роль катода. На них происходит восстановление кислорода:
O2 (г.) + 4H+ (водн.) + 4e = 2H2O (ж.), См. приложение (рис. 1)
В процессе коррозии образующиеся на аноде ионы Fe2+ окисляются до Fe3+ :
4Fe2+ (водн.) + O2 (г.) + (2n + 4)H2O (ж.) = 2Fe2O3•nH2O (тв.) + 8H+ (водн.).
Поскольку роль катода
обычно играет та часть поверхности, которая лучше всего обеспечена притоком
кислорода, ржавчина чаще всего появляется именно на этих участках. Если вы
внимательно осмотрите лопату, простоявшую некоторое время на открытом воздухе с
налипшей на лезвии грязью, то заметите, что под грязью на поверхности металла
образовались углубления, а ржавчина появилась повсюду, куда мог проникнуть О2.
Если вы
внимательно осмотрите лопату, простоявшую некоторое время на открытом воздухе с
налипшей на лезвии грязью, то заметите, что под грязью на поверхности металла
образовались углубления, а ржавчина появилась повсюду, куда мог проникнуть О2.
Рассмотрим контакт двух металлов на примере олова и железа. [3,4] Железо часто покрывают другим металлом, например оловом, цинком или хромом, чтобы защитить от коррозии. Так называемую «белую жесть» получают, покрывая тонким слоем олова листовое железо. Олово защищает железо до тех пор, пока защитный слой остается неповрежденным. Стоит его повредить, как на железо начинают воздействовать воздух и влага, олово даже ускоряет процесс коррозии, потому что служит катодом в электрохимическом процессе. Сравнение окислительных электродных потенциалов железа и олова показывает, что железо окисляется легче олова:
Fe (тв.) = Fe2+ (водн.) + 2e
Sn (тв.) = Sn2+ (водн.) + 2e,
Поэтому железо служит в этом случае анодом и окисляется. См. приложение (рис 2).
См. приложение (рис 2).
Оцинкованное железо получают, покрывая его тонким слоем цинка. Цинк защищает железо от коррозии даже после нарушения целостности покрытия. В этом случае железо в процессе коррозии играет роль катода, потому что цинк окисляется легче железа. См. приложение (рис. 3):
Zn (тв.) = Zn2+ (водн.) + 2e
Следовательно, цинк играет роль анода и корродирует вместо железа.
При электрохимической коррозии в отличие от химической, продукты коррозии (осадки в нейтральных средах) образуются за счет вторичных процессов, то есть они образуются не непосредственно на поверхности корродирующего металла, а в объеме раствора, поэтому обладают более низкими защитными свойствами, чем первичные пленки, образующиеся на поверхности металла при химической коррозии.
Глава 2. Экспериментальные исследования.
Экспериментальные исследования.
В нашей работе для экспериментальных исследований в качестве объекта коррозии были взяты железные гвозди.
2.1 Изучение зависимости скорости коррозии от присутствия кислорода [5]
В три пробирки поместили по одному железному гвоздю. В первую пробирку добавили воды так, чтобы гвоздь оказался покрытым наполовину. Во вторую пробирку добавили воды так, чтобы гвоздь целиком был погружен в воду. В третьей пробирке гвоздь целиком погружен в воду, а сверху дополнительно добавляем слой растительного масла.
Через 5 дней получили следующие результаты:
Наибольшее количество ржавчины образовалось в пробирке №1, где железо соприкасалось и с водой и с кислородом. В пробирке № 2 ржавчины меньше т. к. железо соприкасалось только с водой. В пробирке № 3 гвоздь почти не проржавел, кислород не смог пройти через слой масла.
Уравнения химических реакций:
А(-): Fe – 2e →Fe+2
К(+): О2+ 2Н2О+ 4е → 4ОН—
Fe+2 + 2ОН— → Fe(ОН)2
4Fe(ОН)2 + 2Н2О + О2 → 4 Fe(ОН)3
Вывод: с наибольшей скоростью
коррозия протекает в присутствии кислорода. Кислород в роли сильного
деполяризатора стимулирует коррозию железа, увеличивая скорость ее за счет
активации катодного процесса. Если доступ
кислорода ограничен (использован слой масла на поверхности воды), то процесс
коррозии незначителен.
Кислород в роли сильного
деполяризатора стимулирует коррозию железа, увеличивая скорость ее за счет
активации катодного процесса. Если доступ
кислорода ограничен (использован слой масла на поверхности воды), то процесс
коррозии незначителен.
2.2 Изучение влияния электролитов на процесс коррозии железа.
В четыре химических стакана поместили по железному гвоздю. В первый стакан налили чистой воды так, чтобы вода покрывала половину гвоздя. Во второй стакан налили р-р NaCl. В третий стакан поместили гвоздь, обмотанный алюминиевой проволокой, и налили р-р NaCl. В четвертый стакан поместили гвоздь, обмотанный медной проволокой, и налили р-р NaCl. [5]
Через 5 дней получили следующие результаты:
в стакане № 1наблюдается
незначительное количество ржавчины. В данном случае мы наблюдаем химическую
коррозию. В стакане № 2 ржавчины намного больше, следовательно хлорид ионы
увеличивают скорость коррозии. В стакане №3 тоже наблюдаем коррозию, но не железа,
а алюминия, так как железо в контакте с более активным металлом в сильно
коррозионной среде – NaCl не корродирует до тех пор, пока не прокорродирует
весь алюминий. В стакане № 4 -скорость коррозии очень велика, образовалось
много ржавчины.
В стакане №3 тоже наблюдаем коррозию, но не железа,
а алюминия, так как железо в контакте с более активным металлом в сильно
коррозионной среде – NaCl не корродирует до тех пор, пока не прокорродирует
весь алюминий. В стакане № 4 -скорость коррозии очень велика, образовалось
много ржавчины.
Вывод: в чистой воде коррозия идет
медленно, т.к вода слабый электролит. В данном случае мы наблюдаем химическую
коррозию. Присутствие электролита значительно увеличивает скорость коррозии.
При соприкосновении железа с другими металлами возникает гальванический элемент,
при этом более активный металл будет выступать в роли анода и будет окисляться
(разрушаться), менее активный металл будет катодом, и на нем будет происходить
кислородная деполяризация. При контакте железа с более активным металлом
(алюминием) само железо не разрушается, а окисляется более активный металл. При
контакте железа с менее активным металлом (медью), железо будет подвергаться
разрушению и скорость коррозии при этом сильно возрастет. В стаканах 3 и 4 наблюдается процесс электрохимической коррозии.
В стаканах 3 и 4 наблюдается процесс электрохимической коррозии.
Уравнения химических реакций: [6]
В стаканах № 1 и 2:
А(-): Fe – 2e →Fe+2
К(+): О2+ 2Н2О+ 4е → 4ОН—
Fe+2 + 2ОН— → Fe(ОН)2
4Fe(ОН)2 + 2Н2О + О2 → 4 Fe(ОН)3
В стакане № 3:
А(-): Al – 3е → Al+3
К(+): О2+ 2Н2О+ 4е → 4ОН—
Al+3 + 3ОН— → Al(ОН)3
В стакане № 4:
А—( Fe): Fe – 2e →Fe+2
К+(Cu): О2+ 2Н2О+ 4е → 4ОН—
Fe+2 + 2ОН— → Fe(ОН)2
4Fe(ОН)2 + 2Н2О + О2 → 4 Fe(ОН)3
2. 3 Изучение
влияния ингибиторов на процесс коррозии. [5,6]
3 Изучение
влияния ингибиторов на процесс коррозии. [5,6]
В три пробирки поместили по одному железному гвоздю. В первую пробирку налили NaOH и прилили р-р NaCl . Во вторую пробирку налили Na3PO4 и прилили р-р NaCl. В третью пробирку налили K2Cr2O7 и прилили р-р NaCl. Растворы налили так, чтобы гвозди находились полностью в растворах.
Через 5 дней получили следующие результаты:
Уравнения химических реакций:
А(-) Fe – 2e →Fe+2
К(+)О2+ 2Н2О+ 4е → 4ОН—
2Fe + 2H2O + O2 = 2Fe(OH)2
4Fe(ОН)2 + 2Н2О + О2 → 4 Fe(ОН)3
Cr2O72- +2OH– = 2CrO 42- +H2O
Вывод: в первых двух пробирках процесс коррозии железа не наблюдается,
т. к. ингибитор замедляет коррозию. В третьей пробирке имеет место коррозия, но
скорость разрушения металла очень мала. Поскольку в процессе коррозии
образуются в небольшом количестве OH- , то наблюдаем переход дихромата в хромат
и изменение окраски раствора.
к. ингибитор замедляет коррозию. В третьей пробирке имеет место коррозия, но
скорость разрушения металла очень мала. Поскольку в процессе коррозии
образуются в небольшом количестве OH- , то наблюдаем переход дихромата в хромат
и изменение окраски раствора.
Экспериментальная часть по созданию «шиферного» гвоздя, более устойчивого к процессу коррозии в атмосфере.
На основании изучения теоретического материала и выполнения экспериментальной части работы, мы попытались создать «шиферный гвоздь» более устойчивый к процессу коррозии в атмосфере.
Оборудование: железный гвоздь, паяльник, алюминий листовой, флюс для пайки алюминия, дрель, ножницы по металлу.
«Шиферный» гвоздь создан на основе железного гвоздя. При этом к
шляпке железного гвоздя припаиваются алюминиевые пластинки, которые значительно
увеличивают ее площадь. Данный вид гвоздя может быть использован при монтаже
кровли и, в частности, шиферной.
Изучение влияния электролитов на процесс коррозии «шиферного» гвоздя.
В 3 химических стакана поместили по изготовленному «шиферному» гвоздю. В первый стакан прилили чистой воды так, чтобы вода покрывала гвоздь наполовину. Во второй стакан прилили раствор NaCl, а в третий стакан к гвоздю прилили раствор Na3PO4.
Через 5 дней получили следующие результаты:
Уравнения химических реакций:
А(-): Al – 3е → Al+3
К(+): О2+ 2Н2О+ 4е → 4ОН—
Al+3 + 3ОН— → Al(ОН)3
Вывод: во всех трех
химических стаканах коррозии самого гвоздя не наблюдается. В стаканах № 1 и 2
корродирует алюминий как более активный металл. Наибольшая степень его коррозии
в стакане № 2 с р-ром NaCl. В стакане № 3 с раствором Na3PO4 по-прежнему наблюдается
ингибирование данного процесса. Таким образом, «шиферный» гвоздь оказался более
устойчивым к процессу коррозии по сравнению с обычным гвоздем. Его устойчивость
будет сохраняться до тех пор, пока не прокорродирует весь алюминий.
Его устойчивость
будет сохраняться до тех пор, пока не прокорродирует весь алюминий.
Заключение.
Для достоверности полученных результатов, в своей работе мы не стали ограничиваться только исследованием влияния кислорода на степень протекания коррозии, но и провели ряд дополнительных экспериментов, указанных в работе.
Согласно гипотезе, выдвинутой перед началом данного
исследования, скорость коррозии железа уменьшается при погружении его в
щелочную среду. Данная гипотеза полностью нашла свое подтверждение в ходе
экспериментальных исследований данной работы. На основании данных исследований
мы смогли сделать следующие общие выводы:
Данная гипотеза полностью нашла свое подтверждение в ходе
экспериментальных исследований данной работы. На основании данных исследований
мы смогли сделать следующие общие выводы:
● коррозия железа резко усиливается в присутствии кислорода.
● коррозия железа усиливается, если железо соприкасается с менее активным металлом.
● скорость коррозии зависит от состава омывающей металл среды, хлорид ионы усиливают коррозию железа.
● коррозия железа ослабляется в присутствии гидроксид-, фосфат-, хромат -ионов.
Подводя итог своей работы, в ходе проведенного эксперимента, можно выделить следующие способы защиты металлов от коррозии:
1. Применение защитных покрытий.
а) Металлические изделия покрывают лаками, красками, эмалями.
б) металлические изделия покрывают другими металлами. В качестве металлов для покрытия применяют металлы, образующие на своей поверхности защитные пленки. К таким металлам относятся хром, никель цинк, олово и другие.
2. Приготовление сплавов стойких к коррозии части машин,
инструменты и предметы быта изготовляют из нержавеющей стали и других сплавов,
стойких к коррозии. В сплав вводят хром, никель, кремлей, кобальт, алюминий.
Приготовление сплавов стойких к коррозии части машин,
инструменты и предметы быта изготовляют из нержавеющей стали и других сплавов,
стойких к коррозии. В сплав вводят хром, никель, кремлей, кобальт, алюминий.
3. Электрохимические методы защиты.
а) применение заклепок изготовленных из более активных металлов.
б) Прикрепление пластинок из более активного металла для защиты основного металлического изделия. Например в паре Zn-Fe (оцинкованное железо) защищено железо, в паре Sn-Cu защищена медь и т. д.
К днищам кораблей прикрепляют протекторы -слитки более активного металла, чем обшивка днища корабля-это протекторная защита с помощью цинка (анодная защита) Катодная защита – защита менее активным металлом (лужёное железо)Особые требования – не допускать разрушении целостности покрытия.
4. Добавление ингибиторов. Использование замедлителей коррозии (органические, неорганические вещества)
Список использованной
литературы.
- Сюгаев А.В., Ломаева С.Ф., Шуравин А.С. и др. // Коррозия: защита, материалы. 2007. № 1. С. 2
- Шевченко А.А.- Химическое сопротивление неметаллических материалов и защита от коррозии. Учебное пособие. Химия, КОЛОСС; 2004 г.; 248 стр.
3. Семенова И.В., Флорианович Г.М., Хорошилов А.В. Коррозия и защита от коррозии. 2002 год. 335 стр.
4. В.В. Экилик. Электрохимические методы защиты металлов. Методическое пособие по спецкурсу. 2004 год. 50 стр.
5. Кофанова. Коррозия и защита металлов. Уч. пособие. 2003 год.
6. Мезенин Н. Занимательно о железе. М., 1985г.
Приложение
Рис. 1.
1.
Схема электрохимической коррозии железа
без контакта с другими металлами
Рис. 2.
Схема электрохимической коррозии
при контакте железа и олова
Рис. 3.
Схема электрохимической коррозии
при контакте железа и цинка
Определение – степень – коррозия
Cтраница 1
| Приспособление для определения коррозии по краю. [1] |
Определение степени коррозии по краю проводят на четырех образцах материала, с предварительно полностью вытравленной фольгой, размером 25×24 мм. Для испытания используют край среза диэлектрика, который дэ-ет. [2]
Для определения степени коррозии меркаптанами внутренних стенок стальных резервуаров, в которых длительно хранится топливо, со дна были собраны отложения и выполнено их исследование. [3]
[3]
| Влажная камера конструкции. [4] |
При определении степени коррозии металлов пользуются как весовыми, так и объемными методами. В первом случае собирают и взвешивают продукты коррозии, во втором измеряют объем выделяющегося водорода или поглощенного кислорода. [5]
Наиболее простые и широко распространенные методы оценки защитных свойств смазок основаны на определении степени коррозии металлических пластинок ( цилиндриков), покрытых слоем испытуемой смазки и выдерживаемых в заданных условиях испытания. Стандартный метод ( ГОСТ 4699 – 53) предусматривает использование металлических шлифованных пластинок одного типа с применяемыми при оценке антикоррозионных свойств. [6]
Предназначен для определения коррозийности минеральных масел по методу Пинкевича, а также для выявления динамики коррозийной агрессивности масла во времени, установки потенциальной коррозийности смазочных масел, определения степени коррозии данного металла данным маслом и антикоррозийной эффективности тех или иных присадок на масле. [7]
[7]
Метод оценки коррозии по удлинению числа загибов или угла загиба ( для менее пластичных металлов) после коррозии связан с эффектом надреза вследствие образования литтингов или межкри-сталлитной коррозии и чаще ВСЕГО используется при определении степени межкрисгаллитной коррозии. Способ применяют при испытании легких сплавов и оценке охрупчивания материала, связанного с наводороживанием. [8]
Исследуемые образцы известное время находятся в камере. Определение степени коррозии ведется визуальным, гравиметрическим и другими методами. [9]
Испытание г о т о в ы х и з д е-лий в натуре является самым совершенным видом испытаний на коррозию. Основным методом определения степени коррозии при этом способе испытания является точная фиксация наблюдаемых изменений процесса корозии. [10]
Системы аварийной остановки на нефтяных и газовых платформах используют различные приборы и мониторы для выявления протечек, пожаров, прорывов и других опасных ситуаций, включают тревогу и останавливают работы в запланированной логической последовательности. Там, где это необходимо в силу естественных свойств сырой нефти или газа, для определения степени коррозии трубопровода, труб нагревательной установки, технологических обрабатывающих установок и резервуаров, использующихся при добыче и переработке сырой нефти, конденсата и газа, должны использоваться недеструктивные методы анализа. К ним относятся ультразвуковой и рентгеновский методы, метод магнитных частиц, метод контроля посредством жидкости с красителем или визуальная проверка.
[11]
Там, где это необходимо в силу естественных свойств сырой нефти или газа, для определения степени коррозии трубопровода, труб нагревательной установки, технологических обрабатывающих установок и резервуаров, использующихся при добыче и переработке сырой нефти, конденсата и газа, должны использоваться недеструктивные методы анализа. К ним относятся ультразвуковой и рентгеновский методы, метод магнитных частиц, метод контроля посредством жидкости с красителем или визуальная проверка.
[11]
Тарнопол и Юнге61 изучали коррозию зеркального стекла под действием сильных щелочей. Они установили, что гидроокиси натрия и калия оказывают меньшее коррозионное воздействие, чем карбонаты и пирофосфаты. Определение степени коррозии только по шероховатости поверхности стекла ненадежно для количественной оценки, так как, несмотря на высокую коррозионную способность, пирофосфаты вызывают лишь слабую матовость стекла. Вообще соли натрия оказывают большее воздействие, чем соли калия. Тарнопол и Юнге наблюдали, что коррозия в зависимости от концентрации щелочей имеет максимум. С), действуя короткое время, существенно изменяют адсорбционную способность мягкого стекла или стекла пирекс.
[12]
Тарнопол и Юнге наблюдали, что коррозия в зависимости от концентрации щелочей имеет максимум. С), действуя короткое время, существенно изменяют адсорбционную способность мягкого стекла или стекла пирекс.
[12]
| Влияние условий регенерации диэтиленгликоля на его термическое разложение. [13] |
Результаты исследований приведены в табл. 7.6. Снижение кислотности растворов диэтиленгликоля при нагревании можно объяснить появлением продуктов термического разложения и окисления – альдегидов и низкомолекулярных кислот. Для изучения коррозионной активности диэтиленгликоля были проведены опыты по определению степени пароконденсатной коррозии при нагревании диэтиленгликоля. Таким образом, диэтиленгликоль в атмосфере азота при 175 С практически не окисляется. [14]
До сих пор коррозионные гальванические микро – и макропары мы рассматривали преимущественно сточки зрения законов термодинамики. Однако этого недостаточно для решения многих вопросов. Во-первых, при термодинамических расчетах трудно предусмотреть сложное влияние среды, которая зачастую играет решающую роль в определении степени коррозии металла. Во-вторых, с помощью термодинамики принципиально невозможно вычислить скорость коррозионных процессов, определяющих долговечность конкретных сооружений и сроки их ремонта.
[15]
Однако этого недостаточно для решения многих вопросов. Во-первых, при термодинамических расчетах трудно предусмотреть сложное влияние среды, которая зачастую играет решающую роль в определении степени коррозии металла. Во-вторых, с помощью термодинамики принципиально невозможно вычислить скорость коррозионных процессов, определяющих долговечность конкретных сооружений и сроки их ремонта.
[15]
Страницы: 1 2
Скорость коррозии стали в… | Американская ассоциация гальванистов
Дом ” Коррозия » Процесс коррозии металла » Скорость коррозии
Приблизительно 85% всей производимой стали представляет собой углеродистую сталь и поэтому подвержена естественному окислению и гальванической коррозии. Скорость коррозии хорошо известна в типичных атмосферных условиях, но инженер-конструктор должен хорошо понимать точные локальные условия или условия микроокружения, чтобы быть уверенным в конечной долговечности конструкции. Другие микросреды включают воздействие пресной и соленой воды (в или очень близко) или в почве.
Другие микросреды включают воздействие пресной и соленой воды (в или очень близко) или в почве.
Коррозия углеродистой стали и даже легированных сталей в микросреде может быть очень сложной. Например, pH, содержание влаги и уровень хлоридов — это всего лишь три переменных, определяющих скорость коррозии оцинкованной стали в почве.
Карты коррозии трудно разработать из-за множества переменных, присутствующих в любой данной микросреде. Например, коррозия в воде должна учитывать такие факторы, как содержание кислорода, степень волнения, воздействие волн, температура, уровень хлоридов и многое другое. Это делает разработку диаграммы, предсказывающей скорость коррозии для любого конкретного места, обширной и иногда дорогостоящей, и поэтому существует множество диаграмм скорости коррозии, но только для уникальных мест и условий.
Немного подробнее о скорости коррозии стали в различных средах.
Атмосферный
Наиболее распространенной средой для коррозии металлов является атмосферный воздух. Когда сталь, медь, магний, алюминий и др. подвергаются воздействию атмосферы, они вступают в реакцию со свободно текущим воздухом и влагой с образованием оксидов. Характеристики металлов, подвергающихся воздействию атмосферы, зависят от пяти основных факторов: температуры, влажности, количества осадков, концентрации диоксида серы (загрязнения) в воздухе и солености воздуха. Ни один из этих факторов нельзя выделить в качестве основного фактора коррозии. Были проведены обширные исследования этих металлов, и для каждого доступна предсказуемая скорость коррозии.
Когда сталь, медь, магний, алюминий и др. подвергаются воздействию атмосферы, они вступают в реакцию со свободно текущим воздухом и влагой с образованием оксидов. Характеристики металлов, подвергающихся воздействию атмосферы, зависят от пяти основных факторов: температуры, влажности, количества осадков, концентрации диоксида серы (загрязнения) в воздухе и солености воздуха. Ни один из этих факторов нельзя выделить в качестве основного фактора коррозии. Были проведены обширные исследования этих металлов, и для каждого доступна предсказуемая скорость коррозии.
Коррозия углеродистой стали возникает при относительной влажности воздуха от 70% до 80% и температуре воздуха выше 32 F. Скорость коррозии может быть ускорена примесями воздуха, которые растворяются в конденсированной воде или дождевой воде, а также пылью и грязью. оседание на металлическую поверхность.
Общие скорости коррозии углеродистой стали в различных атмосферах, и следует отметить, что скорости коррозии в микросредах могут значительно превышать эти скорости коррозии.
В почве
Сталь в почве подвергается ряду коррозионных воздействий, совершенно не похожих на те, которые испытываются в атмосферных условиях, и характеристики стали в земле не так хорошо изучены, как долговечность в наземных условиях. Поскольку в Северной Америке выявлено более 200 различных типов почв, скорость коррозии в почвах различна и ее трудно предсказать. Для коррозии стали требуются кислород, влага и присутствие растворенных солей. Если какой-либо из них отсутствует, коррозионная реакция прекратится или будет протекать очень медленно. Сталь быстро корродирует в кислой среде и медленно или совсем не корродирует при увеличении щелочности. Скорость коррозии стали в почве может варьироваться от менее 0,2 микрон в год в благоприятных условиях до 20 микрон в год и более в очень агрессивных почвах.
Коррозия металлов в почве чрезвычайно изменчива, и хотя почвенная среда сложна, можно сделать некоторые обобщения о типах почвы и коррозии. Основными факторами, определяющими коррозионную активность почвы, являются влажность, уровень pH и хлориды. На эти почвенные условия влияют дополнительные характеристики, такие как аэрация, температура, удельное сопротивление и текстура или размер частиц. Любая почва представляет собой очень неоднородный материал, состоящий из трех фаз: твердой, газообразной и водной.
На эти почвенные условия влияют дополнительные характеристики, такие как аэрация, температура, удельное сопротивление и текстура или размер частиц. Любая почва представляет собой очень неоднородный материал, состоящий из трех фаз: твердой, газообразной и водной.
Твердая фаза состоит из частиц почвы, которые различаются по размеру, химическому составу и уровню вовлеченного органического материала. Твердая фаза почв классифицируется по среднему размеру частиц и химическому составу. Традиционно частицы от 0,07 мм до 2 мм считаются песком, частицы от 0,0005 мм до 0,07 мм — илами, а 0,005 мм и меньше — глинами. Из-за меньшего размера частиц и их способности легко поглощать воду глинистые почвы имеют более высокую скорость коррозии, чем песчаные почвы.
Газообразная фаза состоит из воздуха, вовлеченного в поры почвы. Доступ газа (воздуха) в почву зависит от ее водопроницаемости. Более сухие почвы или более крупнозернистые почвы обеспечат больший доступ кислорода к недрам и увеличат скорость коррозии стали по сравнению с областями с меньшим содержанием кислорода.
Водная фаза, или почвенная влага, является средством, способствующим развитию коррозии. Относительная кислотность водного раствора является наиболее важным фактором скорости коррозии. При низком pH выделение водорода имеет тенденцию исключать возможность образования защитной пленки, поэтому коррозия стали продолжается, но в щелочных растворах образуются защитные пленки и снижают скорость коррозии. Чем выше щелочность, тем медленнее становится скорость атаки. В нейтральных растворах другие факторы, такие как аэрация, становятся более важными, поэтому делать обобщения труднее.
Менее распространенной средой для металла является погружение в воду или воздействие воды. Влага вызывает сильную коррозию большинства металлов, включая сталь, алюминий и цинк. Существует множество различных типов воды (чистая вода, природная пресная вода, питьевая вода (очищенная питьевая вода) и морская вода), и каждый из них имеет различные механизмы, определяющие скорость коррозии. Параметры, влияющие на коррозию металлов в воде, включают уровень pH, содержание кислорода, температуру воды, волнение, наличие ингибиторов и приливные условия.
Береговые зоны морской коррозии включают доки, гавани, военно-морские верфи, где могут использоваться расходуемые аноды, обеспечивающие катодную защиту, а также защитные покрытия, такие как судовые краски и цинкование. Морские нефтяные и газовые платформы подвергаются особенно агрессивной коррозии от брызг морской соли и погружения.
Трубопровод
В зависимости от характера перевозимого продукта, условий воздействия, условий эксплуатации (24 часа в сутки, 7 дней в неделю по сравнению со спорадическими) и необходимости технического обслуживания коррозия трубопровода может означать срок службы от одного года до более 50 лет. Северная Америка стоимость коррозии трубопровода составляет приблизительно 9 долларов США.миллиардов в год, при этом 10 % приходится на затраты в связи с отказом, 38 % — на требования к капиталу и 52 % — на эксплуатацию и техническое обслуживание.
Несмотря на то, что инвестиции в технологии и оборудование для мониторинга значительно увеличились за последние несколько лет, включая программы оценки рисков и управления целостностью трубопроводов, несколько громких отказов ставят под сомнение эффективность такой приверженности безопасности.
Одной из проблем, связанных с коррозией трубопровода, является то, что она обычно не начинается внутри трубы, что затрудняет ее обнаружение. В отрасли трубопроводов широко распространено менталитет ожидания, пока не произойдет сбой, чтобы исправить его. Это связано с тем, что стоимость внедрения эффективной инспекции, такой как умные свиньи, очень высока. Эта близорукая стратегия может сэкономить деньги в краткосрочной перспективе, но, безусловно, будет иметь более высокие издержки для окружающей среды и будущих требований к капиталу.
Коррозия конструкционной стали – SteelConstruction.info
Коррозия конструкционной стали представляет собой электрохимический процесс, требующий одновременного присутствия влаги и кислорода. По сути, железо в стали окисляется с образованием ржавчины, которая занимает примерно в шесть раз больше объема исходного материала. Скорость, с которой развивается процесс коррозии, зависит от ряда факторов, но главным образом от «микроклимата», непосредственно окружающего конструкцию.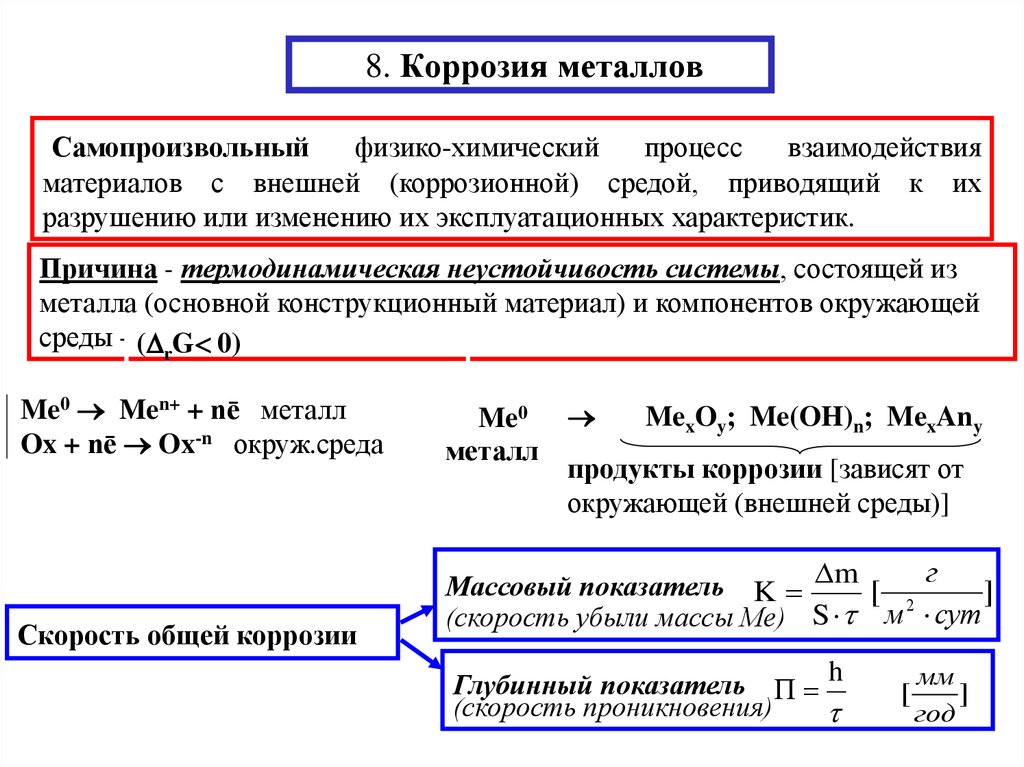
Схематическое изображение механизма коррозии стали
Содержание
- 1 Процесс коррозии
- 2 Локальная коррозия
- 2.1 Биметаллическая коррозия
- 2.1.1 Общая гальваническая серия
- 2.2 Точечная коррозия
- 2.3 Щелевая коррозия
- 2.1 Биметаллическая коррозия
- 3 Скорость коррозии
- 3.1 Время увлажнения
- 3.2 Загрязнение атмосферы
- 3.2.1 Сульфаты
- 3.2.2 Хлориды
- 4 Каталожные номера
- 5 ресурсов
- 6 Дальнейшее чтение
- 7 См. также
- 8 CPD
[наверх]Процесс коррозии
Коррозию стали можно рассматривать как электрохимический процесс, протекающий поэтапно. Начальная атака происходит на анодных участках поверхности, где ионы двухвалентного железа переходят в раствор. Электроны высвобождаются из анода и перемещаются через металлическую структуру к соседним катодным участкам на поверхности, где они соединяются с кислородом и водой, образуя гидроксильные ионы. Они реагируют с ионами двухвалентного железа из анода с образованием гидроксида двухвалентного железа, который сам окисляется на воздухе с образованием гидратированного оксида трехвалентного железа (т.е. красной ржавчины). Сумма этих реакций может быть представлена следующим уравнением:
Они реагируют с ионами двухвалентного железа из анода с образованием гидроксида двухвалентного железа, который сам окисляется на воздухе с образованием гидратированного оксида трехвалентного железа (т.е. красной ржавчины). Сумма этих реакций может быть представлена следующим уравнением:
Fe + 3O 2 + 2H 2 O = 2Fe 2 O 3 H 2 O
(Сталь) + (Кислород) + (Вода) = Гидратированный оксид железа
Однако через некоторое время эффекты поляризации, такие как рост продуктов коррозии на поверхности, замедляют процесс коррозии. Могут образовываться новые реакционноспособные анодные участки, что делает возможной дальнейшую коррозию. В этом случае в течение длительных периодов времени потеря металла достаточно равномерна по всей поверхности, и это обычно описывается как «общая коррозия». Схематическое изображение механизма коррозии показано (вверху справа).
Процесс коррозии требует одновременного присутствия воды и кислорода. При отсутствии того и другого коррозия не возникает.
При отсутствии того и другого коррозия не возникает.
[top]Локальная коррозия
Также могут возникать различные типы локальной коррозии, но они, как правило, не имеют существенного значения для металлоконструкций.
[top]Биметаллическая коррозия
Когда два разнородных металла соединяются вместе и находятся в контакте с электролитом, между ними проходит электрический ток, и на анодном металле возникает коррозия. Некоторые металлы (например, нержавеющая сталь) вызывают преимущественную коррозию низколегированной конструкционной стали, в то время как другие металлы (например, цинк) корродируют преимущественно сами, тем самым защищая низколегированную конструкционную сталь. Склонность разнородных металлов к биметаллической коррозии отчасти зависит от их соответствующего положения в гальваническом ряду. Чем дальше друг от друга два металла в ряду, тем больше тенденция.
Другим аспектом, влияющим на биметаллическую коррозию, является природа электролита. Биметаллическая коррозия наиболее серьезна для погружных или заглубленных конструкций, но и в менее агрессивных средах, т.е. опорные уголки из кирпича из нержавеющей стали, прикрепленные к конструкционным секциям из мягкой стали, воздействие на стальные секции минимально. В большинстве практических ситуаций, связанных со строительством или мостом, никаких особых мер предосторожности не требуется. В ситуациях повышенного риска следует использовать прокладки, втулки и аналогичные электроизоляционные материалы. В качестве альтернативы также эффективно нанесение подходящей системы окраски на собранный стык.
Биметаллическая коррозия наиболее серьезна для погружных или заглубленных конструкций, но и в менее агрессивных средах, т.е. опорные уголки из кирпича из нержавеющей стали, прикрепленные к конструкционным секциям из мягкой стали, воздействие на стальные секции минимально. В большинстве практических ситуаций, связанных со строительством или мостом, никаких особых мер предосторожности не требуется. В ситуациях повышенного риска следует использовать прокладки, втулки и аналогичные электроизоляционные материалы. В качестве альтернативы также эффективно нанесение подходящей системы окраски на собранный стык.
Склонность к биметаллической коррозии также зависит от относительной площади поверхности катодного и анодного металлов (A c / A a ). Проще говоря, чем больше соотношение A c / A a , тем больше склонность к биметаллической коррозии.
[вверх]Общая гальваническая серия
Анодный конец (Более подвержен коррозии)
- Магний
- Цинк
- Алюминий
- Углеродистая и низколегированная (конструкционная) сталь
- Чугун
- Свинец
- Олово
- Медь, латунь, бронза
- Никель (пассивный)
- Титан
- Нержавеющая сталь 430/304/316 (в пассивном состоянии)
Катодный конец (менее подвержен коррозии)
[вверх]Питтинговая коррозия
Поверхность стали с изъязвлениями
В некоторых случаях воздействие на первоначальную область анодирования не подавляется и продолжается глубоко в металле, образуя коррозионную язву. Точечная коррозия чаще возникает у низколегированных конструкционных сталей, находящихся в постоянно влажных условиях или зарытых в почву, а не на воздухе. Следовательно, точечная коррозия редко встречается на типичных современных стальных зданиях или мостах.
Точечная коррозия чаще возникает у низколегированных конструкционных сталей, находящихся в постоянно влажных условиях или зарытых в почву, а не на воздухе. Следовательно, точечная коррозия редко встречается на типичных современных стальных зданиях или мостах.
[top]Щелевая коррозия
Трещины могут образовываться в результате детализации конструкции, сварки, обломков поверхности и т. д. Имеющийся в щели кислород быстро используется в процессе коррозии и из-за ограниченного доступа не может быть заменен. Вход в щель становится катодным, так как он может удовлетворить катодную реакцию, требующую кислорода. Кончик щели становится локализованным анодом, и в этой точке возникают высокие скорости коррозии.
[top]Скорость коррозии
Основными факторами, определяющими скорость коррозии стали на воздухе, являются:
- Время увлажнения
- Атмосферное загрязнение
[наверх]Время увлажнения
Это доля общего времени, в течение которого поверхность остается влажной из-за дождя, конденсации и т. д. Отсюда следует, что для незащищенной стали в сухой среде, например, внутри отапливаемых зданий коррозия будет минимальной из-за малой доступности воды. Требование по нанесению красок или покрытий становится ненужным, кроме как для внешнего вида или противопожарной защиты.
д. Отсюда следует, что для незащищенной стали в сухой среде, например, внутри отапливаемых зданий коррозия будет минимальной из-за малой доступности воды. Требование по нанесению красок или покрытий становится ненужным, кроме как для внешнего вида или противопожарной защиты.
[вверх] Атмосферное загрязнение
Тип и количество атмосферного загрязнения и загрязнителей (например, сульфаты, хлориды, пыль и т. д.)
[вверх] Сульфаты
Они образуются из газообразного диоксида серы, образующегося при сжигании ископаемого топлива, например серосодержащие нефти и каменный уголь. Газообразный диоксид серы реагирует с водой или влагой в атмосфере с образованием сернистой и серной кислот. Промышленная среда является основным источником диоксида серы.
[top]Хлориды
Они в основном присутствуют в морской среде. Самая высокая концентрация хлоридов наблюдается в прибрежных районах, а их быстрое снижение происходит вглубь суши. В Великобритании есть данные, позволяющие предположить, что 2-километровую полосу вокруг побережья можно рассматривать как находящуюся в морской среде.
Как сульфаты, так и хлориды увеличивают скорость коррозии. Они реагируют с поверхностью стали с образованием растворимых солей железа, которые могут концентрироваться в ямках и сами вызывать коррозию.
В определенных местных условиях скорость коррозии может заметно различаться из-за влияния укрытия, преобладающих ветров и т. д. Таким образом, «микроклимат», непосредственно окружающий конструкцию, определяет скорость коррозии для практических целей. Из-за изменений в атмосферных условиях данные о скорости коррозии не могут быть обобщены. Тем не менее, среды можно классифицировать в широком смысле, и соответствующие измеренные скорости коррозии стали дают полезный показатель вероятной скорости коррозии. Дополнительную информацию можно найти в BS EN ISO 129.44-2 [1] и BS EN ISO 9223 [2] .
| Категория коррозионной активности | Низкоуглеродистая сталь Потеря толщины (мкм) a | Примеры типичных сред (только для справки) | |
|---|---|---|---|
| Внешний вид | Интерьер | ||
| C1 очень низкий | ≤ 1,3 | – | Отапливаемые здания с чистой атмосферой, напр. офисы, магазины, школы, гостиницы офисы, магазины, школы, гостиницы |
| C2 низкий | > 1,3 до 25 | Атмосферы с низким уровнем загрязнения: преимущественно сельские районы | Неотапливаемые здания, в которых может образовываться конденсат, напр. склады, спортивные залы |
| C3 средний | > 25 до 50 | Городская и промышленная атмосфера, умеренное загрязнение двуокисью серы; прибрежная зона с низкой соленостью | Производственные помещения с повышенной влажностью и некоторым загрязнением воздуха, напр. предприятия пищевой промышленности, прачечные, пивоварни, молокозаводы |
| C4 высокий | > от 50 до 80 | Промышленные районы и прибрежные районы с умеренным уровнем засоления | Химические заводы, плавательные бассейны, прибрежные суда и верфи |
| C5 очень высокий | > 80 до 200 | Промышленные зоны с повышенной влажностью и агрессивной атмосферой и прибрежные зоны с повышенной соленостью | Здания или зоны с почти постоянной конденсацией и высоким уровнем загрязнения |
| CX экстремальный | > 200 до 700 | Морские районы с высокой соленостью и промышленные районы с повышенной влажностью и агрессивной атмосферой, а также субтропические и тропические атмосферы | Промышленные зоны с повышенной влажностью и агрессивной атмосферой |
Примечания:
- 1 мкм (1 микрон) = 0,001 мм
- a Значения потери толщины приведены после первого года воздействия.
 Убытки могут уменьшиться в последующие годы.
Убытки могут уменьшиться в последующие годы. - Значения потерь, используемые для категорий коррозионной активности, идентичны значениям, указанным в BS EN ISO 9223 [2] .
[наверх]Ссылки
- ↑ 1.0 1.1 BS EN ISO 12944-2: 2017, Краски и лаки. Защита стальных конструкций от коррозии системами защитной окраски. Часть 2. Классификация сред, BSI
- ↑ 2.0 2.1 BS EN ISO 9223: 2012, Коррозия металлов и сплавов. Коррозионная активность атмосферы. Классификация, определение и оценка. БСИ
Ресурсы
- Стальные здания, 2003 г., Британская ассоциация строительных металлоконструкций, ООО.
- Глава 12 – Защита от коррозии
[наверх]Дополнительная литература
- D.Deacon & R.Hudson (2012), Steel Designer’s Manual (7th Edition), Chapter 36 – Corrosion and anticorrosion Prevention, The Steel Construction институт.
- Д.



 Убытки могут уменьшиться в последующие годы.
Убытки могут уменьшиться в последующие годы.