Строение атома цинка: Строение атома цинка (Zn), схема и примеры
alexxlab | 23.03.2023 | 0 | Разное
Таблица менделеева – Электронный учебник K-tree
Электронный учебник
Периодический закон, открытый Д. И. Менделеевым был выражен в таблице. Периодическая таблица химических элементов, или таблица менделеева.
1
H
1.008
2
He
4.003
3
Li
6.938
4
Be
9.012
5
B
10.806
6
C
12.01
7
N
14.006
8
O
15.999
9
F
18.998
10
Ne
20.18
11
Na
22.99
12
Mg
24.304
13
Al
26.982
14
Si
28.084
15
P
30.974
16
S
32.059
17
Cl
35.446
18
Ar
39.948
19
K
39.098
20
Ca
40.078
21
Sc
44.956
22
Ti
47.867
23
V
50.942
24
Cr
51. 996
996
Mn
54.938
26
Fe
55.845
27
Co
58.933
28
Ni
58.693
29
Cu
63.546
30
Zn
65.38
31
Ga
69.723
32
Ge
72.63
33
As
74.922
34
Se
78.971
35
Br
79.901
36
Kr
83.798
37
Rb
85.468
38
Sr
87.62
39
Y
88.906
40
Zr
91.224
41
Nb
92.906
42
Mo
95.95
44
Ru
101.07
45
Rh
102.906
46
Pd
106.42
47
Ag
107.868
48
Cd
112.414
49
In
114.818
50
Sn
118.71
51
Sb
121.76
52
Te
127.6
53
I
126.904
54
Xe
131.293
55
Cs
132.905
56
Ba
137.327
57
La
138.905
72
Hf
178. 49
49
73
Ta
180.948
74
W
183.84
75
Re
186.207
76
Os
190.23
77
Ir
192.217
78
Pt
195.084
79
Au
196.967
80
Hg
200.592
81
Tl
204.382
82
Pb
207.2
83
Bi
208.98
58
Ce
140.116
59
Pr
140.908
60
Nd
144.242
62
Sm
150.36
63
Eu
151.964
64
Gd
157.25
65
Tb
158.925
66
Dy
162.5
67
Ho
164.93
68
Er
167.259
69
Tm
168.934
70
Yb
173.045
71
Lu
174.967
90
Th
232.038
91
Pa
231.036
92
U
238.029
В таблице менделеева колонки называются группами, строки называются периодами. Элементы в группах как правило имеют
одинаковые электронные конфигурации внешних оболочек, например, благородные газы – последняя группа, имеют законченную
электронную конфигурацию.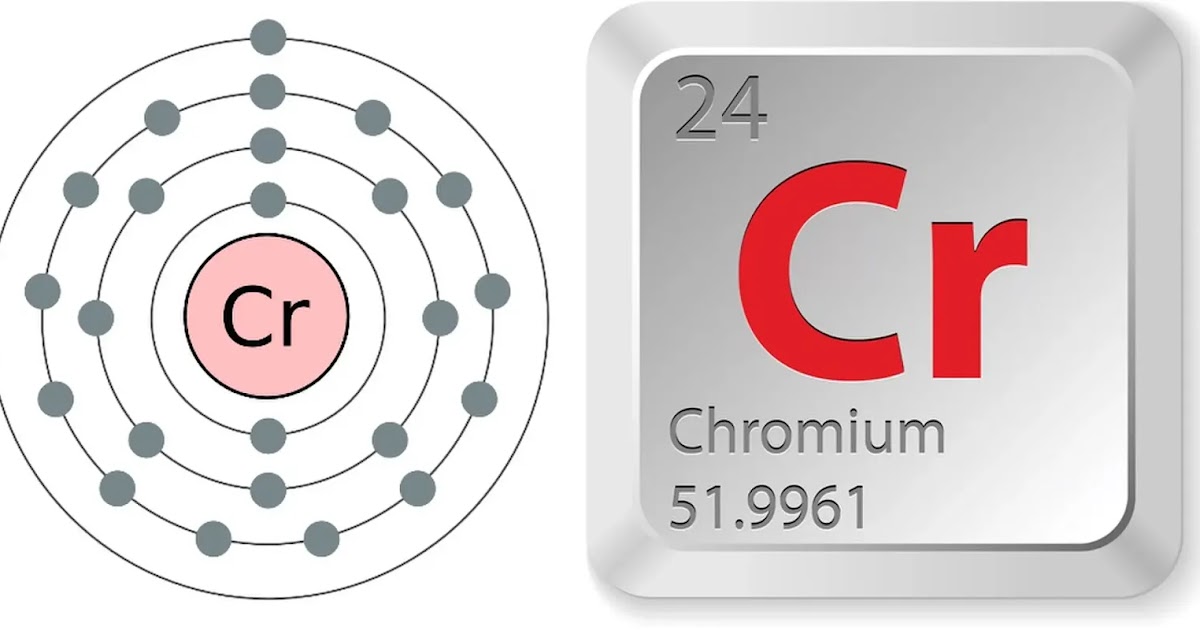
Как заполняется электронная конфигурация элементов подробно описано в статье
Скачать таблицу менделеева в хорошем качестве
© 2015-2022 – K-Tree.ru • Электронный учебник
По любым вопросам Вы можете связаться по почте [email protected]
Копия материалов, размещённых на данном сайте, допускается только по письменному разрешению владельцев сайта.
что это такое, история открытия, применения, физические и химические свойства, место в таблице Менделеева
Цинк – легко окисляемый металл, демонстрирующий амфотерные свойства. Относится к числу незаменимых для человеческого организма микроэлементов. Широко востребован во многих отраслях промышленности – начиная от медицины и заканчивая производством техники.
Оглавление
- История открытия
- Цинк в таблице Менделеева
- Строение атома цинка
- Физические свойства
- Химические свойства
- Цинк в природе
- Применение
- Биологическая роль
История открытия
О существовании этого металла было известно еще в древние времена. Археологами найдены изделия, изготовленные из его сплавов, датируемые до нашей эры.
Археологами найдены изделия, изготовленные из его сплавов, датируемые до нашей эры.
Сложность представлял только процесс получения чистого металла. Это обусловлено его низкой температурой кипения. Впервые задачу удалось решить в 1746 г. Немецкий химик А. С. Маргграф предложил следующую схему:
- В огнеупорной реторте прокаливалась смесь оксида этого металла с углем.
- Получившиеся пары поступали в холодильник и конденсировались.
Этот опыт считается моментом открытия чистого цинка. Хотя ряд источников указывает на то, что такую технологию в Индии знали еще в VII в. Путешественники, например Марко Поло, отражали в своих заметках, что встречали ее в Персии, Китае.
Цинк в таблице Менделеева
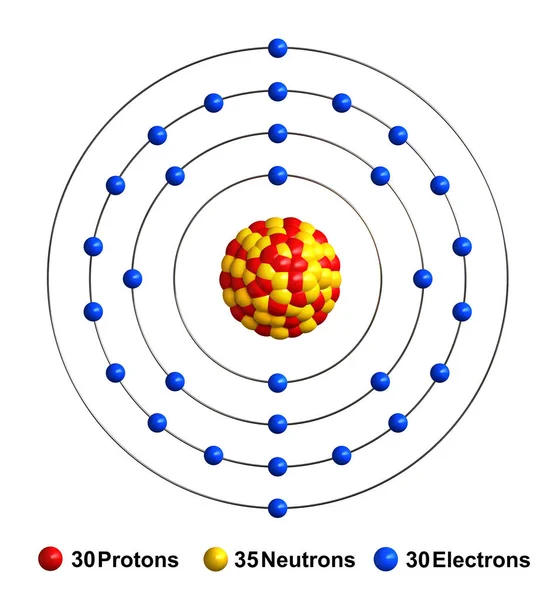
В таблице Менделеева этот металл имеет порядковый номер 30. Элемент принадлежит ко второй группе и расположен в 4 периоде. Его вес 65,37 атомных единиц.
Строение атома цинка
Атом состоит из 30 протонов и электронов, 35 нейтронов. Электроны расположены на 4 орбиталях. Радиус атома – 138 пм.
Радиус атома – 138 пм.
В природе существует 5 стабильных изотопов с атомными массами от 64 до 70 единиц. Из них наиболее распространен вариант, содержащий 34 нейтрона. Также известны 25 радиоактивных изотопов. Период их полураспада варьируется от нескольких сотен наносекунд до 244 дней. Наиболее стабильным является чаще всего встречающийся изотоп с 65 частицами в ядре.
Физические свойства
Цинк в чистом виде – это серебристо-белый металл. При комнатной температуре хрупкий. При нагреве до 150 °C приобретает пластичность, которая теряется при увеличении нагрева до 250 °C. Имеет гексагональную решетку.
Основные параметры:
- плотность при нормальных условиях – 7,133 г/куб. см;
- температура плавления – 419,6 °C;
- температура кипения – 906,2 °C.
Химические свойства
Элемент относят к амфотерным металлам. Это означает, что гидроксид цинка может вступать во взаимодействие и с щелочами, и с кислотами.
Характерная степень окисления +2. При нагревании чистого металла становятся возможны реакции с цинком, в ходе которых образуются:
При нагревании чистого металла становятся возможны реакции с цинком, в ходе которых образуются:
- фосфиды – при взаимодействии с галогенами и фосфором;
- халькогениды – под воздействием серы и аналогичных по свойствам соединений;
- нитрид – в реакции с аммиаком;
- гидроксоцинкаты – в результате контакта кислых или щелочных сред с металлом обычной чистоты.
Основные уравнения цинка, взаимодействующего с другими элементами, приведены на рисунке ниже.
Цинк в природе
В природе в чистом виде этот металл не встречается. Это обусловлено тем, что взаимодействие цинка с кислородом во влажной атмосфере начинается уже при комнатной температуре.
Существует 66 цинксодержащих минералов. Наиболее часто встречается сфалерит. Его название по-гречески означает обманчивый. Оно было дано из-за сложности в идентификации породы. Металл представлен в нем в виде сульфида.
Важную роль играют следующие минералы:
- цинкит;
- виллемит;
- каламин;
- смитсонит;
- франклинит и т.
 д.
д.
Содержание элемента в земной коре 0,0083%. Он тяготеет к изверженным породам, концентрация его в которых достигает 0,013%. Кислые участки им бедны. В России месторождения полиметаллических руд, несущих до 4% сульфида цинка, находятся в Нижнем Приангарье и в западной части Таймырского полуострова.
Большое количество сульфида цинка растворено в воде. Его осаждение востребовано промышленностью.
Применение
Элемент востребован в ряде отраслей экономики. Его используют:
- В процессе получения драгоценных металлов.
- Для создания антикоррозионного покрытия.
- Для металлизации поверхностей.
- При изготовлении элементов питания (аккумуляторов).
- Для полиграфной печати.
- При производстве латуни и других промышленных сплавов.
- При изготовлении люминесцирующих составов.
- Для создания полупроводников.
- Как компонент смеси для изготовления стекол для углекислотных лазеров.
Биологическая роль
Этот химический элемент широко применяется в медицине. На это направление тратится около 10% от общего объема добычи. Оксид цинка используется как противовоспалительное средство, является мощным антисептиком.
На это направление тратится около 10% от общего объема добычи. Оксид цинка используется как противовоспалительное средство, является мощным антисептиком.
Содержание элемента в человеческом теле около 2 г. Точная цифра варьируется в зависимости от пола и веса. Он задействован:
- при продуцировании гормонов, в первую очередь инсулина и тестостерона;
- в метаболизме токоферола;
- в выработке 400 ферментов;
- в регуляции роста волос, расщеплении спирта, синтезе спермы.
Микроэлемент содержится в устрицах, овсянке, бобовых. Широкое распространение получили витамины с цинком. В первую очередь они востребованы при проблемах с потенцией. Но их передозировка приводит к тяжелым симптомам, поэтому препараты должны применяться только при доказанном дефиците.
Цинк – важный химический элемент, ставший незаменимой составляющей живой клетки еще на ранних этапах эволюции. В промышленности он считается самым распространенным из всех металлов. Оцинкование – самый дешевый и надежный способ защиты материалов. Расскажите в комментариях, какая сфера применения этого химического элемента на ваш взгляд самая важная.
Расскажите в комментариях, какая сфера применения этого химического элемента на ваш взгляд самая важная.
Смотрите в видео — свойства цинка, применение и биологическая роль, получение водорода:
Также предлагаем к прочтению статью на тему, что такое алканы — строение и химические свойства. Об этом здесь.
nglos324 – цинк
nglos324 – цинк
| ||||||||||
Цинк
представляет собой металл группы II B периодической таблицы с атомным номером 30,
атомный вес 65,37 и плотность 7,14 Мг/м  В нем есть
температура плавления 419,5 С. В нем есть
температура плавления 419,5 С.электронная конфигурация цинка: (Ar)(3d) 10 (4s) 2 , и имеет атомный радиус 0,138 нм. В
при комнатной температуре металл имеет гексагональную плотноупакованную кристаллическую структуру.
Параметры решетки: Цинк имеет модуль Юнга 70 ГПа, предел текучести 160 МПа, UTS 200 МПа, деформация разрушения 0,9. | ||||||||||
| От: Ньюи и Уивер, «Принципы и практика использования материалов», Баттерворт (1990) | .||||||||||
WebElements Periodic Table » Цинк » свойства свободных атомов
30 Zn
Доступные свойства цинка. ..
..
Атомы цинка имеют 30 электронов, а структура оболочки — 2.8.18.2.
Электронная конфигурация основного состояния газообразного нейтрального цинка в основном состоянии равна [ Ar ]. 3д 10 . 4s 2 и символ термина 1 S 0 .
Схематическая электронная конфигурация цинка. Коссельная структура цинка.Атомный спектр
Изображение атомного спектра цинка.
Энергии ионизации и сродство к электрону
Сродство цинка к электрону составляет 0 кДж моль ‑1 . Энергии ионизации цинка приведены ниже.
| Номер энергии ионизации | Энтальпия / кДж моль ‑1 | |
|---|---|---|
| 1-й | 906,40 | |
| 2nd | 1733. 30 30 | |
| 3rd | 3832.71 | |
| 4th | 5747.9 | |
| 5th | 7970 | |
| 6th | 10420 | |
| 7th | 12920 | |
| 8th | 16780 | |
| 19590 | ||
| 10th | 22960 | |
| 11TH | 26480 | |
| 11TH | 26480 | 007 |
| 12th | 29990 (inferred) | |
| 13th | 40290 | |
| 14th | 43750 | |
| 15th | 47340 | |
| 16th | 52100 | |
| 17th | 55750 | |
| 18th | 59170 | |
| 19 -й | 67300 | |
| 20th | 71140 | |
| 21st | 71140 | |
| 21st | 71140 | |
| 21st | 0007178000 |
Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды “Клементи-Раймонди”, Z eff . Следуйте гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1 с | 29,3245 | ||||||
|---|---|---|---|---|---|---|---|
| 2 с | 21,83 | 2п | 26.10 | ||||
| 3 с | 16,22 | 3п | 15,37 | 3d | 13,88 | ||
| 4с | 5,97 | 4 шт. | (нет данных) | 4д | (нет данных) | 4f | (нет данных) |
| 5 с | (нет данных) | 5p | (нет данных) | 5д | (нет данных) | ||
| 6с | (нет данных) | 6п | (нет данных) | ||||
| 7 с | |||||||
Каталожные номера
Эти эффективные ядерные заряды, Z
eff , адаптированы из следующих ссылок:- E.
 Clementi and D.L.Raimondi, J. Chem. физ. 1963, 38 , 2686.
Clementi and D.L.Raimondi, J. Chem. физ. 1963, 38 , 2686. - Э. Клементи, Д.Л.Раймонди и В.П. Рейнхардт, J. Chem. физ. 1967, 47 , 1300.
Энергии связи электронов
| Этикетка | Орбитальный | эВ [ссылка на литературу] | ||
|---|---|---|---|---|
| K | 1s | 9659 [1] | ||
| L I | 2s | 1196.2 [2] | ||
| L II | 2p 1/2 | M0151 I | 3s | 139. |


 д.
д. Clementi and D.L.Raimondi, J. Chem. физ. 1963, 38 , 2686.
Clementi and D.L.Raimondi, J. Chem. физ. 1963, 38 , 2686.