Строение кристаллической решетки металлов: Глава 2.2. Атомно-кристаллическое строение металлов — Купити в Харкові, Києві, Україні. Безкоштовне тестування
alexxlab | 05.04.2023 | 0 | Разное
Строение металлов | Металлы и сплавы
Строение металла
Теория обработки металлов давлением изучает физическую природу пластической , влияние различных факторов на процесс деформирования, силовое взаимодействие между инструментом и деформируемым металлом, влияние на строение и свойства обрабатываемого материала и др.
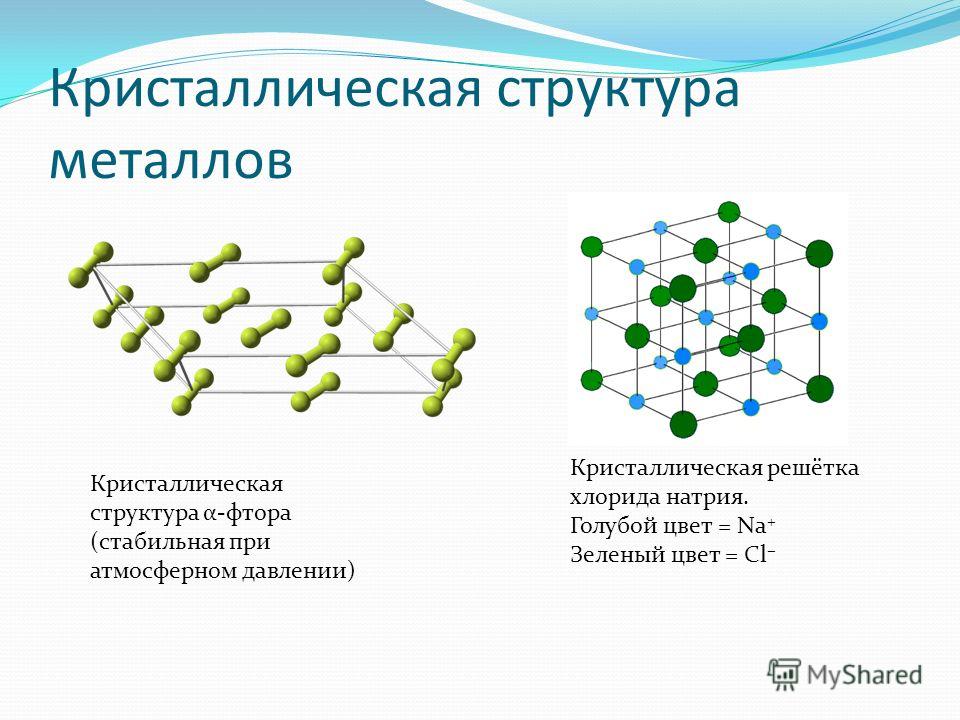
Металлы и сплавы состоят из прочно соединенных друг с другом зерен (рис. 2.1, а). Такое строение формируется в процессе кристаллизации металла и перехода его из жидкого состояния в твердое. В промышленных условиях кристаллизация начинается одновременно во многих точках, называемых центрами кристаллизации. Около этих центров по мере затвердевания металла растут кристаллы металлического вещества, из которых формируются зерна. Если в жидком металле атомы находятся в непрерывном хаотическом движении, то в твердом они располагаются в определенном порядке. Такое строение вещества называется кристаллическим. После кристаллизации зерно представляет собой кристалл неправильной формы и называется кристаллитом, а строение металла – поли- кристаллическим.
Рис. 2.1. Строение металла: а – микроструктура металла, б – схема кристаллического строения, в, г объемно центрированная и гранецентрированная кубические решетки, д – гексагональная решетка
На рис. 2.1, в … д приведены три наиболее распространенных типа элементарных ячеек, в соответствии с которыми получили свое название и кристаллические решетки. Объемно центрированную кубическую решетку (рис. 2.1, в) имеют железо при температуре ниже 910 °С, хром, титан при температуре выше 882 °С, вольфрам, молибден и др., гране центрированную кубическую (рис.
В промышленных металлах и сплавах, как правило, присутствуют различные неметаллические включения в виде оксидов, нитридов, сульфидов и т.д. В силу того что температура затвердевания неметаллических включений ниже, чем металла, в первую очередь кристаллизуются поликристаллы, а затем затвердевают неметаллические включения, которые располагаются по границам зерен в виде тонких прослоек или отдельных включений разнообразной формы. Размеры зерен, во многом зависящие от скорости охлаждения, обычно составляют 0,01 … 0,1 мм; при медленном охлаждении жидкого металла их размеры могут достигать нескольких миллиметров. Следует отметить, что кристаллические решетки в зернах могут иметь различные дефекты (несовершенства) , например отсутствие в некоторых узловых точках атомов (образование вакансий), искажение решётки из-за внедрения лишних атомов, наличие микроскопических пор, образующихся вследствие усадки металла при кристаллизации, и др.
во многое зависят от их кристаллического строения, размера и формы зерен, размера неметаллических включений. Так, кристаллы, имеющие гранецентрированную кристаллическую решетку (свинец, алюминий, медь), обладают наибольшей пластичностью, а деформированный мелкозернистый металл прочнее литого, имеющего крупнозернистое строение.
Похожие материалы
«Кристаллические решетки. Физические и химические свойства металлов». 9 класс
Урок на тему: «Кристаллические решетки. Физические и химические свойства металлов». 9 класс
Цель: сформировать представление учащихся о зависимости физических свойств металлов от типа кристаллической решетки и особенностей строения атома. Рассмотреть общие химические свойства металлов
Задачи:
Образовательные: сформировать представления учащихся о многообразии металлов, их распространения в природе, о характере физических свойств металлов.
Охарактеризовать важнейшие химические свойства металлов;
На примере реакций, характеризующих химические свойства, повторить типы химических реакций
Продолжить формирование умения работать с лабораторным оборудованием
Развивающие: способность формированию умений, наблюдать, анализировать,
делать выводы.
Воспитательные: способствовать развитию интереса к предмету.
Оборудование: модели кристаллических решеток, образцы металлов, изделия из металлов, мультимедийный проектор.
.
Ход урока
I.. Организационный момент
Приветствие учащихся. Проверка готовности к уроку. Сообщение темы и цели урока.
Что же такое металл?
С точки зрения химии, к данным атомам принято относить те, что имеют:
малое число электронов на внешнем уровне;
проявляют сильные восстановительные свойства;
имеют большой атомный радиус;
как простые вещества обладают рядом специфических физических свойств. Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
II.Формирование новых знаний.
1. Атомно-кристаллическое
строение металлов
Атомно-кристаллическое
строение металлов
В чем же
заключается такое строение, чем характеризуется? Само название говорит о том,
что все металлы представляют собой кристаллы в твердом состоянии, то есть при
обычных условиях (кроме ртути, которая является жидкостью). А что такое
кристалл? Это условное графическое изображение, построенное путем пересечения
воображаемых линий через атомы, которые выстраивают тело. Другими словами,
каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень
правильно и последовательно. Так вот, если мысленно соединить все эти частицы в
одну структуру, то получится красивое изображение в виде правильного
геометрического тела какой-либо формы. Это и принято называть кристаллической
решеткой металла. Она очень сложная и пространственно объемная, поэтому для
упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность
таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и
образует кристаллические решетки.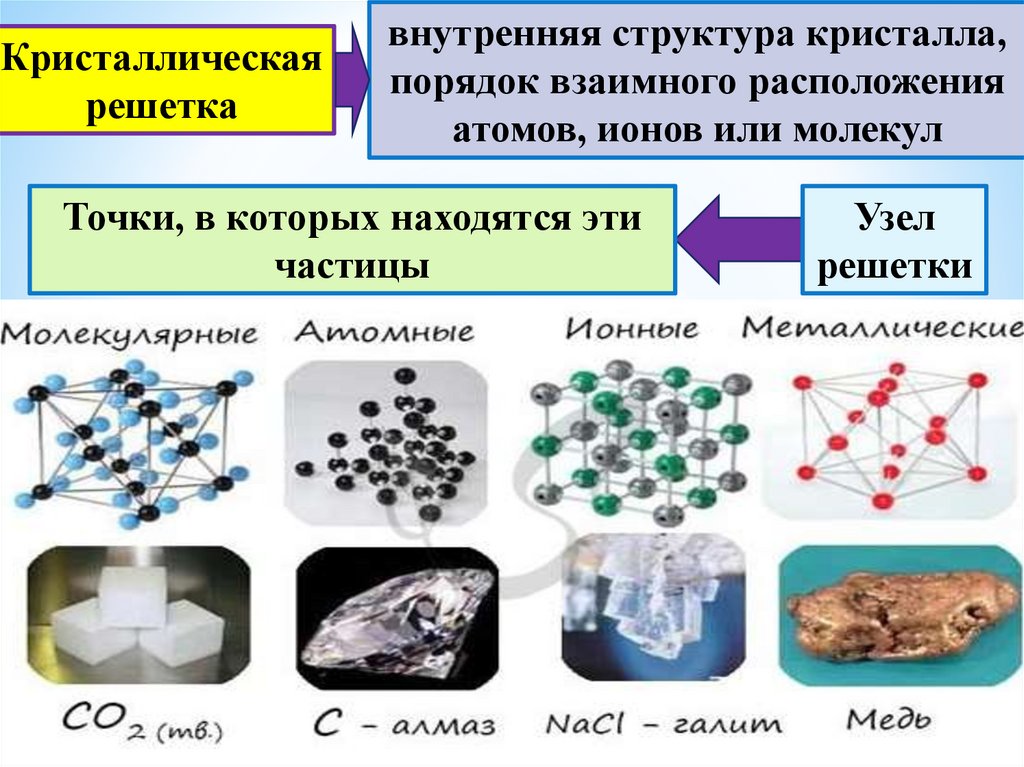
Сама элементарная ячейка – это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства. Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность – в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Типы кристаллических решеток.
Четырнадцать
вариантов строения решетки принято объединять в три основных типа. Они
следующие: Объемно-центрированная кубическая. Гексагональная плотноупакованная.
Гранецентрированная кубическая.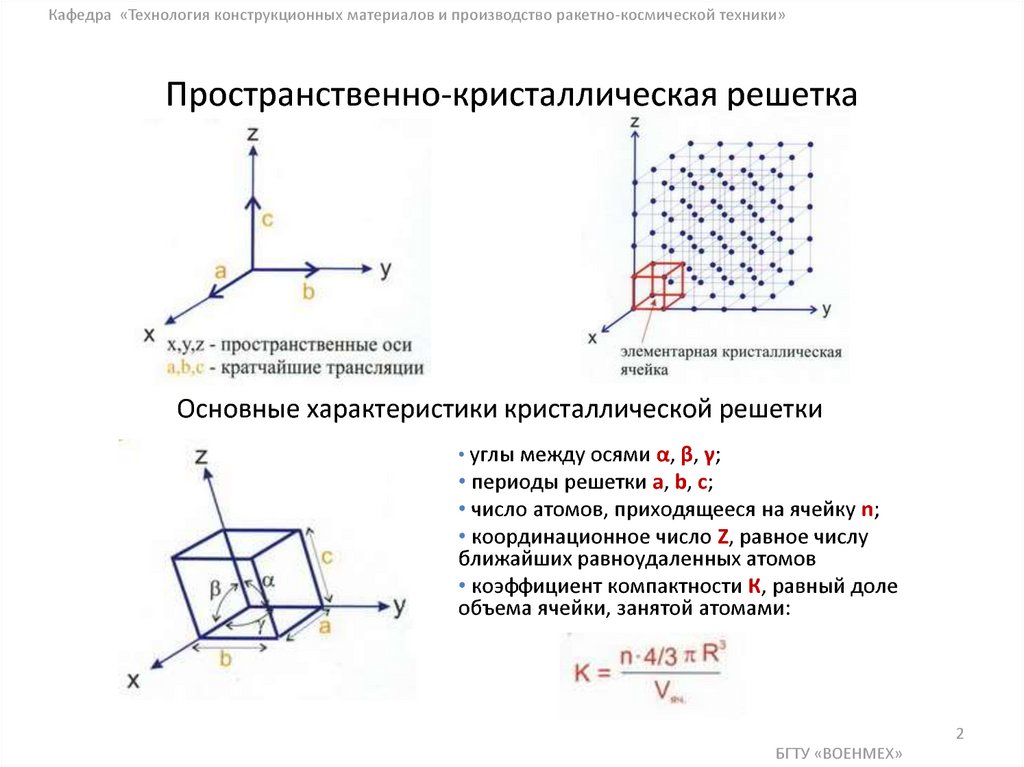
Кристаллическое строение металлов было изучено только благодаря электронной микроскопии, когда стало возможным получать большие увеличения изображений. А классификацию типов решеток впервые привел французский ученый Браве, по фамилии которого их иногда называют.
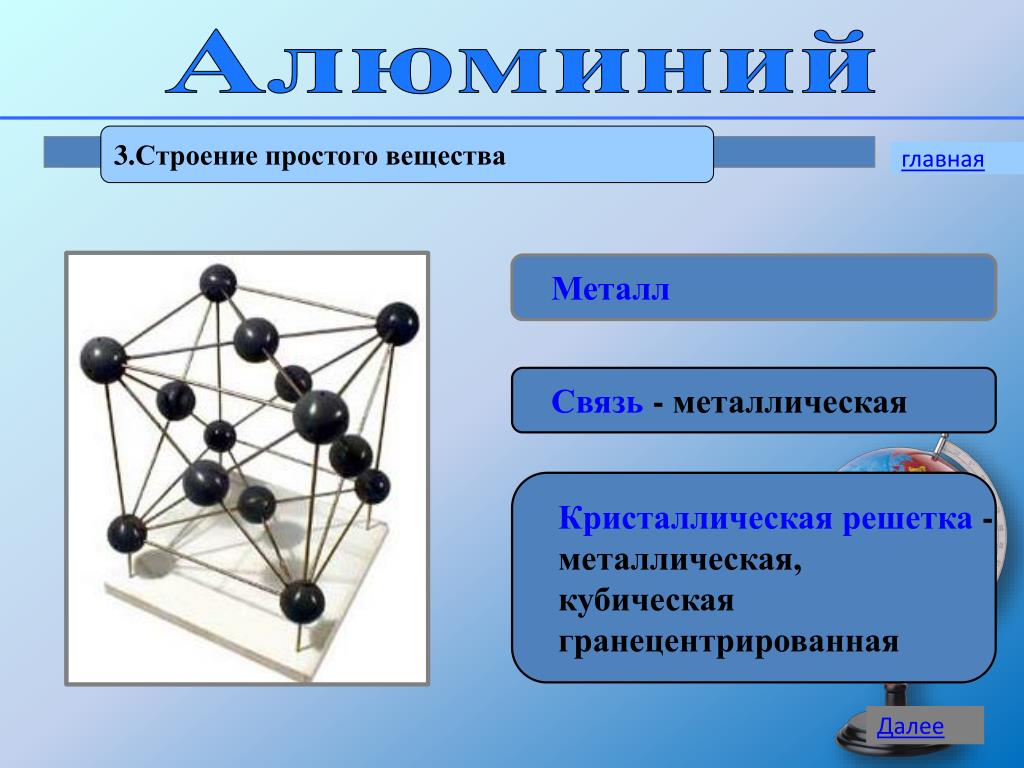
Объемно-центрированная решетка Строение кристаллической решетки металлов данного типа представляет собой следующую структуру. Это куб, в узлах которого находится восемь атомов. Еще один располагается в центре свободного внутреннего пространства ячейки, что и объясняет название “объемно-центрированная”. Это один из вариантов наиболее простого строения элементарной ячейки, а значит, и всей решетки в целом. Такой тип имеют следующие металлы: –
Гранецентрированная решетка
Кристаллическое
строение металлов, имеющих гранецентрированную кубическую решетку, представляет
собой следующую структуру. Это куб, который включает в свой состав четырнадцать
атомов. Восемь из них формируют узлы решетки, а еще шесть расположены по одному
на каждой грани. Подобную структуру имеют: алюминий; никель; свинец;
гамма-железо; медь. Основные отличительные свойства – блеск разного цвета,
легкость, прочность, ковкость, повышенная устойчивость к коррозии.
Восемь из них формируют узлы решетки, а еще шесть расположены по одному
на каждой грани. Подобную структуру имеют: алюминий; никель; свинец;
гамма-железо; медь. Основные отличительные свойства – блеск разного цвета,
легкость, прочность, ковкость, повышенная устойчивость к коррозии.
Гексагональная решетка
Кристаллическое строение металлов, обладающих данным типом решетки, следующее. В основе элементарной ячейки лежит шестигранная призма. В ее узлах располагается 12 атомов, еще два по основаниям и три атома свободно лежат внутри пространства в центре структуры. Всего семнадцать атомов. Подобную сложную конфигурацию имеют такие металлы, как: альфа-титан; магний; альфа-кобальт; цинк. Основные свойства – высокая степень прочности, сильный серебристый блеск.
Основные типы кристаллических решеток: а – объемно-центрированная кубическая;
б– гранецентрированная кубическая; в – гексагональная плотноупакованная
(Демонстрация моделей кристаллических решеток металлов)
Делаем общий вывод: что такое металл как химический элемент? Под химическим элементом- металлом будем понимать вид атомов, способных легко отдавать электроны, а также образовывать простые вещества с характерными физическими свойствами
2. Физические
свойстав простых веществ-металлов.
Физические
свойстав простых веществ-металлов.
Лабораторная работа «Физические свойства металлов»
Цель: Познакомиться с физическими свойствами металлов.
Оборудование: Лоток с набором образцов металлов, алюминиевая проволока, медная проволока или пластины. цинк, железо.
образцы металлов | ТВЕРДОСТЬ- | БЛЕСК | ПРОЗРАЧ- НОСТЬ | ПЛАСТИЧ- НОСТЬ | ЦВЕТ | ЗАПАХ |
ЭЛЕКТРО- ПРОВОД- НОСТЬ |
ТЕПЛОПРО- ВОДНОСТЬ
|
алюминий |
|
|
|
|
|
|
|
|
цинк |
|
|
|
|
|
|
|
|
медь |
|
|
|
|
|
|
|
|
железо |
|
|
|
|
|
|
|
|
Выполнение работы.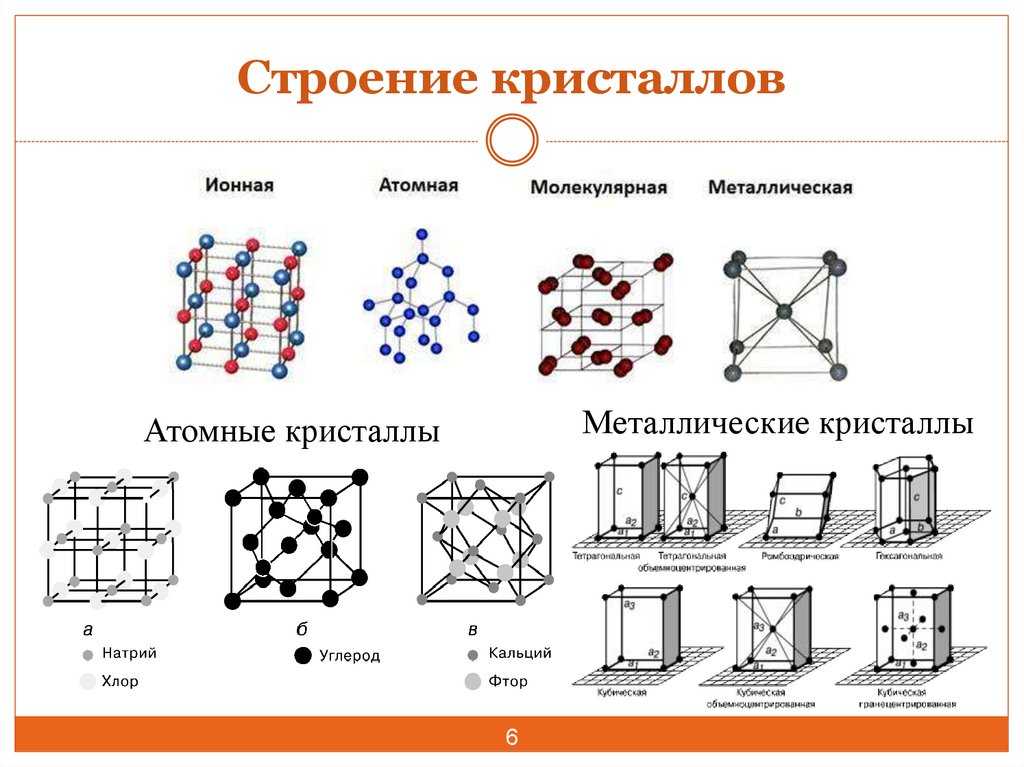
1.выполняй работу строго по инструкции.
2.при выполнении работы будь аккуратен.
3.во время эксперимента не разговаривай и не отвлекайся.
4.четко фиксируй результаты.
Инструктивная карта
1.Внимательно рассмотрите образцы и установите: металлы твердые или жидкие. Зафиксируйте результат
2.Рассмотрите образцы металлов и определите есть ли у них блеск. Зафиксируйте результат.
3.Определите являются ли образцы металлов прозрачными. Результат занесите в таблицу.
4.Несколько раз перегните образцы Ме и установите пластичны ли они.
5.Рассмотрите образцы металлов и определите цвет каждого из них. Зафиксируйте результат.
6.Поднесите образцы Ме на расстояние 10см от лица и, вдыхая воздух, определите запах металлов. Зафиксируйте результат
7. Определите из жизненного опыта тепло и электропроводность алюминия и меди Результат занесите в таблицу.
8.Опустите
образцы металлов в стакан с теплой водой на 10 сек. Выньте из воды, протрите
салфеткой салфеткой, прикоснитесь к тыльной стороне ладони.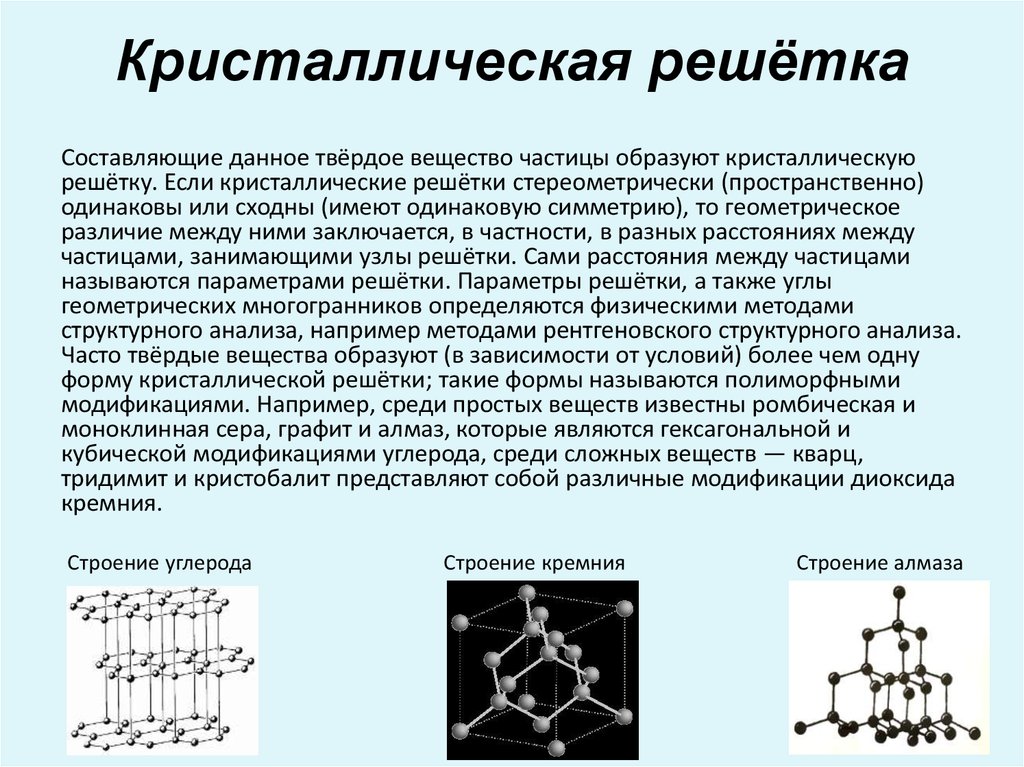 Что можете сказать
о теплопроводности? Зафиксируйте результа
Что можете сказать
о теплопроводности? Зафиксируйте результа
Закрепление: соотнесите цифры с буквами
1.ТВЕРДОСТЬ-
2.ПРОЧНОСТЬ –
3.МЕТАЛЛИЧЕСКИЙ БЛЕСК-
4.ТЕПЛОПРОВОДНОСТЬ-
5.ЭЛЕКТРОПРОВОДНОСТЬ-
6.ТЕМПЕРАТУРА ПЛАВЛЕНИЯ-
7.ПЛОТНОСТЬ-
А- это способность тела проводить электрический ток
Б – это способность металла воспринимать нагрузку, не разрушаясь и не меняя своей формы.
В – это перенос тепла от одних частей тела к другим обусловленный разновидностью температур
Г – температура,при которой твердое кристаллическое тело совершает переход в жидкое состояние и наоборот.
Д – количество массы в единице объема.
Е – свойство сопротивляться изменению формы.
Ж – результат отражения световых лучей от электронов, находящихся в межатомном пространстве.
Ответ: 1 – Е; 2 – Б; 3 – Ж; 4 –
В; 5 – А; 6 – Г; 7 – Д.
Выводы – учитель.
Великий русский ученый М. В.Ломоносов так говорил о металлах: «Металлом называется твердое, непрозрачное и светлое тело, которое на огне плавить и холодное ковать можно». О каких физических свойствах металлов здесь идет речь?
Ковкость (пластическая деформация) Под пластической деформацией металла следует понимать изменение внешней формы под воздействием механических факторов, не приводящих к разрушению его на части. Для того чтобы понять это явление, учащиеся проводят эксперимент. Две стеклянные пластинки накладываю друг на друга. Их легко разъединить. Затем на поверхность пластин наносят несколько капель воды. Пластины легко скользят одна относительно другой, но с трудом отрываются друг от друга.
В качестве подтверждения пластичности металлов приводим интересные сведения о золоте.
Следующее свойство
– твердость. Металлы бывают мягкие и твердые. Калий, натрий
(демонстрация) можно резать ножом. Из вольфрама и хрома изготавливают режущие,
бурильные инструменты. По внешним признакам определяем твердость пластин.
Данные в таблицу.
По внешним признакам определяем твердость пластин.
Данные в таблицу.
Обратите внимание на внешний вид пластин, посмотрите в зеркало. Какое свойство металлов используют при изготовлении зеркал, елочных игрушек? Металлический блеск, непрозрачность. Следующее свойство металлов – электропроводность и теплопроводность. Наиболее электропроводные металлы: серебро, медь, золото. Наиболее теплопроводные – серебро, медь, алюминий, железо.
Важное свойство металлов – их температура плавления. Учащиеся проводят эксперимент: нагревают железный гвоздь и алюминиевую фольгу. Почему фольга изменяет форму, а гвоздь нет? ( Температура пламени спиртовки не позволяет расплавить железо). Итак, металлы бывают легкоплавкие и тугоплавкие,
Плотность металлов различна. Самым легким является литий, его плотность 0,54г/см3, а самым тяжелым – осмий, плотность которого 22,6г/см3
Учитель: Чем
обусловлены общие свойства металлов? (Особенностью
строения кристаллической решетки) Например, пластичность определяется
способностью слоев кристаллической решетки смещаться друг относительно друга
без разрыва связи.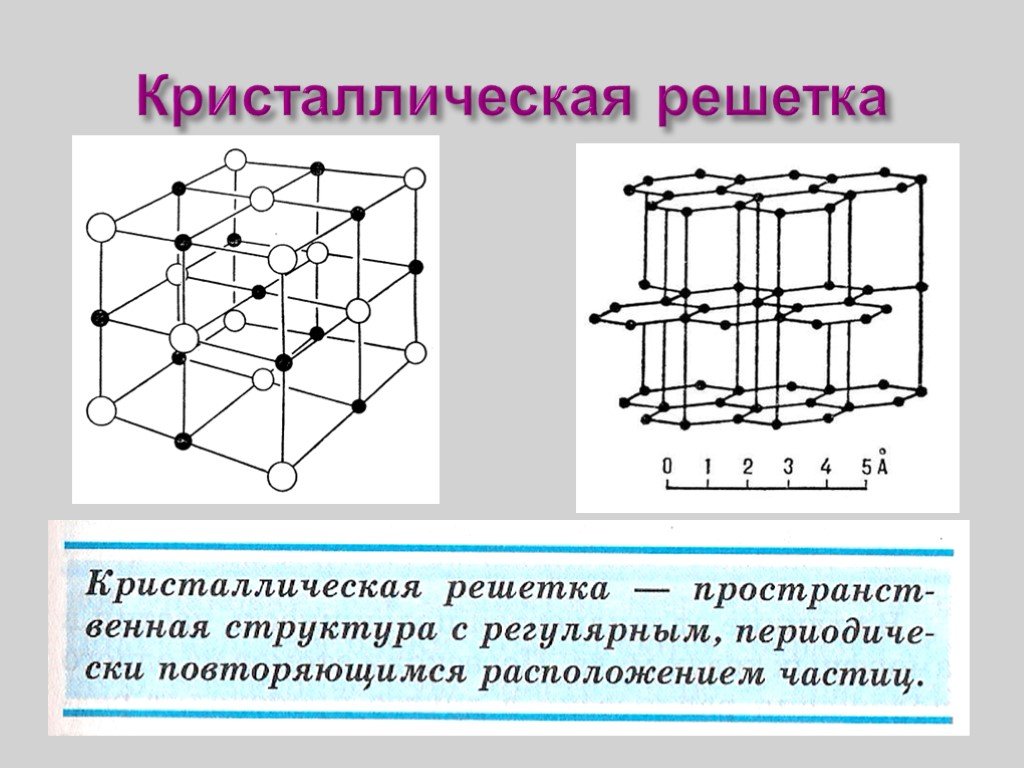 (Скольжение) Металлический блеск объясняется способностью
электронов кристаллической решетки отражать световые лучи, а не пропускать их,
как стекло. Электро-и теплопроводность металлов объясняется присутствием
свободных электронов, которые направленно перемещаются под действием электрического
тока. Большие различия в твердости, температурах плавления и кипения отдельных
металлов свидетельствуют о значительной разнице в энергии металлической связи.
В чем причина общих физических свойств металлов? Выслушиваем ответы учащихся.
Используя полученные знания, школьники, называют металлы, которые они
исследовали в ходе лабораторного опыта (железо, цинк, медь, алюминий).
(Скольжение) Металлический блеск объясняется способностью
электронов кристаллической решетки отражать световые лучи, а не пропускать их,
как стекло. Электро-и теплопроводность металлов объясняется присутствием
свободных электронов, которые направленно перемещаются под действием электрического
тока. Большие различия в твердости, температурах плавления и кипения отдельных
металлов свидетельствуют о значительной разнице в энергии металлической связи.
В чем причина общих физических свойств металлов? Выслушиваем ответы учащихся.
Используя полученные знания, школьники, называют металлы, которые они
исследовали в ходе лабораторного опыта (железо, цинк, медь, алюминий).
III..Химические свойства,
1.Вводное слово учителя
Учитель: «Однажды Роберт Вуд возвращался
домой из лаборатории. Дорога шла через негритянский квартал. Посреди дороги
стояла большая лужа, а неподалеку стояли негры. Проходя мимо них, Вуд кинул в
лужу кусочек натрия.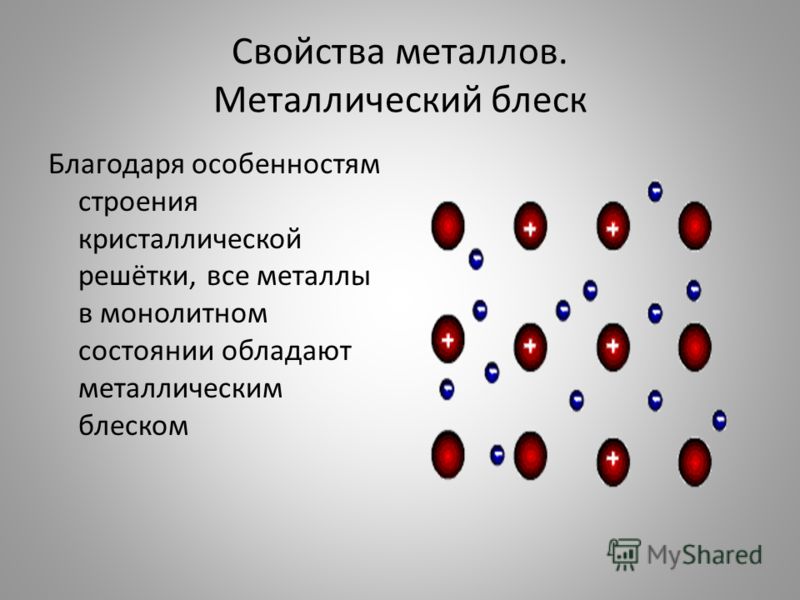 Произошел большой взрыв, большое пламя поднялось над
водой. Люди испугались, стали кричать».
Произошел большой взрыв, большое пламя поднялось над
водой. Люди испугались, стали кричать».
Вопросы:
1.О каких свойствах натрия идет речь в этом отрывке?
2. Что мы сегодня будем изучать на уроке?
3.Какие вопросы мы должны будем рассмотреть?
2.Ряд активности Ме
3.Общая схема химических свойств Ме
4.Лабораторная работа по изучению химических свойсв Ме.
Инструкция
Взаимодействие натрия с водой.
1. Наливаю в чашку воду.
2. Добавляю 2 – 3 капли фенолфталеина.
3. Тигельными щипцами помещаю в воду небольшое количество натрия.
4. Наблюдаю выделение газообразного вещества
и окрашивание фенолфталеина в малиновый цвет.
Горение магния.
1. В тигель помещаю небольшое количество магния.
2. Магний поджигаю.
3. Наблюдаю яркое свечение, что является признаком химической реакции и образование вещества белого цвета.
Взаимодействие алюминия с серной кислотой.
1. В пробирку наливаем 2 мл серной кислоты.
2. Добавляем 2 – 3 гранулы алюминия.
3. Наблюдаем выделение газообразного вещества.
Взаимодействие железа с сульфатом меди (II).
1. В пробирку наливаем 4 мл сульфата меди (II).
2.В раствор помещаем железный гвоздь.
3. Через некоторое время на гвозде образуется налет красного цвета.
5.закрепление по химическим свойствам Ме
Реагирующие вещества | K | Ca | Fe | Cu | Au |
O2 |
|
|
|
|
|
h3O |
|
|
|
|
|
HCl(раствор) |
|
|
|
|
|
Pd(NO3)2(раствор) |
|
|
|
|
|
Ответ:
Реагирующие вещества | K | Ca | Fe | Cu | Au |
O2 | + | + | + | + | – |
h3O | + | + | + | – | – |
HCl(раствор) | + | + | + | – | – |
Pd(NO3)2(раствор) | + | + | + | – | – |
РЕФЛЕКСИЯ
«А
у нас во дворе».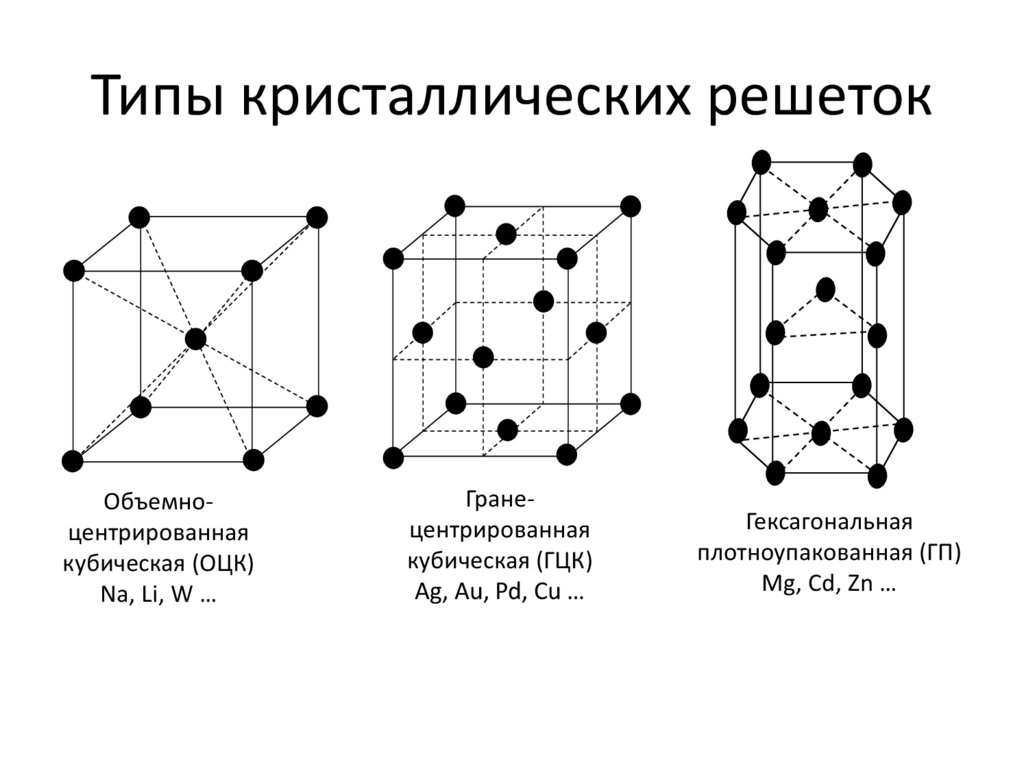
Ртуть на лавочке сидела, рядом Медь дремала.
Цинк взобрался на забор, очень рад- все видит он!
Ну а Натрий непоседа, всем спортсмен известный,
Лихо на одной руке крутит «солнце» на турнике.
Дело было вечером, делать было нечего.
Вдруг, откуда ни возьмись, тучка прибежала.
Озорница все металлы с лейки обливала.
Через несколько секунд вдруг один металл исчез.
Через некоторое время второй металл прибавил вес.
Долго, долго обливала тучка двух лентяев.
А они не шелохнулись, так и сидят до сих пор.
Почему? Кто мне ответит? Что случилось с остальными?
(идет обсуждение с учащимися).
«На дискотеке».
Сегодня праздник у ребят- у Серебра с Железом.
И щеки их с утра горят, сверкая металлическим блеском.
Принарядившись вечерком и захватив с собою электроны,
Отправились друзья все в «Бриз», который в парке рядом с морем.
А в «Бризе» музыка гремит, и под нее кружатся пары.
Бейк-данс
танцует лихо Медь на пару здесь с сульфат- ионом.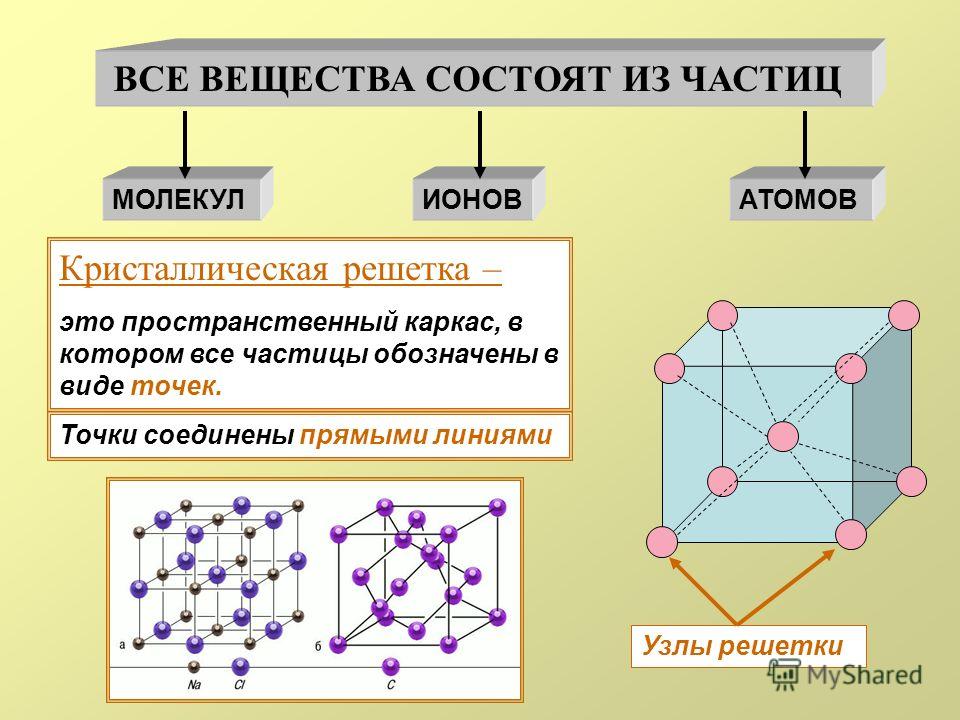
А рядом с ними в ритме танго проплыл, качаясь, Алюминий
В обнимочку с нитратом. Нитрат- ион понравился друзьям.
«Я первое танцую с ним!»- Железо вслух сказало.
И в «па», и в «де», и в «па-де-де» Железо так крутилось!
Но не смогло с Нитратом быть, никак не получилось!
Вперед выходит Серебро, сверкая в лунном свете.
Но Алюминий , ну никак не видит гневный блеск тот!
Тогда сердитое Железо подходит быстро к Меди.
И Медь безропотно садится отдыхать.
Сульфат танцует брейк с Железом!
Не суждено в тот вечер было размяться в танце Серебру.
Но почему? Кто может дать ответ?
(идет обсуждение с учащимися).
Почему металлы образуют кристаллы? | На главную Руководства
Автор: редакция Обновлено 21 июля 2017 г.
Металлы, с которыми мы сталкиваемся ежедневно, имеют форму для практических целей, поэтому металл может быть гладким, шероховатым, зазубренным или заостренным. На микроскопическом уровне металлы сохраняют внутреннюю кристаллическую структуру. На самом деле именно кристаллическая структура металлов придает им такие качества, как пластичность, ковкость или твердость, которые делают их полезными для нас. Основа кристаллической структуры определяется на фундаментальном уровне атомов металла.
Идентификация
Физически мы идентифицируем металлы по их непрозрачному, блестящему внешнему виду и относительной плотности по сравнению с другими элементами. Функционально металлы являются хорошими проводниками тепла и электричества и обладают различными свойствами пластичности и пластичности. Атомы металлов также обычно теряют электроны, образуя положительные ионы, и это в конечном итоге заставляет металлы образовывать кристаллы.
Соображения
Каждый атом металла состоит из ядра, содержащего протоны и нейтроны. Ядро окружено полем электронов. Электроны занимают орбитали, или валентности, группами по восемь. Во всех элементах, когда самая внешняя валентность атома содержит менее 8 электронов, атом будет связываться или реагировать с другими атомами, разделяя электроны.
Ядро окружено полем электронов. Электроны занимают орбитали, или валентности, группами по восемь. Во всех элементах, когда самая внешняя валентность атома содержит менее 8 электронов, атом будет связываться или реагировать с другими атомами, разделяя электроны.
Характеристики
Неметаллические элементы разделяют электроны, образуя ковалентные связи и становясь отдельными молекулами. Однако ионы металлов делят электроны с другими ионами металлов, образуя металлические связи. В металлических связях электроны не принадлежат конкретным атомам, а свободно перемещаются между всеми ионами металлов. Следовательно, ионы металлов не разделяются на молекулярные единицы. Скорее, они объединяются в высокоорганизованную структуру, называемую кристаллической решеткой. Внутри куска металла структура кристаллической решетки не является полностью однородной, а нарушается в определенных точках, называемых границами зерен.
Функция
Металлические связи в кристалле металла не так прочны, как ковалентные связи, поэтому, когда металл куется или вытягивается, атомы металла относительно легко скользят друг по другу, а не распадаются.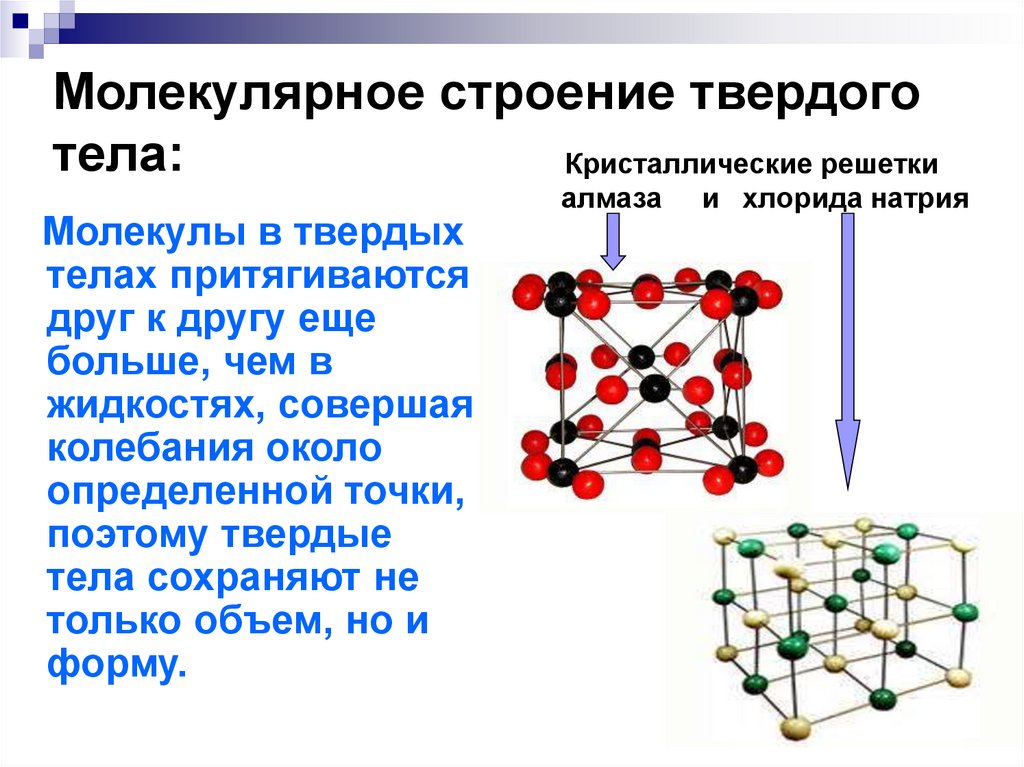 Таким образом, кристаллическая структура делает металл ковким. Количество границ зерен в кристаллической структуре металла также влияет на ковкость. Атомы металла могут легко скользить только в пределах границ зерен, поэтому большее количество границ зерен делает металл более твердым и менее податливым.
Таким образом, кристаллическая структура делает металл ковким. Количество границ зерен в кристаллической структуре металла также влияет на ковкость. Атомы металла могут легко скользить только в пределах границ зерен, поэтому большее количество границ зерен делает металл более твердым и менее податливым.
Эффекты
На пластичность также влияет количество или границы зерен в кристаллической структуре металла. Каждая граница зерна является слабым местом в металле. Таким образом, большее количество границ зерен делает металл менее пластичным и более хрупким. Нагрев металла заставляет атомы металла выстраиваться в более правильную кристаллическую структуру с меньшим количеством границ зерен, что делает металл более ковким и пластичным. Удары молотком или сгибание металла в холодном состоянии приводят к тому, что атомы металла смещаются, что увеличивает количество границ зерен и делает металл более твердым и хрупким.
Writer Bio
Эта статья была написана командой CareerTrend, отредактирована и проверена с помощью многоточечной системы аудита, чтобы наши читатели получали только лучшую информацию. Чтобы задать свои вопросы или идеи или просто узнать больше о CareerTrend, свяжитесь с нами [здесь](http://careertrend.com/about-us).
Чтобы задать свои вопросы или идеи или просто узнать больше о CareerTrend, свяжитесь с нами [здесь](http://careertrend.com/about-us).
Решетчатые структуры: значение, типы и примеры
Что общего у ионной, ковалентной и металлической связи? Дело в том, что все они могут образовывать решетчатые структуры. Поскольку каждая решетка имеет структуру и связи разных типов, это приводит к тому, что они имеют разные физические свойства, такие как различия в растворимости, температуре плавления и проводимости, которые можно объяснить их различной химической структурой.
- Во-первых, мы рассмотрим определение структуры решетки.
- После этого мы рассмотрим типы структур решетки: ионную, ковалентную и металлическую.
- Затем мы рассмотрим характеристики различных решеток.
- Мы рассмотрим несколько примеров решеток в этих разделах.
Определение структуры решетки
Если вы увеличите масштаб любого материала до атомного масштаба, вы обнаружите, что атомы расположены упорядоченно. Представьте себе каркас здания. Такое расположение атомов обычно является повторением основного расположения атомов. Эта «единица», которая может составить всю структуру материала, если повторяется достаточное количество раз, называется решетчатой структурой материала.
Представьте себе каркас здания. Такое расположение атомов обычно является повторением основного расположения атомов. Эта «единица», которая может составить всю структуру материала, если повторяется достаточное количество раз, называется решетчатой структурой материала.
Решетка представляет собой трехмерное расположение ионов или атомов в кристалле.
Типы решетчатых структур
Атомы или ионы в решетке могут быть расположены различными способами в трехмерной геометрии.
Структура гранецентрированной кубической (FCC) решетки
Это кубическая решетка с атомом или ионом в каждом из 4 углов куба, плюс атом в центре каждой из 6 граней куба. Отсюда и название гранецентрированная кубическая решетчатая структура.
Объемно-центрированная кубическая решетка
Как можно догадаться по названию, эта решетка представляет собой кубическую решетку с атомом или ионом в центре куба. Все углы имеют атом или ион, но не грани.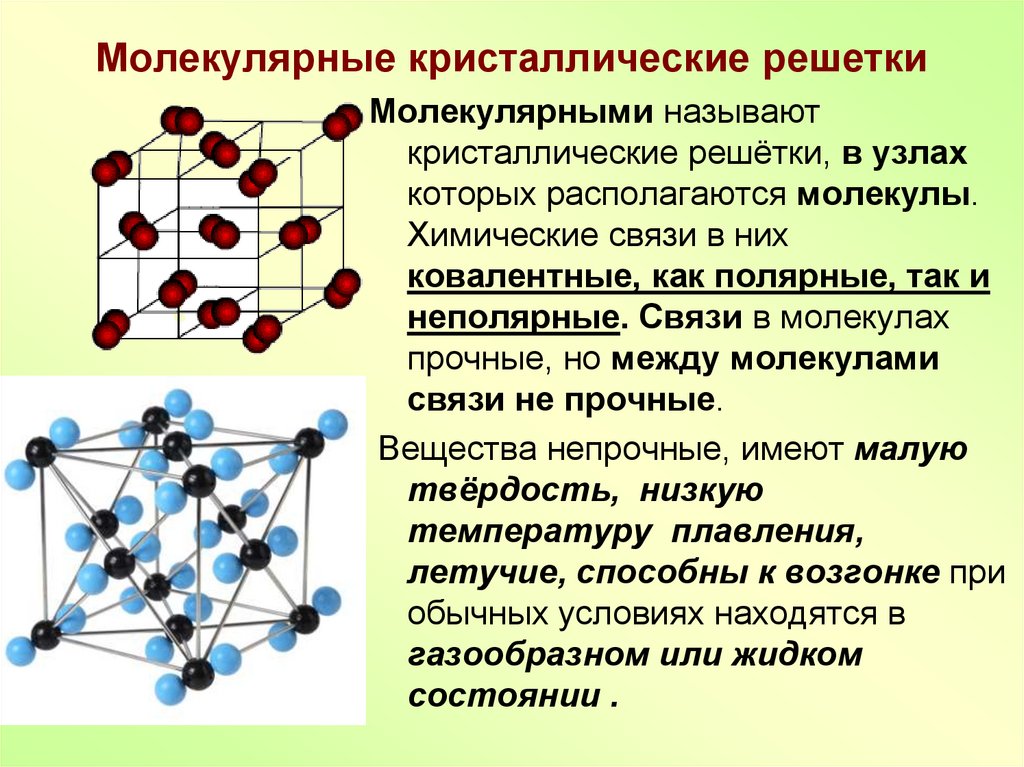
Объемно-центрированная кубическая решетка[1], Голарт, CC BY-SA 3.0, через Wikimedia Commons
Гексагональная плотнейшая решетчатая структура
Название этой решетчатой структуры может не сразу нарисовать картину в вашей голове. Эта решетка не кубическая, как две предыдущие. Решетку можно разделить на три слоя, в верхнем и нижнем слоях атомы расположены гексагонально. Средний слой состоит из 3 атомов, которые зажаты между двумя слоями, причем атомы плотно прилегают к промежуткам между атомами в двух слоях.
Представьте себе, что вы укладываете 7 яблок на верхний или нижний слой этой решетки. А теперь попробуйте положить 3 яблока поверх этих яблок — как бы вы это сделали? Вы бы поместили их в промежутки, именно так устроены атомы в этой решетке.
Примеры решетчатых структур
Теперь, когда мы знаем, как могут существовать атомы соединения, давайте рассмотрим некоторые примеры этих решетчатых структур.
Гигантская ионная решетка
Вы, возможно, помните из наших статей о связи, что ионная связь происходит посредством переноса электронов от металлов к неметаллам. Это заставляет металлы заряжаться, теряя электроны, образуя положительно заряженные ионы (катионы). Неметаллы, с другой стороны, становятся отрицательно заряженными, приобретая электроны. Таким образом, ионная связь включает сильные электростатические силы, возникающие между противоположно заряженными ионами в структуре решетки.
Это заставляет металлы заряжаться, теряя электроны, образуя положительно заряженные ионы (катионы). Неметаллы, с другой стороны, становятся отрицательно заряженными, приобретая электроны. Таким образом, ионная связь включает сильные электростатические силы, возникающие между противоположно заряженными ионами в структуре решетки.
Эти соединения могут быть организованы в гигантские ионные решетки, называемые ионными кристаллами . Их называют «гигантскими», поскольку они состоят из большого количества одних и тех же ионов, расположенных в повторяющемся порядке.
Примером гигантской ионной решетки является хлорид натрия, NaCl. В решетке хлорида натрия ионы Na + и ионы Cl – притягиваются друг к другу в противоположных направлениях. Ионы упакованы вместе в кубическую форму, при этом отрицательные ионы больше по размеру, чем положительные ионы.
Схема гигантской ионной решетки NaCl. StudySmarter Originals
Другим примером гигантской ионной решетки является оксид магния, MgO. Подобно решетке NaCl, в ее решетке ионы Mg2+ и O2- притягиваются друг к другу. А также подобно решетке NaCl, они упакованы вместе в кубическую решетку. Отрицательные ионы кислорода больше, чем положительные ионы магния.
Подобно решетке NaCl, в ее решетке ионы Mg2+ и O2- притягиваются друг к другу. А также подобно решетке NaCl, они упакованы вместе в кубическую решетку. Отрицательные ионы кислорода больше, чем положительные ионы магния.
Решетчатая структура оксида магния, MgO | Embibe
Ковалентные решетки
Еще одним важным типом связи является ковалентная связь. Ковалентная связь возникает только между неметаллами.
Ковалентная связь — это сильное электростатическое притяжение между двумя положительными ядрами и общей парой электронов между ними.
Существует два типа структур, которые могут содержать ковалентные связи: гигантские ковалентные структуры и простые ковалентные структуры. Разница между ними в том, что электростатическое притяжение, скрепляющее гигантские структуры, сильнее, чем электростатическое притяжение, удерживающее простые структуры.
Простые молекулы
Некоторыми примерами простых молекулярных решеток могут быть йод, бакминстерфуллерен (C 60 ) и лед.
Бакминстерфуллерен (C60) представляет собой аллотроп углерода, что означает, что его молекулы состоят только из атомов углерода. Всего в бакминстерфуллерене (C 60 ) 60 атомов углерода, которые расположены в 20 гексагональных и 12 пентагональных кольцах. Эти кольца образуют сферическую структуру.
Диаграмма, представляющая бакминстерфуллерен (C 60 ). Studysmarter Originals
При замерзании воды молекулы h3O образуют кристаллическую решетку. Знаете ли вы, что вода расширяется при замерзании? Это связано с тем, что молекулы воды получают больше пространства между собой, когда расположены в кристаллической структуре, чем в жидком состоянии. Красные кружки — атомы кислорода, желтые кружки — атомы водорода.
Йод — еще одна простая молекула, молекулы которой расположены в кристаллической решетке. Молекулы йода образуют гранецентрическую кубическую решетку. Гранецентрическая кубическая решетка представляет собой куб из молекул с другими молекулами в центре граней куба.
Элементарная ячейка йода, размещена в открытом доступе, Wikimedia commons
Решетку йода может быть немного сложно визуализировать даже с помощью изображения. Посмотрите на решетку сверху — вы увидите, что молекулы на правой и левой сторонах куба выровнены одинаково, а в середине — в другом.
Гигантские ковалентные структуры
Примерами гигантских молекулярных решеток являются графит, алмаз и оксид кремния (IV).
Формы гигантских молекулярных решеток. StudySmarter Originals
Графит является аллотропом углерода, т. е. полностью состоит из атомов углерода. Графит представляет собой гигантскую ковалентную структуру, поскольку в одной молекуле графита могут существовать миллионы атомов углерода. Атомы углерода расположены в виде шестиугольных колец, а несколько колец соединены вместе, образуя слой. Графит состоит из нескольких таких слоев, уложенных друг на друга.
Структура графита, общедоступная, Викисклад.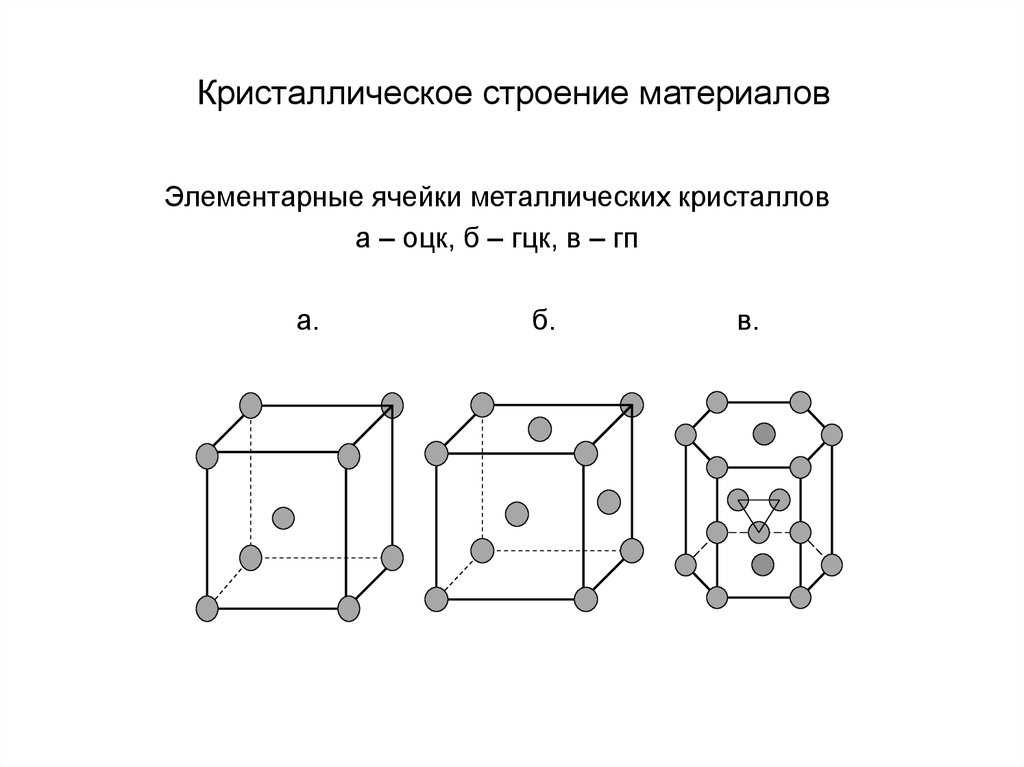
Связи, общие для атомов углерода в слое, являются сильными ковалентными связями. Каждый атом углерода образует 3 одинарных ковалентных связи с 3 другими атомами углерода. Между слоями существуют слабые межмолекулярные силы (показаны на рисунке пунктирными линиями). Графит — это уникальный материал с очень интересными свойствами и применением, о которых вы можете узнать больше в статье, посвященной графиту.
Алмаз — еще одна аллотропная форма углерода с гигантской ковалентной структурой. Алмаз и графит полностью состоят из углерода, но имеют совершенно разные свойства. Это связано с разницей в структуре решетки двух соединений. В алмазе атомы углерода расположены в тетраэдрической структуре. Каждый атом углерода образует 4 одинарных ковалентных связи с 4 другими атомами углерода.
Структура алмаза | Углерод расположен в тетраэдрической геометрии | находится в открытом доступе, Wikimedia Commons
Эта тетраэдрическая геометрия делает алмаз самым твердым материалом в мире! Подробнее о Diamond вы можете прочитать в статье, посвященной ему.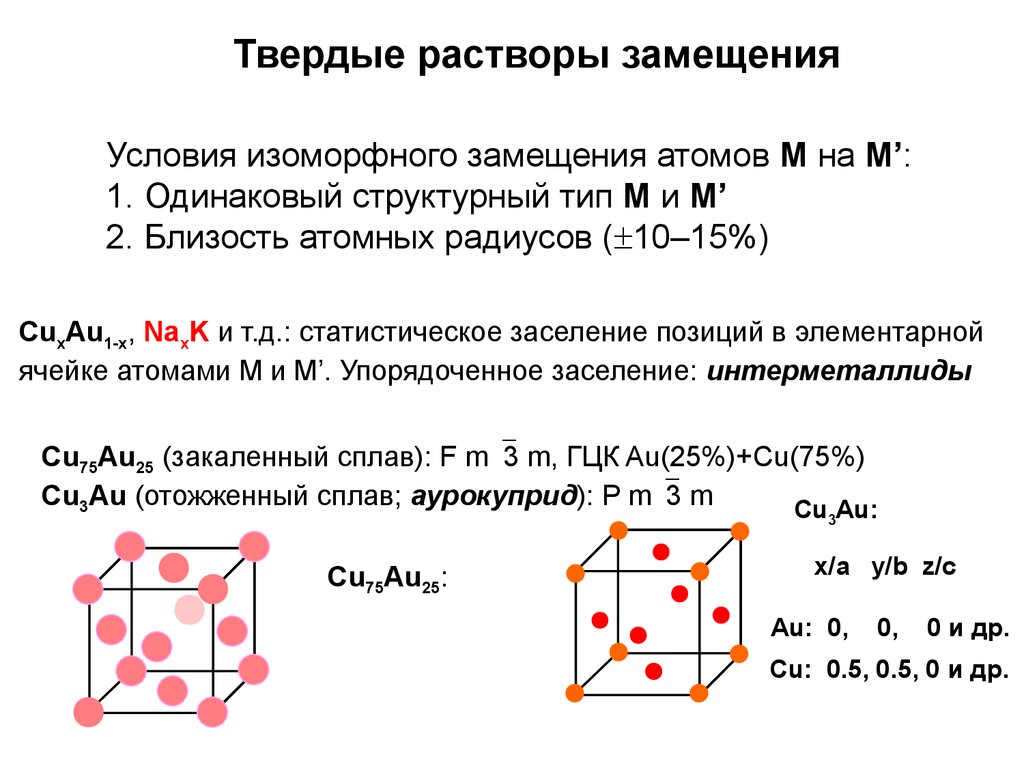
Другим примером гигантской ковалентной структуры является оксид кремния (IV), также известный как кремнезем. Кремнезем является основным компонентом песка. Химическая формула кремнезема: SiO 2 . Подобно алмазу, атомы кремнезема также расположены в тетраэдрической геометрии.
Тетраэдрическая геометрия диоксида кремния | Создано с использованием изображений из Викисклада, размещенных в открытом доступе
Из-за тетраэдрической структуры оксид кремния (IV) очень твердый. Силикагель также используется в производстве стекла.
Металлические решетки
Когда атомы металлов плотно упакованы вместе, они образуют правильную форму, которую мы называем гигантской металлической решеткой.
Внутри этой решетки есть свободные электроны на внешней оболочке атомов металла. Эти свободные электроны также известны как «делокализованные» электроны, и они могут свободно дрейфовать по структуре, позволяя образовываться положительным ионам. Это приводит к возникновению металлической связи.
Это приводит к возникновению металлической связи.
Металлическая связь — это сильное электростатическое притяжение между делокализованными электронами и положительными ионами металла.
Примером металлической решетки является кальций, и его ионы имеют заряд 2+. Медь образует гранецентрированную кубическую (ГЦК) решетку . В решетке FCC в каждой вершине куба есть атом, и в центре каждой грани куба есть атом. Металлы образуют гигантские металлические структуры, поскольку состоят из миллионов атомов.
Характеристики решеток
Ионные решетки
Гигантские ионные решетки имеют очень высокие температуры плавления и кипения из-за сильного притяжения, удерживающего ионы вместе.
Они проводят электричество, но только когда они растворены или расплавлены. Когда ионные решетки находятся в твердом состоянии, их ионы фиксируются на месте и не могут двигаться, поэтому электричество не проводится.
Гигантские ионные решетки растворимы в воде и полярных растворителях; однако они нерастворимы в неполярных растворителях. Полярные растворители имеют атомы, которые имеют большую разницу в электроотрицательности. Неполярные растворители содержат атомы с относительно небольшой разницей в электроотрицательности.
Ковалентные решетки
Простые ковалентные решетки:Простые ковалентные решетки имеют низкие температуры плавления и кипения, потому что они имеют слабые межмолекулярные силы между молекулами. Следовательно, для разрушения решетки требуется лишь небольшое количество энергии.
Они не проводят электричество ни в одном из состояний — твердом, жидком или газообразном, поскольку в них нет ионов или делокализованных электронов, которые могли бы перемещаться по структуре и нести заряд.
Простые ковалентные решетки более растворимы в неполярных растворителях и нерастворимы в воде.
Гигантские ковалентные решетки имеют высокие температуры плавления и кипения, поскольку для разрыва прочных связей между молекулами требуется большое количество энергии.
Большинство этих соединений не могут проводить электричество, потому что нет свободных электронов, способных нести заряд. Однако графит может проводить электричество, поскольку имеет делокализованные электроны.
Эти типы решеток нерастворимы в воде, так как не содержат ионов.
Металлические решетки
Гигантские металлические решетки имеют умеренно высокие температуры плавления и кипения из-за сильной металлической связи.
Эти решетки могут проводить электричество, когда они твердые или жидкие, поскольку свободные электроны доступны в обоих состояниях и могут дрейфовать вокруг структуры, несущей электрический заряд.
Они нерастворимы в воде из-за очень прочных металлических связей.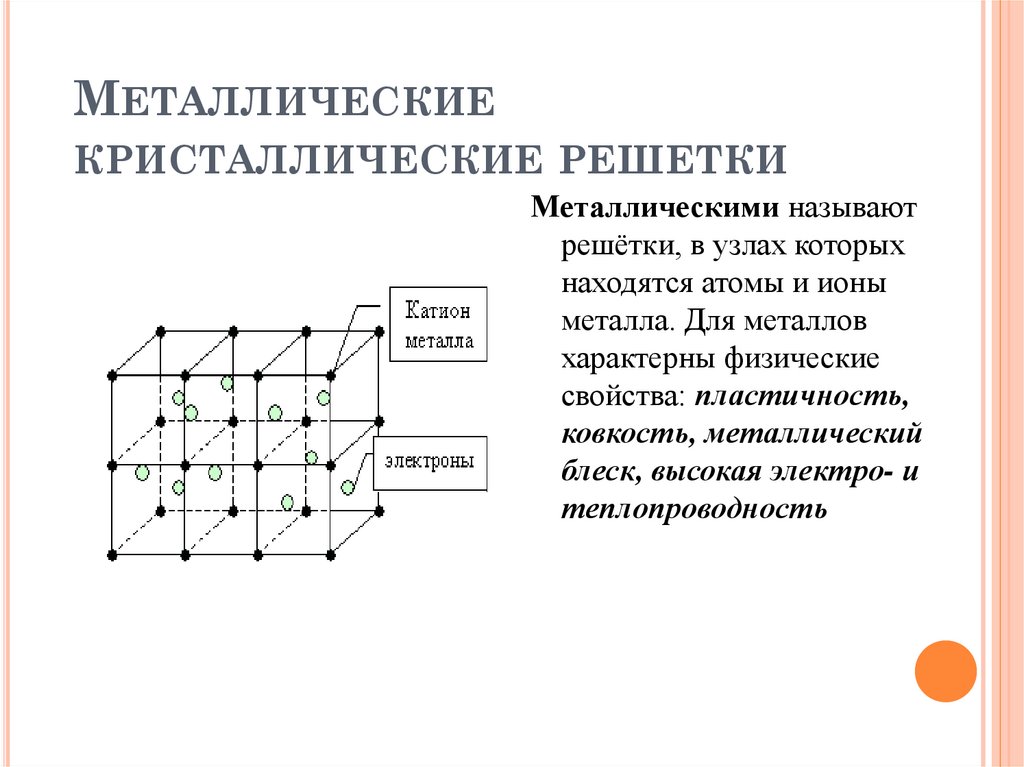 Однако растворяться они могут только в жидких металлах.
Однако растворяться они могут только в жидких металлах.
Параметры решетки
Теперь, когда мы поняли различные типы решетчатых структур и их характеристики, мы теперь рассмотрим параметры решетки, которые будут описывать геометрию элементарной ячейки кристалла.
Параметры решетки – это физические размеры и углы элементарной ячейки.
Элементарная ячейка простого куба с отмеченными параметрами решетки | Арчана Тадимети | StudySmarter Originals
Параметры решетки для этого простого куба: a,b,c и углы \( \alpha , \beta , \gamma \). Все они вместе называются параметрами решетки, которые одинаковы для некоторых других кубических систем, таких как FCC или BCC. 9\цирк\).
Константы решетки
“Постоянная решетки относится к постоянному расстоянию между элементарными ячейками в кристаллической решетке.” [2]
Постоянная решетки уникальна для каждого кристалла в зависимости от структуры их элементарной ячейки. Например, постоянная решетки а полония составляет 0,334 нм или 3,345 А ° . Как это было получено?
Например, постоянная решетки а полония составляет 0,334 нм или 3,345 А ° . Как это было получено?
Чтобы понять это, давайте посмотрим, как атомы полония распределены в его простой кубической решетке.
Простой кубический кристалл | Cdang, Samuel Dupré, Daniele Pugliesi CC BY-SA 3.0, via Wikimedia Commons[3]
Каждый атом Po находится в углах куба. Как вы знаете, этот куб не одинок, а трехмерно окружен элементарными ячейками. Вот почему на этой картинке изображены только те части атома (предполагаемые сферами), которые находятся внутри данной элементарной ячейки, следовательно, нарисованы как бы «обрубленные» атомы, оставшиеся запасные части которых находятся с другими элементарными ячейками, окружающими эту элементарную ячейку.
Теперь вернемся к длине каждого ребра этой элементарной ячейки, представленной буквой «а». Каждый атом на краю имеет радиус ‘r’. Таким образом, длина ребра \(a = r + r = 2r \).
Теперь, когда мы поняли, что \( a = 2r\) , мы воспользуемся этим для расчета постоянной решетки полония.
Из периодической таблицы атомный радиус полония , \(r = 0,168\пространственная нм \) . Следовательно, постоянная решетки полония равна \( 2 \times r = 2 \times 0,168 \space nm = 0,336\space nm \) .
Теперь, когда мы поняли, что такое постоянная решетки, давайте перейдем к нескольким способам изучения структур решетки.
Использование структуры решетки
Структура решетки, которую образуют атомы соединения, влияет на его физические свойства, такие как пластичность и пластичность. Когда атомы расположены в гранецентрированной кубической структуре решетки, соединение проявляет высокую пластичность. Соединения с ГПУ-решеткой обладают наименьшей деформируемостью. Соединения с ОЦК структурой решетки находятся между соединениями с ГЦК и ГПУ с точки зрения пластичности и пластичности.
Свойства, на которые влияют решетчатые структуры, используются во многих материалах. Например, атомы в графите расположены в ГПУ-решетке. Поскольку атомы расположены со смещением относительно атомов в слоях выше и ниже, слои могут относительно легко сдвигаться друг относительно друга. Это свойство графита используется в стержнях для карандашей – слои могут легко смещаться и отделяться и осаждаться на любой поверхности, позволяя карандашу «писать».
Это свойство графита используется в стержнях для карандашей – слои могут легко смещаться и отделяться и осаждаться на любой поверхности, позволяя карандашу «писать».
Решетчатые конструкции — основные выводы
- Решетка представляет собой трехмерное расположение ионов или атомов в кристалле.
- Гигантские ионные решетки называются «гигантскими», поскольку они состоят из большого количества одинаковых ионов, расположенных в повторяющемся порядке.
- Ионы в гигантской ионной решетке притягиваются друг к другу в противоположных направлениях.
- Существует два типа ковалентных решеток: гигантские ковалентные решетки и простые ковалентные решетки.
- Электростатическое притяжение, скрепляющее гигантские структуры, сильнее, чем электростатическое притяжение, удерживающее простые структуры.
- Металлы образуют гигантские металлические решетчатые структуры, состоящие из плотно упакованных атомов правильной формы.
Ссылки
- Голарт, CC BY-SA 3.