Строение металлической кристаллической решетки: Типы кристаллических решёток — урок. Химия, 8 класс.
alexxlab | 20.07.2023 | 0 | Разное
Кристаллическое строение металлов. Кристаллическая решетка металлов
Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. В каждую эпоху предпочтение отдавалось разным видам этих удивительных веществ. Так, IV-III тысячелетия до нашей эры считаются веком хальколита, или медным. Позже его сменяет бронзовый, а затем в силу вступает тот, что и по сей день является актуальным — железный.
Сегодня вообще сложно представить, что когда-то можно было обходиться без металлических изделий, ведь практически все, начиная от предметов быта, медицинских инструментов и заканчивая тяжелой и легкой техникой, состоит из этого материала или включает в свой состав отдельные части из него. Почему же металлы сумели завоевать такую популярность? В чем проявляются особенности и как это заложено в их строении, попробуем разобраться далее.
Общее понятие о металлах
«Химия. 9 класс» — это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.
Химические свойства меди:
| 300 | Химические свойства | |
| 301 | Степени окисления | -2, 0, +1, +2 , +3, +4 |
| 302 | Валентность | I, II |
| 303 | Электроотрицательность | 1,90 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 745,48 кДж/моль (7,726380(4) эВ) |
| 305 | Электродный потенциал | Cu+ + e— → Cu, Eo = +0,520 В, Cu2+ + e— → Cu+, Eo = +0,153 В, Cu2+ + 2e— → Cu, Eo = +0,337 В |
| 306 | Энергия сродства атома к электрону | 119,235(4) кДж/моль (1,23578(4) эВ) |
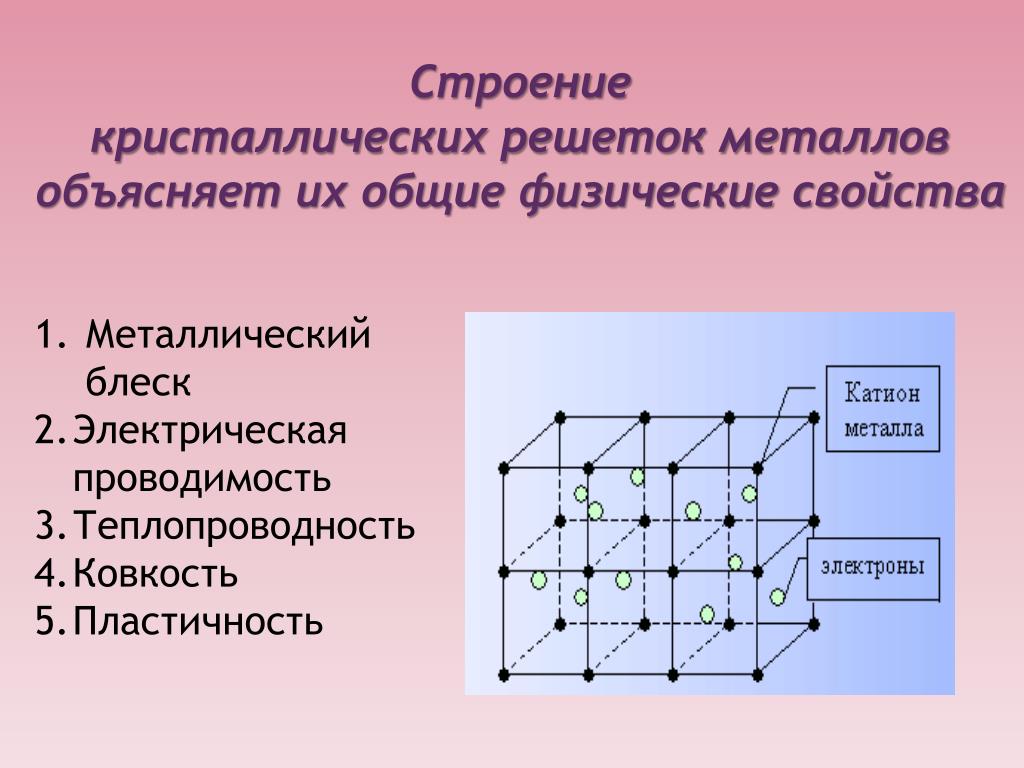
Свойства металлов
К специфическим свойствам рассматриваемых веществ относят следующие.
- Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
- Ковкость и пластичность — способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
- Электропроводность и теплопроводность — одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.
1.3. Кристаллографические направления и плоскости
Упорядоченность кристаллического строения в пространственной решетке позволяет выделить отдельные кристаллографические направления и плоскости.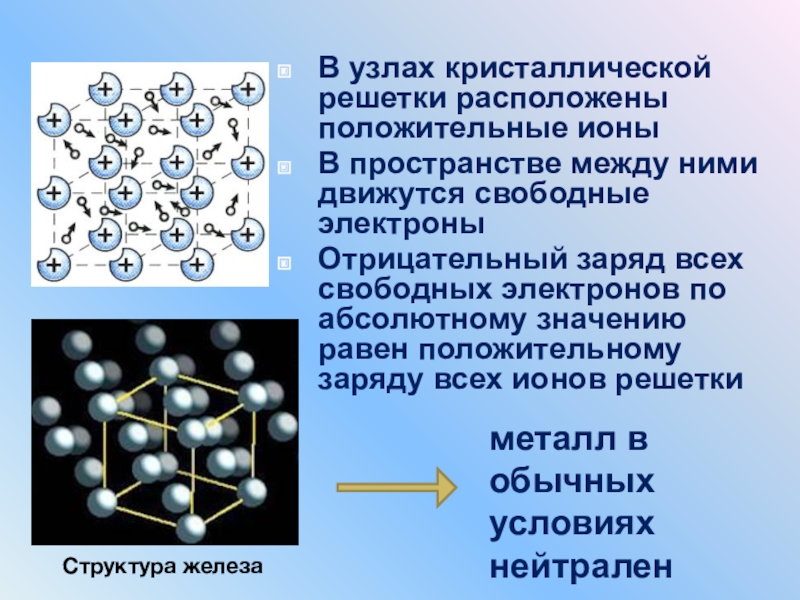
Кристаллографические направления — это характерные прямые линии, выходящие из точки отсчета, вдоль которых в кристаллической решетке располагаются атомы. Точками отсчета, могут служить вершины куба, а кристаллографическими направлениями — его ребра и диагонали, а также диагонали граней (рис. 1.4, а).
Рис. 1.4. Кристаллографические направления и плоскости в кристаллической решетке: а) — основные направления и их обозначение; б), в), г)
— основные плоскости и их обозначение
Кристаллографическими плоскостями являются, например, плоскости граней кубов (рис. 1.4, б), а также их различные диагональные плоскости вместе с находящимися на них атомами (рис. 1.4, в, г). Для ГПУ-решеток кристаллографическими плоскостями могут быть плоскости оснований (рис. 1.2, г).
Для определения индекса какого-либо направления необходимо найти индекс ближайшего к данной точке отсчета атома, находящегося на данном направлении. Например, индекс ближайшего атома вдоль оси ОХ
обозначается цифрами 100 (рис.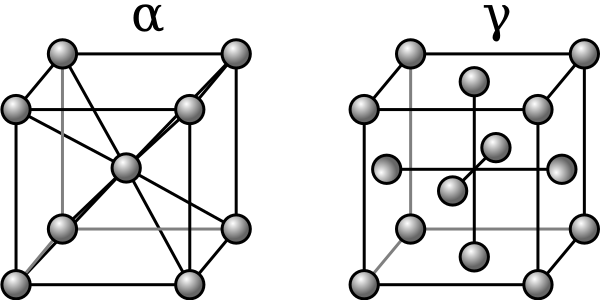 1.4,а). Эт и цифры представляют собой координаты упомянутого атома относительно точки О, выраженные через количество параметров вдоль осей OX,
1.4,а). Эт и цифры представляют собой координаты упомянутого атома относительно точки О, выраженные через количество параметров вдоль осей OX,
OY
и
OZ
соответственно.
Индексы направления ОХ и параллельных ему направлений обозначаются [100]. Соответственно направления OY
и
OZ
обозначаются [010] и [001]. Кристаллографические направления вдоль диагоналей граней
XOZ, XOY
и
YOZ
обозначают [101], [110] и [011]. Пользуясь указанной методикой, можно определить индекс любого направления. Например, индекс направления вдоль диагонали куба выразится так: [111].
Атомно-кристаллическое строение металлов
В чем же заключается такое строение, чем характеризуется? Само название говорит о том, что все металлы представляют собой кристаллы в твердом состоянии, то есть при обычных условиях (кроме ртути, которая является жидкостью). А что такое кристалл?
Это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки. Химия, физика и металловедение — это науки, которые занимаются изучением особенностей строения таких структур.
Сама элементарная ячейка — это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства.
Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность — в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Страница про автора
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Типы кристаллических решеток
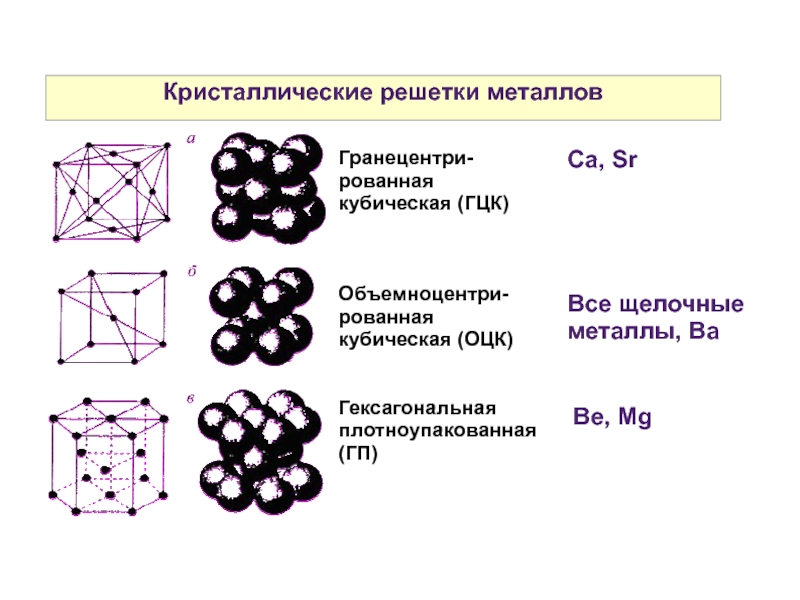
Четырнадцать вариантов строения решетки принято объединять в три основных типа. Они следующие:
- Объемно-центрированная кубическая.

- Гексагональная плотноупакованная.
- Гранецентрированная кубическая.
Кристаллическое строение металлов было изучено только благодаря электронной микроскопии, когда стало возможным получать большие увеличения изображений. А классификацию типов решеток впервые привел французский ученый Браве, по фамилии которого их иногда называют.
Кристаллическая решётка меди:
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 3,615 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 315 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
Объемно-центрированная решетка
Строение кристаллической решетки металлов данного типа представляет собой следующую структуру. Это куб, в узлах которого находится восемь атомов. Еще один располагается в центре свободного внутреннего пространства ячейки, что и объясняет название «объемно-центрированная».
Это куб, в узлах которого находится восемь атомов. Еще один располагается в центре свободного внутреннего пространства ячейки, что и объясняет название «объемно-центрированная».
Это один из вариантов наиболее простого строения элементарной ячейки, а значит, и всей решетки в целом. Такой тип имеют следующие металлы:
- молибден;
- ванадий;
- хром;
- марганец;
- альфа-железо;
- бетта-железо и другие.
Основные свойства таких представителей — высокая степень ковкости и пластичности, твердость и прочность.
Атомная решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Гранецентрированная решетка
Кристаллическое строение металлов, имеющих гранецентрированную кубическую решетку, представляет собой следующую структуру. Это куб, который включает в свой состав четырнадцать атомов. Восемь из них формируют узлы решетки, а еще шесть расположены по одному на каждой грани.
Подобную структуру имеют:
- алюминий;
- никель;
- свинец;
- гамма-железо;
- медь.
Основные отличительные свойства — блеск разного цвета, легкость, прочность, ковкость, повышенная устойчивость к коррозии.
Виды решеток
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:

Металлическаякристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Гексагональная решетка
Кристаллическое строение металлов, обладающих данным типом решетки, следующее. В основе элементарной ячейки лежит шестигранная призма. В ее узлах располагается 12 атомов, еще два по основаниям и три атома свободно лежат внутри пространства в центре структуры. Всего семнадцать атомов.
Подобную сложную конфигурацию имеют такие металлы, как:
- альфа-титан;
- магний;
- альфа-кобальт;
- цинк.
Основные свойства — высокая степень прочности, сильный серебристый блеск.
1.4. Анизотропия в кристаллах
Под анизотропией
понимается неодинаковость механических и других свойств в кристаллических телах вдоль различных кристаллографических направлений. Она является естественным следствием кристаллического строения, так как на различных кристаллографических плоскостях и вдоль различных направлений плотность атомов различна.
Например, в кубических решетках (см. рис. 1.2, б, в) по направлениям вдоль ребер насчитывается меньше атомов, чем вдоль диагоналей куба в ОЦК-решетке или диагоналей граней в ГЦК-решетке. На плоскостях, проходящих через грани ОЦК- и ГЦК-решеток, находится меньше атомов, чем на диагональных плоскостях.
Поскольку механические, физические и химические свойства вдоль различных направлений зависят от плотности находящихся на них атомов, то перечисленные свойства вдоль различных направлений в кристаллических телах должны быть неодинаковыми.
Анизотропия проявляется только в пределах одного монокристалла или зерна-кристаллита. В поликристаллических телах она не наблюдается из-за усреднения свойств по каждому направлению для огромного количества произвольно ориентированных друг относительно друга зерен. Поэтому реальные металлы являются квазиизотропными телами, т. е. псевдоизотропными.
Рис. 1.5. Элементарная ячейка решетки ОЦК
Сдвиг в кристалле происходит наиболее легко вдоль атомных плоскостей с наиболее плотной упаковкой атомов. Рассмотрим объемно-центрическую кубическую решетку (ОЦК) (рис. 1.5):
Рассмотрим объемно-центрическую кубическую решетку (ОЦК) (рис. 1.5):
1) Плоскость ABCD (рис 1.6 а) . Количество атомов в плоскости ABCD – 1; площадь ABCD = a 2 ; площадь, приходящаяся на 1 атом – удельная площадь:
– мера плотности упаковки.
Рис. 1.6. Плоскости решетки ОЦК
а) — базисная плоскость; б) — плоскость с максимальной упаковкой атомов
2) Плоскость ABGH (рис 1.6 б) . Количество атомов в плоскости ABGH – 2; площадь ABGH = a 2
;
В плоскости ABGH плотность упаковки больше чем в AB С D . Наиболее вероятен сдвиг вдоль диагональных плоскостей.
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.
1.1. Аморфные и кристаллические тела
В твердых телах атомы могут размещаться в пространстве двумя способами:
Беспорядочное расположение атомов, когда они не занимают определенного места друг относительно друга. Такие тела называются аморфными
.
Аморфные вещества обладают формальными признаками твердых тел, т.е. они способны сохранять постоянный объем и форму. Однако они не имеют определенной температуры плавления или кристаллизации.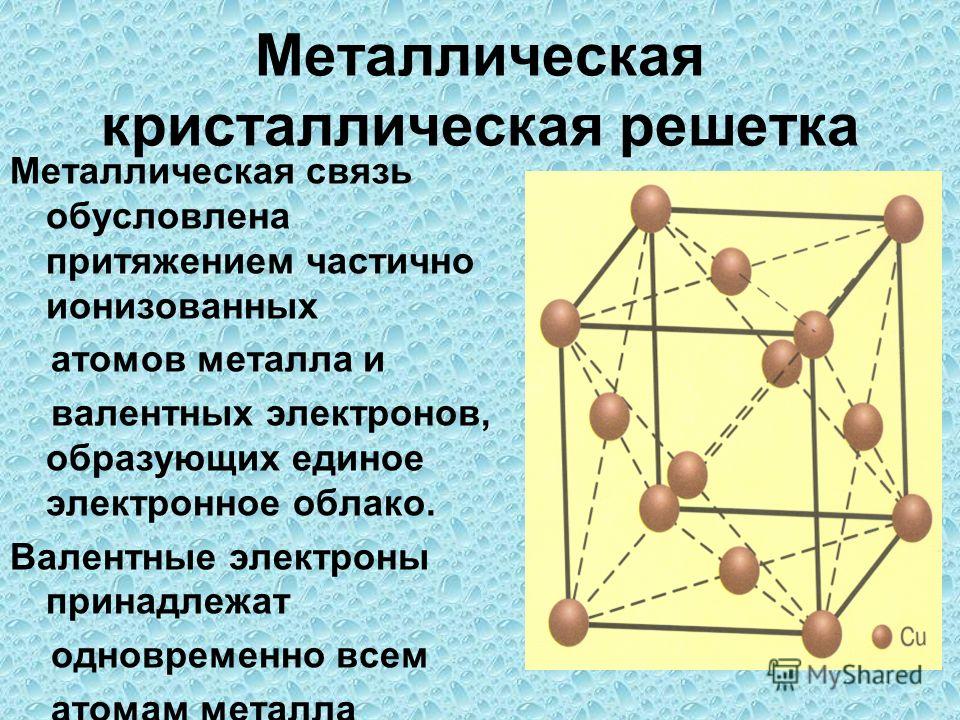
Упорядоченное расположение атомов, когда атомы занимают в пространстве вполне определенные места, Такие вещества называются кристаллическими
.
Атомы совершают относительно своего среднего положения колебания с частотой около 10 13 Гц . Амплитуда этих колебаний пропорциональна температуре .
Благодаря упорядоченному расположению атомов в пространстве, их центры можно соединить воображаемыми прямыми линиями. Совокупность таких пересекающихся линий представляет пространственную решетку, которую называют кристаллической решеткой
.
Внешние электронные орбиты атомов соприкасаются, так что плотность упаковки
атомов в кристаллической решетке весьма велика.
Кристаллические твердые тела состоят из кристаллических зерен — кристаллитов. В соседних зернах кристаллические решетки повернуты относительно друг друга на некоторый угол.
В кристаллитах соблюдаются ближний и дальний порядки. Это означает наличие упорядоченного расположения и стабильности как окружающих данный атом ближайших его соседей (ближний порядок
), так и атомов, находящихся от него на значительных расстояниях вплоть до границ зерен (
дальний порядок
).
Рис. 1.1. Расположение атомов в кристаллическом (а) и аморфном (б) веществе
Вследствие диффузии
отдельные атомы могут покидать свои места в узлах кристаллической решетки, однако при этом упорядоченность кристаллического строения в целом не нарушается.
Значение знаний о кристаллическом строении металлов
Из вышеизложенного материала очевидно, что знания о тонкой структуре и строении позволяют спрогнозировать свойства материала и повлиять на них. И это позволяет делать наука химия. 9 класс общеобразовательной школы делает в процессе обучения упор на то, чтобы сформировать у учащихся четкое понятие о важном значении основополагающей логической цепочки: состав — строение — свойства — применение.
Сведения о кристаллическом строении металлов очень четко иллюстрирует эту зависимость и позволяет учителю наглядно объяснить и показать детям, насколько важно знать тонкую структуру, чтобы правильно и грамотно использовать все свойства.
1.
 5. Аллотропия металлов
5. Аллотропия металловНекоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение, т. е. изменять тип элементарной ячейки своей кристаллической решетки. Это явление получило название аллотропии
или
полиморфизма
, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
На рис. 1.7 показано изменение свободной энергии
F
от температуры
t
для двух вариантов кристаллического строения железа: ОЦК (кривая
1
) и ГЦК (кривая
2).
В интервале температур 911-1392 о C железо имеет решетку ГЦК, так как при этом его свободная энергия меньше. При t 1392°С, у него должна быть решетка ОЦК, обладающая меньшей свободной энергией.
Рис. 1.7. Изменение свободной энергии (Fсв) в зависимости от температуры (T) и типа кристаллической решетки: 1 — для ОЦК-решетки; 2 — для ГЦК-решетки
Разные аллотропические формы металлов обозначаются буквами греческого алфавита, при этом низкотемпературные модификации обозначаются буквой a
, а последующие в порядке роста температур — буквами
b, g ,d
и т.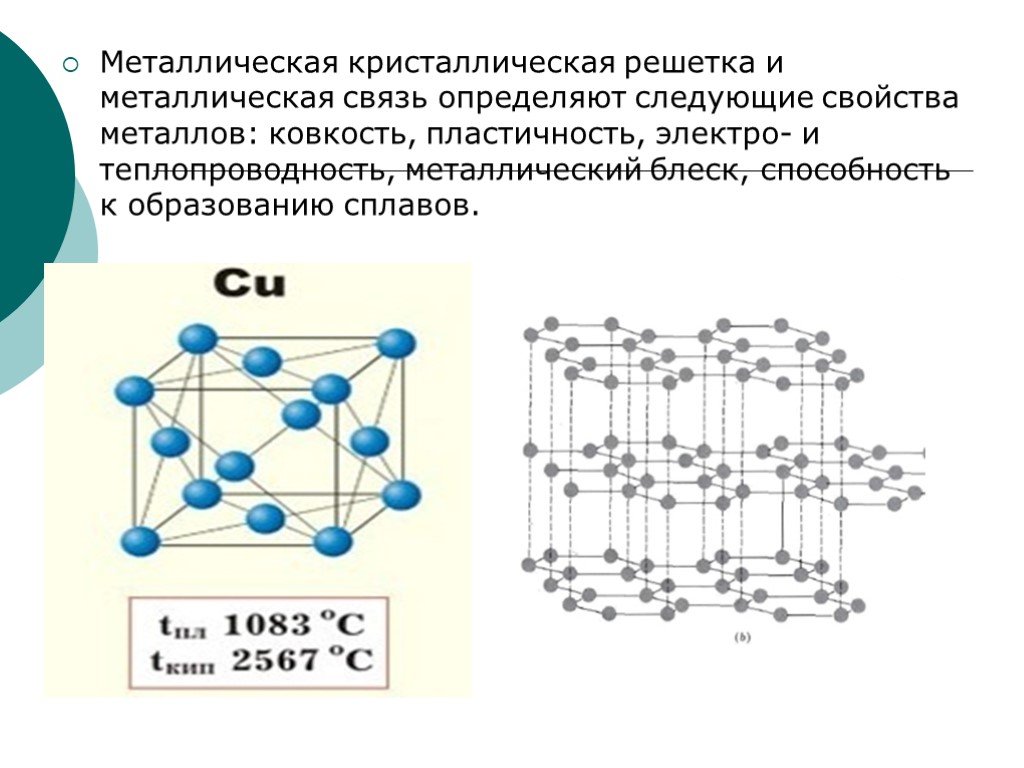 д. Аллотропическими формами железа являются: до 911°С — альфа-железо (
д. Аллотропическими формами железа являются: до 911°С — альфа-железо (
a
-Fe), имеющее ОЦК-решетку, от 911°С до 1392 °С -гамма-железо (
g
-Fe) с решеткой ГЦК и от 1392°С до 1539 °С т. е. до температуры плавления — снова
a
-Fe с решеткой OЦK, однако, чтобы отличить его от низкотемпературной модификации, его принято называть дельта-железом (
d
-F е).
Известное в практике так называемое немагнитное бета-железо ( b
-Fe) самостоятельной аллотропической формой не является, так как имеет такую же, как у
a
-Fe ОЦК-решетку и отличается от него только отсутствием магнитных свойств, которые оно теряет при 768°С (
точка Кюри
).
Молекулярная кристаллическая решётка
В узлах этой структуры находятся молекулы, которые плотно упакованы между собой. Для таких веществ характерна ковалентная полярная и неполярная связь. Интересно, что независимо от ковалентной связи, между частицами образуете очень слабое притяжение (из-за слабых ван-дер-вальсовых сил). Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
Именно поэтому такие вещества очень хрупкие, обладают низкой температурой кипения и плавления, а также они летучие. К таким веществам относятся: вода, органические вещества (сахар, нафталин), оксид углерода (IV), сероводород, благородные газы, двух– (водород, кислород, хлор, азот, йод), трёх- (озон), четырёх- (фосфор), восьмиатомные (сера) вещества и так далее.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам в личном кабинете
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно его приобрести.
Получите невероятные возможности
Конспект урока «Типы кристаллических решёток»
Для определения типа кристаллической решётки поступают следующим образом. Если связь в соединении ионная, то кристаллическая решётка всегда ионного типа
: хлорид калия, нитрат калия, нитрид кальция, карбид кальция, оксид алюминия.
Если связь металлическая, то и кристаллическая решётка всегда металлическая
: латунь, железо, медь, натрий.
Если связь ковалентная, то решётка может быть, как атомной
, так и
молекулярной
. Веществами с атомной кристаллической решёткой являются: карборунд, оксид кремния четыре, бор, кремний, алмаз, графит, чёрный и красный фосфор.
У веществ с молекулярной кристаллической решёткой
в узлах кристаллической решётки расположены молекулы,
прочность данной связи слабая
.
Для веществ с
характерны низкие
температуры плавления
, то есть они легкоплавки и летучи, значительная сжимаемость, иногда запах, а также явление сублимации, или возгонки, как для йода и твёрдого углекислого газа.
Для веществ с молекулярной кристаллической решёткой
характерна
небольшая твёрдость
, большинство этих веществ хорошо растворимы в воде. Молекулярную кристаллическую решётку имеют газы и жидкости в твёрдом агрегатном состоянии. Например, кристаллический йод, сера, белый фосфор, углекислый газ, большинство органических соединений.
Например, кристаллический йод, сера, белый фосфор, углекислый газ, большинство органических соединений.
У веществ с атомной кристаллической решёткой
в узлах расположены атомы.
Связь между атомами в кристаллические решётки
–
ковалентная
, очень прочная. Для этих веществ характерны высокие температуры кипения и плавления, то есть они тугоплавки и нелетучий, очень твёрдые, практически не растворимы в воде и не имеют запаха.
Примером веществ с таким типом кристаллических решёток являются алмаз и графит.
Как известно, твёрдость алмаза
оценивается по шкале Мооса самым высоким значением – 10. Благодаря высокой твёрдости алмаз используют для изготовления буров, свёрл, шлифовальных инструментов, стеклорезов. Алмаз является камнем ювелиров, они используют отшлифованные алмазы – бриллианты.
Графит
также является веществом с атомной кристаллической решёткой, но несмотря на это, он мягкий, так как имеет слоистую структуру.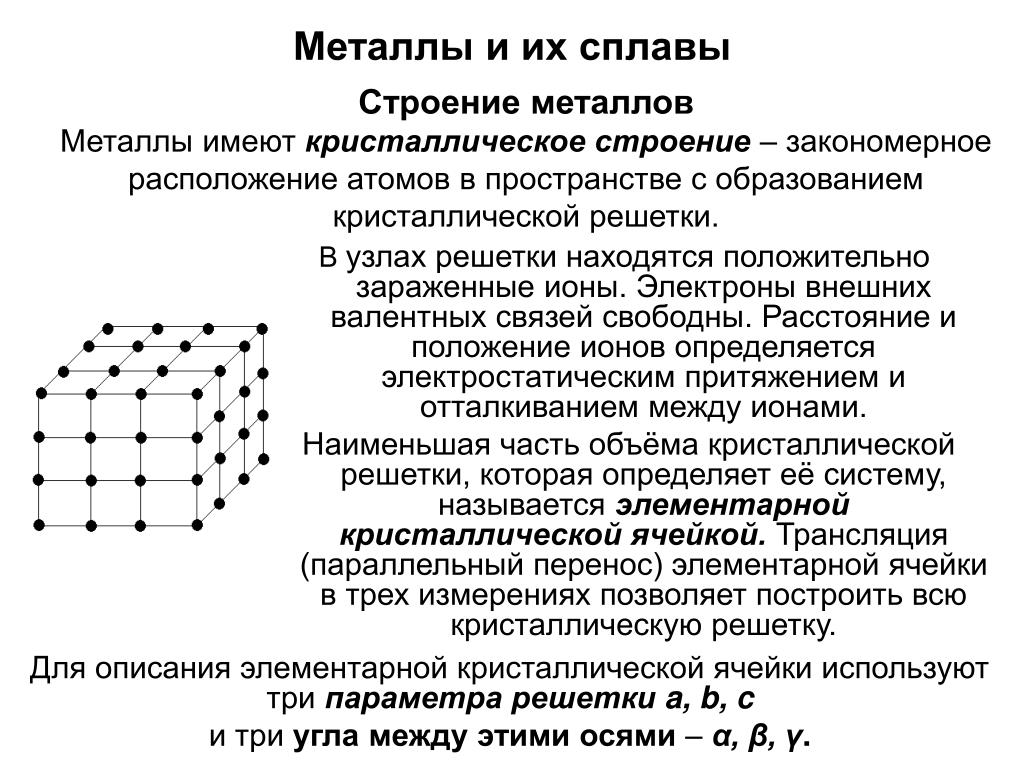 В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, связаны в правильные шестиугольники.
В кристаллической решётке графита атомы углерода, лежащие в одной плоскости, связаны в правильные шестиугольники.
Связи между слоями непрочные
, за счёт этого графит мягкий. Графит, как и алмаз, тугоплавкий. Из него изготавливают электроды, твёрдые смазки, стержни для карандашей, замедлители нейтронов в ядерных реакторах.
Атомные кристаллические решётки имеют не только простые, но и сложные вещества. Например, все разновидности оксида алюминия. Такие, как наждак, корунд, рубин, сапфир.
Наиболее распространённое соединение кремния
– это оксид кремния четыре, который также имеет атомную кристаллическую решётку. Почти чистым оксидом кремния четыре является минерал кварц.
У веществ с ионным типом
связи в узлах кристаллической решётки расположены ионы, связь между частицами – ионная, она прочная.
Для веществ с ионным типом связи характерны следующие свойства
:
высокие температуры плавления и кипения
, они тугоплавки и нелетучи, они твёрдые, хрупкие, многие растворимы в воде.
Вещества с ионным типом связи плохо проводят электрический ток и тепло. Но их растворы и расплавы проводят электрический ток. Вещества с ионным типом связи не имеют запаха
.
Ионное соединение представляет собой гигантскую ассоциацию ионов, расположенных в пространстве благодаря равновесию сил притяжения и отталкивания.
Например, кристалл хлорида натрия состоит из катионов натрия и анионов хлора. Каждый катион натрия окружён шестью анионами хлора, а каждый анион хлора – шестью катионами натрия. Наименьшей структурной единицей кристалла является элементарная ячейка. Строение элементарной ячейки зависит от соотношения размеров катиона и аниона.
У веществ с металлическим типом
связи в узлах кристаллической решётки расположены атом-ионы, связь между ними металлическая.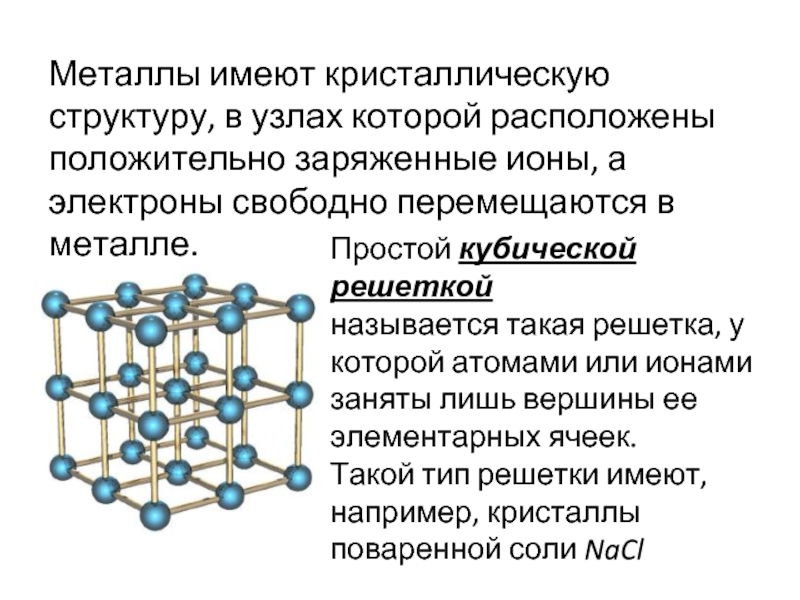 Связь может быть различной по прочности.
Связь может быть различной по прочности.
Металлическая кристаллическая решётка
определяет свойства металлов: ковкость, пластичность, электро-и теплопроводность, металлический блеск, способность образовывать сплавы.
Пластичность
выражается в способности металлов деформироваться под действием механической нагрузки. Это свойство лежит в основе ковки, прокатки металлов, их способности вытягиваться в проволоку. Пластичность объясняется тем, что под воздействием силы слои перемещаются относительно друг друга без разрыва связи между ними.
Например, если двумя плоскими стеклянными пластинками поместить несколько капель воды, то пластинки будут свободно скользить относительно друг друга, но вот разъединить их будет достаточно сложно. Таким образом, в данном опыте вода играла роль свободных электронов, которые находятся в металлической кристаллической решётке.
Наиболее пластичными металлами являются золото, серебро и медь. Именно из золота можно сделать самую тонкую фольгу толщиной три тысячных миллиметра. Такую тонкую фольгу использую для золочения. Примером может служить Янтарная комната в Большом Екатерининском дворце.
Такую тонкую фольгу использую для золочения. Примером может служить Янтарная комната в Большом Екатерининском дворце.
Высокая электропроводность металлов обусловлена наличием свободных электронов, которые под действием электрического тока приобретают направленное движение.
Лучшими проводниками
электрического ока
являются
серебро
и
медь
, немного худшим – алюминий. Однако в большинстве случаев в качестве электропроводов используют алюминий, а не медь.
также объясняется
движением свободных электронов
, которые сталкиваются с атом-ионами в узлах кристаллической решётки и обмениваются с ними энергией. Благодаря этому свойству металлическая посуда равномерно нагревается.
Вещества с металлическим типом кристаллической решётки имеют металлический блеск из-за отражения световых лучей.
Высокой светоотражающей способностью обладают ртуть, серебро, палладий и алюминий. Из серебра, палладия и алюминия изготавливают зеркала, прожектора и фары. В порошкообразном состоянии металлы теряют свой блеск, только магний и алюминий сохраняют его.
Из серебра, палладия и алюминия изготавливают зеркала, прожектора и фары. В порошкообразном состоянии металлы теряют свой блеск, только магний и алюминий сохраняют его.
Большинство металлов имеет серебристо-белый цвет. Только золото окрашено в жёлтый цвет, а медь в красный.
Металлическая кристаллическая решётка характерна не только для металлов, но и для сплавов
. Это отличает металлические сплавы от других сплавов: стекла, фарфора, керамики, базальтов, гранитов, гнейсов.
АХМЕТОВ М. А. УРОК 7. ТЕОРИЯ. Выбрать другой урок http://maratakm.narod.ru Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки. Ранее мы познакомились со следующими видами химической связи: ионная, металлическая, ковалентная полярная и неполярная. Вещества с ионной связью образуют ионную кристаллическую решетку. Вещества с ионной кристаллической решеткой имеют прочную химическую связь и как следствие имеют кристаллическое строение, высокие температуры плавления, многие из этих веществ относятся к электролитам.
Рис. 7.1. Кристаллическая решетка ионных кристаллов Уподобим ионную структуру группе расположенных в шахматном порядке мужчин и женщин (рис. 7.2. Рис. 7.2. . Романтическая сила влечения – аналогия ионного кристалла. Вещества с металлической связью образуют металлическую кристаллическую решетку. Вещества с металлической решеткой являются электропроводными, имеют высокую теплопроводность, ковкие. S-металлы обычно имеют низкие температуры плавления, d-металлы – более высокие. Для иллюстрации строения металлов в твердом состоянии найдена особенно экстравагантная аналогия. Группа мужчин (рис. 7.3.) изображает катионы металлов (узлы металлической кристаллической решетки). Рис. 7.3. Среди пчел (аналогия структуры металла), сравни с кристаллической структурой металла
Вещества с ковалентной связью образуют два типа кристаллической решетки атомную и молекулярную. Вещества с атомной кристаллической решеткой имеют достаточно высокие температуры плавления, обладают высокой твердостью (кроме графита). Твердость – это способность к нанесению царапин. Вещества с атомной кристаллической решеткой химически инертны. В узлах атомной кристаллической решетки находятся атомы, связанные прочными ковалентными связями в протяженную пространственную сеть. В этом случае структура отличается таким внутренним единством, что можно сказать, что весь кристалл представляет одну молекулу. Представим эту структуру виде гимнастической пирамиды (рис. Рис. 7.4 Гимнастическая пирамида (аналогия атомного кристалла) Каждый гимнаст на ней символизирует атом углерода, связанный четырьмя ковалентными связями с соседними атомами. Целостность структуры поддерживается исключительно благодаря усилиям каждого из гимнастов. Таким образом, зависимость людей друг от друга в этой ситуации больше, чем на любом из предыдущих рисунков (это и является аналогией повышенной прочности атомного кристалла). Пирамида демонстрирует также высокую взаимосвязанность узлов атомной кристаллической решетки: стоит одному из гимнастов ослабить только одну связку, и вся структура может рухнуть. Наиболее известный из таких кристаллов – алмаз (рис. 7.5). Алмаз состоит только из одного элемента углерода – того же самого, из которого состоит обыкновенная сажа и графит. В алмазе каждый 4-х валентный атом углерода связан с другим атомом углерода чисто ковалентной связью и количество таких связанных в каркас атомов чрезвычайно велико. Алмаз можно было бы назвать гигантской молекулой, если бы к молекулам не предъявлялось требование иметь постоянный состав.
Рис. 7.5. Кристаллическая структура алмаза. В кристалле графита атомы углерода связаны несколько по-иному (рис. 7.6.). Они объединены в плоские слои, состоящие из правильных шестиугольников. Можно представить, что в этих шестиугольниках атомы углерода связаны между собой как простыми, так и двойными связями (двойные связи на рисунке не показаны). Расстояние между слоями в графите довольно велико, а силы взаимодействия между ними довольно слабы (в основном это слабые межмолекулярные связи, показанные пунктирными линиями), поэтому графит может расщепляться на тонкие чешуйки. Чешуйки легко прилипают к бумаге – вот почему из графита делают грифели карандашей.
Рис 7.6. Кристаллическая структура графита
У веществ с молекулярным строением в узлах кристаллической решетки находятся молекулы с прочными ковалентными связями между атомами. В то же время отдельные молекулы взаимосвязаны гораздо слабее, что делает молекулярный кристалл довольно непрочным. Можно уподобить эту структуру группе семейных пар (рис. 7.7). В каждой паре супругов связывают прочные узы брака (подобно прочной связи атомов внутри молекулы), а вот отношения между парами носят поверхностный характер: они могут дружить семьями, испытывать дружеские чувства, но довольно свободно могут обойтись и друг без друга.
Рис. 7.7. Группа супружеских пар (аналогия молекулярного кристалла). Сравни с кристаллической решеткой йода.
|
Кристаллические структуры термообработанной стали | L&L печь
28 июля 2021 г.
Красота и элегантность термообработанной стали не ограничиваются поверхностью металла; их также можно увидеть в сложных кристаллических структурах, которые придают металлу его отличительные характеристики.
В этой статье мы рассмотрим природу кристаллической структуры стали, а также свойства, которые обнаруживаются в различных видах стали после термической обработки.
В твердом состоянии металлы состоят из кристаллизованных решетчатых структур, которые обычно называют в более общем смысле «кристаллической структурой» металла.
Атомы, составляющие эту особую кристаллическую структуру, могут различаться, хотя нержавеющая сталь преимущественно состоит из атомов железа, а также некоторого количества углерода и небольшого количества других металлов в зависимости от типа.
Стальные кристаллические структуры впервые появляются при затвердевании. В своей жидкой форме железо вообще не является кристаллическим. Однако по мере того, как расплавленный металл начинает остывать, постепенно начинают формироваться кристаллы.
Поскольку металл подвергается нескольким температурным стадиям, образуются различные типы кристаллов. Таким образом, готовая сталь будет содержать следовые количества феррита, аустенита и цементита.
Что делает кристаллические структуры стали такими отличными друг от друга? Эти структуры будут различаться в зависимости от количества углерода, которое они могут поглотить.
Ферритные кристаллические структуры содержат лишь небольшое количество углерода, примерно 0,025%. Это делает ферритную сталь чрезвычайно мягкой и пластичной, хотя отсутствие углерода также означает, что ферритная сталь имеет низкую коррозионную стойкость.
Кроме того, ферритная сталь имеет среднюю прочность, что означает, что ее не рекомендуется использовать в условиях высоких температур.
Свойства ферритной сталиПричина того, что ферритная сталь поглощает так мало углерода, заключается в ограничениях геометрии ее кристаллической структуры. Кристаллическая структура ферритной стали характеризуется расположением в форме куба, в котором атомы железа размещены в каждом углу и один в центре. Именно такое расположение придает ферритной стали характерные магнитные свойства.
Использование ферритной стали Поскольку это не самая прочная форма стали, ферритная сталь не находит широкого применения. Однако в некоторых случаях ферритную сталь можно комбинировать с другими элементами (например, хромом) для повышения ее долговечности и коррозионной стойкости.
Однако в некоторых случаях ферритную сталь можно комбинировать с другими элементами (например, хромом) для повышения ее долговечности и коррозионной стойкости.
Ферритная сталь нередко используется в следующих областях:
- Автомобильные выхлопные системы
- Пищевое оборудование и приборы
- Теплообменники
- Бытовая техника
В более крупных приложениях используются другие формы стали для большей долговечности.
Аустенитная стальАустенит — это форма железа, которая может поглощать больше углерода, чем феррит. Аустенит можно получить из феррита, подвергая его воздействию экстремальных температур (1000 °C и более), что позволит его объемно-центрированной кубической кристаллической структуре перейти в гранецентрированную структуру.
Свойства аустенита Эти гранецентрированные кристаллические структуры стали позволяют аустениту поглощать до 2% углерода, что значительно больше, чем ферритная сталь.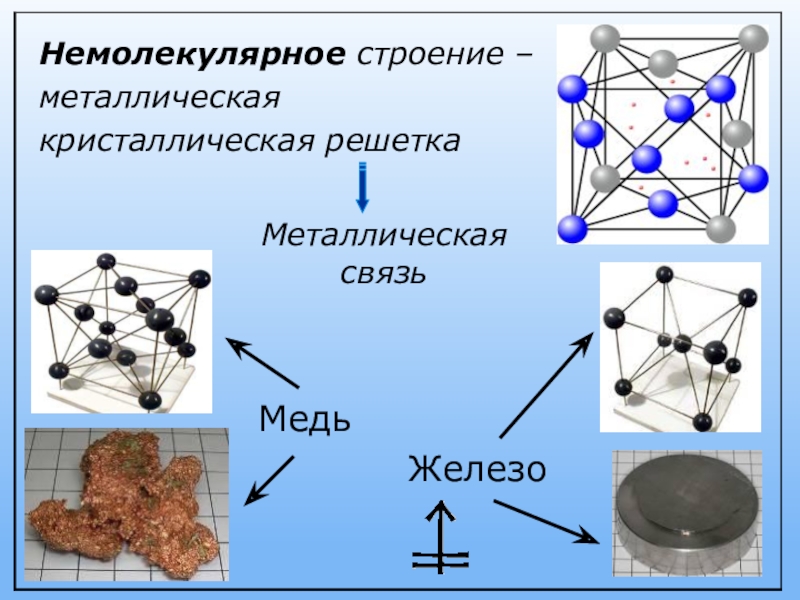
К сожалению, при охлаждении аустенит снова принимает свою ферритную форму. Однако сталь можно заставить сохранить свою структуру путем добавления дополнительных металлов, таких как никель и марганец. Это обеспечивает сохранение аустенитом своей структуры и свойств даже при низких температурах.
Аустенитная сталь легче поддается сварке, чем другие виды стали. Это делает аустенит немного более универсальным и доступным, поскольку различные куски стали можно изготавливать отдельно, а затем сваривать вместе.
Использование аустенитаИз-за долговечности аустенита это одна из наиболее часто используемых форм нержавеющей стали.
Металл в ваших винтах из нержавеющей стали или другом оборудовании почти всегда представляет собой форму аустенита. Этот металл используется из-за его относительной прочности и высокой устойчивости к коррозии.
Устойчивость к коррозии также делает аустенит идеальным выбором для пищевой, фармацевтической и нефтехимической промышленности. Некоторые виды мебели также могут быть изготовлены из аустенитной стали. Эту сталь можно использовать даже для некоторых видов металлоконструкций.
Некоторые виды мебели также могут быть изготовлены из аустенитной стали. Эту сталь можно использовать даже для некоторых видов металлоконструкций.
При быстрой закалке высокотемпературного аустенита атомы углерода захватываются кристаллическими структурами стали. При этом образуется мартенсит.
Свойства мартенситаКристаллическая структура стали в мартенсите содержит относительно большое количество углерода, что делает этот металл чрезвычайно прочным и устойчивым к разрушению. Низкая пластичность (способность изгибаться или скручиваться в проволоку) также делает эту сталь прочной и долговечной.
Кроме того, мартенсит можно выдерживать при относительно низких температурах в течение различных периодов времени в процессе, называемом отпуском. Закалка снижает прочность, повышая ударную вязкость и пластичность. Это позволяет обрабатывать мартенсит и адаптировать его для самых разных применений.
Поскольку мартенсит настолько стабилен и прочен, он является идеальным материалом для столовых приборов, ножей и других высококачественных кухонных принадлежностей. Но помимо кухни мартенсит также находит применение в области медицины, а также в аэрокосмической промышленности.
Точное применение мартенситной стали будет зависеть от содержания углерода, полученного в ходе металлургического процесса.
Нержавеющая сталь типа 410 может быть универсальным материалом, который хорошо подходит для изготовления скобяных изделий, деталей оружия, лопаток турбин и деталей машин. Нержавеющая сталь типа 440 обладает большей твердостью, что может быть идеальным для лезвий, поскольку их не придется часто затачивать. Вы можете найти сталь типа 440 в кухонных столовых приборах и медицинских инструментах.
Заключение Конфигурация кристаллических структур стали влияет на способность металла поглощать углерод. Это оказывает большое влияние на общее качество и долговечность готового продукта.
Это оказывает большое влияние на общее качество и долговечность готового продукта.
Наиболее распространенные формы кристаллической структуры стали включают ферритную, аустенитную и мартенситную сталь, хотя аустенитная и мартенситная сталь имеют более широкий спектр применения из-за их более высокой прочности и долговечности.
Надежная термообработка рядом со мнойL&L Special Furnace Co. разбирается в химических и механических процессах, связанных с термообработанной сталью. Мы гордимся своей давней репутацией, когда речь идет о промышленных печах, печах, сушильных камерах, закалочных емкостях и других системах термообработки.
Мы стремимся к инновациям и качеству изготовления. Вы можете найти наши предприятия, расположенные к югу от Филадельфии, штат Пенсильвания, хотя мы обеспечиваем продажу и обслуживание оборудования по всему миру.
Свяжитесь с нами для ваших потребностей в термообработке, и мы можем сотрудничать с вами, чтобы предоставить доступное и надежное обслуживание.
Кристаллические структуры благородных металлов и их поведение
Выпуск 036, 23 мая 2022 г.
Меган К. Пуглиа, доктор философии, старший химик-исследователь
Благородные металлы представляют собой кристаллические твердые вещества при комнатной температуре, что означает, что их атомы упорядочены по трехмерному повторяющемуся шаблону, называемому решеткой. Модель твердых сфер описывает поведение этой кристаллографической решетки¹; 1) атомы представляют собой сферы, которые могут соприкасаться друг с другом, но никогда не могут проникать друг в друга, и 2) атомы имеют тенденцию оптимизировать свое расположение, чтобы максимизировать стабильность и плотность упаковки (также известная как плотная упаковка). Наиболее распространенная структура для чистых металлов и сплавов заменителей также является наиболее плотно упакованной: объемно-центрированная кубическая (ОЦК), гексагональная закрытая упаковка (ГПУ) и гранецентрированная кубическая (ГЦК). Благородные металлы², как показано на рисунке 1, встречаются только в структурах FCC и HCP, но это не означает, что интерметаллические сплавы исключают альтернативные кристаллические структуры.
Рисунок 1 : Усеченная периодическая таблица элементов, изображающая кристаллическую структуру благородных и неблагородных металлов по определению Дерингера-Ней².
Металлурги представляют бесконечно повторяющуюся решетку с более управляемой «элементарной ячейкой», которая является простейшей повторяющейся единицей, необходимой для воссоздания кристалла. Элементарная ячейка предоставляет обширную информацию о стехиометрии, изотропии и характеристиках³. Пластичность и приспособление к пластической деформации также можно объяснить с помощью кристаллографии.
Определенные ориентации элементарной ячейки содержат плотноупакованные плоскости и плотноупакованные направления, которые вместе также известны как системы скольжения. В этих системах скольжения между атомами нет промежутка, и атомы могут легко скользить в соседнее положение. Это способствует легкому способу движения дислокаций, а количество доступных систем скольжения напрямую коррелирует с пластичностью.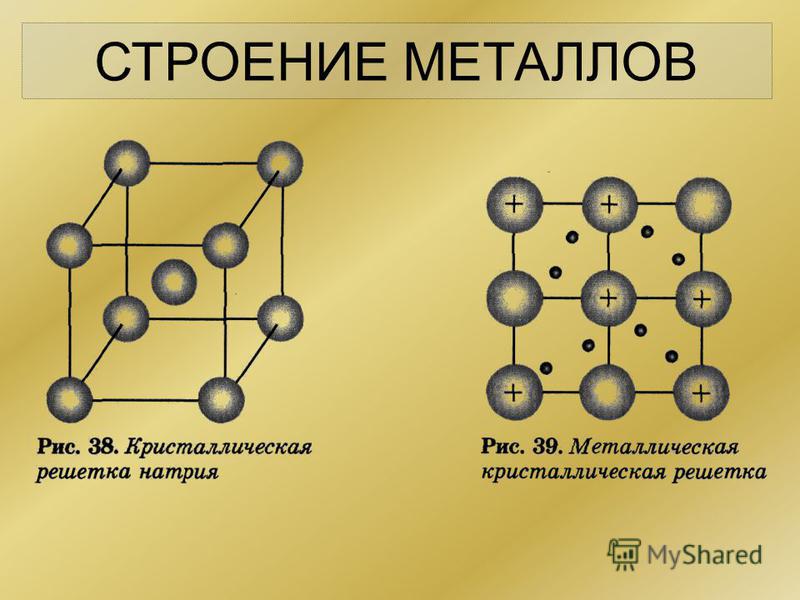
Объемно-центрированный кубический: ОЦК-кристаллы имеют кубические элементарные ячейки с атомом в центре и, как показано на рис. 2, имеют плотноупакованные направления, но не имеют истинно плотноупакованных плоскостей. Однако, с учетом самой плотной плоскости, систем скольжения может быть до 48. Металлы ОЦК часто претерпевают пластическое превращение в хрупкое при криогенных температурах; это связано с тем, что этим системам скольжения требуется тепло для активации движения дислокаций. Этот барьер для миграции дислокаций делает ОЦК-металлы менее пластичными, чем ГЦК-металлы, но все же более пластичными, чем ГПУ-металлы.
Рисунок 2 : Диаграмма, изображающая а) элементарную ячейку ОЦК и б) наиболее плотно упакованную плоскость, обозначенную зеленой плоскостью и зелеными атомами, лежащими на этой плоскости.
Шестиугольная закрытая упаковка: Всего существует 14 различных систем решетки, и кристаллы не всегда располагаются вдоль кубических решеток³. Структура ГПУ является одним из таких кристаллов и имеет гексагональную элементарную ячейку, рис. 3. На элементарную ячейку приходится только одна плоскость плотной упаковки и только три системы скольжения. Этого недостаточно для облегчения пластической деформации, и кристаллические структуры ГПУ, такие как Re, Ru и Os, известны своей плохой способностью приспосабливаться к пластической деформации. Некоторые кристаллы HCP, такие как Ti, могут использовать дополнительные плотно упакованные плоскости, которые улучшают их пластичность.
Структура ГПУ является одним из таких кристаллов и имеет гексагональную элементарную ячейку, рис. 3. На элементарную ячейку приходится только одна плоскость плотной упаковки и только три системы скольжения. Этого недостаточно для облегчения пластической деформации, и кристаллические структуры ГПУ, такие как Re, Ru и Os, известны своей плохой способностью приспосабливаться к пластической деформации. Некоторые кристаллы HCP, такие как Ti, могут использовать дополнительные плотно упакованные плоскости, которые улучшают их пластичность.
Рисунок 3 : Диаграмма, изображающая а) элементарную ячейку ГПУ и б) плоскость плотной упаковки, обозначенную зеленой плоскостью, и зеленые атомы, лежащие на этой плоскости.
Гранецентрированный куб: Кристаллы FCC также имеют кубические элементарные ячейки, но с атомом на каждой грани куба. Как показано на рисунке 4, все атомы на этой плоскости касаются своих ближайших соседей. Эта конфигурация имеет как плоскости, так и направления плотной упаковки и порождает в общей сложности 12 систем скольжения.


 Когда мы говорим о химической связи мы имеем ввиду то, как связаны атомы между собой. Когда мы говорим о кристаллической решетке и строении вещества, то имеется ввиду большая совокупность атомов. Говоря другими словами химическая связь – это микроуровень, а кристаллическая решетка – это макроуровень. Свойства вещества находятся в непосредственной зависимости от того, как организовано его строение на макроуровне или каким является его кристаллическая решетка.
Когда мы говорим о химической связи мы имеем ввиду то, как связаны атомы между собой. Когда мы говорим о кристаллической решетке и строении вещества, то имеется ввиду большая совокупность атомов. Говоря другими словами химическая связь – это микроуровень, а кристаллическая решетка – это макроуровень. Свойства вещества находятся в непосредственной зависимости от того, как организовано его строение на макроуровне или каким является его кристаллическая решетка. ). Пусть мужчины символизируют катионы, а женщины – анионы. Тогда каждый человек оказывается в зоне действия обаяния окружающих его представителей противоположного пола, к которым он (она) в силу закона притяжения противоположностей испытывает интерес. Интерес этот одинаково выражен во всех направлениях, поскольку на рисунке – холостые мужчины и незамужние женщины. Этим и объясняется повышенная прочность ионного кристалла.
). Пусть мужчины символизируют катионы, а женщины – анионы. Тогда каждый человек оказывается в зоне действия обаяния окружающих его представителей противоположного пола, к которым он (она) в силу закона притяжения противоположностей испытывает интерес. Интерес этот одинаково выражен во всех направлениях, поскольку на рисунке – холостые мужчины и незамужние женщины. Этим и объясняется повышенная прочность ионного кристалла.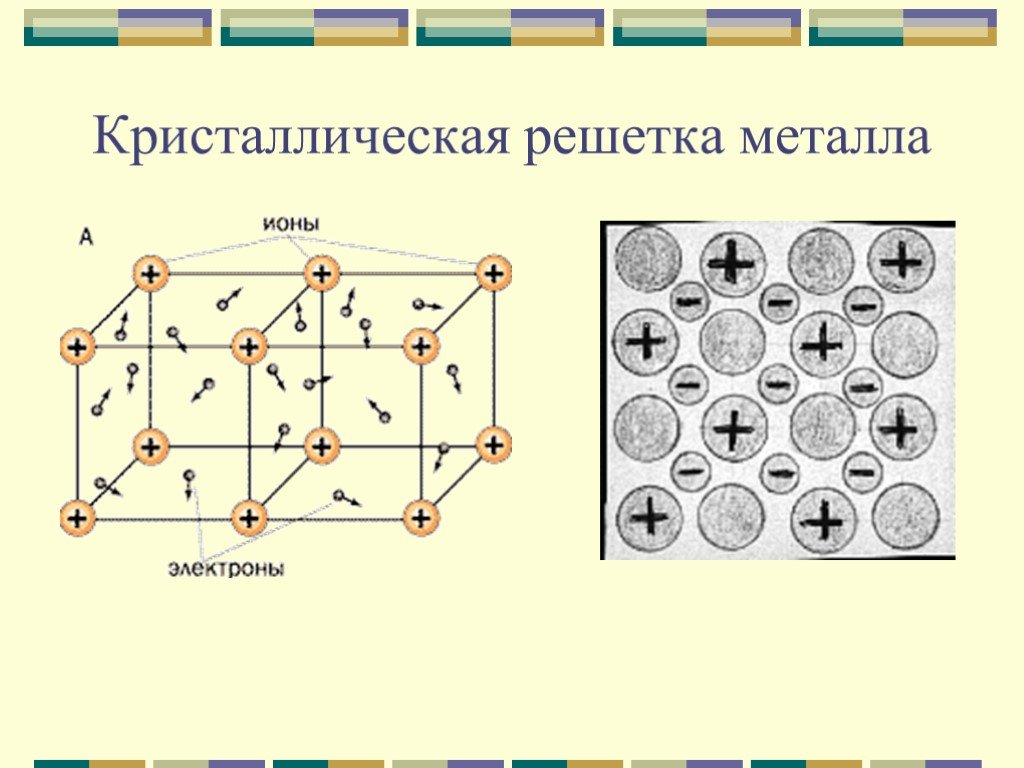
 7.4).
7.4).
